-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lymfoproliferativní onemocnění u pacientů s autoimunitními a infekčními onemocněními: význam antigenní stimulace a zánětlivých procesů
Tvarůžková Z, Pavlová Š, Doubek M, Mayer J, Pospíšilová Š. Lymphoproliferative disease in patients with autoimmune and inflammatory diseases: significance of antigenic stimulation and inflammatory processes
Evidence has been growing that the pathogenesis of lymphoproliferative disease involves immune processes deregulation. It is believed that antigens or immunological elements can trigger transformation of normal lymphocyte polyclonal population into monoclonal neoplastic disorder – lymphoproliferative disease. Extensive studies point to the link between malignant lymphoma development and autoimmune or inflammatory diseases – namely rheumatoid arthritis, Sjörgen’s syndrome, coeliac disease, systemic lupus erythematosus or thyroiditis. Increased risk of lymphoproliferative disease development was also proved for some infections. These infections involve both viral (e.g. Epstein-Barr virus, HIV or hepatitis C virus) and bacterial agents (e.g. Helicobacter pylori, Borrelia burgdorferi). Besides various lymphomas, the links to autoimmune/inflammatory diseases have also been described in chronic lymphocytic leukaemia. Regarding clinical medicine, it is necessary to distinguish patients with autoimmune, inflammatory and infectious diseases who are at the increased risk of tumour development. New approaches must be found to lower this risk. Also, the relationship between autoimmune/inflammatory disease therapy and lymphoma development should be clarified. Although lymphomas associated with autoimmune and inflammatory diseases represent only a small proportion of all lymphomas, any new findings regarding these diseases can cast light on lymphoma pathogenesis as a whole.
Key words:
lymphoma, leukaemia lymphocytic chronic B-cell, antigens, autoimmune diseases, inflammation, lymphocyte activation, cell transformation neoplastic.
Autori: Zuzana Tvarůžková; Šárka Pavlová; Michael Doubek; Jiří Mayer; Šárka Pospíšilová
Pôsobisko autorov: Masarykova univerzita v Brně, Lékařská fakulta, Interní hematoonkologická klinika FN Brno, Centrum molekulární biologie a genové terapie
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 161-168
Kategória: Přehledový článek
Súhrn
V posledních letech je stále více zřejmé, že se na patogenezi lymfoproliferativních onemocnění významně podílí deregulace imunitních procesů. Předpokládá se, že antigenní nebo imunologický element může být podnětem pro transformaci polyklonální populace normálních lymfocytů na monoklonální neoplastickou poruchu – lymfoproliferativní onemocnění. Rozsáhlé studie poukazují na vztah mezi autoimunitními nebo zánětlivými nemocemi a vývojem maligních lymfomů. Nejčastěji je popisován vztah k revmatoidní artritidě, Sjögrenovu syndromu, celiakii, systémovému lupus erythematodes a tyreoiditidě. Zvýšené riziko vzniku lymfoproliferativních chorob bylo prokázáno také u některých nemocí infekčního původu. Jedná se jak o virové infekce (např. virus Epsteina-Barrové, virus HIV nebo virus hepatitidy C), tak o bakteriální infekce (např. Helicobacter pylori, Borrelia burgdorferi). Kromě řady lymfomů byly souvislosti s autoimunitními/zánětlivými nemocemi popsány také u chronické lymfocytární leukémie. Z klinického hlediska je třeba zjistit, jak mezi pacienty s autoimunitními, zánětlivými a infekčními onemocněními rozpoznat ty, kteří mají zvýšené riziko vzniku nádoru, a jak toto riziko snížit. Je také nezbytné porozumět tomu, jakým způsobem ovlivňuje vznik lymfomů léčba autoimunitních a zánětlivých onemocnění. Ačkoliv lymfomy asociované s autoimunitními a zánětlivými onemocněními představují jen malou část všech lymfomů v celé populaci, jakákoliv nová zjištění týkající se těchto nemocí mohou ozřejmit i dosud málo objasněnou patogenezi ostatních lymfomů.
Klíčová slova:
lymfom, chronická lymfocytární leukémie, antigeny, autoimunitní onemocnění, zánět, aktivace lymfocytů, neoplastická transformace buňky.Při správně fungující imunitní reakci jsou tělu vlastní antigeny tolerovány, nežádoucí antigeny eliminovány a počty lymfocytů (a dalších imunitních buněk) v periferní krvi a v sekundárních lymfoidních orgánech se po skončení této reakce opět normalizují. Jejich absolutní počty a chování jsou přísně regulovány. Pokud je regulace proliferace, buněčné smrti, migrace a dalších procesů narušena, může dojít – podobně jako u jiných tkání – ke vzniku malignity.
V posledních letech je čím dál více zřejmé, že k narušení této regulace u lymfocytů dochází snáze v případech chronických zánětlivých procesů, tedy při přetrvávání patogenu v organismu, při prolomení autotolerance (autoimunitní onemocnění nebo jiná chronická expozice autoantigenům, ke kterým nebyla navozena tolerance) a chronické rejekci transplantované tkáně (obr. 1). V souvislosti s některými autoimunitními chorobami byl pozorován zvýšený výskyt lymfomů. Některé lymfomy jsou typicky asociovány s virovými infekcemi (např. virus Epsteina-Barrové – EBV, nebo virus lidského imunodeficitu – HIV). Nebylo zatím zcela objasněno, jaká je v těchto případech biologická podstata maligní transformace lymfocytů. V literatuře se spekuluje o dlouhodobé stimulaci antigeny vnitřního (autoantigeny) i vnějšího původu, transformaci virovými onkoproteiny, ale také o vlivu dlouhodobého zánětu a imunosuprese, která může být vyvolána léky nebo samotnou chronickou imunitní reakcí. Není dosud známo, zda je mechanismus maligní transformace lymfocytů podobný u autoimunitních chorob a chronických infekcí ani zda by bylo možné tyto mechanismy absolutně zobecnit na všechny maligní lymfoproliferace. Přesto se očekává, že další výzkum v této oblasti přispěje k pochopení procesů vedoucích k tomu, že se normální lymfocyt vymkne kontrole.
Obr. 1. Schéma možného vývoje maligních lymfoproliferací založeného na chronické antigenní stimulaci: Chronická antigenní nebo imunologická stimulace vede ke zvýšené proliferaci velkého počtu klonů lymfocytů. Pokud dojde v jedné buňce (několika buňkách) k nahromadění mutací vedoucích k její nádorové transformaci, vzniká klon (případně několik klonů) nádorových lymfocytů, který dá vznik malignímu lymfomu. Za podmínek vrozené nebo získané imunodeficience se proces lymfomageneze výrazně zrychluje. 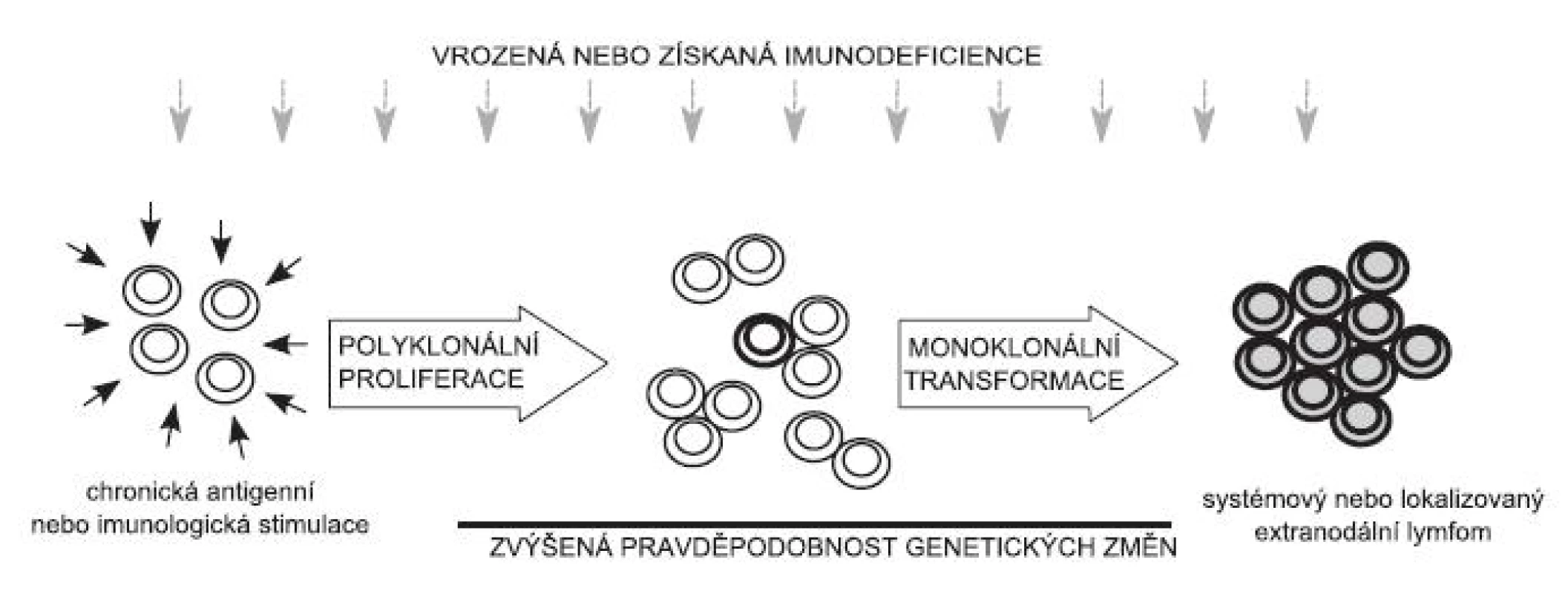
Tato přehledová práce si klade za cíl předložit českému čtenáři souhrn publikovaných dat o vzniku a výskytu lymfoproliferací u pacientů s jednotlivými autoimunitními onemocněními a s vybranými infekcemi. V závěru článku je zařazena kapitola o současném pohledu na úlohu antigenu při vzniku lymfoproliferací. Téma článku se pohybuje na rozhraní několika rozsáhlých oborů, neklademe si proto za cíl předložit detailní přehled, ale spíše naznačit souvislosti a propojení mezi imunologií a hematoonkologií.
Autoimunitní onemocnění a chronická zánětlivá onemocnění s autoimunitními projevy
Data týkající se výskytu lymfoproliferací u pacientů s určitými autoimunitními nebo chronickými zánětlivými onemocněními jsou velmi heterogenní. Jednu z příčin této heterogenity je už fakt, že pohledy na to, které onemocnění má vlastně jednoznačný autoimunitní původ, se velmi liší. Hranice mezi autoimunitním onemocněním a „pouhým“ nálezem hraničních laboratorních hodnot, které zatím ještě nenaplňují diagnostická kritéria autoimunitní choroby, může být také velmi nepřesně vymezená. V případě některých autoimunitních/zánětlivých onemocnění byly analyzovány skupiny pacientů s různou závažností choroby a různým způsobem léčby; oba tyto faktory mohou mít na výskyt lymfoproliferací vliv. Je také nezbytné uvést, že i přes desítky tisíc osob zařazených do jednotlivých analýz jsou absolutní počty jedinců s jednotlivými diagnózami relativně malé.
Zvýšené riziko vzniku maligních lymfomů bylo opakovaně popsáno u Sjögrenova syndromu (SS), systémového lupus erythematodes (SLE) a revmatoidní artritidy (RA), zatímco názory na vliv dalších autoimunitních onemocnění (např. lupénky, zánětlivých střevních poruch a granulomatózních nemocí – sarkoidózy) jsou rozporuplnější (tab. 1).
Tab. 1. Přehled autoimunitních/zánětlivých onemocnění opakovaně asociovaných se vznikem maligních lymfomů (včetně relativního rizika – RR, vedlejších rizikových faktorů a asociovaných typů lymfomů) 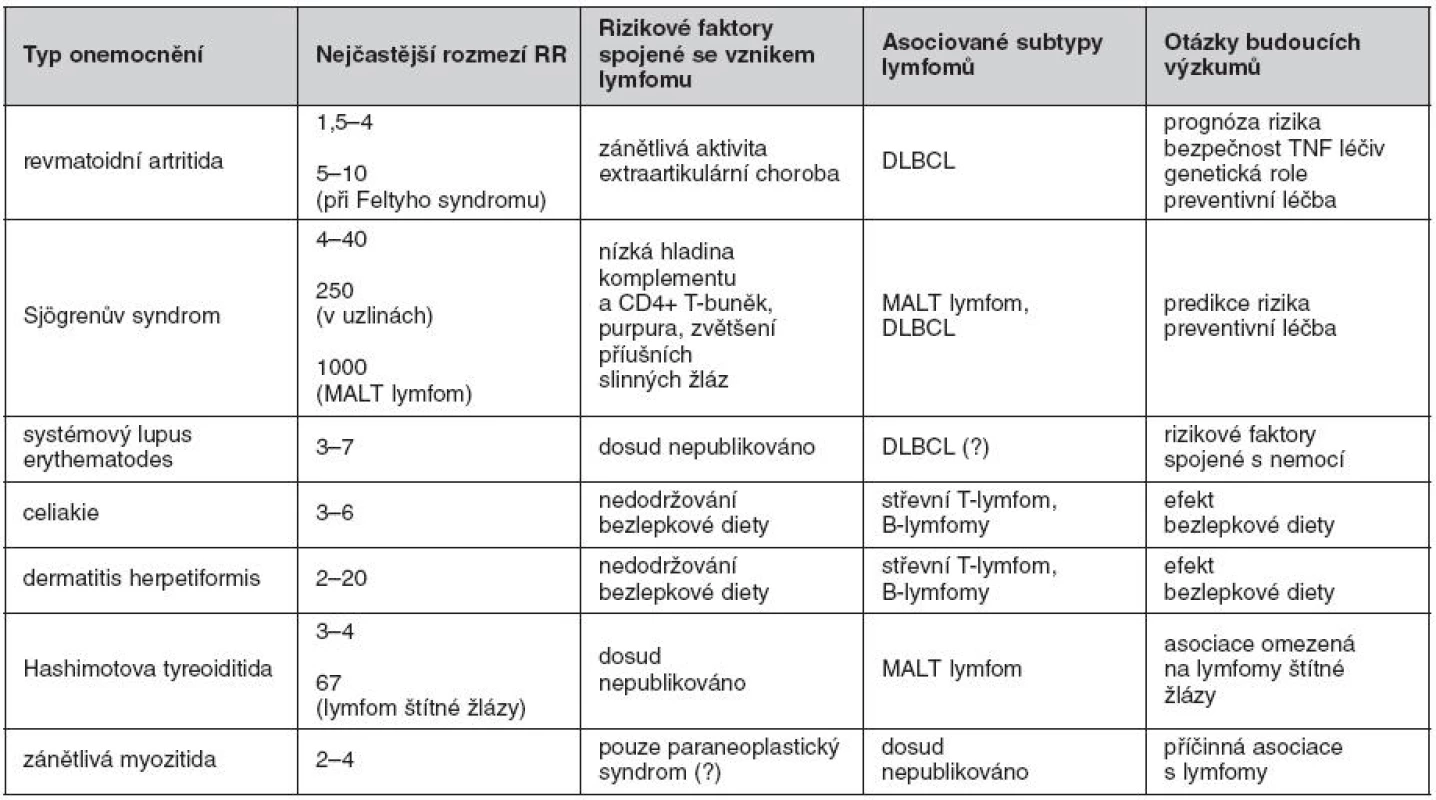
DLBCL – difuzní velkobuněčný B-lymfom, MALT – slizniční lymfoidní tkáň V posledních letech byly publikovány výsledky několika rozsáhlých studií. Skupina kolem K. E. Smedby v letech 2006 a 2008 shrnula a analyzovala dosud publikovaná data (1, 2). Autoři se nesnažili pouze zhodnotit, mezi kterými autoimunitními onemocněními a lymfoproliferacemi existuje souvislost, ale pokusili se také definovat rizikové skupiny v rámci daných autoimunitních chorob. Věnují se tak závažnosti onemocnění/intenzitě zánětu, vlivu terapie a dalším faktorům. Tato pracovní skupina zároveň publikovala vlastní data získaná z populační studie pacientů s nehodgkinskými lymfomy (NHL) ve Švédsku a Dánsku založené na telefonickém pohovoru (3) a stála v čele v rozsáhlé analýzy, která sdružovala dvanáct dílčích studií v rámci konsorcia InterLymph (4). Autoři se domnívají, že závažnost onemocnění, chronická aktivace B-lymfocytů a zánět jsou rozhodujícími činiteli při zvýšení rizika vzniku lymfomů.
Goldin a Landgren (5) shrnuli výsledky analýz skandinávské populace a amerických veteránů publikovaných v letech 2006–2008. Výskyt autoimunitních onemocnění byl posuzován nejen u pacientů s lymfomy, ale také u jejich přímých příbuzných. Cílem bylo vyvrátit nebo potvrdit teorii, že za asociací mezi lymfomy a autoimunitními onemocněními stojí genetické faktory vedoucí k náchylnosti k oběma skupinám onemocnění.
V roce 2009 byly publikovány výsledky analýzy dat získaných z amerického nádorového registru zahrnujícího americké občany nad 65 let, jejichž zdravotní pojištění je hrazeno v rámci vládního programu Medicare (6). Tato práce analyzuje data pacientů s lymfomy starších 67 let, která byla získána na základě údajů z jejich zdravotního pojištění.
V souvislosti s autoimunitními onemocněními jsou nejčastěji uváděny lymfomy marginální zóny (MZL) typu MALT (mucosa-associated lymphoid tissue = slizniční lymfoidní tkáň) a difuzní velkobuněčné B-lymfomy (DLBCL), někdy také Burkittův lymfom (BL), folikulární lymfom (FL) nebo lymfom z plášťových buněk (MCL). U některých typů autoimunitních onemocnění jsou popisovány asociace s T-lymfomy.
Sjögrenův syndrom
Sjögrenův syndrom je onemocnění charakteristické infiltrací lymfocytů do slinných a slzných žláz s následnou produkcí protilátek způsobujících progresivní destrukci těchto žláz. Lymfocyty však mohou pronikat také do jiných orgánů a dávat zde vznik malignímu klonu. Autoprotilátky jsou namířené proti extrahovatelným nukleárním antigenům (SS-A, SS-B).
Pacienti se Sjögrenovým syndromem mají vyšší riziko výskytu NHL (3). Relativní riziko, vyšší u primárního syndromu než u sekundárního, se v různých studiích pohybuje mezi 4 a 40. Ve většině případů se jedná o MZL pomalu rostoucího typu. Smedby et al. (3) zjistili asociaci SS s MALT lymfomem (28× vyšší riziko vzniku) a také 11× vyšší pravděpodobnost vzniku DLBCL.
U SS je výrazně zvýšené riziko vzniku přesně lokalizovaných nádorů. NHL se u těchto pacientů vyskytují nejčastěji ve slinných žlázách, ve slizniční lymfoidní tkáni (MALT) a v lymfatických uzlinách. Smedby et al. (4) uvádí, že v příušních uzlinách je riziko výskytu NHL zvýšené 250× a riziko MALT lymfomu dokonce 1000×. To poukazuje na antigenně řízenou klonální expanzi v příušních uzlinách (7).
Systémový lupus erythematodes
Systémový lupus erythematodes (SLE) je systémové autoimunitní onemocnění doprovázené výskytem autoprotilátek proti jaderným antigenům (ANA, anti ds-DNA, anti-Sm) a krevním elementům.
Relativní riziko vzniku lymfoproliferativního onemocnění se podle různých studií pohybuje mezi 3–7 (4, 8). Jedna z nejrozsáhlejších studií založená na propouštěcích diagnózách více než 5700 pacientů uvádí 3× vyšší riziko vzniku NHL v souvislosti s touto nemocí (8). Jedná se především o MALT lymfomy a DLBCL. Autoři však nepotvrdili všeobecnou souvislost mezi NHL a SLE, riziko se zvýšilo jen při diagnóze SLE po 33. roce věku. Je tedy možné, že včasná diagnóza a zahájení léčby může snížit riziko vzniku lymfomů.
Celiakie a dermatitis herpetiformis
Celiakie a dermatitis herpetiformis jsou autoimunitní onemocnění spouštěná po vystavení sliznice tenkého střeva vlivu glutenu (lepku). Mohou se kombinovat s dalšími autoimunitními poruchami (např. diabetes nebo RA). U dermatitis herpetiformis se relativní riziko vzniku lymfomu pohybuje mezi 2–20 (2). U pacientů s celiakií bylo zjištěno přibližně 3–6× vyšší riziko vývoje lymfomu jak ve větších populačně založených studiích, tak ve výběrových statistických skupinách. Dalšími malignitami, které mohou provázet celiakii, jsou adenokarcinomy tenkého střeva a skvamózní karcinomy jícnu a hltanu (9). V doposud největší studii sledující skupinu 11 000 pacientů bylo u dospělých jedinců zjištěno 6× vyšší riziko vzniku nádorů (10).
Pacienti s celiakií mají zvýšené množství intraepiteliálních T-lymfocytů, což může vést k vyššímu riziku vzniku střevních nádorů (11). T-buněčné lymfomy vztahující se k enteropatii (celiakii) se nejčastěji vyskytují v jejunu, a to buď samostatně, nebo současně s výskytem dalších lymfomů v různých částech gastrointestinálního traktu. Předpokládá se, že tyto lymfomy vznikají z intraepiteliálních T-lymfocytů. Podle některých autorů jsou však klonální lymfocyty schopné šířit se krevním řečištěm i do odlehlých míst (12).
Zdá se, že včasné a absolutní dodržování bezlepkové diety zabrání zvýšení rizika vzniku nádoru (13). Avšak citovaná studie uvádí jen nepřímé důkazy a malý statistický vzorek. U nemocných s komplikovanou formou celiakie často nepomáhá ani bezlepková dieta a je u nich také častěji nalezena oligoklonální nebo monoklonální populace lymfocytů (14).
Revmatoidní artritida
Revmatoidní artritida (RA) je systémové zánětlivé onemocnění postihující zejména klouby. Většina pacientů má v krvi detekovatelný tzv. revmatoidní faktor (RF), autoprotilátku proti imunoglobulinu třídy IgG.
Již několik desetiletí se předpokládá, že pacienti s RA mají zvýšené riziko výskytu NHL. Výsledky metaanalýzy předložené Zintsarasem (15) potvrdily vyšší riziko vzniku lymfomů v porovnání s běžnou populací. Podle přehledu (1) se relativní riziko vzniku NHL a Hodgkinova lymfomu (HL) u pacientů s RA pohybuje mezi 1,5 a 4. Toto rozmezí však může zahrnovat podskupiny pacientů, u nichž se riziko značně liší (2). Gridley et al. (16) například poukazuje na to, že pacienti s Feltyho syndromem (chorobné zvětšení sleziny a abnormální snížení počtu granulocytů), který je spjat s vážnou a dlouhodobou RA, mají riziko vzniku lymfomu zvýšené 5–10×.
Polemizuje se i o tom, zda nemůže být vznik lymfomu důsledkem imunosupresivní léčby (17). Podobně bylo publikováno, že použití cytotoxických a biologických léčiv zvyšuje riziko vzniku lymfomů oproti tradičním léčebným postupům. Ve srovnání s ostatními způsoby léčby nebyl sice vliv etanerceptu (antagonista tumor nekrotizujícího faktoru – TNF) a infliximabu (monoklonální protilátka proti TNF-α) jednoznačný, avšak jejich vliv na vývoj NHL se jevil jako velmi pravděpodobný.
Je možné, že ke vzniku NHL, a to především indolentního extranodálního MZL, přispívá dlouhodobý a rozsáhlý zánět provázející RA (18).
Hashimotova tyreoiditida
Některé studie ukazují přibližně 3–4× zvýšenou pravděpodobnost vzniku lymfomu v souvislosti s Hashimotovou tyreoiditidou (1), což je autoimunitní onemocnění postihující štítnou žlázu. Již Holm et al. (19) ve své studii z roku 1985 uvádějí, že při tyreoiditidě se zvyšuje riziko vzniku myeloproliferativní nebo lymfoproliferativní malignity. Zjistili, že se relativní riziko vzniku maligního lymfomu štítné žlázy při tomto onemocnění zvedá až na 67.
Tyreoidní lymfomy jsou obvykle typu MALT, z nichž se někdy mohou vyvinout závažnější lymfomy, jako je DLBCL (20). Hashimotova tyreoiditida jednoznačně zvyšuje riziko vzniku lymfomů štítné žlázy, dlouho ale nebylo známo, zda může být také příčinou nádorů s jinou lokalizací. Nedávná studie z roku 2008 naznačuje možnou asociaci této nemoci i s MALT lymfomy lokalizovanými mimo štítnou žlázu (21).
Polymyozitida a dermatomyozitida
Dermatopolymyozitida je systémové autoimunitní onemocnění postihující svaly a klouby. Udává se, že zánětlivá myozitida je spojena s 2–4× vyšším rizikem vzniku NHL (22). Ve skandinávské studii sledující 1500 pacientů však nebylo zjištěno zvýšené riziko vzniku lymfomu již po roce od diagnózy (23). Je tedy možné, že zánětlivá myozitida se vyskytuje primárně jako paraneoplastický syndrom.
Zánětlivá onemocnění střev
Většina výzkumů ulcerózní kolitidy nezjistila vztah k vývoji lymfomů (1). V obšírné studii Crohnovy nemoci zahrnující 20 000 pacientů byla pravděpodobnost vzniku lymfomu zvýšena o 30 %, přičemž byl vyloučen první rok následující po diagnóze (24). Avšak po 5 letech pozorování již bylo riziko vzniku lymfomu stejné jako u zdravé populace. Podle Asklinga není zvýšení rizika vyloučené, avšak z dlouhodobého hlediska se vliv Crohnovy nemoci zdá být nepravděpodobný.
Lupénka a psoriatrická artritida
Lupénka je kožní autoimunitní onemocnění. V části případů je doprovázena artritidou. Doposud asi největší studie zabývající se lupénkou zahrnuje 150 000 pacientů s mírnou a 4000 pacientů s vážnou formou této nemoci (25). Byl zjištěn čtyřnásobný nárůst rizika vzniku kožního T-buněčného lymfomu u mírné formy onemocnění a více než desetinásobné zvýšení u formy vážné. Studie konsorcia InterLymph poukazuje u tohoto onemocnění na zvýšené riziko vzniku anaplastického velkobuněčného T-lymfomu (4).
Další onemocnění
V dosud největší studii čítající 11 800 pacientů s roztroušenou sklerózou nebylo prokázáno zvýšení rizika vzniku NHL ani HL (26). Stejně tak toto riziko nebylo prokázáno u ankylozující spondylitidy (27), systémových vaskulitid (28) a diabetes mellitus 1. typu (29).
Paraneoplastické syndromy
Doprovodným projevem některých vznikajících lymfoproliferativních malignit je paraneoplatistický autoimunitní fenomén (30). Jedná se o příznaky provázející nádorové onemocnění, které přímo nesouvisejí s růstem primárního ložiska nádoru nebo se vznikem či růstem metastáz a které mají charakter podobný jako u autoimunitních nemocí. Tento efekt v některých případech komplikuje správnou diagnózu lymfoproliferace, která je zaměňována za autoimunitní poruchu. Do jisté míry tak zkresluje správný odhad rizika vzniku lymfoproliferace u autoimunitních/zánětlivých nemocí. Nejčastěji k chybné klasifikaci dochází u zánětlivé myozitidy a u autoimunitní hemolytické anémie. Řada studií popisuje zvýšený výskyt nádorů při myozitidě, avšak takřka ve všech případech je nádor diagnostikován ve stejné době jako právě myozitida (23).
Autoimunitní hemolytická anémie (AIHA) představuje komplikaci NHL a zejména chronické lymfocytární leukémie (CLL). Vyskytuje se mimo jiné jako důsledek použití některých typů léčiv u CLL, zejména purinových analogů (31). Některé studie z posledních let však ukazují na možnou asociaci mezi historií této anémie a vznikem NHL a CLL. Smedby et al. (4) popisuje 2–3× vyšší riziko vzniku NHL u pacientů s AIHA, které přetrvává po více než 10 let od diagnózy AIHA.
Kromě autoimunitní hemolytické anémie byly u CLL popsány také asociace s imunitní trombocytopenií (32) a aplazií červených krvinek (pure red cell aplasia) (33).
Onemocnění infekčního původu
U některých lymfomů je možné najít souvislost mezi jejich vznikem a různými infekčními činiteli (34, 35). Mezi ně patří viry HIV, EBV, lidský T-lymfotropní virus 1 (HTLV-1), lidský herpes virus-8, virus hepatitidy typu C (36) a bakterie Helicobacter pylori (37) či Borrelia burgdorferi (38). Byl popsán také možný vztah mezi vývojem lymfomů a bakteriemi Chlamydiophila psittaci (39) a Campylobacter jejuni (40).
V souvislosti s podílem infekčních agens na vzniku lymfomů je navrhováno uplatnění následujících procesů: chronická stimulace lymfocytů, onkoproteiny kódované genomem virů a imunosuprese doprovázející chronický zánět. S výjimkou virových onkoproteinů představují tyto procesy pojítko s procesy uplatňujícími se při vzniku lymfomů u autoimunitních chorob. Zajímavé je, že při chronické infekci některými infekčními agens dochází v části případů k proliferaci klonu lymfocytů nesoucího revmatoidní faktor, tedy k narušení regulace autoreaktivních lymfocytů.
Virus Epsteina-Barrové
Virus Epsteina-Barrové (EBV) je běžně se vyskytující herpetický virus, který osídluje lymfatický systém. EBV infekcí B-lymfocytů kultivovaných in vitro lze vytvořit tzv. lymfoblastoidní linii; takto transformované B-lymfocyty získávají schopnost neomezeně proliferovat. Protilátky proti EBV má podle některých zdrojů až 95 % populace, infekce většinou proběhne v dětství bez výrazných klinických příznaků. V období adolescence nebo časné dospělosti může při primoinfekci dojít k rozvinutí infekční mononukleózy. Virus přetrvává v paměťových buňkách pod silnou kontrolou imunitního systému, zprostředkovanou zejména T-lymfocyty (41), která je narušena při oslabení imunitního systému.
S EBV je asociována endemická forma Burkittova lymfomu, HL a lymfomy spojené s primární a sekundární imunodeficiencí. Takřka u všech endemických Burkittových lymfomů je přítomna DNA viru Epsteina-Barrové a transkripty některých virových genů (42). Tato EBV-pozitivní forma Burkittova lymfomu je pravděpodobně podmíněna oslabením imunitního systému malárií (Plasmodium falciparium). U EBV-pozitivních Hodgkinových lymfomů (asi 40 %) je intenzivně studováno zvýšené riziko v souvislosti s infekční mononukleózou. Z lymfomů vznikajících u pacientů s transplantovanými orgány jsou s EBV spojeny zejména ty, které vznikají v období krátce po transplantaci, kdy jsou podávány nejvyšší dávky imunosupresiv (35). V některých případech bylo snížení dávek imunosupresiv spojeno se spontánní regresí nádoru.
Virus HIV
Výskyt lymfomů představuje typický znak onemocnění AIDS (43). Lymfomy u HIV pozitivních jedinců lze podle jejich patogeneze rozdělit do dvou typů. U první skupiny se jedná o velkobuněčné lymfomy s imunoblasty, které jsou často asociované s EBV a podobají se lymfomům u imunosuprimovaných pacientů po transplantaci. Druhá skupina zahrnuje nádory typu Burkittova lymfomu.
HIV není považován za onkogenní virus, neboť sekvence viru nebyly nikdy v buňkách lymfomů jednoznačně prokázány (35). Při lymfomagenezi u HIV-pozitivních jedinců se uplatňuje polyklonální expanze B-lymfocytů podněcovaná antigenní stimulací virem HIV a dalšími agens (44). S postupným snižováním hladiny CD4 T-lymfocytů klesá také imunita vůči virovým antigenům.
Zavedení HAART (vysoce aktivní antiretrovirová terapie) znamenalo průlom v léčbě AIDS. Očekávalo se, že trvalé zvýšení počtu CD4 T-lymfocytů a suprese replikace HIV doprovázená částečnou obnovou imunitního systému povedou k poklesu lymfomů. Bylo popsáno výrazné snížení výskytu lymfomů (45), avšak dlouhodobé důsledky zavedení HAART zatím nemohou být plně zhodnoceny (46).
Virus hepatitidy C
Virus hepatitidy C (HCV) se replikuje zejména v jaterních buňkách. Mimo to je označován jako lymfotropní a převažuje názor, že infikuje mononukleární buňky periferní krve. Není chápán jako onkovirus, nicméně proteiny virového obalu mohou vést k chronické antigenní stimulaci a proliferaci B-lymfocytů. Asociaci s HCV je možné najít u všech typů NHL (47). Zvýšený výskyt HCV u pacientů s lymfomy oproti kontrolní populaci byl popsán v Itálii (32 % vs. 1,3 %) (48), podle studií z jiných zemí je však vliv HCV geograficky omezený (49).
Smíšená kryoglobulinémie (MC – mixed cryoglobulinaemia) je nejčastějším a nejvážnějším mimojaterním projevem infekce HCV s prevalencí 10–70 % (50, 51). Jedná se o lymfoproliferativní poruchu, která je charakterizována ukládáním imunokomplexů obsahujících revmatoidní faktor, IgG a HCV RNA v endotelu malých cév. Mechanismy vedoucí k aktivaci a expanzi B-lymfocytů nebyly dosud objasněny. MC díky dlouhodobé antigenní stimulaci příležitostně progreduje do NHL charakterizovaného klonální expanzí RF + B-lymfocytů. Riziko vzniku NHL je u pacientů s HCV-MC přibližně 35× vyšší než v běžné populaci (52). Tyto NHL jsou obvykle nízce maligní (lymfoplazmocytární lymfom, splenický MZL, MALT lymfom). Zdá se, že v části případů mohou progredovat do DLBCL. DLBCL se vyskytuje spíše v případech infekce HCV bez smíšené kryoglobulinémie a mechanismus patogeneze je pravděpodobně odlišný.
Podle některých studií vede antivirová terapie interferonem u pacientů s lymfomem asociovaným s HCV jak ke snížení virémie, tak dokonce i k regresi nádoru.
Helicobacter pylori
Bakterie Helicobacter pylori způsobuje chronický zánět žaludeční sliznice a vyvolává i žaludeční vředy. V prostředí chronického zánětu se může vyvinout lymfom marginální zóny (MZL) typu MALT. Vztah mezi tímto lymfomem a infekcí Helicobacter pylori (53) je nejčastěji zmiňovaným, ale také jediným jednoznačným příkladem lymfomageneze způsobené bakteriemi (pro přehled (54)). V buňkách lymfomu je konstitutivně aktivovaná dráha NF-κB, dráha s klíčovou úlohou při vyzrávání B-lymfocytu a také při maligní transformaci buněk. U pacientů, u kterých je aktivace této dráhy závislá na přítomnosti bakterie, dojde po vyléčení infekce k vymizení lymfomu. Vývoj tohoto lymfomu na molekulární úrovni a jeho vztah k Helicobacter pylori je – jako modelový příklad – detailněji rozpracován na obrázku 2 a v následující části článku věnované roli antigenů.
Borrelia burgdorferi
Vztah mezi vznikem kožního MZL a infekcí bakterií Borelia burgdorferi, původcem lymské boreliózy, popsal Garbe et al. (55). U některých případů tohoto nádoru byla potvrzena somatická hypermutace a izotypový přesmyk, jež jsou společným znakem také pro lymfom marginální zóny typu MALT (56).
Chlamydiophila psittaci
V roce 2004 publikovali Ferreri et al. (39) výsledky PCR analýzy ukazující, že existuje vztah mezi infekcí Chlamydiophila (dříve Chlamydia) psittaci a výskytem očního adnexálního lymfomu. Zjistili, že se tato intracelulární bakterie vyskytuje ve vysoké míře jak v nádorové tkáni, tak v mononukleárních buňkách periferní krve. Testovali také vliv léčby antibiotiky proti chlamydiím a zjistili, že u nadpoloviční většiny léčených pacientů došlo ke zmenšení nádoru.
Ve studii provedené Zhang et al. (57) se však nepodařilo souvislost mezi infekcí C. psittaci a očním adnexálním lymfomem prokázat. Autoři poukazují na geografickou variabilitu, která může být navíc zesílena rozdíly způsobenými použitím různých technik pro detekci DNA C. psittaci. V Rakousku byl však krátce na to vztah mezi výskytem očního adnexálního lymfomu a C. psittaci opět potvrzen (58). Jako kontrolní vzorek sloužily MALT lymfomy gastrointestinálního traktu.
Campylobacter jejuni
V roce 2004 byl publikován možný vliv infekce bakterií Campylobacter jejuni na rozvoj imunoproliferativního onemocnění tenkého střeva (40). Jedná se o typ lymfomu vznikajícího v MALT tenkého střeva, pro který je charakteristický výskyt zkrácených monotypických těžkých α-řetězců imunoglobulinů bez současné asociace s příslušnými lehkými řetězci. C. jejuni nepřetrvává, narozdíl od výše popisovaného H. pylori, ve svém hostiteli potenciálně po celý život. To však nezbytně nevyvrací, že může být iniciátorem lymfoproliferativního procesu. Z těla může být eliminován až poté (59).
Role antigenů při vývoji lymfoproliferativních malignit
Teorie, že vývoj zhoubných nádorů zralých B-lymfocytů souvisí s antigenní stimulací, je v posledních letech všeobecně přijímána (60). Předpokládá se, že dlouhodobá antigenní stimulace B-lymfocytů doprovázená jejich proliferací zvyšuje riziko vzniku nepříznivých genetických událostí, které mohou vyústit až ve vznik neoplastického klonu (viz obr. 1). Jednou z otázek, která zůstává, je, jaká je povaha stimulujícího antigenu – zvažují se infekční agens i autoantigeny včetně tzv. kryptických antigenů, tj. antigenů, které nejsou za normálních okolností imunitním systémem rozpoznatelné, ale mohou se objevit např. až při buněčné smrti. Příkladem může být protein U1-70K, který je složkou malého jaderného ribonukleoproteinového komplexu (snRNP) U1. Tento protein se podílí na sestřihu pre-mRNA a během apoptózy je štěpen kaspázou 3. Stává se tak autoantigenem, který je popisován u SLE (61). Dědičné faktory, jako jsou rozdíly v HLA a jiných genech kódujících proteiny účastnící se imunitní odpovědi, se mohou chovat jako predispoziční faktory a mohou napomáhat jak vzniku lymfoidních malignit, tak autoimunitního onemocnění. Zatímco za normálních okolností může trvat vývoj lymfomu desítky let, za podmínek primární nebo sekundární imunodeficience je výrazně zkrácen.
Ke studiu vztahů mezi antigenní stimulací a maligní transformací B-lymfocytů přispěla analýza BCR receptorů u pacientů s CLL (60). U těchto pacientů je v maligních B-lymfocytech pozorováno jiné zastoupení IGHV subgenů v porovnání se zdravými B-lymfocyty. Až u 30 % pacientů se také v lehkém i těžkém řetězci vyskytují vysoce homologní, tzv. komplementaritu určující oblasti (CDR3 – complementarity-determining region 3) (62, 63). CDR3 je nejvariabilnější oblastí molekuly Ig, spoluurčuje antigenní specifitu BCR a je v podstatě jedinečná pro každý B-lymfocyt. Pravděpodobnost, že v populaci dojde k proliferaci lymfocytů se stejným nebo velmi podobným BCR, je extrémně nízká, což vede k hypotéze, že neoplastické klony lymfocytů jsou vybírány na základě omezeného počtu antigenů. Výskyt tzv. stereotypních BCR také svědčí pro to, že antigeny zapojené do patogenze CLL mají některé znaky společné, a potvrzuje fakt, že vznik a vývoj CLL je přinejmenším zčásti antigenně řízeným procesem.
Ukázalo se, že několik typů protilátek, které byly získány od pacientů s CLL a mají stereotypní receptory, je autoreaktivních. Existuje tedy možnost, že CLL může být ve svém vývoji spuštěna nebo podpořena autoantigeny. Na tomto procesu se podle některých studií mohou podílet také infekční agens (HCV, bakteriální infekce dýchacích cest) (64, 65).
Chronická antigenní stimulace se patrně uplatňuje také při vzniku mnohočetného myelomu (MM) a monoklonální gamapatie nejasného významu (MGUS). Mnohočetné myelomy jsou nádory z plazmatických buněk, u nichž došlo k somatické hypermutaci imunoglobulinových genů a přesmyku tříd (IgG nebo IgA) (60). Plazmablasty produkují monoklonální protilátky – paraproteiny. Je tedy pravděpodobné, že maligní klon je u MM selektován antigenem. Je zajímavé, že oproti tomu u MGUS probíhají antigenně podněcované somatické hypermutace průběžně. Podobně jako u CLL mají v některých případech paraproteiny mnohočetných myelomů autoprotilátkovou aktivitu, a reagují tak s vlastními antigeny nervového systému, molekulami imunoglobulinů, červenými krvinkami a srážecími faktory. V dalších případech jsou protilátky namířeny proti širokému spektru infekčních agens.
Struktura BCR je studována také u lymfomů vyskytujících se u autoimunitních chorob. Bende et al. (64) analyzovali 32 lymfomů slinných žláz asociovaných se Sjögrenovým syndromem. Zjistili, že ve více než 40 % případů byla oblast CDR3 membránových imunoglobulinů homologní s CDR3 revmatoidních faktorů (autoprotilátka vázající se na IgG, viz výše). To ukazuje, že za stimulaci B-lymfocytů mohou být zodpovědné IgG prostřednictvím imunokomplexů (2).
V synoviálních B-lymfocytech pacientů s RA bylo zjištěno nenáhodné využití genů těžkých řetězců imunoglobulinů a somatické hypermutace, což je považováno za znak antigenně řízené selekce (67). Kim a Berek (68) zjistili, že neoplastické buňky lymfomů u pacientů s RA jeví výraznou sekvenční homologii IGHV s řetězci přítomnými u B-buněčných lymfomů vznikajících u Sjögrenova syndromu a smíšené kryoglobulinémie asociované s hepatitidou C. Při patogenezi lymfomů asociovaných s různými autoimunitními chorobami se tedy mohou uplatňovat společné mechanismy.
Je však třeba vzít v úvahu, že u autoimunitních poruch zahrnuje pojem „zánětlivá aktivita“ nejen dlouhodobou aktivaci autoimunitních B-lymfocytů, ale také dlouhodobý zánět (2). Znaky obou jsou často patrné u RA, oproti tomu u Sjögrenova syndromu klinické projevy systémového zánětu chybí (69). Je možné, že dva různé řídící mechanismy vedou k různým typům lymfomů. U RA může dlouhodobá systémová zánětlivá aktivita vézt ke vzniku nelokalizovaných lymfomů a vyššímu výskytu DLBCL. Trvalá stimulace autoreaktivních B-lymfocytů naopak nejspíš souvisí se vznikem lymfomů u orgánově specifických autoimunitních poruch, jako je právě SS, u něhož jsou autoimunitní B-lymfocyty marginální zóny aktivovány ve slinných žlázách a dalších místech sliznice, což vede ke zvýšení výskytu lymfomů typu MALT a dalších lymfomů marginální zóny.
Je tedy zřejmé, že na vývoji alespoň některých maligních lymfoproliferací se podílí dlouhodobé působení určitých antigenů v organismu. To vede k přetrvávání a proliferaci klonů lymfocytů, z nichž jeden se vymkne kontrole a dojde k neoplastické transformaci. Takovýmto dlouhodobě působícím antigenem může být autoantigen nebo infekční agens. Jak je ale patrné z výše uvedených příkladů, při stimulaci některými infekčními agens často dochází současně k narušení regulace proliferace klonu lymfocytů a zároveň k narušení přísně regulované autoreaktivity imunitního systému. Příkladem komplexních vztahů mezi vznikem lymfoproliferativního onemocnění a působení infekčního agens za doprovodu autoreaktivního projevu je vývoj lymfomu typu MALT ve tkáni žaludku infikované bakteriemi Helicobacter pylori (viz obr. 2): Výsledky in vitro experimentů překvapivě ukázaly, že nádorové B-lymfocyty neodpovídají na H. pylori přímo, ale jejich přežití závisí na signálech poskytovaných Th lymfocyty přítomnými v tkáni nádoru, které jsou specifické pro H. pylori. (70). Další experimenty potvrdily, že rekombinantní protilátky odvozené z povrchových receptorů B lymfocytů (BCR) MZL žaludku nevykazují žádnou reaktivitu s H. pylori. U části lymfomů vzniklých v prostředí chronické infekce H. pylori však BCR vykazuje homologii s RF, váže se tedy na konstatní oblast IgG (66). Tato homologie je jedinečná pro lymfomy marginální zóny. Podle navrhovaného modelu (viz obr. 2) mohou být tedy MZL, které nesou BCR se silnou afinitou k IgG, nepřetržitě stimulovány komplexy antigen-protilátka, jako např. H. pylori opsonizovaný molekulami IgG u žaludečních MZL nebo komplexy IgG s SSA/SSB-RNA u Sjögrenova syndromu. Po BCR-zprostředkované internalizaci antigenu pak mohou být stimulovány Toll-like receptory TLR-7 a/nebo TLR-9 uvnitř B-lymfocytu, což přispívá ke konstitutivní aktivaci dráhy NF-κB. Tato dráha, která hraje významnou úlohu při vyzrávání B-lymfocytu a jeho nádorové transformaci, je také souběžně aktivována přímo přes BCR receptor a interakcí buňky s Th-lymfocytem.
Obr. 2. Model vysvětlující možný molekulární mechanismus vzniku lymfomu žaludku (MZL typu MALT) v prostředí chronické infekce H. pylori: Proliferace nádorových buněk je závislá na konstitutivní aktivaci dráhy NF-κB. Tato dráha může být aktivována souběžnou stimulací BCR/CD40/TLR-7/9 bakteriemi a složkami imunitního systému (viz text článku) nebo jako následek translokace t(11;18). Dokud je dráha NF-κB aktivována v důsledku přítomnosti H. pylori, může vést vyléčení bakteriální infekce k regresi nádoru. Hromadění genetických změn v nádorových buňkách může mít za následek aktivaci dráhy NF-κB bez závislosti na stimulech z vnějšího prostředí a u části pacientů také k progresi do DLBCL. BCR – B-lymfocytárního receptor, CD40 – receptor interagující s ligandem CD40L Th-lymfocytů, TLR-7/9 – Toll-like receptor interagující s CpG úseky DNA, RF – revmatoidní faktor = BCR receptor nebo protilátka rozpoznávající konstatní oblast imunoglobulinu 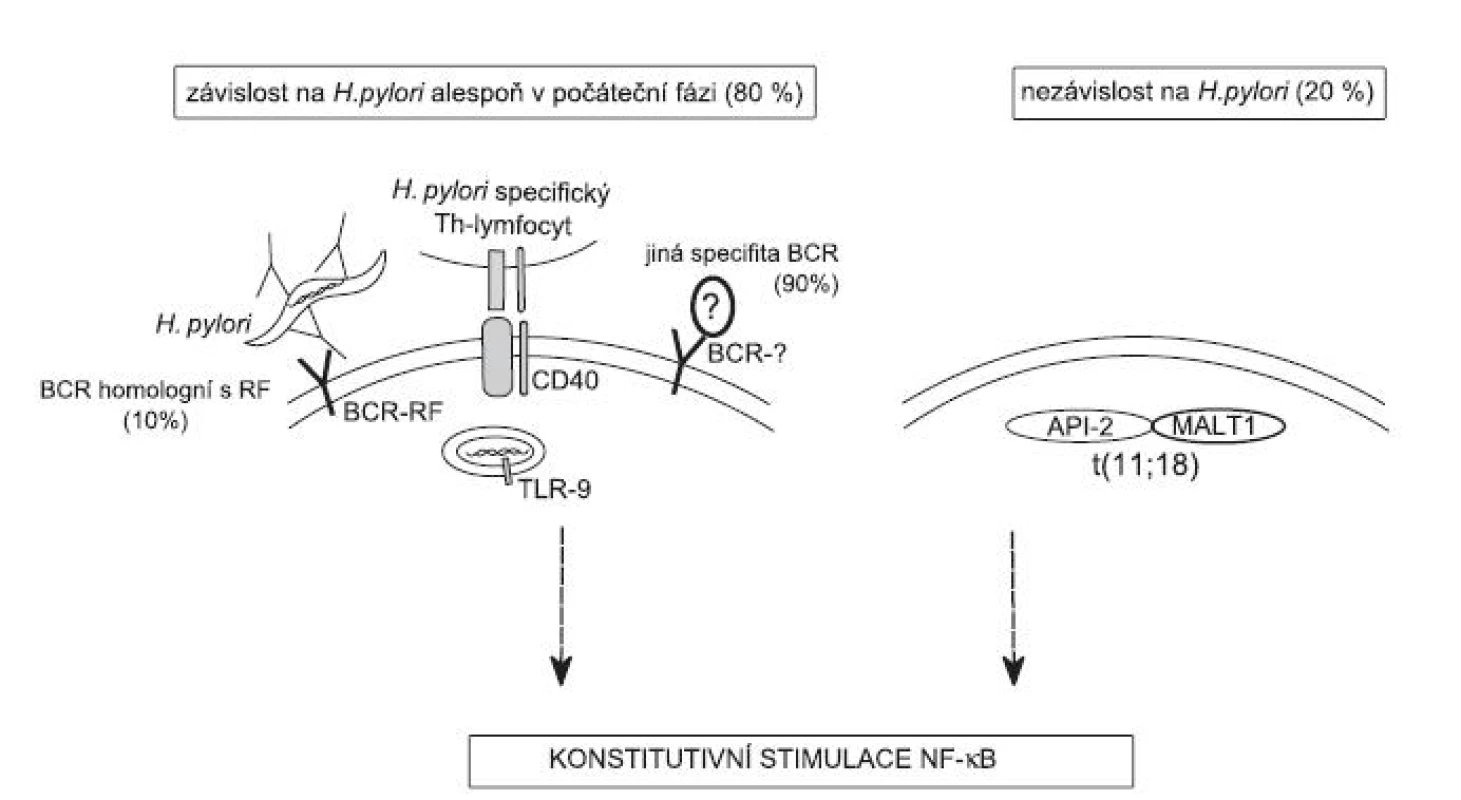
Závěr
Ačkoliv lymfoproliferace vztahující se k autoimunitním a zánětlivým onemocněním představují jen část všech lymfoproliferací v celé populaci, nová zjištění mohou přispět ke objasnění patogeneze ostatních sporadických lymfoproliferací.
V posledních letech se ustupuje od studií zaměřených na průměrné riziko vzniku lymfoproliferace u rozsáhlého vzorku pacientů s autoimunitními nebo zánětlivými nemocemi. Jako přínosnější se nyní zdají studie zjišťující, jak se riziko vzniku lymfoproliferace při stejném onemocnění mění u pacientů s různými fenotypovými charakteristikami a způsoby léčby. Z klinického hlediska se jeví jako nejpodstatnější otázka jak rozpoznat pacienty se zvýšeným rizikem vzniku nádoru a jak toto riziko redukovat (1). Je také nezbytné porozumět tomu, zda ke vzniku lymfoproliferací v těchto případech přispívá lékařská péče, nebo naopak její nedostatek. Hlubší zkoumání faktorů podílejících se na vzniku lymfoproliferací u nemocných s autoimunitní nebo zánětlivou poruchou by mělo vést k identifikaci pacientů s nejvyšším rizikem už při diagnóze jejich nemoci, a přispět tak k včasné diagnostice hrozícího lymfoproliferativního onemocnění.
Zkratky
AIHA – autoimunitní hemolytická anémie BCR – receptor B-lymfocytů BL – Burkittův lymfom CLL – chronická lymfocytární leukémie DLBCL – difuzní velkobuněčné B-lymfomy EBV – virus Epsteina-Barrové FL – folikulární lymfom HCV – virus hepatitidy C HIV – virus lidského imunodeficitu HL – Hodgkinův lymfom HTLV-1 – lidský T-lymfotropní virus 1 IGHV – těžký řetězec imunoglobulinu MALT – slizniční lymfoidní tkáň (mucosa-associated lymphoid tissue) MC – smíšená kryoglobulinémie (mixed cryoglobulinaemia) MCL – lymfom z plášťových buněk MGUS – monoklonální gamapatie nejasného významu MM – mnohočetný myelom MZL – lymfomy marginální zóny NHL – nehodgkinský lymfom RA – revmatoidní artritida RF – revmatoidní faktor RR – relativní riziko SLE – systémový lupus erythematodes SS – Sjögrenův syndrom SS-A, SS-B – nukleární antigeny TLR-7/9 – Toll-like receptor interagující s CpG úseky DNA TNF – tumor nekrotizující faktor Práce vznikla za podpory projektů IGA MZ ČR NS10439-3/2009, MŠMT ČR MSM0021622430 a MPO ČR FR-TI2/254.
Adresa pro korespondenci:
Mgr. Šárka Pavlová, PhD.
Centrum molekulární biologie a genové terapie, Interní hematoonkologická klinika LF MU a FN
Černopolní 9, 613 00 Brno
fax: +420 532 234 623, e-mail: spavlova@fnbrno.cz
Zdroje
1. Smedby K, Baecklund E, Askling J. Malignant lymphomas in autoimmunity and inflammation: a review of risks, risk factors, and lymphoma characteristics. Cancer Epidemiol Biomarkers Prev 2006; 15 : 2069–2077.
2. Smedby K, Askling J, Mariette X, et al. Autoimmune and inflammatory disorders and risk of malignant lymphomas – an update. J Intern Med 2008; 264 : 514–527.
3. Smedby K, Hjalgrim H, Askling J, et al. Autoimmune and chronic inflammatory disorders and risk of non-Hodgkin lymphoma by subtype. J Natl Cancer Inst 2006; 98 : 51–60.
4. Ekström Smedby K, Vajdic C, Falster M, et al. Autoimmune disorders and risk of non-Hodgkin lymphoma subtypes: a pooled analysis within the InterLymph Consortium. Blood 2008; 111 : 4029–4038.
5. Goldin L, Landgren O. Autoimmunity and lymphomagenesis. Int J Cancer 2009; 124 : 1497–1502.
6. Anderson L, Gadalla S, Morton L, et al. Population-based study of autoimmune conditions and the risk of specific lymphoid malignancies. Int J Cancer 2009; 125 : 398–405.
7. Yamamoto K. Pathogenesis of Sjögren‘s syndrome. Autoimmun Rev 2003; 2 : 13–18.
8. BjörnĆdal L, Löfström B, Yin L, et al. Increased cancer incidence in a Swedish cohort of patients with systemic lupus erythematosus. Scand J Rheumatol 2002; 31 : 66–71.
9. Prokopová L. Celiakie – co má vědět ambulantní internista. Interní Med 2008; 10 : 7.
10. Askling J, Linet M, Gridley G, et al. Cancer incidence in a population-based cohort of individuals hospitalized with celiac disease or dermatitis herpetiformis. Gastroenterology 2002; 123 : 1428–1435.
11. Isaacson P. Gastrointestinal lymphoma. Hum Pathol 1994; 25 : 1020–1029.
12. Cellier C, Delabesse E, Helmer C, et al. Refractory sprue, coeliac disease, and enteropathy-associated T-cell lymphoma. French Coeliac Disease Study Group. Lancet 2000; 356 : 203–208.
13. Holmes G, Prior P, Lane M, et al. Malignancy in coeliac disease – effect of a gluten free diet. Gut 1989; 30 : 333–338.
14. Bagdi E, Diss T, Munson P, et al. Mucosal intra-epithelial lymphocytes in enteropathy-associated T-cell lymphoma, ulcerative jejunitis, and refractory celiac disease constitute a neoplastic population. Blood 1999; 94 : 260–264.
15. Zintzaras E, Voulgarelis M, Moutsopoulos H. The risk of lymphoma development in autoimmune diseases: a meta-analysis. Arch Intern Med 2005; 165 : 2337–2344.
16. Gridley G, Klippel J, Hoover R, et al. Incidence of cancer among men with the Felty syndrome. Ann Intern Med 1994; 120 : 35–39.
17. Mariette X, Cazals-Hatem D, Warszawki J, et al. Lymphomas in rheumatoid arthritis patients treated with methotrexate: a 3‑year prospective study in France. Blood 2002; 99 : 3909–3915.
18. Baecklund E, Sundström C, Ekbom A, et al. Lymphoma subtypes in patients with rheumatoid arthritis: increased proportion of diffuse large B cell lymphoma. Arthritis Rheum 2003; 48 : 1543–1550.
19. Holm L, Blomgren H, Löwhagen T. Cancer risks in patients with chronic lymphocytic thyroiditis. N Engl J Med 1985; 312 : 601–604.
20. Derringer G, Thompson L, Frommelt R, et al. Malignant lymphoma of the thyroid gland: a clinicopathologic study of 108 cases. Am J Surg Pathol 2000; 24 : 623–639.
21. Troch M, Woehrer S, Streubel B, et al. Chronic autoimmune thyroiditis (Hashimoto‘s thyroiditis) in patients with MALT lymphoma. Ann Oncol 2008; 19 : 1336–1339.
22. Sigurgeirsson B, Lindelöf B, Edhag O, et al. Risk of cancer in patients with dermatomyositis or polymyositis. A population-based study. N Engl J Med 1992; 326 : 363–367.
23. Hill C, Zhang Y, Sigurgeirsson B, et al. Frequency of specific cancer types in dermatomyositis and polymyositis: a population-based study. Lancet 2001; 357 : 96–100.
24. Askling J, Brandt L, Lapidus A, et al. Risk of haematopoietic cancer in patients with inflammatory bowel disease. Gut 2005; 54 : 617–622.
25. Gelfand J, Shin D, Neimann A, et al. The risk of lymphoma in patients with psoriasis. J Invest Dermatol 2006; 126 : 2194–2201.
26. Nielsen N, Rostgaard K, Rasmussen S, et al. Cancer risk among patients with multiple sclerosis: a population-based register study. Int J Cancer 2006; 118 : 979–984.
27. Askling J, Klareskog L, Blomqvist P, et al. Risk for malignant lymphoma in ankylosing spondylitis: a nationwide Swedish case-control study. Ann Rheum Dis 2006; 65 : 1184–1187.
28. Faurschou M, Sorensen I, Mellemkjaer L, et al. Malignancies in Wegener‘s granulomatosis: incidence and relation to cyclophosphamide therapy in a cohort of 293 patients. J Rheumatol 2008; 35 : 100–105.
29. Zendehdel K, Nyrén O, Ostenson C, et al. Cancer incidence in patients with type 1 diabetes mellitus: a population-based cohort study in Sweden. J Natl Cancer Inst 2003; 95 : 1797–1800.
30. Hagler K, Lynch JJ. Paraneoplastic manifestations of lymphoma. Clin Lymphoma 2004; 5 : 29–36.
31. Sallah S, Sigounas G, Vos P, et al. Autoimmune hemolytic anemia in patients with non-Hodgkin‘s lymphoma: characteristics and significance. Ann Oncol 2000; 11 : 1571–1577.
32. Hegde U, Wilson W, White T, et al. Rituximab treatment of refractory fludarabine-associated immune thrombocytopenia in chronic lymphocytic leukemia. Blood 2002; 100 : 2260–2262.
33. Borthakur G, O‘Brien S, Wierda W, et al. Immune anaemias in patients with chronic lymphocytic leukaemia treated with fludarabine, cyclophosphamide and rituximab – incidence and predictors. Br J Haematol 2007; 136 : 800–805.
34. Fisher S, Fisher R. The epidemiology of non-Hodgkin‘s lymphoma. Oncogene 2004; 23 : 6524–6534.
35. Fisher S, Fisher R. The emerging concept of antigen-driven lymphomas: epidemiology and treatment implications. Curr Opin Oncol 2006; 18 : 417–424.
36. Libra M, Gasparotto D, Gloghini A, et al. Hepatitis C virus (HCV) I hepatitis C virus (HCV) infection and lymphoproliferative disorders. Front Biosci 2005; 10 : 2460–2471.
37. Uemura N, Okamoto S, Yamamoto S, et al. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med 2001; 345 : 784–789.
38. Goodlad J, Davidson M, Hollowood K, et al. Primary cutaneous B-cell lymphoma and Borrelia burgdorferi infection in patients from the Highlands of Scotland. Am J Surg Pathol 2000; 24 : 1279–1285.
39. Ferreri A, Guidoboni M, Ponzoni M, et al. Evidence for an association between Chlamydia psittaci and ocular adnexal lymphomas. J Natl Cancer Inst 2004; 96 : 586–594.
40. Lecuit M, Abachin E, Martin A, et al. Immunoproliferative small intestinal disease associated with Campylobacter jejuni. N Engl J Med 2004; 350 : 239–248.
41. Shah K, Young L. Epstein-Barr virus and carcinogenesis: beyond Burkitt‘s lymphoma. Clin Microbiol Infect 2009; 15 : 982–988.
42. Tao Q, Robertson K, Manns A, et al. Epstein-Barr virus (EBV) in endemic Burkitt‘s lymphoma: molecular analysis of primary tumor tissue. Blood 1998; 91 : 1373–1381.
43. Hamilton-Dutoit S, Pallesen G, Franzmann M, et al. AIDS-related lymphoma. Histopathology, immunophenotype, and association with Epstein-Barr virus as demonstrated by in situ nucleic acid hybridization. Am J Pathol 1991; 138 : 149–163.
44. Dal Maso L, Franceschi S. Epidemiology of non-Hodgkin lymphomas and other haemolymphopoietic neoplasms in people with AIDS. Lancet Oncol 2003; 4 : 110–119.
45. Kirk O, Pedersen C, Cozzi-Lepri A, et al. Non-Hodgkin lymphoma in HIV-infected patients in the era of highly active antiretroviral therapy. Blood 2001; 98 : 3406–3412.
46. Clifford G, Polesel J, Rickenbach M, et al. Cancer risk in the Swiss HIV Cohort Study: associations with immunodeficiency, smoking, and highly active antiretroviral therapy. J Natl Cancer Inst 2005; 97 : 425–432.
47. Aljurf M, Owaidah T, Ezzat A, et al. Antigen – and/or immune-driven lymphoproliferative disorders. Ann Oncol 2003; 14 : 1595–1606.
48. Mele A, Pulsoni A, Bianco E, et al. Hepatitis C virus and B-cell non-Hodgkin lymphomas: an Italian multicenter case-control study. Blood 2003; 102 : 996–999.
49. Vallisa D, Bernuzzi P, Arcaini L, et al. Role of anti-hepatitis C virus (HCV) treatment in HCV-related, low-grade, B-cell, non-Hodgkin‘s lymphoma: a multicenter Italian experience. J Clin Oncol 2005; 23 : 468–473.
50. Ferri C, Monti M, La Civita L, et al. Infection of peripheral blood mononuclear cells by hepatitis C virus in mixed cryoglobulinemia. Blood 1993; 82 : 3701–3704.
51. Charles E, Dustin L. Hepatitis C virus-induced cryoglobulinemia. Kidney Int 2009; 76 : 818–824.
52. Saadoun D, Landau D, Calabrese L, et al. Hepatitis C-associated mixed cryoglobulinaemia: a crossroad between autoimmunity and lymphoproliferation. Rheumatology (Oxford) 2007; 46 : 1234–1242.
53. Wotherspoon A, Ortiz-Hidalgo C, Falzon M, et al. Helicobacter pylori – associated gastritis and primary B-cell gastric lymphoma. Lancet 1991; 338 : 1175–1176.
54. Bende R, van Maldegem F, van Noesel C. Chronic inflammatory disease, lymphoid tissue neogenesis and extranodal marginal zone B-cell lymphomas. Haematologica 2009; 94 : 1109–1123.
55. Garbe C, Stein H, Dienemann D, et al. Borrelia burgdorferi – associated cutaneous B-cell lymphoma: clinical and immunohistologic characterization of four cases. J Am Acad Dermatol 1991; 24 : 584–590.
56. Aarts W, Willemze R, Bende R, et al. VH gene analysis of primary cutaneous B-cell lymphomas: evidence for ongoing somatic hypermutation and isotype switching. Blood 1998; 92 : 3857–3864.
57. Zhang G, Winter J, Variakojis D, et al. Lack of an association between Chlamydia psittaci and ocular adnexal lymphoma. Leuk Lymphoma 2007; 48 : 577–583.
58. Aigelsreiter A, Leitner E, Deutsch A, et al. Chlamydia psittaci in MALT lymphomas of ocular adnexals: the Austrian experience. Leuk Res 2008; 32 : 1292–1294.
59. Peek RJ. Intestinal malignancy and Campylobacter jejuni. Gastroenterology 2004; 127 : 1266–1267; discussion 1267–1268.
60. Caligaris-Cappio F. Autoimmune disorders and lymphoma. Ann Oncol 2008; 19(Suppl 4): iv31–34.
61. Rodenburg R, Raats J, Pruijn G, et al. Cell death: a trigger of autoimmunity? Bioessays 2000; 22 : 627–636.
62. Johnson T, Rassenti L, Kipps T. Ig VH1 genes expressed in B cell chronic lymphocytic leukemia exhibit distinctive molecular features. J Immunol 1997; 158 : 235–246.
63. Stamatopoulos K, Belessi C, Moreno C, et al. Over 20% of patients with chronic lymphocytic leukemia carry stereotyped receptors: Pathogenetic implications and clinical correlations. Blood 2007; 109 : 259–270.
64. Kostareli E, Janus A, Gounari M, et al. Chronic Lymphocytic Leukemia with Stereotyped IGHV4-59/IGKV3-20 B Cell Receptors: Another Manifestation of Hepatitis C Virus‑Associated B Cell Lymphoproliferation? Blood ASH Annual Meeting Abstracts) 2009; 114: Abstract 2331.
65. Landgren O, Rapkin J, Caporaso N, et al. Respiratory tract infections and subsequent risk of chronic lymphocytic leukemia. Blood 2007; 109 : 2198–2201.
66. Bende R, Aarts W, Riedl R, et al. Among B cell non-Hodgkin‘s lymphomas, MALT lymphomas express a unique antibody repertoire with frequent rheumatoid factor reactivity. J Exp Med 2005; 201 : 1229–1241.
67. Quartuccio L, De Re V, Fabris M, et al. Atypical lymphoproliferation progressing into B-cell lymphoma in rheumatoid arthritis treated with different biological agents: clinical course and molecular characterization. Haematologica 2006; 91 : 691–694.
68. Kim H, Berek C. B-cells in rheumatoid arthritis. Arthritis Res 2000; 2 : 126–131.
69. Gottenberg J, Busson M, Cohen-Solal J, et al. Correlation of serum B lymphocyte stimulator and beta2 microglobulin with autoantibody secretion and systemic involvement in primary Sjőgren‘s syndrome. Ann Rheum Dis 2005; 64 : 1050–1055.
70. Hussell T, Isaacson P, Crabtree J, et al. Helicobacter pylori – specific tumour-infiltrating T cells provide contact dependent help for the growth of malignant B cells in low-grade gastric lymphoma of mucosa-associated lymphoid tissue. J Pathol 1996; 178 : 122–127.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Neurogenní plicní edémČlánek Eugen Strouhal – 80. letČlánek LÉKAŘSTVÍ STARÝCH EGYPŤANŮ IČlánek HALDAN KEFFER HARTLINEČlánek Ateroskleróza 2010
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
-
Všetky články tohto čísla
- Neurogenní plicní edém
- Zásadní význam chirurgické léčby u karcinomu ledvin, možnosti biologické léčby
- Lymfoproliferativní onemocnění u pacientů s autoimunitními a infekčními onemocněními: význam antigenní stimulace a zánětlivých procesů
- Ambulance paliativní onkologické péče
- Česko-slovenská nemocnice v Ugandě v letech 2009–2010
- Kolegové profesora Josefa Thomayera v jeho zápiscích z let 1905–1918
- Ateroskleróza 2010
-
Sympozium z dějin farmacie a veterinární medicíny
Brno, 7. října 2010 -
Profesní problematika v alergologii
Praha, 11. listopadu 2010 -
12. beskydské alergologické a imunologické dny
Malenovice, 19. a 20. listopadu 2010 -
Medzinárodná konferencia o lyzozómových poruchách
Praha, 2.–4. december 2010 - Eugen Strouhal – 80. let
- Dvacet let po odchodu prof. MUDr. Jana Dobiáše, CSc. a deset let po odchodu prof. MUDr. Vladimíra Študenta, DrSc.
- Zkrácený projev prof. MUDr. Jaroslava Blahoše, DrSc. na Volebním sjezdu delegátů ČLS JEP
- LÉKAŘSTVÍ STARÝCH EGYPŤANŮ I
- HALDAN KEFFER HARTLINE
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Lymfoproliferativní onemocnění u pacientů s autoimunitními a infekčními onemocněními: význam antigenní stimulace a zánětlivých procesů
- Neurogenní plicní edém
- LÉKAŘSTVÍ STARÝCH EGYPŤANŮ I
- Zásadní význam chirurgické léčby u karcinomu ledvin, možnosti biologické léčby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



