-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kryokonzervace spermatu před gonadotoxickou léčbou ve Fakultní nemocnici Brno v letech 1995–2020
Cryopreservation of sperm before gonadotoxic treatment at the University Hospital Brno in the years 1995–2020
Objective: Sperm cryopreservation before gonadotoxic treatment is the basic and mos teffective method of preserving reproduction, which can be used during adolescence. The communication summarizes 26 years of experience in the operation of an oncological sperm bank, analyzes spermiograms of oncological patients, assesses the relationship between sperm pathology and diagnosis, and determines the number of deaths and the use of frozen sperm.
Methods: During the existence of CAR 01 (assisted reproduction center), more than 50,000 spermiograms were performed. From January 1995 to December 2020, a total of 24,729 men were examined within the sperm bank, of which 1,448 (5.9%) had an oncological diagnosis. The spermiograms were evaluated according to current WHO (World Health Organization) manuals. Cryopreservation of sperm has undergone a major development. The rules for the storage of frozen cells have been laid down by Act No. 296/2008 Coll. since 2008. In 2019, the methodology „Cryopreservation of reproductive cells and tissues in patients before cancer treatment“ was updated. In all cases, the standard thawing technique was used. The sperms were processed by the swim-up method. As part of the treatment with assisted reproduction methods, oocytes were fertilized by the ICSI (intracytoplasmatic sperm injection) micromanipulation technique.
Results: Out of 1,448 examined spermiograms in men with oncological diagnoses, testicular cancer was present in 43.7% of patients and malignant diseases of lymphatic and hematopoietic tissue were found in 24.1%, of which 70,1% included Hodgkin‘s lymphomas and 29,9% were non-Hodgkin‘s lymphomas. Leukemia was found in 7.9%, bone and cartilage cancers in 6.8%. The age of the clients of the whole group ranged from 13 to 64 years (27.2 ± 6.8 years). A total of 38.3% of men had normozoospermia, 54.2% of spermiograms showed pathological findings in 1 to 3 evaluated parameters and 7.5% of patients had azoospermia. Severe asthenozoospermia (mobility ≤ 10%) was detected in 57.2% of men and severe oligozoospermia (concentration ≤ 1 × 106 mm3) in 22.3% of patients. The lowest values of the spermiogram were found in men with testicular cancer; the best values were seen in CNS (central nervous system) cancers. The cryopreservation of sperm was performed in 1,340 cases (92.5%). So far, a total of 160 men (11.9%) have used frozen sperm, of which 6.2% in our center. In these 83 cases, the ICSI technique was always used, 38 clinical pregnancies (45.8%) and 32 births were achieved. We have registered 424 completed storages of semen (31.6%), of which 148 (11.0% of all oncology patients) were made due to death and the others at patients’ request. Using the sperm of the dead is a specific issue.
Conclusion: In cancer patients, sperm pathologies occur in high percentage. The lowest spermiogram values were found in men with testicular cancer. It is necessary to take into account long-term storage and fertilization by micromanipulation methods. The number of men who die is significantly higher than the number of those who use sperm to treat infertility. Cryopreservation of sperm should be offered to each patient prior to the therapy leading to the destruction of spermatogenesis.
Keywords:
spermiogram – sperm banking – cryopreservation of sperm – malignancies – gonadotoxic treatment – assisted reproduction – oncofertility – spermiogram – sperm banking – cryopreservation of sperm – malignancies – gonadotoxic treatment – assisted reproduction – oncofertility
Autori: Ventruba Pavel 1; Žáková Jana 1; Ješeta Michal 1; Crha Igor 1,2; Lousová Eva 1; Huser Martin 1; Hudeček Robert 1
Pôsobisko autorov: Gynekologicko-porodnická klinika LF MU a FN Brno 1; Katedra ošetřovatelství a porodní asistence, LF MU Brno 2
Vyšlo v časopise: Ceska Gynekol 2021; 86(3): 156-162
Kategória: Pôvodná práca
doi: https://doi.org/10.48095/cccg2021156Súhrn
Cíl práce: Kryokonzervace spermatu před gonadotoxickou léčbou je základní a nejúčinnější metodou zachování reprodukce, která může být využita i v období adolescence. Sdělení shrnuje 26 let zkušeností provozu onkologické spermabanky, uvádí analýzy spermiogramů onkologic-kých pacientů, posouzení vztahu patologie spermatu s diagnózou, stanovení počtu zemřelých a využití zamrazeného spermatu.
Metodika: Za dobu existence CAR 01 (centrum asistované reprodukce) bylo provedeno více než 50 000 spermiogramů. V rámci spermabanky od ledna 1995 do prosince 2020 bylo vyšetřeno 24 729 mužů, z toho 1 448 (5,9 %) mělo onkologickou diagnózu. Spermiogramy byly vyhodnoceny podle aktuálních manuálů Světové zdravotnické organizace (WHO – World Health Organization). Kryokonzervace spermatu prošla zásadním vývojem. Pravidla pro skladování zamražených buněk jsou od roku 2008 stanoveny zákonem č. 296/2008 Sb. V roce 2019 byla aktualizována metodika „Kryokonzervace reprodukčních buněk a tkání u pacientů před onkologickou léčbou”. Ve všech případech byla použita standardní technika rozmrazení. Spermie byly zpracovány metodou swim-up. V rámci léčby metodami asistované reprodukce byly oocyty oplozovány mikromanipulační technikou ICSI (intracytoplazmatická injekce spermie).
Výsledky: Z 1 448 vyšetřených spermiogramů u mužů s onkologickou diagnózou byl zhoubný nádor varlete u 43,7 % pacientů, maligní onemocnění mízní a krvetvorné tkáně v 24,1 %, z toho Hodgkinův lymfom 70,1 %, non-Hodgkinův lymfom 29,9 %. Leukemie byla zjištěna u 7,9 %, zhoubné nádory kostí a chrupavek u 6,8 % pacientů. Věk klientů celého souboru byl od 13 do 64 let (27,2 ± 6,8 let). Normozoospermii mělo 38,3 % mužů, 54,2 % spermiogramů vykázalo patologický nález v 1–3 hodnocených parametrech a azoospermii mělo 7,5 % pacientů. Těžká astenozoospermie (pohyblivost ≤ 10 %) byla prokázána u 57,2 % mužů a těžká oligozoospermie (koncentrace ≤ 1 × 106 mm3) u 22,3 % pacientů. Nejnižší hodnoty spermiogramu byly zjištěny u mužů s tumorem varlete, nejlepší hodnoty byly u nádorových onemocnění centrální nervové soustavy (CNS). Kryokonzervace spermatu byla provedena v 1 340 případech (92,5 %). Zamrazené sperma dosud celkem využilo 160 mužů (11,9 %), z toho 83 u nás (6,2 %). V těchto 83 případech byla vždy použita technika ICSI, bylo dosaženo 38 klinických těhotenství (45,8 %) a 32 porodů. Máme evidováno 424 ukončených skladování spermatu (31,6 %), z toho 148 z důvodu úmrtí, tzn. u 11,0 % všech onkologických pacientů, ostatní na vlastní žádost. Specifickou otázkou je využití spermatu zemřelých.
Závěr: U onkologických pacientů jsou ve vysokém procentu těžké patologie spermatu. Nejnižší hodnoty spermiogramu byly prokázány u mužů se zhoubným nádorem varlete. Je nutné počítat s dlouhodobým skladováním a oplozením mikromanipulačními metodami. Počet mužů, kteří zemřou, je výrazně vyšší než těch, kteří sperma využijí pro léčbu neplodnosti. Kryokonzervace spermatu by měla být nabídnuta každému pacientovi před terapií vedoucí k destrukci spermatogeneze.
Klíčová slova:
spermiogram – spermabanka – kryokonzervace spermatu – zhoubné nádory – gonadotoxická léčba – asistovaná reprodukce – onkofertilita
Úvod
Kryokonzervace spermatu před gonadotoxickou léčbou je základní a nejúčinnější metodou zachování reprodukce u mužů, která může být využita i v období adolescence. Pro efektivní využití tohoto přístupu je nezbytná úzká spolupráce mezi onkologickým pracovištěm a centrem asistované reprodukce (CAR) schopným tuto péči poskytnout. CAR 01 Brno zahájilo program zamražení a dlouhodobého uskladnění spermatu již v roce 1990 a od roku 1995 je rozvíjen onkologický program [1–3].
Terapeutické postupy využívané u onkologických onemocnění mají různé stupně účinků na gametogenezi, v závislosti na kvalitě spermií před léčbou, typu malignity, vlastnostech léku, léčebném režimu a citlivosti pacienta. Proto není možné spolehlivě předpovědět, zda se z konkrétního pacienta stane trvale azoospermik, nebo naopak zda se po léčbě obnoví parciální normální spermatogeneze [4,5]. Ve skutečnosti se míra azoospermie po chemoterapii pohybuje v rozmezí 0–63 %, podle diagnózy a terapeutického protokolu [4]. Nicméně pro mužské onkologické pacienty je klíčové rutinní použití metody intracytoplazmatické injekce spermie (ICSI) do oocytu v asistované reprodukci. Zavedení mikromanipulační techniky oplození oocytu vybranou spermií zcela změnilo reprodukční vyhlídky chlapců a mužů léčených s rakovinou. Díky metodě ICSI by měly být kryokonzervovány téměř všechny vzorky spermatu, i ty, které obsahují třeba i jen několik živých spermií [6]. Kryokonzervace by neměla být prováděna po zahájení terapie z důvodu chromozomálního a strukturálního poškození spermií během terapie [7]. Gonadotoxické účinky a doba regenerace spermií po radioterapii závisí nejen na počáteční kvalitě spermatu, ale také na dávkování a způsobu podání chemoterapeutik a na fázi spermatogeneze, na kterou má daný lék vliv. Kombinovaná léčba radioterapií a chemoterapií vyvolá větší gonadotoxicitu než použití těchto metod samostatně [8].
Sdělení shrnuje 26 let zkušeností provozu onkologické spermabanky, uvádí analýzy spermiogramů onkologických pacientů, posouzení vztahu patologie spermatu s diagnózou, stanovení počtu zemřelých, využití zamrazeného spermatu metodami asistované reprodukce a dosažená těhotenství.
Metodika
Od vzniku CAR 01 na Gynekologicko-porodnické klinice Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno (GPK LF MU a FN Brno) v roce 1982 zde bylo provedeno více než 50 000 spermiogramů. V rámci činnosti spermabanky bylo za období leden 1995 až prosinec 2020 vyšetřeno 24 729 mužů, z toho 1 448 (5,9 %) pacientů mělo onkologickou diagnózu.
Sperma bylo získáno masturbací do sterilní nádoby a před analýzou ponecháno 60 min. Spermiogramy byly vyhodnoceny podle aktuálního laboratorního manuálu Světové zdravotnické organizace (WHO – World Health Organization), s použitím nejprve Bürkerovy a nyní Maklerovy počítací komůrky. Do roku 2005 byla prováděna pomalá kryokonzervace spermatu s kryoprotektivním Richardsonovým médiem na přístroji Planer Kryo F10 standardní křivkou pomalého ochlazování (Sunbury-On-Thames, Velká Británie). Od roku 2005 byly vzorky kryokonzervovány metodou rychlého mrazení ejakulátu za pomoci komerčních kryokonzervačních médií v parách a v tekutém dusíku. Zamrazení spermatu bylo prováděno po naředění do kryoprotektivního média Medi-Cult, resp. Origio (Dánsko) s přihlédnutím k počtu spermií a jejich motilitě. Ejakulát byl smíchán s kryoprotektantem a rozdělen do 1,0 ml, resp. 1,8 ml kryotub (Nunc, Dánsko).
Kryotuby byly skladovány v kapalném dusíku při –196 °C v kontejneru na tekutý dusík MVE XC Dewar (Tailor-Wharton, Velká Británie). Od roku 2008 jsou pravidla pro skladování zamražených buněk stanoveny zákonem (296/2008 Sb.) a související vyhláškou 422/2008 Sb. [9,10]. Technologie kryokonzervace a postupy používané při skladování zmrazených vzorků spermií byly zaměřeny na minimalizaci rizik možného křížového přenosu infekce. Bylo vyžadováno předběžné vyšetření pacientů na hepatitidu B a C, HIV 1, 2 a syfilis.
Naše CAR GPK má výbornou mezioborovou spolupráci s onkologickými centry z FN Brno a Fakultní nemocnice u sv. Anny (FN u sv. Anny), s Masarykovým onkologickým ústavem (MOÚ) a s dalšími mimobrněnskými pracovišti. V roce 2019 byla zaktualizována a zjednodušena metodika „Kryokonzervace reprodukčních buněk a tkání u pacientů před onkologickou léčbou” tak, aby byla pro odesílající lékaře i klienty co nejsnazší [11].
Ve všech případech využití kryokonzervovaného spermatu byla u našich klientů použita standardní technika rozmrazení. Po vytažení z tekutého dusíku byl vzorek ponechán 10 min v termoboxu při teplotě 37 °C, poté promyt médiem vhodným pro spermie, promíchán a centrifugován. Spermie byly zpracovány metodou swim-up. V rámci léčby metodami asistované reprodukce byly oocyty oplozovány mikromanipulační technikou ICSI, případně v kombinaci s technikou PICSI (intracytoplazmatické injekce předvybrané spermie), tj. s využitím injekce preselektované spermie pomocí hyaluronanu.
Data byla hodnocena základní popisnou statistikou, vztahy mezi parametry spermiogramu a diagnózou byly testovány metodou Kruskal-Wallis ANOVA.
Výsledky
Naše publikované práce z let 1995 – –2005 shrnují vyšetření spermatu před terapií maligního nádoru chemoterapií, aktinoterapií nebo orchidektomií u 521 pacientů, tj. v průměru 47 případů ročně [4,5,34]. V období 2006–2020, které zahrnuje 927 vyšetřených onkologických pacientů, došlo k nárůstu průměrného ročního počtu na 62 případů za rok [2,12].
Z celkového souboru 1 448 vyšetřených spermiogramů u mužů s onkologickou diagnózou v letech 1995–2020 byl diagnostikován zhoubný nádor varlete u 43,7 % pacientů, maligní onemocnění mízní a krvetvorné tkáně v 24,1 %, z toho Hodgkinův lymfom 17,8 % a non-Hodgkinův lymfom 7,6 %. Leukemie byla zjištěna u 7,9 % a zhoubné nádory kostí a chrupavek u 6,8 % pacientů. Další diagnózy zahrnovaly zhoubná onemocnění gastrointestinálního traktu (GIT), ledvin a retroperitonea (17,5 %) (tab. 1). Věk klientů celého souboru byl v rozmezí 13–64 let (27,2 ± 6,8 let). Rozložení vyšetření spermiogramu u onkologických pacientů v jednotlivých letech shrnuje graf 1.
Tab. 1. Indikace ke kryokonzervaci spermatu u onkologických pacientů. Indications for sperm cryopreservation in cancer patients. 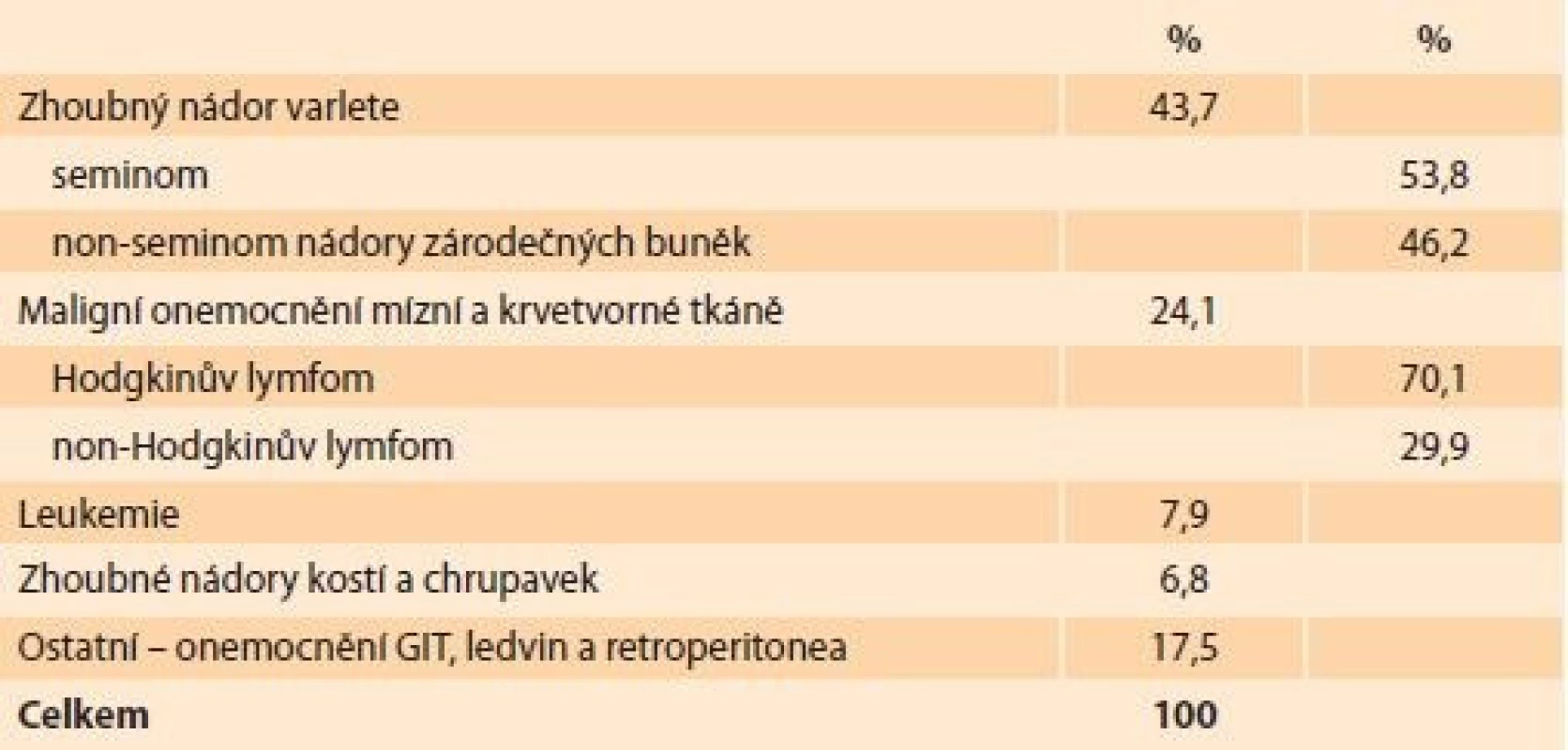
GIT – gastrointestinální trakt Graf 1. Rozložení onkologických pacientů v letech 1995–2020. Soubor 1995–2005 zahrnuje 521 pacientů a soubor 2006–2020 má 927 pacientů se zamrazením spermatu před terapií maligního nádoru chemoterapií, aktinoterapií nebo orchidektomií. Distribution of oncological patients in the years 1995–2020. The 1995–2005 group includes 521 patients and the 2006–2020 group has 927 patients with sperm freezing before the treatment of a malignant tumor with chemotherapy, actinotherapy or orchidectomy. 
Z hodnocení spermiogramů vyplynulo, že normozoospermii mělo pouze 38,3 % mužů a naopak byl vysoký podíl azoospermie (7,5 %). Zbývajících 54,2 % spermiogramů vykázalo patologický nález v 1–3 hodnocených parametrech (koncentrace spermií, pohyblivost, morfologie). Z této skupiny pacientů měla více než polovina (57,2 %) těžkou astenozoospermii (pohyblivost spermií ≤ 10 %). Těžkou oligozoospermii (koncentrace ≤ 1 × 106 mm3) mělo 22,3 % mužů (tab. 2). Nejnižší hodnoty spermiogramu byly zjištěny u mužů s diagnózou tumoru varlete, kdy průměrná koncentrace spermií dosáhla 17,9 × 106 mm3 a průměrná pohyblivost byla 9,0 %. Nejlepší hodnoty spermiogramu byly u nádorových onemocnění CNS (centrální nervová soustava) s průměrnou koncentrací spermií 44,9 × 106 mm3 a pohyblivostí spermií 15,4 %.
Tab. 2. Hodnoty spermiogramů u onkologických pacientů. Values of spermiograms in cancer patients. 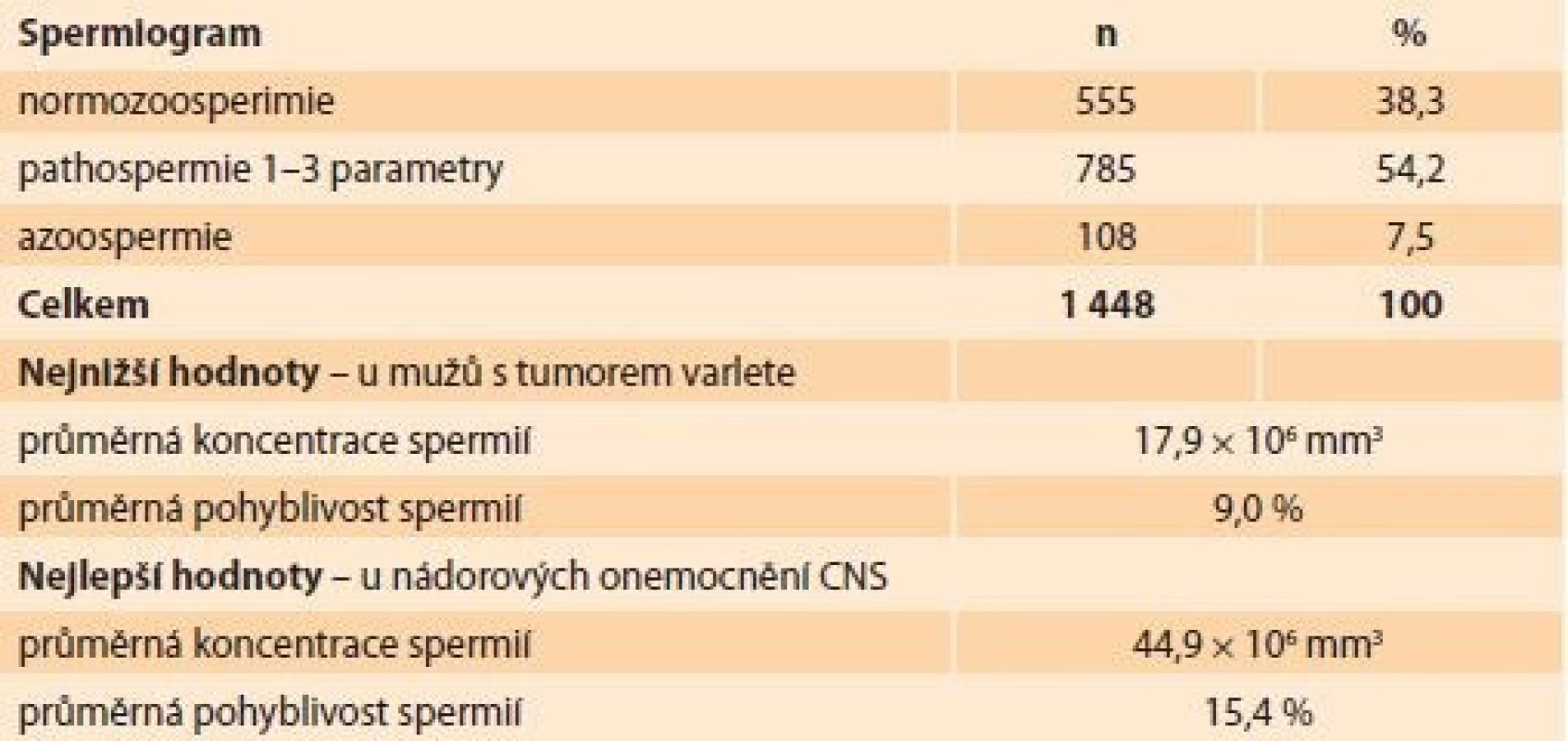
n – celkový počet CNS – centrální nervová soustava Kryokonzervace spermatu u onkologických pacientů byla provedena v 1 340 případech (92,5 %). U 108 mužů s prokázanou azoospermií (7,5 %) nebylo možné sperma zamrazit (graf 2).
Graf 2. Vyšetření spermiogramu v CAR 01 Brno 1985–2020. Examination of spermiogram at CAR 01 Brno 1985–2020. 
CAR – centrum asistované reprodukce AR – asistované reprodukce SPG – spermiogram IUI – intrauterinní inseminace Zamrazené sperma dosud využilo 160 mužů (11,9 %), z toho 83 pacientů na našem CAR (6,2 %) a u 77 klientů (5,7 %) byl proveden transport spermatu na jiné pracoviště v ČR. Ve všech našich 83 případech byla použita technika ICSI oplození oocytů a byl proveden transfer jednoho embrya. U 38 párů (45,8 %) bylo dosaženo klinické těhotenství a 32 porodů zdravého dítěte. Máme evidováno celkem 424 ukončených skladování spermatu (31,6 %), z toho 148 z důvodu úmrtí, tzn. u 11,0 % všech onkologických pacientů. Ve zbývajících 226 případech (68,4 %) byla ukončena kryokonzervace spermatu na vlastní žádost pacienta.
Diskuze
Zahájení programu asistované reprodukce na naší klinice na počátku 80. let s dosažením porodu prvního dítěte ze zkumavky v bývalém Československu umožnilo prudký rozvoj diagnostiky a léčby poruch plodnosti. Zavádění kryokonzervace spermatu a embryí bylo spojeno se vznikem spermabanky a andrologického centra. Postupně byla zahájena spolupráce s onkologickými pracovišti FN Brno, Fakultní dětské nemocnice, FN u sv. Anny a MOÚ v rámci zachování možnosti budoucí reprodukce jejich pacientů.
Vzestup incidence andrologického faktoru poruch plodnosti s poklesem parametrů spermiogramu byl jasně prezentován rozsáhlou metaanalýzou v roce 2017 a projevil se i v opakovaných vydáních manuálu WHO (1980, 1987, 1992, 1999 a aktuální vydání z roku 2010) na jeho hodnocení [13]. Rovněž metodika hodnocení, zpracování a kryokonzervace spermatu našeho souboru prošla během 26 let řadou změn – od techniky použití programovatelných zmrazovačů až po současné metodiky využívající počátečního zmrazení vzorků v parách dusíku a následně pro dlouhodobou kryokonzervaci, kdy jsou vzorky přeneseny do kapalného dusíku.
Poškození spermií kryokonzervací je minimální, pokud je postupováno správně během procesu kryokonzervace. Vlastní doba skladování spermií není problém, protože spermie lze skladovat v kapalném dusíku (teplota –196 °C) po celá desetiletí bez ztráty kvality [14]. Léčba rakoviny zahrnující chemoterapii či radiační terapii může poškodit reprodukční funkce přímým poškozením zárodečného epitelu způsobující oligozoospermii či azoospermii, nebo může dojít k poškození nervové dráhy a narušení reflexu erekce či ejakulace [15]. Je známo, že testikulární tkáň je velice citlivá a může být poškozena během radioterapie a navíc některé látky jako alkylační činidla nebo platina mají destrukční efekt na zárodečný testikulární epitel [10]. Radioterapie a chemoterapie mohou navíc být příčinou vzniku aneuploidních spermií [16]. Kolem 15–30 % vyléčených pacientů s rakovinou zůstává po terapii dlouhodobě sterilních [17]. Ačkoli se obecně předpokládá, že muži léčení na rakovinu varlat mají lepší prognózu pro zachování svého progenitivního potenciálu, nedávná velká multicentrická studie ukázala, že přibližně jeden ze tří léčených pacientů s touto diagnózou měl potíže s oplodněním své partnerky, zejména po radioterapii [18].
Během doby našeho souboru se vyvíjela pravidla pro skladování. V roce 2008 vyšel zákon o zajištění jakosti a bezpečnosti lidských tkání a buněk určených k použití u člověka a o změně souvisejících zákonů (zákon o lidských tkáních a buňkách) a vyhláška č. 422/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidských tkání a buněk určených k použití u člověka [9,19]. Z něj vyplynuly požadavky na minimalizaci rizik možného křížového přenosu infekce. Bylo nařízeno předběžné vyšetření pacientů na hepatitidu B a C, HIV 1, 2 a syfilis. Pro případy infekčních vzorků byly vyčleněny samostatné kontejnery pro každou infekci zvlášť.
Využití zamrazeného spermatu u onkologických pacientů pro následnou léčbu metodami asistované reprodukce je ovlivněno více faktory. Přímo na našem pracovišti bylo sperma využito relativně v malém počtu 6,2 % pacientů. Je nutné však vzít v potaz, že dalších 77 klientů využilo možnost transportu spermatu na geograficky bližší CAR, kde následně podstoupili léčbu poruch plodnosti. Důvodem je koncentrace léčby onkologických pacientů z celé ČR na brněnských pracovištích. Celkové využití kryokonzervovaného spermatu našeho souboru tak činí 11,9 % a je vyšší ve srovnání s italským centrem IRCCS (Scientific Institute for Research, Hospitalization and Healthcare), kde bylo během 15 let zamraženo sperma 682 onkologických pacientů, ale pouze 4 % mužů sperma využilo (26 pacientů) a 2 % pacientů si nechala spermie převézt do jiného centra [19]. Podobně v japonské studii na University of Medical school Tokyo bylo prezentováno, že z celkového množství zamrazeného spermatu od 122 onkologických pacientů využilo své spermie pro IVF (in vitro fertilizaci) pouze 12 mužů (9,8 %) a z nich bylo dosaženo 41,7 % klinických těhotenství [21]. Obecně je míra využití kryokonzervovaného spermatu nižší než 10–15 % a mezi studiemi se značně liší. V metaanalýze, která vyhodnotila výsledky 30 studií na 11 798 pacientech, bylo zjištěno, že pouze 8 % pacientů využilo své spermie pro IVF a z nich bylo 49 % úspěšných a dosáhlo klinického těhotenství. To znamená, že pouze 3,9 % mužů, kteří si zamrazili své spermie, dosáhlo se svými partnerkami těhotenství [22]. Zajímavé je, že pouze 16 % pacientů zrušilo své skladování spermií bez dalšího využití, což naznačuje, že většina pacientů zahrnutých do programů rozhodně nevylučuje možnost použití jejich zmrazeného spermatu v budoucnu. Tato skutečnost je nejpřesvědčivějším důkazem podporujícím myšlenku, že pozorovaných 8 % použití zmrazených spermií je významným podhodnocením skutečné konečné míry použití [23].
Pro dosažení těhotenství jsou nejúčinnější metody asistované reprodukce s oplozením vajíčka technikou ICSI. V posledních letech se stále více využívá možnost výběru spermií speciální metodou PICSI, kdy podstatou výběru je vazba zralých spermií na hyaluronan, nebo magnetická separace spermie (MACS) – výběr spermií pomocí magnetu a odseparování spermií, které jsou v apoptóze. Úspěšnost dosažených klinických těhotenství a porodů zdravých dětí se ve většině studií výrazně neliší od standardních souborů a činí kolem 49 % [23]. V našem souboru činila kumulativní úspěšnost 45,8 % klinických těhotenství po kryokonzervaci ejakulátu.
Při kryokonzervaci spermatu onkologických pacientů je nutné počítat s horší kvalitou spermatu. Velmi často jsou parametry spermiogramu výrazně sníženy, normozoospermiků je jen malý počet. Změny jsou vysvětlovány alterací organizmu a supresivním vlivem některých faktorů, které zhoubné tumory produkují [24,25]. Pro pacienty s nádorem varlete jsou nejtěžší poruchy spermatogeneze typické a azoospermie je prokazována ve více než 20 % již před léčbou [10,26]. Z toho vyplývá také vhodnost cíleného urologického vyšetření na vyloučení zhoubného nádoru varlete u mužů s těžkými patologiemi spermiogramu. V řadě případů je tak možné zachytit do té doby skrytý maligní proces [21,26,27].
Problematika ochrany reprodukčních funkcí – nazývaná onkofertilita – má výrazný mezioborový charakter. Základem je úzká spolupráce onkologického centra s CAR, které je schopno zajistit potřebné výkony vč. operačních výkonů.
Na našem pracovišti jsme zahájili zamrazování spermií před chemoterapií ve spolupráci s Interní hematoonkologickou klinikou a Urologickou klinikou FN Brno již v roce 1995. Postupně se ke spolupráci připojovala další onkologická pracoviště a v roce 2009 bylo založeno Centrum reprodukční ochrany. Cílem těchto center je poskytovat konzultaci, možnost ochrany plodnosti a léčbu pacientům s nově diagnostikovaným onkologickým onemocněním [26,28].
Předpokladem spolupráce je dobrá informovanost pracovníků onkologických center o současných možnostech zachování fertility a pravidlech odesílání pacientů do příslušného CAR. Lékaři asistované reprodukce konzultují s onkology možné léčebné postupy, především jejich časovou náročnost a s tím spojené možné riziko oddálení chemoterapie.
Důležitá je informovanost pacienta o daném výkonu a především o postupu v budoucnosti – zajištění odpovídajících vyšetření a potřebné léčby v době, kdy bude plánovat založení rodiny [29].
Ukončení skladování spermií, o které nikdo nejeví další zájem, bylo dlouhá léta velkým problémem. Spermie se nemohly rozmrazit a zlikvidovat a narůstal jejich objem v kontejnerech. Až zákon č. 373/2011 Sb., o specifických zdravotních službách, poskytl pravidla, kdy, za jakých podmínek a jakým způsobem lze přistoupit k likvidaci kryokonzervovaného biologického materiálu [30]. Rovněž ukončení skladování spermatu z důvodu úmrtí je poměrně časově náročné na dohledání. Částečně lze využít registru zemřelých osob vedeného na základě listu o prohlídce zemřelého. Ten je součástí Národního zdravotnického informačního systému (NZIS), kdy od 1. 1. 2013 došlo vyhláškou č. 297/2012 Sb., o listu o prohlídce zemřelého, ke změně evidence [31]. Specifickou otázkou je využití spermatu zemřelých, nezbytná je spolupráce s etickou komisí a s právním oddělením [32,33].
Jak bylo konstatováno na 30. sympoziu asistované reprodukce v listopadu 2020 v Brně, došlo v posledních letech k výraznému zvýšení informovanosti zdravotníků i onkologických pacientů o možnosti kryokonzervace spermatu [34]. Ta by měla být nabídnuta každému pacientovi před zahájením terapie gametotoxické terapie nebo radikální operační léčby.
Závěr
U onkologických pacientů jsou ve vysokém procentu těžké patologie spermatu. Nejnižší hodnoty spermiogramu byly prokázány u mužů se zhoubným nádorem varlete. Je nutné počítat s dlouhodobým skladováním a oplozením mikromanipulačními metodami. Počet mužů, kteří zemřou, je výrazně vyšší než těch, kteří sperma využijí pro léčbu neplodnosti. V případech využití rozmrazeného spermatu onkologických pacientů metodami asistované reprodukce je úspěšnost dosažení porodu zdravého dítěte velmi vysoká. Program onkologické spermabanky vyžaduje úzkou spolupráci lékařů CAR s onkology. Kryokonzervace spermatu by měla být nabídnuta každému pacientovi před terapií vedoucí k destrukci spermatogeneze.
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Dedikace: Práce vznikla za podpory projektu MZ ČR – RVO (FNBr: 65269705), reg. č. IGA NR/ 8469-3, AZV MZ ČR č. NV-18-01-00544 a NV-18-08-00291.
Zdroje
1. Crha I, Ventruba P, Petrenko M et al. Kryokonzervace spermatu před onkologickou léčbou – 7 let zkušeností. Ceska Gynekol 2002; 67 (6): 324–328.
2. Ventruba P, Crha I, Žáková J et al. 25 let kryokonzervace spermatu před gonadotoxickou léčbou: 1995–2020. In: Sborník abstrakt 30. sympozia asistované reprodukce SAR ČGPS ČLS JEP a 19. česko-slovenské konference reprodukční gynekologie, 10.–11. 11. 2020. Brno: 16–17.
3. Žáková J, Lousová E, Ventruba P et al. Sperm cryopreservation before testicular cancer treatment and its subsequent utilization for the treatment of infertility. Sci World J 2014; 2014 : 575978. doi: 10.1155/2014/575978.
4. Meseguer M, Molina N, García-Velasco JA et al. Sperm cryopreservation in oncological patients: a 14-year follow-up study. Fertil Steril 2006; 85 (3): 640–645. doi: 10.1016/j.fertnstert.2005.08. 022.
5. Tomlinson M, Meadows J, Kohut T et al. Review and follow-up of patients using a regional sperm cryopreservation service: ensuring that resources are targeted to those patients most in need. Andrology 2015; 3 (4): 709–716. doi: 10.1111/andr.12045.
6. Tournaye H, Goossens E, Verheyen G et al. Preserving the reproductive potential of men and boys with cancer: current concepts and future prospects. Hum Reprod Update 2004; 10 (6): 525–532. doi: 10.1093/humupd/dmh038.
7. Nangia AK, Krieg SA, Kim SS. Clinical guidelines for sperm cryopreservation in cancer patients. Fertil Steril 2013; 100 (5): 1203–1209. doi: 10.1016/j.fertnstert.2013.08.054.
8. Vakalopoulos I, Dimou P, Anagnostou I et al. Impact of cancer and cancer treatment on male fertility. Hormones (Athens) 2015; 14 (4): 579–589. doi: 10.14310/horm.2002.1620.
9. Vyhláška č. 422/2008 Sb. O stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidských tkání a buněk určených k použití u člověka. 2008 [online]. Dostupné z: https: //zakonyprolidi.cz/cs/2008-422.
10. Xiaohua L, Jiabao W, Yunge T. Effect of tumor and its treatment on fertility of male patients and genetic risk analysis. Chin J Fam Plan 2018; 26 : 415–419.
11. Metodický pokyn GPK č. A-3: Kryokonzervace reprodukčních buněk a tkání u pacientů před onkologickou léčbou. 2021 [online]. Dostupné z: http: //www.ivfbrno.cz.
12. Crha I, Ventruba P, Žáková J et al. Survival and infertility treatment in male cancer patients after sperm banking. Fertil Steril 2009; 91 (6): 2344–2348. doi: 10.1016/j.fertnstert.2008.03. 053.
13. Levine H, Jørgensen N, Martino-Andrade A et al. Temporal trends in sperm count: a systematic review and meta-regression analysis. Hum Reprod Update 2017; 23 (6): 646–659. doi: 10.1093/humupd/dmx022.
14. Bolten M, Weissbach L, Kaden R. Cryopreserved human sperm deposits: usability after decades of storage. Urologe A 2005; 44 (8): 904–908. doi: 10.1007/s00120-005-0840-6.
15. Loren AW, Mangu PB, Beck LN et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 2013; 31 (19): 2500–2510. doi: 10.1200/JCO.2013.49.2678.
16. Foresta C, Bettella A, Marin P et al. Analysis of sperm aneuploidy in infertile subjects after chemotherapy treatment. Ann Ital Med Int 2000; 15 (3): 189–194.
17. Schrader M, Müller M, Straub B et al. The impact of chemotherapy on male fertility: a survey of the biologic basis and clinical aspects. Reprod Toxicol 2001; 15 (6): 611–617. doi: 10.1016/s0890-6238 (01) 00182-4.
18. Huyghe E, Matsuda T, Daudin M et al. Fertility after testicular cancer treatments: results of a large multicenter study. Cancer 2004; 100 (4): 732–737. doi: 10.1002/cncr.11950.
19. Zákon č. 296/2008 Sb. O lidských tkáních a buňkách. 2008 [online]. Dostupné z: https: //zakonyprolidi.cz/cs/2008-296.
20. Stigliani S, Massarotti C, De Leo C et al. Fifteen year regional center experience in sperm banking for cancer patients: use and reproductive outcomes in survivors. Cancers (Basel) 2021; 13 (1): 116. doi: 10.3390/cancers13010116.
21. Kobayashi H, Tamura K, Tai T et al. Semen cryopreservation as an oncofertility treatment in 122 Japanese men with cancer: a decade-long study. Reprod Med Biol 2017; 16 (4): 320–324. doi: 10.1002/rmb2.12044.
22. van Casteren NJ, van Santbrink EJ, van Inzen W et al. Use rate and assisted reproduction technologies outcome of cryopreserved semen from 629 cancer patients. Fertil Steril 2008; 90 (6): 2245–2250. doi: 10.1016/j.fertnstert.2007.10.055.
23. Ferrari S, Paffoni A, Filippi F et al. Sperm cryopreservation and reproductive outcome in male cancer patients: a systematic review. Reprod Biomed Online 2016; 33 (1): 29–38. doi: 10.1016/j.rbmo.2016.04.002.
24. Huser M, Zakova J, Smardova L et al. Combination of fertility preservation strategies in young women with recently diagnosed cancer. Eur J Gynaecol Oncol 2012; 33 (1): 42–50.
25. Ješeta M, Žáková J, Ventruba P et al. Cryopreservation of human gametes and embryos: current state and future perspectives. In: Marco-Jiménez F, Akdemir H. Cryopreservation in Eukaryotes. InTech – Open Acces Publisher. 2016 [online]. Available from: https: //www.intechopen.com/books/cryopreservation-in-eukaryotes/cryopreservation-of-human-gametes-and-embryos-current-state-and-future-perspectives.
26. Crha I, Huser M, Žáková J. Onkofertilita – perspektivy a komplikace. Onkologie 2018, 12 (1): 25–28. doi: 10.36290/xon.2018.006.
27. Ventruba P, Žáková J, Crha I et al. Treatment of infertility with cryopreserved sperm before treatment of testicular cancer. In: Conference Abstract Book 3rd International Congress of Gynaecology and Obstetrics, October 24–26. Taiyuan, China, 2014 : 63.
28. Huser M, Smardova L, Janku P et al. Fertility status of Hodgkin lymphoma patients treated with chemotherapy and adjuvant gonadotropin-releasing hormone analogues. J Assist Reprod Genet 2015; 32 (8): 1187–1193. doi: 10.1007/s10815-015-0452-z.
29. Huser M, Crha I, Zakova J et al. Fertility preservation in clinical practice. Praha: Maxdorf 2019.
30. Zákon č. 373/2011 Sb. O specifických zdravotních službách. 2011 [online]. Dostupné z: https: //zakonyprolidi.cz/cs/2011-373.
31. Vyhláška č. 297/2012 Sb. O Listu o prohlídce zemřelého. 2012 [online]. Dostupné z: https: //zakonyprolidi.cz/cs/2012-297.
32. Crha I, Dostál J, Ventruba P et al. Etické a legislativní otázky odběru a užití spermií zemřelého. Ceska Gynekol 2004; 69 (4): 335–339.
33. Crha I, Ventruba P, Žáková J et al. Kryokonzervace spermatu před gonadotoxickou léčbou – 11 let zkušeností. Ceska Gynekol 2007; 72 (5): 320–326.
34. Ventruba P, Žáková J, Rumpík D. 30. sympozium asistované reprodukce s mezinárodní účastí a 19. česko-slovenská konference reprodukční medicíny, 10.–11. listopadu 2020, Brno. Ceska Gynekol 2021; 86 (1): 61–62.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2021 Číslo 3- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Kryokonzervace spermatu před gonadotoxickou léčbou ve Fakultní nemocnici Brno v letech 1995–2020
- Vliv reziduálního defektu svěrače konečníku na kvalitu života pacientek
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Sonograficky riadená vákuumaspiračná liečba ektopickej gravidity v jazve po cisárskom reze
- Guillain-Barré syndrom v graviditě
- Sexualita žen se syndromem Mayer-Rokitansky-Küster-Hauser
- Sakrospinózní hysteropexe – alternativa v primární chirurgické léčbě sestupu apikálního kompartmentu
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Antifosfolipidové protilátky a infekce covidem-19 u žen se sníženou plodností
- 5. evropský kongres o endometrióze
- Estetrol a možnosti jeho klinického využití
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Estetrol a možnosti jeho klinického využití
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



