-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stanovení aktivity cholinesteras a jejich využití pro diagnostiku patologických stavů
Cholinesterase activity assays and their use in the diagnosis of various pathological states including poisoning by neurotoxic agents
Cholinesterases are enzymes important for some nerve transmissions where the enzyme acetylcholinesterase plays a crucial role. The second enzyme, butyrylcholinesterase, is not necessary for the neurotransmission but it is involved in some detoxification reactions. A survey of literature, a discussion of diagnostic importance and the methods for an activity assay are presented in this review article. Liver failures, exposure to neurotoxic compounds, genetic dispositions are outlined here. In the field of assays, spectrophotometric, colorimetric and electrochemical tests are discussed.
Key words:
acetylcholinesterase • butyrylcholinesterase • poisoning • liver function test • pesticide • nerve agent • Alzheimer disease • pathological state
Autori: Miroslav Pohanka
Vyšlo v časopise: Čes. slov. Farm., 2017; 66, 147-153
Kategória: Přehledy a odborná sdělení
Súhrn
Cholinesterasy jsou enzymy nezastupitelné v některých nervových přenosech, kde hraje zásadní roli acetylcholinesterasa. Druhá cholinesterasa, butyrylcholinesterasa, pak není nezbytná pro neurotransmisi, ale může se podílet na některých detoxifikačních reakcích. V tomto přehledovém článku je provedeno shrnutí literatury, diskuze diagnostického významu a metod určení aktivity. Je tak nastíněno například rozpoznání jaterních selhání, expozice neurotoxickým látkám, geneticky podmíněné dispozice. V oblasti testování je diskutováno provádění spektrofotometrických, kolorimetrických a elektrochemických měření.
Klíčová slova:
acetylcholinesterasa • butyrylcholinesterasa • otrava • test funkčnosti jater • pesticid • nervově paralytická látka • Alzheimerova choroba • patologický stavÚvod
V současnosti jsou známé dvě cholinesterasy: butyrylcholinesterasa (BChE; EC 3.1.1.8) a acetylcholinesterasa (AChE; EC 3.1.1.7). Zatímco BChE byla v minulosti nazývaná též plazmatická cholinesterasa s ohledem na fakt, že na rozdíl AChE; EC 3.1.1.7 lokalizované v neurosynapsích a povrchu erytrocytů, je nejvyšší aktivita BChE přítomna v plazmě. BChE své pojmenování nese po umělém substrátu – chemické sloučenině butyrylcholinu, který je schopen štěpit s vysokým číslem přeměny. AChE je pak pojmenována po neurotransmiteru acetylcholinu, který štěpí.
Zatímco AChE má význam jako enzym ukončující cholinergní neurotransmisi a porucha její funkce může mít fatální následky, BChE zdánlivě nemá v organismu význam. Zároveň není znám její endogenní substrát, neboť butyrylcholin není na rozdíl od acetylcholinu látka tělu vlastní. Jak na úrovni transgenních zvířat, tak ojedinělých humánních případů nebyl prokázán žádný patologický proces spojitelný s poruchou tvorby BChE1–3). Na druhou stranu je nutné zdůraznit, že BChE se účastní detoxifikačních reakcí a je schopna štěpit některé toxické látky obsahujících esterovou vazbu. Podílí se např. na hydrolýze kokainu a prokainu4–6). Cílem tohoto přehledu je uvést základní informace o diagnostickém významu cholinesteras a metod vyšetření (stanovení) jejich aktivit ve vzorcích přírodního původu. Lze říci, že cholinesterasy se hodí především k diagnostice jaterních selhání (BChE), nesnášenlivosti některých anestetik (BChE) a rozpoznání otrav neurotoxickými látkami (AChE a BChE). Z tohoto důvodu je v textu nastíněn mechanismus inhibice cholinesteras, vysvětleny principy metod vhodných pro stanovení aktivity cholinesteras v biologických vzorcích a v poslední kapitol je uvedena diagnostická interpretace změn aktivity ve vzorcích krve, krevní plazmy a krevního séra.
Cholinesterasy a jejich inhibice širokou skupinou látek
Strukturně obě cholinesterasy náleží do rodiny esteras – lipas7, 8). Esterasy si obecně uchovávají velkou míru sekvenční podobnosti i pro proteiny získané z evolučně vzdálených organizmů8, 9). U obou enzymů nalezneme rovněž katalytickou triádu tvořenou serinem, histidinem a kyselinou glutamovou10). Sekvenční analýzou byla prokázána téměř 54% podobnost mezi lidskou BChE a AChE z modelového organismu parejnoka kalifornského (Torpedo californica)11). Oba enzymy se mohou vyskytovat v monomerní až homotetramerní formě. Pro uchycení v membráně může být přítomna i glykofosfatidylinositolová (GPI) kotva poskytující amfifilní vlastnosti12). Velikost podjednotky AChE je 69 kDa, BChE má podjednotku větší – 85 kDa10).
S ohledem na katalytické působení cholinesteras a mechanismus působení inhibitorů mají následující části význam: aktivní centrum, aromatické hrdlo a periferní nebo též β anionické místo. Aby substrát pronikl až do aktivního centra, musí projít β anionickým místem a aromatickým hrdlem. Začněme prvním místem, které musí substrát minout při své cestě k aktivnímu centru. β anionické místo nebo též periferní anionické místo hraje významnou roli v molekule AChE, zatímco molekula BChE jej má výrazně méně vyvinuté1, 13, 14). Rezidua aminokyselin Tyr 72, Asp 74, Tyr 124, Trp 286 a Tyr 341 (pořadí pro savčí typ AChE) v β anionickém místě jsou zodpovědné za interakce kation π a π-π s četnými farmakologicky zajímavými inhibitory a následnou konformační změnu v molekule AChE15). Do β anionického místa AChE se vážou inhibitory schopné interakce kation π a π-π. Jedná se například o aflatoxiny16, 17) a ethidium a propidium18, 19). Další látka, huperzin A, je schopna interakce s oběma anionickými místy20). Bezprostředně za periferním anionickým místem se nachází aromatické hrdlo, jež je tvořeno, jak název napovídá, větším množstvím reziduí aromatických aminokyselin – v případě AChE 14 a v případě BChE osmi aromatickými rezidui21). Aromatické hrdlo brání průchodu hydrofilních a velkých sloučenin. Inhibice prostřednictvím aromatického hrdla je spíše zřídkavá. Zmiňme vazbu 4-acetoxy-plakinaminu B22) nebo dekamethonia23).
Aktivní centra AChE a BChE jsou si vzájemně velmi podobná. Triáda katalytických aminokyselin serin – glutamát – histidin (pozice Ser 203 – Glu 334 – His 447; číslování pro savčí typ AChE) tvoří tzv. esterové nebo též esteratické místo zodpovědné za hydrolytické štěpení esterové vazby substrátu24). Druhou nezbytnou součástí aktivního centra cholinesteras je α anionické místo někdy označované jen anionické místo nebo aktivní anionické místo. Toto místo je zodpovědné za správnou orientaci substrátu vůči esterovému místu díky vytváření interakcí kation π se substrátem25). Serin v aktivním centru vytváří stabilní ester s organofosforovými inhibitory schopnými ireverzibilně inhibovat jak AChE, tak i BChE. Jedná se například o nervově paralytické látky užívané ve vojenství: sarin, soman, tabun, VX a látky v minulosti užívané jako pesticidy, jako je např. malaoxon či paraoxon26, 27). Jiné látky, neinhibující cholinesterasy, jako je např. malathion či parathion, jsou v organismu konvertovány na zmíněné inhibitory malaoxon a paraoxon1, 14). Se serinem v esterovém místě reagují i karbamátové inhibitory cholinesteras. Tuto inhibici označujeme jako pseudoireverzibilní, protože vzniklý konjugát je nestabilní a dochází ke spontánní pomalé hydrolýze a tím návratu aktivity cholinesteras28, 29). Typickými zástupci karbamátových inhibitorů jsou například lék na nemoc myasthenia gravis – pyridostigmin28), lék užívaný při Alzheimerově chorobě rivastigmin30, 31) a v zemích Evropské unie zakázaný insekticid karbofuran32, 33). Inhibitory vázající se do α anionického místa jsou například látky užívané pro zmírnění příznaků Alzheimerovy choroby huperzin, který by v budoucnosti měl být zaveden jako dostupný lék34–36), v minulosti distribuovaný takrin37–40) a v současnosti farmakologicky užívaný galantamin41–45) a donepezil46, 47). Selektivita zmíněných látek vázajících se do α anionického místa je rozdílná vůči AChE a BChE. Zatímco huperzin, takrin a galantamin jsou silné inhibitory AChE a BChE je jimi inhibována výrazně méně, donepezil má afinitu pouze k AChE. Inhibitory cholinesteras jsou přehledně shrnuty v tabulce 1.
Tab. 1. Přehled vybraných inhibitorů cholinesteras 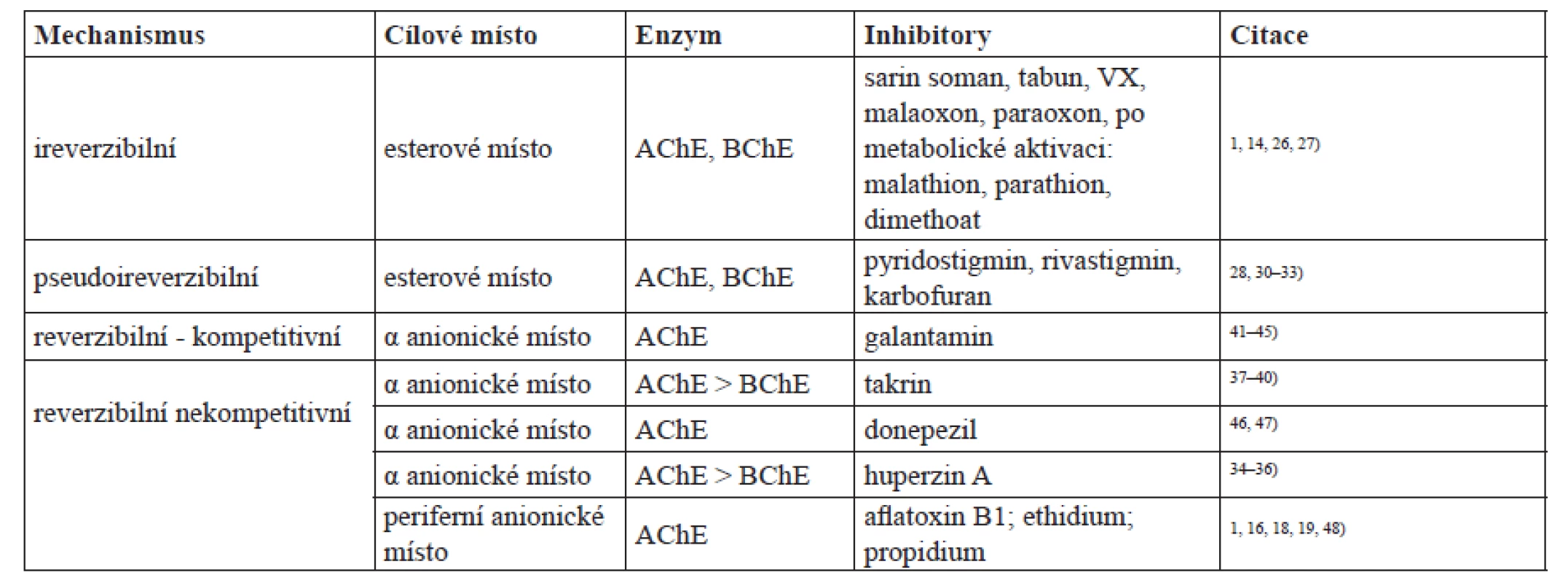
Stanovení aktivity cholinesteras
Obě cholinesterasy vykazují acylamidasovou, esterasovou a thioesterasovou aktivitu, tzn., že mohou provádět štěpení některých arylacylamidů, esterů a thioesterů schopných proniknout do aktivního centra a nalézt zde vhodnou orientaci vůči esterovému místu aktivního centra. Různé typy hydrolytických reakcí katalyzovaných cholinesterasami jsou na příkladech ukázány na obrázku 1. AChE je schopna na rozdíl od BChE štěpit acetyl-β-metylthiocholin a acetyl-β-metylcholin49, 50). Číslo přeměny acetylcholinu a acetylthiocholinu je vyšší při hydrolýze katalyzované AChE než BChE51–53). Naopak BChE lépe štěpí butyrylcholin54), butyrylthiocholin53, 55), propionylcholin56) a propionylthiocholin53, 57). Specifické pro BChE je štěpení acylamidů jako na obrázku 1 zobrazeného o-nitroacetanilidu58–60). Z výše zmíněných reakcí lze přímo spektrofotometricky stanovovat aktivitu BChE díky její acylamidasové aktivitě. Jestliže zůstaneme u příkladu o-nitroacetanilidu, tak vzniká o-nitroanilin dávající roztoku žluté až žlutooranžové zabarvení.
Obr. 1. Ukázka štěpení aryl acylamidu, esteru a thioesteru pomocí cholinesteras. Hydrolýza o-nitroacetanilidu pomocí BChE (reakce a), acetylcholinu pomocí AChE (reakce b) a butyrylthiocholinu pomocí BChE (reakce c) jsou vyobrazeny jako příklady. Reakční schémata jsou upravena z citovaných prací <sup>61, 62).</sup> 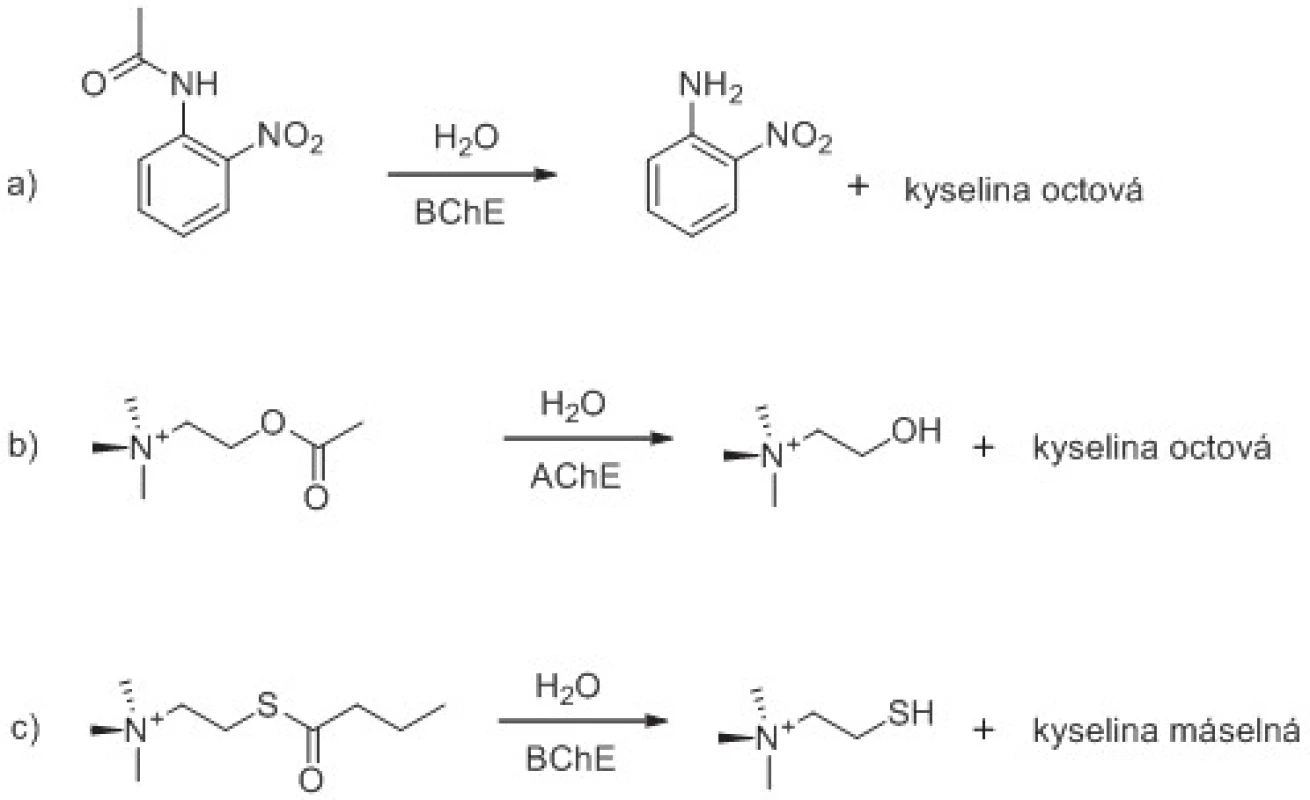
Při stanovení aktivity cholinesteras lze využít faktu, že z esteru vzniká kyselina snižující pH roztoku. Například v případě acetylcholinu a acetylthiocholinu kyselina octová. V případě butyrylcholinu a butyrylthiocholinu kyselina máselná. Aplikace pH indikačního činidla nebo provádění reakce na tenké pH indikující vrstvě jsou dostatečné pro posouzení změn v aktivitě enzymu či stanovení přítomnosti inhibitoru63). Jinou možností je acidobazická titrace s kolorimetrickým či potenciometrickým výstupem64). Metody založené na sledování pH mají ovšem své limity. Při analýze je třeba překonat pufrující schopnost roztoku. U cholinesteras navíc dochází k prudkému poklesu čísla přeměny, pokud reakce neprobíhá při optimálním pH, kterým je pro většinu cholinesteras fyziologické pH 7,465, 66).
Běžným laboratorním testem pro stanovení aktivity cholinesteras je tzv. Ellmanova metoda zavedená na počátku šedesátých let 20. století67). Ellmanovou metodou lze spektrofotometricky stanovit aktivitu jak AChE, tak i BChE použitím acetylthiocholinu v případě AChE, nebo butyrylthiocholinu v případě BChE1). Je samozřejmě možné použít i jiné thioestery, které však nacházejí uplatnění spíše výjimečně. Princip metody je patrný z obrázku 2. Metoda je založena na dvou krocích. V prvním kroku se thioester hydrolyzuje na thiocholin a příslušnou kyselinu katalytickým působením AChE nebo BChE. Ve druhém kroku thiocholin spontánně reaguje s chromogenem, kyselinou 5,5´-dithiobis-(2-nitrobenzoovou), za vzniku konjugátu thiocholinu s kyselinou 5-thio-2-nitrobenzoovou a kyseliny 5-thio-2-nitrobenzoové68). Kyselina 5-thio-2-nitrobenzoové, respektive její anionická forma vyskytující se při pH 7,4, absorbuje při 412 nm s extinkčním koeficientem ε = 14150 l/mol.cm69). Nevýhodou Ellmanovy metody je interference hemoglobinu při dané vlnové délce a interference některých chemických látek včetně látek obsahujících thiol a oxim70).
Obr. 2. Princip Ellmanovy metody pro stanovení aktivity AChE. Reakční schéma je upraveno z citovaných prací <sup>61, 62)</sup>. 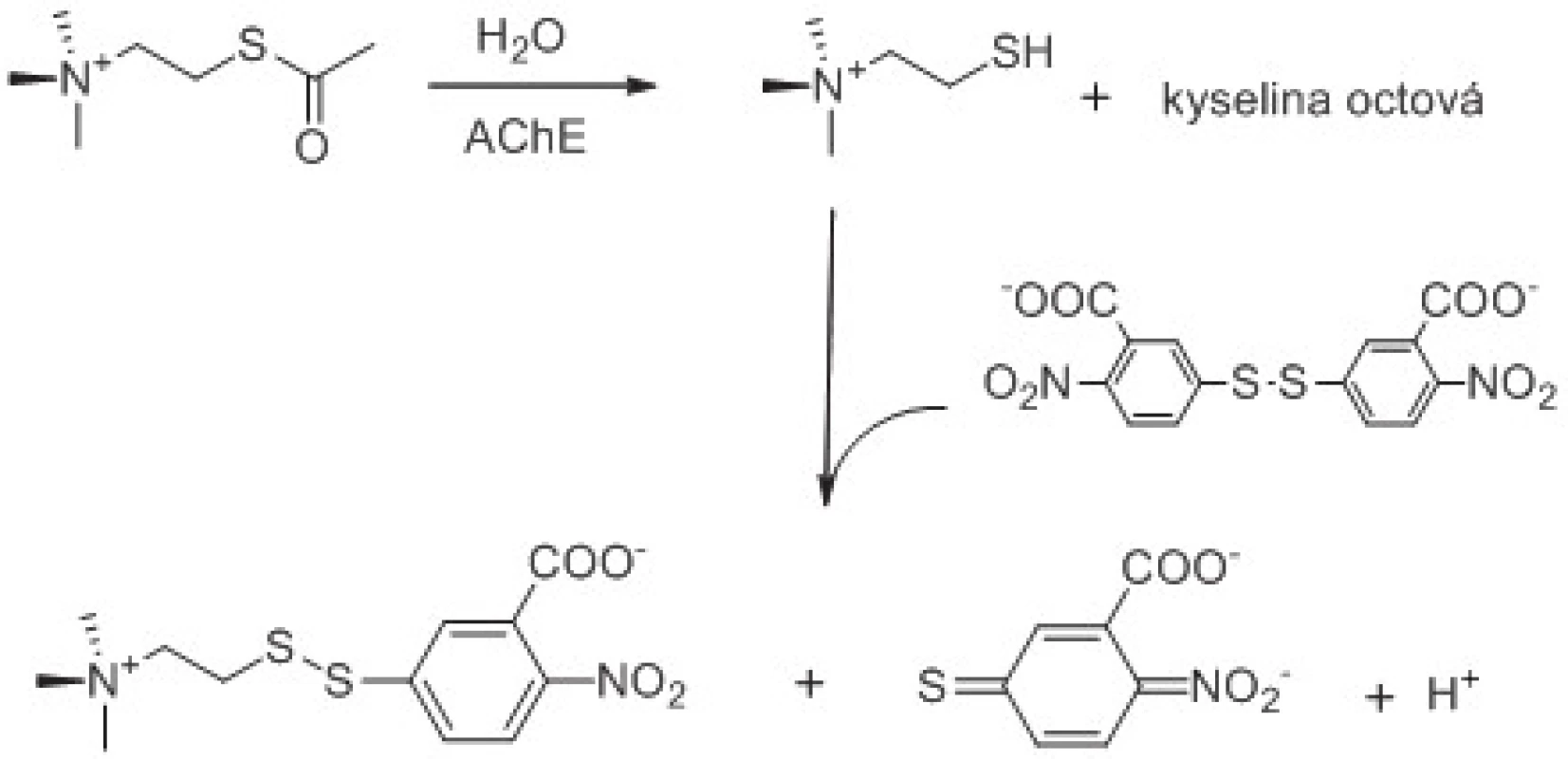
Ačkoliv hydrolýza esterů cholinesterasami nedává snadnou možnosti přímé instrumentální analýzy, pokud není žádoucí provádět výše zmíněné hodnocení změn pH, existuje možnost stanovit cholinesterasy i jiným způsobem. Tím je přidání cholinoxidasy (EC 1.1.3.17) do roztoku či společné imobilizování s cholinesterasou na převodník v případě biosenzorů (obr. 3). Cholin, který vzniká výše popsanými reakcemi jak katalýzou AChE, tak i BChE, je v přítomnosti kyslíku cholinoxidasou přeměněn na betain aldehyd za současného vzniku peroxidu vodíku71). Množství vznikajícího peroxidu vodíku lze měřit spektrofotometricky použitím např. o-fenylendiaminu, 3,3´,5,5´-tetrametylbenzidinu, či vhodnou voltametrickou metodou72).
Obr. 3. Využití cholinoxidasy při stanovení aktivity AChE. Znázorněno je i použití chromogenního substrátu reagujícího se vznikajícím peroxidem vodíku. Reakční schéma je upraveno z citovaných prací <sup>61, 62)</sup>. 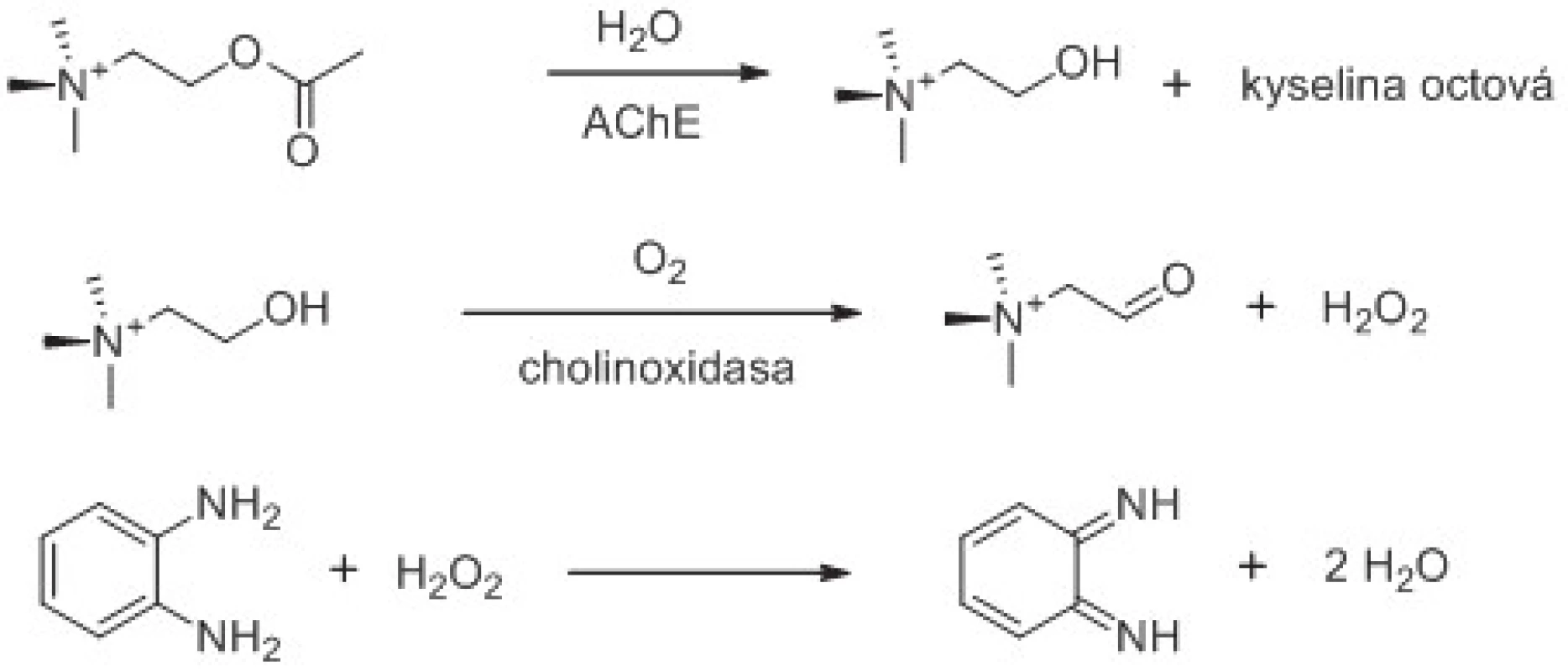
Cholinesterasy mohou štěpit i fluorogenní a chromogenní estery, jako je indofenyl acetát, 2,6-dichlorindofenyl acetát a indoxylacetát73, 74). Výsledné zabarvení roztoku nebo tenké vrstvy na matrici lze hodnotit vizuálně nebo instrumentálně75). Indoxylacetát po štěpení AChE nebo BChE přechází v následující spontánní oxidaci na modré indigo76, 77). Reakce je ukázána na obrázku 4. I tento druh stanovení aktivity cholinesteras má několik nevýhod. Jsou jimi malá rychlost konverze především pro AChE, špatná rozpustnost ve vodě a anorganických pufrech a nízký extinkční koeficient ε = 3900 l.mol–1.cm–1 74, 75). Výhodnější je využití indoxylacetátu pro stanovení aktivity BChE než AChE. Indigo lze stanovit i fluorescenčně74).
Obr. 4. Stanovení aktivity cholinesteras za využití indoxylacetátu jako fluorogenního a chromogenního substrátu. Reakční schéma je upraveno z citovaných prací <sup>61, 62)</sup>. 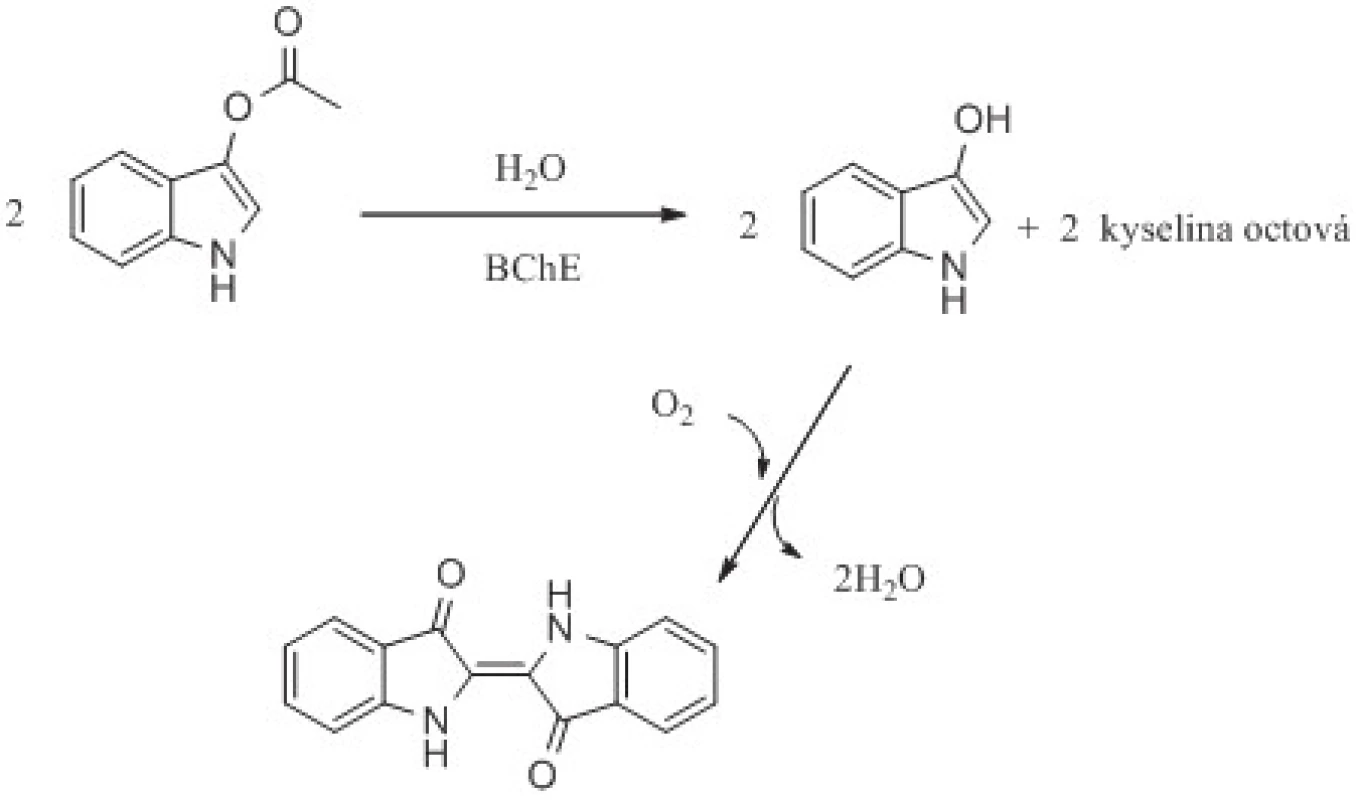
Tvorba cholinesteras v organismu a diagnostický význam
AChE se ve starší literatuře nazývá krevní cholinesterasa (v anglickém jazyce používaný termín blood cholinesterase) nebo též pravá cholinesterasa (v anglickém jazyce používaný termín true cholinesterase). BChE bývá označována jako plazmatická cholinesterasa. Názvy vypovídají o faktu, že AChE je přítomna na povrchu erytrocytů a zůstává v krevní sedlině. BChE je vytvářena v játrech a secernována do krevního oběhu. Při zpracování krve na krevní plazmu či sérum zůstává BChE právě v této části vzorku. Mimo krve je AChE přítomna v nervových propojeních. Místo vzniku předurčuje diagnostický význam choliesteras. BChE můžeme označit za univerzální marker z toho důvodu, že její aktivitu lze stanovit v plazmě a krevním séru, které jsou snáze uchovatelné. Z praktického hlediska nezáleží na tom, jestli se jedná o plazmu či sérum, metodika zpracování krve na plazmu či sérum výsledek stanovení téměř neovlivňuje. AChE je přítomna v nervové tkáni a hodí se pro speciální toxikologická vyšetření post mortem, u živých pacientů vyšetření aktivity AChE v nervové tkáni nejsou pochopitelně možná. AChE lokalizovaná na povrchu erytrocytů již může sloužit jako standardní biochemický marker a je využitelné pro rozpoznávání otrav79, 80).
BChE je konstituována v různých orgánech, především v játrech81). BChE dosahuje koncentrace v krevní plazmě 5 mg/ml a její poločas je 12 dní82). Majoritní část BChE v plazmě pochází z jater, a pokles případně nárůst aktivity BChE v plazmě lze tudíž přičítat změnám v játrech, a BChE může být z tohoto důvodu snadno využita jako marker funkčnosti jater. V literatuře je popsána jak hypercholinesterasemie, tak i hypocholinesterasemie68). K hypercholiensterasemii může dojít vlivem vzniku nádorů jater83). Hypercholinesterasemii ve srovnání s hypocholinesterasemií můžeme považovat za raritní nález.
U běžné populace se aktivita BChE pohybuje v rozmezí 105–240 U/l. Vzácná je rodinná (geneticky podmíněná) forma hypocholinesterasemie, která byla popsána v několika japonských rodinách84). Akutní hypocholinesterasemie může nastat jako následek poškození jater, např. akutní hepatitidou nebo cirhózou85). Plazmatická hladina BChE obvykle dobře koreluje s ostatními jaterními markery – nepřímo úměrně s transaminasami a přímo úměrně s hladinou albuminu86, 87). Jedná se o spolehlivý biochemický marker s dobrým diagnostickým významem.
K poklesu aktivity plazmatické BChE může dojít i z důvodu její inhibice. Ve srovnání s AChE je množství inhibitorů mnohem nižší. Z praktického hlediska mají význam nervově paralytické látky (např. sarin, soman, tabun, VX) a některé léky, tzv. karbamátové inhibitory cholinesteras (rivastigmin, neostigmin, pyridostigmin) působící ireverzibilním, resp. pseudoireverzibilním mechanismem inhibice88–90). Problematika inhibitorů a rozdíly v senzitivitě AChE a BChE k různým látkám jsou hodnoceny v otištěných přehledových pracích1, 14, 91). Při otravě zmíněnými látkami bude prokázána hypocholinesterasemie bez přítomnosti hypertransaminasemie a hypoalbuminemie. v případě práce se vzorky plné krve, orgánů, krevních homogenátů atd. bude potom nalezena i snížená aktivita AChE. Jako vzorky lze též použít hmyz a jiné evolučně nižší formy organizmů, vodní organismy a hmotu více buněčných vodních mikroorganismů živočišného původu.
BChE má zásadní význam i z důvodu vyšetření tzv. dibukainového čísla. Mimo majoritní A alelu pro BChE existuje v lidské populaci i K alela rozšířená především v kavkazské oblasti, která předurčuje přítomnost BChE s nižší afinitou k sukcinylcholinu92). Homozygotní jedinci s K alelou mají nižší plazmatickou aktivitu BChE. Zajímavou a doposud ne zcela objasněnou skutečností je nižší incidence Alzheimerovy choroby u jedinců nesoucí K alelu93). K varianta BChE má velmi nízké číslo přeměny pro myorelaxant sukcinylcholin a u lidí s touto variantou hrozí následné komplikace94).
V populaci běžná BChE kódovaná A alelou je citlivá k inhibici dibukainem (též známý pod názvem cinchokain). AChE a K varianta BChE nejsou k této inhibici příliš citlivé. Biochemické vyšetření založené na sledování aktivity sérové, nebo plazmatické BChE v přítomnosti a nepřítomnosti dibukainu slouží ke kalkulaci tzv. dibukainového čísla (dibucain number – DN) – procenta inhibice BChE. To je používané k vyšetření, zda jedinec nemá K alelu (DN 75), je homozygot (DN < 20), nebo heterozygot nesoucí jednu K alelu (DN ~ 40–70), a je tedy nadměrně vnímavý k podání sukcinylcholinu95, 96). Celkový diagnostický význam cholinesteras přináší tabulka 2.
Tab. 2. Přehled diagnostického významu cholinesteras 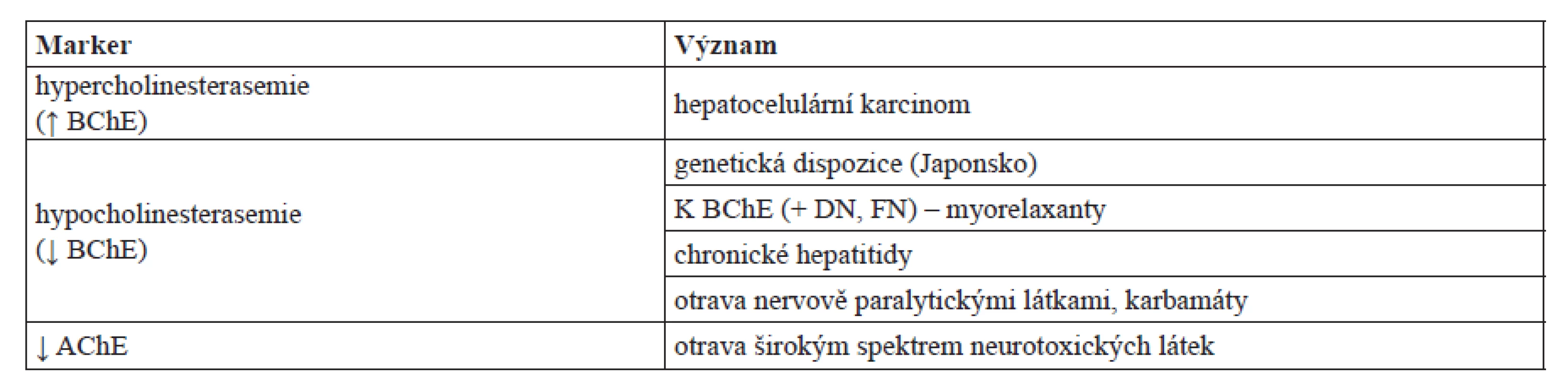
↓ = nalezeno snížení aktivity ve vzorku krve nebo plazmy, ↑ = nalezeno zvýšení aktivity ve vzorku krve nebo plazmy Z předchozího textu je patrné, že diagnostický význam BChE je univerzálnější a změny v cholinesterasemii mohou vypovídat o širokém spektru patologických stavů. Oproti tomu vyšetření aktivity AChE je především nástrojem analytické toxikologie a slouží pouze k rozpoznání otrav neurotoxickými látkami. Při srovnání diagnostiky otrav pomocí AChE a BChE je třeba zohlednit fakt, že aktivitu BChE lze určit v séru a plazmě, zatímco v případě AChE je třeba pracovat s krví. Pro diagnostiku otrav organofosforovými a karbamátovými látkami jsou vhodné oba enzymy. V případě reverzibilní inhibice (kompetitivní a nekompetitivní) je nutné vzít v úvahu fakt, že v rámci analýzy dochází k naředění biologického vzorku a vzhledem k částečnému návratu aktivity inhibovaných enzymů díky disociaci inhibitoru z aktivního centra. Proto nejsou standardní metody k měření aktivity cholinesteras úplně vhodné k rozpoznání otravy reverzibilním inhibitorem, protože množství vzorku je obvykle do 10 % celkové roztoku reakční směsi obsahující i ostatní činidla. Vhodnější pro diagnostiku je použití metod, které umožňují pracovat se substráty sorbovanými na pevný povrch. Tyto metody však nejsou v praxi dostupné a jedná se spíše o ojedinělou výzkumnou záležitost97). Na druhou stranu je třeba vzít potaz fakt, že pokles aktivity BChE s séru či plazmě může mít více důvodů a před závěrem, že se jedná o otravu, je nezbytné vyloučit poškození jater například vyšetřením aktivity transaminas.
Závěr
Cholinesterasy jsou významným biochemickým ukazatelem vhodným pro rozpoznání patologických stavů spojených s otravami, selháním jater a některých nádorových onemocnění. Doposud detailně neobjasněné zůstává propojení Alzheimerovy choroby s cholinesterasami. Pro účely jejich vyšetření byly v minulosti zavedeny testovací metody, v klinické praxi však převažuje tzv. Ellmanův test.
Poděkování
Autor děkuje za podporu v rámci Dlouhodobého záměru rozvoje organizace a projektům Specifického výzkumu (Fakulta vojenského zdravotnictví, Univerzita obrany v Brně).
Střet zájmů: žádný.
pplk. prof. RNDr. Miroslav Pohanka, Ph.D., DSc.
Fakulta vojenského zdravotnictví, Univerzita obrany
Třebešská 1575, 500 01 Hradec Králové
e-mail: miroslav.pohanka@gmail.com
Zdroje
1. Pohanka M. Cholinesterases, a target of pharmacology and toxicology. Biomed. Pap. Olomouc 2011; 155, 219–229.
2. Duysen E. G., Li B., Lockridge O. The butyrylcholinesterase knockout mouse a research tool in the study of drug sensitivity, bio-distribution, obesity and Alzheimer’s disease. Expert Opin. Drug Metab. Toxicol. 2009; 5, 523–528.
3. Li B., Duysen E. G., Carlson M., Lockridge O. The butyrylcholinesterase knockout mouse as a model for human butyrylcholinesterase deficiency. J. Pharmacol. Exp. Ther. 2008; 324, 1146–1154.
4. Yuan J., Yin J., Wang E. Characterization of procaine metabolism as probe for the butyrylcholinesterase enzyme investigation by simultaneous determination of procaine and its metabolite using capillary electrophoresis with electrochemiluminescence detection. J. Chromatogr. A 2007; 1154, 368–372.
5. Duysen E. G., Lockridge O. Prolonged toxic effects after cocaine challenge in butyrylcholinesterase/plasma carboxylesterase double knockout mice: a model for butyrylcholinesterase-deficient humans. Drug Metab. Dispos. 2011; 39, 1321-1323.
6. Masson P., Carletti E., Nachon F. Structure, activities and biomedical applications of human butyrylcholinesterase. Protein Pept. Lett. 2009; 16, 1215–1224.
7. Cygler M., Schrag J. D., Sussman J. L., Harel M., Silman I., Gentry M. K., Doctor B. P. Relationship between sequence conservation and three-dimensional structure in a large family of esterases, lipases, and related proteins. Protein Sci. 1993; 2, 366–382.
8. Akoh C. C., Lee G. C., Liaw Y. C., Huang T. H., Shaw J. F. GDSL family of serine esterases/lipases. Prog. Lipid Res. 2004; 43, 534–552.
9. Myers M., Richmond R. C., Oakeshott J. G. On the origins of esterases. Mol. Biol. Evol. 1988; 5, 113–119.
10. Shafferman A., Kronman C., Flashner Y., Leitner M., Grosfeld H., Ordentlich A., Gozes Y., Cohen S., Ariel N., Barak D., Harel M., Silman I., Sussman J. L., Velan B. Mutagenesis of human acetylcholinesterase. Identification of residues involved in catalytic activity and in polypeptide folding. J. Biol. Chem. 1992; 267, 17640–17648.
11. Lockridge O., Bartels C. F., Vaughan T. A., Wogn C. K., Norton S. E., Johnson L. L. Complete amino acid sequence of human serum cholinesterase. J. Biol. Chem. 1987; 262 549–557.
12. Massoulie J., Anselmet A., Bon S., Krejci E., Legay C., Morel N., Simon S. The polymorphism of acetylcholinesterase: post-translational processing, quaternary associations and localization. Chem. Biol. Interact. 1999; 120, 29–42.
13. Nawaz S. A., Ayaz M., Brandt W., Wessjohann L. A., Westermann B. Cation-π and π-π stacking interactions allow selective inhibition of butyrylcholinesterase by modified quinine and cinchonidine alkaloids. Biochem. Biophys. Res. Commun. 2011; 404, 935–940.
14. Pohanka M. Acetylcholinesterase inhibitors: a patent review (2008 – present). Expert Opin. Ther. Pat. 2012; 22, 871–886.
15. Johnson G., Moore S. W. The peripheral anionic site of acetylcholinesterase: structure, functions and potential role in rational drug design. Curr. Pharm. Des. 2006; 12, 217–225.
16. Cometa M. F., Lorenzini P., Fortuna S., Volpe M. T., Meneguz A., Palmery M. In vitro inhibitory effect of aflatoxin B-1 on acetylcholinesterase activity in mouse brain. Toxicology 2005; 206, 125–135.
17. Stepurska K. V., Soldatkin O. O., Arkhypova V. M., Soldatkin A. P., Lagarde F., Jaffrezic-Renault N., Dzyadevych S. V. Development of novel enzyme potentiometric biosensor based on pH-sensitive field-effect transistors for aflatoxin B1 analysis in real samples. Talanta 2015; 144, 1079–1084.
18. Cavalli A., Bottegoni G., Raco C., De Vivo M., Recanatini M. A computational study of the binding of propidium to the peripheral anionic site of human acetylcholinesterase. J. Med. Chem. 2004; 47, 3991–3999.
19. Mazzanti C. M., Spanevello R. M., Obregon A., Pereira L. B., Streher C. A., Ahmed M., Mazzanti A., Graca D. L., Morsch V. M., Schetinger M. R. Ethidium bromide inhibits rat brain acetylcholinesterase activity in vitro. Chem. Biol. Interact. 2006; 162, 121–127.
20. Wong D. M., Greenblatt H. M., Dvir H., Carlier P. R., Han Y. F., Pang Y. P., Silman I., Sussman J. L. Acetylcholinesterase complexed with bivalent ligands related to huperzine a: experimental evidence for species-dependent protein-ligand complementarity. J. Am. Chem. Soc. 2003; 125, 363–373.
21. Saxena A., Redman A. M., Jiang X., Lockridge O., Doctor B. P. Differences in active site gorge dimensions of cholinesterases revealed by binding of inhibitors to human butyrylcholinesterase. Biochemistry 1997; 36, 14642–14651.
22. Khan I., Samad A., Khan A. Z., Habtemariam S., Badshah A., Abdullah S. M., Ullah N., Khan A., Zia-Ul-Hag M. Molecular interactions of 4-acetoxy-plakinamine B with peripheral anionic and other catalytic subsites of the aromatic gorge of acetylcholinesterase: computational and structural insights. Pharm. Biol. 2013; 51, 722–727.
23. Axelsen P. H., Harel M., Silman I., Sussman J. L. Structure and dynamics of the active site gorge of acetylcholinesterase: synergistic use of molecular dynamics simulation and X-ray crystallography. Protein Sci. 1994; 3, 188–197.
24. Gilson M. K., Straatsma T. P., McCammon J. A., Ripoll D. R., Faerman C. H., Axelsen P. H., Silman I., Sussman J. L. Open „back door“ in a molecular dynamics simulation of acetylcholinesterase. Science 1994; 263, 1276–1278.
25. Holtje H. D., Kjier L. B. Nature of anionic or alpha-site of cholinesterase. J. Pharm. Sci. 1975; 64, 418–420.
26. Marrs T. C. Organophosphate poisoning. Pharmacol. Ther. 1993; 58, 51–66.
27. Andreescu S., Marty J. L. Twenty years research in cholinesterase biosensors: from basic research to practical applications. Biomol. Eng. 2006; 23, 1–15.
28. Yu Q. S., Holloway H. W., Luo W., Lahiri D. K., Brossi A., Greig N. H. Long-acting anticholinesterases for myasthenia gravis: synthesis and activities of quaternary phenylcarbamates of neostigmine, pyridostigmine and physostigmine. Bioorg. Med. Chem. 2010; 18, 4687–4693.
29. Venkatasubban K. S., Johnson J. L., Thomas J. L., Faug A., Cusack B., Rosenberry T. L. Steric effects in the decarbamoylation of carbamoylated acetylcholinesterases. Chem. Biol. Interact. 2005; 157–158.
30. Yang Z. Z., Zhang Y. Q., Wu K., Wang Z. Z., Qi X. R. Tissue distribution and pharmacodynamics of rivastigmine after intranasal and intravenous administration in rats. Curr. Alzheimer Res. 2012; 9, 315–325.
31. Tayeb H. O., Yang H. D., Price B. H., Tarazi F. I. Pharmacotherapies for Alzheimer‘s disease: beyond cholinesterase inhibitors. Pharmacol. Ther. 2012; 134, 8–25.
32. Rai D. K., Sharma B. Carbofuran-induced oxidative stress in mammalian brain. Mol. Biotechnol. 2007; 37, 66–71.
33. Bucaretchi F., Prado C. C., Branco M. M., Soubhia P., Metta G. M., Mello S. M., de Capitani E. M., Lanaro R., Hyslop S., Costa J. L., Fernandes L. C. R., Vieira R. J. Poisoning by illegal rodenticides containing acetylcholinesterase inhibitors (chumbinho): a prospective case series. Clin. Toxicol. 2012; 50, 44–51.
34. Rampa A., Belluti F., Gobbi S., Bisi A. Hybrid-based multi-target ligands for the treatment of Alzheimer‘s disease. Curr. Top. Med. Chem. 2011; 11, 2716–2730.
35. Bai D. L., Tang X. C., He X. C. Huperzine A, a potential therapeutic agent for treatment of Alzheimer´s disease. Curr. Med. Chem. 2000; 7, 355–374.
36. Liu J., Zhang H. Y., Tang X. C., Wang B., He X. C., Bai D. L. Effects of synthetic (-)-huperzine A on cholinesterase activities and mouse water maze performance. Zhongguo Yao Li Xue Bao 1998; 19, 413–416.
37. Luo W., Li Y. P., He Y., Huang S. L., Li D., Gu L. Q., Huang Z. S. Synthesis and evaluation of heterobivalent tacrine derivatives as potential multi-functional anti-Alzheimer agents. Eur. J. Med. Chem. 2011; 46, 2609–2616.
38. Jogani V. V., Shah P. J., Mishra P., Mishra A. K., Misra A. R. Nose-to-brain delivery of tacrine. J. Pharm. Pharmacol. 2007; 59, 1199–1205.
39. Knapp M. J., Gracon S. I., Davis C. S., Solomon P. R., Pendlebury W. W., Knopman D. S. Efficacy and safety of high-dose tacrine – a 30 week evaluation Alzheimer Dis. Assoc. Dis. 1994; 8, S22–S31.
40. Davis K. L., Thal L. J., Gamzu E. R., Davis C. S., Woolson R. F., Gracon S. I., Drachman D. A., Schneider L. S., Whitehouse P. J., Hoover T. M., Morris J. C., Kawas C. H., Knopman D. S., Earl N. L., Kumar V., Doody R. S. A double-blind, placebo-controlled multicenter study of tacrine for Alzheimers-disease. New Engl. J. Med. 1992; 327, 1253–1259.
41. da Silva V. B., de Andrade P., Kawano D. F., Morais P. A. B., de Almeida J. R., Carvalho I., Taft C. A., da Silva C. In silico design and search for acetylcholinesterase inhibitors in Alzheimer’s disease with a suitable pharmacokinetic profile and low toxicity. Future Med. Chem. 2011; 3, 947–960.
42. Rainer M. Galanthamine in Alzheimer’s disease - A new alternative to tacrine? CNS Drugs 1997; 7, 89–97.
43. Lilienfeld S. Galantamine – a novel cholinergic drug with a unique dual mode of action for the treatment of patients with Alzheimer’s disease. CNS Drug. Rev. 2002; 8, 159–176.
44. Darreh-Shori T., Soininen H. Effects of cholinesterase inhibitors on the activities and protein levels of cholinesterases in the cerebrospinal fluid of patients with Alzheimer’s disease: a review of recent clinical studies. Curr. Alzheimer Res. 2010; 7, 67–73.
45. Thomsen T., Kewitz H. Selective inhibition of human acetylcholinesterase by galanthamine in vitro and in vivo. Life Sci. 1990; 46, 1553–1558.
46. Berg L., Andersson C. D., Artursson E., Hornberg A., Tunemalm A. K., Linusson A., Ekstrom F. Targeting acetylcholinesterase: identification of chemical leads by high throughput screening, structure determination and molecular modeling. PLoS One 2011; 6, e26039.
47. Cheewakriengkrai L., Gauthier S. A 10-year perspective on donepezil. Expert Opin. Pharmacother. 2013; 14 331–338.
48. Pohanka M. Spectrophotomeric assay of aflatoxin B1 using acetylcholinesterase immobilized on standard microplates. Anal. Lett. 2013; 46, 1306–1315.
49. Plageman L. R., Pauletti G. M., Skau K. A. Characterization of acetylcholinesterase in Caco-2 cells. Exp. Biol. Med. (Maywood) 2002; 227, 480–486.
50. Zhukovskii Y. G. On establishment of individuality of the choliensterase enzyme in the studied preparation. J. Evol. Biochem. Physiol. 2003; 39, 281–290.
51. Giacobini E. Cholinesterases: new roles in brain function and in Alzheimer’s disease. Neurochem. Res. 2003; 28, 515–522.
52. Grigoryan H. A., Hambardzumyan A. A., Mkrtchyan M. V., Topuzyan V. O., Halabyan G. P., Asatryan R. S. alpha,beta-Dehydrophenylalanine choline esters, a new class of reversible inhibitors of human acetylcholinesterase and butyrylcholinesterase. Chem. Biol. Interact. 2008; 171, 108–116.
53. Tecles F., Ceron J. J. Determination of whole blood cholinesterase in different animal species using specific substrates. Res. Vet. Sci. 2001; 70, 233–238.
54. Debord J., Laubarie C., Dantoine T. Microcalorimetric study of the inhibition of butyrylcholinesterase by carbamates. Anal. Biochem. 2008; 373, 247–252.
55. Kamal M. A., Klein P., Luo W., Li, Y., Holloway H. W., Tweedie D., Greig N. H. Kinetics of human serum butyrylcholinesterase inhibition by a novel experimental Alzheimer therapeutic, dihydrobenzodioxepine cymserine. Neurochem. Res. 2008; 33, 745–753.
56. Nagasawa T., Sagisaki H., Tani Y., Ogatak K. Purification and characterization of butyrylcholine-hydrolyzing enzyme from Pseudomonas polycolor. Biochim. Biophys. Acta 1976; 429, 817–827.
57. Monteiro M., Quintaneiro C., Morgado F., Soares A. M., Guilhermino L. Characterization of the cholinesterases present in head tissues of the estuarine fish Pomatoschistus microps: application to biomonitoring. Ecotoxicol. Environ. Saf. 200; 5; 62, 341–347.
58. Masson P., Froment M. T., Gillon E., Nachon F., Darvesh S., Schopfer L. M. Kinetic analysis of butyrylcholinesterase-catalyzed hydrolysis of acetanilides. Biochim Biophys Acta 2007; 1774, 1139–1147.
59. Montenegro M. F., Moral-Naranjo M. T., de la Cadena P. M., Campoy F. J., Munoz-Delgado E., Vidal C. J. The level of aryl acylamidase activity displayed by human butyrylcholinesterase depends on its molecular distribution. Chem. Biol. Interact. 2008; 175, 336–339.
60. Montenegro M. F., Maria T. M., de la Cadena M. P., Campoy F. J., Munoz-Delgado E., Vidal C. J. Human butyrylcholinesterase components differ in aryl acylamidase activity. Biol. Chem. 2008; 389, 425–432.
61. Pohanka M. Biosensors containing acetylcholinesterase and butyrylcholinesterase as recognition tools for detection of various compounds. Chem. Pap. 2015; 69, 4–16.
62. Pohanka M. Butyrylcholinesterase as a biochemical marker, a review. Brat. Med. J. 2013; 114, 726–734.
63. Pohanka M., Karasova J. Z., Kuca K., Pikula J., Holas O., Korabecny O., Cabal J. Colorimetric dipstick for assay of organophosphate pesticides and nerve agents represented by paraoxon, sarin and VX. Talanta 2010; 81, 621–624.
64. Bazire A., Gillon E., Lockridge O., Vallet V., Nachon F. The kinetic study of the inhibition of human cholinesterases by demeton-S-methyl shows that cholinesterase-based titration methods are not suitable for this organophosphate. Toxicol. Vitro 2011; 25, 754–759.
65. Bartling A., Worek F., Szinicz L., Thiermann H. Enzyme-kinetic investigation of different sarin analogues reacting with human acetylcholinesterase and butyrylcholinesterase. Toxicology 2007; 233, 166–172.
66. Gabrovska K., Marinov I., Godjevargova T., Portaccio M., Lepore M., Grano V., Diano N., Mita D. G. The influence of the support nature on the kinetics parameters, inhibition constants and reactivation of immobilized acetylcholinesterase. Int. J. Biol. Macromol. 2008; 43, 339–345.
67. Ellman G. L., Courtney K. D., Andres V., Jr., Feather-Stone R. M. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem. Pharmacol. 1961; 7, 88–95.
68. Pohanka M. Cholinesterases in biorecognition and biosensor construction, a review. Anal. Lett. 2013; 46, 1849–1868.
69. Eyer P., Worek F., Kiderlen D., Sinko G., Stuglin A., Simeon-Rudolf V., Reiner E. Molar absorption coefficients for the reduced Ellman reagent: reassessment. Anal. Biochem. 2003; 312, 224–227.
70. Sinko G., Calic M., Bosak A., Kovarik Z. Limitation of the Ellman method: Cholinesterase activity measurement in the presence of oximes. Anal. Biochem. 2007; 370, 223–227.
71. Zitova A., O’Mahony F. C., Kurochkin I. N., Papkovsky D. B. A simple screening assay for cholinesterase activity and inhibition based on optical oxygen detection Anal. Lett. 2010; 43, 1746–1755.
72. Evans O. On-line deoxygenation in reductive (and oxidative) amperometric detection: environmental applications in the liquid chromatography of organic peroxides. Analyst 1999; 124, 1811–1816.
73. No H. Y., Kim Y. A., Lee Y. T., Lee H. S. Cholinesterase-based dipstick assay for the detection of organophosphate and carbamate pesticides. Anal. Chim. Acta 2007; 594, 37–43.
74. Wu Z. L., Podust M. L. M., Guengerich F. P. Expansion of substrate specificity of cytochrome P450 2A6 by random and site-directed mutagenesis. J. Biol. Chem. 2005; 280, 41090–41100.
75. Tingfa D., Shiguang Z., Mousheng T. A new micro-detection tube for cholinesterase inhibitors in water. Enivron. Pollut. 1989; 57, 217–222.
76. Miao Y., He N., Zhu J. J. History and new developments of assay for cholinesterase activity and inhibition. Chem. Rev. 2010; 110, 5216–5234.
77. Guilbault G. G., Kramer D. N. Resorufin butyrate and indoxyl acetate as fluorogenic substrates for cholinesterase. Anal. Chem. 1965; 37, 120–123.
78. Pohanka M. Acetylcholinesterase based dipsticks with indoxylacetate as a substrate for assay of organophosphates and carbamates Anal. Lett. 2012; 45, 367–374.
79. Santarpia L., Grandone I., Contaldo F., Pasanisi F. Butyrylcholinesterase as a prognostic marker: a review of the literature. J. Cachexia Sarcopenia Muscle 2013; 4, 31–39.
80. Lockridge O. Review of human butyrylcholinesterase structure, function, genetic variants, history of use in the clinic, and potential therapeutic uses. Pharmacol. Ther. 2015; 148, 34–46.
81. Iwasaki T., Yoneda M., Nakajima A., Terauchi Y. Serum butyrylcholinesterase is strongly associated with adiposity, the serum lipid profile and insulin resistance. Intern. Med. 2007; 46, 1633–1639.
82. Ostergaard D., Viby-Moogensen J., Hanel H. K., Skovgaard L. T. Half-life of plasma cholinesterase. Acta Anaesthesiol. Scand. 1988; 32, 266–269.
83. Tajiri J., Nishizono Y., Fujiyama S., Sagara K., Sato T., Shibata H. Hypercholinesterasemia in patients with hepatocellular carcinoma: a new paraneoplastic syndrome. Gastroenterol Jpn 1983; 18, 137–141.
84. Lu W. D., Hada T., Fukui K., Imanishi H., Matsuoka N., Iwasaki A., Higashino K. Familial hypocholinesterasemia found in a family and a new confirmed mutation. Intern. Med. 1997; 36, 9–13.
85. Prellwitz W., Kapp S., Muller D. Comparative methods for the determination of the activity of serumcholinesterases (acylcholin-acyl-hydrolase E.C. 3.1.1.8) and their diagnostical value J. Clin. Chem. Clin. Biochem. 1976; 14, 93–97.
86. Duran-Ferreras E., Diaz-Narvaez F., Raffo-Marquez M. Chronic hepatic encephalopathy in a patient with primary biliary cirrhosis. Gastroenterol. Hepatol. 2011; 34, 401–405.
87. Kemkes-Matthes B., Preissner K. T., Langenscheidt F., Matthes K. J., Muller-Berghaus G. S protein/vitronectin in chronic liver diseases: correlations with serum cholinesterase, coagulation factor X and complement component C3. Eur. J. Haematol. 1987; 39, 161–165.
88. Kassa J. Review of oximes in the antidotal treatment of poisoning by organophosphorus nerve agents. J. Toxicol.-Clin. Toxicol. 2002; 40, 803–816.
89. Bajgar J. Organophosphates/nerve agent poisoning: Mechanism of action, diagnosis, prophylaxis, and treatment Adv. Clin. Chem. 2004; 38, 151–216.
90. Bajgar J. Biological monitoring of exposure to nerve agents. Brit. J. Ind. Med. 1992; 49 648–653.
91. Pohanka M. Alzheimer’s disease and related neurodegenerative disorders: implication and counteracting of melatonin. J. Appl. Biomed. 2011; 9, 185–196.
92. Hashim Y., Shepherd D., Wiltshire S., Holman R., Levy J. C., Clark A., Cull C. A. Butyrylcholinesterase K variant on chromosome 3 q is associated with Type II diabetes in white Caucasian subjects. Diabetologia 2001; 44, 2227–2230.
93. Holmes C., Ballard C., Lehmann D., Smith A. D., Beaumont H., Day I. N., Khan M. N., Lovestone S., McCulley M., Morris C. M., Munoz D. G., O’Brien K., Russ C., Del Ser T., Warden D. Rate of progression of cognitive decline in Alzheimer’s disease: effect of butyrylcholinesterase K gene variation. J. Neurol. Neurosur. Ps. 2005; 76, 640–643.
94. Kaufman S. E., Donnell R. W., Aiken D. C., Magee C. Prolonged neuromuscular paralysis following rapid-sequence intubation with succinylcholine. Ann. Pharmacother. 2011; 45, e21.
95. Kalow W., Genest K. A method for the detection of atypical forms of human serum cholinesterase; determination of dibucaine numbers. Can. J. Biochem. Physiol. 1957; 35, 339–346.
96. Yen T., Nightingale B. N., Burns J. C., Sullivan D. R., Stewart P. M. Butyrylcholinesterase (BCHE) genotyping for post-succinylcholine apnea in an Australian population. Clin. Chem. 2003; 49, 1297–1308.
97. Pohanka M. Determination of acetylcholinesterase and butyrylcholinesterase activity without dilution of biological samples. Chem. Pap. 2015; 69, 1044–1049.
Štítky
Farmácia Farmakológia
Článek Brněnské výstavy herbářůČlánek Nové knihy
Článok vyšiel v časopiseČeská a slovenská farmacie

2017 Číslo 4-
Všetky články tohto čísla
- Stanovení aktivity cholinesteras a jejich využití pro diagnostiku patologických stavů
- Možnosti využití hyaluronátu sodného ve farmacii a medicíně
- Specifika některých solí vápníku v intravenózní terapii hypokalcemie a jejich další využití
- Synergický účinok azolových antimykotík (klotrimazol, flukonazol) a prírodných látok
- Simplicia a nádoby jezuitské lékárny v Telči
- XLIII. lekárnické dni Lekárnickej sekcie Slovenskej farmaceutickej spoločnosti, venované 65. výročiu vzniku Farmaceutickej fakulty Univerzity Komenského v Bratislave, boli v Košiciach
- Brněnské výstavy herbářů
- Nové knihy
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti využití hyaluronátu sodného ve farmacii a medicíně
- Specifika některých solí vápníku v intravenózní terapii hypokalcemie a jejich další využití
- Synergický účinok azolových antimykotík (klotrimazol, flukonazol) a prírodných látok
- Stanovení aktivity cholinesteras a jejich využití pro diagnostiku patologických stavů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



