-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
„Switch“ z biosimilárního infliximabu CT-P13 na biosimilární infliximab SB-2 v dlouhodobé udržovací terapii IBD pacientů – prospektivní observační studie
Switch from biosimilar infliximab CT-P13 to biosimilar infliximab SB-2 in the long-term maintenance therapy in IBD patients – prospective observational study
Introduction: Therapeutical switch from originator to biosimilar infliximab has been proved as effective and safety procedure. We have a few information about non-medical swich from one biosimilar to the another biosimilar infiximab. Aim: This is a prospective observational study from one tercial IBD center, performed in 2021 and 2022 which was focused on efficacy and safety after switch from infliximab CT-P13 to infliximab SB-2 in patients with IBD. Methods: The cohort group comprised with 287 patients with IBD who have been consecutively treated with infliximab CT-P13 and they were switched to infliximab SB-2. All the re cruited patients were in clinical and biological sustained remission at mean for 6 months before the switch. Results: We proved that persistence on infliximab SB-2 therapy after the switch was 86.4% of treated patients, no significant changes in clinical inflammatory activities and biological parameters have been detected after the switch. The therapy termination due to side effects or loss of response in 39 patients (13.9%) has been detected due to lost of clinical response, side effects or lost of follow-up. No higher immunogenicity after the switch was found. Conclusion: Non-medical switch from one biosimilar infliximab (CT-P13) to another one (SB-2) was not associated with higher risks of disease destabilisation or immunogenicity.
Keywords:
inflammatory bowel disease – biosimilar infliximab CT-P13 – biosimilar infliximab SB-2 – therapeutical switch
Autori: M. Lukáš 1
; V. Hrubá 1
; J. Reissigová 2
; Karin Černá 1
; N. Machková 1; D. Ďuricová 1
; M. Kolář 1
; K. Vlková 1; L. Čermáková 1; M. Lukáš Jr 1
Pôsobisko autorov: Klinické a výzkumné centrum pro střevní záněty, Klinické centrum ISCARE a. s. a 1. LF UK v Praze 1; Ústav informatiky AV ČR, Praha 2
Vyšlo v časopise: Gastroent Hepatol 2023; 77(4): 336-341
Kategória: IBD: původní práce
doi: https://doi.org/10.48095/ccgh2023336Súhrn
Úvod: Převod biologické léčby (switch) z originálního na biosimilární infliximab je prokazatelně efektivním a bezpečným postupem. Méně informací je v klinické praxi o switchi z jednoho biosimilárního léčiva na jiný. Cíl: Prospektivní, observační studie provedená v jednom terciálním IBD centru v letech 2021 a 2022 se zaměřila na posouzení účinnosti a bezpečnosti léčby po převedení z jednoho biosimilárního léčiva (CT-P13) na jiný biosimilární infliximab SB-2 u nemocných s idiopatickými střevními záněty. Metodika: Do sledování bylo zařazeno celkem 287 nemocných s Crohnovou chorobou a ulcerózní kolitidou, kteří byli v průměru 6 měsíců před ne-medicínským switchem v klinické a laboratorní remisi onemocnění. Výsledky: V průběhu 13 měsíců po provedené změně léčby bylo zjištěno, že perzistence na léčbě po switch na biosimilární infliximab SB-2 byla 86,4 % a nedošlo k významnějším změnám v klinických ani biologických parametrech aktivity IBD. Předčasně muselo po provedení switche ukončit léčbu 39 nemocných (13,9 %), a to pro ztrátu účinnosti, vznik vedlejších efektů terapie nebo pro ztrátu sledování. Nebyly zjištěny vyšší projevy imunogenicity léčby po provedené změně léčby z infliximabu CT-P13 na infliximab SB-2. Závěr: Ne-medicínský switch biologické léčby z jednoho (CT-P13) na jiný biosimilární infliximab (SB-2) není spojen s vyšším rizikem destabilizace IBD nebo s vyšším rizikem imunogenicity.
Klíčová slova:
idiopatické střevní záněty – biosimilární infliximab CT-P13 – infliximab SB-2 – terapeutický switch
Úvod
První biosimilární infliximab CT-P13 byl do klinické praxe povolen agenturou EMA (European Medical Agency) již v roce 2013, a to pro všechny indikace originálního infliximabu včetně nemocných s idiopatickými střevními záněty (IBD). Větší rozšíření terapie s CT-P13 ve střední a východně Evropě bylo zaznamenáno až po roce 2015. Dramatické snížení nákladovosti biologické léčby v našich podmínkách přesahující 90 % původní ceny originálního infliximabu vedlo k významnému zvýšení dostupnosti biologické léčby pro nemocné trpícími Crohnovou nemocí (CN) a ulcerózní kolitidou (UC). V průběhu posledních 8 let se počet nemocných se střevními záněty léčených biologickými léčivy zvýšil v ČR z původních 1 700 na 10 000. Přesto zůstává „proléčenost“ IBD pacientů v ČR na polovičních hodnotách oproti západní Evropě. V současnosti je u nás přibližně 20 % nemocných s CN a 10 % pacientů s UC na biologické nebo inovativní terapii. Původní velké obavy z biosimilárních léčiv s ohledem na nižší účinnost a vyšší výskyt nežádoucích účinků definitivně odstranily výsledky rozsáhlého klinického projektu Nor-Switch, který byl organizován a financován norskou vládou a monitoroval efekt infliximabu CT-P13 v léčbě autoimunitně zprostředkovaných chorob. Výsledkem několikaletého projektu bylo zjištění, že efektivita, vedlejší účinky a také imunogenicita biosimilárního infliximabu CT-P13 se neliší oproti léčbě originálním infliximabem [1,2]. V dalších letech byly do terapie střevních zánětů zavedeny další biosimilární infliximaby a později také biosimilární adalimumaby. I v těchto případech se ukázalo, že změna z originálního na biosimilární adalimumab není spojena s větším rizikem ztráty efektu nebo s vyšším rizikem vedlejších efektů léčby [3]. V poslední době se objevila nová otázka, a sice zda přechod léčby z jednoho biosimilárního léčiva na jiný biosimilární prostředek je efektivním a bezpečným léčebným přístupem. K ověření tohoto postupu byla provedena prospektivní, observační studie v Klinickém centru ISCARE a. s. u nemocných s CN a UC, kteří byli převedeni z původní terapie infliximabem CT-P13 na infliximab SB-2.
Metodika
Od 1. 3. 2021 do 30. 3. 2022 byli nemocní s CN a UC v Klinickém a výzkumném centru pro IBD na terapii biosimilárním infliximabem CT-P13 switchováni na léčbu s biosimilárním infliximabem SB-2. Všichni nemocní vykazovali klinické a laboratorní známky remise CN nebo UC, v průměru 6 měsíců (medián 5,6; IQR = 0,4) před provedením switche. U každého nemocného byl ponechán stávající režim podávané biologické léčby s ohledem na denní dávku a také na interval intravenózního podávání, jaký byl zaveden pro konkrétního pacienta při léčbě biosimilárním CT-P13. Nemocní byli monitorováni klinicky, v případě CN byla aktivita choroby vyjádřena pomocí Harvey-Bradshawova indexu; u nemocných s UC byla klinická aktivita nemoci hodnocena podle pMayo indexu. Všichni nemocní měli pravidelně monitorovány biologické známky aktivity nemoci prostřednictvím koncentrace fekálního kalprotektinu a sérové koncentrace CRP. Sledování klinických a laboratorních parametrů bylo provedeno 6 měsíců před změnou léčby, v době změny terapie a poté za 7 (medián 7,1; IQR = 1,8) a 13 (medián 12,6; IQR = 0,9) měsíců po změně léčby na infliximab SB-2, kde IQR značí kvartilové rozpětí. Současně byla monitorována sérová koncentrace infliximabu před dalším podáním infuze (trough level), ve stejných intervalech jako zmíněné laboratorní parametry. Hladina infliximabu se měřila pomocí enzymatické imunoeseje ImmunoGuide (IG-AB101).
Všichni nemocní byli před provedením změny léčby, tj. před převodem z infliximabu CT-P13 na infliximab SB-2, podrobně informováni a změna terapie byla provedena až po získání pacientova souhlasu.
Statistická analýza
K analýze zjištěných dat byly použity následující statistické metody:
Hodnoty spojitých veličin jsou vyjádřeny pomocí boxplotů (Q1 označuje první kvartil hodnot, Q3 třetí kvartil). Párové hodnoty spojitých veličin se porovnávaly Wilcoxonovým testem (veličiny nebyly normálně rozděleny, ověřováno Shapirovým-Wilkovým testem a pomocí Q-Q grafu) a hodnoty párových kategorizovaných hodnot McNemarovým testem (s korekcí nebo bez korekce kontinuity). Závislost hodnot spojitých veličin na čase měření se analyzovala robustními lineárními regresivními modely se smíšenými efekty (v obou případech s náhodným efektem pro každého pacienta). Modely zahrnovaly i pacienty, kteří neměli všechna měření v čase. Analýza chybějících hodnot se provedla pomocí logistické regrese, avšak chybějící hodnoty nebyly odhadovány. Pravděpodobnost perzistence na léčbě je znázorněna pomocí Kaplanovy-Mayerovy křivky a rozdíl v křivkách mezi skupinami (definovanými na základě léčby) se vyhodnocovala log rankovým testem. Analýza dat byla zpracována ve statistickém R softwaru, verze 4.3.0.
Výsledky
Do projektu bylo zařazeno celkem 287 IBD pacientů (125; 43,6 % žen), z nichž 215 (74,9 %) mělo CN a 72 (25,1 %) UC, z toho 107 nemocných (37,1 %) bylo biologicky naivních a CT-P13 byla první biologickou léčbou. Podrobná charakteristika celého souboru je uvedena v tab. 1. U nemocných s CN byl dominantním fenotypem zánětlivá forma choroby (B1) v 85 % případů, u nemocných s UC byla nejčastěji se vyskytujícím levostranná forma nemoci (L2) u 48,6 % (grafy 1–3).
Tab. 1. Charakteristika pacientů.
Tab. 1. Characteristics of patients.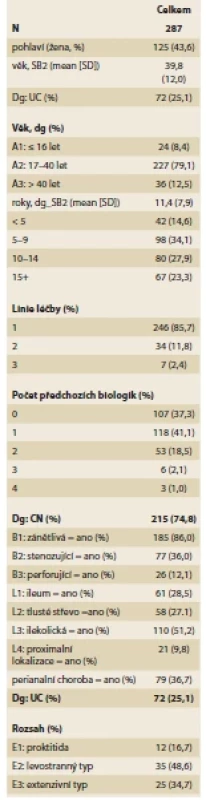
Monitorování pacientů ukázalo, že za > 1 rok po převedení z infliximabu CT-P13 na biosimilární SB-2 nedošlo ke změně klinických ani biologických indikátorů aktivity IBD.
To znamená, že v žádném případě nebyly hodnoty Harvey-Bradshawova indexu u nemocných s CN, hodnoty sérového C-reaktivního proteinu a koncentrace fekálního kalprotektinu u IBD pacientů signifikantně závislé na čase měření (graf 1; p = 0,508), (graf 2; p = 0,369), (graf 3; p = 0,262). Pokud jsme se omezili na rozdíly párových hodnot, ani v tomto případě jsme nezjistili signifikantní rozdíly mezi hodnotami měřenými v průběhu studie a hodnotami měřenými 6 měsíců před switchem.
Graf 1. Boxploty hodnot Harvey-Bradshawova indexu u nemocných s CN před (šedá) a po switchi (zelená barva).
Chart 1. Boxplots of Harvey-Bradshaw index values in patients with CN before (gray) and after the switch (green).
Graf 2. Boxploty sérových koncentrací C-reaktivního proteinu u IBD pacientů před (šedá) a po switchi (zelená).
Graph 2. Boxplots of serum concentrations of C-reactive protein in IBD patients before (gray) and after the switch (green).
Graf 3. Boxploty koncentrací fekálního kalprotektinu (na logaritmické stupnici).
Graph 3. Boxplots of faecal calprotectin concentrations (on a logarithmic scale).
Plazmatická hladina infliximabu (through level) se v průběhu 13 měsíců signifikantně zvyšovala (graf 4; p < 0,001). Jak z grafů 1 a 4 vyplývá, ne u všech pacientů byla k dispozici všechna měření v čase. Všechny chybějící hodnoty však nebyly signifikantně závislé na pohlavní ani věku, vyjma koncentrací fekálního kalprotektinu, které chyběly převážně u mladších pacientů (p < 0,001). Když jsme však zohlednili věk při statistické analýze koncentrací fekálního kalprotektinu, závěry byly stejné: čas měření neměl na hodnoty signifikantní vliv.
Graf 4. Boxploty sérových koncentrací infl iximabu (Ctrough) před (šedá) a po (zelená) switchi.
Graph 4. Boxplots of infl iximab serum concentrations (Ctrough) before (gray) and after (green) switchi.
Podíl nemocných s aktivní perianální formou CN v čase signifikantně klesal (p < 0,001); před převedením léčby vykazovalo 13,9 % (n = 287) pacientů aktivitu perianální formy CN, za 1 rok po převedení na infliximab SB-2 to bylo 8,5 % pacientů (n = 247). Rovněž podíl nemocných, kteří užívali konkomitantní imunosupresivní léčbu (azathioprin nebo metotrexát), signifikantně klesal; před switchem užívalo celkem 32,8 % nemocných (n = 287) imunosupresiva, za 1 rok po switchi na SB-2 to bylo 24,3 % nemocných (n = 247) (p< 0,001). Celková perzistence na změněné biologické léčbě byla na konci ročního sledování 86,4 %; 95% CI (82,5 %; 90,4 %) (graf 5).
Graf 5. Perzistence pacientů na léčbě biosimilárním infl iximabem SB-2 po provedeném switchi. Graph 5. Persistence of patients on treatment with biosimilar infl iximab SB-2 after the switch. 
Ukončení terapie po provedeném switchi bylo zjištěno u 39 pacientů (13,7 %). Nejčastějším důvodem k předčasnému ukončení terapie byl výskyt kožních nežádoucích účinků (psoriaziformní dermatitida, zhoršení atopického ekzému, folikulitida) zaznamenaných u 14 nemocných (4,9 %) a na druhém místě se jednalo o selhání terapeutické účinnosti u 10 pacientů (3,5 %).
Diskuze
Výsledky naší prospektivní, observační studie ukázaly, že změna léčby z jednoho biosimilárního infliximabu (CT-P13) na druhý biosimilární infliximab SB2 z důvodu ne-medicínského switche je efektivním a bezpečným postupem u většiny nemocných s IBD, kteří jsou na dlouhodobé udržovací terapii. Během více než ročního sledování po switchi jsme nezjistili žádný negativní vliv změny léčby na klinické ani na biologické parametry střevního zánětu a drtivá většina pacientů zůstala v klinické remisi. Neukázaly se žádné klinické ani laboratorní nepřímé známky podporující vyšší imunogenicitu indukovanou switchem. Medián plazmatických hladin infliximabu (trough level) před změnou léčby a po ní byl téměř identický. Nemáme žádná robustní data o přítomnosti protilátek proti infliximabu, protože ty se stanovují na našem pracovišti pouze u pacientů, kteří mají nulové plazmatické hladiny léku, a to bylo zaznamenáno pouze u dvou nemocných v průběhu sledování. Vysoká efektivita léčby SB-2 je také nepřímo podporována tím, že nebyl změněn (numericky snížen) podíl nemocných, kteří vyžadovali konkomitantní podávání imunosupresivní terapie před provedením switche a po něm (32,8 vs. 24,5 %). Celkem 13,7 % nemocných ukončilo léčbu v následujícím roce po switchi. Vedoucí příčinou předčasného ukončení léčby byly kožní vedlejší efekty terapie, především zhoršení konkomitující atopické dermatitidy, vznik psoriaziformních ložisek na obličeji nebo objevení se pustulózní dermatitidy. V porovnání s výsledky, které jsme zaznamenali v našem historickém souboru IBD pacientů čítající celkem 916 případů na terapii infliximabem (87 % nemocných dostávalo biosimilární infliximab), byly kožní nežádoucí efekty terapie zaznamenány u 83 osob (9,1 %). V porovnání s tím nebyl zjištěn významněji odlišný počet kožních lézí po provedení switche (4,9 %) [4]. Alergické reakce byly v historické kohortě 916 pacientů zjištěny celkem v 51 případech (5,6 %), ve sledované kohortě pacientů po provedeném switchi nebyly zjištěny ani v jednom případě. Pravděpodobným důvodem je, že všichni pacienti před switchem byli léčeni infliximabem po delší dobu (v průměru 4 roky) a vznik protilátek proti infliximabu a následných alergických reakcí je popisován většinou v prvním roce léčby [4]. U 10 (3,5 %) nemocných došlo po switchi v průběhu ročního sledování ke ztrátě účinnosti léčby a z toho důvodu musela být terapie ukončena a tito nemocní byli převedeni na jinou biologickou léčbu nebo museli být operováni.
Za největší přínos našeho projektu považujeme relativně velkou kohortu pacientů, kteří byli 13 měsíců po switchi monitorováni, včetně klinických, biochemických a imunologických kritérií. Nedostatkem, který limituje významnost námi zjištěných výsledků, je provedení studie pouze v jednom centru a nepřítomnost kontrolní skupiny léčených pacientů bez provedeného switche. Určitým dalším limitem byla také nekompletnost všech potřebných dat k provedení analýzy včetně endoskopického vyšetření a zhodnocení slizničního nálezu. Nicméně recentně byly publikovány podobně příznivé výsledky switche z CT-P13 na SB-2 na menší kohortě pacientů rekrutovaných ze dvou nizozemských pracovišť [5]. Ve velké švédské studii vycházející z národního registru revmatologických pacientů se ukázalo, že retence (perzistence) na léčbě je mezi originálními a biosimilárními léčivy zahrnujícími infliximab, adalimumab, etanercept a rituximab velmi podobná. Neexistují tedy žádné signály o menší účinnosti a větší toxicitě biosimilárních monoklonálních protilátek také z jiných oborů medicíny [6]. Debaty o vzájemné zaměnitelnosti originálních a biosimilárních monoklonálních protilátek byly v podstatě ukončeny v září 2022, kdy EMA vydala prohlášení, ve kterém všechny tři eventuality, tj. záměna originální molekuly za biosimilární, nebo záměna jednoho biosimilárního léčiva za druhý, nebo převedení biosimilární monoklonální protilátky za originální, považuje za adekvátní a rovnocenné [7]. Výsledky našeho monocentrického projektu toto stanovisko dobře podporují. Bezpečnost a účinnost biosimilárních, vzájemně zaměnitelných protilátek je u nemocných s IBD velmi důležitá, a to nejen s ohledem na ekonomický benefit, tedy ušetření financí pro novější a nákladnější léčbu u nemocných, kteří mají těžký a medikamentózně refrakterní průběh nemoci. V kontextu s recentním stanoviskem ECCO ohledně tzv. recycling terapie, tedy znovuzavedené biologické léčby u nemocných s relapsem choroby vzniklé po přerušení nebo ukončení biologické léčby, jsou data o efektivitě a bezpečnosti biosimilárních léčiv rovněž velmi důležitá [8].
ORCID autorů
M. Lukáš ORCID 0000-0002-1463-3840,
V. Hrubá ORCID 0000-0001-5218-0363,
J. Reissigová ORCID 0000-0002-5402-699X.
K. Černá ORCID 0000-0003-1593-5899,
D. Ďuricová ORCID 0000-0002-6090-3522,
M. Kolář ORCID 0000-0001-9501-0604.
Doručeno/Submitted: 28. 7. 2023
Přijato/Accepted: 7. 8. 2023
prof. MUDr. Milan Lukáš, CSc., AGAF
Klinické a výzkumné centrum pro střevní záněty
Klinické centrum ISCARE a. s. a 1. LF UK v Praze
Českomoravská 19
190 00 Praha 9
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů, a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their names and e-mails in the published article/ manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for bio medical papers.
Gastroent Hepatol 2023; 77(4): 336 – 341
Zdroje
1. Lukáš M. Přínos biosimilárních monoklonálních protilátek v terapii idiopatických střevních zánětů. Gastroent Hepatol 2022; 76 (5): 447–452. doi: 10.48095/ccgh2022447.
2. Jorgensen KK, Olsen IC, Goll GL et al. Switching from originator infliximab to biosimilar CT-P13 compared with maintenance treatment with original infliximab (Nor-Switch): a randomized 52 week, double blind, non-inferiority study. Lancet 2017; 389 (10086): 2304–2316. doi: 10.1016/S0140-6736 (17) 30068-5.
3. Lukas M, Kolar M, Reissigová K et al. A switch from originator adalimumab to the biosimilar SB5 in patients with Crohn’s disease: an analysis ot two propensity score-matched cohorts. Scand J Gastroenterol 2022; 57 (7): 814–824. doi: 10.1080/00365521.2022.2041082.
4. Lukáš M, Ďuricová D. Zkušenosti s biologickou léčbou v Klinickém centru ISCARE. In: Idiopatické střevní záněty II. Nové trendy a mezioborové souvislosti. Praha: Grada Publishing 2021; 177–202.
5. Hanzel J, Jarisen JM, Ter Steege RW et al. Multiple switches from the originator infliximab to biosimilar is effective and safe in inflammatory bowel disease: A prospective multicenter cohort study. Inflamm Bowel Dis 2022; 26 (4): 495–501. doi: 10.1093/ibd/izab099.
6. Di Giuseppe D, Lindstrom U, Bower H et al. Comparison of treatment retention of originator vs biosimilar products in clinical rheumatology practice in Sweden. Rheumatology 2022; 61 (9): 3596–3605. doi: 10.1093/rheumatology/keab933.
7. Statement on the scientific rationale supporting interchangeability of biosimilar medicines in the EU. 2022 [online]. Dostupné z: statement-scientific-rationale-supporting-interchangeability-biosimilar-medicines – EMA review following PROM endorsement (europa.eu).
8. Noor NM, Sousa P, Bettenworth D et al. ECCO topical review on biological treatment cycles in Crohn’s disease. J Crohns Colitis 2023; 17 (7): 1031–1045. doi: 10.1093/ecco-jcc/jjad001.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2023 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Klinická a experimentální gastroenterologie
- Hepatogenní diabetes u kandidátů transplantace jater: prevalence, rizikové faktory a potransplantační vývoj – prospektivní studie
- Biofeedback assisted deep breathing training in refractory disorders of gut-brain interaction – our first experience, impressions and suggestions for further clinical practice
- Robotická chirurgie slinivky břišní v pankreatochirurgickém high-volume centru – první zkušenosti
- Bolest na hrudi jako atypický příznak akutní cholecystitidy
- Vliv pandemie covidu-19 na akutní pankreatitidu v České republice – pilotní data studie PANACOTA (PANcreatitis Acuta in COvid Time Analysis)
- Zmena epidemiologického charakteru klostrídiovej kolitídy – rastúci počet komunitných foriem a infekcií u detí
- Proč bychom měli a neměli využívat ChatGPT v gastroenterologii?
- EUS navigovaná drenáž žlučníku: vlastní soubor 66 pacientů za období 2016–2022 z Nemocnice Jablonec nad Nisou
- „Switch“ z biosimilárního infliximabu CT-P13 na biosimilární infliximab SB-2 v dlouhodobé udržovací terapii IBD pacientů – prospektivní observační studie
- Lékové formy perorálního mesalazinu a jejich klinické využití
- Subkutánní infliximab – poznatky z praxe a další možnosti využití u pacientů s IBD
- Výběry z mezinárodních časopisů
- Správná odpověď na předchozí kvíz
- 12th Club Symposium on Portal Hypertension April, 14th–15th 2023, Banská Štiavnica
- 44. české a slovenské endoskopické dny a Olomouc Live Endoscopy 2023
- Kreditovaný autodidaktický test: Klinická a experimentální gastroenterologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Zmena epidemiologického charakteru klostrídiovej kolitídy – rastúci počet komunitných foriem a infekcií u detí
- Robotická chirurgie slinivky břišní v pankreatochirurgickém high-volume centru – první zkušenosti
- EUS navigovaná drenáž žlučníku: vlastní soubor 66 pacientů za období 2016–2022 z Nemocnice Jablonec nad Nisou
- Lékové formy perorálního mesalazinu a jejich klinické využití
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




