Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
Osmotic Demyelination Syndrome – MRI Diagnosis: a Case Report
Central pontine myelinolysis (CPM) together with extrapontine myelinolysis (EPM) are also named osmotic demyelination syndrome (ODMS). The osmotic destruction of myelin sheaths in the pons and/or extrapontine localization occurs in this disease while neurons and their axons remain intact. The mechanism of the myelinolysis development is not well known yet. It is commonly found in association with mineral dysbalance (particularly hyponatraemia or its rapid correction), therefore chronic alcoholics or seriously malnourished patients are typically afflicted. Common symptoms are spastic quadruparesis, pseudobulbar paralysis, pseudocoma (locked-in syndrome), coma, and a few cases may also progress to death. MRI is of the main importance in the ODMS diagnosis. In the case of CPM, we can find T1 hypointense, T2, PD (proton density weighed images) and FLAIR (fluid attenuated inversion recovery) hyperintense lesion in the central pons whereas peripheral area and pyramidal tracts remain intact. There is either no enhancement or a ring-like peripheral enhancement after a contrast agent administration. DWI (diffusion weighed images) with ADC (apparent diffusion coefficient) allow to differentiate cytotoxic oedema, which can be present in ODMS, and vasogenic oedema. Similar imaging findings as those in ODMS can be also observed in ischaemia, astrocytoma, multiple sclerosis, some metabolic diseases, posterior reversible encephalopathy syndrome or mesial temporal sclerosis. The authors have presented their experience with 7 cases of ODMS diagnosed by MRI in their institution.
Key words:
central pontine myelinolysis (CPM) – extrapontine myelinolysis (EPM) – osmotic demyelination syndrome (ODMS) – magnetic resonance imaging (MRI)
Autori:
M. Slanina 1; J. Žižka 1; L. Klzo 1; J. Novotný 1; P. Ryška 1; Z. Špriňar 1; J. Hons 2; M. Šenkeřík 3; P. Kunc 4
Pôsobisko autorov:
Radiologická klinika LF UK a FN
Hradec Králové
1; Psychiatrická klinika LF UK a FN
Hradec Králové
2; Dětská klinika LF UK a FN
Hradec Králové
3; Neurologická klinika LF UK a FN
Hradec Králové
4
Vyšlo v časopise:
Cesk Slov Neurol N 2007; 70/103(3): 322-327
Kategória:
Kazuistika
Súhrn
Centrální pontinní myelinolýza (CPM) se společně s extrapontinní myelinolýzou (EPM) označuje také jako osmotický demyelinizační syndrom (ODMS). Je charakterizován osmotickým rozpadem myelinu v pontu event. extrapontinní lokalizaci, zatímco neurony a jejich axony zůstávají neporušeny. Vlastní mechanizmus vývoje těchto změn není doposud spolehlivě objasněn. Onemocnění postihuje osoby s rozvratem iontového metabolizmu (nejčastěji jde o hyponatremii či spíše její překotnou korekci), s nímž se typicky setkáváme u chronických alkoholiků nebo při pokročilé malnutrici. Klinické příznaky zahrnují spastickou kvadruparézu, pseudobulbární paralýzu, pseudokóma (locked-in syndrome), kóma, stav však může končit i smrtí. Stěžejní význam v diagnóze ODMS má MRI. V případě CPM se setkáváme s neexpandující, T1 hypointenzní, na T2, PD (vážení dle protonové denzity) a FLAIR (fluid attenuated inversion recovery – sekvence s potlačením signálu tekutiny) obrazech hyperintenzní lézí centrálně v pontu, zatímco periferní zóna a oblasti pyramidových drah bývají ušetřeny. Po aplikaci kontrastní látky se ložisko nesytí, někdy se lze setkat s prstenčitou opacifikací jeho periferie. DWI (diffusion weighted images – difuzně vážené obrazy) se stanovením ADC (apparent diffusion coefficient – aparentní difuzní koeficient) umožňují navíc rozlišit mezi cytotoxickým edémem, který bývá u ODMS přítomen, a edémem vazogenním. Obraz obdobný ODMS při MRI mohou mít zejména ischemie, astrocytom, roztroušená skleróza, některé metabolické choroby, syndrom zadní reverzibilní encefalopatie či meziální temporální skleróza. Autoři popisují zkušenosti se 7 případy ODMS diagnostikovanými na jejich pracovišti pomocí MRI.
Klíčová slova:
centrální pontinní myelinolýza (CPM) – extrapontinní myelinolýza (EPM) – osmotický demyelinizační syndrom (ODMS) – magnetická rezonance (MRI)
ÚVOD
Centrální pontinní myelinolýza (CPM) byla poprvé popsána v r. 1959 Adamsem [1]. Spolu s extrapontinní myelinolýzou (EPM), která je přibližně stejně častá jako centrální pontinní varianta, se označuje také jako osmotický demyelinizační syndrom (ODMS) [2] a řadí se mezi tzv. toxicko-metabolické demyelinizace [3]. Vyskytuje se o něco častěji u mužů než u žen, objevuje se ve všech věkových kategoriích, nejčastěji však ve středním věku [4]. Onemocnění je charakterizováno osmotickým rozpadem myelinu a poškozením oligodendrocytů v pontu a/nebo extrapontinní lokalizací, zatímco neurocyty a jejich výběžky bývají ušetřeny. Postihuje osoby s rozvratem iontového metabolizmu (typicky se rozvíjí při hyponatremii, resp. její příliš rychlé korekci) [3]. S tímto stavem se nejčastěji setkáváme u chronických alkoholiků či u pokročilé malnutrice (zpravidla v souvislosti s profuzním zvracením) [3]. ODMS se však může rozvinout i u chronických orgánových onemocnění [5], po transplantaci jater [6], u diabetes mellitus [7,8], imunokompromitovaných jedinců [9], některých nádorů [5], endokrinních chorob [10] a byl popsán i případ vzniku tohoto syndromu při otravě pesticidy [11]. Klinickou manifestací je obvykle spastická kvadruparéza, pseudobulbární paralýza [5], paréza okohybných svalů [12], extrapyramidové symptomy (u EPM) [13], pseudokóma (locked-in syndrome), kóma a vzácně stav končí i smrtí [5]. Tyto symptomy se objevují 2-4 dny po korekci iontové poruchy [4]. Existují však i případy asymptomatického ODMS [12], nikoliv vzácně se lze setkat s částečnou nebo úplnou regresí onemocnění [14,15]. Makroskopickým korelátem ODMS je měkká, šedavá diskolorace v místě léze [4], mikroskopickým pak absence oligodendroglie, infiltrace pěnovými buňkami a reaktivní astrocytóza při absenci známek zánětu; neurony a jejich axony jsou zpravidla neporušeny [4,9]. Prognóza onemocnění bývá nejistá, kauzální terapie v současnosti neexistuje [2]. Je proto nutné zaměřit se především na preventivní opatření (pozvolná korekce osmotických dysbalancí). Vliv plazmaferézy, infuze glukózy, aplikace kortikosteroidů či vitaminů na průběh onemocnění je předmětem výzkumu současných studií [3, 4].
ZOBRAZOVACÍ DIAGNOSTIKA ODMS
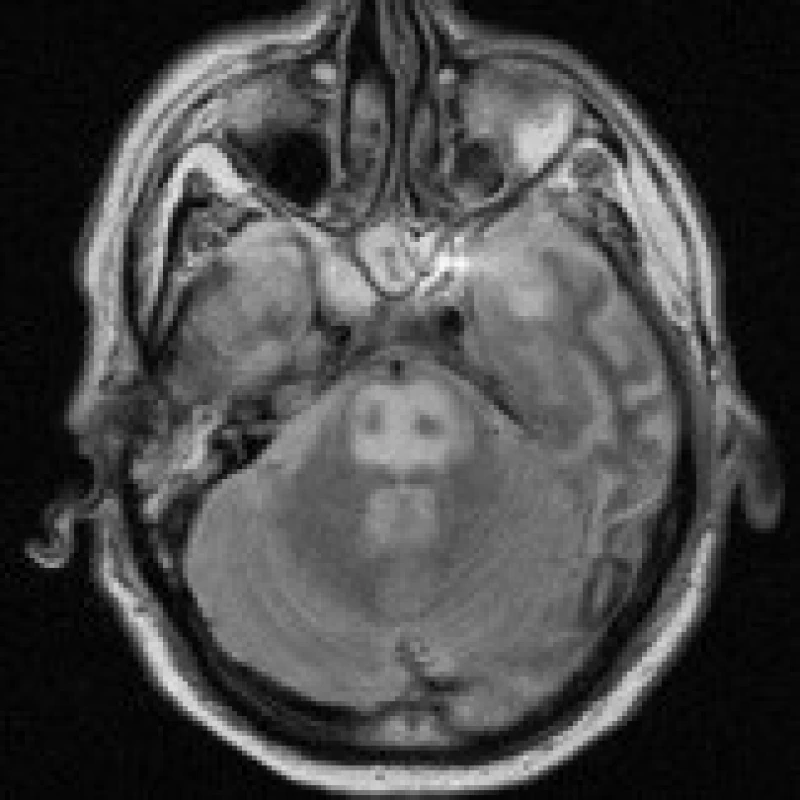
Na CT obrazech můžeme prokázat hypodenzní ložisko zpravidla bez opacifikace po podání kontrastní látky [4], stěžejní význam v diagnóze má však MR [16]. Zde se v případě CPM setkáváme s neexpandující okrouhlou či triangulární [4], T1-hypointenzní, na T2-vážených obrazech, PD obrazech (obrazy vážené dle protonové denzity) a FLAIR sekvencích (fluid attenuated inversion recovery – sekvence s potlačením signálu tekutiny) hyperintenzní lézí v centrální části pontu. Periferní zóna a oblasti kortikospinálních drah bývají ušetřeny [3], čímž vzniká typický obraz sovích očí (owl’s eyes) (obr. 1). Ložisko se po aplikaci kontrastní látky většinou nesytí, pouze u těžších případů se lze setkat s prstenčitým typem opacifikace na jeho periferii. V extrapontinní lokalizaci se s obdobným nálezem setkáváme nejčastěji ve středních vrstvách atrofického kalózního tělesa (v tomto případě jde pravděpodobně o specifickou variantu EPM, tzv. Morbus Marchiafava – Bignami) [3], mezencefalu, bazálních gangliích, talamu, capsula interna (event. externa, extrema), na rozhraní bílé a šedé hmoty [9], vzácněji i v corpora geniculata (lateralia) [4]. Tyto nálezy jsou zpravidla pozitivní během 10-14 dní [17] po nástupu klinických příznaků, jejich rozsah však nemusí nutně korelovat s mírou těchto projevů [2,18]. Na DWI (diffusion weighted images – difuzně vážené obrazy) je léze taktéž hyperintenzní a hodnota ADC (apparent diffusion coefficient – aparentní difuzní koeficient) bývá snížena [9]. DWI se stanovením ADC zachycují změny v difuzi vody při poruše buněčného transportu a následný rozvoj cytotoxického edému ještě před vznikem vlastní myelinolýzy. To umožňuje časnou diagnózu onemocnění již v prvním týdnu [14] a rozlišení mezi cytotoxickým edémem, který bývá u ODMS přítomen [19] a edémem vazogenním. DWI s ADC ovšem neodliší myelinolýzu od ischemie, kde je ADC také snížen. Hodnota ADC se normalizuje zhruba za 3 týdny po nástupu klinických příznaků [14]. Reziduální ložiskové změny na MRI obrazech často přetrvávají mnoho měsíců [3].
KAZUISTIKY
Od roku 1998 bylo na našem pracovišti zaznamenáno celkem 7 případů ODMS (6 mužů ve věku 38-73 let a jedna pětiletá dívka), z nichž 5 s dostupnou klinickou dokumentací je podrobněji rozebráno níže.
Kazuistika 1
Na dětskou kliniku byla odeslána 5letá dívka, která postnatálně prodělala operaci meningomyelokély s připojením ventrikuloperitoneální drenáže. Nyní byla přijata pro přetrvávající septický stav po proběhlé peritonitidě s meningitidou (leukocyty 18000/mm3, C reaktivní protein 116 mg/l, teplota 39,2 °C, kalium 3,5 mmol/l, ostatní minerály v normě), doprovázený opakovaným zvracením a dehydratací. Kultivačně byla při punkci shuntu zastižena Klebsiella pneumoniae. I přes antibiotickou terapii došlo ke zhoršení stávajícího septického stavu (leukocyty 32 000/mm3, C reaktivní protein 151 mg/l, teplota 40,2 °C), proto byla provedena dočasná externalizace drenáže a výměna antibiotik. Od tohoto okamžiku se nemocná klinicky zlepšovala, normalizoval se krevní obraz i zánětlivé markery (leukocyty 7 000/mm3, C reaktivní protein 4 mg/l, teplota 36,4 °C) a při kontrolní lumbální punkci byl i kultivační nález negativní. Na MR vyšetření mozku provedeném za 11 dní od přijetí nebyly prokázány přímé známky ventrikulitidy či meningitidy, patologickým nálezem byla neexpandující okrouhlá zóna T2 hyperintenzity centrálně v pontu o velikosti 14×11 mm (obr. 2a), periferně se opacifikující (obr. 2b). Na prvním místě se pomýšlelo na kmenový absces, CPM se jevila jako méně pravděpodobná. Na kontrolním MRI vyšetření v odstupu 1 měsíce byl však nález stacionární a diagnóza byla uzavřena jako CPM. Při vyšetření po 1 roce byly zachyceny regresivní změny po CPM (8 mm ložisko mírné T2 hyperintenzity) (obr. 2c).

Kazuistika 2
47letý muž, chronický alkoholik s výraznou malnutricí, byl přijat na psychiatrickou kliniku pro poruchu recentní paměti se zmateným chováním a konfabulováním (přijat poté, co vysazoval v dubnu stromek s tím, že se chystá na Vánoce). V biochemickém nálezu dominovala hypokalemie (3,2 mmol/l) při normonatremii a normofosfatemii, zvýšené byly také hladiny transamináz a bilirubinu, hodnoty vitaminu B12 a folátu se nacházely v mezích normy. Hematologický nález byl s obrazem normocytární anémie. Po přijetí byla zahájena terapie Tiapridalem a Diazepamem, dále byla podávána perorální nootropika, tiamin a upravena hladina kalia. Na CT mozku provedeném za 6 dní po korekci hladiny kalia bylo zachyceno neexpandující hypodenzní ložisko s cípatými okraji velikosti asi 15 mm v centrální části pontu s přesahem do mezencefala a difuzní mozková atrofie supra- i infratentoriálně. Následně bylo doporučeno MRI vyšetření mozku k vyloučení benigního astrocytomu mozkového kmene. Na MRI obrazech pořízených za 6 dní po CT vyšetření byla zaznamenána T2 hyperintenzní zóna okrouhlého tvaru vyplňující centrální partie pontu o průměru asi 2 cm, bez opacifikace po podání kontrastní látky, ve které byly patrny dva T2 relativně hypointenzní, vertikálně probíhající pruhy odpovídající zachovaným kortikospinálním traktům; ložisko bylo hyperintenzní i na FLAIR sekvencích. Nález byl uzavřen jako CPM. Na kontrolním MRI vyšetření za 6 týdnů byl nález stacionární. Na tenkých 2mm vrstvách byla shledána i atrofie corpora mamillaria svědčící pro diagnózu Wernickeho encefalopatie. Psychopatologie se v průběhu léčby postupně zlepšovala, nemocný byl lépe orientován, stále však přetrvávaly čerstvé mnestické výpadky paměti s konfabulacemi komplikujícími samostatnou existenci pacienta.
Kazuistika 3
42letý muž, chronický alkoholik, byl odeslán k akutnímu přijetí na psychiatrickou kliniku pro rozvoj deliriózního stavu. Při přijmu byl nemocný nepřesně orientován místem, časem a situací, chůze byla značně nejistá s titubacemi. V biochemickém nálezu se kombinovala hyponatremie (130 mmol/l) s hypokalemií (3,0) při normofosfatemii, dále byly zvýšené hladiny transamináz a bilirubinu. Hematologický nález byl s obrazem normocytární anemie. Během hospiatalizace byl pacient medikován Tiapridalem a Diazepamem, dále byla nasazena vitaminoterapie a zkorigována hladina minerálů. Během týdne byl stav nemocného stabilizován. Na MRI mozku provedené za 15 dní od normalizace minerálové dysbalance byla popsána věku neúměrná mozková atrofie akcentovaná v oblasti vermis cerebella a především zóna T2 zvýšeného signálu uložená v centrální části pontu o velikosti 8×7 mm, neexpandujícího charakteru; na T1 obraze bylo ložisko hypointenzní. Nález byl uzavřen jako CPM menšího rozsahu. Vzhledem k aktuálnímu zdravotnímu stavu byl nemocnému přiznán částečný invalidní důchod. Na kontrolním MRI vyšetření v odstupu 2 let progredovala difuzní mozková atrofie supra- i infratentoriálně, nález těžké atrofie vermis byl stacionární; centrálně v pontu byla zachycena reziduální gliová jizva velikosti 5 mm při regresi CPM.
Kazuistika 4
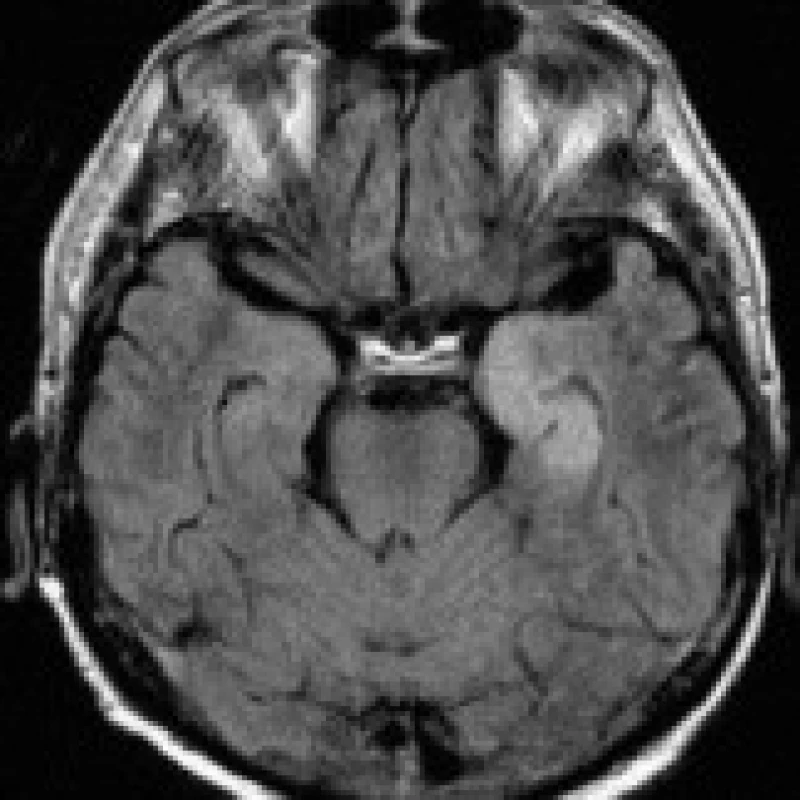
38letý muž, chronický alkoholik, byl přijat na psychiatrickou kliniku pro rozvoj závažného odvykacího stavu s deliriem, velmi těžkým kognitivním deficitem, dezorientací a zmateným chováním. Při přijetí byl pacient febrilní, byla nutná infuzní a antipyretická terapie. Deliriózní stav trval dva týdny a v průběhu léčby jen velmi pozvolna odezníval. V biochemickém nálezu byly zachyceny pouze zvýšené hladiny transamináz, hodnoty minerálů se pohybovaly v mezích normy. Hematologický nález byl s obrazem normocytární anémie. Na MRI mozku provedené za 3 týdny od přijetí byla shledána věku neodpovídající mozková atrofie difuzně supratentoriálně, méně i v zadní jámě lební, jednoznačným dominujícím patologickým nálezem byla však neexpandující, T2 hyperintenzní oblast o průměru 20 mm nacházející se v centrálním pontu, relativně šetřící průběh pyramidových drah (obr. 3a). Jednoznačně hyperintenzní byla i na DWI (obr. 3b), na T1 bylo ložisko mírně hypointenzní. Nález byl uzavřen jako CPM. Po propuštění byl pacient podroben dlouhodobé odvykací protialkoholické léčbě.

Kazuistika 5
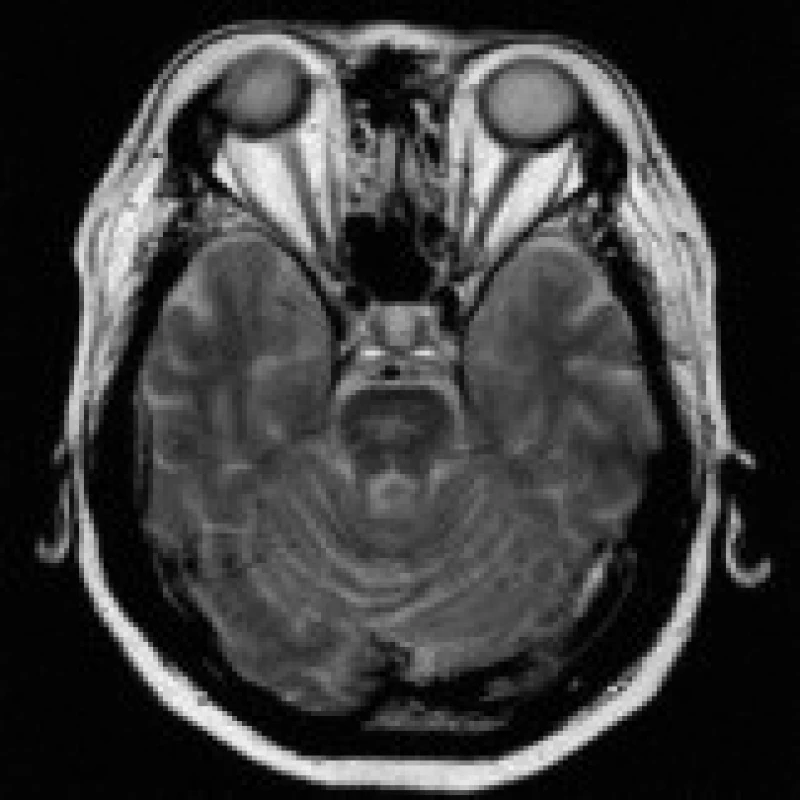
73letý muž byl vyšetřen na neurologické klinice pro amentní stav v. s. při hypohydrataci. V dříve provedeném (8 dní před tímto vyšetřením) laboratorním vyšetření byla zaznamenána hyperglykemie (7,3 mmol/l) a hraničně snížená hladina natria (132 mmol/l), ostatní minerály a hematologický obraz byly v mezích normy. V dnešním biochemickém nálezu byla patrna progrese hyponatremie (119 mmol/l). Na CT mozku byla zachycena pouze mírná periventrikulární atrofie a leukoaraióza, jiné ložiskové změny zaznamenány nebyly. Následující den dle rodiny stav dezorientace progredoval, pacient opakovaně zvracel a prodělal stav porušeného vědomí s generalizovanými křečemi končetin. Kvantitativní porucha vědomí na úrovni soporu až semikomatu dále přetrvávala, ložisková neurologická symptomatika shledána nebyla, v biochemickém nálezu byla zachycena další progrese hyponatremie (108 mmol/l). Následně došlo u nemocného k deviaci levého očního bulbu temporálně a byla doplněna MRI mozku. Ta odhalila ložisko v mediální části levého temporálního laloku velikosti 4×3 cm, hyperintenzní na T2 obrazech a FLAIR sekvencích (obr. 4), bez opacifikace po podání kontrastní látky a bez významnější hyperintenzity na DWI. Charakter nálezu v kontextu klinického a laboratorního obrazu jako příčinu favorizoval EPM meziálních temporálních struktur vlevo. S určitými výhradami byla suspektní i limbická nebo herpetická encefalitida, kterou však vyloučilo likvorologické vyšetření. Pacient byl postupně zkompenzován stran homeostázy včetně osmolarity a porušeného vědomí.
DISKUSE
Alkoholový odvykací stav se objevuje u osob s anamnézou dlouhodobého a intenzivního abúzu alkoholu. Může progredovat do závažného, někdy až život ohrožujícího odvykacího stavu s deliriem. Tento stav bývá komplikován hypoglykemií a poruchami rovnováhy elektrolytů s rizikem metabolického rozvratu, proto je nezbytné sledovat vnitřní prostředí, monitorovat vitální funkce a včas zahájit intenzivní léčbu [20]. Nejběžnější příčinu vzniku ODMS představují hypoosmolární stavy, především hyponatremie a zejména její překotná korekce. Proto se doporučuje relativně rychleji zvýšit natremii na hodnotu 120 mmol/l (rychlostí maximálně 2,5 mmol/l/h), další korekce již musí být mnohem pomalejší a opatrnější [21]. Nejen infuzní terapie, ale také např. substituce glukokortikoidy k úpravě hladiny natria při některých endokrinních chorobách předpokládá podání velmi malých dávek a průběžné monitorování jeho sérové koncentrace [10]. Další příčinou pak může být snížení osmolarity při hypoglykemii [7], ale na druhé straně mohou k ODMS vést i rychlé úpravy stavů hyperosmolárních (hypernatremie [22], hyperglykemie [14]) a také další poruchy minerálního hospodářství i při normonatremii a normálních hodnotách osmolarity [8]. Byly popsány případy rozvoje ODMS při hypokalemii [8,12], hypofosfatemii [15], azotemii či ketoacidóze [4] a také při otravě pesticidy.
Vlastní mechanizmus vzniku ODMS není doposud spolehlivě objasněn. V současnosti přijímaná teorie apoptózy předpokládá kaskádu reaktivních změn v buňce, které vedou až k jejímu zániku. Počátečním impulzem je nedostatek energie pro Na/K-ATPázu gliových buněk, což postihuje transport sodíko-draslíkovým kanálem a snižuje schopnost glie přizpůsobit se i drobným výkyvům hladiny osmolarity a regulovat vlastní objem tekutiny. To vede k jejímu hromadění uvnitř buňky a následné buněčné smrti [15]. Omezení difuze vody a zvětšení intracelulárního objemu vede v akutní fázi k již zmiňovanému poklesu hodnoty ADC (podobně jako u ischemie), naproti tomu při buněčné dehydrataci bývá ADC zvýšen (mozkové nádory, akutní diseminovaná encefalomyelitida – ADEM, roztroušená skleróza – RS) [14]. K nastartování vlastní apoptotické kaskády vede nárůst koncentrace jistých proapoptotických faktorů (Bax, Bak a DR3) a následná blokáda vstupu buňky do mitotické fáze buněčného cyklu. Citlivost oligodendroglie je navíc umocněna zvýšenou expresí specifických receptorů pro tyto faktory. Další buněčné elementy uplatňující se v patogenezi ODMS jsou mikroglie a astrocyty, které jsou aktivovány jako odpověď na destrukci myelinových pochev. Význam mikroglie spočívá především v odbourávání rozpadových produktů myelinu, reaktivní astrocytóza hraje důležitou roli při ochraně neuronů regulací osmolarity a elektrolytové dysbalance. Naproti tomu mohou však oba tyto buněčné typy uvolňovat cytotoxické působky, které se dále podílejí na destrukci oligodendroglie, v tomto případě ovšem bez ovlivnění buněčného cyklu. Nutno však podotknout, že tato teorie nevylučuje i možný podíl nekrózy v patogenezi tohoto onemocnění [23].
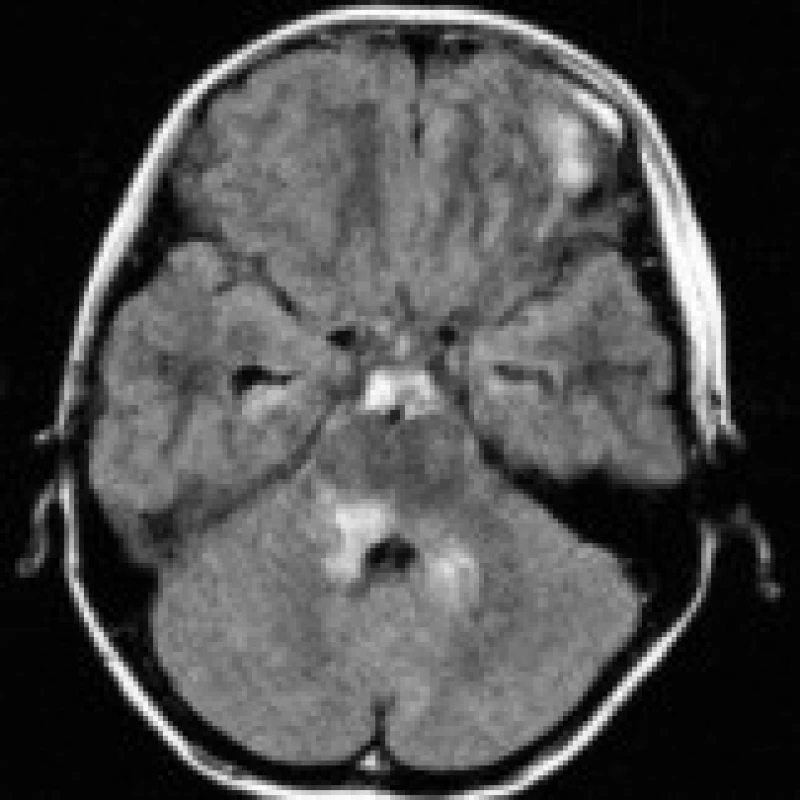
Existuje poměrně široká skupina onemocnění s obdobným nálezem na CT a MRI obrazech, které je nutno vzít v potaz v diferenciální diagnóze. Ložiska pontinní ischemie bývají asymetrická, běžně postihují centrální i periferní oblast pontu, nerespektují průběh pyramidových drah, často naopak respektují střední čáru (obr. 5). Z pontinních tumorů jsou nejčastější benigní astrocytomy (obr. 6), s nimiž se typicky setkáváme u dětských pacientů. Metabolické choroby (př. Morbus Wilson, Morbus Leigh) postihují častěji oblast bazálních ganglií, příp. mezencefala. Při zánětlivých infekčních (encefalitidy) a neinfekčních (RS) demyelinizacích se mohou ložiska nacházet prakticky kdekoli v mozku (event. míše) [4], pro RS jsou typické např. periventrikulární léze protáhlého tvaru. Při podezření na ADEM je velmi důležitý anamnestický údaj o prodělaném virovém onemocnění nebo vakcinaci. Syndrom zadní reverzibilní encefalopatie (posterior reversible encephalopathy syndrome – PRES) bývá spojen s hypertenzní nemocí, může se ovšem vyskytovat i u pacientů s normálními hodnotami krevního tlaku a elektrolytovou dysbalancí podobně jako ODMS. Na rozdíl od ODMS je však PRES obvykle plně reverzibilní, typická je parietookcipitální lokalizace lézí a vznik vazogenního edému, který vede k relativnímu poklesu signálu na DWI (obr. 7a, b, c) [24,25]. Meziální temporální skleróza postihuje oblast hipokampu (vzácněji i obou hipokampů). Objem T2 hyperintenzního hipokampu bývá redukován, někdy můžeme zaznamenat i atrofii celého temporálního laloku a rozšíření temporálního rohu postranní komory. Vystavení organizmu chemickým (cytostatika, imunosupresiva, narkotika) či fyzikálním (aktinoterapie) faktorům může vést ke vzniku multifokálních až splývajících ložisek nepravidelného tvaru. Mimo zhodnocení vlastního CT či MRI nálezu je podstatné vždy přihlédnout ke klinickému stavu pacienta, anamnestickým údajům, laboratorním nálezům a posoudit vývoj lézí v čase při opakovaných vyšetřeních [3].

Chronický etylizmus je nejčastější příčinou rozvoje ODMS, a to ve 39 % případů. Navíc ve 22 % případů následuje demyelinizace po překotné korekci hladiny natria [2]. Abúzus alkoholu představoval hlavní příčinu vzniku ODMS i u pacientů vyšetřených na našem pracovišti, a to celkem u 5 ze 7 nemocných. Zbývající 2 případy tohoto syndromu byly zaznamenány u 5letého děvčete s dlouhodobou hematogenní sepsí a u staršího muže s projevy dehydratace. Z 5 dostatečně zdokumentovaných případů byla u 3 z nich zaznamenána minerálová dysbalance. V prvním případě se kombinovala hyponatremie s hypokalemií, v dalším byla zachycena izolovaná hypokalemie a v posledním hyperglykemie a hraničně snížená hladina natria. U zbylých 2 pacientů se sérové hodnoty minerálů v době přijetí pohybovaly v mezích normy. U jednoho z nich byla při hematologickém vyšetření zachycena normocytární anémie (ta se ovšem vyskytovala i u 2 ze 3 výše uvedených pacientů s minerálním rozvratem), v případě hematogenní sepse byly výrazně zvýšeny zánětlivé markery. Úbytek elektrolytů se zvýšenými hodnotami jaterních enzymů (kazuistika 4) a bilirubinu (kazuistiky 2 a 3) jsou změny napovídající o chronickém abúzu alkoholu.
ZÁVĚR
Hlavní význam v detekci morfologických změn při ODMS má zobrazení pomocí MR. Zobrazovací diagnostická schémata by měla zahrnovat T2 vážené obrazy a FLAIR sekvence (neexpandující T2 hyperintenzní ložisko v pontu šetřící periferii, s relativně hypointenzními zónami odpovídajícími zachovaným pyramidovým drahám), event. skeny získané po aplikaci kontrastní látky (ložisko bez opacifikace či s prstenčitou opacifikací). Difuzně vážené obrazy (DWI) umožňují časnou diagnózu ODMS a se stanovením aparentního difuzního koeficientu (ADC) jsou schopné odlišit cytotoxický edém, který bývá u ODMS přítomen, od edému vazogenního. Neodliší však myelinolýzu od ischemie, neboť v obou případech je hodnota ADC snížena. Velký význam má rovněž znalost průběhu onemocnění, anamnestických údajů a laboratorních nálezů. Vyšetření MRI by měla být u sporných případů v odstupu času opakována. Lze tak vyloučit jiné příčiny poškození mozku, které mohou mít při MR vyšetření obdobný obraz.
Přijetí k recenzi: 29. 6. 2006
Přijetí do tisku: 16. 11. 2006
MUDr. M. Slanina
Radiologická klinika LF UK a FN Hradec Králové
Sokolská 581,
500 05 Hradec Králové
e-mail: slaninajicin@seznam.cz
Zdroje
1. Adams RD, Victor M, Mancall EL. Central pontine myelinolysis: a hitherto undescribed disease occuring in alcoholic and malnourished patients. AMA Arch Neurol Psychiatry 1959; 81: 154–72.
2. Lampl C, Yazdi K. Central pontine myelinolysis. Eur Neurol 2002; 47: 3–10.
3. Žižka J. Onemocnění bílé hmoty. In: Černoch Z et al. Neuroradiologie. Hradec Králové: Nucleus 2000: 383–414.
4. Osborn AG. Osmotic Demyelination Syndrome. In: Osborn AG et al. Diagnostic Imaging: Brain. 1st ed. Salt Lake City: Amirsys Inc 2004: 42–5.
5. Nusbaum AO, Fung KM, Atlas SW. White Matter Diseases and Inherited Metabolic Disorders. In: Atlas SW. Magnetic Resonance Imaging of the Brain and Spine. 3rd ed. Philaladelphia: Lippincott Williams & Wilkins 2002: 457–563.
6. Yu J, Zheng SS, Liang TB, Shen Y, Wang WL, Ke QH. Possible causes of central pontine myelinolysis after liver transplantation. World J Gastroenterol 2004; 10: 2540–3.
7. Kozáková S, Zamrazil V, Tomek A, Charvát J, Kvapil M. Centrální pontinní myelinolýza u diabetes mellitus 1. typu. Praha: GEUM: Kazuistiky v diabetologii 2003; 1: 28–30.
8. Shintani M, Yamashita M, Nakano A, Aotani D, Maeda K, Yamamoto T et al. Central pontine and extrapontine myelinolysis associated with type 2 diabetic patient with hypokalemia. Diabetes Res Clin Pract 2005; 68: 75–80.
9. Moritani T, Ekholm S, Westesson PL, Zhong J. Toxic and Metabolic Disease. In: Moritani T, Ekholm S, Westesson PL. Diffusion Weighted MR Imaging of the Brain. Berlin, Heidelberg: Springer-Verlag 2003: 119–30.
10. Lasheen I, Doi SA, Al-Shoumer KA. Glucocorticoid replacement in panhypopituitarism complicated by myelinolysis. Med Princ Pract 2005; 14: 115–7.
11. Santinelli R, Tolone C, D'Avanzo A, del Giudice EM, Perrone L, D'Avanzo M. Pontine myelinolysis in a child with carbamate poisoning. Clin Toxicol (Phila) 2006; 44: 327–8.
12. Sugimoto T, Murata T, Omori M, Wada Y. Central pontine myelinolysis associated with hypokalaemia in anorexia nervosa. J Neurol Neurosurg Psychiatry 2003; 74: 353–5.
13. Grossman RI, Yousem DM. White Matter Diseases. In: Grossman RI, Yousem DM. The Requisites: Neuroradiology. St. Louis: Mosby-Year Book, Inc 1994: 201–24.
14. Cramer SC, Stegbauer KC, Schneider A, Mukai J, Maravilla KR. Decreased diffusion in central pontine myelinolysis. AJNR Am J Neuroradiol 2001; 22: 1476–9.
15. Michell AW, Burn DJ, Reading PJ. Central pontine myelinolysis temporally related to hypophosphataemia. J Neurol Neurosurg Psychiatry 2003; 74: 820.
16. Chua GC, Sitoh YY, Lim CC, Chua HC, Ng PY. MRI findings in osmotic myelinolysis. Clin Radiol 2002; 57: 800–6.
17. Kumar SR, Mone AP, Gray LC, Troost BT. Central pontine myelinolysis: delayed changes on neuroimaging. J Neuroimaging 2000; 10: 169–72.
18. Bartoš A, Rusina R. Centrální pontinní myelinolýza v klinicko-neuroanatomických souvislostech. Česk Slov Neurol N 2000; 63: 422–5.
19. Chu K, Kang DW, Ko SB, Kim M. Diffusion-weighted MR findings of central pontine and extrapontine myelinolysis. Acta Neurol Scand 2001; 104: 385–8.
20. Popov P. Návykové poruchy. In: Raboch J, Zvolský P et al. Psychiatrie. Praha: Galén 2001: 182–226.
21. Horáček J, Zadák Z, Živný P. Metabolismus. In: Bureš J, Horáček J. Základy vnitřního lékařství. Praha: Galén 2003: 611–54.
22. Achiwa S, Ando K, Ishikura R, Takada Y, Takahashi Y. A case of extrapontine myelinolysis precipitated by correction of a hyperosmolar state. Nippon Igaku Hoshasen Gakkai Zasshi 2004; 64: 310–2.
23. DeLuca GC, Nagy Z, Esiri MM, Davey P. Evidence for a role for apoptosis in central pontine myelinolysis. Acta Neuropathol (Berl) 2002; 103: 590–8.
24. Hinchey J, Chaves C, Appignani B, Breen J, Pao L, Wang A et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med 1996; 334: 494–500.
25. Keswani SC. Central pontine myelinolysis associated with hypokalaemia in anorexia nervosa. J Neurol Neurosurg Psychiatry 2004; 75: 663.
Štítky
Detská neurológia Neurochirurgia NeurológiaČlánok vyšiel v časopise
Česká a slovenská neurologie a neurochirurgie

2007 Číslo 3
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
Najčítanejšie v tomto čísle
- Chiariho malformace – vlastní zkušenosti
- Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
- MRI zobrazení mozku u pacientů s myotonickou dystrofií DM 1
- Osteoplastická dekompresivní kraniotomie





