Kognitívne evokované potenciály – vlna P300 u pacientov so sclerosis multiplex: vzťah k forme ochorenia, somatickému postihnutiu a kvalite života
Cognitive Evoked Potentials – the P300 Wave in Patients with Sclerosis Multiplex: Relation to the Form of the Disease, Somatic Affection and Quality of Life
Introduction:
Cognitive function disorders are detected in approximately 65 % of multiple sclerosis (MS) patients. Auditory cognitive evoked potentials (ERP), especially the P300 wave, are an objective electrophysiological indicator of cognitive functions. The objective of the study was to detect cognitive disorders in patients with MS with the use of auditive cognitive evoked potentials, and to compare the disorders with patient demographic and clinical data.
Patient group and method:
The authors of the study examined 110 patients with a definitive MS diagnosis (60 with relapsing/remittent, 41 with secondary progressive and 9 with primary progressive form of MS), and 130 persons from a control group. ERP results were compared with the degree of functional disability measured on the Kurtzke EDSS (Expanded Disability Status Scale), with the degree of cognitive disorders in psychometric tests, the degree of pathological fatigue, depression, and with the patients’ quality of life.
Outcome:
The latencies of the N200 and P300 waves were pathologically prolonged in 69 % of cases as compared with the controls; a higher value of the P300 wave amplitude was detected. Prolonged P300 wave latency highly correlated with cognitive disorders in the psychomotor test (Grassi test), the EDSS score and the quality of life. Low correlations were detected with the patient's age, duration of the disease, degree of EDSS, and the Mini-Mental-State-Examination and IQ scores (evaluated by Raven's progressive matrices). The cognitive deficit did not correlate with the degree of depression in the patients. Patients with progressive forms (primarily and secondarily progressive) showed a higher cognitive deficit as compared with the relapse/remittent form of the disease.
Conclusion:
The rate of incidence of cognitive deficit in our patient group was 69 %. It was related to pathological fatigue and had a negative impact on patients' quality of life. The deficit was more marked in the progressive forms of MS and grew in the course of the disease. Auditive cognitive evoked potentials, the P300 wave, are a suitable method of examining and monitoring cognitive disorders in multiple sclerosis.
Key words:
multiple sclerosis – cognitive disorders – cognitive evoked potentials – P300 wave – quality of life
Autori:
J. Szilasiová; Z. Novosadová; Z. Gdovinová
Pôsobisko autorov:
Neurologická klinika LF UPJŠ a FN L. Pasteura, Košice, Slovenská republika
Vyšlo v časopise:
Cesk Slov Neurol N 2007; 70/103(6): 665-673
Kategória:
Původní práce
Súhrn
Úvod:
Poruchy kognitívnych funkcií sa vyskytujú približne u 65 % patientov so sclerosis multiplex (SM). Sluchové kognitívne evokované potenciály (ERP), hlavne vlna P300, sú objektívnym elektrofyziologickým ukazovateľom kognitívnych funkcií. Cieľom práce bolo zistiť výskyt kognitívnych porúch u pacientov so SM pomocou sluchových kognitívnych evokovaných potenciálov a porovnať ich s demografickými a klinickými dátami chorých.
Súbor pacientov a metodika:
Autori vyšetrili 110 pacientov s definitívnou diagnózou SM (60 s relapso-remitujúcou, 41 so sekundárne progresívnou a 9 s primárne progresívnou formou SM) a 130 osôb kontrolnej skupiny. Výsledky ERP boli porovnané so stupňom funkčného zneschopnenia vyjadreným pomocou Kurtzkého stupnice EDSS (Expanded Disability Status Scale), stupňom kognitívnych porúch v psychometrických testoch, rozsahom chorobnej únavy, depresie a kvalitou života chorých.
Výsledky:
Latencie vlny N200 a P300 boli patologicky predĺžené v 69 % prípadov pacientov v porovnaní s kontrolami; bola nájdená zvýšená hodnota amplitúdy vlny P300. Predĺženie latencie vlny P300 vysoko korelovalo s kognitívnymi poruchami v psychometrickom teste (Grassiho test organicity), skóre v stupnici únavy a kvality života. Nízke korelácie sa zistili vo vzťahu k veku pacienta, trvaniu ochorenia, stupňu EDSS, skóre v Mini-Mental-State-Examination a IQ (hodnotené testom Ravenových progresívnych matríc). Kognitívny deficit nekoreloval so stupňom depresie chorých. Pacienti s progresívnymi formami (primárne a sekundárne progresívna) vykazovali výraznejší kognitívny deficit v porovnaní s relapso–remitujúcou formou ochorenia.
Záver:
Kognitívny deficit sa vyskytuje v našom súbore u 69 % pacientov. Súvisí s chorobnou únavou a negatívne ovplyvňuje kvalitu života chorých. Deficit je výraznejší u progresívnych foriem SM a v priebehu ochorenia narastá. Sluchové kognitívne evokované potenciály, vlna P300, sú vhodnou metódou vyšetrenia a monitoringu kognitívnych porúch u sclerosis multiplex.
Klíčová slova:
sclerosis multiplex – kognitívne poruchy – kognitívne evokované potenciály – vlna P300 – kvalita života
ÚVOD
45 až 65 % pacientov so sclerosis multiplex (SM) má určitý stupeň kognitívneho deficitu [1]. Tento deficit sa zistí v 5 % už na začiatku ochorenia a v pokročilých štádiách postihuje 70 % pacientov. Porucha kognície u SM nie je globálna, ide skôr o selektívny deficit určitých funkcií [2]. Príčinou je rôzny stupeň kortikálnej deaferentácie ako následok poškodenia bielej hmoty [2,3,5].
Málo sa vie o dynamike kognitívnych porúch v priebehu ochorenia, ich zastúpení v jednotlivých klinických formách choroby, vzťahu k neurologickému deficitu a vplyve na sociálne aktivity chorých. V tejto oblasti boli publikované pomerne nejednotné a kontroverzné názory.
Cieľom práce bolo zistiť výskyt a rozsah kognitívnych porúch v súbore pacientov so SM metódou sluchových kognitívnych evokovaných potenciálov a porovnať ich s výsledkami v psychometrických testoch. Následne zhodnotiť vzťah medzi kognitívnou dysfunkciou a parametrami: vek pacientov, trvanie ochorenia, úroveň vzdelania, klinická forma, stupeň funkčnej nespôsobilosti vyjadrený pomocou Kurtzkého stupnice EDSS, chorobná únava a kvalita života.
SÚBOR A METODIKA
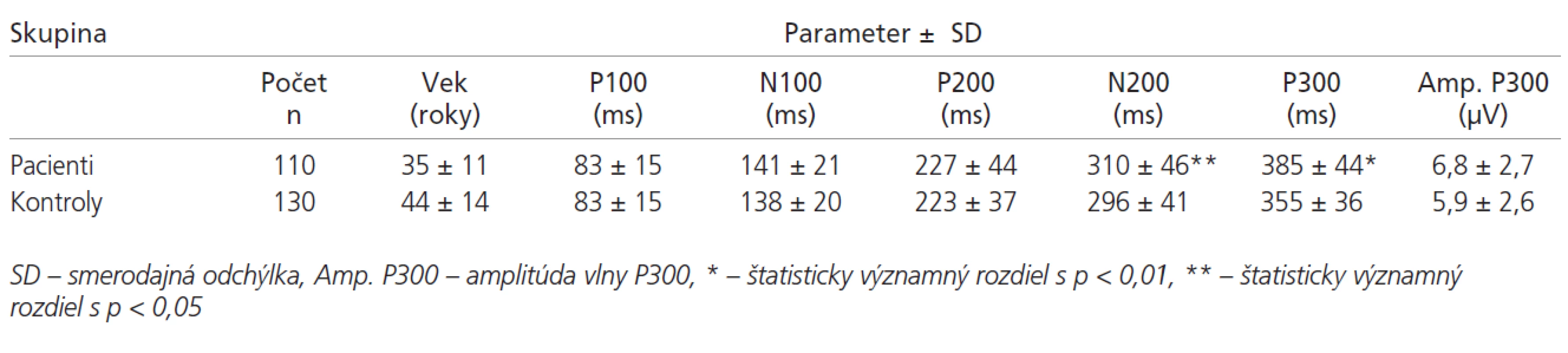
Vyšetrili sme 110 pacientov (74 žien a 36 mužov), s definitívnou diagnózou sclerosis multiplex podľa Poserových kritérií [4]. V tomto súbore bolo 74 žien (67 %) a 36 mužov (33 %). Priemerný vek pacientov bol 35,5 roka (15-62). Všetci boli hospitalizovaní a liečení na Neurologickej klinike LF UPJŠ a FNLP v Košiciach, v období rokov 2001-2004. Priemerná doba trvania ochorenia bola 7±6,6 rokov (2 mesiace - 30 rokov). Základné vzdelanie malo 10 (9 %), stredoškolské 72 (66 %) a vysokoškolské 28 pacientov (25 %). Priemerná úroveň dosiahnutého vzdelania bola 12,8±2,7 rokov (6-20). Jednotlivé klinické formy ochorenia boli zastúpené nasledovne: relapso-remitujúca forma 60 (55 %), sekundárne progresívna forma 41 (37 %) a primárne progresívna forma 9 pacientov (8 %). Stupeň funkčného zneschopnenia vyjadrený pomocou stupnice EDSS bol v priemere 3,3±1,9 (0,5- 8,0).
Kontrolnú skupinu tvorilo 130 osôb (63 mužov, 67 žien) s priemerným vekom 44±14 rokov (17-75). Základné vzdelanie malo 16, stredoškolské 75 a vysokoškolské 39 osôb. Priemerná doba vzdelania bola 13,2±2,9 rokov. 80 osôb malo diagnózu diskogénneho radikulárneho syndrómu, 2 osoby tenznú bolesť hlavy, 1 pacient esenciálny tremor, 1 neurogénnu tetániu, 1 Bellovu obrnu a 1 pacient myasteniu gravis. Zvyšných 44 osôb boli zdraví dobrovoľníci - študenti lekárskej fakulty a personál neurologickej kliniky.
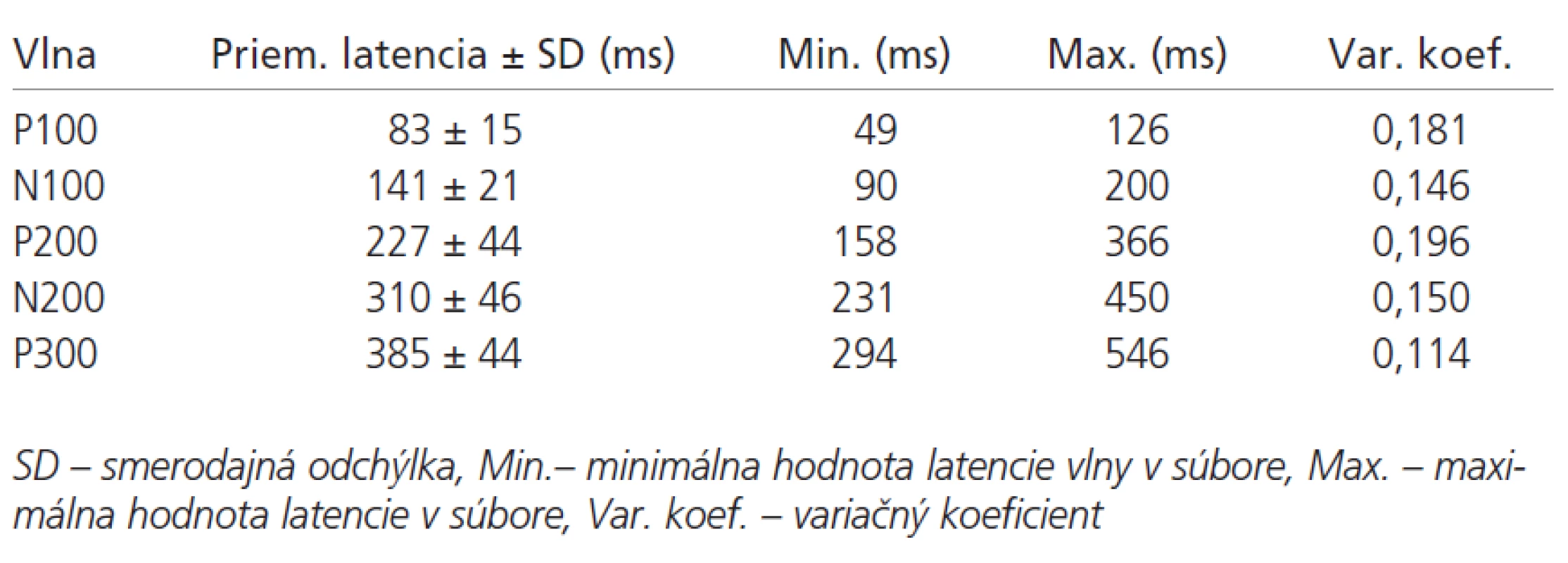
Sluchové kognitívne evokované potenciály (Event-related evoked potentials- ERP) boli vyšetrované na prístroji Multiliner Toennies firmy JAEGER, s voliteľným stimulátorom tónov. Podmienky snímania kognitívnych potenciálov boli u všetkých vyšetrovaných osôb štandardné. Osoby boli vyšetrené medzi 10. a 13. hodinou, v ležiacej polohe, so zatvorenými očami. Každej osobe bola vysvetlená úloha, potichu počítať vysoké, nepravidelne sa vyskytujúce tóny a na konci série oznámiť ich počet vyšetrujúcemu. Vyšetrované osoby mali na ušiach slúchatká, ktorými počuli binaurálne sekvenciu tónov. Po zmeraní odporov, nasledovala sekvencia stimulov, ktoré generoval zvukový stimulátor. Prestimulačný interval bol 100 ms a celková časová základňa 750 ms. Trvanie podnetu bolo 50 ms, vzostup a pokles zvukového stimulu trval 10 ms. Interstimulačný interval bol 1,4 s. Registrované hodnoty boli spriemernené. Vyšetrenie sa dvakrát opakovalo, každé obsahovalo sekvenciu 200 tónov so zastúpením nepravidelných a pravidelných stimulov v pomere 1:4. Registračná elektróda bola umiestnená v bode Pz podľa medzinárodného systému 10-20, referenčná na ušnom laloku (A1) a uzemňovacia na čele (Fz). Impedancia elektród nepresahovala 5 kOhm. Nastavenie filtrov bolo v rozsahu 5-40 Hz. Pásková uzemňujúca elektróda bola umiestnená na predlaktí vpravo. Evokované potenciály boli spriemernené oddelene cestou 2 snímacích kanálov. Jeden kanál registroval spracovanie nepravidelného tónu s frekvenciou 2000 Hz. Druhý kanál registroval spracovanie tzv. non-target, pravidelného tónu s frekvenciou 1000 Hz. Sekvencia tónov bola automatická s hlasitosťou 65 dB. Na krivkách sme hodnotili latencie a amplitúdy vĺn P100, N100, P200, N200 a P300.
Normatívne dáta sluchových ERP boli stanovené po vyšetrení štandardnou metódou v kontrolnom súbore zdravých dobrovoľníkov, s primeraným zastúpením vekových kategórií, pohlaví a dosiahnutého vzdelania (základné, stredoškolské, vysokoškolské). Úroveň dosiahnutého vzdelania sme hodnotili aritmetickým súčtom rokov strávených vzdelávaním na rôznych typoch škôl. Kontrolnú skupinu tvorilo 130 zdravých dobrovoľníkov bez kognitívneho deficitu.
Klinický neurologický nález bol kvantifikovaný pomocou Kurtzkého rozšírenej stupnice invalidity u sclerosis multiplex – EDSS [5]. Trvanie ochorenia sme hodnotli ako dobu od objavenia sa prvých príznakov SM do dátumu vyšetrenia ERP. Podľa klinického priebehu boli pacienti zaradení do podskupín: relapso-remitujúca (RRSM), sekundárne progresívna (SPSM) a primárne progresívna (PPSM) forma.
Úroveň kognitívnej výkonnosti sme zisťovali pomocou - MMSE (Mini Mental State Examination), Ravenových progresívnych matríc (z výsledku Ravenovej skúšky možno odhadnúť pomocou prevodných tabuliek inteligenčný kvocient- IQ), Grassiho testu organicity a Benderovej vizuálne - motorického Gestalt testu [6-12].
Na zistenie prítomnosti a závažnosti depresie sme použili Zungovu samoposudzovaciu stupnicu depresie (Zung´s Self-Rating Depression Scale- SDS) [13,14]. Prítomnosť a stupeň chorobnej únavy sme stanovili pomocou stupnice Fatigue severity scale (FSS) [15-17]. Kvalitu života, obmedzenie denných aktivít chorých pre ich somatické i mentálne poruchy, sme zisťovali stupnicou podľa Karnofského (KPSS-Karnofsky Performance Status Scale) a Groningenskou mierkou obmedzenia aktivity (GARS-Groningen Activity Restriction Scale) [18-20].
V porovnávacích analýzach a hľadaní korelačných vzťahov sme použili metódu regresnej korelačnej analýzy. Na overenie predmetnej hypotézy bol použitý test zhody. Hypotéza rovnosti stredných hodnôt medzi súborom chorých a kontrolným bola overovaná nepárovým T testom. Tam, kde nebol splnený predpoklad normality rozloženia sme použili na testovanie hypotézy rovnosti stredných hodnôt Mann-Whitneyov neparametrický test.
VÝSLEDKY
V grafe 1 je znázornená lineárna závislosť medzi vekom a latenciou vlny P300 v súbore kontrol r = 0,75 (p < 0,01). Medzi latenciou vlny P300 a vekom sme zistili matematický vzťah: Latencia P300 = 1,86 x vek + 274,9. Medzi vekom a amplitúdou vlny P300 sa nenašiel významný korelačný vzťah (r = -0,09); podobne ani medzi latenciou vlny P300 a jej amplitúdou (r = -0,043).

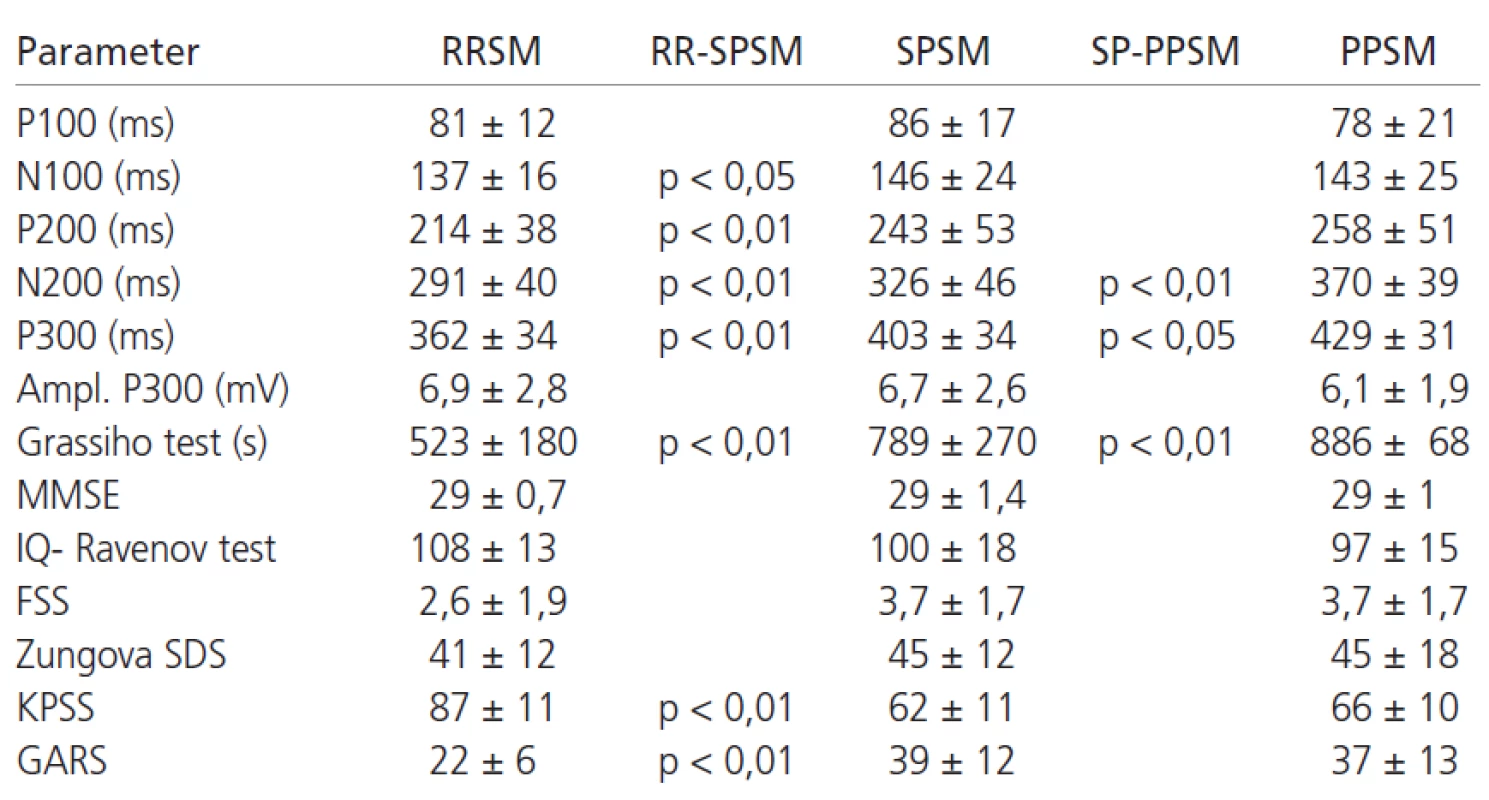
V tab. 1 sú uvedené hodnoty latencií vlny P100-P300 v súbore pacientov. Základné štatistické parametre ERP pacientov a kontrol sú uvedené v tab. 2. Latencie vlny P300 sú v súbore pacientov v porovnaní s kontrolami abnormálne predĺžené v 69 % prípadov (p < 0,01). Latencia vlny N200 bola v súbore chorých oproti kontrolám tiež významne predĺžená (p < 0,05). V hodnotách latencií vlny P100, N100 a P200 neboli medzi súborom kontrol a pacientov nájdené signifikantné rozdiely (graf 2). Amplitúda vlny P300 bola v súbore pacientov oproti kontrolám vyššia (p < 0,01).

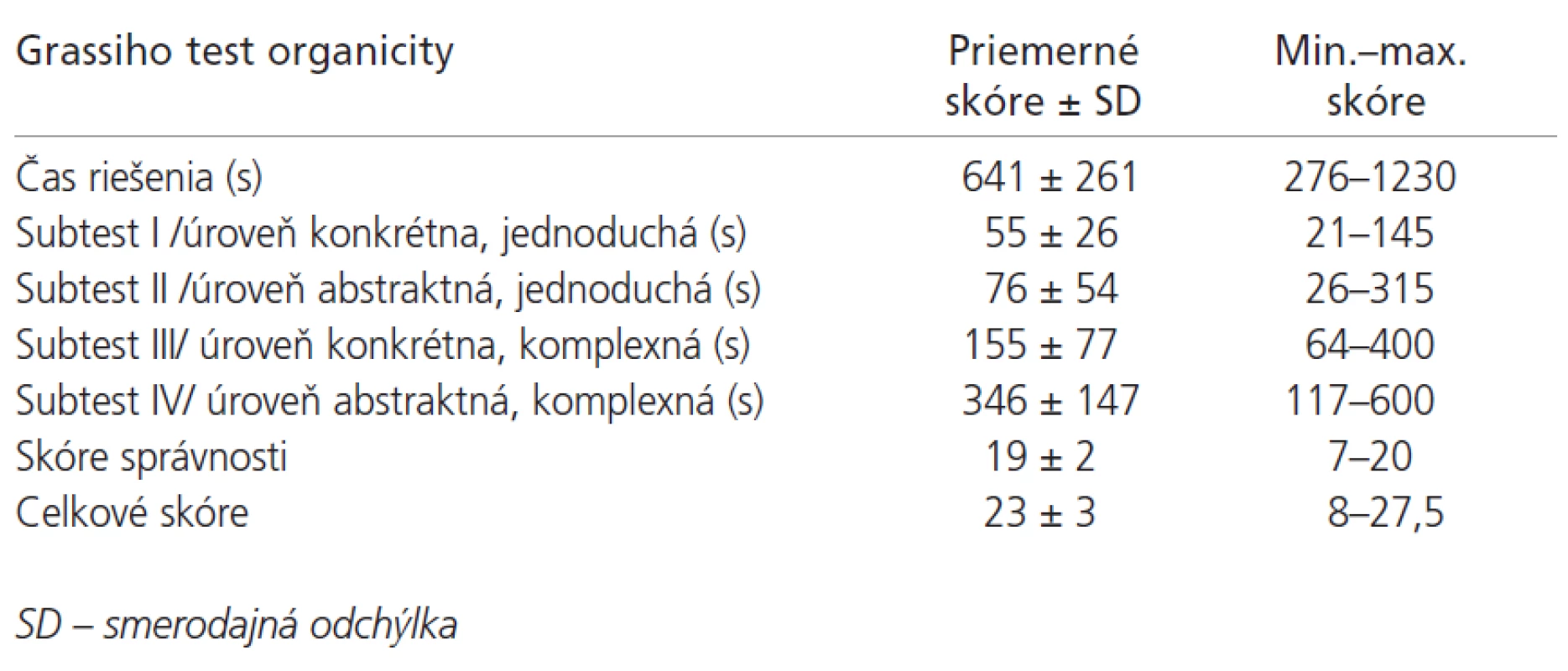
Priemerná hodnota výsledného skóre MMSE bola 29±1 bodov (min. 25, max. 30 bodov) (n = 110). Žiaden pacient nedosiahol kritickú hodnotu 24 a menej bodov, zodpovedajúcu demencii ľahkého stupňa. Vyšetrenie intelektu pomocou Ravenových progresívnych matríc (n = 110) s nasledovnými výsledkami: priemerný čas riešenia testu bol 42 ±1 6 minút (min. 15, max. 90 minút), priemerné hrubé skóre 45± 9 bodov (min. 19, max. 59 bodov), priemerné IQ 105 ± 16 (min. 67, max. 132). Výsledky Grassiho testu organicity (n = 108) sú uvedené v tab. 3. Celkové skóre v rozsahu 0-16 bodov (ťažko deteriorovaný intelekt) mali 3 pacienti (2,8 %), v rozsahu 16-20 bodov (stredná deteriorácia intelektu) 4 pacienti (3,7 %) a v rozsahu 20 a viac bodov (bez deteriorácie intelektu) 101 pacientov (93,5 %). Benderovej vizuálne-motorický Gestalt test (n = 67): 17 (25 %) osôb malo normálny, 31 (46 %) hranične abnormálny a 19 (29 %) vykazovalo abnormálny výsledok. V Zungovej samoposudzovacej stupnici depresie (n = 99) bolo priemerné skóre 43±12 (min. 28, max. 70). Priemerné skóre chorobnej únavy (n = 101) bolo 3,2 ± 1,9 (min. 0, max. 6,5). V hodnotení kvality života pacientov pomocou stupnice KPSS (n = 104) boli priemerné hodnoty 76±16 bodov (min. 40, max. 100 bodov). Priemerná hodnota výsledného skóre v GARS (n = 104) bola 30 ± 13 bodov (min. 18, max. 65 bodov).
Porovnaním súboru kontrol a pacientov sa nezistil významný rozdiel v úrovni dosiahnutého vzdelania. Medzi latenciou vlny P300 a úrovňou dosiahnutého vzdelania sa potvrdil lineárny vzťah nepriamej závislosti (p< 0,01) s r = -0,57. Vzdelanie nemalo vplyv na amplitúdu vlny P300 (r = -0,03).
Pacienti s progresívnymi (PPSM, SPSM) formami ochorenia vykazovali väčšie abnormality vlny P300 v porovnaní s RRSM (graf 3). Na rozdiel od kontrol, u pacientov nebola nájdená významná korelácia medzi latenciou ERP a vzrastajúcim vekom, podobne ani medzi klesajúcou amplitúdou vlny P300 a vekom. Medzi latenciou vlny P300 a úrovňou dosiahnutého vzdelania nebol významný korelačný vzťah; podobne ani medzi vzdelaním a amplitúdou vlny P300.

19 pacientov malo trvanie ochorenia menej ako 1 rok. V tejto podskupine bola abnormálne predĺžená latencia vlny P300 u 10 (53 %) chorých (p < 0,01). V hodnotách latencií vlny P100, N100, P200, N200 neboli v porovnaní s kontrolami významné rozdiely. 58 pacientov malo trvanie ochorenia do 5 rokov a abnormálne predĺženú latenciu vlny P300 v 34 (59 %) prípadoch (p < 0,01). Amplitúda vlny P300 bola v porovnaní s kontrolami vyššia (p < 0,05). 88 pacientov malo trvanie ochorenia menej ako 10 rokov. V tejto podskupine bola abnormálne predĺžená latencia vlny P300 v 41 prípadoch (47 %) a amplitúda vlny P300 bola tiež signifikantne vyššia (p < 0,01).
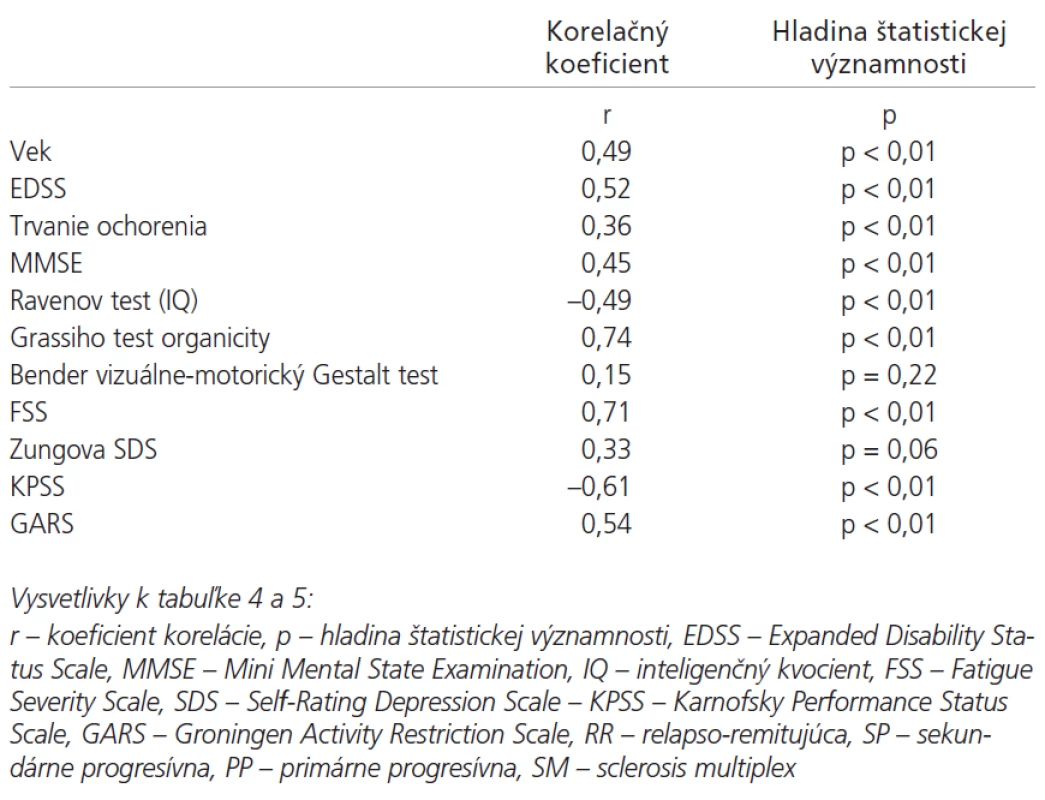
Lineárny vzťah na hladine štatistickej významnosti p < 0,01 sa potvrdil medzi latenciou vlny P300 a parametrami pacientov: vek, EDSS, trvanie ochorenia, MMSE, IQ (Ravenov test), Grassiho test organicity (graf 4), stupeň chorobnej únavy (graf 5), KPSS (graf 6) a GARS. Vzťahy medzi latenciou vlny P300 a Benderovej vizuálne-motorickým Gestalt testom ako aj Zungovou stupnicou depresie nedosiahli významné korelácie. Medzi amplitúdou vlny P300 a EDSS nebola zistená významná korelácia. Medzi skóre v FSS a stupňom depresie sme našli stredne vysokú koreláciu. Vysoký korelačný koeficient sme zistili medzi latenciou vlny P300 a skóre v Grassiho teste organicity (r = 0,74); najvyšší koeficient korelácie sa potvrdil medzi latenciou vlny P300 a subtestom II a IV Grassiho testu, ktoré sa vyznačujú najvyššími nárokmi na využitie schopnosti abstrakcie a vyvodzovania záverov (tab. 4). V tab. 5 je prehľad výsledkov u jednotlivých foriem SM. Pre nutnú stručnosť boli uvedené len najdôležitejšie nálezy, rozsiahle tabuľky korelácií sú pre záujemcov k dispozícii u autorov.



DISKUSIA
Cieľom práce bolo posúdiť výskyt a rozsah kognitívneho deficitu u pacientov so sclerosis multiplex metódou sluchových ERP a psychometrických testov, a porovnať výsledky s ďalšími sledovanými parametrami chorých. Najpodstatnejším zistením je, že kognitívny deficit sa vyskytuje až u 69 % pacientov so SM, a výsledky sluchových kognitívnych evokovaných potenciálov vysoko korelujú s nálezmi v psychometrických testoch. Sluchové ERP predstavujú užitočnú a rýchlu metódu na určenie rozsahu alterácie kognitívnych funkcií, obzvlášť pozornosti, pracovnej pamäti a schopnosti abstrakcie. Na rozdiel od časovo náročných psychometrických testov, umožňuje vyšetrenie ERP rýchlejšie kvantifikovať stupeň abnormality a eliminuje prípadný vplyv motorického a zrakového postihnutia na výsledok testovania.
Údaje o výskyte kognitívnych porúch u sclerosis multiplex sú značne rozdielne a závisia od použitej metódy výskumu a súborov chorých. Porucha kognitívnych funkcií je v priamom vzťahu k rozsahu poškodenia bielej hmoty mozgu [1, 21-25]. Podľa literárnych údajov sa u 56-65 % pacientov so SM zisťujú abnormality vlny P300 v zmysle predĺženia latencie, poklesu amplitúdy, alebo zmeny tvaru vlny [3,28,29]. V našej práci sme zmeny tvaru vlny nehodnotili. V súbore chorých sme zistili významné predĺženie latencie vlny P300 v porovnaní s kontrolami až v 69 % prípadov. Latencia vlny N200, ktorá je súčasťou kognitívneho komplexu (N200-P300) bola oproti kontrolám tiež predĺžená. Predĺženie latencie vlny P300 sa pripisuje hlavne spomaleniu vedenia nervového vzruchu bielou hmotou mozgu a považuje sa za index kortikálnej deaferentácie [30,31].
Pri výbere psychometrických testov na stanovenie kognitívnej výkonnosti sme brali do úvahy časový faktor, nakoľko bolo potrebné realizovať všetky testy v krátkom časovom intervale s vyšetrením ERP. Priemerný IQ celej skupiny pacientov bol v medziach normy. Z vysokej korelácie medzi latenciou vlny P300 a skóre v Grassiho teste organicity v subtestoch náročných na analýzu, syntézu a abstrakciu usudzujeme, že práve tieto schopnosti sú spomedzi kognitívnych funkcií u SM najviac postihnuté. Môžeme potvrdiť, že ERP našich pacientov s progresívnymi formami v porovnaní s RRSM boli výrazne horšie. Naše nálezy podobne ako aj iné práce potvrdzujú, že predlženie latencie vlny P300 zodpovedá alterácii kognitívnych funkcií meraným pomocou špecifických neuropsychologických testov [32,33].
Nízky korelačný vzťah medzi latenciou vlny P300 a výsledkom BGT ukazuje, že metóda ERP je zrejme náročnejšia na pozornosť, schopnosť triedenia informácií a pamäť, a menej vyžaduje zapojenie vizuálne-priestorových schopností. Naši pacienti nevykazovali výrazne patologické hodnoty v správnosti riešenia konkrétnych úloh a v zhode s nálezmi iných autorov, sme v našom súbore nezistili závažnejší stupeň mentálnej alebo intelektovej deteriorácie. Výrazne abnormálne výsledky boli v testoch s meraním času riešenia určitej úlohy (Grassiho test organicity). Práve tieto nálezy vysoko korelujú s abnormitami latencie vlny P300, ktorá v podstate tiež odráža časový faktor vedenia impulzu nervovými dráhami mozgu a jeho následnej analýzy sivou hmotou pri spracovaní zadanej úlohy. Spomalenie rýchlosti informačných procesov pravdepodobne ovplyvňuje aberantný spôsob kortikálnej aktivácie - následok kompenzačných mechanizmov s uplatnením neuronálnej plasticity [34-38].
Zhodne s literárnymi údajmi, ani v našom súbore pacientov nebol významný vzťah medzi kognitívnym deficitom a dĺžkou ochorenia, ani vekom pacienta [39-41]. Z časového aspektu choroby neprebieha poškodenie bielej hmoty mozgu kontinuálne proporcionálne, ale vplyvom mnohých faktorov nepravidelne. Variabilita výskytu a závažnosti kognitívnych porúch zodpovedá individuálnej variabilite choroby. Môžeme potvrdiť, že u sclerosis multiplex je latencia vlny P300 nezávislá od narastajúceho veku a patologické predĺženie latencie P300 vplyv veku prekrýva.
Prekvapením bolo zistenie, že viac ako polovica pacientov (53 %) mala už v priebehu prvého roku ochorenia zachytené patologické nálezy latencie vlny P300 a po desiatich rokoch ochorenia sa vyskytuje kognitívny deficit tiež približne u polovice pacientov. Avšak v celom súbore chorých je predĺženie latencie vlny P300 prítomné u viac ako dvoch tretín prípadov. Z toho usudzujeme, že po 10 rokoch trvania ochorenia pravdepodobne narastá kognitívny deficit výraznejšie, následkom trvalej kumulácie ložísk a vyčerpávania mechanizmov neuronálnej plasticity. Tento nález pravdepodobne súvisí so známym vývojom ochorenia. Vieme, že po 7-10 rokoch ochorenia dochádza u väčšiny chorých s RR formou k prechodu do sekundárnej progresie. V našej podskupine pacientov so sekundárne progresívnou formou sme zistili vyšší výskyt abnormalít vlny P300 v porovnaní s RR formou. Progresiou ochorenia dochádza teda napriek liečbe i k progresii kognitívnych porúch.
Stredne vysokú koreláciu medzi latenciou vlny P300 a EDSS možno vysvetliť známym nedostatkom EDSS stupnice, ktorá poskytuje malý priestor na kvantifikáciu kognitívnych porúch. Prekvapivý bol vysoký stupeň korelácie medzi stupňom únavy a latenciou vlny P300. Ak chápeme fenomén patologickej únavy u SM ako následok interakcie zápalových cytokínov a neurotransmiterov nielen v CNS, ale aj na neuromuskulárnom prenose, potom je únava logickým sprievodným javom ochorenia a súvisí aj so spomalením informačných procesov. Faktor únavy nesúvisel s depresiou, čo potvrdzujú aj nálezy iných autorov. Rovnako nemala depresia vplyv na kognitívne poruchy našich pacientov. Podobné závery priniesli štúdie hľadajúce vzťahy medzi zmenami kognitívnych funkcií a emočnými poruchami u SM [16, 42-47].
Nedostatkom našej práce bolo, že sme z časových dôvodov nepodrobili kontrolnú skupinu všetkým psychometrickým testom, iba vyšetreniu sluchových ERP. V jednotlivých psychometrických testoch sme porovnávali výsledky našich pacientov s odporúčaným normatívnym rozpätím v zdravej populácii s vekovou korekciou.
Výsledky hodnotení kvality života potvrdili náš predpoklad, že kognitívny deficit negatívne ovplyvňuje kvalitu života chorých a limituje denné aktivity v rovnakej miere ako somatické postihnutie. Z našich výsledkov vyplýva, že sluchové kognitívne evokované potenciály, vlna P300, by mali byť brané do úvahy pri komplexnom posudzovaní stupňa dizability i pracovnej schopnosti chorých so sclerosis multiplex. Početné klinické štúdie zaoberajúce sa kvalitou života zdôrazňujú negatívny dopad kognitívnych porúch na pracovné a sociálne aktivity a označujú ich za závažný faktor limitujúci kvalitu života pacienta s SM [48,49].
Přijato k recenzi: 6. 12. 2007
Přijato do tisku: 14. 5. 2007
MUDr. Jarmila Szilasiová, PhD.
Neurologická klinika, LF UPJŠ a FN L. Pasteura
Trieda SNP 1
040 11 Košice
Slovenská republika
E-mail: szilasj@lf.upjs.sk
Zdroje
1. Havrdová E, Bojar M, Čechová Z, Doležil D, Fraňková V, Marečková H a kol. Neuroimunologie. Praha: Maxdorf 2001.
2. LaRocca NG. Cognitive and Emotional Disorders. In: Burks S, Johnson KP, editors. Multiple Sclerosis. Diagnosis, Medical Management, and Rehabilitation. New York: Demos 2000: 405.
3. Honig LS, Ramsay RE, Sheremata WA. Event-related potential P300 in multiple sclerosis. Arch Neurol 1992; 49: 44-50.
4. Poser CM, Paty DW, Scheinberg L, McDonald WI, Davis FA, Ebers GC et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Ann Neurol 1983; 13: 227-231.
5. Kurtzke RF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983; 33: 1444-1452.
6. Folstein MF, Folstein SE, McHugh PR. Mini Mental State. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12: 189-198.
7. Raven JC. Guide to the Standard Progressive Matrices. London: H.K. Lewis 1960.
8. Repáň Ľ. Ravenova skúška pre dospelých. Bratislava: Psychodiagnostika 1968.
9. Říčan P. Ravenova skouška pro dospělé. Příručka. Bratislava: Psychodiagnostické a didaktické testy 1997.
10. Koubek K, Roušalová V. Grassiho test organicity. Příručka. Bratislava: Psychodiagnostické testy 1986.
11. Bender L. Instructions for the use of visual motor Gestalt test. New York, Am Orthopsychiat Assoc,1946. Bratislava: Psychodiagnostika 1974.
12. Piotrowski C. A Review of the Clinical and Research Use of the Bender-Gestalt test. Perceptual Motor Skills 1995; 81: 1271-1274.
13. Zung WWK. Self-rating Depression Scale. Archives of General Psychiatry 1965; 12: 63-70.
14. Zung WWK. A cross-cultural survey of depressive-symptomatology in normal adults. J Cross-Cult Psychol1972; 3: 177-183.
15. Chalder T, Berelowitz G, Pawlikowska T, Watts L, Wessely S, Wright D et al. Development of a fatigue scale. J Psychosom Res 1993; 37: 147-153.
16. Krupp LB, Sliwinski M, Masur DM, Friedberg F, Coyle PK. Cognitive functioning and depression in patients with chronic fatigue syndrome and multiple sclerosis. Arch Neurol 1994; 51: 705-710.
17. Krupp LB, LaRocca NG, Muir-Nash J, Steinberg AD. The Fatigue Severity Scale: Application to patients with multiple sclerosis and systemic lupus erythematosus. Arch Neurol 1989; 46: 1121-1123.
18. Schag CC, Heinrich RL, Ganz PA. Karnofsky performance status revisited: Reliability, validity and guidelines. J Clin oncology 1984; 2: 187-193.
19. Crooks V, Waller S, Smith T, Hahn TJ. The use of the Karnofsky Performance Scale in determining outcomes and risk in geriatric outpatients. J Gerontol 1991; 46: 139-144.
20. Suurmeijer A, Doeglas DM, Moum T, Briancon S, Krol B, Sanderman R et al. The Groningen Activity Restriction Scale for measuring disability: its utility in international comparisons. Am J Public Health 1994; 84: 1270-1273.
21. Comi G, Filippi M, Martinelli V, Sirabian G, Visciani A, Campi A et al. Brain magnetic resonance imaging correlates of cognitive impairment in multiple sclerosis. J Neurol Sci 1993; 115 (Suppl): 66-73.
22. Comi G, Filippi M, Martinelli V, Campi A, Rodegher M, Alberoni M et al. Brain MRI correlates of cognitive impairment in primary and secondary progressive multiple sclerosis. J Neurol Sci 1995; 132: 222-2227.
23. Filippi M, Tortorella C, Rovaris M, Bozzali M, Possa F, Sormani MP et al. Changes in the normal appearing brain tissue and cognitive impairment in multiple sclerosis. J Neurol Neurosurg Psychiatry 2000; 60: 157-161.
24. Pozilli C, Passafiume D, Bernardi S, Pantano P, Incoccia C, Bastianello S et al. SPECT, MRI and cognitive function in multiple sclerosis patients. J Neurol Neurosurg Psychiatry 1991; 54: 110-15.
25. Rao SM, Leo GJ, Haughton VM, St. Aubin-Faubert P, Bernardin L. Correlation of magnetic resonance imaging with neuropsychological testing in multiple sclerosis. Neurology 1989; 39: 161-166.
26. Rovaris M, Filippi M, Falautano M, Minicucci L, Rocca MA, Martinelli V et al. Relation between MR abnormalities and patterns of cognitive impairment in multiple sclerosis. Neurology 1998; 50: 1601-1608.
27. Ryan L, Clark CM, Klonoff H, Li D, Paty D. Patterns of cognitive impairment in relapsing-remitting multiple sclerosis and their relationship to neuropathology on magnetic resonance images. Neuropsychology 1996; 10: 176-193.
28. Aminoff JC, Goodin DS. Long-latency cerebral event-related potentials in multiple sclerosis. J Clin Neurophysiol 2001; 18: 372-377.
29. Ellger T, Bethke F, Frese A, Luettmann RJ, Buchheister A, Ringelstein EB, Evers S. Event-related potentials in different subtypes of multiple sclerosis - a cross -sectional study. J Neurol Sci 2002; 15: 35-40.
30. Casanova-Gonzales MF, Cabrera-Gomez JA, Aquino-Cais J, Aneiro Rivas R, Fernandes-Bermudez R. Neurophysiological assesment in patients with clinically defined multiple sclerosis with special reference to P300 wave study. Rev Neurol 1999; 29: 1134-1137.
31. Gil R, Zai L, Neau JP, Jonveaux T, Agbo C, Rosolacci T et al. Event-related auditory potentials and multiple sclerosis. Electroencephalogr Clin Neurophysiol 1993; 88: 182-7.
32. Giesser BS, Schroeder MM, LaRocca NG, Kutzberg D, Ritter W, Vaughan HG et al. Endogenous event-related potentials as indices of dementia in multiple sclerosis patients. Electroencephalogr Clin Neurophysiol 1992; 85: 320-329.
33. Ruchkin DS, Grafman J, Krauss GL, Johnson RJr, Canoune H, Ritter W. Event-related brain potential evidence for a verbal working memory deficit in multiple sclerosis. Brain 1994; 117: 289-305.
34. Camp SJ, Stevenson VL, Thompson AJ, Miller DH, Borras C, Auriacombe S, Brochet B et al. Cognitive function in primary progressive and transitional progressive multiple sclerosis: a controlled study with MRI correlates. Brain 1999; 122: 1341-1348.
35. Grigsby J, Ayarbe SD, Kravcisin A, Busenbark D. Working memory impairment among persons with chronic progressive multiple sclerosis. J. Neurol 1994; 241: 125-131.
36. Javurková A. Neuropsychologické vyšetření u pacientu s roztroušeou sklerózou. Československá psychologie 2001, 3: 22-26.
37. Brázdil M, Dobšík M, Pažourková M, Krupa P, Rektor I. Význam funkční magnetické rezonance pro hodnocení kognitivních pochodu v lidském mozku. Lokalizace „oddball“ úkolem aktivovaných neuronálních populací. Cesk Slov Neurol N 66/99; 2003; 1: 20-30.
38. Staffen W, Mair A, Zauner H, Unterrainer J, Niederhofer H, Kutzelnigg A et al. Cognitive function and fMRI in patients with multiple sclerosis: evidence for compensatory cortical activation during an attention task. Brain 2002; 125: 1275-1282.
39. Beatty WW, Goodkin DE, Hertsgaard D, Monson N. Clinical and demographic predictors of cognitive performance in multiple sclerosis: Do diagnostic type, disease duration, and disability matter? Arch Neurol 1990; 47: 305-308.
40. Klonoff H, Clark C, Oger J, Paty D, Li D. Neuropsychological performance in patients with mild multiple sclerosis. J Nerv Ment Dis 1991; 179: 127-131.
41. Rao SM, Leo GJ, Bernardin L, Unverzagt F. Cognitive dysfunction in multiple sclerosis: I. Frequency, patterns, and prediction. Neurology, 41: 685-691.
42. Krokavcová M, Gavelová M, Nagyová I, Gdovinová Z, van Dijk JP, Middel B et al. Self-rated health in patients with different forms of multiple sclerosis: preliminary results. Eur J Public Health 2004; 14: 96.
43. Drobný M, Bartko D, Kurča E, Šútorová D, Michalik J, Voško MR, Krátky M a kol. Sclerosis multiplex. Martin: Reklas 2002.
44. Maurelli M, Marchioni E, Cerretano R, Bosone D, Bergamaschi R, Citterio A et al. Neuropsychological assessment in MS: clinical, neuropsychological and neuroradiological relationships. Acta Neurol Scand 1992; 86: 124-128.
45. Millefiorini E, Padovani A, Pozzilli C, Loriedo C, Bastianello S, Buttinelli C et al. Depression in the early phase of MS: Influence of functional disability, cognitive impairment and brain abnormalities. Acta Neurol Scand 1992; 86: 354-358.
46. Moller A, Wiedemann G, Rohde U, Backmund H, Sontag A. Correlates of cognitive impairment and depressive mood disorder in multiple sclerosis. Acta Psych Scand 1994; 89: 117-121.
47. Sládková V, Muchová B, Ticháčková A, Mareš J, Urbánek K, Kaňovský P. Výskyt depresí u nemocných s roztroušenou sklerózou mozkomíšní. Cesk Slov Neurol N 2006; 69/102: 280-285.
48. Amato MP, Ponziani G, Siracusa G, Sorbi S. Cognitive dysfunction in early-onset multiple sclerosis: a reappraisal after 10 years. Arch Neurol 2001; 10: 1602-1606.
49. Rao SM, Leo GJ, Ellington L, Nauertz T, Bernardin L, Unverzagt F. Cognitive dysfunction in multiple sclerosis. II. Impact on employment and social functioning. Neurology 1991; 41: 692-696.
Štítky
Detská neurológia Neurochirurgia NeurológiaČlánok vyšiel v časopise
Česká a slovenská neurologie a neurochirurgie

2007 Číslo 6
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
Najčítanejšie v tomto čísle
- Obrna lícního nervu
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
