-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Validace dotazníku pro poruchy chůze u pacientů s roztroušenou sklerózou – česká verze MSWS-12
Validation of the Multiple Sclerosis Walking Scale-12 – Czech version
Aim: Walking difficulties are a common and serious symptom of MS. A validated questionnaire for the evaluation of gait disorders in patients with MS in the Czech language is missing. The aim of this study was to create and validate the Czech version of the 12-Item Multiple Sclerosis Walking Scale (MSWS-12) questionnaire, a simple anamnestic tool consisting of 12 questions. Materials and methods: The Czech version of the MSWS-12 questionnaire was created by the forward-backward translation method and validated in 50 MS patients and 25 healthy volunteers. The questionnaire was administered repeatedly one week apart to assess repeatability and reproducibility. Walking was objectively assessed using the Timed Up and Go (TUG) test and the 25 Foot Walk (T25FW) test. The results were correlated also with the Expanded Disability Status Scale (EDSS) and the Four-Stage Balance Test (FSBT). Results: Healthy controls scored 12.4 ± 0.7 points in the MSWS-12. In patients with MS, the values were significantly higher (P < 0.001) and reached 24.0 ± 11.8 points in average. The MSWS-12 score values closely correlated with walking tests and level of disability. i.e., the TUG test (r = 0.788; P < 0.001), T25FW test (r = 0.878; P < 0.001), EDSS (r = 0.878; P < 0.001), and FSBT (r = 0.831; P < 0.001). The repeatability assessed by Pearson´s correlation was 0.96 (P < 0.001). The reproducibility value of Cronbach’s alpha reached 0.983, which demonstrates the high internal consistency of the questionnaire. Conclusion: The Czech version of the MSWS-12 questionnaire showed very good validity in the evaluation of gait disorders in MS patients, and excellent reproducibility and internal consistency.
Keywords:
Multiple sclerosis – gait – walking speed – questionnaire – validation study
Autori: J. Kolčava 1; M. Sládečková 2; J. Kočica 1; P. Štourač 1; E. Vlčková 1; J. Bednařík 1
Pôsobisko autorov: Neurologická klinika, LF MU a FN Brno 1; Rehabilitační oddělení, FN Brno 2
Vyšlo v časopise: Cesk Slov Neurol N 2021; 84/117(4): 367-373
Kategória: Původní práce
doi: https://doi.org/10.48095/cccsnn2021367Súhrn
Cíl: Potíže s chůzí jsou častým a závažným symptomem RS. Validovaný dotazník pro zhodnocení poruch chůze u pacientů s RS v českém jazykovém prostředí chybí. Cílem studie proto bylo vytvořit a validovat českou verzi dotazníku 12-Item Multiple Sclerosis Walking Scale (MSWS-12). Jedná se o jednoduchý anamnestický nástroj sestávající z 12 otázek. Materiál a metodika: Česká verze dotazníku MSWS-12 byla vytvořena metodou zpětného překladu a validována na souboru 50 pacientů s RS a 25 zdravých dobrovolníků. Dotazník byl administrován opakovaně s odstupem jednoho týdne za účelem hodnocení opakovatelnosti a reprodukovatelnosti. Chůze byla objektivně hodnocena pomocí testů Timed Up and Go (TUG) a Timed 25-Foot Walk (T25FW). Výsledky byly korelovány také s Expanded Disability Status Scale (EDSS) a Four-Stage Balance Test (FSBT). Výsledky: Skóre MSWS-12 dosáhlo u zdravých kontrol hodnot 12,4 ± 0,7 bodů. U pacientů s RS byly hodnoty významně vyšší (p < 0,001) a dosahovaly v průměru 24,0 ± 11,8 bodů. Hodnoty skóre MSWS-12 úzce korelovaly s objektivními testy chůze i disabilitou, tj. s TUG testem (r = 0,788; p < 0,001), T25FW testem (r = 0,878; p < 0,001), EDSS (r = 0,878; p < 0,001) i FSBT (r = 0,831; p < 0,001). Opakovatelnost MSWS-12 hodnocená pomocí Pearsonovy korelace byla vynikající (r = 0,96; p < 0,001). Hodnota Cronbachova alfa odrážející reprodukovatelnost dosáhla 0,983, což prokazuje vysokou vnitřní konzistenci dotazníku. Závěr: Česká verze dotazníku MSWS-12 prokázala velmi dobrou validitu v hodnocení poruch chůze u pacientů s RS a vynikající reprodukovatelnost a vnitřní konzistenci.
Klíčová slova:
roztroušená skleróza – chůze – rychlost chůze – dotazník – validace
Úvod
Roztroušená skleróza je chronické zánětlivé autoimunitní demyelinizační onemocnění CNS, které postihuje široké spektrum neurologických systémů. Mezi nejčastější symptomy u pacientů s RS patří spasticita, svalová slabost a potíže s chůzí, které se objevují až u 75–85 % pacientů [1–3]. Porucha chůze se u pacientů projevuje především sníženou rychlostí, asymetrií, nevhodným stereotypem a omezenou výkonností [4]. Příčinou může být kombinace několika faktorů, jako jsou rychlý nástup únavy, porucha rovnováhy, svalová slabost či spasticita svalů dolních končetin [5]. Zmíněné projevy onemocnění často vedou ke snížení denní pohybové aktivity pacienta, a to především z důvodu pocitu nejistoty chůze a strachu z pádu [6]. Toto pohybové omezení může negativně ovlivnit průběh onemocnění. Naopak z pravidelné pohybové aktivity, která má řadu pozitivních vlivů u zdravé populace, profitují i pacienti s RS. Aktivní pohyb u těchto pacientů nejenom snižuje únavu, nýbrž i zlepšuje rovnovážné schopnosti, čímž snižuje riziko pádů a zvyšuje kvalitu života [5,7].
Chůze je velmi důležitá pro běžné fungování a její poruchy výrazně omezují každodenní činnosti pacientů s RS. Jedná se o jednu z nejvíce limitujících a invalidizujících potíží [8]. Je tedy velmi důležité přesně kvantifikovat limitaci chůze u pacientů s RS užíváním validních škál a testů.
Mezi specifické testy k objektivizaci chůze u pacientů s RS patří např. The Timed 25-Foot Walk (T25FW) test, Six-Minute Walk Test (6MWT) či Timed Up and Go test (TUG) [9–11].
Vedle objektivního hodnocení chůze je také důležitá pacientova subjektivní percepce, a právě proto vznikl dotazník Multiple Sclerosis Walking Scale-12 (MSWS-12) [12]. Dotazníkem s cílenými dvanácti otázkami lze zjistit, zda pacient pociťuje omezení ve stoji, při chůzi, běhu anebo rovnováze. V dotazníku jsou pacienti tázáni, jak moc byla ovlivněna jejich schopnost chůze, běhu, chůze po schodech, rovnováhy při stoji či chůzi a jak často potřebovali asistenci při chůzi v posledních dvou týdnech. Limitace je subjektivně hodnocena na škále od 1 (vůbec) do 5 bodů (extrémně). Pacient tedy může dosáhnout výsledku v rozpětí od 12 do 60 bodů, přičemž rostoucí počet bodů reflektuje narůstající klinické potíže [12–15].
Původně anglický dotazník musí být adaptován do jiného jazyka před použitím u neanglicky mluvících pacientů. Validovaný dotazník MSWS-12 je již dostupný ve švédské [16], brazilské [17], brazilsko-portugalské [18], italské [2] a perské verzi [19].
Cílem naší studie bylo vytvořit a validovat českou verzi dotazníku MSWS-12 pro potřeby české populace, jelikož validovaný dotazník pro hodnocení chůze u pacientů s RS dosud v českém jazykovém prostředí chybí.
Materiál a metodika
První fází této prospektivní validační studie bylo vytvoření české jazykové verze dotazníku MSWS-12 metodou zpětného překladu (forward-backward translation) s pomocí profesionálního překladatele a rodilého mluvčího dle publikovaných doporučení [20,21]. Česká i originální anglická verze jsou uvedeny v tab. 1 a 2.
Tab. 1. Dotazník Multiple Sclerosis Walking Scale – původní verze. 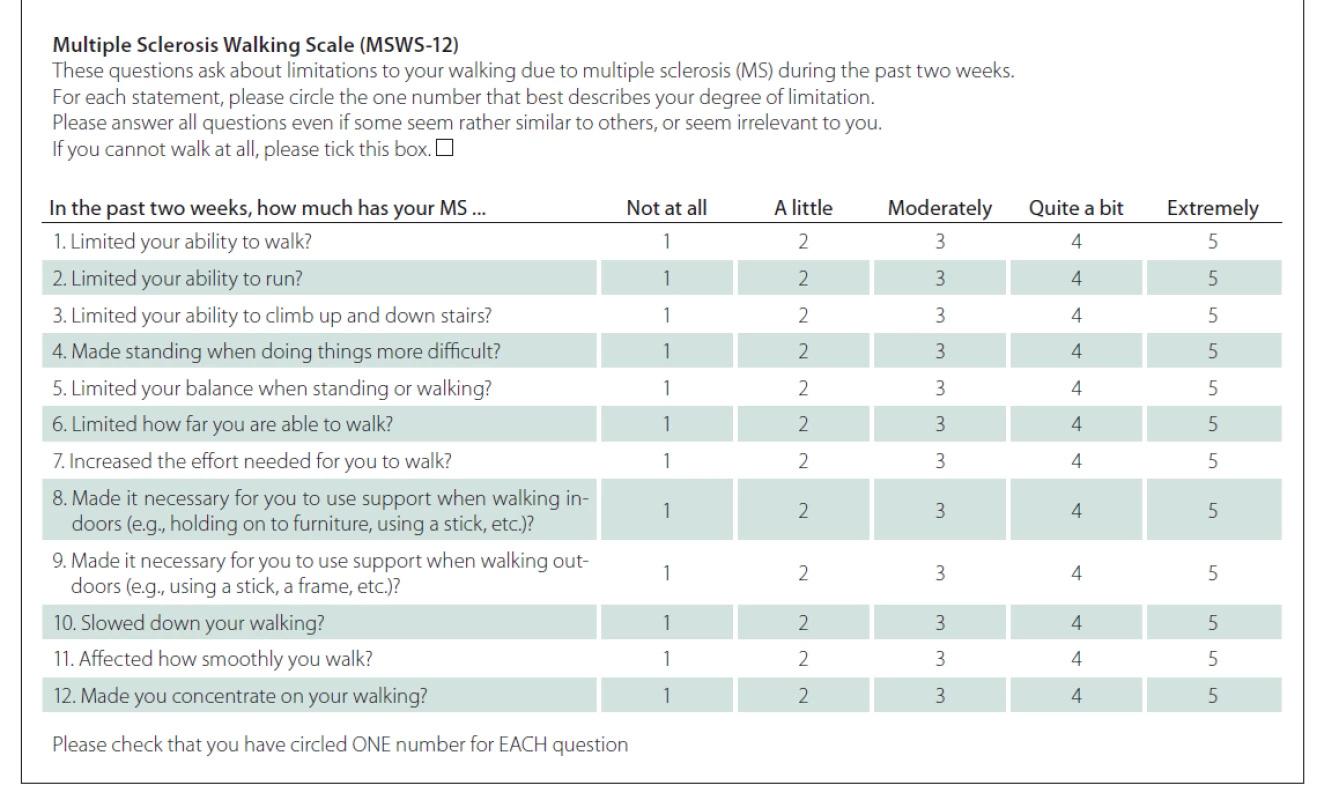
Tab. 2. Dotazník Multiple Sclerosis Walking Scale – česká verze. 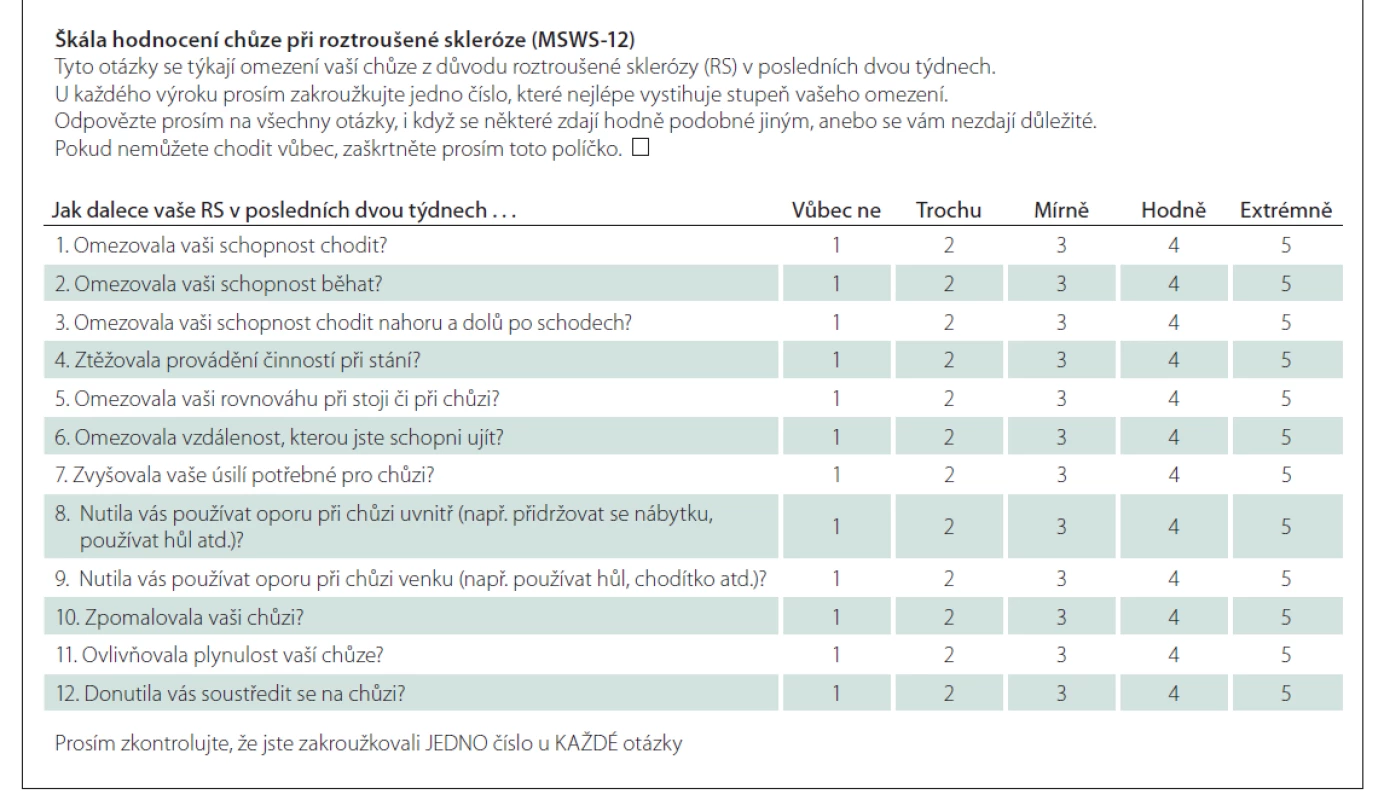
Na každou položku dotazníku odpovídá pacient na škále pěti možných odpovědí, za které získává 1–5 bodů (1 – vůbec ne; 2 – trochu; 3 – mírně; 4 – hodně; 5 – extrémně). Celkové skóre tedy může dosahovat hodnot v rozmezí 12–60 bodů.
Česká verze dotazníku MSWS-12 byla následně administrována dvěma skupinám jedinců:
Asymptomatickým dobrovolníkům (n = 25) (průměrný věk byl 43,2 let ± 10,2 let; 19 žen). Dobrovolníci nesměli mít známé neurologické onemocnění či onemocnění, které by mohlo způsobovat potíže s chůzí, a měli normální nález při orientačním klinickém neurologickém vyšetření;
Pacientům s RS (n = 50) sledovaným v RS centru Fakultní nemocnice Brno. Všichni pacienti splňovali diagnostická McDonaldova kritéria 2017 [22]. Vylučujícím kritériem pro účast v tomto projektu byl výskyt komorbidních neurologických či jiných (např. ortopedických) onemocnění s potenciálním vlivem na poruchy chůze a/nebo relaps onemocnění v posledních 30 dnech. Celkem bylo do studie zařazeno 12 mužů (24 %) a 38 žen (76 %), průměrný věk 43,4 let ± 9,5 let, průměrná doba trvání základního onemocnění 10,5 ± 5,7 let. Čtyřicet pacientů (80 %) mělo relabující-remitující formu RS, šest pacientů (12 %) sekundárně progresivní formu a čtyři pacienti (8 %) primárně progresivní formu. Průměrná hodnota Expanded Disability Status Scale (EDSS) byla 3,0 ± 1,6. Testování u těchto pacientů proběhlo během rutinních kontrol.
Všichni pacienti a kontroly podstoupili při vstupu do studie klinické neurologické vyšetření. U zdravých kontrol byl normální výsledek vyšetření a absence výskytu komorbidních neurologických či jiných (např. ortopedických) onemocnění s potenciálním vlivem na poruchy chůze podmínkou pro zařazení do studie. Pacienti i zdravé kontroly byli testováni sadou testů (TUG test, T25FW test, Four-Stage Balance Test [FSBT]). Následně bylo u pacientů i zdravých dobrovolníků provedeno testování pomocí dotazníku MSWS-12. Použitá verze dotazníku je uvedena v tab. 2. Asymptomatičtí dobrovolníci byly instruováni, aby namísto základního dotazu „Jak dalece vaše RS v posledních dvou týdnech…“ vztahovali své potenciální potíže s chůzí k obecnějšímu dotazu „Jak dalece jste pociťovali v posledních dvou týdnech…“. Po ukončení administrace dotazníku byli pacienti i kontroly dotazováni na jeho srozumitelnost. K vyhodnocení opakovatelnosti a reprodukovatelnosti dotazníku MSWS-12 v českém jazyce bylo použito opakované testování (test-retest). Pacienti i zdravé kontroly byli po 7–10 dnech telefonicky kontaktováni a v rámci tohoto telefonického rozhovoru jim byl s jejich souhlasem znovu administrován dotazník MSWS-12, přičemž neměli přístup k dříve vyplněnému dotazníku [23]. Opakovatelnost a reprodukovatelnost byla ověřena na vzorcích 50 pacientů s RS a 25 zdravých kontrol.
Popis jednotlivých testů
Timed Up and Go (TUG) test
Pacient je vyzván, aby vstal z obyčejné židle, ušel 3 m k čáře na podlaze obvyklým tempem, otočil se a vrátil se zpět k židli a znovu se posadil. Hodnocený pacient může po dobu testování využívat své obvyklé pomůcky pro chůzi. Dále je pacient instruován, aby při vstávání nepoužil své ruce. Žádná vnější pomoc není po čas testování povolena. Čas měřený v sekundách se zaznamenává od pokynu „jdi“ nebo „vstaň“ po opětovné posazení se pacienta na židli a dotyku jeho zad opěradla. Testování se provádí dvakrát. Výsledný čas se zaznamenává na stopkách. Čím kratší je čas potřebný pro vykonání úkolu, tím lepší výkon a rovnováhu vykazuje [10].
Timed 25-Foot Walk (T25FW) test
V testu měříme dobu, za jakou pacient ujde „co nejrychleji, ale bezpečně“ vzdálenost 25 stop (7,62 m). Pacient může jít s pomůckou, či bez pomůcky. Test T25FW je široce používaný v klinických studiích RS. Změna rychlosti v testu T25FW o 20 % byla validována jako klinicky významná změna [24].
Four-Stage Balance Test (FSBT)
Při testování FSBT se hodnotí statická rovnováha ve čtyřech pozicích, jejichž náročnost se postupně zvyšuje. V každé pozici by měl pacient vydržet 10 sekund s otevřenýma očima. První pozicí je stoj spojný, při druhé pozici je jedno chodidlo předsunuto tak, že střed jeho mediální hrany leží vedle palce druhého chodidla, třetí pozicí je tandemový stoj a čtvrtou pozicí je stoj na jedné dolní končetině [11].
Statistická analýza
Data byla statisticky zpracována pomocí programu SPSS verze 27 (IBM, Armonk, NY, USA). Ke zviditelnění rozdělení primárních hodnot jednotlivých testovaných parametrů byla použita standardní deskriptivní statistika (průměry a směrodatné odchylky pro spojité proměnné a absolutní a relativní četnosti pro data kategoriální). Srovnání hodnocených parametrů mezi jednotlivými skupinami pacientů bylo provedeno pomocí t-testu a Cohenova d (Cohenův koeficient účinku d). Srovnání kategoriálních dat (pohlaví) bylo provedeno pomocí chí-kvadrát testu. Jako koeficient opakovatelnosti (test-retest) byl použit Pearsonův korelační koeficient. K analýze vnitřní konzistence dotazníku bylo použito Cronbachovo alfa. Ke korelaci dotazníku MSWS-12 s demografickými a klinickými daty a objektivními testy byl použit Pearsonův korelační koeficient.
Výsledky
Vytvoření české verze dotazníku MSWS-12 prokázalo vynikající shodu mezi originální a zpětně přeloženou verzí. V rámci zpětného překladu nebyl zaznamenán žádný konfliktní či problematický termín. Pacienti s RS i dobrovolníci neměli v rámci vstupní administrace potíže porozumět otázkám a byli schopni dotazník vyplnit do 2 min.
Skóre MSWS-12 dosáhlo u zdravých kontrol hodnot průměrně 12,4 ± 0,7 bodů. U pacientů s RS byly hodnoty významně vyšší (p < 0,001) a dosahovaly v průměru 24,0 ± 11,8 bodů.
Pacienti s RS měli signifikantně vyšší hodnoty i v ostatních provedených objektivních testech chůze, tj. v testu TUG (p < 0,001) a testu T25FW (p < 0,001), a signifikantně nižší FSBT (p < 0,001) (tab. 3).
Tab. 3. Rozdíly mezi pacienty s RS a zdravými kontrolami. 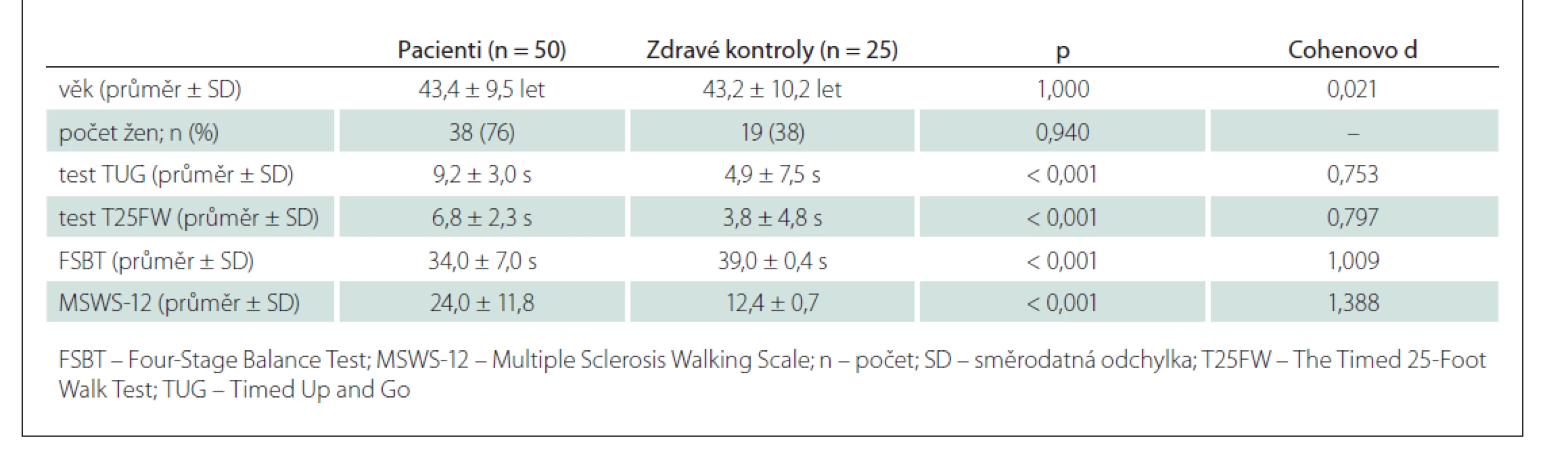
Průměr odpovědí u jednotlivých otázek byl u pacientů signifikantně vyšší, než u zdravých kontrol (p < 0,001), také hodnota Cohenova d reflektující míru věcné významnosti rozdílů prokázala střední až vysokou významnost (tab. 4).
Tab. 4. Průměr odpovědí u jednotlivých otázek u pacientů a zdravých kontrol. 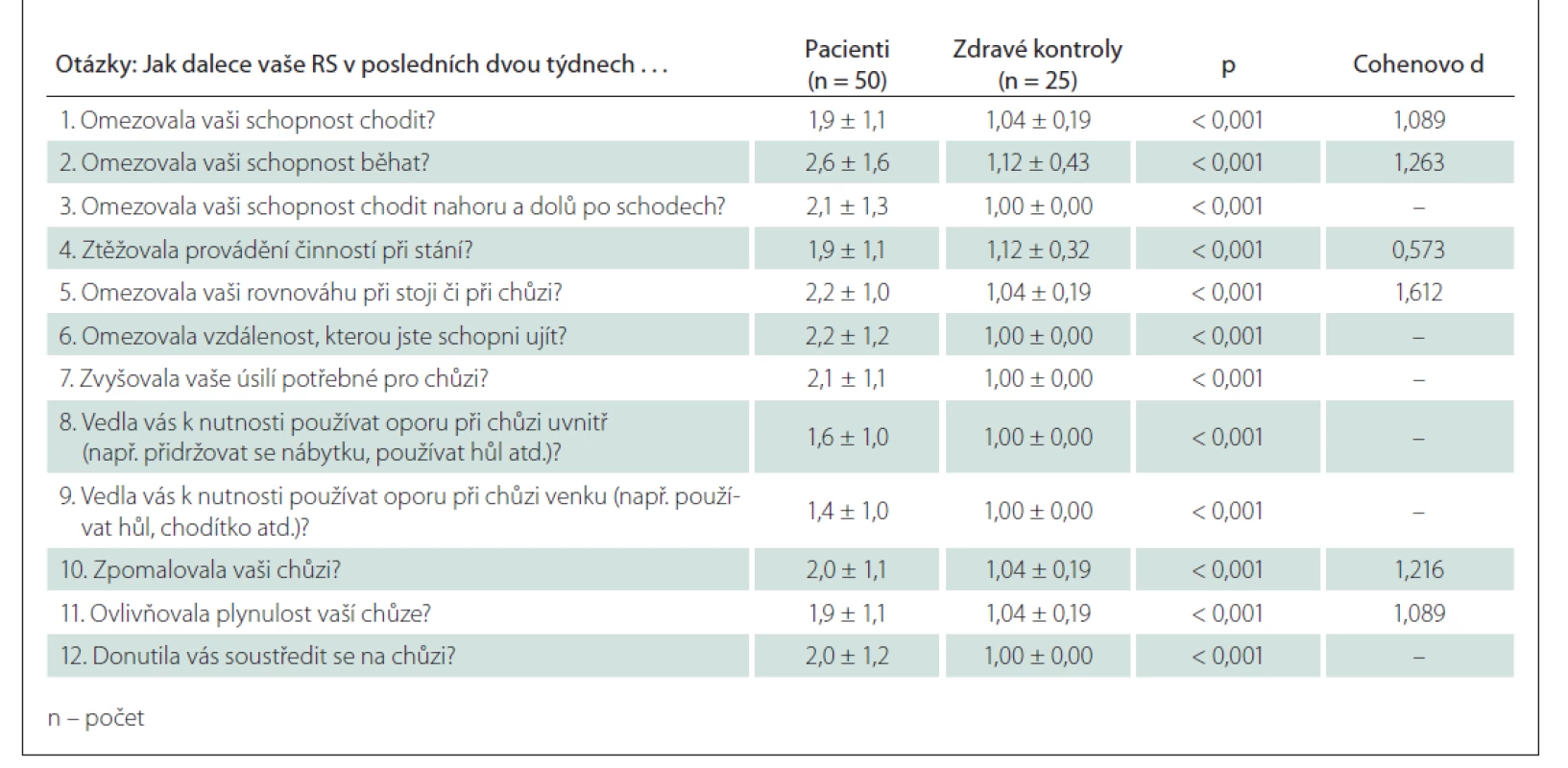
Pacienti s progresivními formami RS (primárně-progresivní RS či sekundárně-progresivní RS) měli signifikantně vyšší hodnoty EDSS (p < 0,001), testu TUG (p < 0,001), testu T25FW (p < 0,001) i dotazníku MSWS-12 (p < 0,001) a nižší hodnoty ve FSBT (p < 0,001) (tab. 5).
Tab. 5. Porovnání hodnot pacientů s RRRS a progresivními formami roztroušené (PPRS a SPRS). 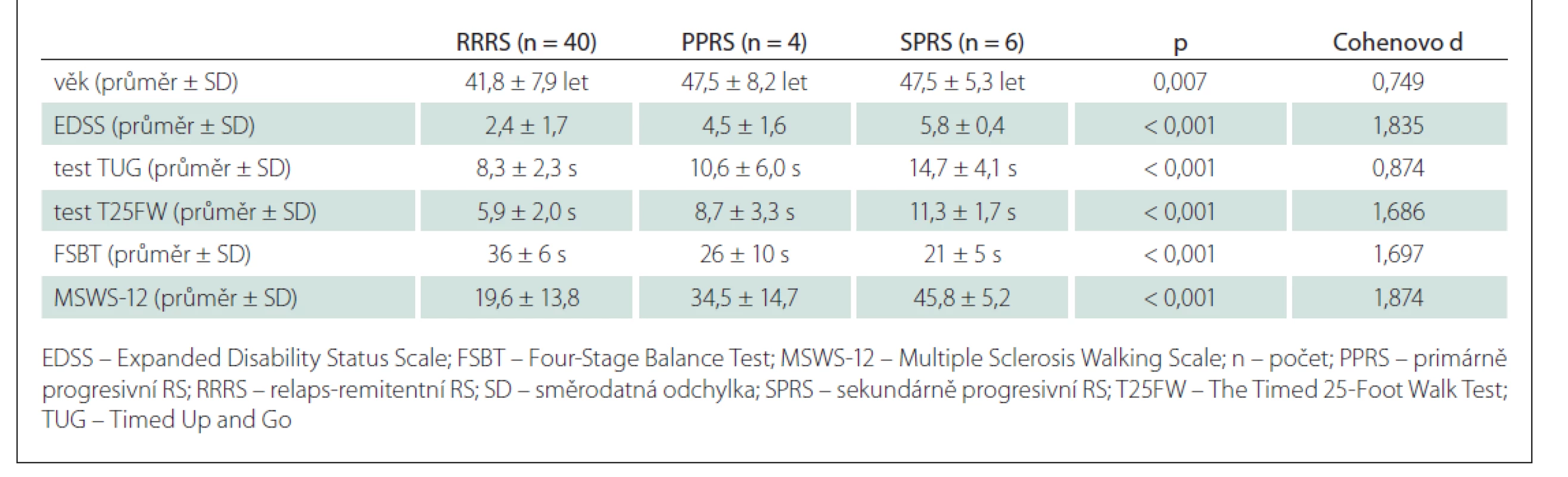
Ve skupině pacientů s RS jsme zjistili signifikantní korelaci dotazníku MSWS-12 s testem TUG (r = 0,807; p < 0,001), testem T25FW (r = 0,877; p < 0,001), EDSS (r = 0,878; p < 0,001) a také FSBT (r = –0,831; p < 0,001). Signifikantní korelace byla zjištěna také s demografickými a klinickými proměnnými, tedy s věkem (r = 0,392; p = 0,005), dobou trvání RS (r = 0,465; p = 0,001) či pohlavím pacientů (p = 0,39).
V kontrolní skupině nebyla zjištěna signifikantní korelace dotazníku MSWS-12 s testem TUG (r = 0,371; p = 0,068), testem T25FW (r = 0,125; p = 0; 550), FSBT (r = 0,164; p = 0,434) ani s věkem dobrovolníků (r = 0,288; p = 0,162) či pohlavím dobrovolníků (p = 0,72).
Opakovatelnost testu mezi vstupní a kontrolní administrací hodnocená pomocí Pearsonovy korelace dosáhla při souhrnném hodnocení všech subjektů vynikající hodnoty r = 0,975 (p < 0,001). Opakovatelnost ve skupině pacientů s RS byla r = 0,967 (p < 0,001). Hodnota Cronbachova alfa (reflektující reliabilitu neboli spolehlivost testu) dosáhla při souhrnném hodnocení všech zařazených jedinců úrovně 0,987, což prokazuje celkově vysokou vnitřní konzistenci dotazníku, přičemž reliabilita dosáhla hodnoty 0,983 ve skupině pacientů s RS. Všechny otázky v souhrnu prokázaly vysokou vnitřní konzistenci vyjádřenou pomocí hodnoty Cronbach alfa, která byla u všech otázek vyšší než 0,850 (tab. 6).
Tab. 6. Hodnoty Cronbachovy alfa (refl ektující reliabilitu neboli spolehlivost testu) u jednotlivých otázek souhrnně v celém souboru testovaných jedinců. 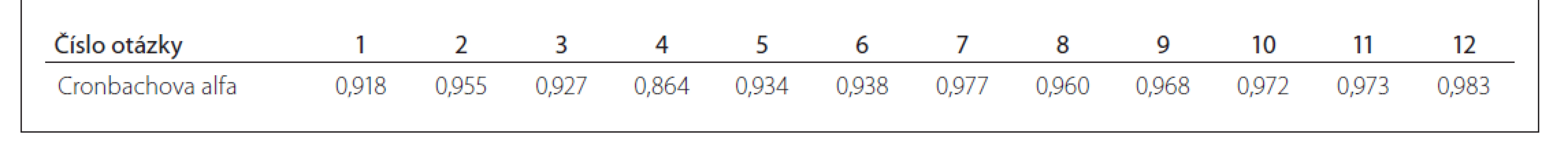
Diskuze
Prezentovaná práce umožnila vytvoření české verze dotazníku MSWS-12 a prokázala, že představuje jednoduchý a efektivní nástroj k hodnocení subjektivních potíží s chůzí u pacientů s RS. Potvrdila také časově nenáročnou administraci dotazníku a jeho snadné použití pro pacienty i personál. Naše data prokazují i výbornou opakovatelnost české verze dotazníku, a tedy jeho spolehlivost při vícenásobném použití, např. v rámci longitudinálního sledování pacientů nebo při hodnocení terapeutických intervencí zaměřených na poruchy chůze.
Výrazné rozdíly v dotazníku MSWS-12 mezi zdravými kontrolami a pacienty spolu s dobrou korelací s objektivními způsoby hodnocení chůze naznačují dobrou diagnostickou schopnost testu v detekci pacientů s poruchou chůze při RS.
Mezi limity provedené validační studie patří relativně nízký počet pacientů. Tento počet byl mírně nižší než v předešlých validačních studiích pro jiné jazykové adaptace [2,16–19], přesto umožnil dosažení velmi vysoké statistické významnosti mezi srovnávanými soubory. Určitým limitem může být také absence přesné informace o výšce a hmotnosti (resp. body mass indexu) vyšetřených jedinců. Případný vliv obezity na mobilitu pacientů se však autoři pokusili vyloučit nastavením vstupních kritérií (obézní pacienti ani kontroly nebyli do studie zařazeni). Obecnou limitací dotazníku MSWS-12 je pak jeho relativní nespecifita pro RS. Výsledky dotazníku mohou být ovlivněny celou řadou neurologických i jiných onemocnění. Vliv takových proměnných na výsledky provedené validační studie se autoři pokusili maximálně omezit nastavením vstupních kritérií. Pacienti s onemocněními potenciálně ovlivňujícími chůzi (komorbidními neurologickými či jinými, např. ortopedickými, chorobami) nebyli do studie zařazeni. Možné ovlivnění výsledků MSWS-12 jinými faktory než vlastní RS je však v interpretaci výsledků dotazníku nutné zohlednit i při použití dotazníku v klinické praxi.
Neurologické symptomy jako svalová slabost, spasticita, ataxie a senzitivní dysfunkce jsou časté již na počátku onemocnění a vedou k signifikantnímu zhoršení chůze u pacientů s RS, přičemž stupeň postižení chůze závisí na závažnosti dysfunkce jednotlivých subsystémů [25]. Potíže s chůzí jsou popsány jako významné až u 85 % pacientů s RS a přibližně jedna třetina z nich ztratí schopnost chůze do 20 let po stanovení diagnózy. Poruchy chůze mohou být také známkou progrese onemocnění, a proto je důležité mít k dispozici objektivní i subjektivní nástroje k jejich kvantifikaci, stejně tak i monitoraci léčby či účinnosti rehabilitace [25–28].
Nejrozšířenější klinická škála pro pacienty s RS je EDSS. Tato škála však není schopna dostatečně kvantifikovat potíže s chůzí, a především u pacientů s nižší disabilitou, kteří jsou schopni ujít více než 500 metrů, není dostatečně senzitivní. Stejně tak běžný dotaz neurologů „Kolik metrů jste schopen/schopna ujít?“ je pro kvantifikaci poruch chůze u RS nedostatečný. Některé objektivní testy (mj. testy TUG či T25FW) hodnotí jen krátký úsek chůze a nejsou schopny posoudit schůzi pacienta na delší vzdálenost a zhodnotit tak vliv zvýšené únavnosti na potíže s chůzí. Včasným zjištěním i minimálních poruch chůze je možné zahájit cílenou terapii dříve, a tím zlepšovat kvalitu života pacienta [29,30].
Hobart a kolektiv [12] vyvinuli dotazník MSWS-12 pro hodnocení tohoto důležitého klinického symptomu RS. Dvanáct otázek bylo vytvořeno na základě rozhovorů s pacienty, expertních názorů a rešerší literatury. Dotazník je používán v řadě klinických studií [31,32] i v rehabilitačních projektech [33].
Pro možnost porovnání výsledků validační studie byly pro vyjádření reliability použity hodnoty Cronbachovo alfa, tak jako v předešlých validačních studiích v dalších jazycích. Hodnota Cronbachova alfa dosáhla při souhrnném hodnocení všech zařazených jedinců úrovně 0,987, což prokazuje celkově vysokou vnitřní konzistenci dotazníku. Podobně výbornou reliabilitu celého dotazníku dosáhly i validační studie v dalších jazycích. Brazilská validační studie prokázala hodnotu Cronbachova alfa 0,94 [18], italská studie 0,97 [2] a perská studie 0,96 [19]. Ve validačních studiích původního dotazníku v angličtině prokazovala hodnota Cronbachova alfa také vysokou reliabilitu (0,97) [12,13].
Švédská validační studie posuzovala reliabilitu jednotlivých otázek pomocí Cronbachova alfa, kdy byla prokázána vysoká hodnota u devíti z dvanácti otázek (0,7–0,84) [16], podobnou či vyšší míru vnitřní konzistence jsme prokázali také v naší validační studii.
Cronbachovo alfa nabývá hodnot od 0 do 1, přičemž hodnoty větší než 0,5 ukazují na testy, které mají reálný smysl. Hodnoty blízké 0 znamenají, že v měření testu převažuje chybová složka rozptylu a mezi jednotlivými položkami testu je velmi nízká shoda. Hodnoty blízké 1 naopak znamenají, že chybová složka rozptylu měření je relativně nízká a dílčí položky testu jsou vnitřně maximálně konzistentní. Vysoké hodnoty Cronbachova alfa ukazují vysoký stupeň shody položek testu v tom smyslu, že stejně dobře odrážejí tentýž pozorovaný jev [34].
Poměrně velký rozptyl výsledku dotazníku MSWS-12 (24,0 ± 11,8 bodů) u pacientů s RS poukazuje na velké interindividuální rozdíly, jelikož někteří pacienti s RS prakticky žádné subjektivní potíže s chůzí neudávali a jejich hodnota MSWS-12 tak byla minimální, zatímco u jiných pacientů byly již problémy s chůzí zřetelně objektivně vyjádřeny, a tedy i subjektivně percipovány. Výsledné skóre MSWS-12 u většiny asymptomatických dobrovolníků bylo minimální (12 bodů), pouze šest dobrovolníků udávalo minimální omezení v chůzi, což reflektuje subjektivitu dotazníku, jelikož i zdravý jedinec může cítit malé omezení.
Do původní validační studie byly zařazeni pacienti, kteří jsou schopni ujít alespoň 5 metrů s nebo bez opory při chůzi (EDSS 0–7) [13].
V souhrnu tedy naše práce přinesla vytvoření a validaci české verze dotazníku MSWS-12, který je jednoduchým screeningovým nástrojem pro zhodnocení potíží s chůzí u pacientů s RS. Česká verze dotazníku vykazuje srovnatelnou validitu, opakovatelnost, spolehlivost a vnitřní konzistenci jako originální verze MSWS-12 a její následně validované další jazykové mutace.
Etické aspekty
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v roce 2000.
Postupy byly schváleny Etickou komisí FN Brno dne 15. 7. 2020 (02-150720/EK; ČP: 113/20), pacienti podepsali informovaný souhlas.
Rukopis byl přečten a schválen k publikaci všemi spoluautory a byly splněny požadavky na autorství.
Grantová podpora
Práce byla podpořena z prostředků MZ ČR – RVO (FNBr, 65269705) a projektem specifického výzkumu č. MUNI/A/1600/2020 z programu podpory studentských projektů na Masarykově univerzitě.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Mgr. Michaela Sládečková
Rehabilitační oddělení
FN Brno
Jihlavská 340/20
625 00 Brno
e-mail: sladeckova.michaela@fnbrno.cz
Přijato k recenzi: 30. 4. 2021
Přijato do tisku: 15. 7. 2021
Zdroje
1. Bethoux F, Bennett S. Evaluating walking in patients with multiple sclerosis: which assessment tools are useful in clinical practice?. Int J MS Care 2011; 13 (1): 4–14. doi: 10.7224/1537-2073-13.1.4.
2. Solaro C, Trabucco E, Signori A et al. Italian validation of the 12-item multiple sclerosis walking scale. Mult Scler Int 2015; 2015: e540828. doi: 10.1155/2015/540828.
3. Souza A, Kelleher A, Cooper R et al. Multiple sclerosis and mobility-related assistive technology: systematic review of literature. J Rehabil Res Dev 2010; 47 (3): 213–223. doi: 10.1682/jrrd.2009.07.0096.
4. Adusumilli G, Lancia S, Levasseur VA et al. Turning is an important marker of balance confidence and walking limitation in persons with multiple sclerosis. PLoS One 2018; 13 (6): e0198178. doi: 10.1371/journal.pone.0198 178.
5. Charron S, McKay KA, Tremlett H. Physical activity and disability outcomes in multiple sclerosis: a systematic review (2011–2016). Mult Scler Relat Disord 2018; 20 : 169–177. doi: 10.1016/j.msard.2018.01.021.
6. Kalron A, Allali G. Gait and cognitive impairments in multiple sclerosis: the specific contribution of falls and fear of falling. J Neural Transm (Vienna) 2017; 124 (11): 1407–1416. doi: 10.1007/s00702-017-1765-0.
7. Abasıyanık Z, Özdoğar AT, Sağıcı Ö et al. Explanatory factors of balance confidence in persons with multiple sclerosis: beyond the physical functions. Mult Scler Relat Disord 2020; 43 : 102239. doi: 10.1016/j.msard.2020.102239.
8. Kieseier BC, Pozzilli C. Assessing walking disability in multiple sclerosis. Mult Scler 2012; 18 (7): 914–924. doi: 10.1177/1352458512444498.
9. Motl RW, Balto JM, Ensari I et al. Self-efficacy and walking performance in persons with multiple sclerosis. J Neurol Phys Ther 2017; 41 (2): 114–118. doi: 10.1097/NPT.0000000000000172.
10. Podsiadlo D, Richardson S. The timed „Up & Go“: a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc 1991; 39 (2): 142–148. doi: 10.1111/j.1532-5415.1991.tb01616.x.
11. Kaesler DS, Mellifont RB, Swete Kelly P et al. A novel balance exercise program for postural stability in older adults: a pilot study. J Bodyw Mov Ther 2007; 11 (1): 37–43. doi: 10.1016/j.jbmt.2006.05.003.
12. Hobart JC, Riazi A, Lamping DL et al. Measuring the impact of MS on walking ability: the 12-Item MS walking scale (MSWS-12). Neurology 2003; 60 (1): 31–36. doi: 10.1212/wnl.60.1.31.
13. McGuigan C, Hutchinson M. Confirming the validity and responsiveness of the multiple sclerosis walking scale-12 (MSWS-12). Neurology 2004; 62 (11): 2103–2105. doi: 10.1212/01.wnl.0000127604.84575.0d.
14. Pilutti LA, Dlugonski D, Sandroff BM et al. Further validation of multiple sclerosis walking scale-12 scores based on spatiotemporal gait parameters. Arch Phys Med Rehabil 2013; 94 (3): 575–578. doi: 10.1016/j.apmr.2012.08.214.
15. Tajali S, Shaterzadeh-Yazdi MJ, Negahban H et al. Predicting falls among patients with multiple sclerosis: comparison of patient-reported outcomes and performance-based measures of lower extremity functions. Mult Scler Relat Disord 2017; 17 : 69–74. doi: 10.1016/j.msard.2017.06.014.
16. Nilsagård Y, Gunnarsson L-G, Denison E. Self-perceived limitations of gait in persons with multiple sclerosis. Adv Physiother 2007; 9 : 136–143. doi: 10.1080/140 38190701256402.
17. Marangoni BEM, Pavan K, Tilbery CP. Cross-cultural adaptation and validation of the 12-item multiple sclerosis walking scale (MSWS-12) for the Brazilian population. Arq Neuropsiquiatr 2012; 70 (12): 922–928. doi: 10.1590/s0004-282x2012001200004.
18. Nogueira LAC, Baitelli C, Alvarenga RMP et al. Translation and cross-cultural adaptation of the multiple sclerosis walking scale (MSWS-12) into Brazilian Portuguese. Cad Saude Publica 2012; 28 (5): 998–1004. doi: 10.1590/s0102-311x2012000500019.
19. Nakhostin Ansari N, Naghdi S, Mohammadi R et al. Multiple sclerosis walking scale-12, translation, adaptation and validation for the Persian language population. Gait Posture 2015; 41 (2): 420–424. doi: 10.1016/j.gaitpost.2014.11.003.
20. Beaton DE, Bombardier C, Guillemin F et al. Guidelines for the process of cross-cultural adaptation of self-report measures. Spine (Phila Pa 1976) 2000; 25 (24): 3186–3191. doi: 10.1097/00007632-200012150-00014.
21. Guillemin F, Bombardier C, Beaton D. Cross-cultural adaptation of health-related quality of life measures: literature review and proposed guidelines. J Clin Epidemiol 1993; 46 (12): 1417–1432. doi: 10.1016/0895-4356 (93) 90142-n.
22. Thompson AJ, Banwell BL, Barkhof F et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17 (2): 162–173. doi: 10.1016/S1474-4422 (17) 30470-2.
23. Bot AGJ, Becker SJE, Mol MF et al. Validation of phone administration of short-form disability and psychology questionnaires. J Hand Surg Am 2013; 38 (7): 1383–1387. doi: 10.1016/j.jhsa.2013.03.033.
24. Kaufman M, Moyer D, Norton J. The significant change for the timed 25-foot walk in the multiple sclerosis functional composite. Mult Scler 2000; 6 (4): 286–290. doi: 10.1177/135245850000600411.
25. Givon U, Zeilig G, Achiron A. Gait analysis in multiple sclerosis: characterization of temporal-spatial parameters using GAITRite functional ambulation system. Gait Posture 2009; 29 (1): 138–142. doi: 10.1016/j.gaitpost.2008.07.011.
26. Pearson OR, Busse ME, van Deursen RWM et al. Quantification of walking mobility in neurological disorders. QJM 2004; 97 (8): 463–475. doi: 10.1093/qjmed/hch 084.
27. Gianfrancesco MA, Triche EW, Fawcett JA et al. Speed - and cane-related alterations in gait parameters in individuals with multiple sclerosis. Gait Posture 2011; 33 (1): 140–142. doi: 10.1016/j.gaitpost.2010.09.016.
28. Sacco R, Bussman R, Oesch P et al. Assessment of gait parameters and fatigue in MS patients during inpatient rehabilitation: a pilot trial. J Neurol 2011; 258 (5): 889–894. doi: 10.1007/s00415-010-5821-z.
29. Keclíková L, Hoskovcová M, Gál O et al. Možnosti pohybových aktivit u pacientů s roztroušenou sklerózou mozkomíšní. Cesk Slov Neurol N 2014; 77/110 (1): 23–28.
30. Martin CL, Phillips BA, Kilpatrick TJ et al. Gait and balance impairment in early multiple sclerosis in the absence of clinical disability. Mult Scler 2006; 12 (5): 620–628. doi: 10.1177/1352458506070658.
31. Allart E, Benoit A, Blanchard-Dauphin A et al. Sustained-released fampridine in multiple sclerosis: effects on gait parameters, arm function, fatigue, and quality of life. J Neurol 2015; 262 (8): 1936–1945. doi: 10.1007/s00415-015 - 7797-1.
32. Hupperts R, Lycke J, Short C et al. Prolonged-release fampridine and walking and balance in MS: randomised controlled MOBILE trial. Mult Scler 2016; 22 (2): 212–221. doi: 10.1177/1352458515581436.
33. Baert I, Freeman J, Smedal T et al. Responsiveness and clinically meaningful improvement, according to disability level, of five walking measures after rehabilitation in multiple sclerosis: a European multicenter study. Neurorehabil Neural Repair 2014; 28 (7): 621–631. doi: 10.1177/1545968314521010.
34. Dušek L, Pavlík T, Jarkovský J et al. Analýza dat v neurologii: XXIX. Spolehlivost (reliabilita) klinických testů. Cesk Slov Neurol N 2011; 74/107 (5): 594–599.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek EditorialČlánek Intramedulární absces
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2021 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Proč se dráhy kříží? Základní principy uspořádání mozku obratlovců
- Role mikroRNA v patogenezi spinální muskulární atrofie
- Nové možnosti laboratórnej diagnostiky ochorení spojených s tvorbou amyloidov
- Využití rohovkové konfokální mikroskopie u neurologických onemocnění
- Poruchy čichu po COVID-19 – diagnostika, význam a léčba
- Kappa free light chains in multiple sclerosis – diagnostic accuracy and comparison with other markers
- Studijní protokol – robotická terapie chůze pomocí přístroje Lokomat Pro FreeD u pacientů v subakutní fázi ischemické cévní mozkové příhody
- Validace dotazníku pro poruchy chůze u pacientů s roztroušenou sklerózou – česká verze MSWS-12
- Characterization of swallowing disorders in myasthenia gravis through a fibre-optic endoscopic evaluation
- Standardisation of the Slovenian version of the Alzheimer’s Disease Assessment Scale – cognitive subscale (ADAS-Cog)
- The frequency of silent brain infarcts in polycythaemia vera and essential thrombocytosis
- COVID-19 u nemocných s myasthenia gravis
- CANVAS – nově identifikovaná genetická příčina ataxie s pozdním nástupem. Popis prvních diagnostikovaných pacientů v České republice
- Benefits of 18F-FET PET in preoperative assessment of glioma heterogeneity demonstrated in two case reports
- COVID-19 asociovaná myelitida – kazuistika vzácné komplikace závažné SARS-CoV-2 infekce
- Intramedulární absces
- Successful usage of rituximab in a patient with overlapping myelin oligodendrocyte glycoprotein encephalomyelitis and systemic lupus erythematosus
- Informace vedoucího redaktora
- Prof. MUDr. Hana Krejčová, DrSc. 90letá
- Aktualita z kongresu EAN 2021
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Poruchy čichu po COVID-19 – diagnostika, význam a léčba
- CANVAS – nově identifikovaná genetická příčina ataxie s pozdním nástupem. Popis prvních diagnostikovaných pacientů v České republice
- Proč se dráhy kříží? Základní principy uspořádání mozku obratlovců
- COVID-19 asociovaná myelitida – kazuistika vzácné komplikace závažné SARS-CoV-2 infekce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



