-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Aminoglykozidy a kolistín potláčajú tvorbu biofilmu u Klebsiella pneumoniae
Aminoglycosides and Colistin Inhibit Biofilm Formation in Klebsiella pneumoniae
Objective:
To evaluate the effect of subinhibitory concentrations (sub-MICs) of amikacin, tobramycin and colistin on biofilm formation, surface hydrophobicity, lipase activity and response to oxidative stress in two clinical K. pneumoniae strains.Methods :
Biofilm formation was quantitatively determined by a crystal violet absorption assay, surface hydrophobicity was measured by adherence of bacteria to xylene, lipase activity was determined by the spectrophotometric method with Tween-20 as a substrate and oxidative stress was visualized as a zone of clearing around the disc soaked with hydrogen peroxide.Results:
The antibiotics significantly reduced bacterial biofilm formation in a dose-dependent manner. They were most effective at concentrations of 1/2 and 1/4 MIC. Biofilm formation was inhibited by 1/2 MICs of amikacin to 21.2 % (strain 39) and 22.6 % (61/P), of tobramycin to 25.1 % (39) and 19.5 % (61/P) and of colistin to 7.4 % (39) and 19.1 % (61/P) of the control values (no antibiotic). Similarly, 1/4 MICs reduced biofilm formation to 28.6 % (39) and 28.9 % (61/P) of the control levels for amikacin, to 35.3 % (39) and 20.5 % (61/P) for tobramycin and to 8.7 % (39) and 20.4 % (61/P) for colistin. Cultivation of the strains with the antibiotics at 1/16 MICs was least effective in inhibiting biofilm formation. It was reduced to 80.4 % (39) and 97.7 % (61/P) of the control levels for amikacin, to 69.4 % (39) and 64.4 % (61/P) for tobramycin and to 61.3 % (39) and 74.7 % (61/P) for colistin. The tested strains were strongly hydrophilic and changes in surface hydrophobicity caused by antibiotics were negligible. Most antibiotic treated strains showed mildly increased sensitivity to oxidative stress and decreased lipase activity (with the exception of colistin in strain 39).Conclusion:
Amikacin, tobramycin and colistin at sub-MICs considerably reduced biofilm formation K. pneumoniae strains, in most mildly increased sensitivity to oxidative stress, decreased lipase activity but practically did not affect adherence to xylene.Key words:
Klebsiella pneumoniae – antibiotics – biofilm.
Autori: A. Hoštacká; I. Čižnár
Pôsobisko autorov: Slovenská zdravotnícka univerzita, Bratislava
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 79, 2008, č. 3, s. 101-105
Súhrn
Cieľ práce:
Vyhodnotenie účinku subinhibičných koncentrácií (sub-MICs) amikacínu, tobramycínu a kolistínu na tvorbu biofilmu, na povrchovú hydrofobicitu, lipázu a odpoveď na oxidačný stres u dvoch klinických kmeňov K. pneumoniae.Metodika:
Tvorbu biofilmu sme kvantitatívne vyhodnotili testom absorpcie kryštálovej violete, povrchovú hydrofobicitu adherenciou na xylén, lipázu spektrofotometrickou metódou s Tweenom 20 ako substrátom, oxidačný stres ako zónu vyčírenia obklopujúcu disk nasiaknutý peroxidom vodíka.Výsledky:
Antibiotiká výrazne znížili tvorbu bakteriálneho biofilmu v priamej závislosti na koncentrácii. Najúčinnejšie boli v koncentráciách 1/2 a 1/4 MICs. Biofilm po účinku 1/2 sub-MICs amikacínu bol inhibovaný na 21,2 % (kmeň 39) a 22,6 % (kmeň 61/P), po tobramycíne na 25,1 % (39) a 19,5 % (61/P), po kolistíne na 7,4 % (39) a 19,1 % (61/P) kontrolných hodnôt (bez antibiotika). Podobne 1/4 MICs amikacínu zredukovala produkciu biofilmu na 28,6 % (39) a 28,9 % (61/P), tobramycínu na 35,3 % (39) a 20,5 % (61/P) a kolistínu na 8,7 % (39) a 20,4 % (61/P) kontrolných hladín. Biofilm bol najmenej redukovaný po kultivácii kmeňov s 1/16 MICs antibiotík. V týchto prípadoch jeho hodnota bola znížená na 80,4 % (39) a 97,7 % (61/P) kontrolných hodnôt po amikacíne, na 69,4 % (39) a 64,4 % (61/P) po tobramycíne, na 61,3 % (39) a 74,7 % (61/P) po kolistíne. Testované kmene boli silne hydrofilné a zmeny v povrchovej hydrofobicite účinkom antibiotík boli veľmi nepatrné. Kmene po pôsobení antibiotík vo väčšine prípadov vykazovali mierne zvýšenú citlivosť na oxidačný stres a zníženú aktivitu lipázy (s výnimkou kolistínu u kmeňa 39).Záver:
Amikacín, tobramycín a kolistín v sub-MICs u kmeňov K. pneumoniae výrazne znížili tvorbu biofilmu, vo väčšine prípadov mierne zvýšili citlivost na oxidačný stres, znížili aktivitu lipázy ale adherenciu na xylén prakticky neovplyvnili.Kľúčové slová:
Klebsiella pneumoniae - antibiotiká - biofilm.Kmene Klebsiella spp. sú oportúnne patogény, ktoré atakujú hlavne imunokompromitovaných pacientov a novorodencov [14, 27]. Z lekárskeho hľadiska je najdôležitejší druh K. pneumoniae. Tieto baktérie môžu byť príčinou vážnych ochorení ako sepsa, pneumónia, infekcie močového traktu, infekcie mäkkých tkanív [21]. Tiež sú často príčinou nozokomiálnych infekcií. K. pneumoniae môže nadobudnúť rezistenciu na rôzne antibiotiká, a tak multirezistentné kmene predstavujú vážny terapeutický problém [15].
K. pneumoniae podobne ako celý rad ďalších baktérií môže rásť vo forme biofilmu. Biofilm je integrálny fenomén charakteristický pre prokaryonty od ich vzniku [9]. Je to plošná štruktúra vytvorená mikroorganizmami na pevnom podklade a v prostredí polymérneho materiálu, ktorý sami produkujú [6]. Rezistencia na antibiotiká bakteriálnych buniek rastúcich v tejto forme je vyššia v porovnaní s planktónovou formou [1].
Viaceré literárne údaje dokumentujú ovplyvnenie gramnegatívnych ako aj grampozitívnych baktérií v experimentálnych podmienkach in vitro a in vivo po pôsobení antibiotík v subinhibičných koncentráciách (sub-MICs) [8, 12, 18]. Ukázalo sa, že antibiotiká aj v týchto nízkych koncentráciách môžu byť účinné. Sub-MICs antimikróbnych látok sú prítomné v organizme hlavne striedavo počas terapie, v intervale medzi dvomi dávkami a môžu byť potenciálne účinné v oslabení špecifickej bakteriálnej infekcie.
Cieľom tejto práce bolo vyhodnotiť vplyv sub-MICs amikacínu, tobramycínu a kolistínu na tvorbu biofilmu, povrchovú hydrofobicitu, aktivitu lipázy a odpoveď na oxidačný stres dvoch klinických kmeňov K. pneumoniae.
Materiál a metodika
Bakteriálne kmene K. pneumoniae boli izolované od pacientov z katétra (39) a z kanyly (61/P) a identifikované pomocou komerčne identifikačného kitu, Enterotest 24 (Lachema Brno, Česko) (RUVZ Trenčín a Komárno).
Antibiotiká kolistín (Fluka, Dánsko), tobramycín (Brulamycín, Debrecín, Maďarsko), amikacín (amikin, Bristol Myers Squibb, Česko) boli použité v tejto práci
Minimálnu inhibičnú koncentráciu (MIC) sme zisťovali makrodilučnou metódou. Ako médium sme použili Muellerov–Hintonov bujón obohatený o 25 mg Ca 2+/l a 12,5 mg Mg 2+/l (MHB). Najnižšiu koncentráciu antibiotika, ktorá inhibovala bakteriálny rast meraný spektrofotometricky po 24 hod inkubácii pri 37 °C, sme považovali za MIC.
Podmienky kultivácie.Bakteriálnu suspenziu 0,2 ml, A600 = 0,5 ml, 9,7 ml MHB a 0,1 ml príslušného antibiotika v sub-MICs (1/2, 1/4, 1/8 a 1/16 MIC) ako aj kontrolnú kultúru (bez antibiotika) sme inkubovali 24 hod pri 37 °C na reciprokej trepačke. Po inkubácii sme bakteriálne suspenzie použili na vyhodnotenie oxidačného stresu, bunky po centrifugácii bakteriálnej suspenzie sme použili na vyhodnotenie hydrofobicity a produkcie biofilmu. V sterilných filtrátoch kultúr sme určovali lipázu.
Povrchovú hydrofobicitu baktérií sme vyhodnotili ich adherenciou na xylén meranú spektrofotometricky pri 400 nm [23].
Produkciu biofilmu sme kvantitatívne vyhodnotili testom absorbcie kryštálovej violete [25]. Relatívny obsah biofilmu sme určili z koncentrácie tejto farbičky eluovanej z odfarbených buniek v mikrotitračných platničkách kombináciou metód podľa O’Tooleho a Koltera [19] a Bonafonteho et al.[2] s miernymi modifikáciami tak, ako to bolo popísané v našej predchádzajucej práci [13].
Odpoveď baktérií na oxidačný stres vyvolaný reaktívnym oxidačným intermediátom (peroxid vodíka) sme vyhodnotili ako zónu vyčírenia obklopujúcu disky po 24 hod inkubácii pri 37 °C [10].
Lipolytickú aktivitusme vyhodnotili spektrofotometricky za použitia Tweenu 20 ako substrátu [16, 26].
Výsledky a diskusia
Biofilm je mikrobiálny fenomén, ktorý komplikuje starostlivosť o zdravie pacienta, predovšetkým znižovaním účinnosti chemoterapie a zvyšovaním rizika infekcie aj v prostredí ošetrenom antimikrobiálnymi látkami a štandardnými hygienicko-epidemiologickými opatreniami. Z hľadiska patogenetického potenciálu buniek tvoriacich biofilm in vivo je dôležitá ich rezistencia na antibiotiká, biocídy a na obranné mechanizmy makroorganizmu. Ukazuje sa, že na potlačenie vývoja rezistencie na monoterapiu môže byť účinná kombinácia antibiotík predstavujúca synergizmus, resp. čiastočný synergizmus proti baktériám [5, 17]. Počet infekcií zapríčinených tvorbou bakteriálnych biofilmov sa zvyšuje, a preto sa hľadajú stratégie ako tvorbu biofilmu inhibovať. Viaceré práce demonštrujú, že nízke koncentrácie antibiotík do určitého rozsahu môžu inhibovať tvorbu biofilmu [4, 20, 28], resp. môžu spôsobiť jej oneskorenie [7]. Redukcia biofilmu je doprevádzaná aj fyziologickými zmenami v baktériách (štruktúra matrice, povrchové vlastnosti, hrúbka biofilmu, rezistencia na antibiotiká) [3, 7]. Výsledky našej práce ukázali, že amikacín, tobramycín a kolistín v subinhibičných koncentráciách výrazne znížili tvorbu bakteriálneho biofilmu v priamej závislosti na koncentrácii (tab. 1, 2). Najúčinnejšie boli v koncentráciách 1/2 a 1/4 MICs. Biofilm po účinku 1/2 sub-MICs amikacínu bol potlačený na 21,2 % (kmeň 39) a 22,6 % (kmeň 61/P), po tobramycíne na 25,1 % (39) a 19,5 % (61/P), po kolistíne na 7,4 % (39) a 19,1 % (61/P) kontrolných hodnôt (bez antibiotiká). Podobne 1/4 MICs amikacínu zredukovala produkciu biofilmu na 28,6 % (39) a 28,9 % (61/P), tobramycínu na 35,3 % (39) a 20,5 % (61/P) a kolistínu na 8,7 % (39) a 20,4 % (61/P) kontrolných hladín. Biofilm bol najmenej potlačený po kultivácii kmeňov s 1/16 MICs antibiotík. V týchto prípadoch jeho hodnota bola znížená na 80,4 % (39) a 97,7 % (61/P) kontrolných hodnôt po amikacíne, na 69,4 % (39) a 64,4 % (61/P) po tobramycíne, na 61,3 % (39) a 74,7 % (61/P) po kolistíne. Kedže testované kmene boli silne hydrofilné (adherencia na xylén u kmeňa 39 v rozmedzí od 0 - 3,9 %, u kmeňa 61/P od 0-5,8%) zmeny v povrchovej hydrofobicite účinkom antibiotík boli veľmi nepatrné. Kmene po pôsobení antibiotík vo väčšine prípadov vykazovali vyššiu citlivosť na oxidačný stres (s výnimkou kolistínu u kmeňa 39). Aktivita lipázy bola vo väčšine prípadov znížená (s výnimkou účinku kolistínu u kmeňa 39).
Tab. 1. Vplyv amikacínu, tobramycínu a kolistínu na K. pneumoniae 61/P Table. 1. The effect of amikacin, tobramycin and colistin on K. pneumoniae 61/P 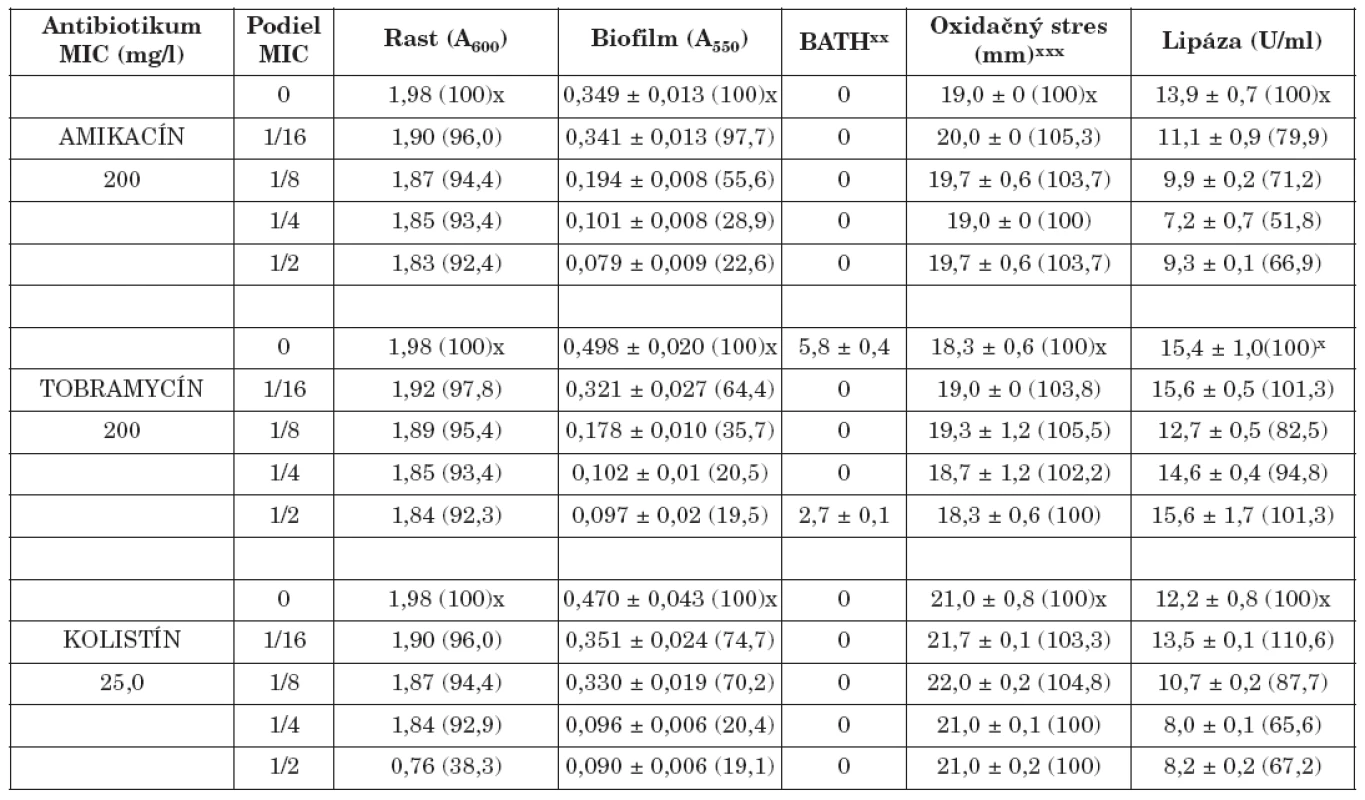
x Percento rastu, biofilmu, oxidačného stresu a lipázy xx Percento zníženia absorbancie nižšej vodnej fázy v porovnaní s pôvodnou suspenziou xxx Priemer zóny inhibovaného rastu x Percentage of the growth, biofilm, oxidative stress and lipase xx Percentage decrease in absorbance of the lower aqueous phase compared with that of the original suspension xxx The bacterial growth inhibition zone Tab. 2. Vplyv amikacínu, tobramycínu a kolistínu na K. pneumoniae 39 Table. 2. The effect of amikacin, tobramycin and colistin on K. pneumoniae 39 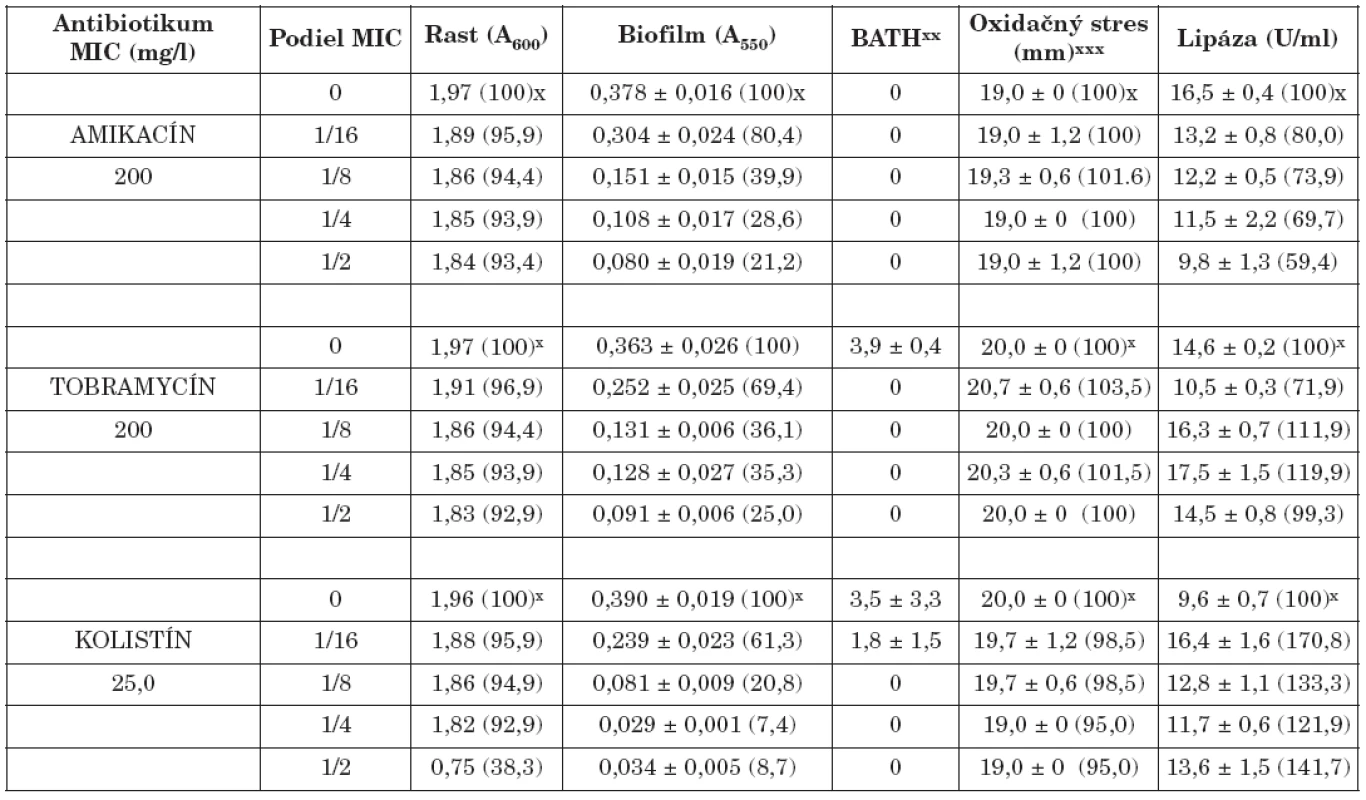
x Percento rastu, biofilmu,, oxidačného stresu a lipázy xx Percento zníženia absorbancie nižšej vodnej fázy v porovnaní s pôvodnou suspenziou xxx Priemer zóny inhibovaného rastu x Percentage of the growth, biofilm, oxidative stress and lipase xx Percentage decrease in absorbance of the lower aqueous phase compared with that of the original suspension xxx The bacterial growth inhibition zone Na druhej strane, niektoré literárne údaje naznačili, že sub-MICs niektorých antibiotík môžu tvorbu biofilmu stimulovať, resp. ju neovplyvniť [22, 24]. Predpokladá sa, že tvorba biofilmu môže byť špecifická, obranná reakcia na prítomnost antibiotík a že molekulárne základy tejto odpovede zahrňujú zmeny na úrovni c-di-GMP [11].
Naše a uvedené literárne údaje demonštrujú variabilitu v ovplyvňovaní tvorby bakteriálneho biofilmu po účinku sub-MICs antibiotík. Treba brať do úvahy aj literárne zistenia, že inhibícia biofilmu po pôsobení nízkych koncentrácií antibiotík je doprevádzaná aj ďalšími zmenami ako napr. zvýšením bakteriálnej rezistencie na antimikrobiálne látky. Toto zistenie by malo byť podnetom pre hľadanie nových možností ovplyvnenia biofilmu.
Záver
Amikacín, tobramycín a kolistín v sub-MICs u kmeňov K. pneumoniae výrazne znížili tvorbu biofilmu, vo väčšine prípadov mierne zvýšili citlivosť na oxidačný stres, znížili aktivitu lipázy a adherenciu na xylén prakticky neovplyvnili.
Vyslovujeme svoje poďakovanie pani A. Korenačkovej a K. Slimákovej za technickú spoluprácu.
Táto práca bola podporovaná Ministerstvom zdravotníctva SR v rámci projektu Analýza tvorby biofilmu u nozokomiálnych bakteriálnych kmeňov ako základ pre prevenciu infekcií v zdravotníckych zariadeniach č. 2005/24-SZU-02.
Do redakce došlo 15. 4. 2008
Ing. A. Hoštacká,CSc.
Slovenská zdravotnícka univerzita
Limbova 12
833 03 Bratislava
Slovenská republika
e -mail:anna.hostacka@szu.sk
Zdroje
1. Anwar, H., Strap, J. L., Chen, K., Costerton, J. W. Dynamic interaction of biofilms of mucoid Pseudomonas aeruginosa with tobramycin and piperacillin. Antimicrob Agents Chemother, 1992, 36, 1208-1214.
2. Bonafonte, A., Solano, K., Sesma, B. et.al. The relationship between glycogen synthesis, biofilm formation and virulence in Salmonella enteritidis. FEMS Microbiol Lett, 2000, 191, 3-36.
3. Cerca, N., Martins, S., Sillankorva, S. et al. Effects of growth in the presence of subinhibitory concentrations of dicloxacillin on Staphylococcus epidermidis and Staphylococcus haemolyticus biofilms. Appl Environ Microbiol, 2005, 71, 8677-8682.
4. Cerca, N., Martins, G., Pier, R., Oliviera, R., Azeredo, J. The relationship between inhibition of bacterial adhesion to a solid surface by sub-MIC concentrations of antibiotics and the subsequent development of a biofilm. Res Microbiol, 2005, 156, 650-655.
5. Černohorská, L., Votava, M. Antibiotic synergy against biofilm-forming Pseudomonas aeruginosa. Folia Microbiol, 2008, 53, 57-60.
6. Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin Microbiol Rev, 2002, 15, 167-193.
7. Gillis, R., Iglewski, B. Azithromycin retards Pseudomonas aeruginosa biofilm formation. J Clin Microbiol, 2004, 42, 5842-5845.
8. Grimwood, K., To, M., Rabin, H. R., Woods, D. E. Inhibition of Pseudomonas aeruginosa exoenzyme expression by subinhibitory antibiotic concentrations. Antimicrob Agents Chemother, 1989, 33, 41-47.
9. Hall-Stoodley, L., Costerton, W. J., Stoodley, P. Bacterial biofilms: from the natural environment to infectious diseases. Nature Rev Microbiol, 2004, 2, 95-108.
10. Hasset, D. J., Schweizer, H. P., Ohman, D. E. Pseudomonas aeruginosa sod A and sod B mutants defective in manganese - and iron-cofactored superoxide dismutase activity demonstrate the importance of the iron-cofactored form in aerobic metabolism. J Bacteriol, 1995, 177, 6330-6337.
11. Hoffmann, L. R., DęArgenio, D. A., MacCoss, M. S. et al. Aminoglycoside antibiotics induce bacterial biofilm formation. Nature, 2005, 436, 1171-1175.
12. Hoštacká, A. The in vitro effect of imipenem and ofloxacin on enzymic activity of Klebsiella strains. Folia Microbiol, 2000, 45, 387-390.
13. Hoštacká, A., Čižnár, I. Tvorba biofilmu a odpoveď na oxidačný stres u kmeňov Pseudomonas aeruginosa a Vibrio cholerae non-01 v závislosti na kultivačných médiách. Epidemiol Mikrobiol Imunol, 2007, 56, 186-190.
14. Kolář, M., Hájek, V., Kantor, L., Wiedermann, J., Koukalová, D. Prevalence of strains of Klebsiella pneumoniae resistant to cephalosporins of the third generation at the paediatric clinic of the faculty hospital in Olomouc. Epidemiol Mikrobiol Imunol, 1995, 44, 111-114.
15. Kolar, M., Latal, T., Cermak, P. et al. Prevalence of extended - spectrum ß - lactamase-positive Klebsiella pneumoniae isolates in the Czech Republic. Int J Antimicrob Agents, 2006, 28, 49-53.
16. Lonon, M. K., Woods, D. E., Straus, D. Production of lipase by clinical isolates of Pseudomonas cepacia. J Clin Microbiol, 1988, 26, 979-984.
17. Monden, K., Ando, E., Iida, M., Kumon, H. Role of fosfomycin in synergistic combination with ofloxacin against Pseudomonas aeruginosa growing in a biofilm. J Infect Chemother, 2002, 8, 218-226.
18. Nomura, S., Nagayama, A. Mechanism of enhancement of bactericidal activity of phagocytes againts Klebsiella pneumoniae treated with subminimal inhibitory concentrations of cefodizime. Chemotherapy, 1995, 41, 267-275.
19. O’Toole, G. A., Kolter, R. Initiation of biofilm formation in Pseudomonas fluorescens WCS 365 proceeds via multiple, convergent signalling pathways: a genetic analysis. Mol Microbiol, 1998, 28, 449-461.
20. Pagano, P., Buchanan, L., Dailey, C. et al. Effects of linezolid on staphylococcal adherence versus time of treatment. Int J Antimicrob Agents, 2004, 23, 226-234.
21. Podschun, R., Ullmann, U. Klebsiella spp. as nosocomial pathogens: epidemiology, taxonomy, typing methods and pathogenicity factors. Clin Microbiol Rev, 1998, 11, 589-603.
22. Rachid, S., Ohlsen, K., Witte, W., Hacker, J., Ziebuhr, W. Effect of subinhibitory antibiotic concentrations on polysaccharide intercellular adhesin expresion in biofilm - forming Staphylococcus epidermidis. Antimicrob Agents Chemother, 2000, 44, 3357 - 3363.
23. Rosenberg, M., Gutnik, D., Rosenberg, E. Adherence of bacteria to hydrocarbons: a simple method for measuring cell-surface hydrophobicity. FEMS Microbiol Lett, 1980, 9, 29-33.
24. Rupp, M. E., Hamer, K. E. Effect of subinhibitory concentrations of vancomycin, cefazolin, ofloxacin, L-ofloxacin and D-ofloxacin on adherence to intravascular catheters and biofilm formation by Staphylococcus epidermidis. J Antimicrob Chemother, 1998, 41, 155-161.
25. Stepanovič, S., Čirkovič, I., Ranin, L., Svabič-Vlahovič, M. Biofilm formation by Salmonella spp. and Listeria monocytogenes on plastic surface. Lett Appl Microbiol, 2004, 38, 428-432.
26. Tirunarayanan, M. O., Lundbeck, H. Investigations on the enzymes and toxins of staphylococci. Acta Pathol Microbiol Scand, 1968, 72, 263-276.
27. Williams, P., Tomás, J., M. The pathogenicity of Klebsiella pneumoniae. Rev Med Microbiol, 1990, 1, 196-204.
28. Yassien, M., Khardori, N., Ahmedy, A., Toama, M. Modulation of biofilms of Pseudomonas aeruginosa by quinolones. Antimicrob Agents Chemother, 1995, 39, 2262-2268.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek TEST
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2008 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Aminoglykozidy a kolistín potláčajú tvorbu biofilmu u Klebsiella pneumoniae
- Micromodification of Virus-neutralisation Assay with Vital Staining in 96-well Plate and its Use in Diagnostics of Ťahyňa Virus Infections
- Profesor Ivo Hána osmdesátníkem
- Spomienka na profesora MUDr. Emila Kmetyho, DrSc
- MUDr. Eduard Sajdák, * 6.5.1934 - † 4.5.2008
- TEST
- Časopis Epidemiologie, mikrobiologie, imunologie zařazen do Seznamu recenzovaných neimpaktovaných periodik vydávaných v České republice
- Opomíjené virové infekce přenášené hematofágními členovci v České republice
- Od historických poznatkov a názorov až po súčasné úlohy na poli celiakie
- Reccurent Erythema Migrans as a Persistent Infection
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Opomíjené virové infekce přenášené hematofágními členovci v České republice
- Aminoglykozidy a kolistín potláčajú tvorbu biofilmu u Klebsiella pneumoniae
- Od historických poznatkov a názorov až po súčasné úlohy na poli celiakie
- Reccurent Erythema Migrans as a Persistent Infection
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



