-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Genotypizace virového glykoproteinu B (gB) u příjemců transplantátu kmenových buněk krvetvorby s aktivní infekcí cytomegalovirem – sledování vlivu genotypů na průběh infekce
Genotyping of Viral Glycoprotein B (gB) in Hematopoietic Stem Cell Transplant Recipients with Active Cytomegalovirus Infection: Analysis of the Impact of gB Genotypes on the Patients’ Outcome
Aim of the study:
Genetic variation of CMV strains may correlate with their pathogenicity for immunocompromised patients. On the basis of sequence variation in the UL55 gene encoding the most abundant viral envelope glycoprotein gB, CMV can be classified into four major gB genotypes. The aim of the study was the analysis of the distribution of gB genotypes in a cohort of haematopoietic stem cell transplant (HSCT) recipients and of the correlation of genetic polymorphisms with clinical outcomes and manifestation of CMV infection.Material and methods:
Archived DNA isolates from consecutive blood samples of 53 adult allogeneic HSCT recipients with active CMV infection, transplanted in 2004-2005, were used for the genetic analysis. HCMV gB genotyping was performed by restriction fragment length polymorphism (RFLP) analysis and sequencing of the central variable region of UL55. The association of gB genotypes with selected clinical parameters was assessed by multivariate analysis after adjustment for graft donor type, HLA-matching and anti-thymocyte immunoglobulin (ATG) therapy.Results:
gB1, gB2, gB3, and gB4 genotypes were detected in 30%, 17%, 26% and 4% of the patients, respectively. An atypical gB genotype was found in one patient. Co-infection with two or more gB genotypes was revealed in 17% of the patients. The distribution of gB genotypes did not vary in time, despite the fact that the patients transplanted in 2005 had more severe CMV infection with higher viral loads in the blood than those transplanted in 2004. gB1 was associated with a lower viral load (p = 0.046) and a milder course of symptomatic CMV infection, but with a higher rate of acute graft versus host disease (OR 3.4; p = 0.067). Pancytopenia was less frequent in the patients infected with gB3 (OR 0.09; p = 0.075). In contrast, gB2-infected patients had a worse outcome of CMV infection with a higher rate of organ involvement and were less responsive to antiviral therapy (OR 6.65 and 0.18; p = 0.15 and 0.12, respectively). The prognostic impact of co-infection with two or more gB genotypes was not shown.Conclusions:
gB genotype may have an impact on the course of CMV infection and its complications in HSCT recipients. Nevertheless, these results need to be tested on a larger group of patients in the context of genetic variability of other functionally important viral genes. The characterization of viral genetic factors determining CMV pathogenesis will be of relevance to the treatment of patients at high risk of CMV infection.Key words:
human cytomegalovirus, pathogenesis, hematopoietic stem cell transplantation, genotype, gB.
Autori: Roubalová K . 1; O. Strunecký 2; S. Žufanová 2; B. Procházka 2; A. Vítek 3
Pôsobisko autorov: Vidia s. r. o., Vestec 1; Státní zdravotní ústav, Praha 2; Ústav hematologie a krevní transfuze, Praha 3
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 59, 2010, č. 2, s. 92-99
Súhrn
Cíle práce:
Genetická variabilita cytomegaloviru (CMV) může ovlivňovat jeho patogenní projevy u imunodeficientních pacientů. Na základě genetické variability v genu UL55, kódujícím dominantní virový obalový glykoprotein gB, lze CMV rozdělit do čtyř hlavních genotypů. Cílem práce byla analýza zastoupení genotypů gB u dospělých příjemců allogenního transplantátu kmenových buněk krvetvorby (HSCT) a jejich vztahu k průběhu transplantace a infekce CMV.Materiál a metody:
gB byl typizován v archivovaných vzorcích, získaných z periferní krve 53 příjemců HSCT, transplantovaných v letech 2004–2005. Pro genotypizaci byla použita metoda analýzy polymorfismu produktů štěpení restrikčními endonukleázami (RFLP) a sekvenace centrální variabilní části genu. Vztah genotypů ke sledovaným klinickým parametrům byl hodnocen multivariantní analýzou s vyloučením vlivu příbuznosti donora, shody HLA a léčby antithymocytárním imunoglobulinem (ATG).Výsledky:
Genotyp gB1 byl prokázán u 30 %, gB2 u 17 %, gB3 u 26 %, a gB4 u 4 % pacientů. U jednoho pacienta byl nalezen atypický genotyp. 17 % pacientů mělo smíšenou infekci více genotypy. Zastoupení jednotlivých genotypů se neměnilo v čase, přestože pacienti, transplantovaní v roce 2005, měli v průměru masivnější infekci s vyššími hladinami viru v krvi. gB1 byl provázen nižší virovou náloží (p=0,046) a mírnějším průběhem symptomatické infekce, ale vyšším výskytem akutní reakce štěpu proti hostiteli (OR 3,4; p = 0,067). Myelosupresivní projevy infekce byly méně časté u pacientů s gB3 (OR 0,09; p = 0,075). Naproti tomu pacienti s gB2 měli horší průběh symptomatické infekce s častějšími projevy orgánového postižení (OR 6,65; p = 0,15) a horší reakcí na antivirovou terapii (OR 0,18; p = 0,12). Vliv smíšené infekce na prognózu onemocnění nebyl prokázán.Závěry:
Výsledky této studie naznačují, že jednotlivé genotypy gB mají vliv na průběh infekce i na případné komplikace u příjemců HSCT. Tato pozorování je však nutno ověřit na větším souboru pacientů v kontextu se sledováním variability dalších důležitých virových genů. Charakterizace virových genetických faktorů, ovlivňujících patogenní projevy CMV, významně ovlivní péči o pacienty s vysokým rizikem cytomegalovirové infekce.Klíčová slova:
lidský cytomegalovirus, patogeneze, transplantace kmenových buněk krvetvorby, genotypizace, gB.Úvod
Přes veškeré úspěchy, které byly v posledních letech učiněny v oblasti terapie i prevence, patří cytomegalovirus (CMV) u příjemců transplantátu allogenních hematopoetických krvetvorných buněk (HSCT) k nejzávažnějším život ohrožujícím patogenům. Aktivní infekci prodělá až 80 % transplantovaných pacientů a u 20–30 % je provázena klinickými příznaky, k nimž patří horečka, pancytopenie a známky orgánového postižení – intersticiální pneumonie, gastroenteritis či hepatitis [1]. Sekundárně se zvyšuje riziko mykotických infekcí a akutní nebo chronické reakce štěpu proti hostiteli (AGVHD,CGVHD) [2]. Nejvýznamnějšími rizikovými faktory pro cytomegalovirovou nemoc u příjemců HSCT jsou transplantace štěpu od nepříbuzných, HLA - neshodných dárců, séropozitivita příjemce, deplece T-lymfocytů a agresivní imunosupresivní terapie [2]. Jednou z možných příčin variability klinických projevů cytomegalovirové infekce mohou být i genetické rozdíly mezi jednotlivými kmeny. Přestože je, v porovnání s jinými viry, CMV geneticky velmi stabilní, jednotlivé kmeny nejsou zcela identické, ale vytváří větší, či menší množství genetických variant (genotypů), které mohou souběžně nebo následně infikovat stejného hostitele [3, 4]. Geneticky variabilní úseky se nacházejí v různých částech virového genomu a zasahují i do funkčně významných genů, jako je např. gen pro hlavní regulátor transkripce (IE1), geny kódující imunomodulační proteiny nebo povrchové glykoproteiny na virovém obalu [5]. Poslední z nich jsou předmětem intenzivního studia, neboť zprostředkují vazbu virionů na buněčné receptory a průnik virů do hostitelských buněk. Jejich variabilita může ovlivnit infekčnost viru, buněčný tropismus i interakci s imunitním systémem hostitelského organismu. Lze tedy předpokládat, že polymorfismus těchto proteinů může ovlivnit patogenní vlastnosti příslušných kmenů CMV. Glykoprotein B (gB), kódovaný genem UL55, je součástí obalového glykoproteinového komplexu gCI, který je hlavní komponentou virového obalu, odpovídá za vazbu virionů na jeden z buněčných receptorů (heparan sulfát) a zahajuje fuzi virového obalu s buněčnou membránou [6]. Jeho součástí je imunodominantní antigen, který vyvolává jak buněčnou imunitní odpověď, tak tvorbu neutralizačních protilátek [7,8]. Genetická variabilita gB je soustředěna v centrální oblasti proteinu, v místě, kde dochází ke štěpení prekurzorového polypeptidu na dvě funkční subjednotky, a umožňuje rozlišení čtyř základních genotypů CMV (gB1,gB2, gB3,gB4) a tří vzácných neprototypových variant [9]. Hlavní antigenní determinanta i doména, která se účastní vazby na receptor, jsou součástí variabilní oblasti [9]. Jednotlivé genotypy se tedy mohou lišit svými imunogenními vlastnostmi i schopnostmi infikovat různé typy buněk. Nejrozšířenějším způsobem prevence cytomegalovirové nemoci u příjemců HSCT je preemptivní terapie antivirotiky. Tento postup zahrnuje pravidelné laboratorní monitorování aktivity cytomegaloviru pomocí pp65-antigenémie nebo kvantifikace virové nálože v krvi pacienta a nasazení léčby při prvních známkách rozvíjející se aktivní infekce [10].
Cílem této studie byla genetická analýza kmenů CMV, identifikovaných u allogenních příjemců HSCT, a sledování vlivu genotypů gB na průběh infekce a její dopad na zdraví pacienta.
Materiál a metody
Pacienti:
Do studie bylo zahrnuto 53 dospělých příjemců allogenního transplantátu HSC, léčených v letech 2004–2005 v Ústavu hematologie a krevní transfuze v Praze. Klinické charakteristiky pacientů jsou znázorněny v tabulce 1a. Cytomegalovirová infekce byla u pacientů monitorována pomocí vyšetření pp65-antigenémie a kvantitativní PCR (viz dále). Do 100. dne po transplantaci či u pacientů, léčených imunosupresivy pro reakci štěpu proti hostiteli (GVHD), bylo vyšetření prováděno jednou týdně, později byli pacienti vyšetřováni v intervalech 14 dnů až 1 měsíc.
Tab. 1a. Klinické charakteristiky vyšetřených pacientů Table 1a. Clinical characteristics of the patients 
1ALL – akutní lymfoblastická leukémie, AML – akutní myeloblastická leukemie,CLL – chronická lymfoblastická leukemie, CML – chronická myeloblastická leukemie,MDS – myelodisplastický syndrom, HD – Hodgkinova choroba, NHL – nehodgkinův lymfom; 2statisticky nesignifikantní; 3hematopoietické kmenové buňky z periferní krve; 4hematopoietické kmenové buňky z kostní dřeně; 5Do studie byly zahrnuti pouze pacienti s aktivní infekcí CMV; 6P – dosažená hladina statistické významnosti při univariantní analýze 1ALL – acute lymphoblastic leukemia, AML – acute myeloblastic leukemia, CLL – chronic lymphoblastic leukemia, CML – chronic myeloblastic leukemia, MDS – myelodisplastic syndrome, HD – Hodgkin’s disease, NHL – non-Hodgkin’s lymphoma; 2non -significant; 3haematopoietic stem cells from the peripheral blood; 4bone marrow stem cells ; 5Only the patients with active CMV infection were enrolled in the study.; 6achieved level of statistical significance in the univariate analysis Vyšetření pp65-antigenémie
Bylo prováděno metodou nepřímé imunofluorescence pomocí monoklonální protilátky proti virovému tegumentovému antigenu pp65 ( pp65 CINA Pool, Argene). Jako sekundární protilátka byl použit prasečí anti-myší imunoglobulin, značený fluorescein-isothiokyanátem (SwAM-FITC, Sevapharma, Praha). Z leukocytů pacienta, získaných z buffy coatu po sedimentaci nesrážlivé krve 1 hod při 37°C, byly připraveny cytospinové nátěry, obsahující 2x105 leukocytů / preparát. Po obarvení výše zmíněnými protilátkami byly na preparátu počítány buňky s jasně zelenou jadernou imunofluorescencí.
Za hranici pozitivity testu bylo považováno 5 specificky svítících buněk / 2x105 leukocytů.
Kvantitativní PCR
Pro kvantifikaci virové DNA v periferní krvi byla použita amplifikace úseku genu UL83 metodou kvantitativní real--time PCR podle Pumannové et al. [11]. Celková DNA byla izolována z 200 μL buffy coatu (viz výše) pomocí kolonek Qiagen (QiaAmp Blood Mini Kit, Qiagen) nebo pomocí automatického extraktoru MagnaPure (LC DNA Isolation Kit, Roche). Výsledek vyšetření byl udáván v počtu genom-ekvivalentů CMV na 1 ml krve.
Genotypizace gB metodou polymorfismu produktů restrikčního štěpení (RFLP)
Pro toto vyšetření byly použity izoláty DNA nebo vzorky buffy coatů, archivované při -20°C . Před použitím byly zahřáty 3 min. na 95°C, promíchány a krátce centrifugovány (8000ot/min. 1 min.). Variabilní úsek gB, zahrnující centrální variabilní oblast genu pro glykoprotein B (UL55, kodon 439 535, 293-6 párů bází) byl amplifikován pomocí nested PCR [12]. Reakce byla prováděna v 50 μl reakční směsi, obsahující 0,25 U Fast-Start Taq DNA polymerázy (Roche), reakční pufr pro amplifikaci DNA fragmentů bohatých na GC (Roche) a 25 pmol primerů. (Primery a amplifikační podmínky – viz Roubalová a spol. [40]. Produkt reakce byl následně štěpen restrikčními endonukleázami Hinf I a Rsa I (Promega). Reakční směs obsahovala 15 μl produktu PCR, 2 μl pufru (Promega), 2 μl Acyl - BSA (1 μg/ml, Promega) a 10U enzymu. Produkty štěpení byly analyzovány pomocí elektroforézy v 12 % akrylamidovém gelu po obarvení ethidium bromidem [9]. Od každého pacienta byly analyzovány minimálně dva nezávisle odebrané vzorky.
Sekvenace
Výsledky RFLP byly ověřeny pomocí sekvenace výše zmíněného úseku virové DNA. Sekvenační reakce, obsahující 10 pmol každého primeru a 0,1–1 μg templátu v 16 μL reakční směsi (Dye Deoxy Terminator Cycle Sequencing Kit BD 3.1), byla provedena v automatickém sekvenátoru (Applied Biosystems 3100). Sekvence byly analyzovány pomocí software SeqScape 2.0 and Mega 4.
Statistické vyhodnocení
Statistické vyhodnocení rozdílů mezi pacienty transplantovanými v letech 2004 a 2005 bylo provedeno pomocí univariantní analýzy s využitím Fischerova χ2 a Man-Whitney-Wilcoxonova testu (EpiInfo 6.04). Vliv genotypu na klinické ukazatele a kvantitativní znaky CMV infekce byl hodnocen pomocí multivariantní analýzy metodou logistické regrese s vyloučením vlivu příbuznosti donora graftu, shody HLA a léčby ATG. Vzájemná interakce zohledněných proměnných nebyla hodnocena. Střední doba přežití byla hodnocena pomocí Kaplan-Meyerovy analýzy a Log rank testu s využitím software SPSS v. 17.
Výsledky
Pacienti, transplantovaní v letech 2004 a 2005, byli srovnatelní co do zastoupení různých typů základního onemocnění, typu transplantátu, podílu nepříbuzenských i HLA-neshodných transplantací a lišili se pouze v četnosti aplikace ATG v průběhu přípravného režimu.
Tab. 1b. Charakteristiky cytomegalovirové infekce Table 1b. Characteristics of CMV infection 
1vyjádřená v ln počtu GE/ml krve na začátku aktivní infekce CMV 2Počet pp65-pozitivních buněk/ 2x105 periferních leukocytů u pacientů s pozitivní pp65-antigenémií 1ln GE/ml blood at the beginning of active CMV infection 2No. of pp65-positive cells/ 2x105 peripheral leukocytes in the patients with positive pp65-antigenemia Přestože celková četnost cytomegalovirové infekce i výskyt cytomegalovirové nemoci byly u obou skupin pacientů podobné, laboratorní parametry CMV (hladina virové DNA v periferní krvi na počátku infekce nebo pp65-antigenémie, tj. počet leukocytů, pozitivních na virový antigen pp65), byly u pacientů transplantovaných v roce 2005 podstatně zvýšeny (tabulka 1b). V zastoupení jednotlivých genotypů gB v obou skupinách pacientů nebyly pozorovány významné rozdíly (tabulka 2).
Tab. 1. Zastoupení jednotlivých genotypů glykoproteinu gB u příjemců HSCT transplantovaných v r.2004 a 2005 Table 2. Distribution of gB genotypes in HSCT recipients transplanted in 2004 and 2005. 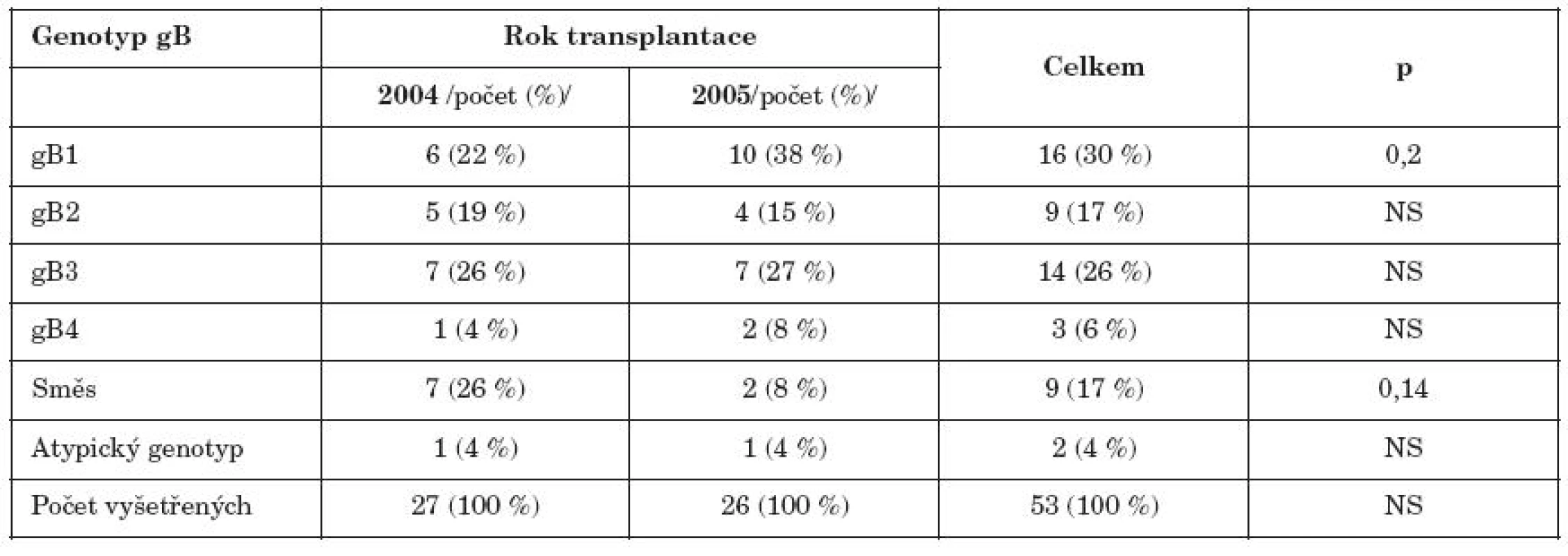
1P – dosažená hladina statické významnosti při univariantní analýze 1P – achieved level of statistical significance in univariant analysis Při první epizodě aktivní infekce CMV byl nejčastěji nalezen gB1 a gB3. Smíšená infekce více genotypy gB byla prokázána u 17 % pacientů a v roce 2004 byla vyšší než v roce 2005; rozdíl však nebyl statisticky významný. Atypický genotyp byl opakovaně zachycen u jednoho pacienta.
Tab. 2. Průběh transplantace u pacientů s různými genotypy gB Table 3. Clinical course of the transplantation in the patients with various gB genotypes 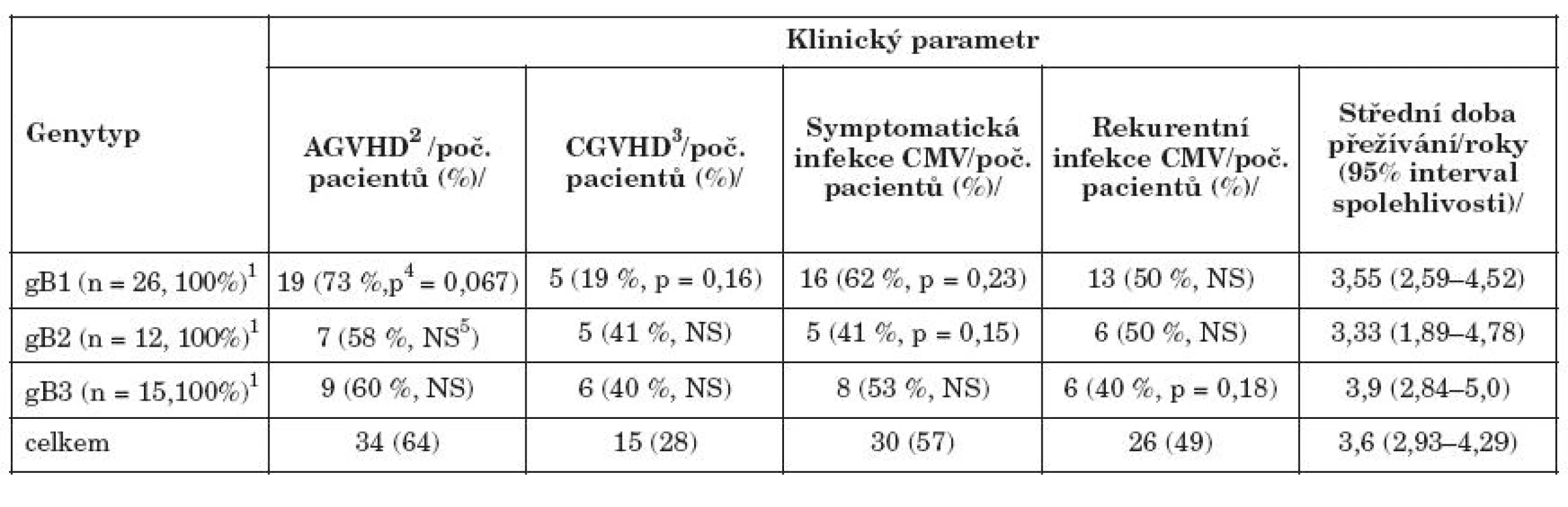
1Počet pacientů s minimálně jedním záchytem daného genotypu (pacienti s gB4 a pacienti, u nichž byla prokázána pouze směs genotypů nebyli hodnoceni); 2akutní reakce štěpu proti hostiteli; 3chronická reakce štěpu proti hostiteli; 4dosažená hladina statistické významnosti při multivariantní analýze s vyloučením vlivu typu dárce, shody HLA a terapie ATG.; 5statisticky nesignifikantní 1No of the patients at least once positive for a genotype (patients with gB4 or with co-infection with two or more gB genotypes were not evaluated); 2Acute graft versus host disease; 3Chronic graft versus host disease; 4achieved level of statistical significance in multivariate analysis adjusted to donor type, HLA matching and ATG therapy.; 5nonsignificant; 5 not significant Tabulka 3 dokumentuje vliv jednotlivých genotypů gB na klinický průběh transplantace. Protože výskyt gB4 byl vzácný, hodnotili jsme pouze přítomnost gB1, 2 a 3, pokud byl daný genotyp zachycen aspoň v jednom z vyšetřených vzorků pacienta. (V této tabulce jsou tedy, narozdíl od tabulky 2, hodnoceny i nálezy z dalších rekurentních epizod infekce. Rekurence byla dokumentována u 49 % pacientů a přesmyk z jednoho genotypu na jiný byl zaznamenán u 9 %.) Pacienti s gB1 měli zvýšený výskyt AGVHD (OR 3,4; p = 0,07) a naopak nižší výskyt chronické GVHD (OR 0,37; p = 0,16). Výskyt symptomatické infekce byl relativně snížen u gB2 (OR 0,32; p = 0,15), u gB3 bylo zvýšeno riziko rekurencí (OR 2,8; p = 0,18). Střední doba přežívání byla nejvyšší u pacientů s gB3 a nejnižší u pacientů s gB2, rozdíl však nebyl statistický signifikantní. Porovnání charakteristik infekce CMV u jednotlivých genotypů gB ukazuje tabulka 4.
Tab. 3. Charakteristiky cytomegalovirové infekce u pacientů s různými genotypy gB Table 4. Characteristics of CMV infection in the patients with various gB genotypes 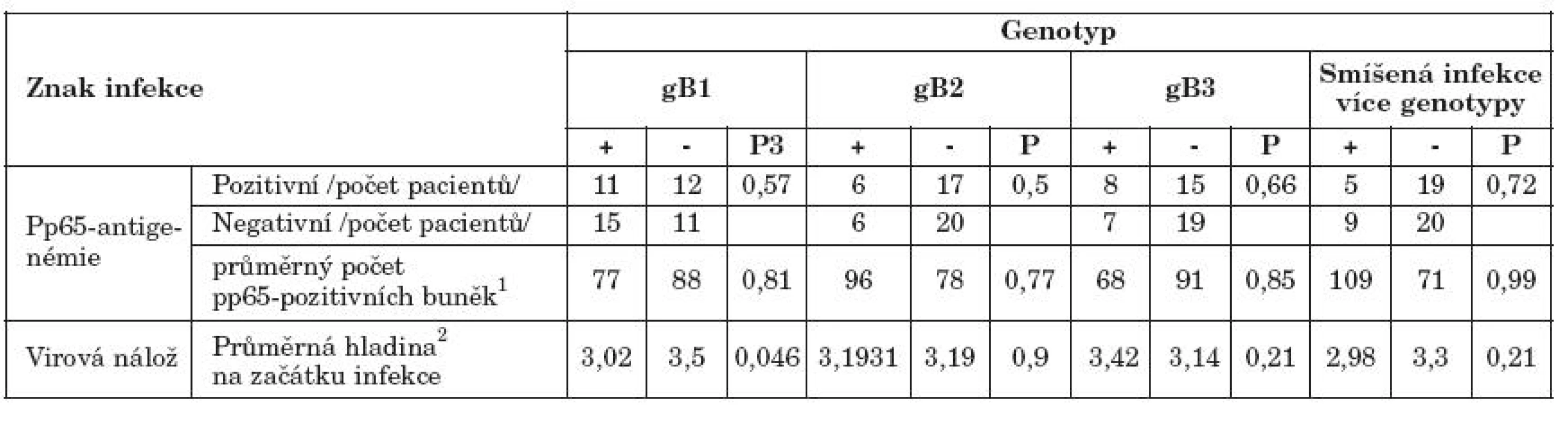
1Počet pp65-pozitivních buněk/ 2x105 periferních leukocytů i u pacientů s pozitivní pp65-antigenemií; 2Průměr ln GE/ml krve; 3P - dosažená hladina statistické významnosti při multivariantní analýze 1No. of pp65-positive cells / 2x105 peripheral leukocytes in the patients with positive pp65-antigenemia; 2Mean ln GE/ml blood; 3achieved level of statistical significance in multivariate analysis Pacienti, infikovaní gB1, měli signifikantně nižší virovou nálož na počátku infekce (p = 0,046). Pacienti s gB3 měli virovou nálož naopak mírně zvýšenou, rozdíl však nebyl statisticky významný. Vliv sledovaných genotypů na četnost a hladiny pp65-antigenemie nebyl prokázán. Průběh symptomatické cytomegalovirové infekce (tabulka 5) byl horší u pacientů s gB2, u nichž častěji docházelo k orgánovému postižení (OR6,7; p = 0,15) a hůře reagovali na antivirovou terapii (OR 0,18; p = 0,12). Pacienti s gB3 měli naopak mírnější průběh s menšími projevy myelosuprese (OR 0,09; p = 0,075). Vliv souběžné infekce více genotypy na průběh cytomegalovirové infekce nebyl prokázán (tabulka 4, 5).
Tab. 4. Klinická manifestace cytomegalovirové infekce u pacientů s rozdílnými gB genotypy Table 5. Clinical manifestation of CMV infection in the patients with various gB genotypes 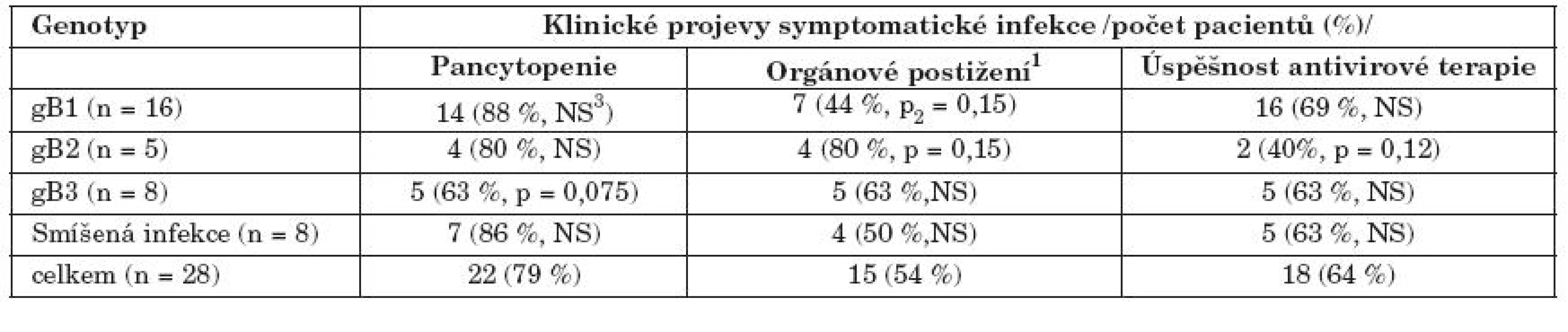
1pneumonie u 11 pacientů, gastroenteritis nebo hepatitis u 4 pacientů; 2dosažená hladina statistické významnosti při multivariantní analýze s vyloučením vlivu typu dárce, shody HLA a terapie ATG. 3statisticky nesignifikantní 1pneumonia in 11 patients, gastroenteritis or hepatitis in 4 patients; 2achieved level of statistical significance in multivariate analysis adjusted to donor type, HLA matching and ATG therapy. 3nonsignificant Diskuse
Vliv genotypu gB na patogenní vlastnosti CMV byl v minulosti sledován u různých skupin rizikových pacientů. U kongenitálně či perinatálně infikovaných dětí byla opakovaně nalézána souvislost gB1 s postižením jater [13,14,15]. Yan et. al. [16] nalezli souvislost mezi gB3 a vrozenou hluchotou u kongenitálně infikovaných dětí, kdežto Bale et. al. [17] naopak nacházeli tento genotyp častěji u asymptomaticky infikovaných novorozenců. U HIV-pozitivních pacientů byly nalézány rozdíly v tkáňové distribuci a způsobu přenosu jednotlivých genotypů [18, 19]. Některé studie popisují souvislost gB2 s postižením CNS [20, 21, 22], jiné ji však nepotvrdily [23, 24, 25]. U příjemců transplantátů solidních orgánů většina studií neprokázala jednoznačný vliv genotypu gB na klinický průběh transplantace či infekce CMV [12, 26, 27, 28]. Některé práce však dokumentovaly zhoršenou prognózu u pacientů, současně infikovaných více kmeny CMV [29, 30, 31]. V naší studii byl u pacientů s gB1 pozorován mírnější průběh infekce, spojený s nižší virovou náloží a menším rizikem generalizace a orgánového postižení. Zároveň však tito pacienti měli vyšší výskyt AGVHD. Pacienti s gB2 měli naopak horší průběh infekce s vyšším rizikem orgánového postižení a horší odpovědí na antivirovou terapii. Spojitost gB1 s lepší prognózou infekce u příjemců HSCT potvrzují i jiné studie [33, 34]. Meyer--Königová et. al. [35] zjistili, že gB1 není schopen infikovat lymfocyty. Snížená patogenita tohoto genotypu u příjemců HSCT by tedy mohla souviset s jeho zhoršenou schopností šířit se krví. S rozdílným buněčným tropismem gB1 může souviset i jeho vztah k AGVHD [34] nebo k akutní rejekci štěpu u pacientů s transplantací solidních orgánů [36]. Horší prognóza infekce u pacientů s gB2 byla popsána i ve studiích Hebarta et. al. [37] nebo Woo et. al. [38]. Na rozdíl od těchto autorů jsme však nenalezli u gB2-infikovaných pacientů vyšší riziko symptomatické infekce, ale pouze její horší průběh. Retiére et. al. [39] prokázal asociaci gB2 s genotypy HLA A11,A32 a DR11, které jsou u příjemců transplantátu ledviny spojeny s vysokým rizikem symptomatické infekce CMV. Důsledkem této kombinace může být nedokonalá prezentace antigenních peptidů, odvozených z gB, imunitnímu systému hostitele a oslabená imunitní odpověď na virovou infekci. U genotypu gB3 byly naše výsledky v porovnání se studií Torok-Storba et. al. [33] protichůdné: zatímco v uvedené práci autoři prokázali u pacientů s gB3 zvýšené riziko úmrtí v důsledku myelosuprese, v našem souboru byl tento genotyp asociován s nižším rizikem pancytopenie u pacientů se symptomatickou infekcí a s lepší střední dobou přežívání. Výsledky, které jsme získali, mohou být ovlivněny menší velikostí našeho souboru pacientů: většina rozdílů, které jsme pozorovali, nedosáhla 95% hranice statistické významnosti, a bude je tedy nutno potvrdit studiem většího souboru pacientů. Příčinou rozdílných výsledků u jednotlivých studií mohou být i rozdíly v metodice: různé výchozí soubory pacientů, různé typy vzorků (klinické vzorky vs virové izoláty, získané na tkáňových kulturách), odlišnosti ve sledovaných parametrech i ve způsobu statistického zpracování dat. Nepochybně zde hraje svoji roli i celková variabilita CMV, která postihuje nejen gB, ale i řadu dalších funkčně významných genů. Na základě současných vědomostí nedokážeme předpovědět, který z nich bude mít za daných podmínek infekce dominantní roli. Toto hledisko je nutno mít na zřeteli při interpretaci výsledků, získaných sledováním variability pouze jednoho z mnoha zúčastněných genů.
Závěry
Patogenita CMV je komplexním jevem, na kterém se podílí řada faktorů jak virového, tak hostitelského původu. Výsledky této studie naznačují, že jednotlivé genotypy gB mají vliv na průběh infekce i na případné komplikace u příjemců HSCT. Tato pozorování je však nutno ověřit na větším souboru pacientů v kontextu se sledováním variability dalších důležitých virových genů. Charakterizace virových genetických faktorů, ovlivňujících patogenní projevy CMV, významně ovlivní péči o pacienty s vysokým rizikem cytomegalovirové infekce.
Seznam zkratek:
- AGVHD – akutní reakce štěpu proti hostiteli
- ATG – anti-thymocytární imunoglobulin
- CGVHD – chronická reakce štěpu proti hostiteli
- CMV – lidský cytomegalovirus
- CNS – centrální nervový systém
- gB – cytomegalovirový glykoprotein gB
- GE – genom-ekvivalent
- HLA – hlavní histokompatibilitní komplex
- HSCT – transplantace kmenových buněk krvetvorby
- OR – odds ratio
- PCR – polymerázová řetězová reakce
- Pp65 – virový fosfoprotein o mol. váze 65 KDal
- RFLP – analýza polymorfismu produktů štěpení restrikčními endonukleázami
Poděkování: Tento projekt byl sponzorován grantem IGA MZ ČR NR9418-3/07 a VZ MZ ČR 23736.
Dr. K. Roubalová
Vidia s.r.o.
Nad Safinou II/365
251 42 Jesenice u Prahy
e-mail: kroubalova@vidia.cz.
Zdroje
1. Hebart, H. Einsele, H. Clinical aspects of CMV infection after stem cell transplantation. Human immunology 2009,65, 432-436.
2. Razonable, R.R. Epidemiology of cytomegalovirus disease in solid organ and hematopoietic stem cell transplant recipients. Amer j health-syst pharm 2005, 62, 57-79.
3. Lasry, S., Dény, P., Asselot, C., Rauzy, M., et. al. Interstrain variations in the cytomegalovirus (CMV) glycoprotein B gene sequence among CMV-infected children attending six day care centers. J Infect Dis 1996, 174, 606-609.
4. Rasmussen, L., Geissler, A., Winters, M. Inter - and intragenic variations complicate the molecular epidemiology of human cytomegalovirus. J Infect Dis 2003 187, 809-819.
5. Pignatelli, S., Dal Monte, P., Rossini, G., Landini, M.P. Genetic polymorphisms among human cytomegalovirus (HCMV) wild-type strains. Rev Med Virol 2004, 14, 383-410.
6. Britt, W.J., Vugler, L.G. Processing of the gp55-116 envelope glycoprotein complex (gB) of human cytomegalovirus. J Virol 1989, 63, 403-410.
7. Boehme, K. W., Singh, J., Perry, S. T., Compton, T. Human cytomegalovirus elicits a coordinated cellular antiviral response via envelope glycoprotein B. J Virol 2004,78, 1202-1211.
8. Alberola, J, Tamarit, A, Igual, R, Navarro, D. Early neutralizing and glycoprotein B (gB)-specific antibody responses to human cytomegalovirus (HCMV) in immunocompetent individuals with distinct clinical presentations of primary HCMV infection. J Clin Virol 2000,16 , 113-122.
9. Chou, S.W., Dennison, K.M. Analysis of interstrain variation in cytomegalovirus glycoprotein B sequences encoding neutralization-related epitopes. J Infect Dis 1991,163, 1229-1234.
10. Boeckh, M. Current antiviral strategies for controlling cytomegalovirus in hematopoietic stem cell transplant recipients: prevention and therapy. Transpl Infect Dis 1999,1, 165-178.
11. Pumannová, M., Roubalova, K., Vítek, A., Sajdová, J. Comparison of quantitative competitive polymerase chain reaction-enzyme-linked immunosorbent assay with LightCycler-based polymerase chain reaction for measuring cytomegalovirus DNA in patients after hematopoietic stem cell transplantation. Diag Microbiol Infect Dis 2006, 54, 115-120.
12. Aquino, V.H., Figueiredo, L.T. High prevalence of renal transplant recipients infected with more than one cytomegalovirus glycoprotein B genotype. J Med Virol 2000, 61, 138-142.
13. Terabe, K., Sugiyama, K., Goto, K., Mizutani, F., et. al. Relationship between human cytomegalovirus glycoprotein B genotype and serum alanine aminotransferase elevation in infants. Tohoku J Exp Med 2004, 203, 339-344.
14. Jin, H., Wang, X., Li, S. Human cytomegalovirus glycoprotein B genotype correlates with different symptoms of infected infants. Intervirology 2007,50, 219-223.
15. Yu, Z. S., Zheng, J. Y., Wu , J. B. Association between clinical manifestations of infants with human cytomegalovirus infection and glycoprotein B genotype. Zhonghua Yi Xue Za Zhi 2007,87, 259-261.
16. Yan, H., Koyano, S., Inami, Y., et. al. Genetic variations in the gB, UL144 and UL149 genes of human cytomegalovirus strains collected from congenitally and postnatally infected Japanese children. Arch Virol 2008,153, 667-674.
17. Bale, J.F. Jr, Murph, J.R., Demmler, G.J., Dawson, J., et. al. Intrauterine cytomegalovirus infection and glycoprotein B genotypes. J Infect Dis 2000, 182, 933-936.
18. Zipeto, D., Hong, C., Gerna, G., Zavattoni, M., et. al. Geographic and demographic differences in the frequency of human cytomegalovirus gB genotypes 1-4 in immunocompromised patients. AIDS Res Hum Retroviruses 1998, 14, 533-536.
19. Fidouh-Houhou, N., Duval, X., Bissuel, F., Bourbonneux, V., et. al. Salivary cytomegalovirus (CMV) shedding, glycoprotein B genotype distribution, and CMV disease in human immunodeficiency virus-seropositive patients. Clin Infect Dis 2001, 33, 1406-1411.
20. Shepp, D.H., Match, M.E., Ashraf, A.B., Lipson, S.M., et. al. Cytomegalovirus glycoprotein B groups associated with retinitis in AIDS. J Infect Dis 1996, 174, 184-187. .
21. Chern, K.C., Chandler, D.B., Martin, D.F., Kuppermann, B.D., et. al. Glycoprotein B subtyping of cytomegalovirus (CMV) in the vitreous of patients with AIDS and CMV retinitis. J Infect Dis 1998,178, 1149-1153.
22. Tarragů, D., Quereda, C., and Tenorio, A. Different cytomegalovirus glycoprotein B genotype distribution in serum and cerebrospinal fluid specimens determined by a novel multiplex nested PCR. J Clin Microbiol 2003, 41, 2872-2877.
23. Gilbert, C, Handfield, J, Toma, E, Lalonde, R, et. al. Human cytomegalovirus glycoprotein B genotypes in blood of AIDS patients: lack of association with either the viral DNA load in leukocytes or presence of retinitis. J Med Virol 1999, 59, 98-103.
24. Peek, R., Verbraak, F., Bruinenberg, M., Van der Lelij, A., et. al. Cytomegalovirus glycoprotein B genotyping in ocular fluids and blood of AIDS patients with cytomegalovirus retinitis. Invest Ophthalmol Vis Sci.1998 Jun;39(7):1183-7. 39, 1183-1187.
25. Drew, W. L., Chou, S., Miner, R. C., Mohr, B. A., et. al. Cytomegalovirus glycoprotein B groups in human immunodeficiency virus-infected patients with incident retinitis. J Infect Dis 2002, 186, 114-117.
26. Humar, A., Kumar, D., Gilbert, C., Boivin, G. Cytomegalovirus (CMV) glycoprotein B genotypes and response to antiviral therapy, in solid-organ-transplant recipients with CMV disease. J Infect Dis 2003, 188, 581-584.
27. Pacsa, A. S., Essa, S., Voevodin, A., el-Shazly, A., et. al. Correlation between CMV genotypes, multiple infections with herpesviruses (HHV-6,7) and development of CMV disease in kidney recipients in Kuwait. FEMS Immunol Med Microbiol 2003, 35, 125-130.
28. Binder, T., Siegert, W., Kruse, A., Oettle, H., et. al. Identification of human cytomegalovirus variants by analysis of single strand conformation polymorphism and DNA sequencing of the envelope glycoprotein B gene region-distribution frequency in liver transplant recipients. J Virol Methods 1999, 78, 153-162.
29. Vogelberg, C., Meyer-König, U., Hufert, F.T., Kirste, G., von Laer, D. Human cytomegalovirus glycoprotein B genotypes in renal transplant recipients. J Med Virol 1996, 50, 31-34.
30. Coaquette, A., Bourgeois, A., Dirand, C., Varin, A., et. al. Mixed cytomegalovirus glycoprotein B genotypes in immunocompromised patients. Clin Infect Dis 2004, 39, 155-161.
31. Puchhammer-Stückl, E., GŲrzer, I., Zoufaly, A., Jaksch, P., et. al. Emergence of multiple cytomegalovirus strains in blood and lung of lung transplant recipients. Transplantation 2006, 81, 187-194.
32. Sarcinella, L., Mazzulli, T., Willey, B., Humar, A. Cytomegalovirus glycoprotein B genotype does not correlate with outcomes in liver transplant patients. J Clin Virol 2002, 24, 99-105.
33. Fries, B.C., Chou, S., Boeckh, M., Torok-Storb, B. Frequency distribution of cytomegalovirus envelope glycoprotein genotypes in bone marrow transplant recipients. J Infect Dis 1994169, 769-774.
34. Torok-Storb, B., Boeckh, M., Hoy, C., Leisenring, W., et. al. Association of specific cytomegalovirus genotypes with death from myelosuppression after marrow transplantation. Blood 1997, 90, 2097-2102.
35. Meyer-König, U., Vogelberg, C., Bongarts, A., Kampa, D., et. al. Glycoprotein B genotype correlates with cell tropism in vivo of human cytomegalovirus infection. J Med Virol 1998, 55, 75-81.
36. Rosen, H.R., Corless, C.L., Rabkin, J., Chou, S. Association of cytomegalovirus genotype with graft rejection after liver transplantation. Transplantation 1998, 66, 1627-1631.
37. Hebart, H, Greif, M, Krause, H, Kanz, L, et. al. Interstrain variation of immediate early DNA sequences and glycoprotein B genotypes in cytomegalovirus clinical isolates. Med Microbiol Immunol 1997, 186, 135-138.
38. Woo, P.C., Lo, C.Y., Lo, S.K., Siau, H., et. al. Distinct genotypic distributions of cytomegalovirus (CMV) envelope glycoprotein in bone marrow and renal transplant recipients with CMV disease. Clin Diagn Lab Immunol 1997, 4, 515-518.
39. Retiťre, C., Lesimple, B., Lepelletier, D., Bignon, J. D., et. al. Association of glycoprotein B and immediate early-1 genotypes with human leukocyte antigen alleles in renal transplant recipients with cytomegalovirus infection. Transplantation 2003, 75, 161-165.
40. Roubalová, K., Žufanová, S., Vítek, A., Staňková, M. zastoupení různých genotypů glykoproteidu gB u pacientů s vysokým rizikem symptomatické infekce lidským cytomegalovirem (CMV). Epidemiol Mikrobiol Imunol 2009, 58, 148-153.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2010 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Vzpomínka na MUDr. Františka Galliu(k 60. výročí jeho úmrtí)
- Mobilní genetické elementy v epidemiologii rezistence bakterií k antibiotikům
- Oportúnne patogénna kvasinka Candida glabrata a jej mechanizmy rezistencie voči antimykotikám (súborný referát)
- Citlivosť kmeňov Staphylococcus aureus rastúcich v biofilme na vankomycín, gentamicín a rifampicín
- Zemřel prof. MUDr. Jiří Horáček, CSc. (24. 3. 1941 – 28. 3. 2010)
- Staphylococcus saprophyticus – jeho rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných z moče
- Genotypizace virového glykoproteinu B (gB) u příjemců transplantátu kmenových buněk krvetvorby s aktivní infekcí cytomegalovirem – sledování vlivu genotypů na průběh infekce
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Staphylococcus saprophyticus – jeho rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných z moče
- Oportúnne patogénna kvasinka Candida glabrata a jej mechanizmy rezistencie voči antimykotikám (súborný referát)
- Mobilní genetické elementy v epidemiologii rezistence bakterií k antibiotikům
- Citlivosť kmeňov Staphylococcus aureus rastúcich v biofilme na vankomycín, gentamicín a rifampicín
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



