-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Meňavky rodu Acanthamoeba – pôvodcovia infekcií človeka
Amoebae of the Genus Acanthamoeba – Causative Agents of Human Infections
Amoebae of the genus Acanthamoeba Volkonsky, 1931 are ubiquitous, amphizoic organisms with a cosmopolitan distribution. Pathogenic strains are the causative agents of a difficult to treat disease, granulomatous amoebic encephalitis (GAE), and skin infections in immunocompromised individuals, and of a painful corneal disease – amoebic keratitis (AK) in immunocompetent individuals. The major portals of entry are the nasopharyngeal mucosa, pulmonary parenchyma, skin lesions (GAE, skin infections), eyes in contact lenses wearers with a history of improper contact lens wear and care, or corneal trauma (AK). Symptoms of the diseases are non-specific and variable which alongside with the lack of awareness among health care professionals often hamper early diagnosis. While treatment options for GAE and skin infections are limited and poorly effective, various antifungals and antimicrobials have proved beneficial in AK, although the therapy is often complicated and long.
Key words:
Acanthamoeba – GAE – AK – epidemiology – pathogenesis – diagnostics
Autori: M. Garajová; M. Mrva
Pôsobisko autorov: Katedra zoológie, Prírodovedecká fakulta, Univerzita Komenského v Bratislave
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 60, 2011, č. 3, s. 121-130
Súhrn
Meňavky rodu Acanthamoeba Volkonsky, 1931 sú ubikvistické organizmy, s amfizoickým spôsobom života a kozmopolitným výskytom. Patogénne kmene sú pôvodcami ťažko liečiteľného ochorenia – granulomatóznej meňavkovej encefalitídy (GAE) a kožných infekcií u imunosuprimovaných pacientov a bolestivého ochorenia rohovky – akantamébovej keratitídy (AK) u imunokompetentných jedincov. Predpokladanou vstupnou bránou infekcie je nazofaryngeálna sliznica, pľúcny parenchým, infekcia z kožných lézií (GAE, kožné infekcie), nedostatočná hygiena pri používaní kontaktných šošoviek alebo pri korneálnej traume (AK). Symptómy jednotlivých ochorení sú nešpecifické a často veľmi variabilné, čo spolu s nedostatočnou informovanosťou odbornej verejnosti výrazne sťažuje včasné určenie správnej diagnózy. Kým v prípade GAE a kožných infekcií sú možnosti terapie obmedzené a málo úspešné, v prípade AK bolo úspešne použitých viacero typov antimykotík a antibiotík, avšak terapia je často veľmi komplikovaná a zdĺhavá.
Kľúčové slová:
Acanthamoeba – GAE – AK – epidemiológia – patogenéza – diagnostikaÚvod
Voľne žijúce meňavky rodu Acanthamoeba Volkonsky, 1931 patria k najvýznamnejším patogénom spomedzi amfizoických meňaviek už aj preto, že v tomto rode je zahrnutá väčšina druhov, ktoré spôsobujú ochorenia človeka. Sú pôvodcami väčšiny prípadov ochorení spôsobovaných voľne žijúcimi meňavkami. Ďalším dôvodom je aj to, že meňavky rodu Acanthamoeba sú pravdepodobne v prírode najčastejšie sa vyskytujúce meňavky, dá sa dokonca povedať, že sú to najbežnejšie Protista vôbec [51]. Okrem vodných a pôdnych biotopov sú často izolované v antropogénnych biotopoch s dostatkom vlhkosti a potravy.
Patogenita niektorých kmeňov vyvolala od začiatku veľký záujem o meňavky rodu Acanthamoeba. Za posledných štyridsať rokov výskum veľmi pokročil, boli skúmané morfologické, cytologické, fyziologické charakteristiky rôznych druhov. Najväčší záujem sa však sústredil na vyšetrovanie, diagnostiku a terapiu meňavkami spôsobených ochorení, ako aj na stále nedostatočne preskúmané mechanizmy patogenézy.
Meňavky rodu Acanthamoeba sú pôvodcami granulomatóznej encefalitídy (GAE), akantamébovej keratitídy (AK), kožných, nazofaryngeálnych a systémových infekcií [24, 28, 34, 51, 58].
Morfológia a životný cyklus meňaviek rodu Acanthamoeba
Trofozoity meňaviek rodu Acanthamoeba v lokomočnej forme sú typické trojuholníkovým, oválnym alebo obdĺžnikovým tvarom bunky s výrazne zúženým zadným koncom (obr. 1A). Dosahujú veľkosť iba 10–40 μm [5, 28, 30, 40, 44]. Okraj hyalínnej zóny cytoplazmy na prednom konci bunky je nepravidelný a vybiehajú z nej tenké, na konci zašpicatené ihlicovité akantopódie [43, 51]. Akantopódie sú produkované aj na rôznych miestach povrchu celej bunky, a vytvárajú tak pre meňavky typický vzhľad [39, 48]. Ich funkcia je neznáma. Predpoklad, že slúžia pre príjem potravy, nebol potvrdený. Okrem akantopódií sa najmä na prednom okraji bunky niekedy vytvárajú aj menšie subpseudopódie so zaoblenými koncami. Zúžený zadný koniec bunky je niekedy ukončený bulbovitým uroidom s krátkymi filamentami, na ktoré sú často adherované baktérie a detrit [40, 44].
Obr. 1. Klinický izolát Acanthamoeba lugdunensis z prípadu akantamébovej keratitídy. A – trofozoity in vivo, B – cysty po protargolovej impregnácii. Mierka je 10 μm. Fig. 1. Clinical isolate of Acanthamoeba lugdunensis from a case of Acanthamoeba keratitis A – trophozoites in vivo, B – protargol impregnated cysts. Scale bar is 10 μm. 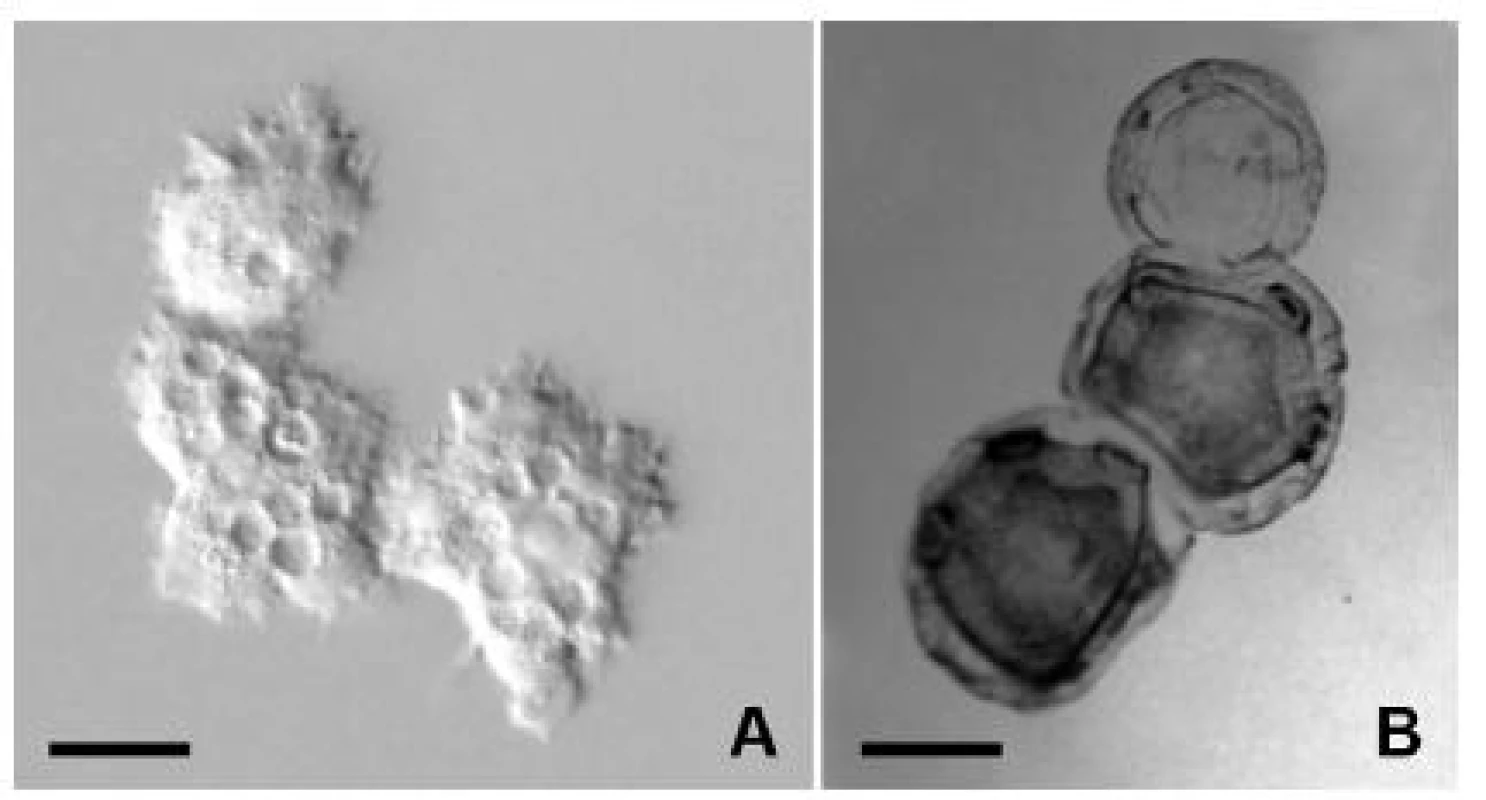
Meňavky rodu Acanthamoeba majú cytoplazmatickú membránu bez extracelulárneho materiálu alebo len s náznakmi glykokalyxu. Cytoplazma je podobne ako u iných skupín nahých meňaviek v dvoch formách, vytvára sklovitú hyaloplazmu a zrnitú granuloplazmu s obsahom organel. Vezikulárne jadro je sférické, vo vnútri s masívnym jadierkom. Veľkosť jadra zväčša dosahuje 5–8 μm, jadierka okolo 2,5 μm [30]. Jedince majú väčšinou jedno jadro, viacjadrové jedince sa objavujú zvyčajne len v in vitro suspenzných kultúrach [28]. Jediná pulzujúca vakuola je v zadnej časti bunky. Potravné vakuoly často vypĺňajú väčšinu objemu cytoplazmy. Ostatné organely sú typickej eukaryotickej stavby. Celková morfológia trofozoitov a cýst je ilustrovaná klinickým izolátom Acanthamoeba lugdunensis (obr. 1A, B) z prípadu AK, identifikovaným na úroveň druhu na základe morfologických kritérií a tolerancie kultivačných teplôt [36].
Štádium pseudocysty je rýchlou obrannou reakciou trofozoita na prítomnosť niektorých organických zlúčenín. Pre pseudocystu je typický guľovitý tvar a cytoplazmatická membrána krytá jednovrstvovým amorfným obalom. Vytvára bariéru voči alkalickému pH (8–11) a zvýšenej teplote. Pseudocysty odolávajú teplote 55 °C až 10 minút [20, 21].
V prípade nedostatku potravy a vysychania biotopu, resp. v chronicky infikovanom tkanive trofozoity postupne encystujú. Cysty meňaviek rodu Acanthamoeba dosahujú veľkosť 10–22 μm a majú stenu skladajúcu sa z vnútornej endocysty a vonkajšej ektocysty [5, 48]. Charakteristické je, že endocysta a ektocysta sú spojené zväčša len na miestach uhlov alebo vo vrcholoch ramien endocysty, kde sa nachádzajú póry uzavreté operkulom (obr. 1B). Cysty sú potom veľmi často polyedrické a nepravidelné, menej často sú oválne či sférické [40, 43, 44, 45]. V zrelej cyste ustáva akákoľvek metabolická činnosť a cysta je pripravená prečkať dlhé obdobie v dormantnej fáze [28]. Priebeh encystácie je pomalý, trvá minimálne 24 hodín [20].
Cysty sa vyznačujú veľkou odolnosťou voči teplote, UV žiareniu a dezinfekčným látkam [9]. Odolnosť jednotlivých druhov na zvýšenú teplotu sa významne líši a závisí aj od experimentálnych podmienok. Cysty Acanthamoebacastellanii (Douglas, 1930) v tekutom médiu prežívali pri teplote 55 °C až 7 hodín. Iný druh, Acanthamoeba palestinensis (Reich, 1933) prežíval v suchej pôde pri 75 °C až 6 hodín. Vo vlhkej pôde boli cysty oveľa citlivejšie a prežívali pri 65 °C len 1 hodinu. Spoľahlivá deštrukcia cýst sa dá dosiahnuť použitím freónu, metylén oxidu alebo autoklávovaním. Vitalita cýst môže dosiahnuť až niekoľko rokov. Cysty uskladnené 24 rokov vo vode pri teplote 4 °C sa podarilo opätovne kultivovať na agare, pričom niektoré kmene si zachovali aj patogenitu [28].
Potravou meňaviek rodu Acanthamoeba v ich prirodzenom prostredí sú prevažne baktérie, ktoré sú meňavkami fagocytované a sú tiež využívané pri kultiváciách [12, 39]. Fagocytóza nastáva v mieste, kde sa vytvorí špecifická štruktúra, v literatúre označovaná „food cup“. V tkanivových kultúrach trofozoity meňaviek niekedy atakujú hostiteľské bunky dlhým výbežkom, ktorý sa označuje ako digitipódium [28]. Dôkazom difúzneho a pinocytárneho príjmu živín sú práve axenické kultúry, v ktorých sa meňavky živia výlučne rozpustenými živnými roztokmi s obsahom peptónu, kvasničného extraktu, krvného séra a podobne [12, 40].
V posledných rokoch sú meňavky vnímané ako významní rezervoároví hostitelia a vektory patogénnych baktérií. Nahé meňavky tak môžu byť akýmsi „Trójskym koňom“, sprostredkovateľom, ktorý zodpovedá za ich šírenie a ochranu pred dezinfekčnými látkami vo vodných systémoch [24, 54, 57]. Bolo zistené, že 20–24 % klinických a environmentálnych izolátov Acanthamoeba spp. má v cytoplazme endosymbiotické baktérie. Najznámejším endosymbiontom je Legionella pneumophila, pôvodca legionárskej choroby. Tieto baktérie sú vysoko rezistentné na dezinfekčné látky, čo môže byť podporené aj ich endosymbiotickým stavom v cytoplazme meňaviek. K ďalším bakteriálnym endosymbiontom zisteným z environmentálnych, ale aj klinických izolátov Acanthamoeba patria Chlamydophila pneumoniae, Staphylococcus aureus, Mycobacterium avium, Pseudomonas aeruginosa, Campylobacter jejuni, Listeria monocytogenes, Vibrio cholerae, Salmonella enterica, Shigella sonnei, Simkania negevensis, Parachlamydia acanthamoebae, Helicobacter pylori. Experimentálnou ko-kultiváciou sa podarilo vpraviť do meňaviek rodu Acanthamoeba patogénny kmeň E. coli K1 a obligatórne intracelulárnu baktériu Coxiella burnetii, pôvodcu Q horúčky [24, 26].
Všetky spomenuté baktérie sú patogénmi alebo potenciálnymi patogénmi, ktoré môžu spôsobiť nebezpečné ochorenia človeka [4, 25, 54]. Bolo zistené, že bakteriálne endosymbionty majú niekedy vplyv na zvýšenie virulencie kmeňov Acanthamoeba [57].
Ekológia a rozšírenie
Vzťahy jednotlivých druhov a ich životného prostredia nie sú celkom objasnené [4]. Meňavky rodu Acanthamoeba sú považované za najčastejšie izolované a najbežnejšie spomedzi všetkých nahých meňaviek. Sú považované za ubikvistické druhy, keďže boli zistené v sladkých vodách [19, 32, 39, 42], v morskej vode [48, 49], v pôde [40]. Nájdené boli aj v komposte, kvetináčovej pôde, vzduchu, klimatizačných zariadeniach, ventilátoroch, domácich akváriách, vodovodnej vode, sprchových hlaviciach, priemyselných chladiacich sústavách, krytých bazénoch, liečebných bazénoch, dialyzačných prístrojoch, puzdrách na kontaktné šošovky či ako kontaminanty bakteriálnych a tkanivových kultúr [6, 9, 13, 18, 24, 51, 53]. Zaujímavé nálezy pochádzajú dokonca z pletiva rastlín a húb [9].
Vzhľadom k príležitostnému výskytu týchto voľne žijúcich meňaviek v telách živočíchov a človeka ich označujeme ako amfizoické [38], podobne ako meňavky ďalších rodov Naegleria (Alexeieff, 1912), Balamuthia Visvesvara, Schuster & Martinez, 1993, Sappinia Dangeard, 1896, Hartmannella (Alexeieff, 1912), Vannella Bovee, 1965 [34, 39]. Meňavky rodu Acanthamoeba boli izolované zo zvieracích vnútorných orgánav, napríklad z mozgu, pečene, sleziny a obličiek rýb [10], z pľúc dobytka a čreva žeriava [38]. Menej sú známe izoláty z tiel plazov [9]. Izolácie z rôznych orgánov človeka sú známe už približne štyridsať rokov. Vďaka izoláciám z nosovej dutiny zdravých ľudí bola vyslovená domnienka, že môžu byť aj súčasťou fyziologickej mikroflóry [8, 29]. Doposiaľ to však nebolo potvrdené a predpokladá sa, že cysty z prostredia sú počas respirácie v kontaminovanom ovzduší bežne zachytávané na sliznici [46].
Kmene, ktoré sú schopné rásť pri zvýšených teplotách, sú preukazne viac patogénne než ostatné [6, 13]. Mnohé sa množia len pri teplotách do 37 °C, ale niektoré dokonca aj pri 40 °C. Keďže rohovka oka človeka sa vyznačuje nižšou teplotou než vnútorné orgány, je pochopiteľné, že virulentnými sú aj niektoré kmene neschopné rásť pri teplotách nad 37 °C a riziko infekcie z vonkajšieho prostredia stúpa [9].
Percento termotolerantných kmeňov Acanthamoeba, izolovaných z biotopu, býva často veľmi vysoké. Z kmeňov izolovaných z rybníkov v Oklahome bolo až 90 % termotolerantných, pričom 2 % z nich bolo patogénnych pre myši. V zdrojoch pitnej vody v Nemecku bolo zistených 55–80 % kmeňov ako termotolerantných [51].
Cysty meňaviek rodu Acanthamoeba sa vyznačujú mimoriadnou odolnosťou, čo je pravdepodobne hlavným faktorom celosvetovo narastajúceho počtu prípadov akantamébových keratitíd. Odolávajú veľkému počtu dezinfekčných roztokov na kontaktné šošovky a spoľahlivá je iba tepelná dezinfekcia. Pokiaľ roztok eliminuje len trofozoity, ale nie cysty, po určitom čase, keď dôjde k oslabeniu jeho dezinfekčných schopností, nastáva excystácia a zvýšené riziko infekcie [9, 34].
Zvýšený záujem o patogénne kmene viedol k publikovaniu množstva prác prakticky zo všetkých obývaných oblastí sveta. Druhy rodu Acanthamoeba sú považované za kozmopolitné [28, 51] a boli nájdené v mnohých krajinách všetkých svetadielov, vrátane Antarktídy [24, 30].
Taxonómia a systematika
Identifikácia meňaviek rodu Acanthamoeba je stále nedoriešeným problémom. Nedostatky taxonomických kritérií, napriek viacerým snahám [44, 50], neumožňujú spoľahlivú identifikáciu väčšiny izolátov na úroveň druhov [9]. Na základe morfológie cýst Pussard a Pons [45] rozdelili druhy do troch skupín označených rímskymi číslicami I., II., III. Tento systém sa dodnes používa [39, 40, 51, 60]. Druhy skupiny I. sa vyznačujú hviezdicovitým tvarom endocysty s niekoľkými ramenami a pomerne hladkou, guľovitou ektocystou. Skupina II. je typická polyedrickou, resp. hviezdicovitou endocystou s tromi a viac výbežkami a silne zvlnenou, nepravidelnou alebo guľovitou ektocystou. Skupina III. má endocystu aj ektocystu hladkú a sférickú, bez viditeľných ramien alebo vrcholov endocysty [39, 40]. Vzhľadom k veľmi malým rozdielom v morfológii cýst a množstvu prechodných foriem sa v súčasnosti často používa identifikácia na základe variability v sekvenciách jadrovej 18S rRNA. Na základe tejto variability sa v súčasnosti rozlišuje 15 odlišných evolučných línií, označovaných T1–T15. Variabilita v kultivačných teplotách, morfológií cýst, patogenite a fragmentoch rDNA v rámci toho istého druhu však výrazne sťažuje identifikáciu [22, 51].
Systematické postavenie meňaviek rodu Acanthamoeba je už dlhé roky pomerne stabilné. Na základe najnovších štúdií je čeľaď Acanthamoebidae umiestňovaná do nadskupiny Amoebozoa spoločne s ďalšími meňavkovitými organizmami [1], alebo do kmeňa Acanthamoebia v rámci podríše Lobosea a ríše Amoebozoa [31]. V súčasnosti sa do čeľade Acanthamoebidae zaraďuje aj ďalšia patogénna amfizoická meňavka Balamuthia mandrillaris Visvesvara, Schuster & Martinez, 1993, ktorá je síce morfologicky veľmi odlišná, ale na základe molekulárnych analýz je príbuzná meňavkám rodu Acanthamoeba [1, 51].
Na základe morfologickej identifikácie, doposiaľ zistené patogénne kmene patria k nasledovným druhom: Acanthamoeba astronyxis (Ray & Hayes, 1954), A. castellanii (Douglas, 1930), A. culbertsoni (Singh & Das, 1970), A. griffini Sawyer, 1971, A. hatchetti Sawyer, Visvesvara & Harke, 1977, A. healyi Moura, Wallace & Visvesvara, 1992, A. lugdunensis Pussard & Pons, 1977, A. palestinensis (Reich, 1933), A. polyphaga (Puschkarew, 1913), A. quina Pussard & Pons, 1977, A. rhysodes (Singh, 1952) [33, 40]. Z hľadiska 18S rRNA patrí väčšina patogénnych izolátov spôsobujúcich GAE a AK do genotypu T4 [3, 24, 51, 58]. K zriedkavým genotypom asociovaným s AK patrí T2, T3, T5, T6, T11 [24, 60] a k zriedkavým genotypom asociovaným s nonkeratitídnymi infekciami patria T1, T2, T10, T12 [3, 24, 59].
Ochorenia spôsobované meňavkami rodu Acanthamoeba
Prvé infekcie človeka boli zaznamenané až po roku 1965 hoci už predtým boli meňavky rodu Acanthamoeba zistené ako kontaminanty tkanivových kultúr [61]. Do roku 1984 bolo publikovaných iba 20 prípadov infekcie človeka [9], no ich počet neustále rastie. Patogénne kmene meňaviek rodu Acanthamoeba spôsobujú viaceré závažné ochorenia človeka: granulomatóznu meňavkovú encefalitídu (GAE), akantamébovú keratitídu (AK), nazofaryngeálne, kožné i roztrúsené infekcie [24, 51].
Granulomatózna meňavková encefalitída (GAE)
Granulomatózna meňavková encefalitída (GAE) je chronické dlhotrvajúce ochorenie CNS so zlou prognózou, vyskytujúce sa najmä u imunosuprimovaných osôb ako napríklad HIV pozitívnych, u pacientov s Hodgkinovou chorobou, SLE, diabetikov, u osôb so zlyhaním obličiek, cirhózou, TBC a kožnými vredmi. Rizikovou skupinou sú závislí na alkohole, narkotikách, pacienti liečení steroidmi, chemoterapiou a rádioterapiou a pacienti po transplantáciách. Zriedkavo sa však toto ochorenie vyskytuje aj u imunokompetentných detí i dospelých [23, 24, 28, 29, 34, 51, 58].
Epidemiológia GAE
Predpokladanou vstupnou bránou infekcie je väčšinou pľúcny parenchým alebo infekcia z kožných lézií [23]. Predpokladá sa, že infekcia môže zriedkavo nastať aj cez nazofaryngeálnu sliznicu, čo bolo potvrdené experimentálnymi infekciami laboratórnych zvierat [24]. Prístup do CNS môže byť sprostredkovaný prostredníctvom obehového systému alebo ide o priamy prechod po nervus olfactorius do čuchového laloku predného mozgu [28]. V prípade infekcie prostredníctvom obehového systému sa meňavky dostávajú cez horné a dolné dýchacie cesty až do pľúc, kde prechádzajú do krvného obehu a šíria sa hematogénnou cestou. Meňavky prechádzajú hematoencefalickou bariérou z ciev vyživujúcich mozog do mozgového tkaniva. Vysokú pravdepodobnosť tohto typu šírenia dokazuje distribúcia lézií v CNS a nahromadenie trofozoitov v perivaskulárnom priestore [24]. Pokiaľ je vstupnou bránou infekcie kožná lézia, meňavky sa priamo z kože dostávajú do krvného obehu [23]. Klinické príznaky GAE sa objavia zväčša o niekoľko týždňov alebo mesiacov [28, 51].
Patogenéza GAE
Okrem klinických pozorovaní je veľmi málo informácií o patogenéze infekcie a o odpovedi hostiteľa na infekciu. Pri prekonávaní hematoencefalickej bariéry môžu trofozoity meňaviek prechádzať z ciev do mozgového parenchýmu buď priamo deštrukciou buniek endotelu – transcelulárne, alebo cez ich intracelulárne priestory – paracelulárne, pričom narúšajú iba bunkové spoje endotelu [22, 23]. Pri transcelulárnom spôsobe je dôležitý kontakt s endotelovými bunkami sprostredkovaný manózu-viažúcim proteínom exprimovaným na pelikule trofozoita [22]. Tento kontakt indukuje apoptózu buniek. Apoptóza začína zmenami v hladine iónov Ca2+, ktoré spôsobujú zmeny v cytoskelete a morfológii bunky. Mení sa aj permeabilita cytoplazmatickej membrány a smrť bunky nastáva po niekoľkých minútach. Tieto procesy nastávajú len v prípade kontaktu trofozoitu s hostiteľovou bunkou. U cýst nie je manózu-viažúci proteín prítomný, preto nemôžu adherovať k bunkám tkaniva [23, 24]. Okrem apoptózy adhézia trofozoitu k endotelovej bunke môže viesť sekundárne aj k fagocytóze.
Paracelulárne prekonanie hematoencefalickej bariéry zabezpečujú pravdepodobne extracelulárne proteázy, ktoré v experimentálnych podmienkach spôsobujú deštrukciu jednovrstvy endotelových buniek. Trofozoity produkujú množstvo rôznych enzýmov, najmä serínových proteáz, ktoré degradujú extracelulárnu matrix, fibrinogén, IgG, IgA, albumín a hemoglobín. Vplyv proteáz vysvetľuje rozrušovanie bunkových spojov a migráciu trofozoitov do hlbších vrstiev CNS [23]. Pre patogénne kmene je typická vysoká produkcia týchto proteáz na rozdiel od kmeňov izolovaných z vonkajšieho prostredia [47]. Cytopatický efekt a adherenciu trofozoitov rôznych kmeňov Acanthamoeba spp. k bunkám hostiteľských tkanív sledovali OmaĖa-Molina et al. [35], ktorí zistili, že maximálna adherencia trofozoitov k bunkám MDCK (psie obličkové bunky) nastáva už po 3 hodinách kultivácie. Po šiestich hodinách nasleduje lýza buniek a ich uvoľňovanie sa od podkladu. Úplná deštrukcia vrstvy vplyvom lytických enzýmov a fagocytózy nastáva do 24 hodín [16].
Napriek uvedeným poznatkom nie je objasnené, či je masívna nekróza mozgového tkaniva spôsobená priamou deštrukciou trofozoitmi meňaviek alebo indukovaná zápalovými cytokínmi, napríklad IL 1 a TNF-α [28].
Symptómy a priebeh GAE
Typickými symptómami GAE sú: abnormality v správaní u 86 % pacientov, horúčka (39–40 °C) u 53 % pacientov, ochrnutie nervov u 53 % pacientov, bolesti hlavy u 53 % pacientov, meningitída u 40 % pacientov, poruchy videnia (diplopia) u 25 % pacientov, ataxia a afázia u 20 % pacientov, nauzea u 20 % pacientov, zmätenosť, letargia, stuhnutie šije, zvýšený intrakraniálny tlak. Menej častými príznakmi sú halucinácie, fotofóbia, poruchy spánku, anorexia, Babinského symptóm a Kernigov symptóm [23, 28, 29]. Priebeh ochorenia sa však často u jednotlivých pacientov veľmi líši a dokonca niekedy je celkom asymptomatický [51].
U imunosuprimovaných jedincov môže dôjsť k zaneseniu trofozoitov do kože a podkožného tkaniva, pečene, pankreasu, obličiek, nadobličiek, prostaty, lymfatických uzlín, myometria, trachey a do pľúc. Pri infekcii pľúc dochádza k vývinu zápalu a v alveolách sú prítomné trofozoity i cysty meňaviek. Boli zistené aj infekcie ucha a dokonca druh A. castellanii bol izolovaný z nekrotického kostného tkaniva pacienta s osteomyelitídou [23, 29].
U HIV pozitívnych pacientov je priebeh ochorenia špecifický. Inkubačna doba je skrátená a ochorenie má v dôsledku nedostatočnej imunitnej odpovede rýchly progres. Väčšina pacientov zomiera do jedného mesiaca od nastúpenia prvých príznakov. Časté sú sekundárne prejavy, ako je sinusitída, otitída a kožné lézie, z ktorých je možné izolovať meňavky. Zriedka sa vyskytne aj osteomyelitída a endoftalmitída [29, 30].
Patologické nálezy sú typické ťažkými hemoragickými nekrózami, trombózou a zápalom. Mozgové hemisféry sú postihnuté edémom. Vytvára sa množstvo lokálnych ložísk v mozgovom kmeni, v corpus callosum a v mozočku. Zriedkavo je postihnutá aj predná časť miechy. Chronický zápalový výpotok je pozorovateľný na povrchu kortexu a obsahuje hlavne leukocyty. V perivaskulárnom priestore ciev vyživujúcich mozog sa masovo nachádzajú trofozoity. Prítomná môže byť aj vaskulitída. V tkanive mozgu je možné pozorovať veľké množstvo trofozoitov a cýst meňaviek sústredených v granulómoch. Hemoragické nekrózy sa vyskytujú v okcipitálnom, parietálnom, temporálnom a zriedka frontálnom laloku oboch hemisfér. Stále však nie je jasné, prečo sú u imunokompetentných pacientov granulómy dobre ohraničené, zatiaľ čo u imunosuprimovaných pacientov granulómy chýbajú, alebo sú slabo vyvinuté [17, 23, 27, 28, 29, 34]. Počet zaznamenaných prípadov GAE po štyridsiatich rokoch je malý, v súčasnosti ich je evidovaných okolo 200 [58].
Diagnostika a terapia GAE
Diagnostika sa spočiatku okrem neurologických príznakov opiera o detekciu lézií v kortexe pomocou magnetickej rezonancie a počítačovej tomografie. Vhodné je histopatologické vyšetrenie lézií, napríklad fixácia napadnutého tkaniva 10 % roztokom formalínu a rutinné farbenie hematoxylínom a eozínom, PAS-H farbenie podľa Schiffa, farbenie podľa Giemsu-Wrighta alebo Gomoriho farbenie s methenamin-striebrom. Použiteľná je aj nepriama imunofluorescenčná metóda (IFAT) dôkazu meňaviek v mozgovom tkanive fixovanom vo formalíne a zaliatom v parafíne [29]. Vyžaduje sérum s obsahom špecifických protilátok [24], ktoré však nie je komerčne dostupné. Z novších metód je čoraz viac používanou extrakcia DNA a následná PCR amplifikácia [27]. Tradičnou a spoľahlivou metódou, je kultivačný dôkaz meňaviek z biopsie mozgového tkaniva. Meňavky rodu Acanthamoeba sa bežne darí kultivovať na rôznych typoch monoxenických a axenických médií [41], najčastejšie používanými sú agarové platne s náterom kultúry Escherichia coli, prípadne Enterobacter aerogenes [34]. Kultivácia prebieha pri 37 °C.
Terapia GAE neprináša zatiaľ dobré výsledky. Je to spôsobené prevažne neskorým stanovením správnej diagnózy, oslabenou imunitou pacienta, nízkou senzitivitou meňaviek na liečivá a nedostatočnou penetráciou liečiv cez hematoencefalickú bariéru. S rôznym úspechom boli vyskúšané liečivá ako ketokonazol, flukonazol, itrakonazol, pentamidín izetionát, trimetoprim-sulfametoxazol, sulfadiazín, amfotericín B a flucytozín, ktoré však majú často ťažké vedľajšie účinky. V menej než desiatich úspešných prípadoch bola použitá kombinácia niekedy až piatich liečiv. Osvedčili sa kombinácie trimetoprim-sulfametoxazol s ketokonazolom a rifampicínom, kombinácia penicilínu a chloramfenikolu, kombinácia flukonazolu a sulfadiazínu [15, 24, 52, 58]. Ako perspektívny sa ukazuje úspešne použitý miltefosín [2]. Keďže doposiaľ nebolo vyvinuté liečivo s dostatočným trofocídnym ako aj cysticídnym účinkom, ďalšie možné terapeutiká sú v štádiu testovania [52].
Kožné infekcie
Kožné infekcie spôsobené meňavkami rodu Acanthamoeba sú zriedkavou formou ochorenia, hoci u pacientov s AIDS sa vyskytujú pomerne často. Infekcia CNS sa nemusí vôbec objaviť. Prvý prípad u HIV pozitívneho pacienta bol opísaný až v roku 1986, neskôr sa objavili aj ďalšie [55]. Kožné infekcie voľne žijúcimi meňavkami boli zistené aj u HIV negatívnych pacientov s prejavmi GAE, u pacientov po orgánových transplantáciách a u pacientov s poruchami imunity. Sú charakteristické ťažkým erytémom alebo kožnými ulceráciami s chronickým priebehom [24]. Doposiaľ bolo opísaných minimálne 23 prípadov [14, 55].
Epidemiológia a patogenéza kožných infekcií
Predpokladá sa, že infekcia nastáva pri kožných poraneniach znečistených kontaminovanou vodou alebo pôdou. Meňavky sa hematogénne môžu šíriť až do mozgu a vyvolať GAE. Vzhľadom k malému počtu zachytených prípadov, mechanizmy patogenézy kožných infekcií sú slabo preskúmané [22, 24]. Základné poznatky sú uvedené v kapitole o patogenéze GAE.
Symptómy a priebeh kožných infekcií
Skoré prejavy zahŕňajú vznik tvrdých papúl či uzlíkov s hnisavým výtokom, ktoré sa postupne zmenia na nehojace sa stvrdnuté vredy. Ulcerácie sú lokalizované najmä na tvári, trupe a končatinách. Stále nie je objasnené, či sú kožné lézie primárnym ložiskom infekcie alebo naopak, výsledkom rozšírenia infekcie z CNS prípadne z pľúc. V prípade neurologických prejavov ich infekcia kože predchádza o niekoľko týždňov či mesiacov a otvára tým možnosti skorej diagnózy a potenciálnej liečby GAE [55]. Mortalita dosahuje vysoké percentá, v prípade výskytu výlučne kožných lézií je 73-%, a v prípade prepuknutia GAE až 100-% [28, 55].
Diagnostika a terapia kožných infekcií
Najdôležitejším diagnostickým krokom je podrobné histopatologické zhodnotenie. V histologických nálezoch sú viditeľné nekrotické ložiská obklopené leukocytmi a lymfocytmi, vaskulitída, ďalej trofozoity a cysty meňaviek, ktoré sú často ťažko identifikovateľné. Trofozoity a cysty meňaviek sú lokalizované najmä v okolí krvných a lymfatických ciev a v podkožnom tukovom tkanive [55]. V niektorých prípadoch môžu tieto infekcie pripomínať mykózy, infekcie mykobaktériami a vírusové infekcie. Pri diagnostike je možné pomýliť si trofozoity aj s makrofágmi. Viacero prípadov bolo takto nesprávne determinovaných [28]. Tento problém je možné eliminovať kultivačným dôkazom meňaviek na agarových platniach, analogicky ako pri GAE [34].
Možnosti terapie sú zatiaľ veľmi málo preskúmané a bez väčších úspechov. Známe sú len tri úspešné vyliečenia, pri ktorých boli použité kombinácie liečív: itrakonazol, pentamitín izetionát, 5-fluocytosine, chlorhexitín glukonát, klotrimazol, neomycin, sulfadiazin, kanamycin a ketokonazol [28, 52, 55].
Akantamébová keratitída (AK)
Akantamébová keratitída (AK) je väčšinou bolestivé ochorenie rohovky vážne ohrozujúce zrak, hoci sú známe aj prípady kedy pacient neudával bolesť. Infekcia nastáva po mechanickom poškodení rohovky alebo častejšie pri nedostatočnej hygiene spojenej s používaním kontaktných šošoviek [36, 51, 56]. Prvé prípady akantamébovej keratitídy boli publikované z Veľkej Británie v roku 1974 a USA v roku 1975 [28]. Ochorenie je progresívne, veľmi bolestivé a vážne ohrozuje zrak. Môže nastať až oslepnutie [13]. Na rozdiel od GAE sú postihnutí zväčša imunokompetentní jedinci.
Epidemiológia AK
Pri korneálnej traume sa meňavky priamo dostávajú na povrch alebo až do strómy poškodenej rohovky, napr. z kontaminovanej vody. Pri infekcii prostredníctvom kontaktných šošoviek je zdrojom zväčša roztok na odkladanie šošoviek s nedostatočným mikrobicídnym účinkom [28, 53]. V kontaminovanom puzdre sa môže vytvoriť bakteriálny biofilm, ktorý je potravou pre trofozoity meňaviek. Synergickým efektom pôsobenia metabolitov sprievodných baktérií na rohovku sa môže ešte urýchliť uchytenie trofozoitov meňaviek. Vysoko rizikovým je používanie kontaktných šošoviek počas plávania, kde sa väčšinou vyskytuje bakteriálna mikroflóra a populácie meňaviek [6, 51]. Častý výskyt meňaviek rodu Acanthamoeba v nádržiach pre rozmanité domáce použitie sa podpísal pri zvýšenom výskyte AK vo Veľkej Británii (17–21 prípadov na milión obyvateľov). Celkový odhad vo svete predstavuje viac než 3000 evidovaných prípadov [34, 51].
Patogenéza AK
V patogenéze AK je najdôležitejšia adhézia trofozoitov meňaviek na epitel rohovky a ich postupné prenikanie do hlbších vrstiev, čo je sprostredkované manózu-viažúcim proteínom [22]. Trofozoity fagocytujú bunky hostiteľa a proteolytickými enzýmami spôsobujú rozpad bunkových spojov a extracelulárnej matrix. Sekundárne tiež vyvolávajú spustenie apoptózy napadnutých buniek. Postupným prenikaním do hĺbky rohovky môžu spôsobiť až jej perforáciu [24, 34].
Symptómy a priebeh AK
Typickými príznakmi ochorenia sú silné a prudké bolesti postihnutého oka, korneálny infiltrát, nepriehľadnosť rohovky, uvoľnený rohovkový epitel, začervenanie spojiviek, zápal skléry, fotofóbia, slzenie, neostré videnie, opuch a ptóza očných viečok a podráždenie [11, 28, 58].
Spočiatku sa meňavky dajú detegovať z vnútorných vrstiev epitelu rohovky, ale pri progrese ochorenia invadujú do nižšie uloženej strómy, spôsobujú jej ťažké poškodenie spojené so slabým až ťažkým zápalovým procesom. Najtypickejším symptómom meňavkovej keratitídy je cirkulárny stromálny infiltrát, ktorý je tvorený najmä polymorfonukleárnymi neutrofilmi a inými zápalovými bunkami [13]. V ťažkých prípadoch môžu trofozoity prechádzať až do korneálnych nervov a vyvolať neuritídu a nekrózu. Zriedkavo vyvolávajú aj chorioretinitídu. Pri ťažkom poškodení oka hrozí oslepnutie. Patologické príznaky zahŕňajú väčšinou akútny ako aj chronický zápal, redukciu strómy, zvredovatenie a perforácie [24, 34].
Diagnostika a terapia AK
Akantamébová keratitída býva často chybne diagnostikovaná ako atypická herpetická alebo mykotická keratitída. Komplikáciu v diagnostike predstavujú aj časté sekundárne bakteriálne infekcie. K nesprávnej diagnóze výrazne pomáha aj častá aplikácia antibiotík, antivirotík, antimykotík a kortikosteroidov, ktoré dočasne klinický obraz zlepšia. Včasné stanovenie diagnózy ochorenia je nesmierne dôležité, pretože meňavky encystujú v stróme rohovky a cysty sú veľmi odolné voči mnohým liečivám [13, 34]. Pri meňavkovej keratitíde nevzniká trvalá imunita a reinfekcie sú možné [28].
Mnoho hlásených prípadov bolo diagnostikovaných z histologických preparátov po keratoplastike alebo enukleácii oka [13]. Infiltrácia trofozoitov a cýst býva viditeľná v histologických rezoch farbených hematoxylínom a eozínom alebo farbených Trichrómom podľa Wheatleya. Použiteľné je aj farbenie Giemsovým farbivom, prípadne PAS H farbením podľa Schiffa [13]. Na vizualizáciu meňaviek v korneálnom zoškrabe je rozšírené používanie fluorescenčného farbenia pomocou „calcofluor white“ [11, 51].
Pri kultivačnom dôkaze meňaviek je potrebné nasadiť na kultiváciu korneálnu biopsiu alebo zoškrab a použité kontaktné šošovky. O niekoľko dní sú na kultivačnej pôde pozorovateľné trofozoity a neskôr aj cysty meňaviek. Pri mikroskopovaní kultúr je vhodné využitie fázového kontrastu alebo diferenciálneho interferenčného kontrastu, pretože cysty sú obzvlášť refraktilné [13].
K najnovším diagnostickým metódam s vysokou spoľahlivosťou patrí PCR [56, 58], ktorá však doposiaľ nie je rutinnou diagnostickou metódou [11]. Využitie sérologických metód v diagnostike amfizoických meňaviek nie je spoľahlivé. Keďže tieto ubikvistické organizmy sú rozšírené takmer v každom biotope, veľké množstvo ľudí má na ne vyvinutú protilátkovú odpoveď bez toho, aby sa u nich niekedy predtým prejavilo ochorenie [7, 13, 58]. V klinickej praxi je použiteľná na diagnostiku tandemová konfokálna mikroskopia (tandem scanning confocal microscopy), vyšetrovacia metóda, ktorá umožňuje neinvazívne vyšetrenie oka pacienta [58].
Terapia AK je komplikovaná už aj vďaka odolnosti meňaviek na bežne používané antibiotiká. Niektoré infekcie sa podarilo zlepšiť, či vyliečiť pomocou ketokonazolu, itrakonazolu, klotrimazolu, mikonazolu, neomycínu, neosporínu, gentamycínu, chlorhexidínu a propamidín izetionátu [11, 51, 52, 56]. Osvedčila sa najmä kombinácia topicky podávaného polyhexametylén biguanidu (alebo chlórhexidín diglukonátu) a propamidín izetionátu (alebo hexamidínu). Ako alternatíva je možná aj kombinácia propamidín izetionátu, neomycínu a bacitracínu [37] alebo neosporínu a mikonazolu [34]. Pri neskorom stanovení správnej diagnózy je veľmi často potrebná aj transplantácia rohovky, aby nedošlo k perforácii a strate zraku [11]. V zriedkavých prípadoch je jedinou možnosťou oko enukleovať [13, 28, 36, 58].
Infekcie meňavkami rodu Acanthamoeba na Slovensku
Na území Slovenska bolo doteraz zdokumentovaný len malý počet prípadov akantamébových infekcií. Doposiaľ nebol zaznamenaný alebo identifikovaný žiadny prípad GAE ani kožných infekcií [34]. Túto skutočnosť možno spojiť s nízkym počtom domácich bazénov na celkový počet obyvateľov, nízkym počtom HIV pozitívnych pacientov ale aj nedostatočnou informovanosťou lekárov.
Prvé prípady akantamébovej keratitídy na Slovensku boli zdokumentované len nedávno. Podrobné informácie o prvých piatich kazuistikách prezentovali Žiak et al. [62] a Ondriska et al. [36, 37]. V štyroch prípadoch išlo o nosičov kontaktných šošoviek, ktoré používali aj pri plávaní v kúpaliskách, bazénoch či dokonca v mori. V jednom prípade bola infekcia zrejme výsledkom poranenia a následného vymytia oka vodou z prírodnej studničky. V tomto prípade bol pôvodca infekcie identifikovaný neskoro, ani následná transplantácia rohovky stav nezlepšila a oko bolo nutné enukleovať. V ostatných prípadoch sa aplikáciou propamitín izetionátu a ďalších liečiv ako aj transplantáciou rohovky podarilo ochorenia vyliečiť.
Veľký výskyt prírodných termálnych prameňov na Slovensku pravdepodobne nepredstavuje zvýšené riziko AK, keďže väčšina prípadov bola spojená s umelo vyhrievanými kúpaliskami a bazénmi. Navyše, na Slovensku nie je až tak vysoký počet nosičov kontaktných šošoviek ako v ekonomicky vyspelých západoeurópskych krajinách a USA. Napriek tomu sa ukazuje, že monitoring kúpaliskových vôd a bazénov vyžaduje zvýšenie pozornosti, keďže v nich bolo zistené pomerne vysoké percentuálne zastúpenie meňaviek rodu Acanthamoeba [56].
Záver
Meňavky rodu Acanthamoeba sú rozšírené v širokom spektre biotopov, čo zapríčiňuje pravdepodobne veľmi častý kontakt s človekom. Pacienti s poruchami imunitného systému by mali klásť dôraz na zvýšenú hygienu najmä pri kontakte s pôdou a kontaminovanou vodou v bazénoch a kúpaliskách. Mali by sa im vyhýbať najmä pri poraneniach pokožky a kožných ochoreniach, keďže hrozí riziko vzniku kožných infekcií a GAE [24, 34].
Vzhľadom k tomu, že väčšina prípadov AK sa týka používania kontaktných šošoviek, prevencia sa sústreďuje práve na ne. Komerčne dostupné dezinfekčné roztoky nemajú vždy dostatočnú amebicídnu účinnosť [11]. Je nutné dezinfikovať puzdrá na ukladanie kontaktných šošoviek, pretože aj pitná voda, pokiaľ sa použije pri príprave úložného roztoku alebo pri umývaní puzdra, môže byť zdrojom kontaminácie meňavkami [18]. Odporúčaný je 3-% roztok peroxidu vodíka, ktorým je možné eliminovať nielen trofozoity ale aj cysty. Najspoľahlivejšie je jeho opakované použitie, keďže baktérie v puzdrách môžu roztok čiastočne neutralizovať. Alternatívnym spôsobom eliminácie meňaviek je niekoľkominútové ožiarenie mikrovlnami [28]. Napriek týmto možnostiam sa však za jedinú spoľahlivú metódu eliminácie meňaviek z úložných roztokov považuje stále tepelná dezinfekcia [13]. Aj pri aplikácii kontaktných šošoviek je nutné dodržiavať adekvátnu hygienu. Je potrebné vyhýbať sa noseniu kontaktných šošoviek počas rekreačných a športových aktivít vo vode bazénov ale aj prírodných kúpalísk, pretože sa tým zvyšuje riziko infekcie [34].
Patogénne kmene meňaviek rodu Acanthamoeba, spôsobujúce ochorenia človeka, sú v súčasnosti pomerne dobre preskúmané najmä z hľadiska diagnostiky a terapie. Identifikácia zostáva problematická, pre čo najväčšiu presnosť je vhodné skĺbiť morfologické aj molekulárne kritériá. Chýbajú dostatočné informácie o mechanizmoch patogenézy a vhodné liečivá, ktoré by pomohli pri terapii GAE ako aj pri terapii kožných infekcií. Hoci je AK pomerne dobre zvládnuteľným ochorením, vzhľadom k stúpajúcej tendencii počtu prípadov na celom svete je potrebné zvýšiť prevenciu a informovanosť odbornej verejnosti o diagnostike. Rovnako treba informovať aj širokú verejnosť o rizikách spojených s nosením kontaktných šošoviek.
Poďakovanie: Práca bola podporená grantom VEGA 1/0124/09 a VEGA 1/0600/11.
Adresa pre korešpondenciu:
Mgr. Mária Garajová
Katedra zoológie
Prírodovedecká fakulta, Univerzita Komenského
Mlynská dolina B-1
842 15 Bratislava
Slovenská republika
e-mail: garajova.maria@gmail.com
Zdroje
1. Adl, S. M., Simpson, A. G. B., Farmer, M. A., Andersen, R. A. et al. The new higher level classification of eukaryotes with emphasis on the taxonomy of protists. J. Eukaryot. Microbiol., 2005, 52, p. 399–451.
2. Aichelburg, A. C., Walochnik, J., Assadian, O., Prosch, H. et al. Successful treatment of disseminated Acanthamoeba sp. infection with miltefosine. Emerg. Infect. Dis., 2008, 14, p. 1743–1746.
3. Booton, G. C., Visvesvara, G. S., Byers, T. J., Kelly, D. J. et al. Identification and distribution of Acanthamoeba species genotypes associated with nonkeratitis infections. J. Clin. Microbiol., 2005, 43, p. 1689–693.
4. Cengiz, A. M., Harmis, N., Stapleton, F. Co-incubation of Acanthamoeba castellanii with strains of Pseudomonas aeruginosa alters the survival of amoeba. Clin. Exp. Ophthalmol., 2000, 28, p. 191–193.
5. Chatton, E. Classe des Lobosa Leidy, 1879. Ordre des amoebiens nus ou Amoebaea. In Grassé, P. P. Traité de zoologie, anatomie, systématique, biologie. Tome I. Protozoaires. Paris: Masson, 1953. p. 5–91.
6. Červa, L. Studies of limax amoebae in a swimming pool. Hydrobiologia, 1971, 38, p. 141–161.
7. Červa, L. Acanthamoeba culbertsoni and Naegleria fowleri: occurrence of antibodies in man. J. Hyg. Epidemiol. Microbiol. Immunol., 1989, 33, p. 99–103.
8. Červa, L., Serbus, C., Skočil, V. Isolation of limax amoebae from the nasal mucosa of man. Folia Parasitol., 1973, 20, p. 97–103.
9. De Jonckheere, J. F. Ecology of Acanthamoeba. Rev. Infect. Dis., 1991, 13, p. 385–387.
10. Dyková, I., Lom, J., Schroeder-Diedrich, J. M., Booton, G. C. et al. Acanthamoeba strains isolated from organs of freshwater fishes. J. Parasitol., 1999, 85, p. 1106–1113.
11. Filipec, M., Záhlava, J., Nohýnková, E. Akantamebova keratitida. Čes. a Slov. Oftal., 2005, 61, p. 132–140.
12. Fritsche, T. R. Pathogenic Protozoa: an overview of in vitro cultivation and susceptibility to chemotherapeutic agents. Clin. Lab. Med., 1989, 9, p. 287–317.
13. Fritsche, T. R. Bergeron, D. L. Acanthamoeba keratitis. Clin. Microbiol. News, 1987, 9, p. 109–112.
14. Galarza, C., Ramos, W., Gutierrez, E. L., Ronceros, G. et al. Cutaneous acanthamebiasis infection in immunocompetent and immunocompromised patients. Int. J. Dermatol., 2009, 48, p. 1324–1329.
15. Garcia, L. S. Diagnostic medical parasitology. 5th ed. Washington: ASM Press, 2007. 1202 s.
16. González-Robles, A., CastaĖón, G., Cristóbal-Ramos, A. R., Lázaro-Haller, A. et al. Acanthamoeba castellanii: Structural basis of the cytopathic mechanisms. Exp. Parasitol., 2006, 114, p. 133–140.
17. Hsu, H. L., Chen, C. J., Huang, C. C., Jung, S. M. et al. The evolution of contrast enhancement in granulomatous amebic encephalitis. Eur. J. Radiol., 2003, 45, p. 47–50.
18. Jeong, H. J., Lee, S. J., Kim, J. H., Xuan, Y. H. et al. Acanthamoeba: Keratopathogenicity of isolates from domestic tap water in Korea. Exp. Parasitol., 2007, 117, p. 357–367.
19. Kasprzak, W., Mazur, T. Free-living amoebae isolated from waters frequented by people in the vicinity of Poznań, Poland. Experimental studies in mice on the pathogenicity of the isolates. Z. Tropenmed. Parasitol., 1972, 23, p. 391–398.
20. Klieščiková, J., Nohýnková, E. Môže mať „toxická“ reakcia akantaméb vplyv na rezistenciu akantamébových infekcií k terapii? In Ditrich, O., Sak, B. Sborník abstraktů. VIII. České a Slovenské parazitologické dny. České Budějovice: Česká parazitologická společnost & Slovenská parazitologická spoločnosť, 2008. p. 39.
21. Klieščiková, J., Kulda, J., Nohýnková, E. Stress-induced pseudocyst formation – a newly identified mechanism of protection against organic solvents in acanthamoebae of the T4 genotype. Protist, 2011, 162, p. 58–69.
22. Khan, N. A. Pathogenesis of Acanthamoeba infections. Microbial Pathogenesis, 2003, 34, p. 277–285.
23. Khan, N. A. Acanthamoeba invasion of the central nervous system. Int. J. Parasitol., 2007, 37, p. 131–138.
24. Khan, N. A. Acanthamoeba. Biology and pathogenesis. Norfolk: Caister Academic Press, 2009. 290 s.
25. Lee, J., Ready, D., Maaytah, M. E., Nair, S. Antimicrobial resistance of Staphylococcus aureus following engulfment by amoebae. Br. J. Oral Maxillofac. Surg., 2008, 46, e51.
26. La Scola, B., Raoult, D. Survival of Coxiella burnetii within free-living amoeba Acanthamoeba castellanii. Clin. Microbiol. Infect., 2001, 7, p. 75–79.
27. MacLean, R. C., Hafez, N., Tripathi, S., Childress, C. G. et al. Identification of Acanthamoeba sp. in paraffin-embedded CNS tissue from an HIV+ individual by PCR. Diagn. Microbiol. Infect. Dis., 2007, 57, p. 289–294.
28. Marciano-Cabral, F., Cabral, G. A. Acanthamoeba spp. as agents of disease in humans. Clin. Microbiol. Rev., 2003, 16, p. 273–307.
29. Martínez, A. J. Is Acanthamoeba encephalitis an opportunistic infection? Neurology, 1980, 30, p. 567–574.
30. Martinez, A. J., De Jonckheere, J. F. Les infections par les amibes libres. Bull. Institut Pasteur, 1981, 79, p. 171–205.
31. Matis, D., Tirjaková, E., Hensel, K., Kocian, Ľ. Prehľad zoologického systému. 13. vyd. Bratislava: PRIF UK, 2009. 24 s.
32. Molet, B., Ermolieff-Braun, G. Description d’une amibe d’eau douce: Acanthamoeba lenticulata, sp. nov. (Amoebida). Protistologica, 1976, 12, p. 571–576.
33. Moura, H., Wallace, S., Visvesvara, G. S. Acanthamoeba healyi n. sp. and the isoenzyme and immunoblot profiles of Acanthamoeba spp., groups and 1 and 3. J. Protozool., 1992, 39, p. 573–583.
34. Mrva, M. Infekcie voľne žijúcimi meňavkami. In Holečková, K., Ondriska, F., Ondrušová, A., Šišková, Ľ. Cestovná medicína v praxi. Bratislava: J. Raabe, 2010. C3.20. p. 1–48.
35. OmaĖa-Molina, M., Hernández, D., González-Robles, A., Salazar-Villatoro, L. et al. Relationship between adhesion and cytopathic effect of four strains of Acanthamoeba spp. J. Eukaryot. Microbiol., 2006, 53, p. S18–19.
36. Ondriska, F., Mrva, M., Lichvár, M., Žiak, P. et al. First cases of Acanthamoeba keratitis in Slovakia. Ann. Agric. Environ. Med., 2004, 11, p. 335–341.
37. Ondriska, F., Mrva, M., Lichvár, M., Žiak, P. et al. Akantamébová keratitída – novoobjavená humánna parazitóza na Slovensku. In Furková, K. Novinky v pediatrii III. Bratislava: Herba, 2006. p. 46–48.
38. Page, F. C. Rosculus ithacus Hawes, 1963 (Amoebida, Flabellulidae) and the amphizoic tendency in amoebae. Acta Protozool., 1974, 13, p. 143–154.
39. Page, F. C. A new key to freshwater and soil Gymnamoebae. Ambleside: Freshwater Biological Association, 1988. 122 s.
40. Page, F. C. Nackte Rhizopoda. In Page, F. C., Siemensma, F. J. Nackte Rhizopoda und Heliozoea. Stuttgart-New York: G. Fischer Verlag, 1991. p. 1–170.
41. Penland, R. L., Wilhelmus, K. R. Comparison of axenic and monoxenic media for isolation of Acanthamoeba. J. Clin. Microbiol., 1997, 35, p. 915–922.
42. Pernin, P., Pussard, M. Étude en microscopie photonique et électronique d’une amibe voisine du genre Acantha moeba: Comandonia operculata n. gen., n. sp. (Amoebida, Acanthamoebidae). Protistologica, 1979, 15, p. 87–102.
43. Pussard, M. Le genre Acanthamoeba Volkonsky, 1931 (Hartmannellidae – Amoebida). Protistologica, 1966, 2, p. 71–93.
44. Pussard, M. Comparaison morphologique de 4 souches d’Acanthamoeba du groupe astronyxis-comandoni. J. Protozool., 1972, 19, p. 557–563.
45. Pussard, M., Pons, R. Morphologie de la paroi kystique et taxonomie du genre Acanthamoeba (Protozoa, Amoebida). Protistologica, 1977, 13, p. 557–598.
46. Rivera, F., Medina, F., Ramirez, P., Alcocer, J. et al. Pathogenic and free-living protozoa cultured from the nasopharyngeal and oral regions of dental patients. Environ. Res., 1984, 33, p. 428–440.
47. Rocha-Azavedo, B., Silva-Filho, F. C. Biological characterization of a clinical and an environmental isolate of Acanthamoeba polyphaga: analysis of relevant parameters to decode pathogenicity. Arch. Microbiol., 2007, 188, p. 441–449.
48. Rogerson, A., Patterson, D. J. The naked ramicristate amoebae (Gymnamoebae). In Lee, J. J., Leedale, G. F., Bradbury, P. Illustrated guide to the Protozoa. 2nd ed. Lawrence: Allen Press, 2000. p. 1023–1053.
49. Sawyer, T. K. Acanthamoeba griffini, a new species of marine amoeba. J. Protozool., 1971, 18, p. 650–654.
50. Sawyer, T. K., Griffin, J. L. Acanthamoeba comandoni and A. astronyxis: taxonomic characteristics of mitotic nuclei, „centrosomes“ and cysts. J. Protozool., 1971, 18, p. 382–388.
51. Schuster, F. L., Visvesvara, G. S. Free-living amoebae as opportunistic and non-opportunistic pathogens of humans and animals. Int. J. Parasitol., 2004, 34, p. 1001–1027.
52. Schuster, F. L., Visvesvara, G. S. Opportunistic amoebae: challenges in prophylaxis and treatment. Drug. Resist. Updat., 2004, 7, p. 41–51.
53. Shoff, M. E., Rogerson, A., Kessler, K., Schatz, S. et al. Prevalence of Acanthamoeba and other naked amoebae in South Florida domestic water. J. Water. Health., 2008, 6, p. 99–104.
54. Snelling, W. J., Moore, J. E., McKenna, J. P., Lecky, D. M. et al. Bacterial-protozoa interactions; an update on the role these phenomena play towards human illness. Microb. Infect., 2006, 8, p. 578–587.
55. Torno, M. S., Babapour, R., Gurevitch, A., Witt, M. D. Cutaneous acanthamoebiasis in AIDS. J. Am. Acad. Dermatol., 2000, 42, p. 351–354.
56. Trnková, K., Bieliková, A., Izák, M., Klement, C. Diagnostika akantamébovej keratitídy. Čes. a Slov. Oftal., 2009, 65, p. 155–160.
57. Valdivia, R. H., Heitman, J. Endosymbiosis: The evil within. Curr. Microbiol., 2007, 17, p. 408–410.
58. Visvesvara, G. S., Schuster, F. L. Opportunistic free--living amebae, Part I. Clin. Microbiol. News, 2008, 30, p. 151–158.
59. Walochnik, J., Aichelburg, A., Assadian, O., Steuer, A. et al. Granulomatous amoebic encephalitis caused by Acanthamoeba amoebae of genotype T2 in a human immunodeficiency virus-negative patient. J. Clin, Microbiol., 2008, 46, p. 338–340.
60. Walochnik, J., Haller-Schober, E. M., Kölli, H., Picher, O. et al. Discrimination between clinically relevant and nonrelevant Acanthamoeba strains isolated from contact lens-wearing patients in Austria. J. Clin. Microbiol., 2000, 38, p. 3932–3936.
61. Willaert, E., Stevens, A. R., Tyndall, R. L. Acanthamoeba royreba sp. n. from a human tumor cell culture. J. Protozool., 1978, 25, p. 1–14.
62. Žiak, P., Ondriska, F., Mrva, M. Acanthamoebová keratitis po aplikácii mäkkých kontaktných šošoviek – kazuistika. Čes. a Slov. Oftal., 2003, 59, p. 352–358.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2011 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Prevence klíšťové meningoencefalitidy – souhrnné sdělení
- Využití testů avidity IgG protilátek v diagnostice cytomegalovirové infekce
- Meňavky rodu Acanthamoeba – pôvodcovia infekcií človeka
- Mimoriadne udalosti vo verejnom zdravotníctve
- MUDr. Luděk Bajgar (15. 3. 1952–24. 5. 2011)
- Očkování proti virové hepatitidě A a B u dospělých starších 40 let věku – sledování přetrvávání protilátek a imunitní paměti
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Využití testů avidity IgG protilátek v diagnostice cytomegalovirové infekce
- Meňavky rodu Acanthamoeba – pôvodcovia infekcií človeka
- Očkování proti virové hepatitidě A a B u dospělých starších 40 let věku – sledování přetrvávání protilátek a imunitní paměti
- Prevence klíšťové meningoencefalitidy – souhrnné sdělení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



