Průkaz bakteriálních agens z hemokultur metodou fluorescenční in situ hybridizace
Identification of bacteria from blood cultures by fluorescence in situ hybridization
The diagnosis of bacterial agents of sepsis from blood cultures is crucial for the subsequent treatment of this condition.
The aim of this study was to compare Gram stain, culture, and biochemical identification (conventional methods) and fluorescence in-situ hybridisation (FISH) that detects microorganisms from positive blood cultures using specific probes. Another aim was to evaluate the potential of this method for use in clinical practice.
Altogether 71 samples of positive blood cultures were tested by FISH. Blood cultures were also processed in the conventional way using the BACTEC analyser. The bacteria recovered were inoculated on solid media and then identified biochemically. The results obtained by the conventional methods and HemoFISH were not 100% concordant. The sensitivity of HemoFISH was 90.1%. Very good results were achieved for staphylococci and enterobacteria. FISH identification failed in three cases because the hybridization probes were not able to bind to bacterial rRNA.
The FISH bacterial identification is faster than the conventional methods, but should be confirmed by the latter.
KEYWORDS:
sepsis – blood cultures – Gram stain – fluorescence in situ hybridization
Autori:
L. Černohorská; L. Dolinková
Pôsobisko autorov:
Mikrobiologický ústav LF MU a FN u sv. Anny v Brně
Vyšlo v časopise:
Epidemiol. Mikrobiol. Imunol. 66, 2017, č. 2, s. 86-90
Kategória:
Původní práce
Súhrn
Diagnostika bakteriálního původce sepse z hemokultur bývá stěžejním bodem pro následnou léčbu.
Cílem studie bylo porovnat barvení podle Grama, kultivaci a biochemickou identifikaci s metodikou, která detekuje mikroorganismy z pozitivních hemokultur pomocí specificky připravených sond na podkladě genotypové metody fluorescenční in situ hybridizace (FISH) a zjistit využitelnost této metody pro běžnou klinickou praxi.
Metodou FISH bylo vyhodnoceno celkem 71 vzorků pozitivních hemokultur. Všechny tyto hemokultury byly zpracovány i klasickým způsobem tj. detekovány analyzátorem BACTEC, následně byly zachycené bakterie kultivovány na pevných půdách a biochemicky identifikovány. Shoda mezi výsledky získanými klasicky a stanovením HemoFISH nebyla stoprocentní, senzitivita byla 90,1 %. Velmi dobré výsledky vykazovala analýza stafylokoků a enterobakterií. Pouze ve třech případech jsme nezískali metodou FISH výsledek, protože nedošlo k hybridizaci sondy a bakteriální rRNA.
Identifikace bakterií pomocí FISH je rychlejší než klasické metody, ale měla by být ověřena dalšími metodami.
KLÍČOVÁ SLOVA:
sepse – hemokultura – barvení dle Grama – fluorescenční in situ hybridizace
ÚVOD
Sepse je definována jako život ohrožující orgánová dysfunkce způsobená dysregulovanou (aberantní) odpovědí na infekci [16].
Původcem sepse mohou být gramnegativní a grampozitivní aerobní bakterie, anaerobní bakterie nebo eventuálně mikromycety. V posledních 25 letech bývají nejčastějšími původci sepsí získaných mimo zdravotnické zařízení zlatý stafylokok, pneumokok a Escherichia coli [4]. V nemocničním prostředí se setkáváme s kmeny klebsiel, enterobakterů, proteů, serácií, pseudomonád, acinetobakterů, stenotrofomonád a s dalšími. V současnosti lze sledovat nárůst sepsí způsobených zejména koaguláza negativními stafylokoky a enterokoky [4, 7]. U méně než 10 % sepsí jsou původcem anaerobní bakterie, zejména Bacteroides fragilis, dále peptostreptokoky a peptokoky, vzácně ostatní anaeroby. Anaerobní mikroby hrají rozhodující úlohu u sepse vycházející z břišní a pánevní oblasti v souvislosti s operacemi pro intraabdominální a gynekologické zánětlivé infekce. Pseudomonas aeruginosa se nachází u sepse v pozdějším období po popálení [5]. Přibližně 14 % sepsí má smíšenou etiologii a při volbě terapie je nutné vzít v úvahu všechny kmeny, které byly z hemokultury izolovány; takové případy se označují jako polymikrobní sepse a lze se s nimi setkat např. u sepse z dekubitů [5].
Sepse představuje závažný stav a její léčba vyžaduje komplexní přístup a mezioborovou spolupráci [4]. Zásadní vliv na volbu antibiotik u septických pacientů má skutečnost, zda se jedná o infekci vyvolanou gramnegativními, grampozitivními bakteriemi nebo houbami. Volba vhodných antibiotik závisí na řadě faktorů, a terapie by měla pokrývat všechny předpokládané patogeny [8].
Přítomnost bakteriálního původce lze nejlépe potvrdit pozitivní kultivací krve [4, 7]. K průkazu jsou vhodné automatizované hemokultivační systémy [7], které detekují růst mikroorganismů na základě produkce CO2 a označují pozitivní lahvičky. Detekce původců z lahviček je nejčastěji rutinně prováděna pomocí mikroskopie, s následným kultivačním a biochemickým průkazem. S ohledem na rozvoj rozmanitých molekulárních metod a sílící požadavky ze strany kliniků na včasnou a rychlou diagnostiku původců, se začínají prosazovat i další metody detekce jako MALDI-TOF [1, 18], PCR [2] či FISH [15].
Fluorescenční in situ hybridizace
Tato cytogenetická technika se do laboratorní praxe dostala na konci 80. let minulého století, je založena na schopnosti jakýchkoliv dvou jednořetězcových DNA nebo RNA navzájem hybridizovat za předpokladu, že jejich sekvence se vyznačují úplnou nebo alespoň částečnou komplementaritou bází. Pomocí DNA sondy značené fluoroforem se v analyzovaném materiálu vyhledává cílová sekvence komplementární se sondou za použití fluorescenčního mikroskopu. Ve své podstatě vychází FISH z in situ hybridizace (ISH), která byla použita již roku 1970 [13].
DNA lze denaturovat vlivem zvýšené teploty, některých chemikálií nebo specifických enzymů, po pominutí extrémních podmínek pak lze řetězce následně opětovně spojit, přičemž proces spojení dvou nestejných molekul DNA se nazývá hybridizace [17]. Denaturace a následná renaturace DNA je i základním principem ISH za současného použití uměle připravené sondy, která může být značena atomy radioaktivního izotopu a signálem vzniklé hybridizace je v tomto případě radioaktivita nebo coby značka slouží fluorescenční barvivo a výsledným signálem je fluorescence detekovatelná fluorescenčním mikroskopem [6].
Pracovní postup při ISH zahrnuje denaturaci sondy („proby“) a cílové DNA, která byla obnažena lýzou buněk fixovaných na podložním sklíčku (in situ = na místě). Po navození reasociačních podmínek se denaturovaná sonda připojí ke komplementárním sekvencím a nastává hybridizace sondy a cílové DNA. Působením formamidu nebo roztoku o nízké iontové síle se odstraní nenavázané zbytky sondy z míst, kde nebyla zachována úplná komplementarita a v závislosti na typu použitého značení sondy se pátrá příslušným přístrojovým vybavením po hybridizačním signálu [14].
Fluorescence
U metody FISH se používá sonda značená fluorescenčně. Značení sond lze provádět enzymaticky, a to tzv. nick-translací, kdy se jednořetězcový zlom DNA inkubuje ve směsi DNázy, DNA-polymerázy a deoxyribonukleotidtrifosfátů (dNTP) s chemicky navázaným fluorochromem. V přítomnosti hořečnatých kationtů jsou postupně do vlákna DNA začleněny značené dNTP. Další metodou enzymatického značení je PCR, v tomto případě lze sondu navíc ještě i amplifikovat. Metodami přímého neenzymového značení dochází ke vzniku velmi homogenně značených hybridizačních sond [6].
Fluorochromy jsou polycyklické organické molekuly a jejich deriváty nebo fluorescenční proteiny, které se vyznačují schopností absorbce světelné energie o vlnové délce v neviditelné oblasti spektra. Při pohlcení světla dojde k excitaci molekuly fluorochromu na vyšší energetickou hladinu a při návratu do klidového stavu je emitováno světlo z viditelné části vlnového spektra. Barva pohlceného a vyzářeného světla se tedy liší. Emitované záření má větší vlnovou délku, ale nižší energii, protože se část energie přeměnila na energii vibrační. Nejvíce využívanými fluorochromy jsou: fluorescein-isothiokyanát (FITC), který poskytuje emisní světlo jasně zelené barvy a phycoerythrin (PE) nebo rhodamin s emisním světlem barvy červené [11].
HemoFISH Sepsis Masterpanel
Využívá kvalitativní stanovení pomocí hybridizace nukleové kyseliny bakterie a komerčně připravené sondy. Test rozpozná až 95 % klinicky relevantních patogenů zodpovědných za rozvoj sepse a je určen pro identifikaci bakteriálního druhu, rodu a čeledi (tab. 1). Testování probíhá z krve po detekci pozitivní hemokultury analyzátorem. Je možné použít i kolonie bakterií narostlé na pevném kultivačním médiu.
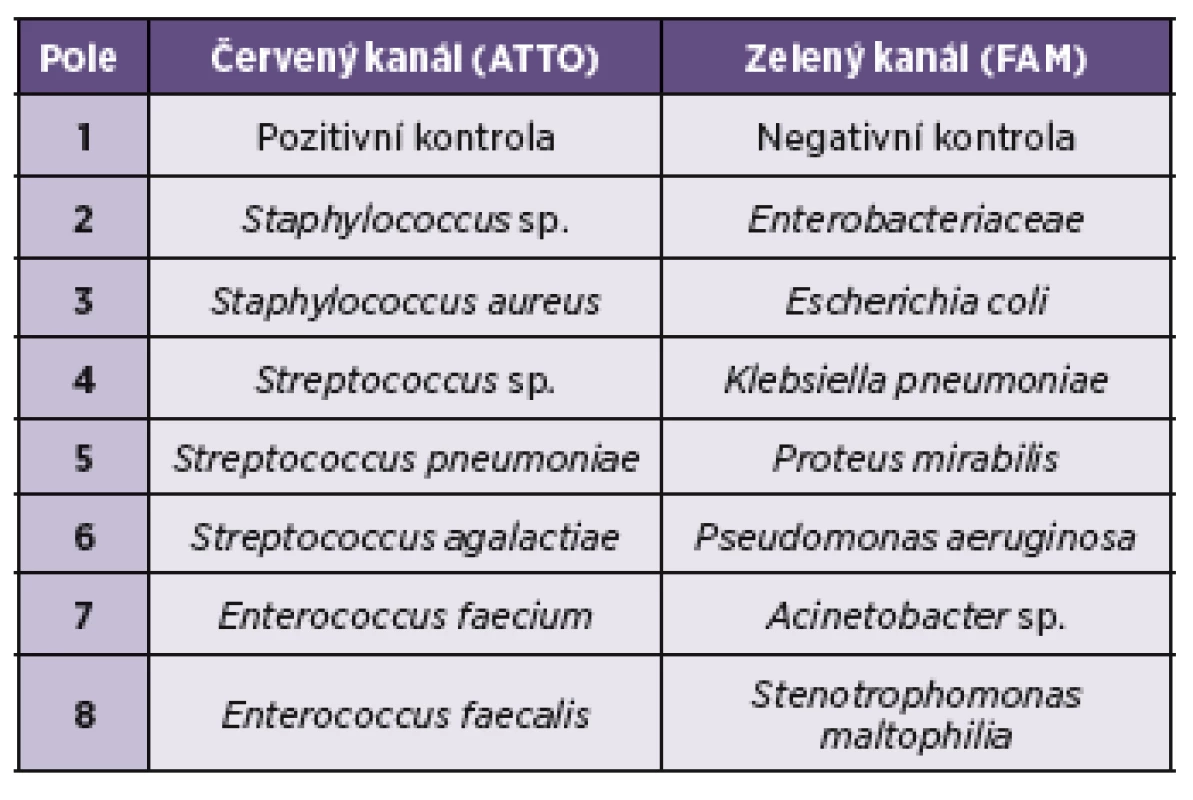
Využívá se klasické FISH technologie s použitím fluorescenčně značených molekulárních sond. Tyto se skládají z DNA sekvence uspořádané v kruhovité struktuře, kde je na 5´ konci zabudovaný fluorofor a tzv. quencher je zasazen na 3´ konci. DNA sekvence na obou koncích jsou mezi sebou komplementární a udržují fluofor a quencher v bezprostřední blízkosti. V tomto stavu je zabráněno vzniku fluorescenčního signálu. DNA sekvence mezi koncovými částmi se na základě párování bází váží na rRNA bakterie, která je unikátní pro jednotlivé bakterie na úrovni čeledi, rodu i druhu. Protože každá bakteriální buňka obsahuje více než deset tisíc kopií rRNA, není nutná amplifikace. Po vniknutí sondy skrz bakteriální stěnu a membránu do nitra buňky, se její DNA sekvence specificky váže na cílovou bakteriální rRNA. Při navázání se fluorofor sondy prostorově vzdálí od tzv. quencheru a tímto je umožněna emise světla v určité vlnové délce poté, co bylo dodáno světlo excitační. Každá rRNA kopie s navázanou sondou produkuje fluorescenční signál a je detekována fluorescenčním mikroskopem jako svítící objekt. Nenavázané sondy nefluoreskují, tudíž negenerují signál a jsou následně v promývacím roztoku odstraněny.
Cílem práce bylo vyzkoušet soupravu HemoFISH Sepsis Masterpanel (fy Miacom® diagnostics) pro identifikaci bakterií z hemokultur, a posoudit výhody či nevýhody metody FISH oproti dosavadně používaným zkouškám.
MATERIÁL A METODY
Pro kultivaci krve byly použity dva typy hemokultivačních lahviček: BD BACTEC™ Plus Aerobic k detekci bakterií, hub a plísní a BD BACTEC™ Plus Anaerobic k detekci anaerobních a fakultativně anaerobních bakterií. Lahvičky byly umístěny do hemokultivačního přístroje BD Bactec™ FX (fy BD Diagnostics). Pozitivní hemokultura byla vyjmuta z přístroje, z kapky krve byl připraven nátěr na podložní sklíčko a obarven podle Grama, zároveň byly naočkovány následující kultivační půdy: krevní agar s 10 % NaCl (fy Oxoid), krevní agar (fy Oxoid), Endova půda (fy Oxoid), eventuálně WCHA agar (fy HiMedia) a CHROMagar™ Candida (fy Trios). Na krevní agar byl naočkován čarou kmen Staphylococcus aureus CCM 6188 kvůli možnosti záchytu zástupců rodu Haemophilus. Krevní agar byl kultivován 18–24 hodin při 37 °C za zvýšené tenze CO2. Krevní agar s 10 % NaCl, Endova půda, (eventuálně CHROMagar™ Candida) byly kultivovány 18–24 hodin při 37 °C. Pokud šlo o pozitivní anaerobní lahvičku, byl přidán WCHA agar a ponechán v anaerobním boxu 48–72 hodin při 37 °C. Následující den bylo provedeno dourčení mikrobů pomocí diagnostických setů ENTEROtest 16 (fy Erba Lachema), RapID™ Plus System (fy Remel) pro rody Corynebacterium, Streptococcus a gramnegativní nefermentující tyčinky a latexové aglutinace – PASTOREX™ STAPH-PLUS (fy BIO-RAD).
Příprava vzorku a komponent
Z hemokulturové lahvičky bylo odebráno cca 1–1,5 ml krevní kultury a přeneseno do sterilní reakční zkumavky. Zvolený stupeň ředění (od 1 : 1 do 1 : 20) závisel na výsledcích Gramova barvení. Pokud byl mikroskopií zjištěn nízký počet bakteriálních buněk, ředilo se v poměru 1 : 1. Pokud byl počet buněk vyšší, bylo použito ředění vyššího stupně. U vzorků, u kterých byla v mikroskopii spatřena záplava bakterií, bylo použito ředění 1 : 20.
Před prvním použitím byl připraven STOP roztok smísením 50 ml STOP roztoku (10krát koncentrovaného), 200 ml deionizované nebo dvakrát destilované vody a 250 ml etanolu (≥ 96% metylovaného či purifikovaného). Zhruba 100 ml této směsi bylo nalito do čisté Coplinovy kyvety. Stejným způsobem byly přichystány dvě lázně etanolu. Dále bylo přidáno 800 µl rekonstitutivních komponent soupravy do každého sloupce zásobníku lytického pufru a zásobníku hybridizačních sond.
Před každodenním použitím byly všechny části soupravy krátce temperovány při teplotě 15–25 °C. Etanolová lázeň byla vždy čerstvá, STOP lázeň byla měněna každých 5 dnů v případě, že byla použita každý den nebo po 15 sklech v ní ponořených.
Vlastní provedení FISH (v závislosti na množství vzorků celkem 20–30 minut):
- a) Fixace: Z naředěného vzorku bylo napipetováno 10 µl na každé pole mikroskopického skla. Sklo bylo umístěno na teplotní ploténku předehřátou na 52 °C (± 1 °C) cca na 5 minut do úplného dosušení.
- b) Parciální lýza buněk: Sklo setrvávalo na teplotní ploténce. Na všechna pole bylo přidáno 10 µl lytického pufru ze zásobníku, tento se nechal 5 minut působit. Sklo bylo propráno v první lázni etanolu, kde zůstalo ponořeno 5 minut. Poté se spodní strana setřela savým papírem nebo buničinou a sklo bylo vráceno na ploténku. Zbytek etanolu se odpařil během 20 sekund.
- c) Hybridizace: Při tomto kroku bylo nutné dbát zvýšené opatrnosti, protože hybridizační sondy obsahovaly formamid. Ze zásobníku bylo napipetováno 10 µl roztoku lyofilizovaných specifických DNA sond na každé pole skla. Sklo bylo přikryto hybridizační komůrkou a přiklopeno víkem ploténky. Hybridizace probíhala 10 minut v temném a vlhkém prostředí při teplotě 52 °C (± 1 °C). V tomto kroku došlo k navázání sondy na molekulu rRNA bakterie v krvi pacienta.
- d) STOP reakce: Hybridizační komůrka byla odstraněna a sklo bylo ponořeno nejprve do STOP lázně na 1 minutu ± 10 sekund, kde došlo k zastavení reakce, následně na 1 minutu do druhé etanolové lázně, která odstranila zbytky STOP roztoku. Spodní strana vyjmutého skla byla setřena savým papírem a krátce dosušena.
- e) Montáž: Na preparát byly naneseny malé kapky montovacího média a následně přikryty krycím sklem tak, aby nevznikaly vzduchové bubliny. Hotový preparát byl chráněn před přímým slunečním zářením či jiným silným zdrojem světla, aby nedošlo k vyblednutí fluorescence.
- f) Odečítání: K odečítání sloužil fluorescenční mikroskop Leica DM750 se 2 filtry; Filtrset A pro ATTO550 – absorpční maximum: 554 nm emisní maximum: 576 nm; Filtrset B pro FAM - absorpční maximum: 494 nm; emisní maximum: 520 nm a světelným zdrojem o výkonu 100 W. Preparát byl prohlížen nejlépe ihned; standardně do 2 hodin od montáže. Při skladování v temnu při 15–25 °C by bylo možné sklo odečítat i během 12 hodin. V závislosti na množství skel doba odečítání trvala 15–30 minut. Počátečním vodítkem byl známý výsledek Gramova barvení. Jednotlivá odečítající pole skla byla ohraničena teflonovým lemem, který umožnil pohyb objektivu pouze v oblasti, kde pole svítila, a bylo možné spatřit fixované bakteriální buňky. Preparát byl ozářen světlem zdroje a po chvíli byly vyhledány fluoreskující buňky bakterií. Střídavě bylo každé pole zkoumáno přes kanál emitující červené záření při 576 nm (filtrset A) a kanál emitující zelené záření při 520 nm (filtrset B). Správně pozitivní výsledek byl definován jako pozitivní fluorescenční signál jen na jednom kanálu. Pozitivita nalezená v obou kanálech byla možná u smíšených sepsí nebo v případě nesprávného postupu, kontaminace apod.
Pole č. 1 v oblasti červeného kanálu sloužilo jako pozitivní kontrola. V případě, že pole zářilo, byly buňky na sklíčku přítomny. Když signál v tomto poli chyběl, ale došlo k výskytu fluoreskujících buněk v jiném poli, byl test zopakován. Jestliže nesvítilo toto ani žádné jiné pole, nedošlo vůbec k hybridizaci, nebo bylo buněk ve vzorku málo a přesto bylo použito silné ředění. V těchto případech došlo k zopakování testu s čerstvě a vhodněji naředěným vzorkem, případně byla znovu hodnocena mikroskopie podle Grama. Pole č. 1 v oblasti zeleného kanálu fungovalo jako negativní kontrola. Pokud se zde objevil signál, test byl zopakován a zkontrolovala se teplota při hybridizaci.
Detekce fluorescence v příslušných polích poukazovala na přítomnost jednotlivých bakterií v krvi pacienta (tab. 1). Pokud druhově specifická sonda dávala pozitivní signál, ale rodová sonda zůstala bez záznamu fluorescence, byl test zopakován, nebo byly využity alternativní metody k určení patogenu.
Kvasinky se mohly objevit jako fluoreskující objekty v obou kanálech [15], přestože souprava nebyla cíleně určena k detekci kvasinek. I když byla jedna bakterie identifikována, byla prohlédnuta všechna pole, aby byla odhalena případná koinfekce. V případě dvou vzorků hemokultur od jednoho pacienta byla provedena obě stanovení.
VÝSLEDKY
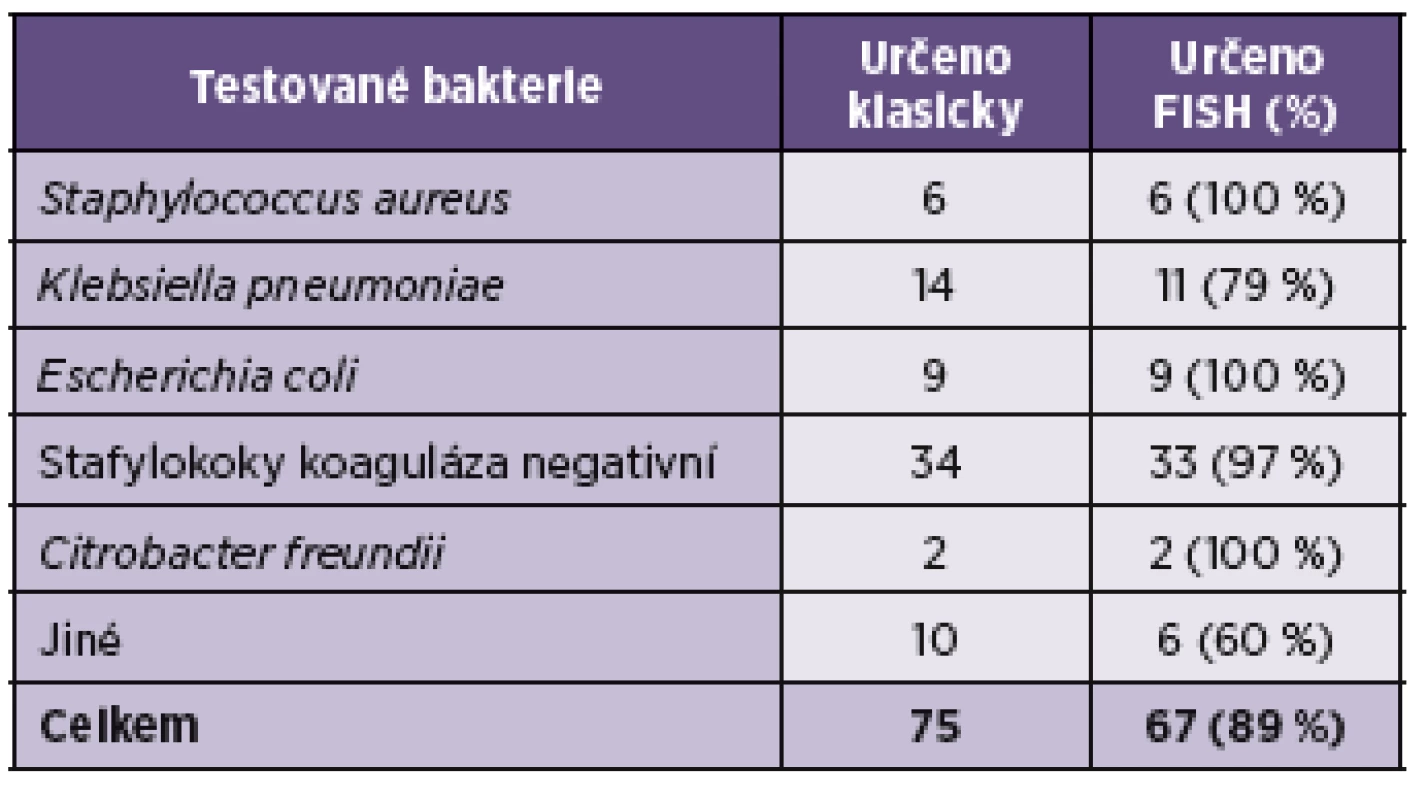
Metodou FISH bylo vyhodnoceno od 20. března do 7. května 2013 celkem 71 vzorků pozitivních hemokultur. Převažovalo stanovení z aerobních typů lahviček. Pro většinu vzorků bylo použito ředění 1 : 4. Jeden vzorek byl analyzátorem z neznámé příčiny vyhodnocen jako pozitivní i přesto, že se při aerobní i anaerobní kultivaci nepodařilo izolovat žádné agens. Ve třech případech jsme nezískali metodou FISH výsledek, protože nedošlo k hybridizaci sondy a bakteriální rRNA. HemoFISH Sepsis Masterpanel diagnostikoval pouze omezený počet gramnegativních bakterií (viz tab. 1), jiné bakterie tak byly určeny sondou pouze jako čeleď Enterobacteriaceae. Celkové výsledky ukazuje tabulka 2. Metoda vykazovala 90,1% senzitivitu a 100% specificitu.
DISKUSE
Metoda vyžadovala precizní zpracování kvalifikovaným personálem na úrovni asepse a přípravu reagencií nejlépe v prostředí biohazard boxu. Jakákoliv mikrobiální kontaminace, stejně jako křížová kontaminace mezi vzorkem a reagenciemi navzájem mohla vést k chybným výsledkům.
Shoda mezi klasicky získanými výsledky a stanovením HemoFISH nebyla stoprocentní, jak se původně předpokládalo. Senzitivita a analytická specificita však byla podobná jako u jiných prací [12, 15]. Velmi dobré výsledky vykazovala analýza stafylokoků a enterobakterií. Opakovaně selhávala diagnostika u směsí dvou mikrobů i přesto, že výrobce garantoval možnost rozpoznání až tří mikrobů v případě koinfekce z jednoho vzorku. V případě odhalení tří a více druhů bakterií v jedné hemokultuře je doporučeno zvážit možné příčiny interferujících vlivů, test opakovat nebo výsledek konfirmovat tradičními identifikačními metodami. U streptokoků patrně interferoval špatně zvolený stupeň ředění krve v ředicím roztoku. Za zábranu hybridizace mohl být též zodpovědný rozpad pouzdra těchto bakterií. Problém vyvstal u odečítání na posledním poli podložního sklíčka, se kterým se pod mikroskopem špatně manipulovalo, tudíž nebyl identifikován Enterococcus faecalis.
Hlavním tématem diskuse je spolehlivost lyofilizovaných sond užitých při testování HemoFISH, které nejsou zcela specifické. Rodově zaměřená sonda pro streptokoky detekuje také rod Lactococcus, podobně druhová sonda pro E. faecium dává pozitivní signál po navázání na rRNA Enterococcus durans a E. hirae [3]. Podle databází fy Miacom diagnostics sondy pro rody Streptococcus a Staphylococcus jsou schopné zachytit většinu druhů těchto bakterií kvůli podobnosti sekvence jejich rRNA. Sonda proti E. coli nedokáže poznat rozdíl E. coli a Shigella sp. [10], přičemž na sebe váže také E. albertii a E. fergusonii, což je způsobeno jejich identickou sekvencí. Stejný případ druhové nespecifické reakce vykazuje sonda pro K. pneumoniae, jež také vychytává Klebsiella variicola a proba pro P. aeruginosa detekuje i Pseudomonas fulva a Pseudomonas mendocina. Jediná sonda fungující pro detekci všech bakterií patřící do čeledi Enterobacteriaceae umí zachytit velké množství rodů jako: Citrobacter sp., Enterobacter sp., Hafnia sp., Morganella sp., Pantoea sp., Escherichia sp., Klebsiella sp., Proteus sp., Salmonella sp., Serratia sp., Shigella sp., Yersinia sp., ale může detekovat některé druhy rodu Aeromonas [3].
Přes nesporné výhody rychlého stanovení patogenů z krve je metoda FISH limitována. Kvůli zachování dobré kondice bakteriálních buněk se musí vyšetření provést z čerstvé krevní kultury co nejdříve po detekci pozitivity hemokultury, nejpozději do 12 hodin. Výsledky získané z krevního lyzátu zpracovaného později než za 24 hodin od detekce pozitivní lahvičky nelze považovat za validní. Analytická senzitivita byla již z dřívějších studií stanovena podle sériových ředicích pokusů na 105 CFU/ ml krve. Reagencie a ostatní komponenty diagnostického setu jsou náchylné ke kontaminaci a vyžadují specifické skladovací podmínky. Velký vliv na úspěšné navázání sondy na bakteriální rRNA má stupeň ředění, teplotní interval při hybridizaci a pečlivé provedení pracovního postupu lege artis.
Falešně negativní výsledky můžeme získat, když je použito jiné vybavení či reagencie, než je doporučeno výrobcem; když není teplota při hybridizaci kontrolována a dojde k jejímu vychýlení od normy, anebo je-li vynechán některý z kroků pracovního postupu. Falešně pozitivní výsledky jsou většinou dány přítomností autofluorescence. Tento jev se může objevit, pokud je použit jiný filtr, než je stanoveno nebo je některá z tekutých komponent, popř. mikroskopická skla kontaminovaná autofluorescenčními částicemi, mezi něž řadíme prachové partikule, vlasy, chlupy a mykotické elementy [3].
Na bakterie, které se ve spektru dané soupravy nenachází, je nutné použít jiný panel. Výsledky HemoFISH by měly být validovány alespoň dvěma alternativními metodami (např. kultivací, biochemickou identifikací, PCR, MALDI-TOF aj.), což analýzu značně prodražuje a měly by korelovat i s dalšími výsledky laboratorních zkoušek a stavem pacienta.
ZÁVĚR
Sepse představuje pro pacienta život ohrožující stav. K diagnostice sepse přispívá výraznou měrou i vyšetření hemokultur. Každé včasné zjištění původce proto může urychlit použití adekvátní terapie. Metoda FISH je rychlá, název bakterie známe již za 1–2 hodiny od detekce pozitivity, může tedy pomoci při nasazování vhodné terapie tam, kde není čas na klasickou kultivaci. Nevýhodou FISH je pak poměrně vysoká cena a zejména nutnost rychlého zpracování materiálu za aseptických podmínek.
Poděkování
Upřímný dík paní Eve Blömeke z firmy Miacom za cenné rady a podporu.
Do redakce došlo dne 28. 11. 2016.
Adresa pro korespondenci:
MUDr. Lenka Černohorská, Ph.D.
Mikrobiologický ústav LF a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: lenka.cernohorska@fnusa.cz
Zdroje
1. Almuhayawi M, et al. The performance of the four anaerobic blood culture bottles BacT/Alert-FN, -FN Plus, BACTEC-Plus and –Lytic in detection of anaerobic bacteria and identifiction by direct MALDI-TOF MS. PLoS One, 2015; 10 (11): 1–11.
2. Beneš J, et al. Infekční endokarditida. Doporučené postupy diagnostiky, léčby, dispenzarizace a profylaxe [On line]. 2007 [cit. 2017-01-01]. Dostupné na www: <http://www.kardio-cz.cz/data/upload/Infekcni_endokarditida_doporucene_postupy_diagnostiky_lecby_dispenzarizace_a_profylaxe.pdf>.
3. Blömeke E. About HemoFISH Miacom possibilities (Product manager, Miacom diagnostics GmbH I Merowingerplatz 1a, D-40225 Düsseldorf, Germany). Ústní sdělení dne 22. 10. 2013.
4. Dostál V. Horečnatý stav. In Beneš J. Infekční lékařství. Galén, 1. vydání; 2009 : 381–394.
5. Havlík J, et al. Sepse a septický šok. In Infekční nemoci. 2. vydání, Praha: Galén; 2002. 186 s.
6. Kočárek E, Pánek M, Novotná D. Klinická cytogenetika I. Úvod do klinické cytogenetiky: vyšetřovací metody v klinické cytogenetice. Praha: Karolinum; 2006, 134 s.
7. Kolář M. Sepse. In Antibiotická léčba nozokomiálních infekcí. Praha: Triton, 2000. s. 125–129.
8. Kula R, Chýlek V, Černý V. Sepse, infekce, antibiotická a antimykotická terapie. In Černý V, Matějovič M, Dostál P. Vybrané doporučené postupy v intenzivní medicíně. Praha: Maxdorf, 2009, s. 157–160.
9. Lamoth F, Jaton K, Prod'hom G et al. Multiplex blood PCR in combination with blood cultures for improvement of microbiological documentation of infection in febrile neutropenia. J Clin Microbiol, 2010; 48(10): 3510–3516.
10. Leitner E, Scherr S, Strempfl Ch, et al. Rapid identification of pathogens with the hemoFISH test applying a novel beacon-based Fluorescence In Situ Hybridization (bbFISH) technology in positive blood culture bottles. J Molecular Diagnostics, 2013; 15, 6 : 835–883.
11. Litzman J, et al. Základy vyšetření v klinické imunologii. Brno: Masarykova univerzita, 2007, 59 s.
12. Makristathis A, Riss S, Hirschl AM. A novel FISH test for rapid pathogen identification in positive blood cultures. Clin Microbiol Infect, 2014; 20(10): 0760-3.
13. Michalová K. Úvod do lidské cytogenetiky. Brno: Institut pro další vzdělávání pracovníků ve zdravotnictví; 1999. 172 s.
14. Nussbaum R L, McInnes RR, Willard HF. Klinická genetika. 6. vydání, Praha: Triton, 2004, 492 s.
15. Sakarikou Ch, Parisato M, Cascio G, et al. Beacon-based (bbFISH®) technology for rapid pathogens identification in blood cultures. BMC Microbiology, 2014; 14 : 99.
16. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA, 2016; 315(8): 801–810.
17. Votava M. Vyšetřovací postupy. In Lékařská mikrobiologie obecná. Brno: Neptun, 2001, s. 203–212.
18. Zhou L, Jones C, Gibani MM, et al. Development and evaluation of a blood culture PCR assay for rapid detection of Salmonella Paratyphi A in clinical samples. Plos One, 2016; 11 (3): e.0150576.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo MikrobiológiaČlánok vyšiel v časopise
Epidemiologie, mikrobiologie, imunologie

2017 Číslo 2
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
Najčítanejšie v tomto čísle
- Diagnostický význam chemokinu CXCL13 a protilátek proti C6 peptidu u pacientů s neuroborreliózou
- Nemoc z kočičího škrábnutí – opomíjená zoonóza
- Štěnice domácí (Cimex lectularius) – biologie, zdravotnický význam, možnosti detekce a hubení
- Vliv sepse na úmrtnost v České republice: analýza vícečetných příčin úmrtí
