-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Invazivní pneumokoková onemocnění u dospělých pacientů hospitalizovaných v Nemocnici Na Bulovce:
sérotypový replacement po zavedení plošné vakcinace dětí
Invasive pneumococcal diseases in adults admitted to the Na Bulovce Hospital:
Serotype replacement after the implementation of general childhood pneumococcal vaccinationObjective: The aim of this study was to analyse epidemiological and clinical characteristics of invasive pneumococcal disease (IPD) in adults before and after the introduction of the general childhood conjugate pneumococcal vaccination programme in the Czech Republic.
Material and Methods: The retrospective observational sentinel study included adults with IPD admitted to the Na Bulovce Hospital in Prague from 1/2000 through 12/2019. A case of IPD was defined as isolation of Streptococcus pneumoniae from a primarily sterile site.
Results: A total of 304 IPD cases were diagnosed during the study period, with a male to female ratio of 1.49 : 1 and age median of 58 years (IQR 43-73). The most prevalent clinical forms were bacteraemic pneumonia (185 cases; 60.9%) and purulent meningitis (90; 29.6%). A total of 157/293 patients (53.6%) required intensive care, and the case fatality rate was 25.3% (n = 77). The serotype was determined in 292 (96.0%) isolates, the most prevalent being serotypes 3 (38; 12.5%), 4 (28; 9.2%), 7F (24; 7.9%), 8 (21; 6.9%), and 1 (18; 5.9%). Both clinical and epidemiological characteristics of IPD caused by the most prevalent serotypes differed considerably. Patients diagnosed with serotype 3 were older, more frequently required intensive care, and showed higher mortality. The proportion of IPD caused by non-PCV13 serotypes increased from 28.8% (19/66) in 2000-2005 to 54.8% (40/70) in 2015-2019 (p = 0.001).
Conclusion: The study demonstrated that invasive diseases caused by the most prevalent pneumococcal serotypes differ in their epidemiological and clinical characteristics and case fatality rate. During the study period, there was a significant increase in IPD caused by non-PCV 13 serotypes, limiting the effect of vaccination in adults.
Keywords:
Streptococcus pneumoniae – pneumococcal infections – pneumonia – Meningitis – Conjugate vaccines – vaccination
Autori: D. Veselý 1,2,3; M. F. Kříha 4; O. Džupová 3,5; J. Kozáková 6
; H. Žemličková 7,8; B. Sýkorová 9; E. Nyčová 9; V. Marešová 10; H. Roháčová 3; D. Pícha 1,3; H. Rozsypal 2,3; M. Trojánek 1,3,10
Pôsobisko autorov: Klinika infekčních nemocí, 2. lékařská fakulta, Univerzita Karlova, Praha 1; Klinika infekčních a tropických nemocí, 1. lékařská fakulta, Univerzita Karlova, Praha 2; Klinika infekčních, parazitárních a tropických nemocí, Nemocnice Na Bulovce, Praha 3; Infekční oddělení, Nemocnice České Budějovice a. s., České Budějovice 4; Klinika infekčních nemocí, 3. lékařská fakulta, Univerzita Karlova, Praha 5; Národní referenční laboratoř pro streptokokové nákazy, Státní zdravotní ústav, Praha 6; Ústav mikrobiologie, 3. lékařská fakulta, Univerzita Karlova, Fakultní nemocnice Královské Vinohrady a Státní zdravotní ústav, Praha 7; Národní referenční laboratoř pro antibiotika, Státní zdravotní ústav, Praha 8; Oddělení klinické mikrobiologie, Nemocnice Na Bulovce, Praha 9; Katedra infekčního lékařství, Institut postgraduálního vzdělávání ve zdravotnictví, Praha 10
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 1, s. 10-17
Kategória: Původní práce
Súhrn
Cíl práce: Cílem předkládané studie bylo analyzovat epidemiologické a klinické charakteristiky invazivního pneumokokového onemocnění (IPO) u dospělých pacientů v období před a po zavedení očkování dětí konjugovanými vakcínami v České republice.
Materiál a metody: Do retrospektivní observační sentinelové studie byli zařazeni dospělí pacienti s IPO (kultivační průkaz S. pneumoniae z primárně sterilního materiálu) hospitalizovaní v Nemocnici Na Bulovce v letech 2000–2019.
Výsledky: Ve studijním období bylo diagnostikováno celkem 304 případů onemocnění s věkovým mediánem 58 let (IQR 43-73) a zastoupením mužů a žen 1,49 : 1. Nejčastější klinickou formu představovaly bakteriemické pneumonie (185 případů; 60,9 %) a purulentní meningitidy (90; 29,6 %). Intenzivní péči vyžadovalo 157/293 pacientů (53,6 %) a 77 nemocných onemocnění podlehlo (25,3 %). Sérotyp byl určen u 292 izolátů (96,0 %) a nejčastěji byly prokázány sérotypy 3 (38; 12,5 %), 4 (28; 9,2 %), 7F (24; 7,9 %), 8 (21; 6,9 %) a 1 (18; 5,9 %). Klinické i epidemiologické charakteristiky infekcí vyvolaných nejčastějšími sérotypy se odlišovaly, přičemž onemocnění vyvolaná sérotypem 3 postihovala starší rizikové pacienty, častěji vyžadovala poskytnutí intenzivní péče a měla vyšší smrtnost. Zastoupení sérotypů, které nejsou obsažené ve 13valentní konjugované vakcíně, vzrostlo z 28,8 % (19/66) v letech 2000–2004 na 54,8 % (40/73) v období 2015–2019 (p = 0,001).
Závěry: Studie prokázala, že infekce vyvolané nejčastějšími sérotypy se odlišují nejen svými epidemiologickými charakteristikami, ale i klinickým průběhem a smrtností. Ve sledovaném období došlo k významnému nárůstu IPO vyvolaných sérotypy, které nejsou zařazeny v 13valentní konjugované vakcíně, což limituje dostupné možnosti prevence u pacientů dospělého věku.
Klíčová slova:
Streptococcus pneumoniae – pneumokokové infekce – pneumonie – meningitida – konjugované vakcíny – očkování
ÚVOD
Streptococcus pneumoniae patří mezi časté původce infekcí respiračního traktu a invazivních onemocnění, které celosvětově významně přispívají k celkové nemocnosti i úmrtnosti [1, 2]. Rovněž dopad tohoto onemocnění na českou populaci je značný, přičemž v roce 2018 bylo v systému surveillance invazivního pneumokokového onemocnění (IPO) hlášeno celkem 481 případů a nemocnost dosáhla 4,2 případů/100 000 obyvatel, což je nejvíce od roku 2007, kdy byl celorepublikový program surveillance IPO zahájen. Mezi rizikové skupiny pro rozvoj onemocnění patří především kojenci, batolata, předškolní děti, ale i osoby vyššího věku či pacienti s vybranými komorbiditami [3].
Pro prevenci IPO byla v minulosti připravena řada očkovacích látek. V roce 1983 byla na trh uvedena 23valentní polysacharidová vakcína a v roce 2000 byla ve Spojených státech registrována první konjugovaná vakcína [4]. Na český trh byla 7valentní konjugovaná vakcína uvedena v roce 2005, avšak její užití bylo zpočátku omezeno pro rizikové skupiny a privátní trh. V roce 2010 bylo očkování 10valentní nebo 13valentní pneumokokovou konjugovanou vakcínou (PCV13) ve schématu 3 + 1 zařazeno mezi dobrovolná, ale přesto plně či částečně hrazená očkování v kojeneckém věku. Odhadovaná proočkovanost podle dat zdravotních pojišťoven v letech 2012–2013 dosáhla 68,6 % [5]. V roce 2018 bylo očkovací schéma v dětském věku upraveno na 2 + 1. U osob starších 65 let je očkování proti pneumokokovým nákazám v ČR plně hrazené od 1. 9. 2015, přičemž zpočátku byla pojišťovnami preferována 23valentní vakcína, která byla 1. 9. 2017 nahrazena PCV13. Očkování je dále plně hrazeno pacientům s hypo - či asplenií, významným imunodeficitem nebo po transplantaci krvetvorných buněk a osobám, které prodělaly invazivní pneumokokové či meningokokové onemocnění [6].
V minulých letech bylo prokázáno, že zavedení konjugovaných vakcín do očkovacího kalendáře v dětském věku ovlivnilo nejen incidenci invazivních a slizničních infekcí, ale i kolonizaci sliznic nosohltanu u očkovaných jedinců. Následkem ovlivnění nosičství u očkovaných jedinců byl pozorován pokles incidence pneumokokových infekcí i u neočkovaných osob (tzv. „herd“ efekt) [7–9]. Avšak v současné době je z celé řady zemí hlášen nárůst incidence invazivního pneumokokového onemocnění vyvolaného nevakcinálními sérotypy. Tento vzestup je pozorován nejen u očkovaných dětí, ale má dopad i na rizikovou populaci starších dospělých, čímž je v této populaci limitován možný přímý i nepřímý přínos očkování proti pneumokokům [10–15]. Zvyšující se incidence pneumokokových infekcí vyvolaných nevakcinálními sérotypy u neočkovaných dospělých osob pravděpodobně souvisí se změnami v osídlení nosohltanu u očkovaných dětí [16, 17].
Cílem předkládané observační sentinelové studie bylo zjistit, jak se v průběhu 20letého období změnily epidemiologické charakteristiky invazivního pneumokokového onemocnění u dospělých pacientů hospitalizovaných v nemocnici fakultního typu, která dlouhodobě patří mezi pracoviště s nejvyššími počty hlášených případů IPO v národním systému surveillance.
MATERIÁL A METODY
Do retrospektivní observační sentinelové studie byli zařazeni dospělí pacienti (≥ 18 let) hospitalizovaní pro invazivní pneumokokové onemocnění v letech 2000 až 2019 v Nemocnici Na Bulovce v Praze. Pacienti byli zařazeni, pokud byl S. pneumoniae kultivačně prokázán z primárně sterilních materiálů (krev, mozkomíšní mok, pleurální, peritoneální nebo synoviální výpotek), avšak do studie nebyly zařazeny případy, u kterých byla diagnóza stanovena pouze pomocí detekce pneumokokového antigenu či nukleových kyselin metodou PCR. Jednotlivé případy byly identifikovány retrospektivně s využitím nemocničního informačního systému UNIS a databáze Národní referenční laboratoře (NRL) pro streptokokové nákazy Státního zdravotního ústavu (SZÚ). Klinická a epidemiologická data byla získána z nemocničního informačního systému UNIS a zahrnovala věk, pohlaví, délku hospitalizace, závěrečnou diagnózu, komplikace a výsledek léčby.
Všechny izolované kmeny S. pneumoniae byly identifikovány podle typické morfologie kolonií, alfa hemolýzy na krevním agaru, citlivosti v optochinovém testu a testu rozpustnosti ve žluči. Sérotypizace pneumokoků byla provedena v NRL pro streptokokové nákazy SZÚ s použitím typových a faktorových antisér (Statens Seruminstitut, Copenhagen, Denmark) [18].
Pro epidemiologické účely byla studie rozdělena na 4 období v závislosti na implementaci pneumokokových konjugovaných vakcín v dětském věku v ČR: 2000–2005 (před zavedením očkování), 2006–2009 (konjugované vakcíny na privátním trhu a pro rizikové skupiny), 2010 až 2014 (časné vakcinační období), 2015–2019 (pozdní vakcinační období). Závažný průběh onemocnění byl definován jako úmrtí pacienta a/nebo příjem na jednotku intenzivní péče a/nebo hospitalizace delší jak 20 dnů a/nebo překlad na lůžko následné péče.
Pro zpracování souboru byly použity standardní statistické postupy. Kategorické proměnné jsou prezentovány jako absolutní frekvence a procenta; spojité proměnné jako mediány s kvartilovým rozpětím (IQR). Kategorické proměnné byly porovnány s užitím Fisherova a chi-kvadrátového testu. K porovnání spojitých dat byl použit Mannův-Whitneyův a Kruskalův-Wallisův test. Pro potřeby této studie byla zvolena hladina signifikace p = 0,05. Analýza dat byla provedena v programu GraphPad Prism 8.4.2 (GraphPad Software, Inc., San Diego, California, USA).
VÝSLEDKY
Ve studijním období bylo kultivačními metodami prokázáno celkem 304 případů IPO. Zastoupení mužů a žen v souboru bylo 1,49 : 1 a věkový medián 58 let (IQR 43-73), přičemž věk žen byl vyšší [59 let (IQR 49 až 76)] než mužů [55 (IQR 41-68), p = 0,042]. Celkem 40 pacientů (13,2 %) bylo mladších 35 let, 63 (20,7 %) ve věku 35–49 let, 96 (31,6 %) ve věku 50–64 let a 105 (34,5 %) osob bylo starších 65 let. Onemocnění vykazovalo typickou sezonnost, přičemž nejvíce případů bylo prokázáno v zimních (115; 37,8 %) a jarních (91; 29,9 %) měsících, naopak v letním období bylo diagnostikováno pouze 29 případů (9,5 %).
Podrobná data o očkování proti pneumokokovým infekcím byla dohledána u 90 pacientů, avšak očkován byl pouze jeden pacient (PCV13), který se nakazil nevakcinálním sérotypem 23B.
Nejčastější klinickou formu onemocnění představovaly bakteriemické pneumonie (185 případů; 60,9 %). Purulentních meningitid bylo diagnostikováno celkem 90 (29,6 %). Ostatní klinické formy byly popsány u 29 pacientů (9,5 %), z toho nejčastější byly bakteriémické infekce bez zřejmého fokusu (16; 5,3 %). Avšak v naší studii byly popsány také některé z méně častých invazivních pneumokokových infekcí: septická artritida (4; 1,3 %), primární peritonitida (3; 1,0 %), infekce mediastina a pleurální dutiny bez zánětlivých změn v plicním parenchymu (3; 1,0 %), infekce měkkých tkání s bakteriémií (2; 0,7 %) a infekční endokarditida (1; 0,3 %). K rozvoji onemocnění došlo u 272/295 pacientů (92,2 %) v komunitním prostředí a nozokomiální infekce byla potvrzena u 23/295 (7,8 %) nemocných, ve zbylých 9 případech nebylo možné na základě dostupné dokumentace o původu onemocnění rozhodnout. Intenzivní péči vyžadovalo 157/293 pacientů (53,6 %) a 77 nemocných onemocnění podlehlo (25,3 %).
Počty a věk pacientů, zastoupení jednotlivých diagnóz a smrtnost infekce v jednotlivých obdobích uvádí tabulka 1. Z této tabulky vyplývá, že od druhého studijního období (2006–2009) zůstává zastoupení jednotlivých klinických forem přibližně shodné, rovněž tak nebyl prokázán signifikantní rozdíl v závažnosti (viz definice v části Materiál a metody) a smrtnosti onemocnění. Z prezentovaných dat je však zřejmé, že došlo k významnému nárůstu věkového mediánu nemocných, zejména v období mezi lety 2000–2005 až 2010–2014.
Tab. 1. Demografické a klinické údaje podle studijních období
Table 1. Demographic and clinical data by study period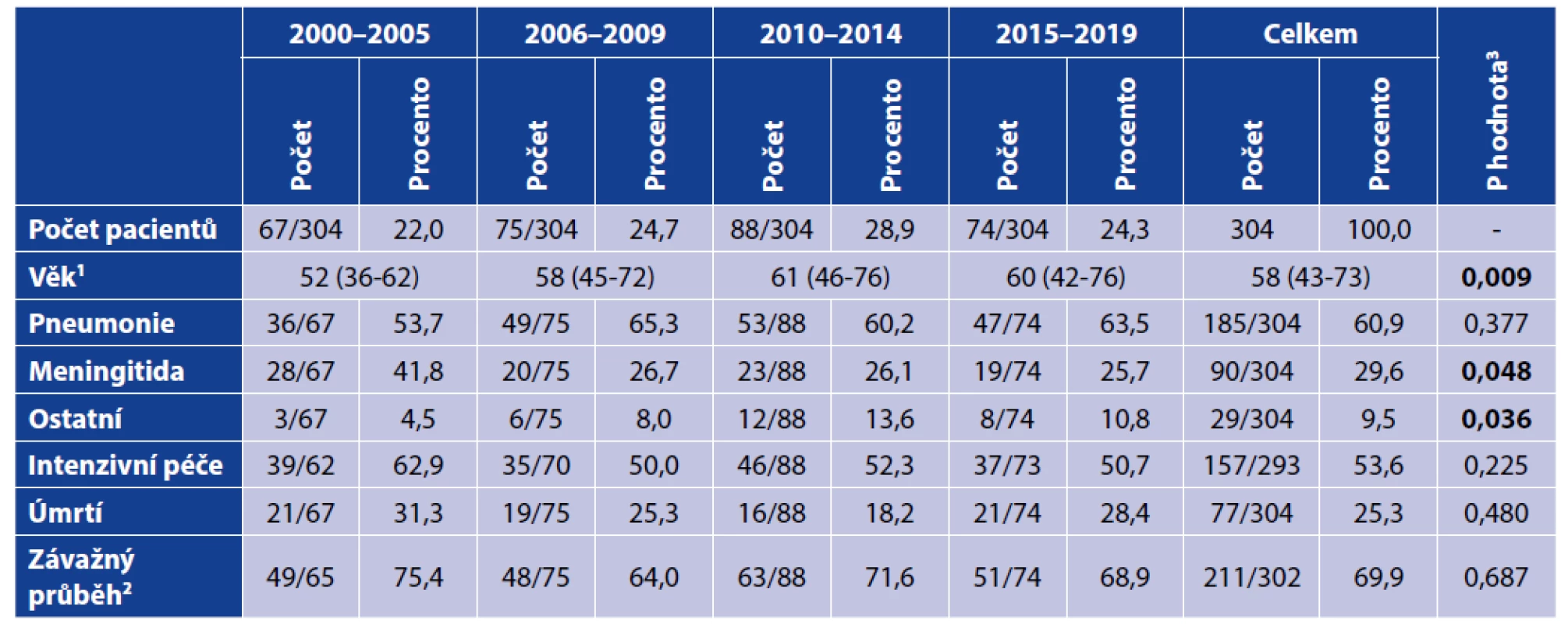
1Spojité proměnné jsou prezentovány jako medián s interkvartilovým rozptylem.
2Závažný průběh je pro potřeby naší studie definován jako úmrtí/potřeba intenzivní nebo následné péče, případně délka hospitalizace více jak 20 dnů.
3Podrobnější údaje o použitých statistických testech jsou uvedeny v sekci „Materiál a metody“.
1Continuous variables are presented as medians with interquartile ranges.
2A severe clinical course is defined in this study as death/need for intensive and/or prolonged care, or length of hospital stay of more than 20 days.
3More details on the statistical tests used are provided in the Material and Methods section.Z celkového počtu izolovaných kmenů byl sérotyp určen u 292 z nich (96,0 %). Nejčastěji byly určeny následující sérotypy: 3 (38; 12,5 %), 4 (28; 9,2 %), 7F (24; 7,9 %), 8 (21; 6,9 %) a 1 (18; 5,9 %). Podrobné informace o zastoupení jednotlivých sérotypů v průběhu studie uvádí tabulka 2.
Tab. 2. Izolované sérotypy S. pneumoniae podle studijních období
Table 2. Isolated serotypes of S. pneumoniae by study period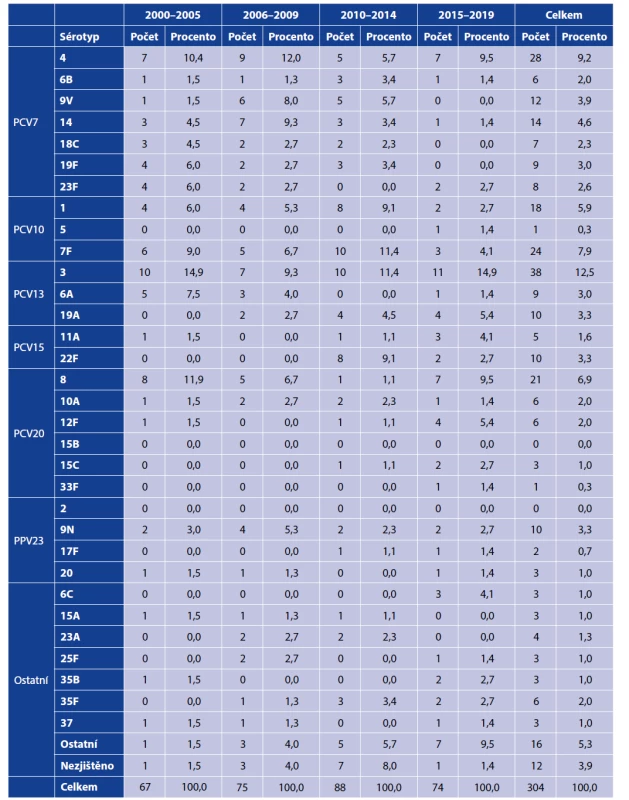
Procentní vyjádření se vztahuje k jednotlivým studijním obdobím – jmenovatel procentního zlomku je uveden v závěrečném řádku „Celkem“.
The percentages relate to the individual study periods – the denominator is given in the bottom line “Total”.Klinický průběh onemocnění vyvolaný nejčastějšími sérotypy je uveden v tabulce 3. Z uvedených údajů vyplývá, že invazivní onemocnění vyvolaná těmito sérotypy se odlišují nejen věkem nemocných, ale i délkou hospitalizace, potřebou intenzivní péče a klinickou formou. Významný rozdíl lze prokázat zejména mezi sérotypem 3, který má nízký invazivní potenciál, proto vyvolává závažnější infekce s nutností poskytnutí intenzivní péče a relativně vysokou smrtností u rizikových osob vyššího věku a sérotypem 1, který má vysoký invazivní potenciál, proto vyvolává zejména pneumonie u zdravých osob nižšího věku, avšak s významně nižší smrtností, přičemž obdobné charakteristiky byly popsány u infekcí vyvolaných sérotypem 4.
Tab. 3. Klinický průběh onemocnění vyvolaných nejčastějšími sérotypy
Table 3. Clinical characteristics of the diseases caused by the most prevalent serotypes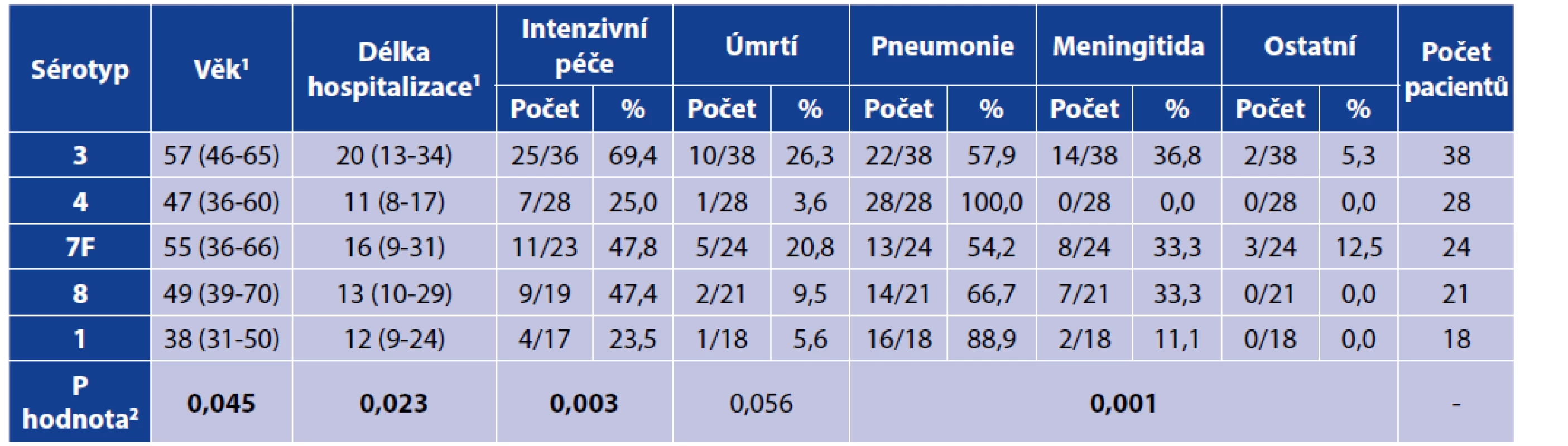
1Spojité proměnné jsou prezentovány jako medián s interkvartilovým rozptylem.
2Podrobnější údaje o použitých statistických testech jsou uvedeny v sekci „Materiál a metody“.
1Continuous variables are presented as medians with interquartile range.
2More details on the statistical tests used provided in the Material and Methods section.Ve studii bylo jednoznačně prokázáno, že v průběhu 20letého období došlo k signifikantnímu poklesu sérotypů obsažených ve všech užívaných konjugovaných vakcínách, přičemž podrobná data uvádí tabulka 4. Zastoupení sérotypů, které nejsou obsažené v PCV13, vzrostl z 28,8 % (19/66) v letech 2000–2004 na 54,8 % (40/73) v období 2015–2019, p = 0,001. Naopak rozdíl v zastoupení sérotypů obsažených ve 23valentní polysacharidové vakcíně ve shodném období nebyl signifikantní [57/66 (86,4 %) versus 55/73 (75,3 %), p = 0,133]. Zastoupení izolovaných sérotypů v dostupných konjugovaných vakcínách v posledním sledovaném období (2015–2019) bylo nízké a v případě PCV13 představovalo pouze 45,2 % (33/73).
Tab. 4. Zastoupení sérotypů izolovaných kmenů ve vakcínách podle studijních období
Table 4. Isolates of vaccine serotypes by study period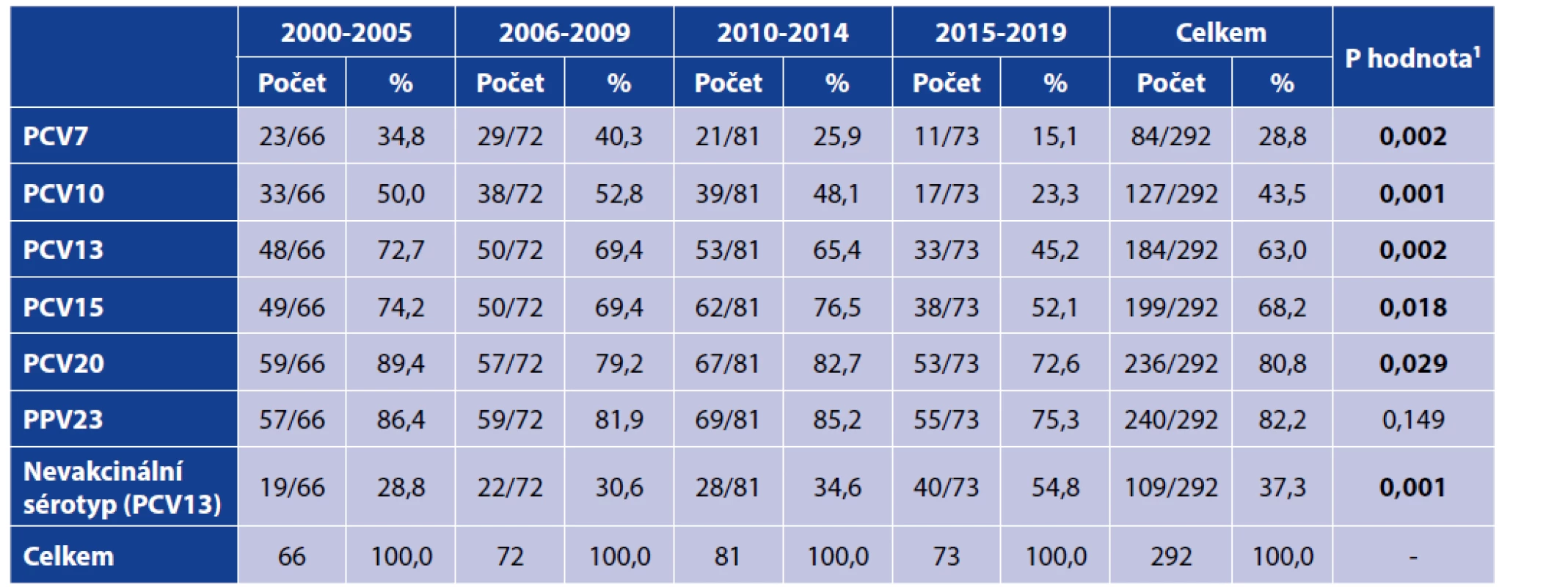
1Podrobnější údaje o použitých statistických testech jsou uvedeny v sekci „Materiál a metody“.
1More details on the statistical tests used are provided in the Material and Methods section.DISKUSE
Předkládaná retrospektivní observační sentinelová studie hodnotila epidemiologické a klinické charakteristiky IPO u dospělých pacientů hospitalizovaných v Nemocnici Na Bulovce během 20letého období, ve kterém došlo k implementaci plošného programu očkování dětí konjugovanými vakcínami. Výhodou pracoviště, které bylo pro sentinelovou epidemiologickou studii zvoleno, je dlouhodobě vysoký počet hlášených případů IPO, což souvisí se zavedenou standardní praxí rutinního odběru hemokultur při přijetí pacientů s febrilním stavem.
Ve studii bylo zjištěno, že IPO u dospělých pacientů ve více než polovině případů vyžadovala poskytnutí intenzivní péče a u čtvrtiny nemocných vedla k úmrtí. Většina pacientů zařazených do naší studie byla starších 50 let, přičemž 31,6 % případů bylo diagnostikováno ve věkové kategorii 50–64 let a 34,5 % u osob starších 65 let. Ve studijním období došlo k nárůstu věkového mediánu nemocných, což lze vysvětlit poklesem počtu případů vyvolaných vybranými vakcinálními sérotypy, které častěji vyvolávají infekce u mladých a zdravých osob (zejména sérotyp 1), a nárůstem onemocnění vyvolaných nevakcinálními (non-PCV13) sérotypy, které se naopak častěji uplatňují jako původci IPO u starších a rizikových pacientů (např. 8, 11A, 12F). Relativně vysoká incidence onemocnění u osob ve věkové kategorii 50–64 let byla opakovaně pozorována i v zahraničních studiích. Vzhledem k tomu, že osoby z této věkové skupiny jsou společensky a pracovně aktivní, předpokládá se, že přímé a nepřímé výdaje spojené s IPO u těchto pacientů jsou vyšší než u seniorů, proto někteří autoři doporučují očkování i v této věkové kategorii [7, 19, 20].
Nejčastější klinické formy v našem souboru představovaly bakteriemické pneumonie (60,9 %) a purulentní meningitidy (29,6 %). Pro srovnání v rozsáhlém souboru u pacientů s IPO v USA byly nejčastěji diagnostikovány pneumonie (53 %) a bakteriemické infekce bez zjištěného fokusu (40 %), přičemž purulentní meningitidy byly prokázány pouze v 5 % případů [21]. Odlišné zastoupení pacientů s jednotlivými klinickými formami v různých studiích souvisí s hemokultivační praxí v daném regionu, neboť zejména v zemích, kde se rutinně provádí odběr hemokultur i u ambulantních pacientů, bývá vyšší zastoupení bakteriemických infekcí bez prokázaného fokusu či bakteriemických pneumonií. Větší zastoupení purulentních meningitid v našem souboru může souviset také s tím, že naše klinika slouží jako referenční centrum pro pacienty s neuroinfekcemi, kteří jsou překládáni z ostatních pražských pracovišť. Přesto lze studijní pracoviště považovat za vhodné k provedení sentinelové epidemiologické studie, neboť poměr počtu případů meningitidy a pneumonie zůstal od druhého studijního období relativně stabilní a častěji byly prokázány pneumonie nebo bakteriemické infekce bez fokusu, jež bývají diagnostikovány především na klinických pracovištích s dobře nastaveným systémem rutinního odběru hemokultur. O dobré hemokultivační praxi na našem pracovišti svědčí i záchyt relativně vzácných forem IPO, u kterých se v klinické praxi obvykle na pneumokokovou etiologii nepomýšlí.
Naše výsledky jednoznačně prokazují, že po implementaci plošného očkování konjugovanými vakcínami v dětském věku došlo k signifikantnímu poklesu infekcí vyvolaných vakcinálními sérotypy u dospělých pacientů. Naproti tomu počet i celkové zastoupení případů IPO vyvolaných nevakcinálními sérotypy významně vzrostlo. Vzhledem k minimální proočkovanosti dospělé populace v České republice nelze předpokládat, že by se jednalo o přímý efekt vakcinace dospělých. Rovněž tak se pravděpodobně nejedná o selekci, která by byla vyvolána rozšířením kmenů s odlišnou citlivostí na antibiotika, protože izoláty S. pneumoniae jsou k antibiotikům velmi dobře citlivé.
Obdobně nepříznivá situace byla popsána i v zahraničních studiích. Kanadská studie popisující sedmileté období 2010–2016 poukazuje na signifikantní nárůst případů IPO způsobených nevakcinálními sérotypy z 266 (25,1 %) na 416 (38,4 %) izolátů (p < 0,05; OR = 0,538; 95% CI = 0,447–0,647) spolu s nárůstem případů vyvolaných sérotypem 3 z 86 (8,1 %) v roce 2010 na 96 (8,9 %) v roce 2016 (p < 0,05; OR = 0,284; 95% CI = 0,197–0,409) [22]. Katalánská studie hodnotila nepřímý efekt očkování kojugovanými vakcínami v dětské populaci na IPO u osob starších 65 let věku srovnáním situace v roce 2009 (před zavedením PCV13) a v období 2014–2016 (po implementaci PCV13). Autoři popisují vzestup incidence onemocnění vyvolaných nevakcinálními sérotypy o 36 % a jako nejčastější byl shodně prokázán sérotyp 3 (11,6 %) [23]. Německá studie popisuje nárůst IPO vyvolaných sérotypy obsaženými v 13valentní konjugované vakcíně u osob starších 60 let z 2,44/100 000 v letech 2013/14 na 3,17/100 000 v období 2017/18, avšak příčinou tohoto vývoje je především signifikantní vzestup počtu onemocnění vyvolaných rizikovým sérotypem 3, který vyvolal 21 % všech případů IPO v této věkové skupině [24]. Dominující zastoupení sérotypu 3, přestože se jedná o sérotyp zastoupený ve 13valentní konjugované vakcíně, podle řady autorů souvisí se suboptimální účinností konjugované vakcíny proti tomuto sérotypu [25, 26, 12].
Potenciální vysvětlení nárůstu incidence invazivního pneumokokového onemocnění vyvolaného nevakcinálními sérotypy u dospělých představuje nepřímý efekt očkování konjugovanými vakcínami v dětském věku, který byl obdobně pozorován po zavedení 7valentní konjugované vakcíny [8, 9, 27], přestože v některých státech, jako např. ve Francii, Španělsku či Nizozemí, nebyl signifikantní [28–32]. V rozsáhlé evropské metaanalýze byl však tento nepřímý efekt po implementaci PCV v dětském věku prokázán, avšak s významnými rozdíly v závislosti na užité vakcíně. Patrně kvůli rozdílům v metodice surveillance, nejednotné definici klinického případu a odlišným klinickým zvyklostem byl nepřímý efekt očkování popsán v jednotlivých národních systémech surveillance v odlišné míře a statisticky se širokými intervaly spolehlivosti [33].
Pozorovaný nárůst incidence IPO vyvolaných nevakcinálními sérotypy představuje značné riziko, protože snižuje nejen nepřímý efekt očkování dětí na celkovou incidenci IPO u dospělých, ale i možnost využití současných vakcín pro přímou protekci [14]. Recentně byly publikovány výsledky studií, které v době plošné vakcinace PCV13 uvádějí jako nejpravděpodobnější původce pneumokokové pneumonie u hospitalizovaných pacientů starších 65 let právě sérotypy, které nejsou zařazeny v 13valentní konjugované vakcíně [34–36]. Proto i americký Poradní sbor pro imunizační postupy (ACIP) změnil doporučení pro užití PCV13 ve skupině dospělých nad 65 let: u nově očkovaných je užití PCV13 ke zvážení, resp. není doporučované, pokud nejsou přítomny další vysoce rizikové faktory pro rozvoj IPO jako likvorhea, přítomnost kochleárního implantátu nebo imunosuprese [37].
Smrtnost invazivního pneumokokového onemocnění u dospělých pacientů v rozvinutých zemích je udávána mezi 11–30 % [21]. Smrtnost v naší studii poklesla z 31,3 % v prevakcinačním období na 18,2 % v letech 2010–2014 s následným vzestupem na 28,4 % v posledním studijním období (2015–2019). Přestože tento trend není statisticky signifikantní, mohl by souviset s replacementem sérotypy, které častěji vyvolávají infekce u rizikových starších a imunodeficientních pacientů s horší prognózou. Konkrétně v naší studii bylo zjištěno, že mezi tyto tzv. rizikové sérotypy patří i sérotyp 3, jehož incidence spolu s nevakcinálními sérotypy narůstá. Avšak smrtnost mohla být ovlivněna i dalšími faktory, především aktivnější přístup k odběrům hemokultur a hlášení případů IPO po implementaci vakcinace PCV mohl vést k častějšímu průkazu méně závažných případů v časném postvakcinačním období, které nebyly v prevakcinačním období zjištěny. Dalším zavádějícím faktorem mohou být změny v poskytované intenzivní a léčebné péči během sledovaného 20letého období.
Limitací předkládané studie je její neintervenční sentinelový design, který neumožňuje podrobně analyzovat všechny pozorované trendy v epidemiologii a klinickém průběhu IPO a stanovit jejich příčinu. Proto ani nemůže nahradit analýzu z výstupů celostátního systému surveillance IPO či rozsáhlejší analytické či intervenční studie, které by mohly přispět k lepšímu pochopení příčiny pozorovaných trendů a měly by být podkladem pro stanovení budoucí strategie v prevenci IPO v ČR.
ZÁVĚRY
Invazivní pneumokoková onemocnění představují i v současné době významnou příčinu nemocnosti nejen v dětském věku, ale zejména u dospělých pacientů. Předkládaná studie prokázala, že IPO u dospělých pacientů představuje závažné onemocnění, které často vyžaduje poskytnutí metod intenzivní péče a mnohdy vede k úmrtí pacienta. Ve sledovaném období byl prokázán signifikantní nárůst věku nemocných. Zároveň bylo zjištěno, že klinický průběh onemocnění vyvolaných nejčastěji izolovanými sérotypy se odlišuje, přičemž za rizikový lze považovat především sérotyp 3, jež vyvolává závažnější infekce u starších nemocných s vyšší smrtností a jehož incidence je dlouhodobě vysoká. Nepříznivým faktem z epidemiologického hlediska, který ovlivňuje výskyt IPO v ČR, je trvale klesající proočkovanost kojenců a batolat. Výsledky předkládané studie však dále ukazují, že v průběhu sledovaného období došlo k významnému replacementu nevakcinálními sérotypy, který značně limituje užití pneumokokových konjugovaných vakcín v prevenci IPO u dospělých pacientů. Možné řešení tohoto problému představuje uvedení nových vícevalentních konjugovaných vakcín na trh.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 17-29256A, 2017-2020. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Do redakce došlo dne 11. 8. 2020.
Adresa pro korespondenci:
MUDr. Milan Trojánek, Ph.D.
Klinika infekčních nemocí 2. LF UK
Budínova 2
180 81 Praha 8
e-mail: milan.trojanek@bulovka.cz
Zdroje
1. Burman LA, Norrby R, Trollfors B. Invasive pneumococcal infections: Incidence, predisposing factors, and prognosis. Rev Infect Dis, 1985;7(2):133–142.
2. Blasi F, Mantero M, Santus P, et al. Understanding the burden of pneumococcal disease in adults. Clin Microbiol Infect, 2012;18(Suppl 5):7–14.
3. Kozáková J, Okonji Z, Šebestová H, et al. Invazivní pneumokokové onemocnění v České republice v roce 2018. Zprávy CEM (SZÚ, Praha), 2019;28(7):277–282.
4. Pittet LF, Posfay-Barbe K. Pneumococcal vaccines for children: A global public health priority. Clin Microbiol Infect, 2012;18(Suppl 5):25–36.
5. Petráš M, Adámková V. Epidemiology of invasive pneumococcal disease in Czech children under 5 years of age after routine immunisation. Cent Eur J Public Health, 2016;24(2):133–136.
6. Doporučení České vakcinologické společnosti ČLS JEP a Odborné společnosti praktických dětských lékařů ČLS JEP k vytvoření metodiky pro vykazování a úhrady očkování vyplývající z novelizace vyhlášky č. 537/2006 Sb. a zákona č. 48/1997 Sb. [online]. 2017-12-14 [cit. 2020-06-30]. Dostupný na www: <http://www.szu.cz/uploads/Epidemiologie/Ockovani/2018_Doporuceni_CVS_a_OSPDL.pdf
7. Weycker D, Sato R, Strutton D, et al. Public health and economic impact of 13-valent pneumococcal conjugate vaccine in US adults aged ≥ 50 years. Vaccine, 2012;30 : 5437–5444.
8. Lexau CA, Lynfield R, Daniela R, et al. Changing epidemiology of invasive pneumococcal disease among older adults in the era of pediatric pneumococcal conjugate vaccine. J Am Med Assoc, 2005;294 : 2043–2051.
9. Pilishvili T, Lexau C, Farley MM, et al. Sustained Reductions in Invasive Pneumococcal Disease in the Era of Conjugate Vaccine. J. Infect. Dis, 2010;201 : 32–41.
10. Ciruela P, Izquierdo C, Broner S, et al. The changing epidemiology of invasive pneumococcal disease after PCV13 vaccination in a country with intermediate vaccination coverage. Vaccine, 2018;36 : 7744–7452.
11. De Wals P, Lebvre B, Deceuninck G, et al. Incidence of invasive pneumococcal disease before and during an era of use of three different pneumococcal conjugate vaccines in Quebec. Vaccine, 2018;36(3):421–426.
12. Ladhani SN, Collins S, Djennad A, et al. Rapid increase in non-vaccine serotypes causing invasive pneumococcal disease in England and Wales, 2000–17: a prospective national observational cohort study. Lancet Infect Dis, 2018;18(4):441–451.
13. Eton V, Schroeter A, Kelly L, et al. Epidemiology of invasive pneumococcal and Haemophilus influenzae diseases in Northwestern Ontario, Canada, 2010–2015. Int J Infect Dis, 2017;65 : 27–33.
14. Zamalloa PL, Sanz Moreno J, Gavín MA, et al. Trends of invasive pneumococcal disease and its serotypes in the Autonomous Community of Madrid. Enferm Infecc Microbiol Clin, 2018;36(10):612–620.
15. Mahmud SM, Sinnock H, Mostaco-Guidolin LC, et al. Long-term trends in invasive pneumococcal disease in Manitoba, Canada. Hum Vaccines Immunother, 2017;13(8):1884–1891.
16. Vissers M, Wijmenga-Monsuur AJ, Knol MJ, et al. Increased carriage of non-vaccine serotypes with low invasive disease potential four years after switching to the 10-valent pneumococcal conjugate vaccine in The Netherlands. PLoS One, 2018;13(3): e0194823.
17. Devine VT, Cleary DW, Jefferies JMC, et al. The rise and fall of pneumococcal serotypes carried in the PCV era. Vaccine, 2017;35 : 1293–1298.
18. Sorensen UB. Typing of pneumococci by using 12 pooled antisera. J Clin Microbiol, 1993;31(8):2097–2100.
19. Weycker D, Strutton D, Edelsberg J, et al. Clinical and economic burden of pneumococcal disease in older US adults. Vaccine, 2010;28 : 4955–4960.
20. Song JY, Choi JY, Lee JS, et al. Clinical and economic burden of invasive pneumococcal disease in adults: a multicenter hospital-based study. BMC Infect Dis, 2013;13 : 202.
21. Drijkoningen JJC, Rohde GGU. Pneumococcal infection in adults: Burden of disease. Clin Microbiol Infect, 2014;20(S5):45–51.
22. Demczuk WHB, Martin I, Desai S, et al. Serotype distribution of invasive Streptococcus pneumoniae in adults 65 years of age and over after the introduction of childhood 13-valent pneumococcal conjugate vaccination programs in Canada, 2010–2016. Vaccine, 2018;36 : 4701–4707.
23. Ciruela P, Broner S, Izquierdo C, et al. Indirect effects of paediatric conjugate vaccines on invasive pneumococcal disease in older adults. Int J Infect Dis, 2019;86 : 122–130.
24. van der Linden M, Imohl M, Perniciaro S. Limited indirect effects of an infant pneumococcal vaccination program in an aging population. PLoS One, 2019;14(8): e0220453.
25. Waight PA, Andrews NJ, Ladhani SN, et al. Effect of the 13-valent pneumococcal conjugate vaccine on invasive pneumococcal disease in England and Wales 4 years after its introduction : an observational cohort study. Lancet Infect Dis, 2015;15(5): 535–543.
26. Andrews NJ, Waight PA, Burbidge P, et al. Serotype-specific effectiveness and correlates of protection for the 13-valent pneumococcal conjugate vaccine: a postlicensure indirect cohort study. Lancet Infect Dis, 2014;14(9):839–846.
27. Whitney CG, Farley MM, Hadler J, et al. Decline in Invasive Pneumococcal Disease after the Introduction of Protein–Polysaccharide Conjugate Vaccine. N Engl J Med, 2003;348(18):1737–1746.
28. Ardanuy C, Tubau F, Pallares R, et al. Epidemiology of Invasive Pneumococcal Disease among Adult Patients in Barcelona Before and After Pediatric 7‐Valent Pneumococcal Conjugate Vaccine Introduction, 1997–2007. Clin Infect Dis, 2009;48(1):57–64.
29. Calbo E, Diaz A, Canadell E, et al. Invasive pneumococcal disease among children in a health district of Barcelona: Early impact of pneumococcal conjugate vaccine. Clin Microbiol Infect, 2006;12(9):867–872.
30. Lepoutre A, Varon E, Georges S, et al. Impact of infant pneumococcal vaccination on invasive pneumococcal diseases in France, 2001–2006. Euro Surveill, 2006;13(7-9):1–6.
31. Rodenburg GD, de Greeff SC, Jansen A, et al. Effects of pneumococcal conjugate vaccine 2 years after its introduction, the Netherlands. Emerg Infect Dis, 2010;16(5):816–823.
32. Myint TTH, Madhava H, Balmer P, et al. The impact of 7-valent pneumococcal conjugate vaccine on invasive pneumococcal disease: A literature review. Adv Ther, 2013;30(2):127–151.
33. Hanquet G, Krizova P, Valentiner-Branth P, et al. Effect of childhood pneumococcal conjugate vaccination on invasive disease in older adults of 10 European countries: Implications for adult vaccination. Thorax, 2019;74(5):473–482.
34. McLaughlin JM, Jiang Q, Isturiz RE, et al. Effectiveness of 13-Valent Pneumococcal Conjugate Vaccine Against Hospitalization for Community-Acquired Pneumonia in Older US Adults: A Test-Negative Design. Clin Infect Dis, 2018;67(10):1498–1506.
35. Daniel P, Rodrigo C, Bewick T, et al. 13-Valent vaccine serotype pneumococcal community acquired pneumonia in adults in high clinical risk groups. Vaccine, 2018;36 : 1614–1620.
36. Pelton SI, Bornheimer R, Doroff R, et al. Decline in Pneumococcal Disease Attenuated in Older Adults and Those with Comorbidities Following Universal Childhood PCV13 Immunization. Clin Infect Dis, 2019;68(11):1831–1838.
37. Matanock A, Lee G, Gierke R, et al. Use of 13-Valent Pneumococcal Conjugate Vaccine and 23-Valent Pneumococcal Polysaccharide Vaccine Among Adults Aged ≥65 Years: Updated Recommendations of the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep, 2019;68(46):1069–1075.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek Reinfekce covidem-19Článek Za MUDr. Vladimírem Verhunem
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2021 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Opakovaně negativní PCR u pacientů s projevy covid-19: Mají či nemají infekci SARS-CoV-2?
-
Invazivní pneumokoková onemocnění u dospělých pacientů hospitalizovaných v Nemocnici Na Bulovce:
sérotypový replacement po zavedení plošné vakcinace dětí - Zkušenosti s léčbou virové hepatitidy C u injekčních uživatelů návykových látek v programu substituční léčby metadonem
- Analýza invalidity pro onemocnění HIV za roky 2010–2018
- Preventivní opatření, rizikové chování a nejčastější zdravotní obtíže u českých cestovatelů: prospektivní dotazníková studie u pacientů ošetřených na ambulanci cestovní medicíny
- Listerióza – analýza výskytu humánních případů v České republice v letech 2008–2018
- Enzymová léčba infekcí kůže a měkkých tkání
- Reinfekce covidem-19
- Potenciálny problém spoločného výskytu pandemického covidu-19 a sezónnej chrípky
- Prvé laboratórne potvrdené invazívne meningokokové ochorenie séroskupiny C s abdominálnou klinickou prezentáciou na Slovensku, 2019
-
Zemřel MUDr. Vladimír Zikmund, CSc.
(27. 5. 1925–18. 10. 2020) - Za MUDr. Vladimírem Verhunem
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Opakovaně negativní PCR u pacientů s projevy covid-19: Mají či nemají infekci SARS-CoV-2?
- Listerióza – analýza výskytu humánních případů v České republice v letech 2008–2018
- Reinfekce covidem-19
- Enzymová léčba infekcí kůže a měkkých tkání
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



