Riziko nádorov pri liečbe diabetes mellitus inzulínom a preparátmi sulfonylurey
Risk of cancers in the treatment of diabetes mellitus by insulin and sulphonylurea drugs
Type 2 diabetes mellitus is associated with increased risk of some types of carcinomas mainly carcinoma of liver and pancreas, colorectal carcinoma, breast, endometrial and bladder cancers, which is modulated by antidiabetic treatment. Insulin is important growth factor for cancers, but it is not cancerogenic and it does not cause the development of cancers, however it can promote growth of tumors such growth factor. According to clinical studies insulin and sulphonylurea drugs moderately increase cancer risk compared to metformin, which is decreased by their combination with metformin. Insulin analogues, including insulin glargine not increase cancer risk compared to standard insulin and they are considered as safe from oncologic point of view.
Keywords:
type 2 diabetes mellitus – insulin – risk of cancers – sulphonylurea drugs
Autori:
Marián Mokáň; Peter Galajda
Pôsobisko autorov:
I. interná klinika JLF UK a UNM, Martin
Vyšlo v časopise:
Forum Diab 2022; 11(3): 151-156
Kategória:
Prehľadová práce
Súhrn
Diabetes mellitus 2. typu sa spája so zvýšeným výskytom niektorých typov karcinómov, najmä karcinómu pečene a pankreasu, kolorektálneho karcinómu, karcinómov prsníka, endometria a močového mechúra, ktorý môže byť modulovaný antidiabetickou liečbou. Inzulín je dôležitý rastový faktor pre nádory, ale nie je karcinogén a nezapríčiňuje vznik nádorov, avšak ako rastový faktor môže podporovať ich rast. Inzulín a preparáty sulfonylurey podľa klinických štúdií v porovnaní s metformínom mierne zvyšujú riziko karcinómov, ktoré sa zníži ich kombináciou s metformínom. Inzulínové analógy, vrátane inzulínu glargín v porovnaní s inzulínom nezvyšujú riziko zhubných nádorov a považujú sa z onkologického hľadiska za bezpečné.
Klíčová slova:
diabetes mellitus 2. typu – inzulín– preparáty sulfonylurey – riziko nádorov
Úvod
Diabetes mellitus 2. typu (DM2T) sa spája so zvýšeným rizikom vzniku onkologických chorôb (najmä karcinómu pečene a pankreasu, kolorektálneho karcinómu, karcinómov prsníka, endometria a močového mechúra). Štandardy Americkej diabetologickej asociácie (ADA – American Diabetes Association) zaraďujú onkologické choroby medzi definované komorbidity u pacientov s DM2T, pričom za hlavné rizikové faktory sa považujú vyšší vek, obezita a fyzická inaktivita, ako aj faktory súvisiace s etiopatogenézou DM2T, ako sú inzulínová rezistencia (IR) a hyperinzulinémia (HI). U diabetikov sa odporúča vykonávať príslušný štandardný skríning onkologických chorôb a redukovať modifikovateľné rizikové faktory (obezita, fyzická inaktivita, fajčenie). Riziko vzniku karcinómov by mohlo byť ovplyvnené antidiabetickou liečbou zasahujúcou do etiopatogenetických mechanizmov diabetu, ale stále na to nemáme jednoznačné dôkazy [1].
Podľa zásad medicíny založenej na dôkazoch nemáme jednoznačnú a definitívnu odpoveď ohľadom onkologickej bezpečnosti antidiabetickej liečby. Vyplýva to jednak zo skutočnosti, že DM2T sa a priori spája so zvýšeným rizikom výskytu zhubných nádorov. Vzhľadom na incidenciu nádorových ochorení na rozdiel od klinických štúdií zameraných na kardiovaskulárnu (KV) bezpečnosť by sme v prípade onkologickej bezpečnosti potrebovali dlhodobé (viac ako 5-ročné) „gigaštúdie“ s optimálnym počtom okolo 100 tisíc vyšetrených pacientov, sledujúce výskyt nádorov ako primárny endpoint a randomizované štúdie zamerané na skupiny s porovnateľnými rizikovými faktormi nádorov. Takéto štúdie však z hľadiska systému organizovania a finančného zabezpečenia nie sú reálne.
Na objasnenie vzťahu liečby DM2T k výskytu nádorov z hľadiska dostatočne veľkých súborov a doby sledovania sa v súčasnosti môžeme opierať o výsledky retrospektívneho hodnotenia veľkých registrov pacientov, ktoré však nie vždy poskytujú dostatočné informácie o rizikových faktoroch nádorov (dĺžka trvania DM2T, predchádzajúca liečba DM2T, výskyt obezity, fajčenia a pod), a preto rôzne liečené skupiny nemusia byť porovnateľné. Prípadové „case/control“ štúdie, sledujúce relevantné rizikové faktory, nie sú prospektívne, a tak nemusia byť z hľadiska posúdenia vplyvu liečby dostatočne kauzálne. Onkologická bezpečnosť sa vyhodnocuje aj v rámci prospektívnych klinických štúdií zameraných na potvrdenie účinnosti a KV-bezpečnosti nových antidiabetických liekov. Ich problémom je relatívne krátka doba sledovania s malým počtom onkologických prípadov v jednotlivých sledovaných ramenách, čo sa však dá štatisticky vylepšiť vykonaním metaanalýzy týchto štúdií. V hláseniach nežiaducich účinkov a v niektorých štúdiách sa môžeme stretnúť s upozornením na zvýšené onkologické riziko niektorých liekov, ktoré sa však v ďalších štúdiách nepotvrdí. Vzhľadom na vyššie uvedené biologické a štatistické faktory musia byť výsledky doteraz publikovaných experimentálnych a klinických štúdií opatrne interpretované [2,3].
V tomto prehľadovom článku sme sa zamerali na posúdenie onkologickej bezpečnosti liečby inzulínom a preparátmi sulfonylurey (SU) ako skupinou inzulínosekretagóg.
Inzulín, inzulínové sekretagogá a onkologické riziko
Inzulín je dôležitý rastový faktor pre nádory obsahujúce receptor pre inzulín typu A, a preto existuje teoretický predpoklad zvýšeného výskytu nádorov pri liečbe inzulínom a inzulínovými sekretagogami – preparátmi SU. Tento predpoklad bol potvrdený aj v experimentálnych štúdiách na bunkových kultúrach nádorových buniek in vitro, v ktorých inzulín zvyšuje ich proliferáciu. Treba však zdôrazniť, že inzulín nie je karcinogén a nezapríčiňuje vznik nádorov, ale ako rastový faktor môže podporovať ich rast. Na druhej strane sa riziko karcinómov môže znižovať pri dlhodobej dobrej glykemickej kontrole. Naviac z pohľadu liečby diabetikov má inzulín veľmi vysoký pomer benefitu a rizika, je nezastupiteľný v substitučnej liečbe pri diabetes mellitus 1. typu (DM1T) a veľmi dôležitý pri intenzifikácii liečby DM2T, a preto prípadné zvýšené onkologické riziko v porovnaní s inzulínovými senzitizérmi nie je dôvodom na zmenu štandardných algoritmov liečby.
Inzulínová liečba
Klinické štúdie venované vplyvu podávania štandardného inzulínu na vznik nádorov zahŕňajú viaceré retrospektívne analýzy registrov, prípadové štúdie a ich metaanalýzy, v ktorých sa v porovnaní s metformínovou skupinou potvrdila zvýšená onkologická mortalita, zvýšený celkový výskyt nádorov, ako aj zvýšený výskyt karcinómov pečene, pankreasu a kolorekta (tab) [4–11].
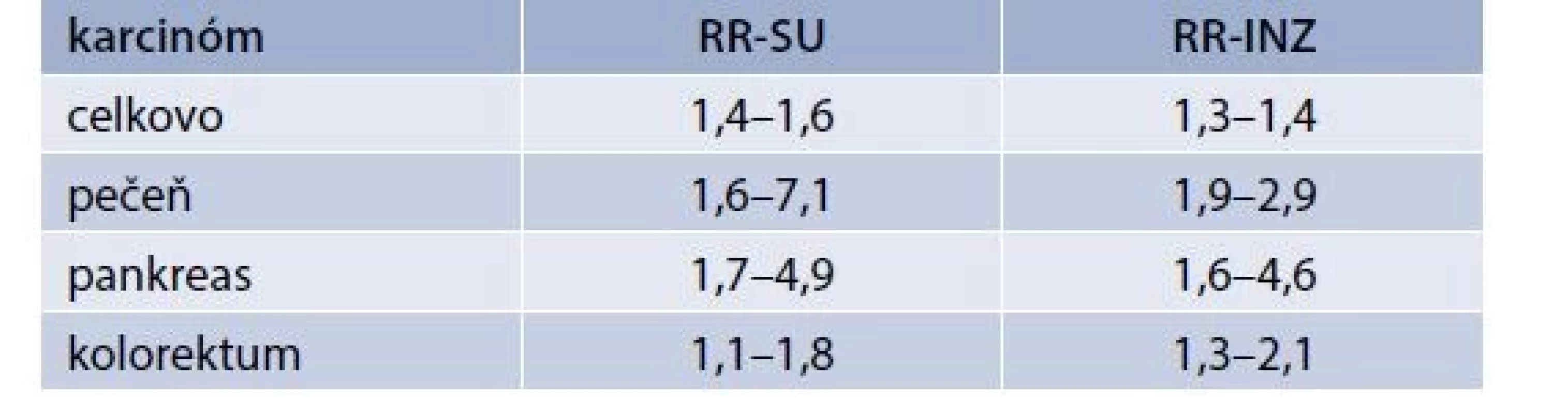
Onkologické riziko liečby inzulínom však môže byť ovplyvnené aj ďalšími faktormi, pretože riziko nádorov u pacientov s DM1T liečených inzulínom je nižšie v porovnaní s diabetikmi 2. typu. DM1T sa tiež spája s mierne zvýšeným výskytom karcinómov (RR 1,2), ale špecificky s inými typmi nádorov ako DM2T dôsledkom vyššej kumulácie iných rizikových faktorov (autoimunitná gastritída, infekcie a pod). V publikovanej švédskej štúdií a metaanalýze klinických štúdií sa pri DM1T potvrdil zvýšený výskyt karcinómu pankreasu s RR 2,0 a endometria s RR 2,7, tak ako pri DM2T, ale aj zvýšený výskyt karcinómov viac sa vyskytujúcich pri DM1T – žalúdka (RR 2,3) a cervixu (RR 1,6) [12,13].
Pre stratégiu antidiabetickej liečby by mohol byť dôležitý poznatok, získaný zatiaľ z retrospektívnych analýz, že metformín v kombinácii s inzulínom v porovnaní s monoterapiou inzulínom významne znižuje onkologickú mortalitu, celkový výskyt karcinómov (RR 0,54), ako aj výskyt karcinómov pankreasu, kolorekta a prsníka (RR 0,73) [4].
Inzulínové analógy a onkologické riziko
Otázka možného zvýšeného onkologického rizika pri niektorých inzulínových analógoch, zvlášť pri bazálnych s dlhodobým účinkom, zamestnávala klinický výskum posledných viac ako 20 rokov. Pri týchto preparátoch existuje teoretický predpoklad zvýšeného onkologického rizika dôsledkom modifikácie molekuly inzulínu v oblasti reziduí B26-B30 a B10, ktorá môže potenciovať jeho rastový účinok predĺžením väzby na inzulínový receptor a zvýšením väzby na receptor pre inzulínu podobný rastový faktor IGF1. Prvý vyvinutý analóg B10Asp mal 2-násobne zvýšenú mitogenicitu v porovnaní s inzulínom, zvyšoval výskyt nádorov prsníka u potkanov, a preto nebol zavedený na trh. Pri krátkodobých inzulínových analógoch nebola pozorovaná zvýšená mitogenicita, ani zvýšené onkologické riziko a diskutovalo sa hlavne o onkologickom riziku bazálnych inzulínových analógov [14,15].
Inzulín glargín
Inzulín glargín je v súčasnosti považovaný z onkologického hľadiska za bezpečný, ale otázka jeho onkologického rizika bola ešte nedávno v odbornej literatúre veľmi diskutovaná. Diskusiu vyvolali v r. 2009 publikované problematické výsledky nemeckého registra, ktoré na pokyn redakcie časopisu Diabetologia boli uverejnené až po vyžiadaní výsledkov z iných registrov a viedli k publikácií ďalších štúdií a množstva komentárov.
Experimentálne štúdie síce potvrdili, že inzulín glargín v porovnaní s inzulínom má vyšší mitogénny potenciál dôsledkom vyššej afinity na receptor pre IGF1 v niektorých kultúrach nádorových buniek in vitro, avšak v situácii in vivo dochádza pôsobením karboxypeptidáz k jeho rýchlej biotransformácii (do 30 min) na účinné metabolity M1 a M2 s nízkym mitogénnym potenciálom. Dvojročný test mitogenicity nepotvrdil zvýšený výskyt nádorov prsníka u potkanov po podávaní inzulínu glargín v porovnaní s NPH inzulínom. Keďže ani krátkodobé klinické štúdie u ľudí nepotvrdili zvýšený výskyt nádorov, splnil inzulín glargín kritériá onkologickej bezpečnosti a bol zavedený na trh [16,17].
Klinické štúdie, venované vplyvu inzulínu glargín na vznik nádorov, zahŕňali viaceré retrospektívne analýzy registrov, ako aj post-hoc analýzy randomizovaných prospektívnych štúdií a metaanalýzy komparatívnych štúdií s kontroverznými výsledkami. Zvýšenie výskytu karcinómov pri liečbe glargínom v porovnaní s NPH-inzulínmi bolo potvrdené v 3 registroch. V spomínanej nemeckej štúdii (German Insurance Study) sa zistil zvýšený celkový výskyt karcinómov iba v podskupine s vyššou dávkou inzulínu (50 j/deň), hoci v celej skupine liečenej inzulínom glargín bol výskyt nádorov nižší. Najväčším problémom štúdie bola porovnateľnosť skupín liečených rôznymi inzulínmi pre chýbajúce údaje o obezite (BMI), dĺžke trvania DM2T, type karcinómov a ďalších rizikových faktoroch onkologických ochorení [18]. Z hľadiska sledovaných rizikových faktorov už bola lepšie koncipovaná škótska štúdia (Scottish Diabetes Research Network) potvrdzujúca zvýšený celkový výskyt karcinómov, ako aj karcinómu prsníka, a analýza švédskeho registra s potvrdeným zvýšeným výskytom karcinómu prsníka, ale nie celkového výskytu karcinómov. Aj pri týchto štúdiách však bola kritizovaná porovnateľnosť sledovaných skupín, pretože glargínová skupina v škótskej štúdii bola z onkologického hľadiska viac riziková, resp. v švédskej štúdii chýbali údaje o liečbe inzulínom pred zavedením registra a údaje o onkologických rizikových faktoroch neboli kompletné [19].
Naviac ďalšie klinické štúdie nepotvrdili vplyv liečby glargínom v porovnaní s NPH-inzulínmi na výskyt karcinómov. Analýza britského registra (UK General Practitioner Register) nepotvrdila zvýšené celkové riziko karcinómov, ani karcinómov prsníka, kolorekta a pankreasu v skupine liečenej glargínom [4]. Post hoc analýza 5-ročnej prospektívnej a randomizovanej štúdie primárne sledujúcej výskyt retinopatie nepotvrdila vplyv liečby glargínom na celkový výskyt karcinómov [20]. Liečba glargínom nebola spojená so zvýšeným celkovým výskytom karcinómov oproti NPH-inzulínom v metaanalýze 31 klinických štúdii s priemerným trvaním 4,5 roku z databázy firmy sanofi-aventis štatisticky významne ani oproti detemiru v metaanalýze komparatívnych klinických štúdií s trvaním aspoň rok z databázy spoločnosti Novo Nordisk [21].
Jednou z nastolených otázok vyššie uvedenej škótskej štúdie bol vzťah liečby inzulínom glargín k zvýšenému výskytu karcinómu prsníka, ale reprodukovateľnosť tohto nálezu bola kontroverzná. Analýza švédskeho registra (The Swedish National Diabetes Register) síce potvrdila zvýšený výskyt karcinómov prsníka v glargínovej skupine, ale v tejto štúdii chýbali údaje o liečbe inzulínom pred zavedením registra a údaje o onkologických rizikových faktoroch neboli kompletné. Následná podrobná analýza švédskeho registra poukazovala na zvýšenie incidencie karcinómu prsníka iba v jednom časovom období, ktoré sa nepotvrdilo v ďalších rokoch sledovania. Sami autori vyžadovali získanie ďalších dát, aby mohli zodpovedne posúdiť, či zvýšenie incidencie karcinómu prsníka pozorované vo Švédsku v rokoch 2006– 2007 bolo iba náhodným štatistickým javom (random fluctuation), alebo existuje asociácia s používaním inzulínu glargín [22–24]. Aj analýza britského registra (UK General Practitioner Register) publikovaná v r. 2009 nepotvrdila zvýšené riziko karcinómov prsníka v skupine liečenej glargínom. Následná analýza britského registra z r. 2011 takisto potvrdila, že riziko karcinómu prsníka u žien s DM2T nie je zvýšené počas prvých 5 rokov podávanie inzulínu glargín. Autori odporučili preveriť epidemiologický signál rizika dlhodobého podávania > 5 rokov hlavne u žien, ktoré dlhodobo dostávali inzulín pred zahájením liečby glargínom [4,25]. Podobne analýza holandského registra potvrdila, že podávanie inzulínu glargín znižuje riziko karcinómov celkovo, najmä kolorektálneho karcinómu, pričom pri zaznamenanom zvýšení rizika karcinómu prsníka sa nedá vylúčiť vplyv ďalších faktorov, hlavne u viac rizikovej skupiny pacientov užívajúcich inzulín glargín [26].
Vzhľadom na kontroverzné diskusie sa k problému v r. 2009 vyjadrila aj Európska lieková agentúra (EMA), ktorá považovala doterajšie výsledky vplyvu glargínu na výskyt nádorov za nejednoznačné pre krátke trvanie štúdií a možný vplyv ďalších rizikových faktorov, ako sú vek, BMI, menopauza, parita a socioekonomický status. Odporučila ich zobrať do úvahy ako epidemiologický signál vyžadujúci ďalšie podrobné zhodnotenie a konštatovala, že nie je dôvod na zmenu liečby inzulínom glargín.
V r. 2012 boli publikované z hľadiska užívania inzulínu glargín priaznivé výsledky. Prezentované výsledky analýzy veľkého počtu pacientov z francúzskej databázy (French Health Insurance Information and the French Hospital Discharge database) nepotvrdili vzťah krátkodobejšieho, v priemere 4-ročného užívania inzulínu glargín k celkovému výskytu nádorov (RR 0,97), ani ku výskytu karcinómu prsníka (RR 1,08) [27]. Bola publikovaná aj metaanalýza 7 štúdií, v ktorej sa potvrdilo, že v porovnaní s inými inzulínmi podávanie inzulínu glargín sa nespája s celkovým zvýšením rizika nádorov (RR 0,86), ani so zvýšením rizika nádorov prsníka (RR 1,14), prostaty (RR 1,00), pankreasu (RR 0,57) a gastrointestinálneho traktu (RR 0,80) [28].
Nakoniec boli prezentované výsledky avizovanej štúdie ORIGIN (Outcome Reduction with an Initial Glargine INtervention), ktorá bola v priebehu upravená aj na možnosť posúdenia onkologického rizika. V nej bolo zahrnutých > 12 500 pacientov s prediabetickými stavmi a včasným DM2T, rozdelených na 2 skupiny – skupinu pacientov užívajúcich inzulín glargín s titrovanou dávkou na dosiahnutie cieľových hladín glykémie nalačno a pacientov užívajúcich inú hypoglykemizujúcu liečbu tak, aby podiel užívajúcich metformín, preparáty sulfonylurey a ostatné antidiabetiká bol v obidvoch ramenách rovnaký. Hoci pôvodne táto štúdia bola zameraná na zhodnotenie vplyvu liečby na riziko KV- a mikrovaskulárnych komplikácií, zhodnotil sa v nej aj výskyt nádorov a vplyv na onkologickú mortalitu. Potvrdilo sa, že užívanie inzulínu glargín nezvyšuje mortalitu na onkologické ochorenia (RR 0,94; p = 0,52), ani riziko vzniku nádorov celkovo (RR 1,00; p = 0,97), ani v špecifických lokalizáciách, vrátane karcinómu prsníka (RR 1,01; p = 0,95), hrubého čreva (RR 1,09; p = 0,61), pľúc (RR 1,21; p = 0,27), prostaty (RR 0,94; p = 0,70), melanómu (RR 0,88; p = 0,71) a iných karcinómov (RR 0,95; p = 0,59). Na základe týchto výsledkov EMA vydala v r. 2013 stanovisko, že neexistujú relevantné dôkazy, že by liečba bazálnym analógom glargín bola spojená s vyšším výskytom nádorov v porovnaní s NPH-inzulínmi a je možno ukončiť vyžadovanie nových dát o riziku karcinómov v súvislosti s liečbou [29]. Neskôr aj ďalšia rozsiahla štúdia CARING (Cancer Risk and Insulin Analogues), zahŕňajúca viac ako 250 000 pacientov sledovaných > 5 rokov, potvrdila, že liečba inzulínom glargín alebo detemir sa nespája so zvýšeným rizikom karcinómov, a považuje sa tak za bezpečnú [30].
Takisto v prípade inzulínu glargín 300, bazálneho inzulínu 2. generácie, vyžadované predklinické testy nepotvrdili zvýšený karcinogénny potenciál a v rámci klinického skúšania sa nezaznamenalo, že by podávanie inzulínu glargín 300 sa spájalo s nepriaznivým ovplyvnením incidencie zhubných nádorov.
Inzulín detemir a inzulín degludek
Experimentálne štúdie potvrdili redukovaný mitogénny potenciál inzulínu detemir v porovnaní s klasickou formou in vitro, pretože napojená acylová skupina interferuje s väzbou na inzulínový receptor. Počas 2-ročného preklinického sledovania nebol zaznamenaný zvýšený výskyt nádorov u experimentálnych zvierat in vivo. Metaanalýza komparatívnych krátkodobých klinických štúdií trvajúcich aspoň rok, zahŕňajúca celkovo 8 693 pacientov, potvrdila, že pacienti liečení inzulínom detemir mali oproti liečbe NPH-inzulínom nižšie celkové riziko karcinómov (inzulín NPH vs inzulín detemir RR 2,44; p = 0,048) [31].
V prípade inzulínu degludek predklinické údaje získané na základe vyžadovaných farmakologických štúdií bezpečnosti (vrátane toxicity po opakovanom podávaní) a karcinogénneho potenciálu neodhalili žiadne bezpečnostné riziká pre ľudí. Metaanalýza krátkodobých klinických štúdií potvrdila onkologickú bezpečnosť inzulínu degludek, ktorého podávanie sa nespájalo so zvýšením incidencie zhubných nádorov u pacientov s DM1T a DM2T [32].
Preparáty sulfonylurey
Tak ako v prípade inzulínovej liečby existuje teoretický predpoklad zvýšeného výskytu nádorov pri liečbe inzulínovými sekretagógami, ako sú deriváty SU, ktoré stimulujú produkciu inzulínu. Deriváty SU však môžu za istých okolností pôsobiť aj preventívne, pretože blokáda K-kanálov in vitro má protirastový účinok na nádorové bunky a pridanie preparátov SU do bunkových kultúr tlmí rast nádorových buniek [33].
Pôvodné klinické štúdie venované vplyvu derivátov SU na vznik nádorov a zahŕňajúce viaceré retrospektívne analýzy registrov, prípadové štúdie a ich metaanalýzy potvrdili v porovnaní s metfomínovou skupinou zvýšenú onkologickú mortalitu, zvýšený celkový výskyt nádorov, ako aj zvýšený výskyt karcinómov pečene, pankreasu, kolorekta a prsníka (tab) [4–7,34,35].
Treba však poznamenať, že tieto štúdie vo veľkej miere hodnotili vplyv preparátov SU 1. generácie, vrátane glibenklamidu. Údaje z prípadových štúdií zároveň upozornili na možnú závislosť rizika vzniku nádorov od jednotlivých preparátov SU, pričom zvýšené riziko bolo potvrdené pri liečbe glibenklamidom s RR 2,6, ale naopak protektívne by mohol pôsobiť gliklazid s RR 0,4, resp. aj glimepirid [36]. Retrospektívna analýza pacientov z databázy The U.K. Clinical Practice Research Datalink zhodnotila viac ako 52 tisíc pacientov, u ktorých sa v období rokov 1988 až 2013 začala liečba glibenklamidom. V tejto štúdii sa potvrdilo, že liečba v porovnaní s druhou generáciou derivátov SU sa spája so štatisticky nevýznamným zvýšením celkového množstva nádorov o 9 %, ale pri dlhodobom podávaní (> 36 mesiacov) sa toto riziko zvyšuje o 21 % [35].
Podľa výsledkov viacerých klinických štúdií, zahŕňajúcich relatívne menšie množstvo pacientov a nízku incidenciu zachytených prípadov nádorov, sa liečba gliklazidom v porovnaní s inými preparátmi SU spája so zníženým celkovým výskytom karcinómov o 40–60 %, ako aj zníženou mortalitou súvisiacou s nádormi [36–39]. Prospektívna analýza holandskej databázy pacientov v primárnej starostlivosti (Zwolle Outpatient Diabetes project Integrating Available Care ZODIAC) spojenej s registrom nádorov (the Netherlands Cancer Registry), zahŕňajúcej viac ako 26 tisíc pacientov užívajúcich rôzne deriváty SU (tolbutamid, glibenklamid, gliklazid) v období rokov 1998–2014, však nepotvrdila rozdiel v riziku vzniku nádorov súvisiacich s obezitou medzi jednotlivými preparátmi SU [40].
Z hľadiska prevencie nádorov sa zdá byť dôležitá kombinácia s metformínom, hoci zatiaľ máme dôkazy iba z retrospektívnych analýz databáz. Podávanie preparátov SU v kombinácii s metformínom v porovnaní s ich podávaním v monoterapii znižuje celkový výskyt nádorov o 46 %, ako aj výskyt karcinómu pankreasu, kolorekta a prsníka o 27 % [4].
Záver
Diabetes mellitus 2. typu sa spája so zvýšeným výskytom niektorých typov karcinómov, ktorý je modulovaný antidiabetickou liečbou nasledujúcim spôsobom:
• inzulín a preparáty SU mierne zvyšujú oproti metformínu riziko karcinómov, ktoré sa zníži ich kombináciou s metformínom
• inzulínové analógy, vrátane inzulínu glargín, v porovnaní s inzulínom nezvyšujú riziko zhubných nádorov prof.
MUDr. Marián Mokáň, DrSc., FRCP Edin
www.unm.sk
Doručené do redakcie 1. 10. 2022
Prijaté po recenzii 28. 10. 2022
Zdroje
1. Draznin B, Aroda VR, Bakris G et al. [American Diabetes Association Professional Practice Committee]. 4. Comprehensive Medical Evaluation and Assessment of Comorbidities – Standards of Medical Care in Diabetes—2022. Diabetes Care 2022; 45(Suppl 1): S46-S59. Dostupné z DOI: <http://dx.doi.org/10.2337/dc22-S004>.
2. Galajda P, Mokáň M. Diabetes mellitus a nádory. Diabetes a obezita 2010; 10(13): 33–43.
3. Galajda P, Mokáň Mi. Michalovičová M et al. Nádorové ochorenia a poruchy metabolizmu glukózy. Quick Print: Martin 2014. 4. Currie CJ, Poole CD, Gale AM. The influence of glucose-lowering therapies on cancer risk in type 2 diabetes. Diabetologia 2009; 52(9): 1766–1777. <Dostupné z DOI: http://dx.doi.org/10.1007/s00125–009–1440–6Z>.
5. Donadon V, Balbi M, Ghersetti M et al. Antidiabetic therapy and increased risk of hepatocellular carcinoma in chronic liver disease. World J Gastroenterol 2009; 15(20): 2506–2511. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.15.2506>.
6. Kawaguchi T, Taniguchi E, Morita Y et al. Association of exogenous insulin or sulphonylurea treatment with an increased incidence of hepatoma in patients with hepatitis C virus infection. Liver International 2009; 30(3): 479–486. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1478–3231.2009.02191.x>.
7. Hassan MM, Curley SA, Li D et al. Association of diabetes duration and diabetes treatment with the risk of hepatocellular carcinoma. Cancer 2010; 116(8): 1938–1946. Dostupné z DOI: <http://dx.doi.org/10.1002/cncr.24982>.
8. Yang XX, Henessy S, Lewis JD. Insulin therapy and colorectal cancer risk among type 2 diabetes mellitus patients. Gastroenterology 2004; 127(4): 1044–1050. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2004.07.011>.
9. Schiel R, Mullar UA, Braun A et al. Risk of malignancies in patients with insulin-treated diabetes mellitus. Eur J Med Res 2005; 10(8): 339–344.
10. Chung YW, Han DS, Park KH et al. Insulin therapy and colorectal adenoma risk among patients with type 2 diabetes mellitus: a case-control study in Korea. Dis Colon Rectum 2008; 51(5): 593–597. Dostupné z DOI: <http://dx.doi.org/10.1007/s10350–007–9184–1>.
11. Vinikoor LC, Long MD, Keku TO et al. The association between diabetes, insulin use and colorectal cancer among whites and African American. Cancer Epidemiol Biomarkers Prev 2009; 18(4): 1239–1242. Dostupné z DOI: <http://dx.doi.org/10.1158/1055–9965.EPI-08–1031>.
12. Stevens RJ, Roddam AW, Beral V. Pancreatic cancer in type 1 and young-onset diabetes: systematic review and meta-analysis. Br J Cancer 2007; 96(3): 507–509. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.bjc.6603571>.
13. Zendehdel K, Nyren O, Ostenson CG et al. Cancer incidence in patients with type 1 diabetes mellitus: a population-based cohort study in Sweden. J Natl Cancer Inst 2003; 95(23): 1797–1800. Dostupné z DOI: <http://dx.doi.org/10.1093/jnci/djg105>.
14. Janssen JA, Varewijck AJ. Insulin analogs and cancer: a note of caution. Front Endocrinol (Lausanne) 2014; 5: 79. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2014.00079>.
15. Sciacca L, Vella V, Frittitta L et al. Long-acting insulin analogs and cancer. Nutr Metab Cardiovasc Dis 2018; 28(5): 436–443. Dostupné z DOI: <http://dx.doi.org/10.1016/j.numecd.2018.02.010>.
16. Agin A, Jeandidier N, Gasser F et al. Glargine blood biotransformation: in vitro appraisal with human insulin immunoassay. Diabetes Metabol 2007; 33(3): 205–212. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabet.2006>.
17. Sommerfeld MR, Mullar G, Tschank G et al. In vitro metabolic and mitogenic signalling of insulin glargine and its metabolites. PLoS One 2010; 5(3): e9540. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0009540>.
18. Hemkens LG, Grouven U, Bender R et al. Risk of malignancies in patients with diabetes treated with human insulin or insulin analogues: a cohort study. Diabetelogia 2009; 52(9): 1732–1744. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–009–1418–4>.
19. Coulhoun HM. [SDRN Epidemiology Group]. Use of insulin glargine and cancer incidence in Scotland: a study from the Scottish Diabetes Research Network Epidemiology Group. Diabetologia 2009; 52(9): 1755–1765. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–009–1453–1>.
20. Rosenstock J, Fonseca V, McGill JB et al. Similar risk of malignancy with insulin glargine and neutral protamine Hagedorn (NPH) insulin in patients with type 2 diabetes: Finding from a 5 year randomised open-label study. Diabetologia 2009; 52(9): 1971–1973. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–009–1452–2>.
21. Home PD, Lagarenne P. Combined randomised controlled trial experience of malignancies in studies using insulin glargine. Diabetologia 2009; 52(12): 2499–2506. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–009–1530–5>.
22. Jonansson JM, Ljung R, Talback M et al. Insulin glargine use and short-term incidence of malignancies – a population-based follow up study in Sweden. Diabetologia 2009; 52(9): 1745–1754. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–009–1444–2>.
23. Ljung R, Talbäck M, Haglund B et al. Insulin glargine use and shortterm incidence of malignancies – a three-year population-based observation. Acta Oncol 2011; 50(5): 685–693. Dostupné z DOI: <http://dx.doi.org/10.3109/0284186X.2011.558913>.
24. Ljung R, Talbäck M, Haglund B et al. Insulin glargine use and shortterm incidence of breast cancer – a four-year population-based observation. Acta Oncol 2012; 51(3): 400–402. Dostupné z DOI: <http://dx.doi.org/10.3109/0284186X.2011.624118>.
25. Suissa S, Azoulay L, Dellaniello S et al. Long-term effects of insulin glargine on the risk of breast cancer. Diabetologia 2011; 54(9): 2254–2262. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–011–2190–9>.
26. Ruiter R, Visser LE, van Herk-Sukel MP et al. Risk of cancer in patients on insulin glargine and other insulin analogues in comparison with those on human insulin: results from a large population-based follow-up study. Diabetologia 2012; 55(1): 51–62. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–011–2312–4>.
27. Fahot JP, Blotiera PO, Ricordeau P et al. Does insulin glargine increase the risk of cancer compared with other basal insulins? A French nationwide cohort study based on national administrative databases. Diabetes Care 2013; 36(2): 294–301. Dostupné z DOI: <http://dx.doi.org/10.2337/dc12–0506>.
28. Du X, Zhang R, Xue Y et al. Insulin glargine and risk of cancer: a meta-analysis. Int J Biol Markers 2012; 27(3): e241-e246. Dostupné z DOI: <http://dx.doi.org/10.5301/JBM.2012.9349>.
29. Gerstein HC, Bosch J, Dagenais GR et al. [ORIGIN Trial Investigators]. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 201; 367(4): 319–328. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1203858>.
30. But A, De Bruin ML, Bazelier MT et al. Cancer risk among insulin users: comparing analogues with human insulin in the CARING five-country cohort study. Diabetologia 2017; 60(9): 1691–1703. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–017–4312–5>.
31. Dejgaard A, Lyngaard H, Rastam J et al. No evidence of increased risk of malignancies in patients with diabetes treated with insulin detemir: a meta-analysis. Diabetologia 2009; 52(12): 2507–2512. Dostupné z DOI: <http://dx.,doi.org/10.1007/s00125–009–1568–4>.
32. Monami M, Mannucci E. Efficacy and safety of degludec insulin: a meta-analysis of randomised trials. Curr Med Res Opin 2013; 29(4): 339–342. Dostupné z DOI: <http://dx.doi.org/10.1185/03007995.2013.772507>.
33. Qian X, Li J, Ding J et al. Glibenclamide exerts an antitumor activity through oxygen species c-jun NH(2)-terminal kinase pathway in human gastric cancer cell line MGC-803. Biochem Pharmacol 2008; 76(12): 1705–1715. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bcp.2008.09.009>.
34. Bowker SL, Majumdar SR, Veugelers P et al. Increased cancer – related mortality for patients with type 2 diabetes who use sulfonylureas or insulin. Diabetes Care 2006; 29(2): 254–258. Dostupné z DOI: <http://dx.doi.org/10.2337/diacare.29.02.06.dc05–1558>.
35. Tuccori M, Wu JW, Yin H et al. The use of glyburide compared with other sulfonylureas and the risk of cancer in patients with type 2 diabetes. Diabetes Care 2015; 38(11): 2083–2089. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15–1358>.
36. Monami M, Balzi D, Lamanna C et al. Are sulphonylureas all the same? A cohort study on cardiovascular and cancer-related mortality. Diabetes Metab Res Rev 2007; 23: 479–484. Dostupné z DOI: <http://dx.doi.org/10.1002/dmrr.736>.
37. Monami M, Lamanna C, Balzi D et al. Sulphonylureas and cancer: a case-control study. Acta Diabetol 2009; 46(4): 279–284. Dostupné z DOI: <http://dx.doi.,org/10.1007/s00592–008–0083–2>.
38. Yang X, So WY, Ma RC et al. Use of sulphonyurea and cancer in type 2 diabetes – The Hong Kong Diabetes Registry. Diabetes Res Clin Pract 2010; 90(3): 343–351. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2010.08.022>.
39. Bo S, Catiglkione A, Chigo E et al. Mortality outcomes of different sulfonylurea drugs? The results of a 14-year cohort study of type 2 diabetic patients. Eur J Endocrinol 2013; 169(1): 117–126. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-13–0299>.
40. Du J, Kleefstra N, Schrijnders D et al. Is gliclazide associated with a lower obesity-related cancer risk compared to other sulfonylureas? A long-term prospective cohort study. Cancer Epidemiol Biomarkers Prev 2020; 29(8): 1596–1605. Dostupné z DOI: <http://dx.doi.org/10.1158/1055–9965.EPI-19–1517>.
Štítky
Diabetológia Endokrinológia Interné lekárstvoČlánok vyšiel v časopise
Forum Diabetologicum

2022 Číslo 3
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Význam hydratace při hojení ran
- Hypolipidemika v terapii akutních koronárních syndromů
- Statinová intolerance
Najčítanejšie v tomto čísle
- Nové kritériá pre diagnostiku gestačného diabetes mellitus a ich dôsledky
- Postavenie inhibítorov SGLT2 v aktuálnych terapeutických odporúčaniach pre liečbu diabetes mellitus 2. typu EASD/ADA 2022 a ich využívanie v praxi: kazuistiky a komentár
- Nové trendy súčasnej bariatricko-metabolickej chirurgie a ich prínos pre liečbu (pre)diabetu
- Prítomnosť a blízka budúcnosť farmakologickej liečby obezity/diabezity
