-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Detekce oligoklonálních IgM pásů v likvoru
Detection of oligoclonal IgM in cerebrospinal fluid
Objective:
Improvement of the procedure used for cerebrospinal fluid (CSF) and serum oligoclonal IgM detection.Design:
Methodical studyMaterial and Methods:
Isoelectric focusing (IEF) in agarose gel followed by affinity immunoblotting. After choosing the best variant from the protocols tested, 35 paired CSF and serum samples were examined.Results:
Improvement of IgM separation has been achieved by using narrower pH gradient (4-8), prefocusing step and cathodic application of samples. Efforts to separate IgM in native CSF or serum samples have been unsuccessful. Satisfactory results have been obtained using sample pretreatment with dithiothreitol, optionally followed by acrylamide pretreatment. Intrathecal synthesis of oligoclonal IgM was demonstrated in 11 out of 35 patients. Samples of symptomatic controls (n=3) or patients with a proved diagnosis of non-inflammatory neurological disease (n=9) were all negative. Oligoclonal IgM result correlated significantly with intrathecal IgM synthesis estimated either by Reiber´s (P=0.007) or Auer´s formula (P=0.026).Conclusion:
The method described in this article enables sensitive and reproducible detection of oligoclonal IgM bands separated by IEF. Further research should address the optimisation of sample pretreatment as well as experiments aimed at separation of IgM in untreated cerebrospinal fluid and serum samples.Keywords:
oligoclonal IgM, isoelectric focusing, affinity immunoblotting, calculation of intrathecal synthesis.
Autori: D. Zeman 1,2; P. Kušnierová 1,2
Pôsobisko autorov: Katedra biomedicínských oborů, Lékařská fakulta, Ostravská univerzita 1; Oddělení klinické biochemie, Ústav laboratorní diagnostiky, Fakultní nemocnice Ostrava 2
Vyšlo v časopise: Klin. Biochem. Metab., 24, 2016, No. 3, p. 141-146
Súhrn
Cíl studie:
Úprava postupu detekce oligoklonálních IgM pásů v likvoru a séru.Typ studie:
Metodická studie.Materiál a metody:
Izoelektrická fokusace (IEF) v agarózovém gelu s následným afinitním imunoblottingem. Po výběru nejlepší varianty z testovaných postupů bylo vyšetřeno 35 párových vzorků likvorů a sér.Výsledky:
Zlepšení separace IgM bylo dosaženo použitím užšího pH gradientu (4-8), prefokusací a katodickou aplikací vzorku. Separace IgM v nativních vzorcích likvoru a séra se nepodařilo dosáhnout. K uspokojivým výsledkům vedla předúprava vzorků dithiothreitolem, popř. následně akrylamidem. Intrathekální syntéza oligoklonálního IgM byla průkazná u 11 z 35 testovaných vzorků. Vzorky všech pacientů s potvrzenou diagnózou nezánětlivého onemocnění nervového systému (n=9) i symptomatických kontrol (n=3) byly negativní. Průkaz oligoklonálního IgM statisticky významně koreloval s výpočtem intrathekální syntézy IgM podle Reibera (P=0,007) i podle Auera et al. (P=0,026).Závěr:
Upravená metoda umožňuje citlivou a reprodukovatelnou detekci oligoklonálního IgM. Další výzkum by měl směřovat jednak k optimalizaci předúpravy vzorku, jednak k pokusům dosáhnout separace IgM izoelektrickou fokusací v nativním (neupraveném) vzorku.Klíčová slova:
oligoklonální IgM, izoelektrická fokusace, afinitní imunoblotting, výpočet intrathekální syntézy.Úvod
Detekce oligoklonálního (o-) IgM v mozkomíšním moku (CSF) byla popsána již před více než 20 lety [1-3], do popředí zájmu neuroimunologů se však dostala až po zjištění, že intrathekální (ith.) syntéza o-IgM může predikovat agresívní průběh onemocnění roztroušenou sklerózou (RS) [4]. Metoda používaná v těchto studiích byla popsána skupinou L. M. Villarové r. 2001 [5]. Tato skupina později vypracovala i metodu detekce o-IgM specifických vůči myelinovým lipidům, které pravděpodobně predikují nepříznivý průběh RS ještě silněji [6].
Přestože klinický význam detekce o-IgM je referován v řadě recentních publikací, podrobnější popis metod v novější literatuře téměř chybí. V r. 2012 bylo publikováno doporučení Sekce pro likvorologii a neuroimunologii České neurologické společnosti [7] zahrnující mezi doporučená vyšetření i detekci o-IgM a o-IgA. Vzhledem k opakovaně prokázané vyšší senzitivitě detekce o-IgG oproti výpočtům ith. syntézy IgG je tato myšlenka nepochybně opodstatněná. Existuje nicméně určitý rozpor mezi tímto doporučením a zahraničními směrnicemi [8, 9], které uvádějí pouze detekci o-IgG, jakož i absencí publikovaných studií v tuzemské literatuře, kde dosud jediné sdělení na toto téma publikovali Kelbich et al. [10]. Použití komerčního kitu pro detekci o-IgM bylo popsáno pouze pro imunofixační elektroforézu [11].
Metoda izoelektrické fokusace s následným afinitním imunoblottingem (IEF/AIB) byla propracována C. J. Sindicem nejprve pro detekci oligoklonálních volných lehkých řetězců [12] a později také o-IgM [2]. Její výhodou je několikanásobně nižší detekční limit oproti klasickému imunoblottingu. S použitím metody pro detekci o-IgG a volných lehkých řetězců máme poměrně rozsáhlé zkušenosti [13-15]. Po úvodních pokusech s metodou Villarové et al. jsme zvolili toto uspořádání i pro studium o-IgM, neboť se nám nepodařilo dosáhnout detekčního limitu 0,02 mg/l popsaného v původní práci [5]. I přes nesystematický experimentální přístup se nám podařilo vyvinout metodu poskytující přijatelné výsledky. Tuto metodu v našem sdělení podrobně popisujeme a nabízíme tak specializovaným laboratořím k použití, další optimalizaci, klinické validaci a ovšem také kritickým připomínkám.
Materiál a metody
IEF je prováděna na přístroji Multiphor II (GE Health-care) se zdrojem EPS-3501XL a termostatickým cirkulátorem. Používáme agarózu pro IEF (kat. č. 17046801), amfolyty Pharmalyte 4-6,5 (kat. č. 17045201) a 5-8 (kat. č. 17045301), GelBond film (kat. č. 80112293), filtrační papír (kat. č. 80112952) a elektrodové stripy (kat. č. 18100440) firmy GE Healthcare; D-sorbitol (kat. č. 85529), DL-dithiothreitol (kat. č. 43815), akrylamid (kat. č. 23701) a tris(hydroxymethyl)aminomethan (kat. č. 252859) firmy Sigma Aldrich; proužky pro aplikaci vzorků (kat. č. 42899), Tween 20 (kat.č. 37470.01) a bovinní sérový albumin (BSA, kat. č. 11924) firmy Serva; nitrocelulózovou membránu s póry 0,45 µm firmy Sartorius (kat. č. 11306-41BL). Anolytem je kyselina octová (0,25 mol/l), katolytem hydroxid sodný (0,25 mol/l).
Pro potah membrán byla použita kozí protilátka proti lidskému IgM firmy Jackson ImmunoResearch (kat. č. 109-005-043). K detekci byl použit biotinem značený F(ab´)2 fragment kozí protilátky proti lidskému IgM téže firmy (kat. č. 109-066-129) s následnou aplikací konjugátu streptavidinu s alkalickou fosfatázou firmy Vector (kat.č. SA-5100), popř. kozí protilátky proti lehkým řetězcům kappa a lambda firmy Bethyl značené přímo alkalickou fosfatázou (kat.č. A80-115AP a A80-116AP). K vizualizaci signálu byl použit substrát BCIP/NBT firmy Vector (kat. č. SK-5400).
Příprava roztoků pufrů Tris-Cl, pH 9,5, Tris-buffered saline (TBS) pH 7,6, TBS s 0,05% Tweenem 20 (TBS-T) a phosphate-buffered saline (PBS) pH 7,4 pro IEF a afinitní imunoblotting je podrobně popsána v práci Bojkové [16].
Po úpravě metody bylo testováno 35 vzorků likvorů a sér zaslaných k vyšetření oligoklonálních pásů. U všech byla provedena kvantifikace albuminu, IgG, IgM a IgA na nefelometru BN ProSpec (Siemens) a detekce o-IgG (IEF s imunofixací, Hydrasys, Sebia). Ith. syntéza imunoglobulinů byla vyhodnocena podle Reiberova vztahu [17] i vztahu nově navrženého Auerem et al. [18]. Ve 30 případech byla provedena také detekce oligoklonálních volných lehkých řetězců kappa a lambda (IEF/AIB). Statistické vyhodnocení bylo provedeno programem MedCalc Statistical Software (verze 16.2.0). Významnost korelace mezi pozitivitou/negativitou jednotlivých testů byla posouzena Fisherovým exaktním testem.
Metoda
Agarózový gel připravíme rozpuštěním 2,6 g sorbitolu a 0,2 g agarózy ve 20 ml destilované vody. Roztok zahříváme k varu a pak po 5-10 minutách necháme pomalu chladnout. Po poklesu teploty na 70°C přidáme 0,75 ml Pharmalytu 4-6,5 a 0,75 ml Pharmalytu 5-8. Po šetrném promíchání gel okamžitě nalijeme předehřátou pipetou do předehřáté masky mezi podložní sklo s GelBond filmem a sklo se „spacerem“ (0,5 mm) a necháme 1 hodinu při pokojové teplotě. Poté šetrně odstraníme vrchní sklo a gel inkubujeme ve vlhké komůrce při 2-8°C 3-24 hodin.
Nitrocelulózové membrány (rozměr 7,5 × 12 cm; dvě membrány na jeden gel) inkubujeme 2-3 minuty v destilované vodě, poté 10-15 minut v TBS. Pak na membránu aplikujeme 8-10 ml neznačené protilátky proti lidskému IgM ředěné v TBS na 10 mg/l. Necháme inkubovat na kývačce při pokojové teplotě 6-14 hodin.
Bezprostředně před prefokusací připravíme vzorky. Likvory s koncentrací IgM > 1 mg/l ředíme 0,75% NaCl na 1 mg/l a na stejnou koncentraci ředíme také séra. Likvory s nižší koncentrací IgM aplikujeme neředěné. Séra můžeme ředit na likvorovou koncentraci IgM, nicméně se nám osvědčilo ředění na 1 mg/l, popř. na 0,5 mg/l u vzorků s koncentrací IgM v likvoru ≤0,5 mg/l. Je nutné dbát na dostatečný objem vzorku (min. 50 µl). Poté napipetujeme do eppendorfek 1 µl zásobního roztoku dithiothreitolu (DTT, 0,5 mol/l v 0,1 mol/l Tris-Cl pufru o pH 9,5) a přidáme 49 µl adekvátně zředěných vzorků likvoru, resp. séra. Důkladně promícháme a inkubujeme 20-30 minut při 37°C. Poté vzorky přemístíme do pokojové teploty. Fakultativně lze doplnit alkylační krok: do eppendorfek napipetujeme 1 µl roztoku akrylamidu (0,4 mol/l v destilované vodě) a přidáme 19 µl výše popsaným způsobem upravených vzorků; inkubujeme při pokojové teplotě v temnu po dobu 30-45 minut.
IEF provádíme při 10°C. Na gel přiložíme suchý filtrační papír a ihned sejmeme. Na keramickou desku přístroje aplikujeme cca 1,5 ml petroleje a poté na ni umístíme gel. Na něj položíme elektrodové stripy nasycené v roztocích anolytu, resp. katolytu (mezielektrodová vzdálenost 8,5 cm) a cca 1,5 cm zevně od nich proužek filtračního papíru. Prefokusace je jednokroková (250 Vh) s nastavenými maximálními hodnotami 600 V, 30 mA, 4 W. Po jejím ukončení vypneme přístroj a 2 cm od katody položíme aplikační proužek pro vzorky; do každé jamky pipetujeme 7 µl vzorku. Poté spustíme IEF program. Používáme gradientovou metodu, při které voltáž lineárně stoupá od hodnoty předchozí fáze až k naprogramované maximální hodnotě. Program má čtyři fáze: 1) 1 Vh, 300 V, 30 mA, 3 W; 2) 125 Vh, 300 V, 30 mA, 3 W; 3) 500 Vh, 1275 V, 30 mA, 8 W; 4) 575 Vh, 1275 V, 30 mA, 8 W.
Po uplynutí 110 Vh fáze 2) IEF přerušíme, vyměníme elektrodové proužky a odsávací papíry za nové a sejmeme aplikační masku. Poté pokračujeme v separaci.
Bezprostředně po této operaci omyjeme nitrocelulózové membrány v TBS a inkubujeme v roztoku 3% BSA v TBS (cca 75-90 minut). Krátce před koncem IEF membrány omyjeme dvakrát v TBS.
Po skončení IEF gel oblotujeme filtračním papírem navlhčeným v TBS a následně přiložíme nitrocelulózové membrány (stranou, na níž byla aplikována protilátka, na gel). Přiložíme 1 filtrační papír navlhčený v TBS, dalších 5-7 suchých filtračních papírů, skleněnou desku a závaží (cca 1,5 kg). Ponecháme 50 ± 5 minut. Poté membrány promyjeme v PBS a inkubujeme v roztoku 0,25% glutardialdehydu v PBS po dobu 15-20 minut při 2-8°C; pak je opláchneme destilovanou vodou a třikrát promyjeme v TBS. Poté inkubujeme v roztoku TBS/0,3% BSA na kývačce po dobu 20 ± 5 minut, znovu promyjeme v TBS a aplikujeme roztok biotinem značené protilátky (ředíme 1/20 000 v TBS/0,3% BSA). Necháme inkubovat 2 – 2,5 hodiny na kývačce při pokojové teplotě. Membránu pak promyjeme v TBS, dvakrát v TBS-T, dvakrát v TBS. Následně aplikujeme roztok streptavidinu značeného alkalickou fosfatázou (ředíme 1/750 v TBS/0,3% BSA) a inkubujeme 50 ± 5 minut, promyjeme v TBS, TBS-T a TBS jak uvedeno výše a konečně detekujeme pomocí roztoku BCIP/NBT. Optimálního zbarvení je dosaženo po 30 až 40 minutách. Nakonec membránu promyjeme 5 minut v TBS a 1-2 minuty v destilované vodě a usušíme.
Výsledky
Ukázky IEF obrazů jsou na obr. 1 a 2. Z 35 vyšetřených pacientů byla ith. syntéza IgM zjištěna výpočtem podle Reibera u šesti a podle Auera et al. u pěti pacientů. Ith. syntéza o-IgM (alespoň dva zřetelné pásy v likvoru bez protějšku v séru) byla detekována u 11 pacientů (Tabulka 1). U pěti z nich byla prokázána ith. syntéza IgM podle Reibera a u čtyř i podle Auera et al. U jedné pacientky s vypočtenou výraznou ith. syntézou IgM (intrathekální frakce 48 %, resp. 28 %) vyzněla detekce o-IgM negativně i při opakovaném vyšetření. Mezi kvantitativní a kvalitativní metodou nacházíme statisticky významnou korelaci (Fisherův exaktní test, P=0,007 při použití Reiberova vztahu a P=0,026 při použití vztahu dle Auera et al.). Přítomnost ith. syntézy o-IgM významně koreluje s přítomností ith. syntézy o-IgG (P=0,023) a oligoklonálních volných lehkých řetězců typu lambda (P<0,0001), ale nikoliv typu kappa (P=0,246).
Tab. 1. Clinical diagnoses and the frequency of positive results for intrathecal immunoglobulin synthesis 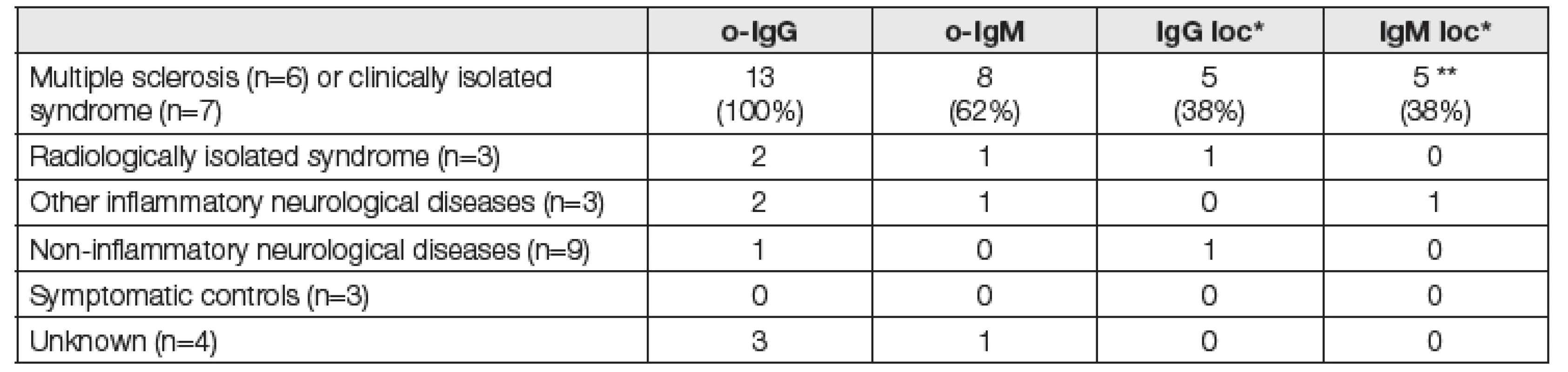
*Ig loc = positive calculation of intrathecal synthesis according to the Reiber´s formula or the formula of Auer et al. Qualitative interpretation of the results (positive/negative) was in perfect agreement for IgG, while one MS patient positive for o-IgM and positive by Reiber´s formula was evaluated as negative using the formula of Auer et al. ** 5 positives by Reiber´s formula and 4 positives by the formula of Auer et al. Fig. 1a. IEF/AIB of 8 serum samples with elevated IgM concentration and/or IgM paraprotein detected on immunofixation (P1-P8) and four CSF(C) – serum (S) pairs (C1-4 and S1-4). NC = negative control (intravenous IgG preparation diluted to 500 mg/l). At least 2 clear-cut IgM bands not present in serum can be seen in C1, while numerous CSF-restricted IgM bands could be counted in C2. C3 and C4 were evaluated as negative. On the right, it is demonstrated that samples (P1-P4) mostly do not enter the gel without dithiothreitol pretreatment. 
Fig. 1b, c. IgM kappa/lambda detection on immunoblots of 8 serum samples with elevated IgM concentration and/or IgM paraprotein detected on immunofixation. The same gel run as in Fig. 1a. The coating anti-human IgM antibody was the same as for total IgM detection, but biotin-labeled anti-human IgM detection antibody was replaced with alkaline phosphatase labeled anti-human kappa and lambda light chain antibodies, respectively. The background is less clear than in Figure 1a; this possibly suggests that trace amounts of immunoglobulins other than IgM might still be transferred onto the membrane and react with anti-kappa and anti-lambda antibodies. Although the results of IEF/AIB patterns are clearly not so straightforward as those of immunofixation electrophoresis, identical conclusions could be driven by using kappa and lambda light chain detection (P2 and P5, IgM kappa; P1, P7 and P8, IgM lambda; P4, IgM kappa and IgM lambda; P3 and P6, no paraprotein detected). 
Fig. 2. IEF/AIB of five CSF (C) – serum (S) pairs (C1-5 and S1-5). Samples were separated within the same run without (2a) or with (2b) alkylation with acrylamide after incubation with dithiothreitol. C1, C3 and C4 were evaluated as negative, while CSFrestricted IgM bands could be seen in sample C2 (arrowheads). Sample C5 was evaluated as unequivocally positive (bands indicated by asterisks) only when alkylated. Interestingly, sample C1 was negative despite pronounced intrathecal IgM synthesis calculated by both formulas, while sample C2 was negative by quantitative testing and the actual CSF IgM concentration 0.17 mg/l represent the lowest CSF IgM value with positive o-IgM test that we have ever met. 
Diskuse
Separace IgM v nativním vzorku likvoru a séra se nepodařilo dosáhnout ani při použití vyšší teploty (15, 25 nebo 35°C), ani použitím gelu obsahujícího nižší koncentraci agarózy (0,8 %), 0,5-1 % detergent (Nonidet P40-Substitute), ani aplikací vzorku při nízkém napětí 150 V podle doporučení Westermeiera [19]. Toto pozorování je v souladu s údaji publikovanými Sindicem [2] a Cornellem [20], přestože některým skupinám se v minulosti podařilo dosáhnout separace nativní molekuly IgM [21-24]. Variantou pro další pokusy může být velmi řídký agarózový gel (<0,8 %), popř. gel obsahující 5-10 % glycerol nebo kompozitní agarózový-polyakrylamidový gel, jehož použití bylo popsáno v práci [22].
V naší studii se separaci IgM podařilo realizovat pouze po předúpravě vzorků DTT, bez níž zůstala ve všech experimentech naprostá většina IgM na startu. Použití redukčního činidla se tedy zdá nutné. Je zajímavé, že ve dvou případech byly o-IgM pásy zřetelné pouze ve vzorku inkubovaném v posledním kroku předúpravy s akrylamidem. Potřeba zařazení alkylačního kroku byla v literatuře diskutována [25], v případě námi zvolené kombinace může spolupůsobit i reakce akrylamidu s přebytkem DTT, a tím zabránění jeho interference při separaci. Zlepšení separace IgM bylo dosaženo vřazením prefokusačního kroku, katodickou aplikací vzorku a použitím užšího pH gradientu (4-8) připraveného kombinací Pharmalytů 4-6,5 a 5-8. Ten se jeví jako vhodnější než gradient 5-8, neboť některé práce uvádějí hodnoty izoelektrických bodů IgM mezi 4,5 a 8 [23, 24, 26].
Již v úvodu byl zmíněn potenciál metody pro podstatně citlivější detekci ith. syntézy oproti kvantitativním (výpočtovým) vztahům. Při výpočtu vycházíme z tzv. limitního kvocientu, který vyjadřuje maximální poměr koncentrací imunoglobulinu v likvoru a séru vysvětlitelný difúzí přes hemato-likvorovou bariéru. Nejčastěji se používá Reiberův vztah, který je matematicky ve shodě s teoretickou představou o kinetice difúze proteinů z krve do likvoru [17] a má obecný tvar:
s hodnotami parametrů pro IgM: a/b = 0,67; b2 = 0,00012, c = 0,0071.
Recentně publikovali Auer et al. [18] vztah:
s hodnotami parametrů pro IgM: a = 1,845; b = 1,34.
Vlastní výpočet ith. syntézy je již shodný [17, 18]:
resp.
Na rozdíl od Reiberova vztahu je rovnice Auera et al. založena na čistě empirickém přístupu; další rozdíl spočívá v tom, že Reiber použil data z ELISA stanovení IgM, Auer et al. měřili IgM nefelometricky na analyzátoru Immage a uvádějí detekční limit 0,3 mg/l. Při použití této metody jsme však v minulosti nalezli v likvoru signifikantně vyšší hodnoty než hodnoty získané nefelometricky na analyzátorech řady BN nebo ELISA metodou [27]. Domníváme se proto, že rovnice Auera et al. může poskytovat falešně negativní hodnoty, resp. hodnoty jejích parametrů bude třeba validovat a upravit v případě použití jiných měřících systémů pro stanovení IgM v likvoru.
Výsledky kvalitativní a kvantitativní metody detekce ith. syntézy IgM i v malém souboru statisticky významně korelují, což je v částečném rozporu s výsledky publikovanými na mnohem větším souboru pacientů Kelbichem et al. [10] Navzdory částečně oprávněným výhradám vůči výpočtům ith. syntézy [28] je nutné si uvědomit, že ith. syntéza způsobuje přítomnost určitého množství imunoglobulinu v likvoru „navíc“ oproti množství, které by bylo za daných podmínek (QAlb a sérové koncentrace imunoglobulinu) přítomno při pouhém pasívním přestupu ze séra. Na tomto elementárním faktu jsou založeny všechny výpočty ith. syntézy. Úplná absence korelace mezi kvantitativní a kvalitativní metodou proto může upozorňovat i na analytické nedostatky jednoho či druhého postupu.
Metoda by mohla sloužit i pro detekci nízkých koncentrací monoklonálních imunoglobulinů, podobně jako u IgG [16, 20]. Klinický přínos takové aplikace je však zřejmě s ohledem na jiné možnosti monitorování monoklonálních gamapatií [29] zanedbatelný.
Potenciál pro významné snížení detekčního limitu vykazuje luminiscenční detekce. Schneiderovi et al. [30] její použití umožnilo ředit vzorky likvorů a sér na 0,05 mg/l a podíl pacientů s CIS a pozitivitou o-IgM je v jejich studii poněkud vyšší (74 %) než v práci Villarové et al. z r. 2005 (46 %). Mnohem nižší detekční limit luminiscenční detekce oproti chromogenním metodám by také mohl výrazně usnadnit detekci antigen-specifických o-IgM (popř. o-IgA, o-IgD) pásů v likvoru. Pořízení příslušného vybavení je u nás bohužel vzhledem k finanční nákladnosti zatím nemožné.
Závěr
Detekce o-IgM v likvoru je obtížná a stále ne zcela uspokojivě vyřešená metoda, která má nicméně významný diagnostický potenciál u zánětlivých onemocnění nervového systému a významný prognostický potenciál specificky u RS, kde intrathekální syntéza o-IgM může signalizovat agresívní průběh onemocnění. Popsaná metoda umožňuje detekovat o-IgM i ve vzorcích s nízkou koncentrací IgM v likvoru. Pro další metodický pokrok je nezbytné srovnání různých variant detekce o-IgM, ale také validace metod založená na klinických datech. Teprve potom bude možno uvažovat o standardizaci postupu, který se ukáže jako nejvhodnější.
Do redakce došlo 4. 4. 2016
Adresa pro korespondenci:
MUDr. Ing. David Zeman, Ph.D.
Oddělení klinické biochemie
Ústav laboratorní diagnostiky
Fakultní nemocnice Ostrava
17. listopadu 1790,
708 52 Ostrava-Poruba
e-mail: david.zeman@osu.cz
Zdroje
1. Kaiser, R. Affinity immunoblotting: rapid and sensitive detection of oligoclonal IgG, IgA and IgM in unconcentrated CSF by agarose isoelectric focusing. J. Neurol. Sci. 1991, 103, p. 216-225.
2. Sindic, C. J., Monteyne, P., Laterre, E. C. Occurrence of oligoclonal IgM bands in the cerebrospinal fluid of neurological patients: an immunoaffinity-mediated capillary blot study. J. Neurol. Sci. 1994, 124, p. 215-219.
3. Rijcken, C. A., Thompson, E. J., Teelken, A. W. An improved, ultrasensitive method for the detection of IgM oligoclonal bands in cerebrospinal fluid. J. Immunol. Methods 1997, 203, p. 167-169.
4. Villar, L. M., Masjuán, J., González-Porqué, P. et al. Intrathecal IgM synthesis is a prognostic factor in multiple sclerosis. Ann. Neurol. 2003, 53, p. 222-226.
5. Villar, L. M., González-Porqué, P., Masjuán, J., Alvarez-Cermeño, J. C., Bootello, A., Keir, G. A sensitive and reproducible method for the detection of oligoclonal IgM bands. J. Immunol. Methods 2001, 258, p. 151-155.
6. Villar, L. M., Sádaba, M. C., Roldán, E. et al. Intrathecal synthesis of oligoclonal IgM against myelin lipids predicts an aggressive disease course in MS. J. Clin. Invest. 2005, 115, p. 187-194.
7. Sobek, O., Adam, P., Koudelková, M., Štourač, P., Mareš, J. Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP. Cesk. Slov. Neurol. N. 2012, 75/108 (2), p. 159-163.
8. Deisenhammer, F., Bartoš, A., Egg, R. et al. Routine cerebrospinal fluid (CSF) analysis. In: Gilhus, N.E., Basrnes, M.P., Brainin, M. (Eds.) European Handbook of Neurological Management: Volume 1, 2nd Edition. Blackwell Publishing Ltd. 2011, p. 5-17.
9. Wick, M. (Ed.). Ausgewählte Methoden der Liquordiagnostik und Klinischen Neurochemie, 3. vydání, 2014, dostupné na: www.dgln.de (sekce Empfehlungen – Methodenkatalog)
10. Kelbich, P., Vachová, M., Kotalová, J., Vondráčková, S., Čujková, O. Detekce intratékální syntézy imunoglobulinů – vlastní zkušenosti. Cesk. Slov. Neurol. N. 2014, 77/110 (Suppl), p. S44.
11. Richard, S., Miossec, V., Moreau, J. F., Taufin, J. L. Detection of oligoclonal immunoglobulins in cerebrospinal fluid by an immunofixation-peroxidase method. Clin. Chem. 2002, 48, p. 165-173.
12. Sindic, C. J., Laterre, E. C. Oligoclonal free kappa and lambda bands in the cerebrospinal fluid of patients with multiple sclerosis and other neurological diseases. An immunoaffinity-mediated capillary blot study. J Neuroimmunol 1991, 33, p. 63-72.
13. Zeman, D., Vaníčková, Z., Benáková, H., Havrdová, E. Volné lehké řetězce typu kappa v likvoru a séru. Klin. Biochem. Metab. 2002, 10 (31), p. 98-102.
14. Nováčková, L., Zeman, D. Detection of oligoclonal IgG bands in cerebrospinal fluid and serum: comparison between commercial immunofixation method and home-made affinity immunoblotting method and evaluation of interobserver agreement. Klin. Biochem. Metab. 2011, 19 (40), p. 229-233.
15. Zeman, D., Hradílek, P., Kušnierová, P. et al. Oligoclonal free light chains in cerebrospinal fluid as markers of intrathecal inflammation. Comparison with oligoclonal IgG. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc, Czech Repub. 2015, 159, p. 104-114.
16. Bojková, J. Detekce nízkých koncentrací paraproteinů v séru a moči metodou izoelektrické fokusace s afinitním imunoblottingem. Diplomová práce. Ústav zdravotnic-kých disciplín, Vysoká škola zdravotníctva a sociálnej práce sv. Alžbety, Bratislava, 2015, p. 1-77.
17. Reiber, H. Flow rate of cerebrospinal fluid (CSF) – a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. J. Neurol. Sci. 1994, 122, p. 189-203.
18. Auer, M., Hegen, H., Zeileis, A., Deisenhammer, F. Quantitation of intrathecal immunoglobulin synthesis – a new empirical formula. Eur. J. Neurol. 2016, p. 713-721.
19. Westermeier, R. Agarose IEF. In: Westermeier R. Electrophoresis in practice. Fourth, revised and enlarged edition. Willey-VCH, Weinheim 2005: p. 189-196.
20. Cornell, F. N. Isoelectric focusing, blotting and probing methods for detection and identification of monoclonal proteins. Clin. Biochem. Rev., 2009, 30, p. 123-130.
21. Rosén, A., Ek, K., Åman, P. Agarose isoelectric focusing of native human immunoglobulin M and α2-macroglobulin. J. Immunol. Methods 1979, 28, p. 1-11.
22. Jackson, D. E., Skandera, C. A., Owen, J., Lally, E. T., Montgomery, P. C. Isoelectric focusing of IgA and IgM in composite acrylamide-agarose gels. J. Immunol. Methods 1980, 36, p. 315-324.
23. Chiodi, F., Sidén, Å., Ösby, E. Isoelectric focusing of monoclonal immunoglobulin G, A and M followed by detection with the avidin-biotin system. Electrophoresis 1985, 6, p. 124-128.
24. Schibeci, A., Wade, A. W., Depew, W. T., Szewczuk, M. R. Analysis of serum antibody repertoires by isoelectric focusing and capillary blotting onto nitrocellulose paper. J. Immunol. Methods 1986, 89, p. 201-205.
25. Herbert, B. Some practices and pitfalls of sample pre-paration for isoelectric focusing in proteomics. In: Garfin D, Ahuja S (Eds.). Handbook of Isoelectric Focusing. Elsevier, Amsterdam 2005, p. 147-164.
26. Wang, Z. Y., Hansen, K., Sidén, Å., Cruz, M. Intrathecal synthesis of anti-Borrelia burgdorferi antibodies in neuroborreliosis: a study with special emphasis on oligoclonal IgM antibody bands. Scand. J. Immunol. 1993, 37, p. 369-376.
27. Zeman, D., Kušnierová, P., Gottwaldová, J. et al. Úskalí kvantifikace IgM v likvoru. Klin. Biochem. Metab. 2012, 20 (41), p. 136-144.
28. Kelbich, P. Jsem skeptický vůči výpočtům intrathe-kální syntézy imunoglobulinů. (Editorial). Klin. Biochem. Metab. 2012, 20 (41), p. 133.
29. Keren, D. F., Schroeder, L. Challenges of measuring monoclonal proteins in serum. Clin. Chem. Lab. Med. 2016, Feb 24. doi: 10.1515/cclm-2015-0862. [Epub ahead of print]
30. Schneider, R., Euler, B., Rauer, S. Intrathecal IgM-synthesis does not correlate with the risk of relapse in patients with a primary demyelinating event. Eur. J. Neurol. 2007, 14, p. 907-911.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článek Editorial
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2016 Číslo 3
-
Všetky články tohto čísla
- Editorial
- Pokroky v imunoanalýzách s luminiscenční a elektrochemickou detekcí
- Nová diagnostická kritéria mnohočetného myelomu
- Vztah hladin molekul BAFF a APRIL k vybraným ukazatelům mnohočetného myelomu
- Výsledky léčby nemocných s mnohočetným myelomem a současným renálním postižením
- Analýza parametrů signálních drah myelomové kostní nemoci u mnohočetného myelomu
- Detekce oligoklonálních IgM pásů v likvoru
- Vitamíny u kriticky nemocných
- Stanovení ftalátů a bisfenolu A a jejich metabolitů v různých typech materiálů
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Detekce oligoklonálních IgM pásů v likvoru
- Vitamíny u kriticky nemocných
- Pokroky v imunoanalýzách s luminiscenční a elektrochemickou detekcí
- Nová diagnostická kritéria mnohočetného myelomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy









