-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nové možnosti léčby glioblastoma multiforme
New Therapeutic Options in Therapy of Glioblastoma Multiforme
Glioblastoma multiforme is one of the most aggressive malignant brain tumours with limited therapeutics options. Standard therapy is maximal surgical resection and adjuvant concurrent chemo ‑ radiotherapy and maintenance therapy with temozolomide. This approach improves median and 5‑year survival in comparison with postsurgical radiotherapy alone. Additional predictive and prognostic biomarkers are necessary, especially due to the development of targeted therapy – antibodies and tyrosine kinase inhibitors. These new therapeutic approaches are under intensive investigation. The most promising data currently available are for anti‑angiogenic therapies, such as bevacizumab and cediranib. This review presents a summary of the possible role of targeted therapy in the treatment of glioblastoma multiforme.
Key words:
glioblastoma multiforme – targeted therapy – biomarkers – angiogenesis – VEGF – EGFR – integrins
Autori: R. Lakomý 1,2; P. Burkoň 1,3; D. Burkoňová 1,3; R. Jančálek 1,4
Pôsobisko autorov: Lékařská fakulta, Masarykova univerzita Brno 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2; Klinika radiační onkologie, Masarykův onkologický ústav, Brno 3; Neurochirurgická klinika, FN u sv. Anny v Brně 4
Vyšlo v časopise: Klin Onkol 2010; 23(6): 381-387
Kategória: Přehledy
Súhrn
Glioblastoma multiforme patří k nejagresivnějším mozkovým nádorům s omezenými léčebnými možnostmi. V současné době je zlatým léčebným standardem kombinace radio ‑ a chemoterapie následující po maximálně možné radikální operaci. Tento postup zlepšuje medián celkového a pětiletého přežití. Další výzkum biomarkerů je nezbytný, zvláště v době rozvoje cílené biologické léčby – protilátek a inhibitorů tyrozinkináz. Zatím nejslibnější výsledky jsou dnes u anti‑angiogenních látek, jako bevacizumab a cediranib. Práce shrnuje aktuální informace o možné roli cílených biologických preparátů v léčbě glioblastomu.
Klíčová slova:
glioblastoma multiforme – cílená léčba – biomarkery – angiogeneze – VEGF – EGFR – integrinyÚvod
Gliomy s vysokým stupněm malignity jsou nejčastějšími primárními mozkovými nádory u dospělých, tvoří přibližně polovinu všech primárních mozkových tumorů v dospělosti. V ČR je ročně diagnostikováno asi 500 – 550 pacientů.
Glioblastoma multiforme (GBM) tvoří přibližně 75 % všech high‑grade gliomů. Incidence se popisuje mezi 3 – 4 případy na 100 000 obyvatel za rok. Postihuje dospělé mezi 45 – 75 lety; více než 80 % pacientů je starší 50 let.
Histopatologicky je multiformní glio-blastom charakterizován velmi rychlým růstem, značnou mitotickou aktivitou, jadernými atypiemi, cévními proliferacemi s arteriovenózními zkraty, trombózami, krvácením s centrální nekrózou uvnitř nádoru. Jakákoliv kombinace tří z těchto ukazatelů – jaderné atypie, mitotická aktivita, vaskulární proliferace a nekróza – tvoří diagnózu GBM. Tyto nádory se chovají značně infiltrativně a zasahují velké části mozkové tkáně.
Vyšetření magnetickou rezonancí ukazuje heterogenní, expanzivně se chovající útvar často utlačující komory a přetlačující středočárové struktury. Často se setkáváme s prstenčitým zvýšením denzity na okraji centrálně uložených nekrotických oblastí přecházejícím do okolního edému.
Prognóza pacientů s GBM je obecně velmi špatná. Medián přežití je přibližně 12 měsíců. Základními prognostickými faktory jsou věk pacienta, histologie, Karnofského index (KPS), rozsah chirurgického výkonu a trvání příznaků. Curran et al při analýze 1 578 pacientů zjistili, že hlavními prognostickými faktory jsou věk a celkový stav pacienta (Karnofsky Performance Status – KPS). Jak ukazuje tab. 1, využitím RPA analýzy je možné pacienty zařadit do skupin s podobnými výsledky léčby [1].
Tab. 1. RPA klasifi kace maligních gliomů (RTOG Recursive Partitioning Analysis of Malignant Glioma) [1]. ![RPA klasifi kace maligních gliomů (RTOG Recursive Partitioning Analysis of Malignant Glioma) [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a6de856341dc8eed68c347321fa91c5a.jpeg)
K recidivám u high‑grade gliomů dochází nejčastěji v místě uložení primárního nádoru; velmi zřídka se setkáváme s metastazováním po liquorových cestách či s rozsevem choroby mimo centrální nervový systém.
Léčba
Standardní léčebnou metodou glioblastoma multiforme je chirurgický výkon následovaný kombinací radioterapie a chemoterapie s temozolomidem (konkomitantně a v adjuvantním podání po ukončení radioterapie) [2].
Léčebná strategie, zvláště pooperační, musí být určena multidisciplinárním týmem, zpravidla ve složení neurochirurg, radiační a klinický onkolog, diagnostik a neurolog a řešena s přihlédnutím ke všem rizikovým faktorům včetně celkového stavu pacienta.
Chirurgie
Základní léčebnou metodou u GBM je neurochirurgický výkon. Cílem neurochirurgického výkonu je dosáhnout maximálně možné makroskopické resekce a vyhnout se pooperační morbiditě. Bohužel radikality lze v mnoha případech těžko dosáhnout pro infiltrativní růst nádoru. K dosažení maximální radikality výkonu se v současné době využívá zobrazení nádorové tkáně pomocí předoperačně perorálně podaného preparátu (5 - ALA), jehož metabolity jsou při operaci vizualizovány speciálně upraveným mikroskopem. Do 48 – 72 hod po operaci je také nutné provést kontrolní CT nebo MR k vyloučení rezidua, eventuálně krvácení [2].
Radikalita a úspěšnost výkonu je rozhodujícím prognostickým faktorem [3,4]. Parciální výkon má vždy horší léčebné výsledky a nejhorší léčebné výsledky jsou uváděny u pacientů s inoperabilními tumory. Histologické ověření nádoru i při neradikálním výkonu je pro stanovení další léčby rozhodující. Při zjevné inoperabilitě se zvažuje provedení verifikační stereotaktické biopsie. Po histologické verifikaci je indikována radioterapie (3D konformní radioterapie nebo IMRT [5]) a případně i chemoterapie (cytostatikem volby je temozolomid).
Chemoradioterapie
Role pooperační chemoterapie v léčbě maligního glioblastomu byla zásadně přehodnocena na základě výsledků randomizované studie publikované R. Stuppem v roce 2005 [6]. Tato studie potvrdila efekt temozolomidu, alkylačního cytostatika, v adjuvantní kombinované léčbě high‑grade gliomů po neurochirurgické resekci. Pooperační chemoradioterapie s temozolomidem zvyšuje celkové přežití a bezpříznakové období. Nové výsledky pětiletého sledování přežití a analýzu prediktivních faktorů včetně hodnocení významu hladiny metylace promotoru genu reparačního enzymu MGMT – methylguanin DNA methyltransferázy – publikovali na základě provedené studie Stupp et al v březnu roku 2009 [7].
Nejlepší léčebné výsledky byly v této studii popsány ve věkové skupině pacientů mladších 50 let; pět let přežívá v případě kombinované terapie 17 % a po samostatné radioterapii pouze 4,9 %. U pacientů nad 50 let přežívá pět let 6,4 – 6,6 % oproti 0 – 1,1 %. Nicméně podání adjuvantní radioterapie a chemoterapie u starších pacientů v dobrém celkovém stavu může být i pro tyto pacienty prospěšné [8].
U pacientů léčených kombinovanou chemoradioterapií je tedy temozolomid standardně podáván v dávce 75 mg/ m2, den 1. – 42., p.o., po celou dobu radioterapie (i přes víkendy). Radioterapie je prováděna standardní frakcionací (5 × 2,0 Gy/ týden, celková dávka 60 Gy za 6 týdnů). Adjuvantní léčba temozolomidem v monoterapii je indikována po ukončení konkomitantní chemoradioterapie (ve 4. týdnu po ukončení ozařování) v dávce 150 – 200 mg/ m2, p.o., den 1. – 5., interval 28 dní, celkem 4 – 6 cyklů nebo do progrese onemocnění.
Cílená biologická léčba
Dnes probíhá řada klinických studií zkoumajících efekt „cílené biologické léčby“. Metody založené na monoklonálních protilátkách a tyrozinkinázových inhibitorech v kombinaci se standardním způsobem léčby se používají především v pooperační indikaci či v léčbě recidivujících nádorů.
Nejvíce jsou zkoumány mechanizmy ovlivňující angiogenezi, epidermální růstové faktory, dráhu m ‑ TOR, integriny, proteinkinázu Cβ2. Nejnadějnější výsledky prokazují inhibitory angiogeneze – bevacizumab a cediranib.
Další rozvoj cílené léčby bude vyžadovat důkladné poznání genetických změn v nádorové buňce a objev nových prognostických a prediktivních faktorů [9]. Centrem zájmu jsou dnes skupiny krátkých nekódujících RNA (20 – 25 nukleotidů) – mikroRNA, které tvoří rozsáhlou síť regulátorů genové exprese.
Angiogeneze – tvoření nových krevních cév – hraje klíčovou úlohu v rozvoji nádorového bujení. Nádor, který dosáhne určité velikosti, potřebuje systém krevních cév, které mu dodají živiny, kyslík a odstraní toxické látky. V roce 1980 byl izolován vaskulární endoteliální růstový faktor (vascular endothelial growth factor – VEGF) jako silný stimulátor růstu endotelových cév, který aktivuje tyrozinkinázové receptory na povrchu buněk endotelu, a je tak hlavním regulátorem normálního i patologického růstu cév. Neovaskularizace je jedním z hlavních znaků multiformního glioblastomu. Podpůrné endotelie GBM exprimují VEGF receptory ve velkém množství.
Možnost využití anti‑angiogenních látek popsali ve své práci Folkman et al před více než třemi desetiletími [10]. Na gliálních modelech bylo dokázáno, že blokáda VEGF se odrazí v poklesu hustoty kapilár a v normalizaci již vytvořené cévní sítě vedoucí ke zvýšení oxygenace a snížení intersticiálního tlaku ve tkáni [11]. Klinické výsledky s první generací léků, jako je thalidomid, byly nadějí do budoucna [12].
Inhibitory vaskulárního endoteliálního růstového faktoru
Největší pozornost je v současné době věnována bevacizumabu a jeho kombinaci se standardní léčbou. Bevacizumab (Avastin, Roche) je humanizovaná monoklonální protilátka proti VEGF. Svoji vazbou na VEGF zabraňuje interakci mezi VEGF a tyrozinkinázovými receptory VEGFR ‑ 1 a VEGFR ‑ 2.
V léčbě recidivujících maligních gliomů byl bevacizumab součástí řady studií fáze I a II. Pope et al pomocí MR vyšetření popsali radiologický efekt po podání bevacizumabu pacientům s recidivujícími high‑grade gliomy pomocí MR vyšetření [13]. Až 45% odpověď na tuto kombinaci zjistili Chen et al pomocí PET vyšetření [14].
V léčbě recidivujícího multiformního glioblastomu byl prokázán efekt kombinace bevacizumabu s irinotecanem, inhibitorem topoizomerázy I, jehož lipofilní metabolity dobře pronikají hematoencefalickou bariérou. Příznivé výsledky publikovali Vredenburgh et al v roce 2007 na souboru 35 pacientů s recidivujícími high‑grade gliomy předléčenými radioterapií a temozolomidem. Četnost léčebné odpovědi dosáhla překvapivých 57 % (20 pacientů), šestiměsíční období bez progrese bylo zaznamenáno u 46 % pacientů a po 6 měsících od započetí léčby přežívalo 77 % pacientů s akceptovatelnými nežádoucími účinky [15].
Pozitivní výsledky při léčbě bevacizumabem zaznamenali také Friedman et al [16]. Cílem této studie fáze II bylo zjistit, jaká je účinnost samotného bevacizumabu. Srovnávacím ramenem byla ověřená kombinace bevacizumabu s irinotecanem. Bevacizumab byl podáván v dávce 10 mg/ kg à 2 týdny, irinotecan v dávce 340 mg/ m2 nebo 125 mg/ m2 à 2 týdny podle toho, zda pacienti současně užívali antiepileptika ovlivňující metabolizmus cytostatika v játrech (s/ bez enzyme ‑ inducing antiepileptic drugs – EIAEDs). Studie se zúčastnilo celkem 167 pacientů. V rameni se samotným bevacizumabem bylo šestiměsíční doby bez progrese dosaženo u 42,6 % pacientů, u kombinace 50,3 %, medián celkového přežití v rameni se samotnou protilátkou byl 9,2 měsíce, u kombinace 8,7 měsíce a četnost léčebných odpovědí 28,2 % vs 37,8 % u kombinace. Komplikace bevacizumabu, jako krvácení do CNS, trombembolické příhody, proteinurie a hypertenze, byly srovnatelné jako při léčbě jiných nádorů a byly přijatelné. Dle aktuálních znalostí lze říci, že bevacizumab je účinný v léčbě relabujícího glioblastomu, a to jak v monoterapii, tak při kombinaci s irinotecanem, s akceptovatelným profilem toxicity.
V roce 2008 byly publikovány výsledky pilotní studie využívající aplikace bevacizumabu spolu s radioterapií a temozolomidem v primární léčbě high‑grade gliomů. Pacienti byli léčeni standardní radioterapií (59,4 Gy za 6,5 týdne, 1,8 Gy na frakci, 5 frakcí týdně) konkomitantně s temozolomidem v dávce 75 mg/ m2 p.o. po celou dobu radioterapie. Bevacizumab byl podáván 14. a 28. den radioterapie i.v. infuzí v dávce 10 mg/ kg. Měsíc po ukončení ozáření pokračovala adjuvantní léčba v 28denních cyklech, přičemž 1. – 7. den byl podáván temozolomid v dávce 150 mg/ m2 a 14. a 28. den cyklu bevacizumab opět v dávce 10 mg/ kg. Autoři popsali 86% odpověď na léčbu, jednoleté přežití bez progrese 59,3 % a jednoleté celkové přežití 86,7 %. Tato studie prokázala efektivitu doplnění standardní léčby bevacizumabem v primární léčbě nově diagnostikovaných high‑grade gliomů. Toxicitu režimu shrnuje tab. 2 [17].
Pod záštitou Radiation Therapy Oncology Group nyní probíhá pro pacienty s nově diagnostikovaným multiformním glioblastomem studie fáze III (RTOG 0825 Study), jejímž primárním cílem je zjistit, zdali přidání bevacizumabu ke standardní léčbě, tj. ke konkomitantní chemoradioterapii s následným podáním adjuvantního temozolomidu, zlepší léčebné výsledky [18].
Všichni pacienti jsou léčeni konformní radioterapií standardní frakcionací, tj. 60,0 Gy/ 30 frakcí/ 5 frakcí týdně – konkomitantně s temozolomidem v dávce 75 mg/ m2 p.o. po celou dobu radioterapie včetně víkendů. Počínaje 16. frakcí ozáření je pacientům v rameni 1 přidáno placebo a pacientům v rameni 2 bevacizumab. Studijní lék je podáván i.v. infuzí v dávce 10 mg/ kg každý 1. a 15. den 28denního cyklu. Po ukončení radioterapie léčba pokračuje dalšími 28denními cykly, kdy 1. – 5. den každého cyklu je podáván temozolomid v dávce 150 – 200 mg/ m2 p.o. a každý 1. a 15. den cyklu je podáván bevacizumab nebo placebo. Základním cílem studie je zjistit vliv bevacizumabu na celkové přežití, dobu do progrese, vedlejší účinky a kvalitu života pacientů. Schéma studie ukazuje tab. 3 [18].
Tab. 3. Schéma studie [18]. ![Schéma studie [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2850b29ed1dfda26a60fb1c9c3af80e9.jpeg)
RT – radioterapie, Gy – Gray, TMZ – temozolomid Aflibercept (Sanofi-Aventis): Tento preparát byl vytvořen fúzí části protilátky IgG1 a solubilního VEGFR ‑ 1, 2 (VEGF ‑ Trap) s afinitou k VEGF ‑ A mnohonásobně větší než bevacizumab. VEGF je solubilním receptorem vychytán, a nemůže tak aktivovat receptor na povrchu endoteliálních buněk. Zatím jsou k dispozici jen data s malými soubory pacientů, dle kterých je četnost radiologických odpovědí srovnatelná s bevacizumabem. Efektivita preparátu bude muset být potvrzena většími studiemi [19].
Inhibitory tyrozinkinázy receptoru pro vaskulární endoteliální růstový faktor
Zatím nadějná data jsou dnes u cediranibu (AZD2171) – RecentinTM. Cílovou strukturou jsou tyrozinkinázové receptory, především VEGFR ‑ 2, ale též VEGFR ‑ 1, VEGFR ‑ 3, c ‑ Kit, receptory růstového faktoru odvozeného z trombocytů PDGFRα a PDGFRβ. Dle publikované studie fáze II s 31 nemocnými s recidivujícím glioblastomem cediranib pozitivně ovlivnil četnost přežití bez progrese v 6 měsících – 25,8 %, přežití bez progrese – 16,7 týdne i celkové přežití – 31,7 týdne; radiologická odpověď byla zaznamenána u 56 % nemocných. Účinky cediranibu jsou poměrně rychlé, již za 24 hod byl prokázán pokles enhancemetu kontrastu v nádoru. Nejčastějšími nežádoucími příhodami při léčbě cediranibem jsou hypertenze a únava [20].
Aktuálně probíhá randomizovaná klinická studie fáze III u nemocných s relabujícím glioblastomem porovnávající účinnost cediranibu v monoterapii a kombinace cediranib + lomustin oproti lomustinu samotnému. Cediranib je zkoušen i u nemocných s nově diagnostikovaným glioblastomem, a to v kombinaci s denním temozolomidem a radioterapií, zatím jen v rámci klinické studie fáze II.
K dalším tyrozinkinázovým inhibitorům, které ovlivňují VEGFR, patří např. sorafenib (Nexavar), sunitinib (Sutent), pazopanib (GW 786034, Armala), vatalanib (PTK 787), vandetanib (AZD 6474). Jde o preparáty zaměřené i na tyrozinkinázy jiných receptorů (tab. 4). Zatím však nejsou k dispozici přesvědčivá data o jejich účinnosti u glioblastomu, klinické studie fáze I/ II probíhají.
Tab. 4. Potenciální molekulární cíle antiangiogenní léčby u maligních gliomů. 
PDGFR – platelet-derived growth factor receptor, EGFR – epidermal growth factor receptor, KIT/SCFR – stem cell factor receptor, FLT-3 – FMS-like tyrosine kinase, CSF-1R – colony stimulating factor 1 receptor, SRC - cellular Rous sarcoma viral oncogene homolog, BCR-ABL – breakpoint cluster region-Abelson tyrosine kinase Inhibitory receptoru pro epidermální růstový faktor
Receptory pro epidermální růstové faktory (EGFR) zahrnují skupinu receptorů označovaných jako erbB ‑ 1 až erbB ‑ 4. Jsou spojeny s kontrolou buněčného růstu prostřednictvím autokrinních a apokrinních růstových faktorů, které se váží na jejich extracelulární doménu. Navázáním dochází k dimerizaci receptoru, který spouští aktivaci intracelulární tyrozinkinázové domény. Tato je následně fosforylována a rozbíhá přenos informací k jádru buňky (signální transdukci).
Receptor EGFR (erbB ‑ 1) je zvýšeně exprimován na povrchu buněk řady nádorů. Jeho exprese je nacházena přibližně u 40 – 50 % pacientů s multiformním glioblastomem. Četnost exprese tohoto receptoru shrnuje tab. 5. Amplifikace genu EGFR vede k řadě dějů, jejichž důsledkem je zvýšená agresivita nádoru a rezistence k radioterapii a chemoterapii. Cílem léčby může být extracelulární část receptoru (cetuximab) nebo jeho tyrozinkináza intracelulárně (gefitinib, erlotinib).
Tab. 5. Exprese EGFR receptoru u různých solidních nádorů. 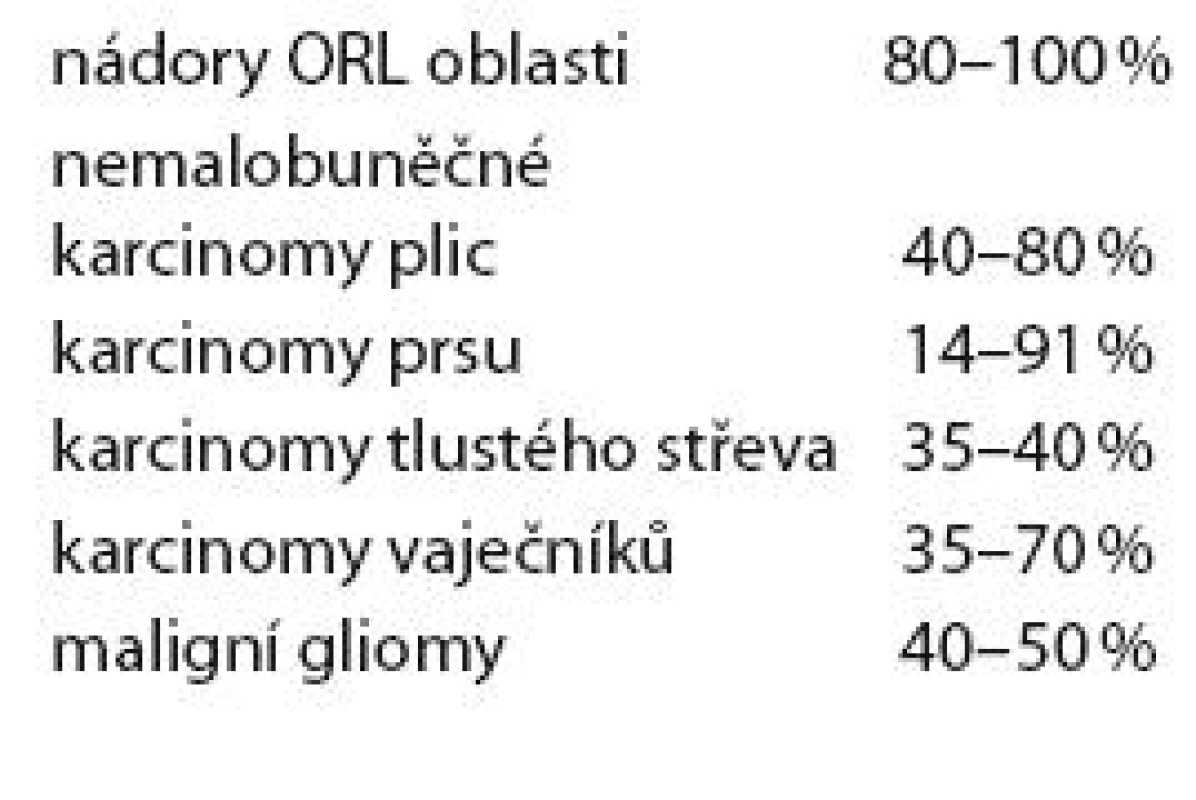
Cetuximab soutěží s endogenním ligandem o vazbu na externí doménu receptoru pro epidermální růstový faktor (erbB ‑ 1/ EGFR). Vazba cetuximabu na receptor vyústí v internalizaci vzniklého komplexu bez další aktivace endogenní tyrozinkinázy. Výsledkem je blokáda signální transdukce, která způsobí inhibici růstu nádoru a vede k apoptóze. Dalším účinkem je produkce angiogenních faktorů a cytotoxicita zprostředkovaná imunitními buňkami. Protilátka nepůsobí cytotoxicky přímo, ale zprostředkovává rozpoznání nádorové buňky cytotoxickými NK ‑ buňkami (natural killers).
Proběhlé studie fáze I a II s monoklonální protilátkou cetuximabem zatím neprokázaly významný efekt v léčbě recidivujících či progredujících maligních gliomů. Významným nedostatkem antiEGFR léčby je stále absence prediktivních faktorů [21].
Intracelulární inhibitory tyrozinkinázové aktivity obsadí a tím blokují vazebné místo pro ATP, a znemožní tak fosforylaci příslušného tyrozinu; signální transdukce je tak zastavena. Při blokádě jde o kompetitivní inhibici buď se specifickým účinkem na určitou tyrozinkinázu, nebo s účinkem na širší spektrum jednotlivých tyrozinkináz.
Nadějné výsledky studií s inhibitory tyrozinkinázy EGFR (gefitinib, erlotinib) z roku 2004 nebyly bohužel potvrzeny v dalších studiích [22,23]. Následné studie prokázaly, že účinek gefinitibu nekoreloval s množstvím EGFR receptorů exprimovaných na buňkách nádorů těchto pacientů [24].
Inhibitory receptoru pro destičkový růstový faktor
Nadměrná aktivace inhibitorů receptoru pro destičkový růstový faktor (PDGFR) a jeho signální dráhy může potencovat proces angiogeneze. Bohužel klinické studie fáze II s imatinibem v monoterapii naznačují, že u neselektovaných nemocných má tento lék omezenou účinnost [25,26]. Možná novější inhibitory PDGFR, jako dasatinib a tandutinib, které mají lepší prostupnost přes hematoencefalickou bariéru, budou mít příznivější výsledky.
Inhibitory rapamycinového receptoru
Everolimus a temsirolimus jsou perorálně účinné inhibitory savčího rapamycinového cílového receptoru (mTOR), jedné z komponent intracelulárních signálních cest ovlivňujících buněčný růst, metabolizmus, proliferaci a angiogenezi. Jde o derivát rapamycinu, který se váže na intracelulární protein FKBP ‑ 12. Vzniklý komplex poté působí jako inhibitor mTOR serin‑threoninové kinázy. Abnormální aktivita tohoto enzymu hraje důležitou roli v rozvoji řady malignit.
Galanis et al podali temsirolimus 65 pacientům s progredujícím GBM po předchozí léčbě nejvíce jednou řadou chemoterapie. U 36 % pacientů léčených temsirolimem zjistili radiologické zlepšení nálezu, což bylo spojeno se signifikantním prodloužením doby do progrese onemocnění. Tyto nálezy však musí být potvrzeny dalšími studiemi [27].
Inhibitory integrinů
Cilengitid (Merck KGaA) patří do nové třídy onkologických terapeutik, tzv. inhibitorů integrinu. Ty se váží na povrchové buněčné receptory – integriny, a inhibují tak růst nádoru a jeho angiogenezi.
Na základě klinické studie fáze I, která potvrdila bezpečnost podání cilengitidu a zjistila maximální tolerovatelnou dávku [28], byla provedena studie fáze II porovnávající účinnost dvou různých dávek cilengitidu u pacientů s recidivujícím multiformním glioblastomem. Lepší výsledky autoři popsali ve skupině pacientů, kterým byla podávána vyšší dávka preparátu; bez progrese bylo po šesti měsících 15 % pacientů a medián celkového přežití byl 9,9 měsíce. Cilengitid byl velmi dobře tolerován [29]. Nedostatky této studie, zejména nedostatečný efekt léčby cilengitidem ve srovnání s temozolomidem či bevacizumabem, shrnul ve svém článku Chamberlain. Je tedy zřejmé, že použití cilengitidu musí být dále potvrzeno [30].
Inhibitory proteinkinázy Cβ2
Proteinkináza C je důležitou součástí signální transdukce, její aktivovaná forma fosforyluje cílové proteiny. Inhibicí proteinkinázy Cβ2 tak sekundárně dochází k potlačení angiogeneze. Pilotní studie s enzastaurinem (GW786034, Eli Lilly) zaznamenaly velmi povzbudivé výsledky [31]. Ty se bohužel nepotvrdily ve větších klinických studiích. Proběhla klinická studie fáze III u rekurentních glioblastomů srovnávající enzastaurin s lomustinem. Dle analýzy nebyl nalezen rozdíl v době bez progrese (PFS), celkovém přežití (OS) nebo přežití bez progrese v šesti měsících. Nehematologická toxicita stupně 3/ 4 byla v obou ramenech podobná, hematologická toxicita stupně 3/ 4 byla častější v rameni s lomustinem [32].
Imunoterapie
Novou léčebnou metodu u glioblastomu představuje také imunoterapie s využitím vakcíny na bázi dendritických buněk. Dle proběhlých studií bylo prokázáno, že především u mladších pacientů může tato vakcína prodloužit přežití až na 24 měsíců. V současné době probíhá v České republice randomizovaná klinická studie fáze II, jejímž cílem je zhodnotit účinnost a bezpečnost intranodálně podané vakcíny v kombinaci se standardní léčbou první linie.
Závěr
Standardní léčebnou metodou v terapii glioblastomu zůstává maximální radikální chirurgický výkon následovaný kombinací radioterapie a chemoterapie s temozolomidem (konkomitantně a v adjuvantním podání po ukončení radioterapie). Tento postup prokázal jednoznačný benefit ve smyslu prodloužení doby do progrese i celkového přežití. Větší benefit z léčby lze dle výsledků analýz očekávat u pacientů s metylací MGMT.
I přes kombinovanou terapii není prognóza těchto pacientů dobrá. Ve snaze zlepšit léčebné výsledky proběhla v posledních letech řada klinických studií s cílenou biologickou léčbou. Byla zkoušena řada monoklonálních protilátek a inhibitorů využívajících vysoké frekvence overexprese receptoru epidermálního růstového faktoru (EGFR) a angiogeneze v těchto nádorech. I přes velké množství nových látek nepřinesly prozatím publikované výsledky klinických studií radikální skok vpřed. Nejdále je výzkum v oblasti inhibice angiogeneze, především s bevacizumabem. Probíhající studie fáze III a jejich výsledky by mohly náhled na standardní terapii změnit.
Tato práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví ČR: FUNDIN MZ0MOU2005.
This work was supported by the Czech Ministry of Health under contract No. FUNDIN – MZ0MOU2005.Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Petr Burkoň, Ph.D.
Klinika radiační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: burkon@mou.cz
Zdroje
1. Curran WJ Jr, Scott CB, Horton J et al. Recursive partitioning analysis of prognostic factors in three Radiation Therapy Oncology Group malignant glioma trials. J Natl Cancer Inst 1993; 85(9): 704 – 710.
2. NCCN Clinical Practice Guidelines in Oncology v. 1.2010. Dostupné z http:/ / www.nccn.org/ index.asp.
3. Laws ER, Parney IF, Huang W et al. Glioma Outcomes Investigators. Survival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project. J Neurosurg 2003; 99(3): 467 – 473.
4. Hentschel SJ, Sawaya R. Optimizing outcomes with maximal surgical resection of malignant gliomas. Cancer Control 2003; 10(2): 190 – 214.
5. Amelio D, Lorentini S, Schwarz M et al. Intensity ‑ modulated radiation therapy in newly diagnosed glioblastoma: A systematic review on clinical and technical issues. Radiother Oncol 2010; 97(3): 361 – 369.
6. Stupp R, Mason WP, van den Bent MJ et al. European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352(10): 987 – 996.
7. Stupp R, Hegi ME, Mason WP et al. European Organisation for Research and Treatment of Cancer Brain Tumour and Radiation Oncology Groups; National Cancer Institute of Canada Clinical Trials Group. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5‑year analysis of the EORTC ‑ NCIC trial. Lancet Oncol 2009; 10(5): 459 – 466.
8. Brandes AA, Vastola F, Basso U et al. A prospective study on glioblastoma in elderly. Cancer 2003; 97(3): 657 – 662.
9. Nečesalová E, Kuglík P, Cejpek P et al. Studium polyzomie chromozomu 7, monozomie chromozomu 10, amplifikace genu EGFR a delece genu p53 u multiformního glioblastomu pomocí metody fluorescenční in situ hybridizace (FISH). Klin Onkol 2006; 19(1): 9 – 14.
10. Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med 1971; 285(21): 1182 – 1186.
11. Jain RK. Normalizing tumor vasculature with anti‑angiogenic therapy : a new paradigm for combination therapy. Nat Med 2001; 7(9): 987 – 989.
12. Glass J, Gruber LM, Nirenberg A. Phase II trial of the antiangiogenic agent thalidomide in patients with recurrent high‑grade gliomas. ASCO Proceedings. J Clin Oncol 1999; 18 (Suppl): 144.
13. Pope WB, Lai A, Nghiemphu P et al. MRI in patients with high‑grade gliomas treated with bevacizumab and chemotherapy. Neurology 2006; 66 : 1258 – 1260.
14. Chen W, Delaloye S, Silverman DH et al. Predicting treatment response of malignant gliomas to bevacizumab and irinotecan by imaging proliferation with [18F] fluorothymidine positron emission tomography: A pilot study. J Clin Oncol 2007; 25 : 4714 – 4721.
15. Vredenburgh JJ, Desjardins A, Herndon JE et al. Bevacizumab plus irinotecan in recurrent glioblastoma multiforme. J Clin Oncol 2007; 25(30): 4722 – 4729.
16. Friedman HS, Prados MD, Wen PY et al. Bevacizumab Alone and in Combination With Irinotecan in Recurrent Glioblastoma. J Clin Oncol 2009; 27(28): 4733 – 4740.
17. Narayana A, Golfinos JG, Fisher I et al. Feasibility of using bevacizumab with radiation therapy and temozolomide in newly diagnosed high‑grade glioma. Int J Radiat Oncol Biol Phys 2008; 72 : 383 – 389.
18. Radiation Therapy Oncology Group 0825, American College of Radiology. Phase III double‑blind placebo ‑ controlled trial of conventional concurrent chemoradiation and adjuvant temozolomide plus bevacizumab versus conventional concurrent chemoradiation and adjuvant temozolomide in patients with newly diagnosed glioblastoma [online]. September 29, 2009. Cited 2010 – 01 – 20. Dostupné z http:/ / www.rtog.org/ members/ protocols/ 0825/ 0825.pdf.
19. De Groot JF, Wen PY, Lamborn K et al. Phase II single arm trial of aflibercept in patients with recurrent temozolomide‑resistant glioblastoma: NABTC 0601. American Society of Clinical Oncology 44th Annual Meeting, Chicago, IL, USA. May ‑ June 2008. Abstract 2020.
20. Batchelor TT, Duda DG, di Tomaso E et al. Phase II study of cediranib, an oral pan ‑ vascular endothelial growth factor receptor tyrosine kinase inhibitor, in patients with recurrent glioblastoma. J Clin Oncol 2010; 28(17): 2817 – 2823.
21. Neyns B, Sadones J, Joosens E et al. Stratified phase II trial of cetuximab in patients with recurrent high‑grade glioma. Ann Oncol 2009; 20(9): 1596 – 1603.
22. Rich JN, Reardon DA, Peery T et al. Phase II trial of gefitinib in recurrent glioblastoma. J Clin Oncol 2004; 22(1): 133 – 142.
23. Peereboom DM, Shepard DR, Ahluwalia MS et al. Phase II trial of erlotinib with temozolomide and radiation in patients with newly diagnosed glioblastoma multiforme. J Neurooncol 2010; 98(1): 93 – 99.
24. Chakravarti A, Seiferheld W, Tu X et al. Immunohistochemically determined total epidermal growth factor receptor levels not of prognostic value in newly diagnosed glioblastoma multiforme: report from the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 2005; 62(2): 318 – 327.
25. Wen PY, Yung WK, Lamborn KR et al. Phase I/ II study of imatinib mesylate for recurrent malignant gliomas: North American Brain Tumor Consortium Study 99 – 08. Clin Cancer Res 2006; 12(16): 4899 – 4907.
26. Van den Bent M, Brandes A, Frenay M et al. Multicentre phase II study of imatinib mesylate (Glivec®) in patients with recurrent anaplastic oligodendroglioma (AOD)/ mixed oligoastrocytoma (MOA) and anaplastic astrocytoma (AA)/ low grade astrocytoma (LGA): an EORTC New Drug Development Group (NDDG) and Brain Tumor Group (BTG) study. ASCO Meeting Abstract, J Clin Oncol 2005; 23 (Suppl): 1517.
27. Galanis E, Buckner JC, Maurer MJ et al. North Central Cancer Treatment Group. Phase II trial of temsirolimus (CCI ‑ 779) in recurrent glioblastoma multiforme: a North Central Cancer Treatment Group Study. J Clin Oncol 2005; 23(23): 5294 – 5304.
28. Nabors LB, Mikkelsen T, Rosenfeld SS et al. Phase I and correlative biology study of cilengitide in patients with recurrent malignant glioma. J Clin Oncol 2007; 25(13): 1651 – 1657.
29. Reardon DA, Fink KL, Mikkelsen T et al. Randomized phase II study of cilengitide: An integrin‑targeting arginine ‑ glycine ‑ aspartic acid peptide, in recurrent glioblastoma multiforme. J Clin Oncol 2008; 26(34): 5610 – 5617.
30. Chamberlain M. Cilengitide: Does it really represent a new targeted therapy for recurrent glioblastoma? J Clin Oncol 2009; 27(11): 1921.
31. Fine HA, Kim L, Royce C et al. Results from phase II trial of Enzastaurin (LY317615) in patients with recurrent high grade gliomas. 2005 ASCO Annual Meeting Proceedings. J Clin Oncol 2005; 23 (Suppl 16): 1504.
32. Wick W, Puduvalli VK, Chamberlain MC et al. Phase III study of enzastaurin compared with lomustine in the treatment of recurrent intracranial glioblastoma. J Clin Oncol 2010; 28(7): 1168 – 1174.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2010 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Nové možnosti léčby glioblastoma multiforme
- Genetické testování a prevence hereditárních nádorů v MOÚ – více než desetiletá zkušenost
- Akútna myeloblastová leukémia s alteráciami MLL protoonkogénu (11q23/ MLL+ AML)
- Aktuálne problémy štruktúry a orientácie komplexných národných programov boja proti zhubným nádorom
- Problematika originálních léčiv, generických přípravků a biosimilars – záměny léků dnes a zítra s hlavním zacílením na rizika spojená s biotechnologiemi
- Hodnocení neoadjuvantní chemoradioterapie u lokálně pokročilého karcinomu rekta srovnáním objemu tumoru před léčbou a po léčbě
- Hormonálna antikoncepcia a jej vzťah k rakovine prsníka
- Pooperačná akcelerovaná parciálna rádioterapia karcinómu prsníka
- Analýza nákladů na cílenou biologickou léčbu pacientů s metastatickým karcinomem ledviny
- Maligní forma cystosarcoma phyllodes s metastázami do mozku
- Inflamatórne kožné metastázy ako prvý prejav progresie karcinómu pľúc – kazuistika
- Variabilita dávek melfalanu vztažených na kilogram tělesné hmotnosti a následky
- Zápis ze schůze výboru České onkologické společnosti dne 26. 10. 2010 ve FN Bulovka Praha
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nové možnosti léčby glioblastoma multiforme
- Hormonálna antikoncepcia a jej vzťah k rakovine prsníka
- Akútna myeloblastová leukémia s alteráciami MLL protoonkogénu (11q23/ MLL+ AML)
- Pooperačná akcelerovaná parciálna rádioterapia karcinómu prsníka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




![Toxicita léčby [17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/53df6be62b26bfe0a84a81c43989aa70.jpeg)