-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Analýza přežití tříletého sledování nemocných s rakovinou hlavy a krku
Survival Analysis Three-year Follow-up of Pacients with Head and Neck Cancer
Background:
Patients with head and neck cancer are predominantnly at the risk for malnutrition. Monitoring of nutritional status and pre-treatment variables can favorably observe many prognostic indicators for overall survival in head and neck cancer before and during oncological treatment up to three years in head and neck cancer pacients.Materials and Methods:
In 726 patients diagnosed head and neck cancer patients with curative intent, were collected data according to the monitoring scheme of observation. As a clinical important of uninteded weight loss was defined weight loss ≥ 10% in input (T0). Differences in groups were analysed by Cox’s regression with adjustments for important demografic and tumor-related data.Results:
The acceptanceof the percutaneous endoscopic gastrostomy was a key factorfor less complications andto improvetoleranceof anticancer treatment. Men-smokers have the highestrisk of cardiovascular mortality. Men-stop-smokers have the most significant life extension of 11 to 22 months; p < 0.007. Men-non-smokers have a life extension of 15 to 23 months (p < 0.005) and having its lowest cardiovascular mortality (11%). Women tolerate cancer better, have minor subjective complaints and a lower number of complications but significantly higher consumption of antidepressants (p < 0.003). While men have higher analgesic consumption (p < 0.001). Weight loss > 10% significantly correlates with the clinical manifestations of malnutrition and isassociated with an increasein complications and mortality dependent cancer (p < 0.008).Conclusion:
Consistent assessment of nutritional status with early interventionis considered as an essential part of comprehensive anticancer treatment. An independent risk factor for cancer-dependent mortality is considered weight loss of > 5% with a BMI < 21 at time T0 or weight loss > 10% weight T0 in BMI 21 – 29 and continuing weight loss toT12 and also BMI ≥ 30. The highest-risk profile has a male sex-smoker, age > 63, hypopharyngeal carcinoma, stage III – IV, weight loss of > 10% and non-acceptance of percutaneous endoscopic gastrostomy. Another long-term observation of monitored nutritional status with intervention, clinical status and quality of life are needed.Key words:
survival analysis – head and neck cancer – HNC – malnutrition – weight loss
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
17. 7. 2015Accepted:
20. 9. 2015
Autori: E. Malá 1; E. Vejražková 2; M. Vošmik 3
; J. Novosad 1; L. Sobotka 4
Pôsobisko autorov: Ústav klinické imunologie a alergologie, FN Hradec Králové 1; IV. interní hematologická klinika LF UK a FN Hradec Králové 2; Klinika onkologie a radioterapie LF UK a FN Hradec Králové 3; III. interní gerontometabolická klinika LF UK a FN Hradec Králové 4
Vyšlo v časopise: Klin Onkol 2016; 29(1): 39-51
Kategória: Původní práce
doi: https://doi.org/10.14735/amko201639Súhrn
Východiska:
Pacienti s rakovinou hlavy a krku jsou vysoce rizikoví pro rozvoj malnutrice. Dlouhodobé sledování nutričního stavu usnadnilo definovat řadu prognostických ukazatelů pro celkové přežití s možností hodnotit efekt nutriční intervence v dlouhodobém horizontu, lze sledovat vztahy předem definovaných veličin před léčbou, v jejím průběhu a po ní v rozmezí tří let.Materiál a metody:
Soubor 726 nemocných s rakovinou hlavy a krku v léčebném záměru byl sledován po dobu tří let podle stanoveného schématu. Jako klinicky významný jsme stanovili pokles hmotnosti ≥ 10 % v čase vstupu do sledování. Rozdíly a statisticky signifikantní proměnné ve vztahu k přežití (demografická i onkologická data) jsme analyzovali Coxovou regresí.Výsledky:
Akceptování zavedení perkutánní endoskopické gastroskopie je zásadním faktorem pro průběh s nižším počtem komplikací, pro zlepšení tolerance onkologické léčby i přežití. V analýze přežití lépe profitují muži. Muži kuřáci vykazují nejvyšší kardiovaskulární mortalitu. Muži stopkuřáci mají nejvýznamnější prodloužení života z 11 na 22 měsíců; p < 0,007. Muži nekuřáci mají prodloužení života z 15 na 23 měsíců (p < 0,005) a mají nejnižší kardiovaskulární mortalitu (11 %). Ženy nádorové onemocnění tolerují s menšími subjektivními obtížemi, mají nižší počet komplikací, ale i signifikantně vyšší spotřebu antidepresiv (p < 0,003), zatímco muži zase vyšší spotřebu analgetik (p < 0,001). Úbytek hmotnosti > 10 % významně koreluje s klinickými projevy malnutrice a je spojen s nárůstem mortality závislé na rakovině i komplikacích (p < 0,008).Závěr:
Důsledné a pečlivé hodnocení nutričního stavu s včasnou intervencí považujeme za esenciální součást komplexní onkologické péče. Za nezávislý rizikový faktor mortality závislé na rakovině považujeme úbytek hmotnosti > 5 % při BMI < 21 v čase T0 nebo úbytek hmotnosti > 10 % hmotnosti v T0 při BMI 21 – 29 či pokračující úbytek hmotnosti do T12 a dále i BMI ≥ 30. Nejrizikovější profil je mužské pohlaví – kuřák, věk > 63, hypofaryngeální karcinom, stadium III – IV, ztráta hmotnosti > 10 % a neakceptování perkutánní endoskopické gastroskopie. Je třeba více dlouhodobých sledování pro zlepšení klinické praxe.Klíčová slova:
analýza přežití – rakovina hlavy a krku – HNC – malnutrice – hmotnostní úbytekÚvod
ČR patří mezi státy s nejvyšší incidencí onkologických onemocnění [1] v Evropě i v celosvětovém měřítku [2]. Mezi nejčastější nádory v ČR patří kolorektální karcinom, rakovina prsu, plic a prostaty [3,4]. Rakovina hlavy a krku (head and neck cancer – HNC) je na 6. místě v celosvětovém měřítku, v zemích Evropská unie je HNC na 4. místě nejčastějších nádorů u mužů. V ČR se incidence HNC pohybuje kolem 2,6 % u mužů a 0,7 % u žen. Toto onemocnění v ČR, společně s Chorvatskem, Polskem a Ruskem vykazuje nejvyšší mortalitu v Evropě [4]. Mezi hlavní příčiny vzestupu incidence nádorových onemocnění [1] v posledních desetiletích patří demografické stárnutí populace [2], životní styl, chronický stres, nevhodný stravovací režim a rizikové chování (abúzus alkoholu, kouření) [1], obezita, chronické prozánětlivé stavy, imunosupresivní léčba a mnoho dalších činitelů, které se nekompromisně uplatňují v interakci organizmu a protinádorové obrany v komplikované patogenezi rakoviny. Prognostické faktory zahrnují lokalizaci nádoru, grading, staging (stadium nemoci) a celkový zdravotní stav [5]. Je nepochybná souvislost mezi stadiem onemocnění, přítomností příznivých prognostických faktorů a nepřítomností znaků nádorové kachexie a malnutrice. Pacienti s HNC jsou ve vysokém riziku malnutrice již v době stanovení diagnózy onkologického onemocnění. Razantní onkologická léčba s neodkladnou a důslednou nutriční intervencí [6 – 9] zlepšuje naději na přežití napříč všemi stadii HNC. Nemocní s HNC ve stadiu I – II [10] mají šanci na přežití pět let kolem 65 %, naopak u pokročilých nádorů (stadium III a IV) nedosahuje pětileté přežití 25 % [10]. Ke zlepšení prognózy došlo v posledních 10 letech u nádorů dutiny ústní, jazyka, tonzil a nosohltanu. Sekundární nádory HNC se vyskytují u 40 % nemocných. Nejvyšší podíl v této skupině představují kuřáci, kteří nepřestali kouřit. Většina recidiv onemocnění se objevuje do dvou let od začátku léčby. Prognóza je zhoršována četnými přidruženými chorobami, jejichž výskyt je v naší populaci také velmi vysoký a významně narůstá s každou dekádou věku nad 60 let (kardiovaskulární onemocnění).
Mezi nejzávažnější projevy nádorového onemocnění patří nádorová kachexie. Její přítomnost přímo ovlivňuje nejen prognózu, ale i další faktory (tolerance k onkologické léčbě, komplikace spojené s nádorovým onemocněním i komplikace plynoucí z komorbidit nemocného). Nádorová kachexie je multifaktoriální syndrom charakterizovaný progresivní ztrátou tělesné hmotnosti (weight loss – WL), doprovázený anorexií. Vzniká interakcí nádorového fenotypu a hostitele. V závislosti na typu nádoru nacházíme WL u 30 – 90 % nemocných. V čase stanovení diagnózy HNC má min. 25 % nemocných WL přesahující 10 % [11]. Nejvyšší WL doprovází karcinomy pankreatu, rakovinu žaludku, žlučníku a plic, vč. nemocných v pokročilejších stadiích HNC. WL je spojen s malnutricí. Společně jsou považovány za závažné nepříznivé prognostické faktory. Obecně lze konstatovat nepřímo úměrnou závislost mezi mírou neočekávaného WL a přežitím. Čím vyšší je neočekávaná WL, tím kratší je přežití nemocného. Ztráta tukové tkáně a devastace kosterní svalové hmoty nemocného ohrožuje závažnými zdravotními komplikacemi, rychle klesá fyzická výkonnost, soběstačnost, zhoršuje se mobilita nemocného, psychický stav s odpovídajícími sociálními konsekvencemi, klesá obranyschopnost organizmu v buněčné i humorální složce. Pokles svalové síly dýchacích svalů je spojen s vysokým rizikem úmrtí z důvodu respiračních infekcí. Zde dominuje problematika zejména hypostatické pneumonie s respiračním selháním postihující 15 – 48 % onkologických nemocných. CACS (cancer-anorexia-cachexia syndrom) je charakterizovaný snížením příjmu potravy, energeticky neefektivním metabolizmem (futilní cykly), kdy jsou energetické nároky plněny katabolickým metabolizmem devastujícím svalovou hmotu s dalším poklesem hmotnosti [12,13]. Mechanizmus CACS je složitý a dosud není dostatečně přesně objasněn [12,14]. Deficitní energetická bilance v rámci futilních cyklů vede k hromadění laktátu. Jeho hladina u nádorového onemocnění pozitivně koreluje s pravděpodobností metastáz i recidivami nádorového onemocnění, naopak negativně koreluje s přežitím. Význam klinické výživy tkví ve stabilizaci energetického obratu nemocného zvýšením dodávky zdrojů energie i nutričních substrátů, které zpomalují devastaci vlastní svalové hmoty (zdroj bílkovin a energie) a zpomalují progresi preexistujícího WL [15,16]. Sondová (i jiná) náhrada energie a nutričních substrátů je nenahraditelným režimem, pokud jedinec není schopen přijímat běžnou potravu. Zajistí překlenutí kritického období disability perorálního příjmu a napomáhá předcházet následkům nádorové kachexie i nežádoucích účinků onkologické léčby. Režim nutriční podpory je třeba nahlížet jako kompaktní, nezbytnou a žádoucí součást onkologické léčby. Příjem potravy je složitý, mnohaetážový proces zprostředkovaný koordinací centrální a periferní regulace neuropeptidových drah hormonálního charakteru. Fyziologickou regulační úlohu v příjmu potravy a chuti k jídlu, stejně jako v podmínkách anorexie/ kachexie, má hypothalamus. V hypothalamickém nucleu arcuatu dochází k integraci periferních signálů, zpracování informací a tvorbě efektorových signálů. Signály rozlišujeme na ty, které zvyšují chuť k jídlu a příjmu energie (ghrelin) – označujeme je jako orexigenní (neuropeptid Y, endogenní opioidy, glutamát, kyselina gama-aminomáselná), a na antiorexigenní signály inhibující příjem energie, tzn., že stimulují pocit sytosti a brání perorálnímu příjmu. Řadíme mezi ně leptin, CRH (corticotropin releasing hormon), GLP-1 (glukagon-like-peptid 1), melanokortin, kokain, amfetamin, oxytocin a cholecystokinin. U pacientů s nádorovým onemocněním byly opakovaně prokázány cytokiny produkované nádorem, které simulují účinky leptinu a potlačují orexigenní účinky ghrelinu nebo neuropeptidu Y (NPY) [12,17]. Proces WL a anorexie se v nádorovém onemocnění komplikuje nejen působky nádoru, ale i nežádoucími účinky protinádorové terapie. Výsledkem těchto faktorů je multifaktoriální anorexie perzistující inhibice orexigenní sítě. S nárůstem kontraregulačních anorexigenních neuropeptidů přetrvává i přes adekvátní reakci z periferních signálů (tj. zvýšení ghrelinu a poklesem hladiny leptinu) v důsledku kompenzačních metabolických regulačních mechanizmů.
Kromě účinků komplexu nádor-nádorová tkáň vs. hostitel a následků protinádorové terapie svůj podíl v poklesu příjmu potravy a potenciaci anorexie mají dále závažné senzorické změny – změny chuti, nárůst oflaktorických poruch vnímání vůní a pachů až do možných pseudohalucinačních fobií spojených s příjmem nebo vnímáním potravy [18 – 23]. Zejména změny vnímání sladké a hořké potravy se významně akcentují. Nelze pominout ani anatomickou lokalizaci a rozsah nádorové masy, mukozitidu a další komplikace [24 – 26]. Zde spatřujeme zásadní místo účinku klinické výživy [18 – 23] společně s důslednou intervencí bolesti [12,27 – 33].
Soubor pacientů a metody
Do sledování jsme zahrnuli pacienty s HNC, kteří byli odesláni onkologem do nutriční ambulance ke zvážení nutriční intervence od ledna 2004 do prosince 2012. Každého z nemocných s HNC jsme sledovali po dobu tří let. Soubor pacientů (n = 726) jsme vzhledem k podstatě nutriční péče [34] rozdělili do dvou skupin: první skupina byli nemocní, kteří akceptovali PEG (perkutánní endoskopická gastrostomie) [6,7,35 – 43] – skupina A, druhá skupina (B) PEG neakceptovala. Vstupním kritériem byla diagnóza HNC bez ohledu na stadium a onkologická léčba v léčebném (nikoliv paliativním) režimu. Jako vylučovací kritéria jsme stanovili recidivu onemocnění, paliativní péči a chybějící data ze sledování. Všichni účastníci podepsali informovaný souhlas. Pacienti byli po dobu trvání projektu v trvalé péči nutriční ambulance a docházeli na kontroly v pravidelných intervalech. V rámci nutriční intervence jsme respektovali osobní stravovací návyky pacientů, s ohledem na komorbidity nemocných (diabetes, hypercholesterolemie) a schopnost perorálního příjmu aktuálně a podle dalšího vývoje léčby nádorového onemocnění.
Obě skupiny nemocných (skupina As PEG a skupina B bez PEG) jsou srovnatelné rozložením typů nádorových onemocnění (mimo rakovinu jazyka, která má vyšší podíl ve skupině B). Srovnatelné jsou skupiny ve smyslu zastoupení stadií onkologického onemocnění i podíly užitých léčebných modalit v obou skupinách. Neprovedli jsme porovnání léčebných dávek radioterapie mezi skupinami, protože tato problematika je prioritou onkologické ambulance. Nemocní ve skupině s PEG (skupina A) byli zajištěni časnou enterální výživou, kterou jsme upravovali podle vývoje stavu. Nutriční podpora u nemocných bez PEG (skupina B) [44,45] byla vedena formou sippingu. Cílová energetická dávka v obou skupinách byla shodná – 12,5 MJ (3 000 kcal) [6 – 9,35,37].
Naše sledované parametry:
- Demografické údaje (pohlaví, věk, vzdělání, anamnéza kouření a pravidelné požívání alkoholu).
- Onkologická data (nádor dle TNM klasifikace – primární nádor, stadium a rozsah nádoru, modalita onkologické léčby).
- Subjektivní klinické symptomy (CSS, 1 – 16 bodů: dysfagie, ztráta chuti k jídlu, pocity plnosti, nevolnost, zvracení, obtíže se žvýkáním, obtíže při polykání, změna chuti, změna čichu, sucho v ústech, vazké/ husté sliny, bolesti v ústech, úbytek energie, úzkosti, bolest, nespavost).
Komorbidity nemocného byly zjištěny pomocí dotazníku CCI (Charlson comorbidity index) [46,47]. CCI hodnotí počet dalších nemocí (komorbidit) provázejících aktuální léčené onemocnění. Jedná se o index s predikcí úmrtí v horizontu 10 let. Každá z nemocí má stanovený počet bodů, které se vzájemně sčítají, a podle výsledku se určuje celkové skóre. Cíleně se šetří přítomnost následujících komorbidit: infarkt myokardu, městnavé srdeční selhání, onemocnění periferních cév, demence, cerebrovaskulární onemocnění, onemocnění pojivové tkáně, vředová choroba, chronické onemocnění jater, diabetes mellitus, přítomnost postižení ledvin, nádorová onemocnění (lymfom, leukemie, nádor, přítomnost metastáz), AIDS. CCI se udává počtem bodů získaných skórovaním přítomných komorbidit; čím je vyšší, tím je vyšší i nemocnost.
Dále jsme hodnotili KP (Karnofsky performance status score) [48] pro hodnocení aktuálního klinického stavu a míry funkčního postižení (údaje jsou v procentech). KPS umožňuje objektivizovat stupeň funkčního poškození a fyzické zdatnosti. Udáván je v procentech od 0 (smrt) do 100 (plná zdatnost).
Z pohledu nutričního hodnocení jsme hodnotili:
- Hmotnost byla měřena na váze zn. Lindeltronic 8000m při všech měřeních.
- BMI (body mass index) [49] byl vypočten jako hmotnost v kg/ výška v m2.
- WL (v %) vyjadřuje neočekávaný pokles hmotnosti z obvyklé tělesné hmotnosti v posledních šesti měsících. Metodologie nutričního screeningu byla realizována podle doporučení ESPEN (European Society for Parenteral and Enteral Nutrition) [6 – 9,35,37].
Měření kvality života (quality of life – QOL) [50 – 53] jsme prováděli pomocí standardizovaných dotazníků EORTC QOL C-30 (European Organisation for Research and Treatment of Cancer, quality of life) [52,54 – 58], byly použity dva moduly: Core-30 [54,58] a HN35 (Head and Neck modul) [59 – 61]. Pro přehlednost dále budeme užívat pro označení zkratky EORTC QOL pouze mezinárodně užívanou zkratku QOL s označením příslušného užitého modulu (C-30 nebo HN35).
Dotazník QOL C-30 slouží ke zjišťování obecného zdravotního, psychického, emocionálního a sociálního stavu nemocného. Dotazník QOL HN35 zohledňuje specifickou problematiku nádorového onemocnění v oblasti hlavy a krku.
Sledování jsme provedli s následujícím schématem:
- vstup pacienta T0,
- kontrola za 6 měsíců T6,
- kontrola po 12 měsících od vstupu nemocného T12,
- kontrola za 24 měsíců T24,
- kontrola za 36 měsíců od vstupu nemocného do sledování T36.
Statistika
Ve sledování se smíšeným designem jsme provedli analýzu přežití ve vztahu ke sledovaným parametrům (PEG vs. skupina nemocných bez PEG, pohlaví a kuřáctví). Opakovaná měření u jednotlivých subjektů byla realizována s cílem zhodnotit chování jednotlivých závisle proměnných v čase s ohledem na nezávislé faktory (PEG) a dále popsat míru vlivu těchto faktorů na přežití nemocných a mortalitu pacientů. Hlavními výstupy jsou statistické modely, které popisují chování jednotlivých proměnných za daných okolností a mohou tak v rámci definované pravděpodobnosti umožnit extrapolaci výstupů na celou populaci pacientů.
Statistické analytické metody byly:
- smíšená faktoriální ANOVA konceptualizovaná spolu s mnohočetnou regresí do obecného lineárního modelu pro opakovaná měření (general linear model for repeated measures – GLM) s odhadem parametrů metodou nejmenších čtverců,
- multivariantní analýza rozptylu (MANOVA),
- smíšený model (mixed model) s odhadem parametrů metodou maximální věrohodnosti (maximum likelihood),
- analýza přežití Kaplan-Meierovým algoritmem,
- Coxova regrese.
Deskriptivní statistika byla použita k popisu charakteristik proměnných, kontinuální proměnné jsou prezentovány jako průměr/ směrodatná odchylka nebo medián/ interkvartilové rozpětí. Kategoriální proměnné jsou prezentovány jako četnosti. Pro srovnání mezi dvěma skupinami kontinuální proměnné byl použit Studentův t-test. Konfigurace kategoriálních dat byly analyzovány pomocí chí-kvadrátu (χ2 test). Analýza přežití byla provedena pomocí Kaplan-Meierova algoritmu a Coxovou regresí definující poměr rizika (HR) odlišných faktorů, doplněného o 95% CI. Opakovaná měření byla ošetřena pomocí smíšené faktoriální ANOVY (GLM) s příslušnými korekcemi dle Greenhouse a Geissera. U nezávislých měření byly aplikovány post hoc testy dle Bonferroniho a Games-Howella. Analýzu přežití jsme hodnotili podle sledovaných parametrů. Všechny výsledky testů považujeme za statisticky významné při p ≤ 0,05. Statistické analýzy byly provedeny s použitím produktu IBM SPSS Statistics software (verze 22).
Výsledky
Popis souboru
Celkový počet nemocných je 726, s průměrným věkem 62 ± 7 let. Muži měli průměrný věk 62 let, ženy 64 let (p < 0,02). Celkový počet kuřáků v čase vstupu do sledování (T0) byl 453 (62 %), z toho 307 mužů a 146 žen. V průběhu sledování dochází k významnému poklesu počtu kuřáků na 33 % nemocných. Nejčastější rakovinou v našem souboru byl hypofaryngeální karcinom (26 %) – přehled v tab. 1. Nejvyšší průměrný věk měli nemocní s rakovinou mandlí (66 let), nejnižší věk měli nemocní s karcinomem jazyka (55 let). Nejčastějším stadiem tumoru u nemocných bylo stadium II (344 pacientů, 48 %). Celkem 190 nemocných (26 %) mělo pokročilé stadium III a IV (tab. 2). K progresi nádorového onemocnění došlo u 19 % pacientů (nejčastěji ze stadia II do III). V obou sledovaných skupinách jsme nenalezli statisticky významný rozdíl v podílu nemocných, u kterých došlo k progresi onemocnění. Naopak nemocní ve skupině A (s PEG) častěji nezaznamenali recidivu onemocnění (p < 0,05). Radioterapií bylo léčeno celkem 523 nemocných (72 %), chemoterapií 7 nemocných (1 %). Modalitu onkologické léčby jsme plně akceptovali podle indikace onkologa. V analýze přežití nemocných jsme zohlednili dominantní zájem nutriční ambulance a provedli srovnání předem stanovených parametrů u nemocných ve skupině s PEG (skupina A) a nemocných bez PEG (skupina B) v čase (T0) a s vývojem v čase.
Tab. 1. Demografická data pacientů a vstupní proměnné v T0. 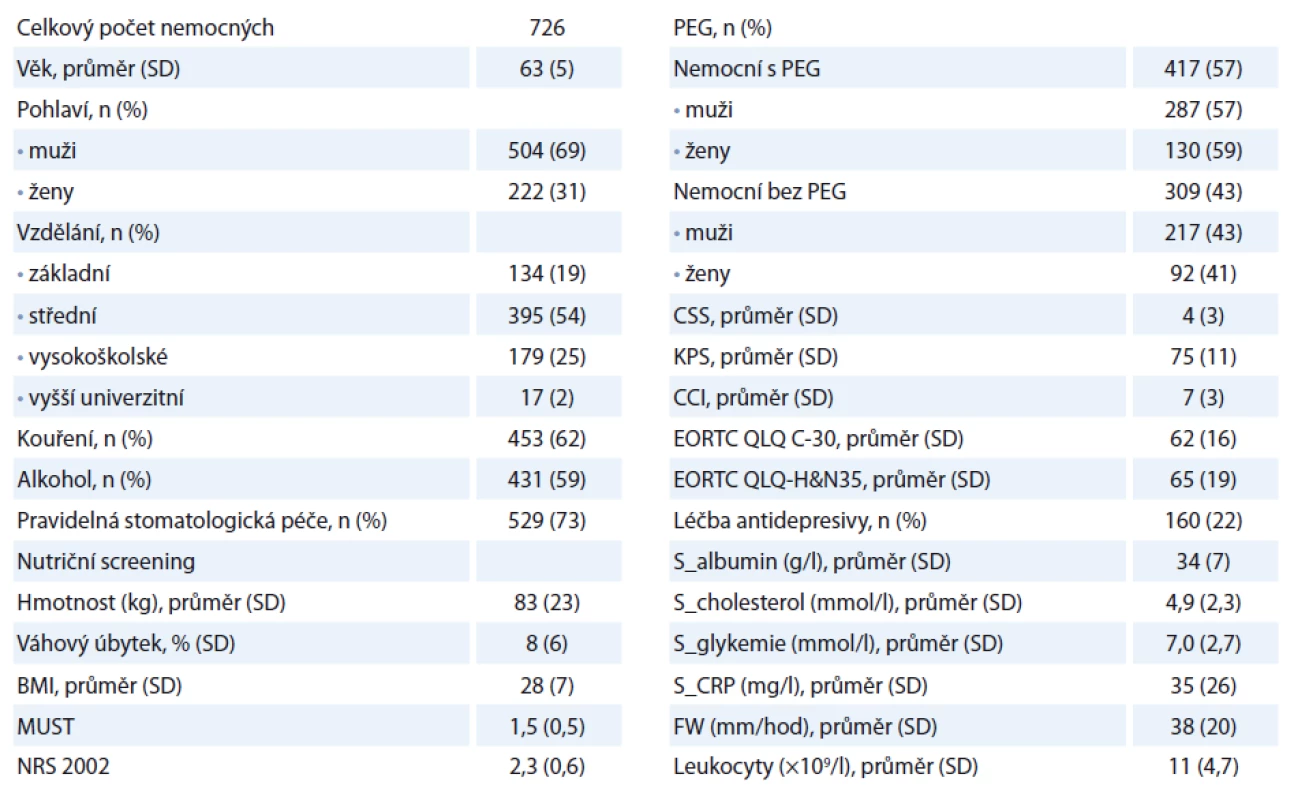
CSS – Klinické symptom skóre, KPS – Karnofsky performance status skóre, CCI – Charlson comorbidity index, MUST – Malnutrition Universal Tool Test, NRS – Nutritional Risk Screening Tab. 2. Zastoupení jednotlivých stadií tumoru v čase vstupu do sledování. 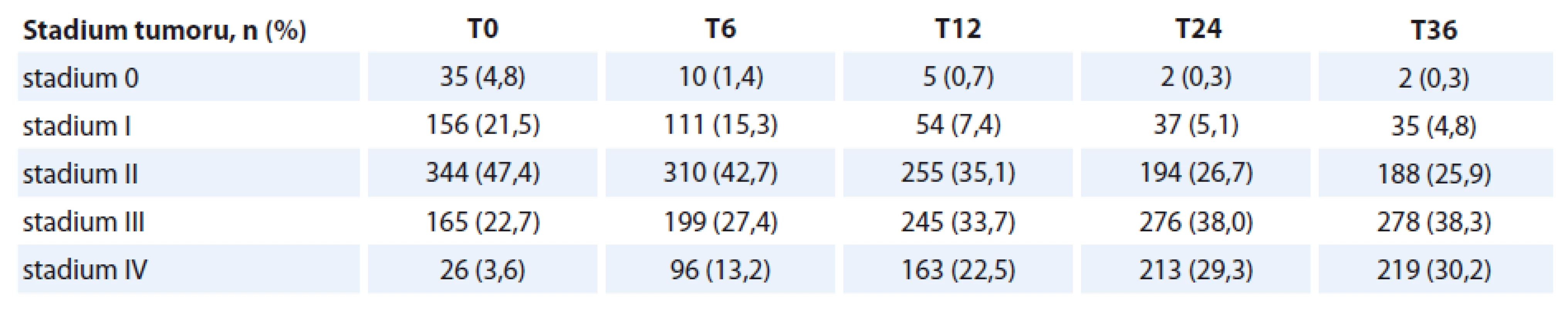
Analýza přežití v rámci studie byla provedena pomocí Kaplan-Meierova algoritmu určeného k opakovaným měřením. K definici odhadu průměru (přesnou hodnotu logicky nelze stanovit, protože neznáme maximální dobu přežití) a medián přežití (tj. dobu, za kterou 50 % pacientů zemře) celkově či v rámci jednotlivých sledovaných podskupin. Významnost v rozdílu přežití je hodnocena testem chí-kvadrát (modifikace log-rank).
1. Obecnou závislost přežití při zohlednění všech příčin úmrtí (nejen úmrtí na nádorové onemocnění) se srovnáním mezi skupinami A a B (bez PEG) na počátku léčby (T0) znázorňuje graf 1. Lze konstatovat, že včasné zavedení PEG prodlužuje medián přežití pacientů ve sledování z 11 měsíců na 23 měsíců (na hladině významnosti p < 0,001). Zásadním efektem zavedené nutriční intervence formou PEG je zajištění zcela stabilizovaného nutričního i energetického příjmu v dlouhodobém horizontu. Hlavním profitem je ukončení dalšího prohlubování WL, časnější stabilizace hmotnosti a BMI (už od kontroly T6) na rozdíl od skupiny B. Srovnání mezi skupinou A (s PEG) a B (bez PEG) pochopitelně prokazuje odlišný vývoj všech sledovaných markerů nutričního stavu a i dalších parametrů (QOL, KPS) – viz dále. Ve skupině A (s PEG) jsme prokázali statisticky významně lepší toleranci k onkologické léčbě, nižší počet případů vynuceného přerušení onkologické léčby, nižší počet komplikací (infekce horních a dolních cest dýchacích), menší klinické symptom score (CSS, tzn. méně klinických problémů v souvislosti s nádorovým onemocněním a jeho léčbou), lepší KSP (stav fyzické výkonnosti), kratší trvání projevů mukozitidy, která vylučovala perorální příjem (srovnání je ale pouze na hranici statistické významnosti mezi oběma skupinami). Dalšími profity byla nižší potřeba rehospitalizací z důvodu komplikací zdravotního stavu. Pokud nastala ve skupině A (s PEG) v čase kontrol T0 – T24 potřeba hospitalizace, pak byla délka pobytu v nemocnici u 76 % nemocných do 10 dnů/ rok. Naopak ve skupině B (bez PEG) byla délka pobytu v nemocnici ve stejném období delší než 21 dnů/ rok u 61 % nemocných. Zmíněná zlepšení vývoje nemoci v čase výraznou intervencí nutričních parametrů (zajištěním PEG) nepochybně významně participují na ovlivnění délky mediánu přežití a odpovídají dynamicky výsledkům, které mají příčinnou vazbu na nutriční zajištění a příznivé okolnosti plynoucí ze stabilizace devastace vlastní kosterní svaloviny.
Graf 1. Závislost přežití na zavedení PEG v T0. 
2. Analýza přežití se zohledněním skupiny A (s PEG) a B (bez PEG) a kritériem kuřáctví v čase T0. Prodloužení přežití pozorujeme ve skupině A u nemocných, kteří v čase T0 byli kuřáky, ale kouřit přestali (z 11 měsíců na 22 měsíců; p < 0,007) (graf 2). Nejvýznamnější prodloužení přežití jsme nalezli u nekuřáků ve skupině A v čase T0 (graf 3), z 15 na 23 měsíců (p < 0,05). Vysvětlením pro tento jev není pouze zavedení PEG, ale i další komorbidity pacientů, životní styl a fyzická kondice nemocných. Nicméně prodloužení přežití je významné i u kuřáků ve skupině B (bez PEG).
Graf 2. Analýza přežití podle PEG u kuřáků. 
Graf 3. Analýza přežití podle PEG u nekuřáků. 
3. Analýza přežití mezi skupinami A a B z hlediska srovnání pohlaví. Lze říci, že zavedení PEG prodlužuje medián přežití u žen i u mužů. Podle výsledků je patrné, že u mužů významněji (p < 0,02). Avšak nutno vzít v potaz, že muži v našem sledování přežívají celkově méně (mají vyšší vstupní počet komorbidit dle CCI a vyšší kardiovaskulární mortalitu při vyšší incidenci diabetu mellitu II. typu a hypercholesterolemie, jsou častějšími kuřáky, přestože mají nižší vstupní věk, kdy se manifestovalo onkologické onemocnění). V případě mužského pohlaví ve skupině A lze považovat PEG nejen za nástroj k nutričnímu zajištění, ale současně i jako pozitivní intervenční faktor, který statisticky významně ovlivňuje nejen nutriční stav nemocných, ale i metabolicky determinované komorbidity (hyperglykemie, hypercholesterolemie) a takto příznivě přispívá k ovlivnění rozvoje komplikací stávajících komorbidit s přežitím (graf 4) ve srovnání s muži ve skupině B (bez PEG) (p < 0,02) (tab. 3). Ženy přežívají celkově déle (p < 0,02) (graf 5), a to i přes srovnatelné zastoupení typů nádorů, jejich stadií. Ženy mají vyšší věk v době stanovení diagnózy a jsou převážně nekuřačkami. Ženy onkologickou léčbu tolerují lépe, s nižším výskytem CSS (klinické symptom skóre) a lepším udržením fyzické kondice a výkonnosti (KPS), přestože vstupní WL je vyšší a je v této skupině i vyšší zastoupení žen s BMI < 21. Ve skupině A dochází k rychlejší stabilizaci hmotnosti s trendem vzestupu, který (přestože je vyšší než u mužů) není (na rozdíl od mužů) zcela setrvalý až do T12. Konstantní vzestup hmotnosti jsme nalezli do T12 pouze u 42 % žen vs. 59 % mužů. Od kontroly v čase T24 se rozdíly eliminují, přestože BMI (pochopitelně) zůstává nadále nižší než u mužů.
Graf 4. Analýza přežití dle PEG u mužů. 
Graf 5. Analýza přežití dle PEG u žen. 
Tab. 3. Tabulka přežití – hodnotícím kritériem je zavedení PEG v T0 dle pohlaví. 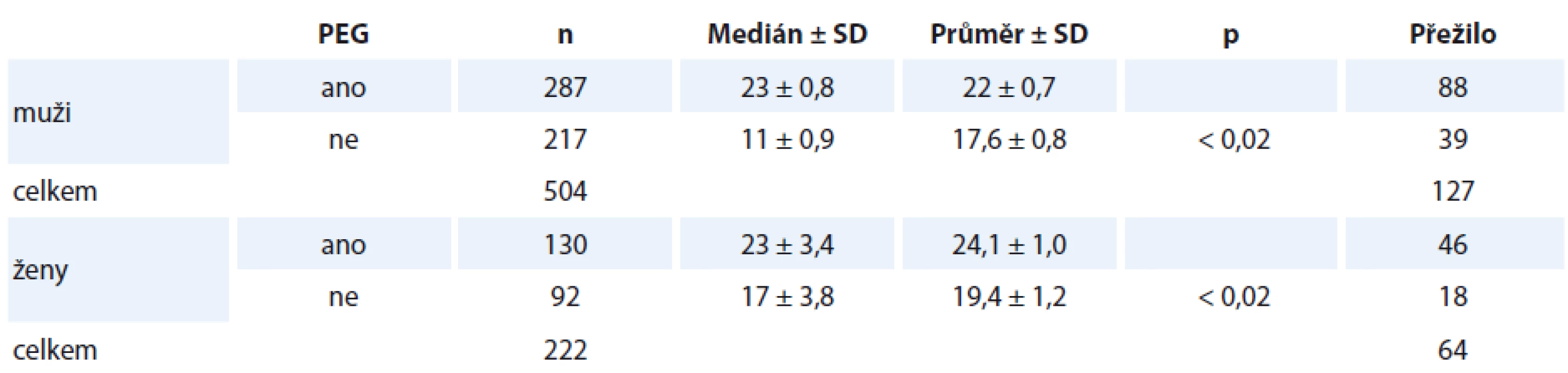
4. Analýza – přežití nemocných ve skupině A a B podle míry WL v čase T0. Jednotlivé kategorie WL v čase T0 jsme rozdělili v tab. 4. a definujeme ji jako neočekávaný WL za posledních šest měsíců před stanovením diagnózy HNC. Nejvýraznější prodloužení mediánu přežití jsme nalezli ve skupině A u všech kategorií skupin WL. Proto vstupní neočekávaný WL považujeme za jeden z nejvýznamnějších faktorů zvyšujících riziko úmrtí. Přesné stanovení („cut-off“ hodnotu) jsme ale nestanovili z důvodu množství zohledňovaných faktorů. Lze přesto říci, že WL napříč skupinou nemocných, který je < 10 %, zvyšuje riziko obecného úmrtí „jen“ 1,3krát (ve všech skupinách bez zohlednění pohlaví, stadia nádoru...). Neočekávaný WL ≥ 10 – 14 % zvyšuje nediferencované riziko úmrtí 2,7krát. WL ≥ 15 % zvyšuje riziko úmrtí 3,6krát. Z pohledu dlouhodobého nutričního sledování lze považovat za významný i trend vývoje hmotnosti během dalšího sledování. Prokázali jsme těsnou souvislost s vývojem komplikací (infekce, sepse, rehospitalizace, tolerance onkologické léčby a nutnost jejího přerušení). Konstatujeme statisticky významné odlišnosti mezi skupinou A (s PEG) a B (bez PEG). Vývoj hmotnosti: stagnace či pokračující WL jsou významným faktorem promortalitního rizika a mají potenciál predikovat riziko úmrtí. V tomto pohledu spatřujeme nezastupitelný význam nutriční ambulance.
Tab. 4. Přežití podle vstupního WL pacientů. 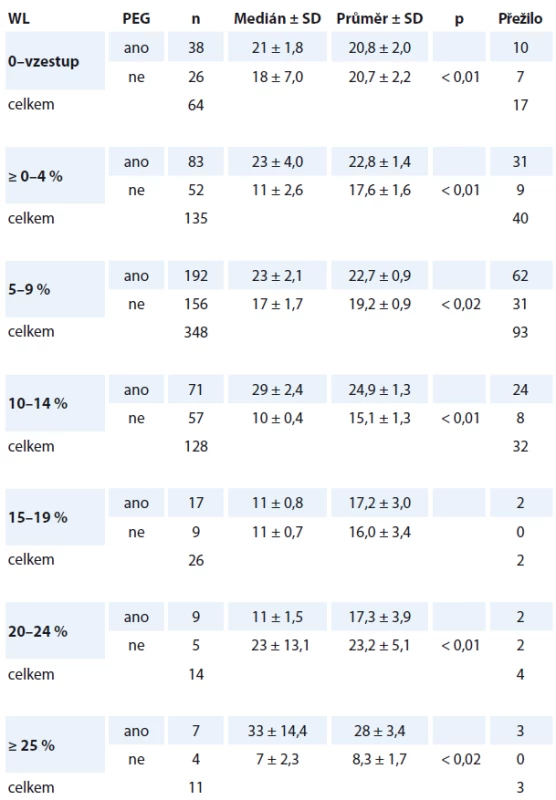
Coxova regrese umožňuje kvantifikovat míru vlivu nezávisle proměnné na nárůst/ pokles rizika výskytu sledovaného jevu v čase, hovoříme o tzv. HR (hazard ratio) – analogie OR (odds ratio) používané v logistické regresi. Jedná se o poměr rizika sledovaného jevu (úmrtí pacienta), pokud nastala/ nenastala nějaká situace (kouření/ nekouření). Uvedené výsledky lze shrnout následujícím způsobem: model jako takový sice není signifikantní (tj. popisuje skutečnost jen s relativně nízkou věrohodností), nicméně může nás upozornit na následující fakta:
Samo mužské pohlaví zvyšuje pravděpodobnost úmrtí pacienta ve studii až o 20,1 % (HR = 1,201). Anamnéza stopkuřáctví v čase T0 naopak pravděpodobnost úmrtí významně snižuje (HR = 0,786) až o 21 %! Je třeba upozornit, že podrobnější analýzou výsledků v čase T0 jsme nalezli další významné souvislosti s obdobným trendem i v následujících kontrolách. Od T6 se význam stopkuřáctví a rizika úmrtí snižuje, přesto ale trvá až do konce sledování, tzn., že HR stoupá nad 1,0 a trvá nárůst mortality u kuřáků, kteří od T0 (čas vstupu) nepřestali kouřit, zatímco stopkuřáctví v T6 (u původních kuřáků v T0) pravděpodobnost úmrtí setrvale snižuje až do konce sledování, v T6 je to až o 36 % (HR = 0,684). Pokud hodnotíme riziko úmrtí z pohledu vstupní hmotnosti, BMI, neočekávaného WL, pak lze říci, že v T0 pravděpodobnost úmrtí významně klesá při WL < 10 % (HR = 0,774) až o 28 % ve skupině A (srovnatelně u mužů i u žen) (graf 6).
Graf 6. Analýza rizika úmrtí dle WL. 
5. Odhad změny rizika úmrtí pouze v souvislosti se zavedením PEG: Obecně lze říci, že zavedení profylaktického PEG snižuje riziko jakéhokoli úmrtí pacientů bez ohledu na další faktory o 33,1 % (HR = 0,669, p < 0,001). Vysvětlení se nabízí několik, ale důvody jsou komplexnější, nikoliv izolované pouze na vazbu přítomného PEG u nemocných (stabilizace stavu, udržení a časnější stabilizace zdevastovaného nutričního stavu, prevence imunosuprese, zprostředkované těžké kachexie apod.). Do další analýzy Coxovy regrese byly použity jako proměnné přítomný PEG (skupina A), pohlaví, lokalizace a stadium nádoru – vždy v interakci s faktory kouření a přesnější subanalýzy mezipohlavní diference (tj. odpověď na otázku, zda stav nutrice v interakci s kouřením ovlivňuje přežití pacientů jinak u mužů a u žen). Pro výpočet byla použita metoda „forward stepwise“, tj. metoda, která vkládá do modelu pouze ty proměnné, které mají skutečně významný vliv na riziko úmrtí, a to v jednotlivých krocích. V našem sledování algoritmus vyhodnotil jako nejdůležitější příznivý faktor zavedení PEG (ve skupině A). Druhou nejvýznamnější proměnnou je faktor stopkuřáctví v T0. Analýza hodnotící význam hmotnosti, BMI a neočekávaného WL v čase T0 ve vztahu k nádor-specifické mortalitě (cancer-dependent mortality), dospěla k závažnému výstupu. Je patrné, že WL má přímý vztah k ovlivnění rizika úmrtí v obou skupinách (A i B). WL > 5 % ve skupině A (s PEG) je spojen s 2násobným zvýšením rizika u mužů a 1,9násobným u žen. Nejzávažnější vliv jsme nalezli ve skupině B u mužů kuřáků, kde je WL > 5 % spojen se zvýšením úmrtí 2,9krát. V subanalýze vlivu podle BMI je zajímavým nálezem i vazba zvýšení rizika mortality, která je závislá na rakovině u mužů s BMI ≥ 30 celkově o 3,7krát (tab. 5). Analýza rizika úmrtí s ohledem na hmotnost v čase T0 při současném BMI ≥ 30 odhalila velmi zajímavý závěr, který lze zobecnit tvrzením, že s každým vzestupem BMI o 5 (kg/ m2) v čase T0 roste riziko úmrtí pacienta o 23 % (HR = 1,201) u všech druhů mortalit, ale dominující je kardiovaskulární mortalita u mužů kuřáků ve skupině B. Výsledky korelují s analýzou počtu komorbidit, kterou jsme hodnotili CCI a KPS. Korelace odpovídá u 89 % nemocných. Ti, kteří zemřeli na kardiovaskulární příčinu, měli nejméně čtyři skórované komorbidity. Nemocní v této skupině, kteří zemřeli z důvodu onkologického onemocnění, měli CCI < 3 (4 %).
Tab. 5. Coxova regresní analýza mezi hodnotami WL během onkologické léčby a ve tříletém obecném a nádor-specifickém přežití. 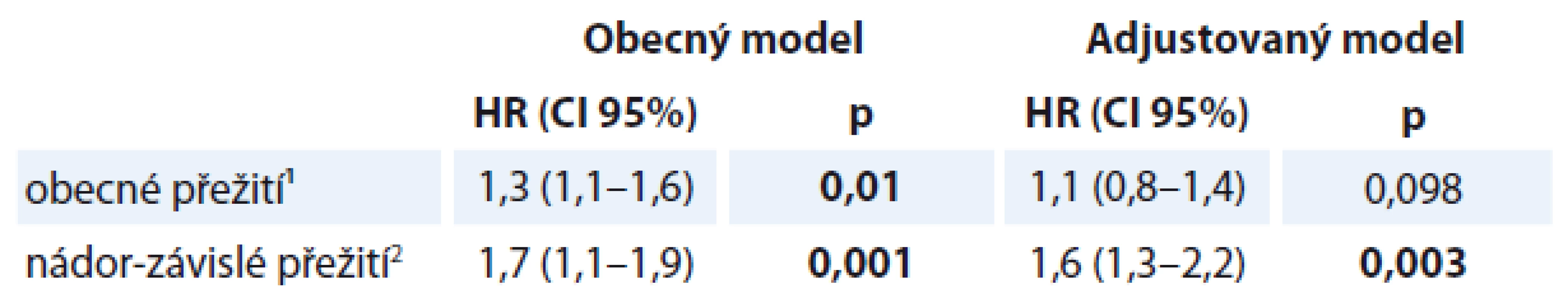
¹vstupní WL > 5 % ²adjustováno pro věk, pohlaví, lokalizaci nádoru, TNM klasifikaci, WL, BMI a léčebnou modalitu HR – hazard ratio, TNM – tumor-node-metastasis, p < 0,05 jsou zvýrazněny Diskuze
Dlouhodobé sledování nemocných cestou nutriční ambulance přineslo řadu podnětů ke zlepšení pozornosti v přístupu k onkologicky nemocným lidem a podle našich zkušeností pak zejména pacientům s HNC. Sledováním vývoje mnoha parametrů v čase (hmotnost, WL, BMI, komorbidity, fyzická kondice a QOL) v kontextu dalších souvisejících proměnných (přítomnost PEG, vývoj kuřáctví v čase, diskriminace souborů podle pohlaví) jsme získali rozsáhlou datovou matici s možností analyzovat složité a klinicky významné vztahy a vazby. Neočekávaný WL a pokles BMI jsou častými symptomy provázejícími většinu nemocných s nádorovým onemocněním. Přesto doposud chybí práce s dlouhodobým sledováním nutričních parametrů v čase s vazbou na konkrétní a definovanou nutriční intervenci, která probíhá v dlouhodobém horizontu. Za klíčové rozhodnutí považujeme doplnění metabolické léčby dlouhodobou dispenzární péčí s monitorováním QOL nemocných. Získané informace se staly podkladem pro cílenější a lepší intervenci obtíží nemocných. Díky užitým nástrojům, které byly časově nesmírně náročné, jsme získali nejen důležité aktuální subjektivní informace, ale současně i možnost sledovat jejich vývoj v čase. Zlepšila se komunikace mezi nemocným a konkrétním specialistou, zvýšila se vzájemná spolupráce i důvěra, zlepšilo se porozumění na obou stranách i komunikace s rodinami. Compliance nemocných byla vynikající. Nemocní i proto profitovali z komplexnější a cíleněji směřované péče, která zajistila nebo kompenzovala jejich aktuální potřeby či potíže. Cílem našeho sledování nebylo tedy zavedení „jen“ nutriční intervence, ale snaha o kompletní péči v rámci multioborové spolupráce – a to se nám zdařilo. Jistě jsme si vědomi, že nutriční intervencí jistě přímo neovlivníme progresi nádorového onemocnění, ale s ohledem na výstupní informace jsme potvrdili, že námi poskytnutá péče je schopna zlepšit celkový stav nemocného člověka, vč. tolerance náročné onkologické léčby. Z našeho souboru (726 nemocných) přežilo tříleté sledování celkem 185 nemocných (26 %) a zemřelo 88 % nemocných, šest pacientů bylo vyloučeno pro absenci dat. Porovnáním sledovaných parametrů navzájem a s proměnnými faktory v čase jsme prokázali významné závislosti většiny sledovaných parametrů, které mají kauzální vztah v čase (hmotnost, WL, BMI, CSS, KPS, CCI, QLQ C-30, QLQ HN-35). Akceptování zavedení PEG (skupina A) lze označit jako zásadní faktor pro průběh s významně nižším počtem komplikací v průběhu terapie i pro zlepšení tolerance onkologické léčby i přežití nemocných. V analýze přežití z nutriční intervence více profitují muži, přestože vykazují v průběhu sledování signifikantně vyšší mortalitu nezávislou na rakovině (cancer-independent mortality) – např. kardiovaskulární mortalitu než ženy (p < 0,03). Ženy nádorové onemocnění i jeho léčbu tolerují lépe, vykazují menší subjektivní obtíže, nižší počet rehospitalizací z důvodu zhoršení zdravotního stavu i celkový počet komplikací (p < 0,02). Současně ženy vykazují signifikantně vyšší spotřebu antidepresivní léčby (p < 0,003), zatímco muži zase vyšší spotřebu analgetik (p < 0,001). Jako klinicky významný jsme stanovili neočekávaný WL z obvyklé hmotnosti > 10 % za posledních šest měsíců. Tento úbytek významně koreluje s klinickými projevy malnutrice a je spojen s nárůstem mortality, komplikací a enormním zvýšením komplikací s nutností přerušení onkologické léčby (i zde dominuje skupina mužů-kuřáků (p < 0,008). S vysokým rizikem kardiovaskulární mortality přímo koreluje CCI (který byl jedním z vedlejších proměnných). Tento parametr úzce odpovídá prevalenci hyperglykemie a hypercholesterolemie, stejně jako informacím, které jsme získávali dle skórovacího systému CCI. Tato skupina nemocných má současně častější BMI ≥ 30 a nepříznivý prediktor kardiovaskulární mortality. Vzestup BMI o > 5 kg/ m2 v čase T0 od BMI 25 zvyšuje riziko úmrtí na všechny příčiny sledovaných mortalit (vč. mortality závislé na rakovině) o 23 %. Za nezávislý rizikový faktor mortality závislé na rakovině (cancer-dependent mortality) považujeme WL > 5 % při BMI < 21 v čase T0 nebo > 10 % hmotnosti v T0 při BMI 21 – 29 nebo pokračující WL mezi kontrolami T6 a T12 ve skupině B (bez PEG). Obecným (neadjustovaným) rizikovým faktorem pro zvýšené riziko úmrtí ale zůstává WL > 5 %. Pro naše sledování jsme přejali definici malnutrice onkologicky nemocných podle guidelines ESPEN (viz výše). Takto rozsáhlé nutriční sledování je ale ojedinělé jak z hlediska počtu sledovaných parametrů, tak i podle délky sledování i vzhledem k rozdělení podle PEG na dvě srovnatelné skupiny (s PEG a bez PEG). Podle dostupné literatury lze dohledat pouze několik prací. Délka sledování i počet proměnných jsou v řadě prací velmi proměnlivé. Výjimečná je v tomto pohledu studie SCRINIO, jejímž investigátorem byl prof. Bozzetti [18 – 23]. Tato multicentrická a dvouletá studie ale neřešila efekt nutriční intervence ani vývoj nutričních parametrů v čase. Práce Paie et al [45] srovnávala rozsáhlou kohortu nemocných, avšak bez specifikace konkrétního maligního onemocnění. V této práci byli nemocní s HNC pouze jednou z mnoha skupin v obecném hodnocení. Přesto ale jsou výstupy vynikajícím nástrojem k získání nadhledu a možnosti srovnání s ostatními onkologickými chorobami – zejména vztah vlivu na závažnost nutričního stavu, ve kterém se nemocní nacházejí. Práce Solheima [25, 26] srovnává v krátkodobém horizontu nemocné v řadě nutričních aspektů. Výstupy s nárůstem HR pro jednoroční mortalitu přesahující 2,2 jsou proto tedy velice významné. V tomto pohledu ale nadále považujeme vstupní WL > 5 % jako přesnější a více senzitivní, který umožňuje nepodcenit závažnost nutričního stavu v průběhu onkologické léčby v delším časovém období. Ve sledování závislosti WL a komplikací u nemocných, kteří přežili, jsme nalezli několik obdobných závěrů. Prvním je souvislost mezi nemocnými nekuřáky, kteří měli WL < 10 %, protože si udrželi prakticky plnou mobilitu (hodnotili jsme ji pomocí KPS). Ve skupině A (s PEG) nemocní měli minimální potřebu sociální dopomoci od T12, protože byli prakticky soběstační. Dalším výstupem je vazba WL s CSS. Nemocní, kteří měli CSS < 5 (bodů), vykazovali po dobu léčení prakticky nejnižší progresi WL mezi T0 a T6. Tito nemocní byli prakticky všichni nekuřáky. Obdobné výstupy, avšak s odlišně vstupně definovanými soubory, byly publikovány v práce Weijse et al [44] a Lise et al [34].
Slabinu naší práce spatřujeme v plném akceptování onkologické léčby, kterou jsme dále přesněji neanalyzovali. Vzhledem k většině nemocných léčených radioterapií jsme blíže nestudovali možné závislosti na dávkách v rámci radioterapie u jednotlivých onemocnění v rámci naší práce.
Obdobná slabina je i u léčebně modality chemoterapie a kombinované léčebné intervence, protože i zde jsme tuto léčbu přejali od onkologů.
V retrospektivním pohledu na naši práci bychom jako zlepšení navrhli zejména vhodnost frekventnějších kontrol pro sledování, které jsme vzhledem k mimořádné náročnosti práce nakonec nezměnili a ponechali v původně nastaveném režimu. V tomto duchu se tedy shodujeme se závěry Paie et al [45] a Soa et al [52], kteří navrhují také delší sledování s kontrolami v intervalu 2 – 3 měsíce. V práci Paie et al byla délka sledování 12 měsíců a práce Soa et al měla délku dva roky.
Práce Silandera et al [51] sleduje nejvíce parametrů, vč. vlivu přítomnosti nutriční intervence cestou zavedené PEG se zohledněním modality onkologické léčby, kde byla výhradní modalitou léčby radioterapie.
Mezi další možnosti, které nabízejí naše výsledky, bychom mohli v analýzách zjišťovat např. vztah specifické nádorové mortalitě vs. QOL a její vývoj, ale to by práce byla mnohem rozsáhlejší. Práce Nelkeové et al [53] byla zaměřena na hodnocení QOL, ale výsledky byly získány v krátkodobém horizontu a hodnoceny výhradně ve vztahu k radioterapii a nikoliv ve vztahu k nutričnímu stavu a jeho intervenci. Přesnost sledování v naší práci je limitována přesnými výpočty energetické bilance, vč. měření „body-composition“, které jsou dostupné v pracích prof. Soeterse et al [11,17]. Ale naše sledování tohoto experimentálního rozsahu jsme v podmínkách běžné ambulantní praxe nedokázali postihnout.
Závěr
Různé způsoby léčby nádorových onemocnění ovlivňují život nemocného ve všech jeho aspektech. Nicméně výsledky ukazují na přínos nutriční péče, vč. výhodnosti zavedení PEG. Nepopiratelný je fakt, že onkologicky nemocný člověk zůstává nemocným i po úspěšně ukončené onkologické léčbě.
Prokázali jsme, že negativní vliv na průběh léčby onkologického nemocného mají následující znaky: věk > 63 let, mužské pohlaví, hypofaryngeální karcinom ve stadiu III nebo IV, základní vzdělání, trvalé kouření, WL > 5 % z obvyklé hmotnosti, BMI ≥ 30 nebo BMI < 21 v čase T0 a neakceptování PEG (skupina B).
Pro mortalitu nezávislou na nádorovém onemocnění jsou dalšími rizikovými faktory diagnózy diabetes mellitus II. typu a hypercholesterolemie (a vyšší vstupní skoring dle CCI).
Pro mortalitu závislou na rakovině jsou v našem tříletém sledování dominantní tyto rizikové faktory: WL ≥ 5 %, BMI < 21, mužské pohlaví a kuřáctví.
Naše sledování prokázalo, že adekvátní nutriční intervence u nemocných ve skupině A (kteří akceptovali PEG) zlepšuje QOL i toleranci onkologické léčby, stejně jako mnoho komplikací zdravotního stavu s potřebou hospitalizace.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Eva Malá
Ústav klinické imunologie a alergologie
FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: eva.taita@seznam.cz
Obdrženo: 17. 7. 2015
Přijato: 20. 9. 2015
Zdroje
1. Zvolsky M, Nechanska B, Kralikova E. The use of diagnoses related to tobacco use in the Czech Republic. Cas Lek Cesk 2012; 151(12): 573 – 578.
2. Dusek L, Pavlik T, Májek O et al. Odhady incidence, prevalence a počtu onkologických pacientů léčených protinádorovou terapií v letech 2015 – 2020, analýza Národního onkologického registru. Klin Onkol 2015; 28(1): 30 – 43. doi: 10.14735/ amko201530.
3. Dusek L, Muzik J, Gelnarova E et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2010; 23(5): 311 – 324.
4. Dusek L, Muzik J, Maluskova D et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2014; 27(6): 406 – 423. doi: 10.14735/ amko2014406.
5. Čelakovský P, Betka J, Plzák J (eds). Krční metastázy. Havlíčkův Brod: Tobiáš 2012 : 17 – 317.
6. Elia M, Stratton R. On the ESPEN guidelines for nutritional screening 2002. Clin Nutr 2004; 23(1): 131 – 132.
7. Fearon KC. The 2011 ESPEN Arvid Wretlind lecture: cancer cachexia: the potential impact of translational research on patient-focused outcomes. Clin Nutr 2012; 31(5): 577 – 582. doi: 10.1016/ j.clnu.2012.06.012.
8. Kondrup J, Allison SP, Elia M et al. ESPEN guidelines for nutrition screening 2002. Clin Nutr 2003; 22(4): 415 – 421.
9. Lochs H, Allison SP, Meier R et al. Introductory to the ESPEN Guidelines on Enteral Nutrition: terminology, definitions and general topics. Clin Nutr 2006; 25(2): 180 – 186.
10. Chroust K, Finek J, Zemanek P et al. Experience in data management of the clinical retrospective project in Czech and Slovak oncology centres (IKARUS Project). Klin Onkol 2009; 22(4): 163 – 167.
11. Soeters PB, Schols AM. Advances in understanding and assessing malnutrition. Curr Opin Clin Nutr Metab Care 2009; 12(5): 487 – 494. doi: 10.1097/ MCO.0b013e32832da243.
12. Sobotka L (ed.). Basics in clinical nutrition. Praha: Galén 2004 : 16 – 723.
13. Soeters MR, Soeters PB, Schooneman MG et al. Adaptive reciprocity of lipid and glucose metabolism in human short-term starvation. Am J Physiol Endocrinol Metab 2012; 303(12): E1397 – E1407. doi: 10.1152/ ajpendo.00397.2012.
14. Younes RN, Noguchi Y. Pathophysiology of cancer cachexia. Rev Hosp Clin Fac Med Sao Paulo 2000; 55(5): 181 – 193.
15. Skipworth RJ, Stewart GD, Dejong CH et al. Pathophysiology of cancer cachexia: much more than host-tumour interaction? Clin Nutr 2007; 26(6): 667 – 676.
16. Smiechowska J, Utech A, Taffet G et al. Adipokines in patients with cancer anorexia and cachexia. J Investig Med 2010; 58(3): 554 – 559. doi: 10.231/ JIM.0b013e3181-cf91ca.
17. Soeters PB, Sobotka L. The pathophysiology underlying the obesity paradox. Nutrition 2012; 28(6): 613 – 615. doi: 10.1016/ j.nut.2011.10.010.
18. Bozzetti F, Cozzaglio L, Gavazzi C et al. Total nutritional manipulation in humans: report of a cancer patient. Clin Nutr 1996; 15(4): 207 – 209.
19. Bozzetti F. Continuing: biology of cachexia. J Natl Cancer Inst 1999; 91(12): 1077 – 1078.
20. Bozzetti F. Screening the nutritional status in oncology: a preliminary report on 1,000 outpatients. Support Care Cancer 2009; 17(3): 279 – 284. doi: 10.1007/ s00520-008-0476-3.
21. Bozzetti F. Nutritional support of the oncology patient. Crit Rev Oncol Hematol 2013; 87(2): 172 – 200. doi: 10.1016/ j.critrevonc.2013.03.006.
22. Bozzetti F. Nutritional status, cachexia and survival in patients with advanced colorectal carcinoma. Different assessment criteria for nutritional status provide unequal results. Clin Nutr 2013; 32(5): 876. doi: 10.1016/ j.clnu.2013.07.003.
23. Bozzetti F. Nutrition, hydration, and patient‘s preferences at the end of life. Support Care Cancer 2015; 23(6): 1487 – 1488. doi: 10.1007/ s00520-014-2591-7.
24. Socher SH, Martinez D, Craig JB et al. Tumor necrosis factor not detectable in patients with clinical cancer cachexia. J Natl Cancer Inst 1988; 80(8): 595 – 598.
25. Solheim TS, Laird BJ. Evidence base for multimodal therapy in cachexia. Curr Opin Support Palliat Care 2012; 6(4): 424 – 431. doi: 10.1097/ SPC.0b013e328359b668.
26. Solheim TS, Blum D, Fayers PM et al. Weight loss, appetite loss and food intake in cancer patients with cancer cachexia: three peas in a pod? – analysis from a multicenter cross sectional study. Acta Oncol 2014; 53(4): 539 – 546. doi: 10.3109/ 0284186X.2013.823239.
27. Linkos.cz [internetová stránka]. Česká onkologická spo-lečnost ČLS JEP, Česká republika; c2000-06. Dostupné z:www.linkos.cz.
28. Cancer.org [homepage on the Internet]. American Cancer Society. Available from: www.cancer.org.
29. Haškovcová H (ed.). Lékařská etika. Praha: Galén 2002 : 272.
30. Wood K. Audit of nutritional guidelines for head and neck cancer patients undergoing radiotherapy. J Hum Nutr Diet 2005; 18(5): 343 – 351.
31. Zadák Z (ed.). Výživa v intenzivní péči. Praha: Grada publishing 2008 : 542.
32. Ptáček R, Bartůněk P et al (eds). Etické problémy medicína na prahu 21. století. Praha: Grada publishing 2014 : 520.
33. Sochor M, Slama O. Management chronické a akutní bolesti u pacientů s nádorovými chorobami. Klin Onkol 2015; 28(2): 94 – 98.
34. Lis CG, Gupta D, Lammersfeld CA et al. Role of nutritional status in predicting quality of life outcomes in cancer – a systematic review of the epidemiological literature. Nutr J 2012; 11 : 27. doi: 10.1186/ 1475-2891-11-27.
35. Arends J, Bodoky G, Bozzetti F et al. ESPEN Guidelines on enteral nutrition: non-surgical oncology. Clin Nutr 2006; 25(2): 245–259.
36. Lee JH, Machtay M, Unger LD et al. Prophylactic gastrostomy tubes in patients undergoing intensive irradiation for cancer of the head and neck. Arch Otolaryngol Head Neck Surg 1998; 124(8): 871 – 875.
37. Loser C, Aschl G, Hebuterne X et al. ESPEN guidelines on artificial enteral nutrition – percutaneous endoscopic gastrostomy (PEG). Clin Nutr 2005; 24(5): 848 – 861.
38. Nicholl MB, Lyons DA, Wheeler AA et al. Repeat PEG placement is safe for head and neck cancer patients. Am J Otolaryngol 2014; 35(2): 89 – 92. doi: 10.1016/ j.amjoto.2013.12.001.
39. Raykher A, Correa L, Russo L et al. The role of pretreatment percutaneous endoscopic gastrostomy in facilitating therapy of head and neck cancer and optimizing the body mass index of the obese patient. JPEN J Parenter Enteral Nutr 2009; 33(4): 404 – 410. doi: 10.1177/ 0148607108327525.
40. Reilly JJ. Does nutrition management benefit the head and neck cancer patient? Oncology (Williston Park) 1990; 4(6): 105 – 115.
41. Schutz T, Valentini L, Herbst B et al. ESPEN guidelines on enteral nutrition – summary. Z Gastroenterol 2006; 44(8): 683 – 684.
42. Schutz T, Herbst B, Koller M. Methodology for the development of the ESPEN Guidelines on enteral nutrition. Clin Nutr 2006; 25(2): 203 – 209.
43. Vassilopoulos PP, Filopoulos E, Kelessis N et al. Competent gastrostomy for patients with head and neck cancer. Support Care Cancer 1998; 6(5): 479 – 481.
44. Weijs TJ, Berkelmans GH, Nieuwenhuijzen GA et al.Routes for early enteral nutrition after esophagectomy. A systematic review. Clin Nutr 2015; 34(1): 1 – 6. doi: 10.1016/ j.clnu.2014.07.011.
45. Pai PC, Chuang CC, Tseng CK et al. Impact of pretreatment body mass index on patients with head-and-neck cancer treated with radiation. Int J Radiat Oncol Biol Phys 2012; 83(1): e93 – e100. doi: 10.1016/ j.ijrobp.2011.11.071.
46. Charlson M, Szatrowski TP, Peterson J et al. Validation of a combined comorbidity index. J Clin Epidemiol 1994; 47(11): 1245 – 1251.
47. Charlson M, Wells MT, Ullman R et al. The Charlson comorbidity index can be used prospectively to identify patients who will incur high future costs. PLoS One 2014; 9(12): e112479. doi: 10.1371/ journal.pone.0112479.
48. Karnofsky DA, Ellison RR, Golbey RB. Selection of patients for evaluation of chemotherapeutic procedures in advanced cancer. J Chronic Dis 1962; 15 : 243 – 249.
49. Takenaka Y, Takemoto N, Nakahara S et al. Prognostic significance of body mass index before treatment for head and neck cancer. Head Neck 2015; 37(10): 1518 – 1523. doi: 10.1002/ hed.23785.
50. Carmack CL, Basen-Engquist K, Gritz ER. Survivors at higher risk for adverse late outcomes due to psychosocial and behavioral risk factors. Cancer Epidemiol Biomarkers Prev 2011; 20(10): 2068 – 2077. doi: 10.1158/ 1055-9965.EPI-11-0627.
51. Silander E, Nyman J, Bove M et al. Impact of prophylactic percutaneous endoscopic gastrostomy on malnutrition and quality of life in patients with head and neck cancer: a randomized study. Head Neck 2012; 34(1): 1 – 9. doi: 10.1002/ hed.21700.
52. So WK, Chan RJ, Chan DN et al. Quality-of-life among head and neck cancer survivors at one year after treatment – a systematic review. Eur J Cancer 2012; 48(15): 2391 – 2408. doi: 10.1016/ j.ejca.2012.04.005.
53. Nelke KH, Pawlak W, Gerber H et al. Head and neck cancer patients‘ quality of life. Adv Clin Exp Med 2014; 23(6): 1019 – 1027. doi: 10.17219/ acem/ 37361.
54. Aaronson NK, Ahmedzai S, Bergman B et al. The European Organization for Research and Treatment of Cancer QLQ-C30:a quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 1993; 85(5): 365 – 376.
55. Bozzetti F. Quality of life and enteral nutrition. Curr Opin Clin Nutr Metab Care 2008; 11(5): 661 – 665. doi: 10.1097/ MCO.0b013e32830a7099.
56. Petruson KM, Silander EM, Hammerlid EB. Quality of life as predictor of weight loss in patients with head and neck cancer. Head Neck 2005; 27(4): 302 – 310.
57. Ravasco P, Monteiro-Grillo I, Marques VP et al. Quality of life in gastrointestinal cancer: what is the impact of nutrition? Acta Med Port 2006; 19(3): 189 – 196.
58. Sat-Munoz D, Moran MA, Solano-Murillo P et al. EORTC QLQ-C30 questionnaire role as predictor for malnutrition risk in head and neck cancer Mexican patients. Nutr Hosp 2012; 27(2): 477 – 482. doi: 10.1590/ S0212-16112012000200019.
59. Aaronson NK. Methodologic issues in assessing the quality of life of cancer patients. Cancer 1991; 67 (Suppl 3):844 – 850.
60. Aaronson NK, Snyder C. Using patient-reported outcomes in clinical practice: proceedings of an International Society of Quality of Life Research conference. Qual Life Res 2008; 17(10): 1295. doi: 10.1007/ s11136-008-9422-6.
61. Bjordal K, Hammerlid E, Ahlner-Elmqvist M et al. Quality of life in head and neck cancer patients: validation of the European Organization for Research and Treatment of Cancer Quality of Life Questionnaire-H&N35. J Clin Oncol 1999; 17(3): 1008 – 1019.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2016 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Genomové testy jako prediktory prognózy pacientek s karcinomem prsu
- Potenciál dlouhých nekódujících molekul RNA v diagnostice nádorových onemocnění
- Úloha bielkovín tepelného šoku v leukémii
- Analýza přežití tříletého sledování nemocných s rakovinou hlavy a krku
- Editorial
- Predikce změny vitality u starších přeživších žen s karcinomem prsu po primární onkologické léčbě – přístup založený na použití změny hladin zánětlivého markeru C reaktivního proteinu v čase
- Úspěšná spojená resekce jater a podvaz portální žíly po neúspěšné dvojité TACE proceduře komplikované sepsí a pankreatitidou
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Úspěšná terapie české pacientky s ROS1 translokací crizotinibem
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 1 – Hypokalemie. Bílkoviny. Kazuistika 1 -
Zpráva z European Cancer Congress 2015
Cílená biologická kombinační léčba prodloužila celkové přežití u metastatického melanomu - Informace z České onkologické společnosti
- Aktuality z odborného tisku
- Docentce MUDr. Janě Prausové, Ph.D., v přátelství a s obdivem
-
Vyhlášení výsledků
SOUTĚŽE NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH - Angiosarkom prsu po radioterapii před 11 lety
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Analýza přežití tříletého sledování nemocných s rakovinou hlavy a krku
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 1 – Hypokalemie. Bílkoviny. Kazuistika 1 - Genomové testy jako prediktory prognózy pacientek s karcinomem prsu
- Úloha bielkovín tepelného šoku v leukémii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



