-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Příprava 223Ra a 99mTc značených hydroxyapatitů a jejich in vitro stabilita
Preparation of hydroxyapatites lebelled with 223Ra and 99mTc and their in vitro stabililty
Introduction:
Increasing attention in targeted radionuclide cancer therapy is given to alpha emitters. 223Ra and 99mTc labelled hydroxyapatites (nHAp) are suitable candidates for using in therapy and diagnostics of bone metastases. Moreover, both radionuclides and hydroxyapatites are already approved by Food and Drug Administration Agency (FDA) to be used in a number of applications.Material and methods:
Nano-hydroxyapatite particles were prepared by precipitation of 1,2 M Ca(NO3)2 . 2H2O with 0,8 M (NH4)2HPO4 at pH 10-–11 and laboratory temperature. Stock 223Ra was prepared from 227Ac/227Th/223Ra generator in our laboratory, which was eluted by 0,7 M HNO3 and methanol (2 : 8). Stock 99mTc was obtained from commercial 99Mo/99mTc generator (DRYTEC™, GE Healthcare) and was eluted with 0.9% saline. Radionuclidic purity was evaluated by gamma-spectrometry with high resolution (in case of 223Ra also by alpha-spectrometry). Two strategies were chosen for nanoparticles labelling i.e. surface sorption of radionuclides and intrinsic incorporation of radionuclides and subsequently stability control in saline was performed during 5 half-lives.Results:
Surface-labelled nHAp were obtained with yields ranging from 80 to 95 %. In the latter strategy, intrinsically labelled nHAp were obtained in the yields of 90–97 %.Conclusion:
Labelling yields of intrinsically labelled [223Ra]nHAp were slightly higher than surface-labelled nHAp. The obtained labelling yields of [99mTc]nHAp were comparable in both methods. Released activity was below 8 % in all cases.Keywords:
99mTc, 223Ra, nanomaterials, hydroxyapatite, therapy and diagnostics, bone metastases
Autori: Petra Mičolová; Martin Vlk; Eva Málková; Anna Bajzíková; Ján Kozempel
Pôsobisko autorov: Fakulta jaderná a fyzikálně inženýrská, Katedra jaderné chemie, ČVUT v Praze, ČR
Vyšlo v časopise: NuklMed 2016;5:4-9
Kategória: Původní práce
Súhrn
Úvod:
Cílené radionuklidové terapii alfa zářiči je věnována stále větší pozornost. Biokompatibilní nanohydroxyapatity (nHAp) značené 223Ra a 99mTc jsou vhodnými kandidáty pro využití v terapii a diagnostice kostních metastáz. Samotný hydroxyapatit i oba nuklidy jsou schváleny FDA a využívají se v řadě aplikací.Materiál a metoda:
Spolusrážením roztoků 1,2 M Ca(NO3)2 . 2H2O a 0,8 M (NH4)2HPO4 při pH 10–11 za laboratorní teploty byly připraveny nHAp. Jako zdroj 223Ra byl použit generátor 227Ac/227Th/223Ra, připravený na Katedře jaderné chemie, který byl eluován 0,7 M HNO3 a methanolem (2 : 8). Jako zdroj 99mTc byl použit generátor DRYTECTM (GE Healthcare Ltd.) eluovaný 0,9% roztokem NaCl. Radionuklidová čistota eluátů byla stanovena pomocí gama spektrometrie s vysokým rozlišením (v případě eluátu 223Ra i pomocí alfa spektrometrie). Pro značení byly zvoleny dvě strategie a to jednak povrchová adsorpce radionuklidu a dále spolusrážení in situ. Následně byla provedena kontrola stability ve fyziologickém roztoku po dobu 5 poločasů.Výsledky:
Při povrchovém značení byly nHAp značeny s výtěžkem 80–95 %. Ve druhém případě byly získány objemově značené nHAp ve výtěžku 90–97 %.Závěr:
Výtěžky objemového značení [223Ra]nHAp byly v porovnání s povrchovým značením nepatrně lepší. V případě značení [99mTc]nHAp jsou výsledky povrchového i objemového značení srovnatelné. Uvolněná aktivita se pohybovala pod 8 %.Klíčová slova:
99mTc, 223Ra, nanomateriály, hydroxyapatit, terapie a diagnostika, kostní metastázyÚvod
Hydroxyapatity reprezentují skupinu minerálních látek nacházejících se v živých soustavách jako složky zubů a kostí. Díky své biokompatibilitě a afinitě ke kostní tkáni jsou nanočástice hydroxyapatitu (nHAp) a jejich kompozity používány v mnoha biomedicínských aplikacích ve formě granulí či bloků např. jako kostní implantáty, přičemž jejich používání v medicíně bylo schváleno Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA). 1 Dále jsou studovány v nanomedicíně jako pH-responzivní nosiče pro cytostatika (např. doxorubicin) a monoklonální protilátky (např. DO-24 mAb, lidské IgCs). 2, 3, 4
V poslední době je nanohydroxyapatitům věnována pozornost hlavně v nukleární medicíně, kde jsou studovány jako potenciální nosiče jak pro diagnostiku s využitím izotopů 18F a 68Ga 5, ale také v terapii ve spojení s 125I, 153Sm a 223Ra. 6, 7, 8, 9 Zvláště pro cílenou alfa terapii kostních metastáz s 223Ra se nanohydroxyapatity jeví jako vhodnější nosiče, především z důvodů biologické kompatibility s cílovou tkání, dobré radiační stability a schopnosti termalizace odražených atomů při přeměně mateřského radionuklidu 10 ve srovnání se studovanými polymerními systémy jako např. polymerozomy. 11 Využití modifikovaných hydroxyapatitů je demonstrováno na příkladu PET radionuklidů 18F a 68Ga, které byly použity při značení jak v krystalové mřížce hydroxyapatitu s využitím [18F]NaF, tak u povrchově funkcionalizovaného nHAp s [68Ga]NO2APBP. 5
Cílem této práce je příprava a studium in vitro stability [223Ra]nHAp a [99mTc]nHAp ve fyziologickém prostředí. Pro přípravu značených nHAp byly zvoleny dva postupy, jednak povrchové značení již připravených nHAp, které je založeno na adsorpci daného radionuklidu na povrch nanomateriálů, a dále značení nosičů spolusrážením s ionty radionuklidů v roztoku. 9, 10
Kombinace 223Ra a 99mTc byla vybrána cíleně. 223Ra bylo schváleno FDA a zařazeno do Evropského lékopisu (registrováno i v ČR) pro paliativní léčbu kostních metastáz. 12 Nanočástice hydroxyapatitu jsou v této fázi studovány jako potenciální nosiče 223Ra, které by v kombinaci se SPECT radionuklidem 99mTc mohli přinést například informace o postupu terapie. Nanohydroxyapatity by tak naplnily theranostický koncept nosiče.
Materiál a metoda
Nanočástice hydroxyapatitu byly připraveny srážením 1,2 M roztoku Ca(NO3)2 . 2H2O a 0,8 M roztoku (NH4)2HPO4 za laboratorní teploty, přičemž před přídavkem vápenaté soli bylo pH roztoku upraveno roztokem NH4OH na 10–11. Suspenze byla míchána po dobu 1 hodiny a následně byla centrifugována při 3 000 otáčkách za minutu (rpm) po dobu 10 min. Použité chemikálie byly v kvalitě p. a. (Lachner nebo VWR International s. r. o.).
Zpracování bylo provedeno opakovaným promýváním ultračistou vodou získanou ze stanice Millipore Direct Q3 (Merck), následně byly připravené nHAp sušeny pod vakuem na vakuové lince s inertní větví, připojenou přes nízkoteplotní chladič chlazený kapalným dusíkem anebo ponorným chladičem HUBER TC50 k olejové vývěvě VR 04 (Lavat s. r. o.). Struktura připravených nHAp byla potvrzena pomocí FT-IR spektrometrie (Fourier Transform Infrared Spectrometry) na spektrometru iS50 (Nicolet) ve střední infračervené oblasti s rozlišením 2 cm-1 metodou difuzní reflektance. Prášková difrakce XRPD (X-ray Powder Diffraction) byla měřena na přístroji Rigaku MiniFlex 600s měděnou katodou (Cu-Kα1,2) a NaI(Tl) scintilačním detektorem. Difraktogram byl zaznamenáván kontinuálně od 10° do 80° 2θ s rychlostí snímání 5° 2θ/min.
Příprava [223Ra]nHAP
Zdrojem 223Ra byl generátor 227Ac/227Th/223Ra, který byl připraven sorpcí roztoku 227Ac (směs 227Ac v rovnováze se svými dceřinými produkty, (Amersham, UK)) na kolonku iontoměniče Dowex-1 (Sigma-Aldrich). (Obr. 1a) Eluce 223Ra byla prováděna 0,7 M HNO3 a CH3OH (2 : 8). 13 Ze získaného eluátu byl nejprve na vakuové odparce odpařen CH3OH, následně byl 223Ra(NO3)2 rozpuštěn v 300 μl destilované vody a pH bylo upraveno pomocí NH4OH (aq, 50 μl) na pH 11. Radionuklidová čistota byla stanovena pomocí gama spektrometrie s vysokým rozlišením a alfa spektrometrie.
Obr. 1a Generátor <sup>227</sup>Ac/<sup>227</sup>Th/<sup>223</sup>Ra. 
Značení [223Ra]nHAp spolusrážením probíhalo následovně: 223Ra(NO3)2 (300 μl, 18 kBq) byl přidán k roztoku 0,8 M (NH4)2HPO4 (40 μl, 32 μmol), poté bylo pH upraveno pomocí NH4OH (aq, 2 kapky) a za stálého míchání byl přidáván 1,2 M Ca(NO3)2 (40 μl, 48 μmol).
Značení [223Ra]nHAp adsorpcí na povrchu bylo prováděno následovně: k navážce nHAp (5 mg) byl přidán fyziologický roztok (40 μl) a směs byla dispergována pomocí vibrační míchačky a následně byl přidán roztok 223Ra(NO3)2 (300 μl, 18 kBq).
Vzorky byly míchány 1 hodinu za laboratorní teploty a následně centrifugovány při 3000 rpm po dobu 10 min. Zpracování proběhlo následně: supernatant byl odebrán a vzorky byly 3x promyty fyziologickým roztokem. Roztoky nad značenými vzorky byly vždy odebrány do samostatných zkumavek a společně s [223Ra]nHAp byly měřeny na NaI(Tl) detektoru (CRC-55tW CAPINTEC, USA) a gama spektrometru (Ortec, USA). U vzorků byl následně stanoven radiochemický výtěžek (Tab. 1) a procento uvolněné aktivity po 24 hodinách a v daných poločasech ve fyziologickém roztoku. (Obr. 2)
Obr. 1. Závislost procenta uvolněné aktivity na době odebírání vzorku pro [<sup>223</sup>Ra]nHAp. ![Závislost procenta uvolněné aktivity na době odebírání vzorku pro [<sup>223</sup>Ra]nHAp.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9503b1698748d9fe237cbbc07f7f980d.jpg)
Příprava [99mTc]nHAp
99mTc bylo získáno z komerčně dostupného generátoru DRYTECTM (GE Healthcare Ltd.) elucí 0,9% roztokem NaCl. (Obr. 1b) Eluovaná aktivita se první den pohybovala okolo 0,2 GBq/ml. Radionuklidová čistota byla kontrolována pomocí gama spektrometrie s vysokým rozlišením.
Obr. 1b DRYTEC™ generátor <sup>99</sup>Mo/<sup>99m</sup>Tc. 
Při značení [99mTc]nHAp spolusrážením bylo nutné nejprve Na99mTcO4 (1 ml, 200 MBq) zredukovat mícháním s roztokem chloridu cínatého po dobu 30 minut. Následně byl přidán 0,8 M (NH4)2HPO4 (40 μl, 32 μmol), poté bylo pH upraveno pomocí 1 M NaOH (aq, 2 kapky) a za míchání byl přidáván 1,2 M Ca(NO3)2 (40 μl, 48 μmol).
Při přípravě povrchově značených [99mTc]nHAp byl k navážkám nHAp (5 mg) přidán vodný roztok chloridu cínatého (500 μl) a vzorky byly dispergovány pomocí vibrační míchačky. Následně byl přidán roztok Na99mTcO4 (1 ml, 150 MBq).
Vzorky byly míchány 1 hodinu za laboratorní teploty a poté centrifugovány při 3000 rpm po dobu 10 min. Následně byly zpracovány stejným způsobem jako v případě značení 223Ra. Odebraný supernatant a [99mTc]nHAp byly měřeny na ionizační komoře (CRC-55tW CAPINTEC, USA). Byl stanoven radiochemický výtěžek (Tab. 2) a procento uvolněné aktivity v poločasech ve fyziologickém roztoku. (Obr. 3)
Obr. 2. Závislost procenta uvolněné aktivity na době odebírání vzorku pro [<sup>99m</sup>Tc]nHAp. ![Závislost procenta uvolněné aktivity na době odebírání vzorku pro [<sup>99m</sup>Tc]nHAp.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/38ea0f5cf467373b958f675d79b96404.jpg)
Sledování stability ve fyziologickém roztoku
Množství uvolněné aktivity ze značených [223Ra]nHAp a [99mTc]nHAp (povrchově i objemově) ve fyziologickém roztoku v podmínkách in vitro bylo sledováno u vybraných vzorků v čase. (Obr. 2 a Obr. 3) Ke vzorkům byl přidán fyziologický roztok (300 μl) a byly dispergovány. Po uplynutí daného časového intervalu (223Ra – 11,3 d, 99mTc – 6 h) byly centrifugovány při 3000 rpm (10 min) a celý postup byl opakován. Byla změřena aktivita supernatantu a značeného nHAp a stanoveno procento uvolněné aktivity z nanočástic do fyziologického roztoku.
Výsledky
Radionuklidová čistota stanovená alfa a gama spektrometrií byla vyšší než 95 %. Pro přípravy značených nHAp byly zvoleny dva postupy: povrchová sorpce a spolusrážení in situ. U druhého popisovaného postupu by měla být výrazným pozitivem inkorporace radionuklidu přímo do struktury hydroxyapatitu. Ionty 223Ra2+ tedy přímo substituují atomy Ca2+ v krystalové mřížce. U hydroxyapatitů značených 99mTc (i obecně dalších radionuklidů ve valenčním stavu jiném než 2+) se lze domnívat, že 99mTc4+ jsou po redukci zachyceny v intersticiálních polohách krystalové mříže a tudíž dochází k jejich významné retenci.
Hydroxyapatit byl připraven s výtěžkem 98 % a jeho struktura byla potvrzena pomocí FT-IR a XRPD. V infračerveném spektru hydroxyapatitu jsou viditelné následující pásy: 3380, 1638, 1009, 598 a 558 cm-1 (Obr. 4), což je v souladu s literaturou. 14 Při porovnání naměřeného difraktogramu nHAp a difraktogramu z databáze bylo potvrzeno, že se jedná o nHAp s krystalickou hexagonální strukturou (Obr. 5), přičemž velikost částeček byla stanovena na 15 nm.
Obr. 3. FT-IR spektrum hydroxyapatitu. 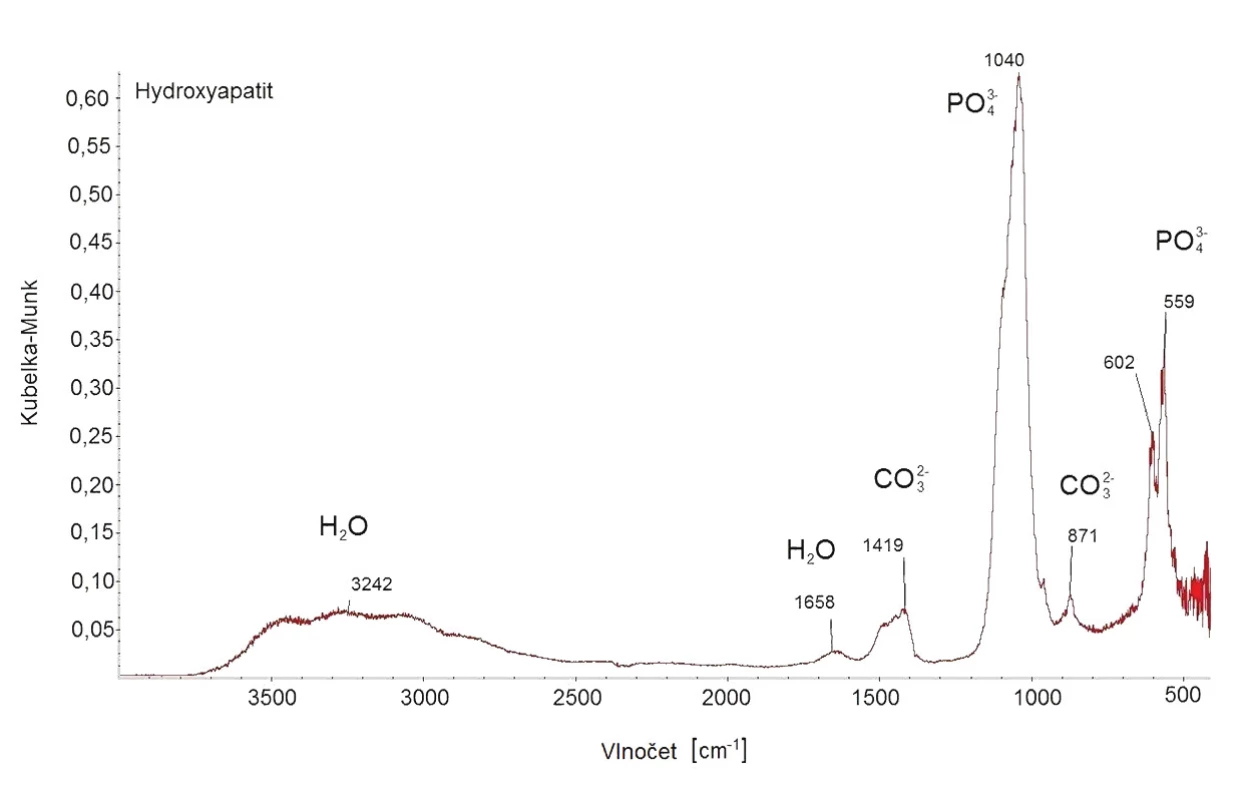
Obr. 4. Difraktogram hydroxyapatitu. 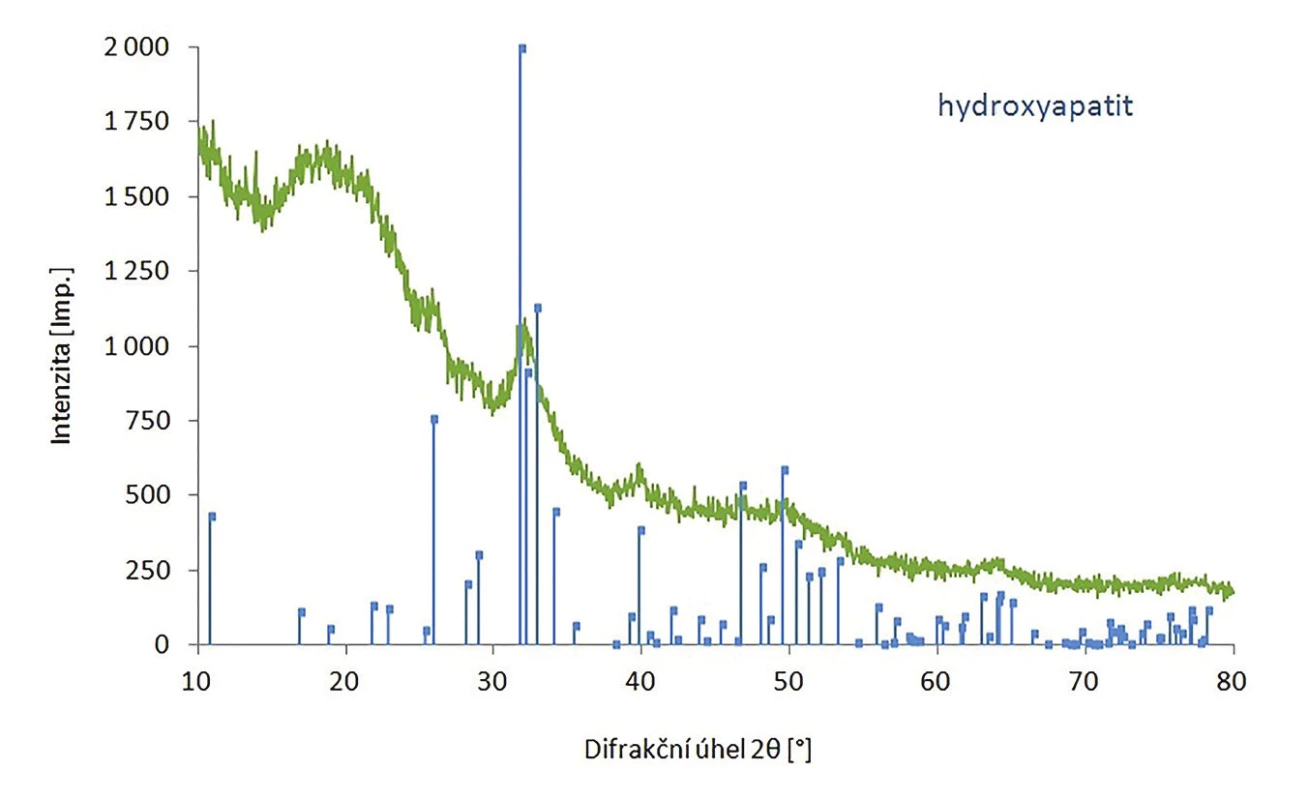
Celkem bylo připraveno 6 vzorků [223Ra]nHAp značených na povrchu (P) a 6 vzorků [223Ra]nHAp značených spolusrážením. (V) (Tab. 1) Stejné množství vzorků bylo připraveno i s 99mTc. (Tab. 2) Výtěžek značení (Y) byl vypočítán dle vztahu (1), přičemž v případě značení s 99mTc bylo nutné vstupní aktivitu korigovat na čas měření značeného nHAp.
Tab. 1. Příprava [<sup>223</sup>Ra]nHAp. P – povrchové značení, V – objemové značení ![Příprava [<sup>223</sup>Ra]nHAp. P – povrchové značení, V – objemové značení](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1e30c5ba1c4571926520d936806baf1b.png)
Tab. 2. Příprava [<sup>99m</sup>Tc]nHAp. P – povrchové značení, V – objemové značení ![Příprava [<sup>99m</sup>Tc]nHAp. P – povrchové značení, V – objemové značení](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/85dee25910edd8bddc2b3ecedcf68cc5.png)
Povrchově značené nHAp byly získány s výtěžky 80–95 %. Ve druhém případě značení byly objemově značené nHAp připraveny ve výtěžku 90–97 % (223Ra) a ve výtěžku 93–97 % (99mTc).
Procento uvolněné aktivity v daném intervalu bylo vypočítáno dle vztahu (2). Získané výsledky jsou uvedeny v grafech. (Obr. 2 a Obr. 3)
Procenta uvolněné aktivity byly ve všech případech pod hranicí 8 %, ve většině případů však nepřesahují hranici 5 %.
Diskuze
Nanohydroxyapatity, stejně tak jako polymerozomy, představují novou generaci potenciálních nosičů jak pro diagnostiku 5 tak i terapii 6, 7, 8, zejména však pro cílenou alfa terapii. 9, 10, 11 Zvolené radionuklidy pro značení nebyly vybrány náhodně. Radionuklid 223Ra je z druhé generace alfa zářičů tzv. in vivo generátorů, kde na jeden rozpad mateřského radionuklidu připadá více alfa a beta částic z rozpadů jeho dceřiných produktů. Kombinací s 99mTc jakožto diagnostického SPECT radionuklidu by bylo možné získat teranostický nosič.
Výsledky povrchového značení hydroxyapatitů a hydroxyapatitů značených spolusrážením in situ jsou porovnatelné. U povrchově značených je výhodou, že k navázání atomů radionuklidu dochází na materiál předem známý, s ověřenou strukturou a velikostí částic. Charakterizace připraveného materiálu byla provedena pomocí infračervené spektrometrie a rentgenové práškové difrakce, přičemž naměřená data jsou v souladu s dostupnou literaturou. 14 Navázání/sorpce radionuklidu je tedy poslední krok přípravy značeného hydroxyapatitu. Na druhou stranu u hydroxyapatitů značených spolusrážením je radionuklid začleněn do jejich struktury, kde substituuje ionty Ca2+ nebo je uzavřen v intersticiálních polohách. Velikost částic stanovená metodou XRPD odpovídá střední velikosti krystalinitů, nevypovídá však dostatečně o pravé velikosti nanočástic, které poměrně rychle agregují do větších shluků, o čem svědčí i pozorování jejich rychlé sedimentace, kterou zmiňuje i literatura. 5 V tomto směru bude zapotřebí zkoumat možnosti stabilizace nanočástic v roztoku, i když velké částice lze, ale za cenu výrazných ztrát aktivity, snadno odstranit filtrací přes standardní 0,22 µm filtr.
V případě 223Ra celková uvolněná energie při kaskádě rozpadů na dceřiné radionuklidy představuje přibližně 27 MeV. Energie uvolněná při jednom rozpadu je distribuována mezi emitovanou alfa částici a odražený dceřiný atom, který je následně stabilizován ve struktuře nosiče, adsorbován na povrchu či může dojít k jeho uvolnění. Rozdíly v uvolněné aktivitě v průběhu 5 poločasů (223Ra – 11,3 d, 99mTc – 6 h) jsou téměř zanedbatelné a procenta uvolněné aktivity v prostředí fyziologického roztoku se pohybují pod 8 %, což naznačuje, že pravděpodobně nedochází k významnému uvolňování radionuklidu z nHAp. Supernatant odebraný ze vzorků po povrchovém i objemovém značení v průběhu stabilitních studií ve fyziologickém roztoku neobsahoval podle spektrometrie gama žádný z produktů rozpadu mateřského 223Ra, a to i navzdory tomu, že byla očekávána přítomnost izotopu 211Pb (poločas 36,1 min.). V případě uvolnění dceřiných odražených atomů může zároveň docházet k jejich povrchové sorpci na okolní nanočástice.
Získané výsledky jsou slibným základem pro další studie, zejména pro aplikace in vivo ve zvířecích modelech, ačkoliv další optimalizace přípravy jsou nutné.
Závěr
Výtěžky značení připravených nanohydroxyapatitů se v případě povrchového značení pohybovaly okolo 85 % u značení 223Ra a 91 % u značení 99mTc. Druhý zvolený postup značení byla příprava nanohydroxyapatitů spolusrážením in situ, u kterého výtěžky značení dosahovaly 94 % pro oba zvolené radionuklidy.
In vitro stabilita připravených nHAp byla sledována ve fyziologickém roztoku a byla stanovena uvolněná aktivita v jednotlivých poločasech (dle daného radionuklidu). Procento uvolněné aktivity se pohybovalo pod 8 %, přičemž ve většině případů dokonce nepřesáhlo 5 %.
V budoucích experimentech bude zapotřebí optimalizovat velikost částic a s tím související jejich stabilitu v disperzi, aby nedocházelo k agregaci. Následně provést testy in vitro stability značených nHAp v biologických matricích (krevní plasma a krevní sérum) a tím provést užší výběr nosiče a postup značení pro in vivo experimenty na myších.
Poděkování:
Tato práce byla podpořena grantem Českého vysokého učení technického v Praze č. SGS15/094/OHK4/1T/14, MŠMT ČR č. LK21310 a Technologickou agenturou ČR č. TA03010027. Speciální poděkování patří Ing. Janu Bártovi za XRPD analýzu připravených materiálů.
Petra Mičolová, Martin Vlk, Eva Málková, Anna Bajzíková, Ján Kozempel
Fakulta jaderná a fyzikálně inženýrská, Katedra jaderné chemie, ČVUT v Praze, ČR
jan.kozempel@fjfi.cvut.cz
Zdroje
1. Food and Drug Administration [online]. [cit. 2015-03-16]. Dostupné na: http://www.fda.gov/RegulatoryInformation/Guidances/ucm080224.htm
2. Hossain S, Yamamoto H, Chowdhury EH et al. Fabrication and Intracellular Delivery of Doxorubicin/Carbonate Apatite Nanocomposites: Effect on Growth Retardation of Established Colon Tumor. PLOS ONE 2013;8:doi:10.1371/journal.pone.0060428
3. Iafisco M, Delgado-Lopez JM, Varoni EM et al. Cell Surface Receptor Targeted Biomimetic Apatite Nanocrystals for Cancer Therapy. Small. 2013;9 : 3834-3844 doi:10.1002/smll.201202843
4. Iafisco M, Varoni E, Di Foggia M et al. Conjugation of hydroxyapatite nanocrystals with human immunoglobulin G for nanomedical applications. Colloids and Surfaces B:Biointerfaces 2012;90;1-7
5. Sandhöfer B, Meckel M, Delgado-López JM et al. Synthesis and Preliminary in Vivo Evaluation of Well-Dispersed Biomimetic Nanocrystalline Apatites Labeled with Positron Emission Tomographic Imaging Agents. ACS Applied Materials and Interfaces 2015;7;10623–10633
6. Xie G, Sun J, Zhong G et al. Hydroxyapatite nanoparticles as a controlled-release carrier of BMP-2: absorption and release kinetics in vitro. J Mater Sci: Mater Med 2010;21;1875-1880
7. Ignjatović N, Djurić SV, Mitić Ž et al. Investigating an organ-targeting platform based on hydroxyapatite nanoparticles using a novel in situ method of radioactive 125Iodine labeling. Material Sciences and Engineering C 2014;43;439-446
8. Liu Y, Sun Y, Cao C et al. Long-term biodistribution in vivo and toxicity of radioactive/magnetic hydroxyapatite nanorods. Biomaterials 2014;35;3348-3355
9. Kozempel J, Vlk M, Málková E et. al. Prospective carriers of 223Ra for targeted alpha particle therapy. Journal of Radioanalytical and Nuclear Chemistry 2014;304;443-447
10. Kozempel J, Vlk M Nanoconstructs in Targeted Alpha-Therapy. Recent Patents on Nanomedicine 2014;4;71-76
11. Wang G, de Kruijff RM, Rol A et al. Retention studies of recoiling daughter nuclides of 225Ac in polymer vesicles. Applied Radiation and Isotopes 2014;85;45-53
12. European medicine agency: European Pharmacopoeia [online] 2014, [cit. 2015-06-25]. Dostupné na: http://www.ema.europa.eu
13. Guseva LI, Tikhomirova GS, Dogadkin NN An 227Ac-221Pb generator for test experiments of solution chemistry of element. Journal of Radioanalytical and Nuclear Chemistry 2004;260;167-172
14. Rehman I, Bonfield W Characterization of hydroxyapatite and carbonated apatite by photo acoustic FTIR spectroscopy. Journal of Materials Sciences: Materials in Medicine 1997;8;1-4
Štítky
Nukleárna medicína Rádiodiagnostika Rádioterapia
Článok vyšiel v časopiseNukleární medicína

2016 Číslo 1
Najčítanejšie v tomto čísle- Flare fenomén u pacientky s karcinomem prsu
- Scintigrafické zobrazení hemangiomu – kazuistika
- Zamyšlení nad zaváděním a využitím hybridních zobrazovacích systémů PET/MR v České republice
- Příprava 223Ra a 99mTc značených hydroxyapatitů a jejich in vitro stabilita
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





