-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Očkování proti karcinomu hrdla děložního a dalším projevům HPV infekce
Vaccination against cervical cancer and other sequelae of human papillomaviruses
Vaccination against human papillomaviruses is a primary prevention against malignant lesions associated with HPV 16 and 18. The use of quadrivalent vaccines has the added value in also safeguarding against genital warts and other genital lesions induced by HPV 6 and 11. The best results are reached by vaccinating HPV-naive persons who have not come into contact with the most frequent sexually transmitted infections. Vaccination is also useful in older women.
Key words:
HPV, vaccination, cervical cancer, genital warts.
Autori: T. Peterka
Pôsobisko autorov: Fakultní Thomayerova nemocnice, Praha ; Primář: MUDr. Tomáš Peterka ; Gynekologicko-porodnické oddělení
Vyšlo v časopise: Prakt. Lék. 2009; 89(1): 8-10
Kategória: Přehledy
Súhrn
Očkování proti lidským papilomavirům přináší možnost prevence nádorových lézí spojených s HPV 16 a 18. Při užití kvadrivalentní vakcíny současně chrání proti genitálním bradavicím a dalším lézím spojeným s infekcí HPV 6 a 11. Optimálních výsledků dosahuje očkování při podání jedincům naivním, kteří dosud nepřišli s touto nejčastější pohlavně přenosnou infekcí do styku. Význam však má i u žen starších.
Klíčová slova:
HPV, vakcinace, karcinom děložního hrdla, genitální bradavice.Před dvěma roky, na podzim roku 2006, byla na trh uvedena kvadrivalentní vakcína proti lidským papilomavirům (HPV) typu 6/11/16/18 Silgard®. Do klinické praxe se tak poprvé dostala možnost očkování proti této nejčastější pohlavně přenosné infekci a ve svém důsledku proti lézím spojeným s infekcí těmito typy HPV – rakovině děložního čípku, cervikálním (CIN), vulvárním (VIN) a vaginálním (VaIN) intraepiteliálním dysplaziím a genitálním bradavicím (10).
Incidence karcinomu děložního hrdla v České republice je 19–22 na 100 000 žen. To znamená ročně 1 100–1 200 nových onemocnění a 400 úmrtí. Bohužel díky dosavadní oportunnosti screeningu jsou to jedna z nejhorších čísel v Evropě. Náš systém prevence tohoto nádoru spočívá v pravidelných cytologických vyšetřeních stěrů z hrdla děložního. Od roku 2008 je ustanoven program screeningu cervikálního karcinomu s plošným zvaním pacientek, programem kontroly kvality cytologických laboratoří i vyjmutí cytologického vyšetření z indukované péče.
Lidské papilomaviry (HPV)
Lidské papilomaviry (HPV) jsou tvořeny dvoušroubovicí DNA, která kóduje až 8 časných (E) a 2 pozdní (L) proteiny, tvořící virovou kapsidu. Z pohledu lidského zdraví má význam 40 typů, které infikují epitel kůže a sliznic, zejména anogenitální oblasti. Jedná se o nejčastější pohlavně přenosnou infekci s celoživotním rizikem až 80 %, při prevalenci 14–40 % s maximem mezi 18. a 25. rokem. Naštěstí u 80 % infikovaných dochází k vymizení infekce.
Za měsíc po infekci se aktivuje nejprve buněčná a později protilátková imunita, která se však vyvíjí pouze u 54–69 % infikovaných. Perzistující (přetrvávající) infekce je spojena s klinickými projevy typickými pro jednotlivé skupiny HPV (1).
Low risk (LR) HPV
se projevují genitálními bradavicemi a laryngeálními papilomy (rekurentní respirační papilomatóza, RRP). Z nich více jak 90 % je spojeno s typy 6 a 11, které současně způsobují 10–15 % CIN I. Genitální bradavice se vyvíjí během několika měsíců od infekce a mají tendenci se opakovat.
High risk (HR) HPV
za současného působení dalších rizikových faktorů (časné koitarché, promiskuita, kouření, multiparita, dlouhodobé užívání hormonální antikoncepce, další sexuálně přenosné choroby) vedou k rozvoji karcinomu hrdla děložního. V oblasti hrdla děložního se léze nízkého stupně s cytologickým hodnocením LG-SIL (low-grade squamous intraepitelial lesion) s histologickým ekvivalentem CIN 1 většinou spontánně zhojí. Malá část progreduje do lézí vyššího stupně s cytologickým hodnocením HG-SIL (high grade SIL) s histologickým ekvivalentem CIN 2/3, které jsou již považovány za prekancerózy. Ty již méně často regredují, a proto vyžadují histologické ověření a ošetření (LEEP – loop electroexcision procedure, konizace).
Jinak mohou progredovat v karcinom děložního hrdla, který je v 70 % spojen s HR HPV typu 16 a 18. HR HPV 16 a 18 jsou také podkladem 25 % CIN I, 50 % CIN 2/3, 70 % ostatních genitálních karcinomů a 60 % karcinomů konečníku.
HR HPV jsou nacházeny v 99,7 % spinocelulárních a v 56–94 % adenokarcinomů hrdla děložního (6).
Možnosti očkování proti HPV
Kvadrivalentní vakcína proti HPV 6/11/16/18 Silgard® (MSD) je registrována k užití u žen od 9 do 26 let a u chlapců ve věku 9–15 let. Bivalentní vakcína Cervarix® (GSK) proti HPV 16/18 je registrována pro ženy ve věku 10 až 25 let (tabulka 1). Obě vakcíny jsou rekombinantní a obsahují virus like partikule vytvořené z kapsidových L1 proteinů.
Tab. 1. Srovnání indikační šíře HPV vakcín 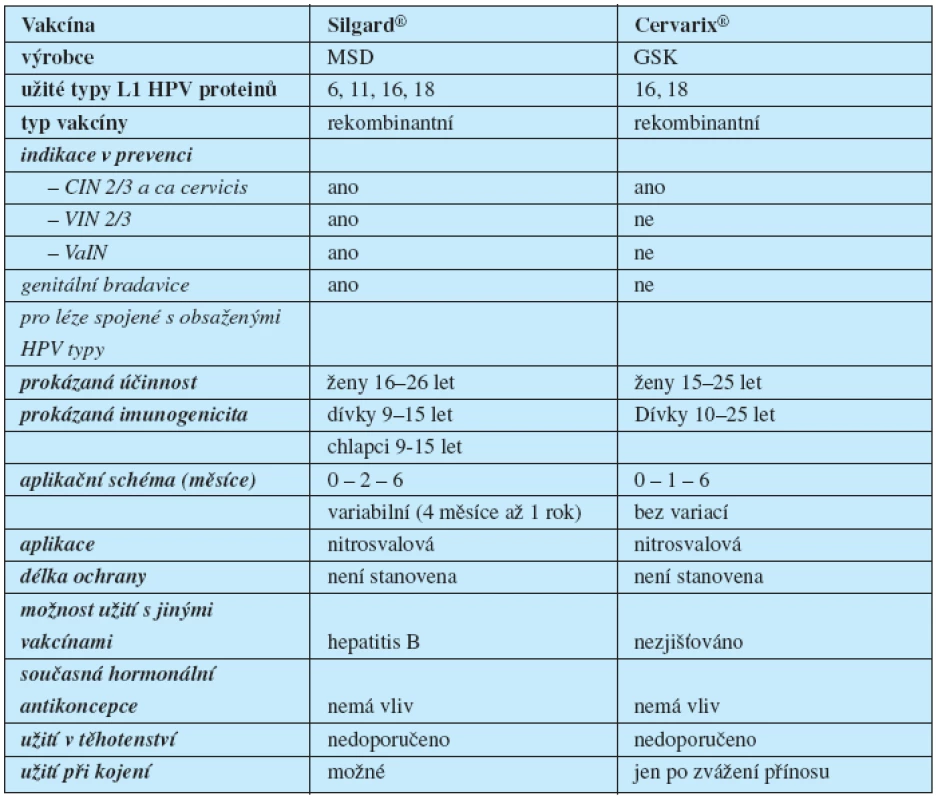
Obě vakcíny prokázaly vynikající imunogenicitu se 100% serokonverzí po očkování. Bivalentní vakcína Cervarix® díky užití adjuvantního systému 04, obsahujícího vedle hliníkového nosiče rovněž 3-O-desacyl-4´-monophosphoryl lipid A (imunostimulans antigenní struktury Salmonela minesota) dosahuje vyšších hladin protilátek (vztaženo k hladinám po přirozené infekci) ve srovnání s konvenčním adjuvans Al(OH)3 (2, 4, 8).
Délka ochrany obou vakcín je dosud prokázána na 5,5 let u kvadrivalentní, respektive 6,4 let u bivalentní vakcíny. Nutnost přeočkování nebyla stanovena.
Přímé srovnání kvadrivalentní vakcíny Silgard s bivalentní vakcínou Cervarix dle dosud dostupných studií je pouze přibližné. Firmy používají odlišný design studií, včetně definování intervenčních skupin, jiné jednotky pro měření hladin protilátek i jinou techniku jejich stanovení. Zatímco výrobce Silgardu, firma MSD, zaměřuje svoje studie na průkaz prevence lézí, studie výrobce Cervarixu, firmy GSK, zdůrazňuje hlavně hladiny protilátek a prevenci perzistující infekce (tabulka 2) (11, 13, 14).
Tab. 2. Účinnostní data HPV vakcín dle SPC 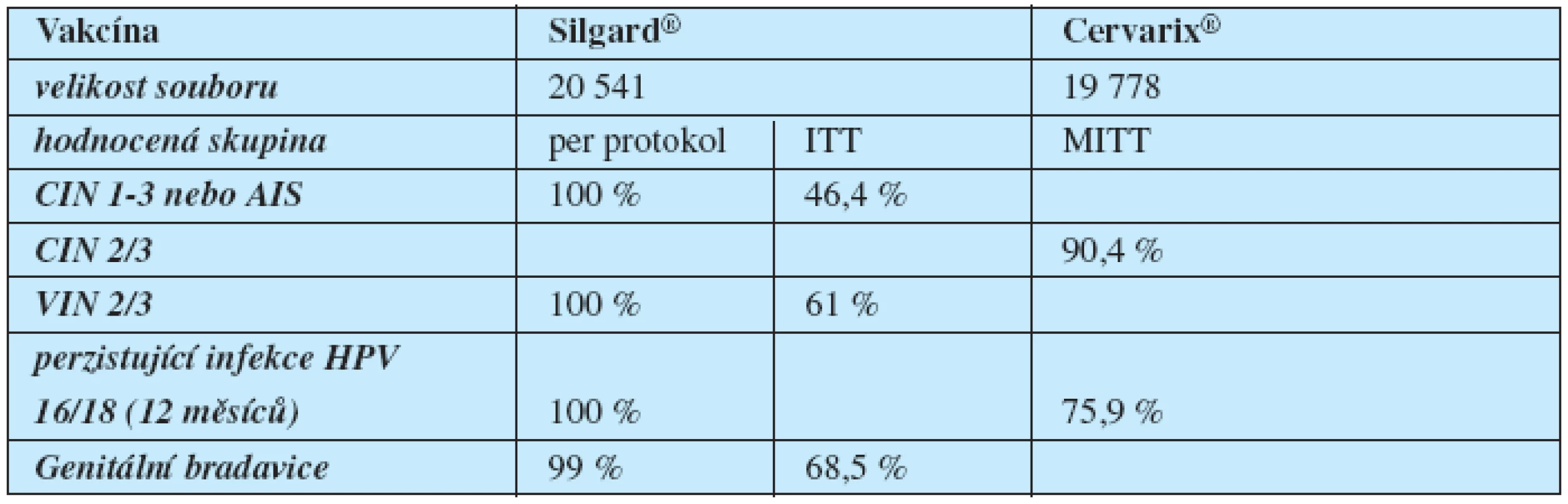
ITT – intention to treat – bez ohledu na stav infekce a dodržení schématu aplikace, MITT – modified intention to treat – bez infekce do zahájení očkování, per protokol – bez infekce do dokončení očkování Díky morfologické podobnosti L1 proteinů některých HPV typů chrání vakcíny částečně i proti nim – cross protekce. Kvadrivalentní vakcína má prokazatelnou zkříženou účinnost proti dalším deseti typům HPV 31/33/35/39/45/51/52/56/58/59. Tato účinnost dosahuje 38 % pro cervikální intraepiteliální neoplazii 2 a 3 a adenokarcinom in situ (AIS) u těchto 10 HPV typů neobsažených ve vakcíně a 62 % u HPV typů 31 a 45. Zkřížená ochrana bivalentní vakcínou dosáhla snížení perzistentní infekce pro léze HPV 45 v 59,9 %, HPV 31 v 36 % a HPV 52 v 31 %. Obě vakcíny prokazují imunogenicitu v subpopulaci žen do 45 let (9).
Bezpečnost obou vakcín je výborná. Velmi časté (tedy více jak v 10%) komplikace pro Silgard jsou systémově pyrexie a místně bolest, zarudnutí a otok. Cervarix velmi často způsobuje systémově bolest hlavy, únavu a myalgie, lokálně bolest, zarudnutí a otok.
Vakcína Silgard má v protokolu nejen základní schéma 0 – 2 – 6 měsíců (druhá dávka dva měsíce od první dávky a třetí dávka šest měsíců od první dávky), ale i minimální intervalové schéma, kdy mezi první a druhou dávkou jsou 4 týdny, mezi druhou a třetí dávkou 12 týdnů. Dojde-li k přerušení mezi první a druhou dávkou, druhá dávka se podá co nejdříve a třetí dávka pak nejdříve za 12 týdnů od dávky druhé. V případě, že dojde k přerušení mezi druhou a třetí dávkou, je nutné podat třetí dávku co nejdříve. Celé schéma by mělo být podáno nejpozději v průběhu jednoho roku (5).
Vakcína Cervarix má jako protokolární schváleno pouze základní schéma 0 – 1 – 6 měsíců.
Doporučení k očkování u nás vytvořila Česká gynekologicko-porodnická společnost (tabulka 3) i Odborná společnost praktických dětských lékařů (tabulka 4).
Tab. 3. Doporučení ČGPS ČLS JEP k očkování proti HPV ze dne 23. 3. 2007. 
Tab. 4. Doporučení výboru OSPDL k vakcinaci proti HPV 
Testování stavu HPV infekce před očkováním se nedoporučuje, protože infekce všemi čtyřmi typy virů současně je velmi vzácná (5). Očkování tak vždy přinese ochranu před zbývajícími typy HPV. Dokonce doporučení americké ACIP (The Advisory Committee on Immunization Practices) je podávat Gardasil i ženám s abnormalitami cytologie, genitálními bradavicemi či pozitivním DNA testem na HPV (12).
Závěr
Očkování proti lidským papilomavirům přináší možnost prevence nádorových lézí spojených s HPV 16 a 18, tedy 70 % karcinomů hrdla děložního a části nádorů konečníku, penisu a nádorů oropharyngeální oblasti. Strukturální příbuznost s dalšími high risk typy HPV vede k prokazatelné ochraně před cervikálními lézemi a perzistentní infekcí v dalších více jak 10 % případů. Optimálních výsledků dosahuje očkování při podání jedincům HPV naivním, kteří dosud nepřišli s touto nejčastější pohlavně přenosnou infekcí do styku, ale vysoká účinnost je prokázána i pro vyšší věkové kategorie.
Kvadrivalentní vakcína současně chrání proti více jak 90 % případům genitálních bradavic a dalším lézím spojeným s infekcí HPV 6 a 11 (10–15 % cervikálních lézí, respirační rekurentní papilomatóza). Snížení počtu benigních cervikálních lézí sníží náklady na opakovaná cytologická a expertní kolposkopie i obavy pacientek z opakovaných vyšetření (7).
Vzhledem k tomu, že současná vakcinace pokrývá přes 80 % HPV infekcí spojených s nádorem hrdla děložního, je i u vakcinovaných žen nutno pokračovat ve screeningu (3).
Při volbě očkovací látky je logickým trendem volit dle dostupných dat o účinnosti a bezpečnosti. Zatímco bezpečnost a snášenlivost obou vakcín je srovnatelná, dostupná data pro účinnost vůči lézím HPV 16/18 hovoří ve prospěch kvadrivalentní vakcíny Silgard®. Nikoli nevýznamným bonusem pro očkovaného jedince je pak při užití kvadrivalentní vakcíny současná ochrana proti lézím způsobeným HPV 6/11.
Pro populaci by mělo přínos pouze očkování plošné, ale individuální přínos pro očkovaného jedince je neoddiskutovatelný. Volba očkovat se na vlastní náklady je ukazatelem schopnosti převzít zodpovědnost za své zdraví.
MUDr. Tomáš Peterka
Vídeňská 800
140 59 Praha 4-Krč
E-mail: tomas.peterka@ftn.cz
Zdroje
1. Bosh, F.X., Castellsague, X., Sanjosé, S. HPV and cervical cancer: screening or vaccination. Br. J. of Cancer 2008, 98, p. 15-21.
2. Crosbie, E.J., Kitchener, H.C. Cervarix – a bivalent L1 VLP vaccine for prevention of human papillomavirus type 16 - and 18 - associated cervical cancer. Expert Opin. Biol. Ther. 2007, 7, 3, p. 391-395.
3. Franco, E.L., Cucick, J. Cervical cancer screening following prophylactic human papillomavirus vaccination. Vaccine 2008, 265, A16-23.
4. Fraser, C., Tomassini, J.E., Xi, L. et al. Modeling the long-term antibody response of HPV VLP type 16 prophylactic vaccine. Vaccine 2007, 25, p. 4324-4333.
5. FUTURE II Study Group. Quadrivalent vaccine against HPV to prevent high-grade cervical lesions. N. Engl. J. Med. 2007, 356,19, p. 1915-1927.
6. Fait, T., Vrablík, M., Češka, R. a kol. Preventivní medicína. Praha: Maxdorf Jessenius, 2008, s. 554.
7. Garland, S.M., Hernandez-Avila, M., Wheeler, C.M. et al. Quadrivalent vaccine against HPV to prevent anogenital disease (FUTURE I). N. Engl. J. Med. 2007, 356, 19, p. 1928-1943.
8. Giannini, S.L., Hanon, E., Moris, P. et al. Enhanced humoral and memory B cellular immunity using HPV 16/18 LV VLP vaccine formulated with the MLP/aluminium salt combination (AS04) comapred to aluminium salt only. Vaccine 2006, 24, p. 5937-5949.
9. Harper, M., Paavonen, J. Age for HPV vaccination. Vaccine 2008, 265, A7-11.
10. Joura, E.A., Leodolter, S., Hernandez-Avila, M. et al. Efficacy of quadrivalent prophylactic HPV (type 6, 11, 16, 18) L1 virus-like-particle vaccine against high-grade vulval and vaginal lesions: a combined analysis of three clinical trials. Lancet 2007, 369, p. 1693-1702.
11. Paavonen, J., Jenkins, D., Bosh, F.X. et al. Efficacy of a prophylactis adjuvanted bivalent L1 virus-like.particle vaccine against infection with human papillomavirus types 16 and 18 in young women. Lancet 2007, 369, p. 2161-2170.
12. Saslow, D., Castle, P.E., Cox, J.T. et al. American Cancer Society Guideline for HPV Vaccine Use to Prevent Cervical Cancer and Its Precursors. CA Cancer J. Clin. 2007, 57, p. 7-28.
13. Villa. L,L., Ault. K,A., Giulian. A,R. Immunologic response following administration of a vaccine targeting HPV types 6, 11, 16 a 18. Vaccine 2006, 7, p. 557-583.
14. Villa, L.L., Costa, R.L.R., Petta, C.A. et al. High sustained efficacy of a prophylactic quadrivalent HPV type 6/11/16/18 L1 virus-like particle vaccine through 5 years of follow up. Brit. J. Cancer 2006, 95, p. 1459-1466.
15. Wright, T.C., Bosch, F.X. Is viral status needed before vaccination? Vaccine 2008, 265, A12-15.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2009 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Současné možnosti péče o pacienty s epilepsií
- Regulační T lymfocyty a jejich význam pro zhoubné novotvary hlavy a krku
- Malující lékař dobývá rodné město
- Péče o výživu nedonošeného novorozence po propuštění z nemocnice
- Postoj k dispenzarizaci a zvládání stresu u pacientů dlouhodobě sledovaných pro diagnózu melanom
- Procesy globalizace a harmonizace práce etických komisí v EU
- Prohlášení
- Léčba chronických ran u seniorů pod vedením geriatra
- Subakutní trombóza dvou stentů jako příčina akutního infarktu myokardu
- Posuzování změn ledvinové funkce na podkladě sérových koncentrací kreatininu – možnosti a omezení
- Motivační dotazník jako intervenční a diagnostický nástroj
- Identita etických komisí, identita členů etických komisí
- Miniportréty slavných českých lékařů Profesor MUDr. Vratislav Jonáš, světově uznávaný, ale trochu zapomínaný kardiolog
- Nový projekt preventivní péče
- Jarní semináře o bolesti 2009
- Zánět středního ucha u dětí
- Jubilea
- Očkování proti karcinomu hrdla děložního a dalším projevům HPV infekce
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba chronických ran u seniorů pod vedením geriatra
- Péče o výživu nedonošeného novorozence po propuštění z nemocnice
- Současné možnosti péče o pacienty s epilepsií
- Zánět středního ucha u dětí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



