Léky a doporučená laboratorní vyšetření – máme vše skutečně pod kontrolou?
Medicinal products and laboratory tests – do we really control it?
In this review article authors want to draw attention to possible inappropriate prescribing when drugs altering kaliemia or magnesemia are prescribed without ordering appropriate laboratory tests. Hypokaliemia and/or hypomagnesemia increases risk of serious cardiac arrhytmia, such as torsade de pointes, which is rare but life threatening, especially when drugs prolonging QT interval are co-prescribed. Co-prescription of drugs afecting RAAS and mineralocorticoid receptor antagonists (MRA) can cause hyperkalemia, which can also kill patients. Recent abroad studies revealed, that physicians do not allways order appropriate laboratory tests to identify the drug risk. To identify the physicians and advice them should be within the abilities of health funds.
Keywords:
hypokaliemia – hypomagnesemia – hyperkaliemia – patient monitoring
Autori:
M. Prokeš; J. Suchopár
Pôsobisko autorov:
INFOPHARM, a. s.
Vyšlo v časopise:
Reviz. posud. Lék., 18, 2015, č. 2, s. 50-56
Kategória:
Souhrnná sdělení, původní práce, kazuistiky
Súhrn
V přehledovém článku se autoři snaží upozornit na možné suboptimální předepisování léků, kdy jsou předepisovány léky ovlivňující kalémii nebo magnezémii, aniž by byly hladiny těchto minerálů kontrolovány. Hypokalémie a/nebo hypomagnezémie zvyšuje riziko závažných srdečních arytmií, jako je torsade de pointes, která je vzácná, ale život ohrožující. Vyskytuje se zejména v případě, když jsou současně předepsány léky, které prodlužují interval QT. Současná preskripce léků ovlivňujících renin angiotensinový systém (RAAS) a antagonistů receptorů pro mineralokortikoidy (MRA) může způsobit hyperkalémii, která též může pacienty usmrtit. Nedávno zveřejněné studie provedené v zahraničí ukázaly, že lékaři vždy neordinují příslušné laboratorní testy. Zdravotní pojišťovny by měly být schopny takové lékaře identifikovat a upozorňovat je na možné nedostatky.
Klíčová slova:
hypokalémie– hypomagnezémie – hyperkalémie – monitorování pacienta
ÚVOD
V řadě vyspělých států světa se snaží stát, zdravotní pojišťovny nebo jiné instituce monitorovat preskripci lékařů a upozorňovat je na možná zdravotní rizika. Bez takového upozornění si nemusí lékaři být vůbec vědomi, že kombinace vybraných léčiv může pacienta poškodit, anebo o riziku vědí, ale v běžné praxi si včas nevybaví, kdy je třeba provést určitá laboratorní vyšetření. Z databází zdravotních pojišťoven lze vyčíst nejen to, kdy byly které léky předepsány, ale též kdy byla prováděna laboratorní vyšetření, např. kalémie, magnezémie, stanovení kreatininu v krvi nebo EKG. Provádění určitých laboratorních vyšetření při podávání léků doporučují nejen guidelines (doporučené postupy) nebo odborné články, ale též výrobci léčiv v souhrnech údajů o přípravku (SPC), které jsou schvalovány Státním ústavem pro kontrolu léčiv a které tedy mají oficiální charakter. Preskripce léčiv, která není doplněna doporučeným vyšetřením, se tak stává „off-label“ použitím léčivého přípravku a vystavuje lékaře značnému riziku, pokud by došlo k poškození a pacient (respektive pozůstalí) by lékaře zažalovali. Lékaři by si proto měli uvědomit, že pokud je zdravotní pojišťovna upozorňuje na možná opomenutí, chrání tak nejen své klienty, ale též samotné lékaře.
Graf 1 ukazuje, že spotřeby léků, které mohou ovlivnit plazmatické koncentrace kalia a/nebo magnézia, stoupají. Jako klasická diuretika jsou značena diuretika, která mohou způsobit hypokalémii, typicky thiazidová diuretika a furosemid. Mezi kalium šetřící diuretika jsme zařadili spironolakton, eplerenon a amilorid. PPI znamená inhibitory protonové pumpy (např. omeprazol) a léky RAAS zahrnují jak ACE-inhibitory (např. enalapril, perindopril, ramipril, a další), tak i inhibitory angiotenzinu II (např. losartan, telmisartan a další). Spotřeby jsou čerpány z programu AISLP, který data získal od SÚKL a jsou vyjádřeny v DDD/1000 obyv./den. Hodnoty v letech 2009 a 2014 jsou vždy vztaženy k roku 2004.

HYPOKALÉMIE
Hypokalémie je stav, kdy plazmatické koncentrace kalia klesají pod 3,5 mmol/l, což je závažným rizikovým faktorem různých arytmií včetně TdP. Hypokalémii mohou vyvolat průjmy, selhávání ledvin, osmotická diuréza během dekompenzace diabetu a léky. Je obecně známo, že hypokalémie způsobená diuretiky (hydrochlorothiazid, chlortalidon, indapamid a furosemid) může zvýšit toxicitu digoxinu. Méně je známo, že hypokalémie je také jedním z rizikových faktorů pro prodloužení intervalu QT a vzniku potenciálně fatální arytmie torsade de pointes (TdP), která je často vyvolávána určitými léky, typicky antiarytmiky. V ČR je registrována řada léčivých látek, které mohou takovou arytmii vyvolat, jako jsou např.:
- Antiarytmika Ia a III třídy: amiodaron, dronedaron a sotalol.
- Antibiotika: klarithromycin, azithromycin, moxifloxacin a levofloxacin.
- Antipsychotika: haloperidol, droperidol, sulpirid, chlorpromazin a vzácně i levomepromazin.
- Antidepresiva: citalopram, escitalopram a vzácně i tricyklická antidepresiva.
- Další léčiva: domperidon, ondansetron a anagrelid.
Prodloužení intervalu QT samo o sobě neškodí, ale je markerem zvýšeného rizika pro zmíněnou TdP. U mužů se považuje za horní hranici QT intervalu 450 ms, u žen 470 ms, nad 500 ms je riziko zvláště významné. Následující dvě sdělení ukazují případy, kdy vyšetření kalémie zřejmě nebylo včas provedeno.
McKibbin et al. [1] popisují sérii kazuistik 13 (1 M/12 F) pacientů ve věku 31–80 let užívajících sotalol 80–480 mg denně, u kterých došlo k synkopě a k prodloužení intervalu QTc na 580–760 ms. Všichni současně užívali hydrochlorothiazid 25 až 75 mg denně, suplementaci kaliem dostávali jen tři pacienti. Osm pacientů mělo kalémii nižší než 3,5 mmol/l. Čtyři pacienti užívali ještě další léky, které bývají spojovány s prodloužením intervalu QT, a to disopyramid (n = 3), imipramin (n = 1) a/nebo amitriptylin (n = 1). Arytmie TdP byla potvrzena u deseti z uvedených pacientů, u dalších dvou byl zjištěn jiný typ ventrikulární tachykardie. U osmi pacientů došlo k příhodě během 10 dnů od započetí podávání sotalolu a hydrochlorothiazidu, u ostatních k příhodě došlo s odstupem až tří let po různých provokujících podnětech, např. po epizodě průjmů, které k hypokalémii přispěly. Ve všech případech bylo podávání sotalolu ukončeno a případná hypokalémie byla korigována, během několika dní vždy došlo k normalizaci intervalu QTc.
Digby et al. [2] popisují kazuistiku 58leté ženy léčené pro srdeční slabost, hypertenzi a CHOPN, která byla hospitalizována pro celkovou slabost, nevolnost a pocení. Užívala kromě jiného i quetiapin 350 mg denně, citalopram 60 mg denně, hydrochlorothiazid 25 mg denně a mirtazapin 30 mg denně. Při přijetí byly plazmatické koncentrace kalia 2,5 mmol/l a magnézia 0,75 mmol/l (na dolní hranici normálního rozmezí). Na EKG bylo zjištěno prodloužení QTc na 720 ms a byly zaznamenány běhy arytmie torsade de pointes s epizodami fibrilací síní, které se dařilo úspěšně defibrilovat. Následně bylo podáváno magnézium a metoprolol a byla zavedena dočasná kardiostimulace, všechny léky spojované s prodloužením intervalu QT byly vysazeny. Následně došlo k normalizaci QTc intervalu na 410 ms a pacientka byla propuštěna do domácího ošetřování bez dalších příhod.
Někteří lékaři se domnívají, že podávání furosemidu spíše navodí hypokalémii než podávání hydrochlorothiazidu, ale fakta tomu odporují. Autoři Morgan et al. již v roce 1980 [3] z různých klinických studií prováděných v 60. a 70. letech minulého století zjistili, že hydrochlorothiazid průměrně snižuje kalémii o 0,66 mmol/l u pacientů s hypertenzí a o 0,68 mmol/l u pacientů se srdeční slabostí, kdežto furosemid snížil kalémii pouze o 0,36 mmol/l u hypertenze, a dokonce pouze o 0,19 mmol/l u srdeční slabosti. Přitom pacienti neužívali žádná kalium šetřící diuretika ani přípravky s tímto minerálem. Přesto je třeba sledovat mineralogram i při podávání furosemidu.
Hypokalémie může být spouštěcím faktorem arytmie i bez současného užívání zmíněných rizikových léků u pacientů s poškozením srdce, které bývá nejčastěji způsobeno ICHS. Dalšími rizikovými faktory je vyšší věk a ženské pohlaví.
HYPOMAGNEZÉMIE
Hypomagnezémie je závažným rizikovým faktorem různých arytmií včetně TdP. Hypomagnezémie je stav, kdy plazmatické koncentrace magnézia klesají pod 0,70 mmol/l (respektive 1,5 mg/dl), přičemž koncentrace nižší než 0,5 mmol/l je hypomagnezémie závažná. Hypomagnezémii mohou vyvolat různá onemocnění střev, pankreatu a ledvin a může být způsobena i léky, typicky diuretiky. Ve vzácných případech mohou závažnou hypomagnezémii vyvolat i inhibitory protonové pumpy (PPI). Bibway et al. [4] popisují případ 53letého muže bez anamnézy kardiovaskulárního onemocnění, který byl hospitalizován pro fibrilaci síní s akcí komor 190/min. Bylo započato podávání diltiazemu i. v., heparinu a v rámci údajného „rutinního postupu“ mu byl preventivně podáván pantoprazol 40 mg denně p. o. Plazmatická koncentrace kalia byla v normě, 4,6 mmol/l, ale koncentrace magnézia byla na dolní hranici normálního rozmezí. Sedm hodin po přijetí se dostavila arytmie TdP, kterou bylo třeba zrušit elektrickou defibrilací, následná délka QTc kolísala mezi 510 ms a 650 ms. V následujících 16 dnech bylo trvale intravenózně podáváno magnesium sulfuricum v dávce až 6000 mg denně, přesto se nepodařilo plazmatické koncentrace magnézia dostatečně zvýšit, interval QTc byl v rozmezí 470–720 ms a pacient musel být šestkrát defibrilován pro TdP. Šestnáctý den bylo podávání pantoprazolu ukončeno, potřeba magnesium sulfuricum klesla na 2 000 mg denně, interval QTc se spontánně zkrátil na průměrnou hodnotu 457 ms a arytmie TdP již nebyla pozorována. Koronarografií nebylo zjištěno žádné kardiovaskulární onemocnění a po měsíci bez příhod činilo QTc pouze 380 ms.
Hoorn et al. [5] popsali čtyři případy hypomagnezémie v rozmezí 0,06–0,68 mEq/l způsobené PPI, z nichž byly podávány esomeprazol 20 mg denně (n = 2), pantoprazol 40 mg denně (n = 1), omeprazol 40 mg denně (n = 1) a rabeprazol 20 mg denně (n = 1). U dvou z pacientů došlo k velmi významnému prodloužení z 391, respektive 386 ms, na 491 ms, respektive na 463 ms. Zajímavé je, že suplementací minerály nebylo možno dosáhnout normálních hodnot plazmatických koncentrací magnézia, vždy bylo třeba ukončit podávání PPI.
Ve studii hlášení nežádoucích účinků FDA Luk et al. [6] prokázali, že inhibitory protonové pumpy (PPI) zvyšují riziko vzniku hypomagnezémie, přičemž takové riziko bylo nejvyšší při podávání pantoprazolu, a to 4,3krát (3,3–5,7 na 95% hladině spolehlivosti, p < 0,001). Zipursky et al. [7] zvýšení rizika hypomagnezémie potvrdili a jako přídatný rizikový faktor u uživatelů PPI odhalili současné užívání diuretik. Z toho je mimo jiné patrné, že otázka minerálů v krvi a jejich vyšetřování je stále živá i ve vyspělých státech světa a že tato vyšetření jsou zřejmě i tam občas zanedbávána. Dlouhodobé podávání inhibitorů protonové pumpy by mělo být alespoň 1krát ročně provázeno vyšetřením mineralogramu včetně plazmatických koncentrací magnézia.
Na okraj doplňujeme, že rizikovým faktorem vzniku arytmie TdP je současné podávání dvou nebo více léků, které mohou TdP způsobit (viz výše). Proto se doporučuje nejen vyšetření mineralogramu, ale též EKG před a několik dní po nasazení takové lékové kombinace. Jak bylo výše uvedeno, při vynaložení určité námahy pojišťovny mohou takové informace z lékových záznamů pacienta vyčíst a zjistit, jak určitá pracoviště lékařů toto opatření dodržují. Ze zahraničních zkušeností je zřejmé, že řada lékařů si není takového rizika vědoma, ačkoliv výrobci rizikových léků na nebezpečí upozorňují a monitorování EKG doporučují.
HYPERKALÉMIE
Hyperkalémie znamená plazmatické koncentrace kalia vyšší než 5,0 mEq/l (respektive mmol/l), klinicky významná hyperkalémie je stav, kdy kalium v séru je vyšší než 6,0 mEq/l. Čím rychleji kalémie stoupá, tím je nebezpečnější. Pacient s chronickou hyperkalémií v rozmezí 6,0–6,5 mEq/l může být léčen ambulantně, ale kalémie nad 6,5 mEq/l zpravidla vyžaduje hospitalizaci a zjištění hodnot nad 7,0 mEq/l je třeba považovat za urgentní situaci, kdy hrozí fatální srdeční arytmie. Hyperkalémie bývá způsobena selháním ledvin, zvýšeným přísunem kalia potravou nebo léky snižujícími vylučování kalia. Snížené vylučování kalia způsobuje amilorid, antagonisté receptorů pro mineralokortikoidy (MRA), tedy spironolakton a eplerenon, a léky ovlivňující osu renin-angiotenzin (RAAS), jako jsou ACE-inhibitory a antagonisté angiotensinu II (ARB). Dalším rizikovým faktorem pro vznik hyperkalémie je současné podávání nesteroidních antiflogistik (NSA).
MRA i léky ovlivňující RAAS jsou nezbytnou součástí terapie srdečního selhání i hypertenze, neboť existují jasné důkazy, že tyto léky snižují mortalitu určitých skupin pacientů. To bylo pro spironolakton prokázáno v roce 1999 ve studii RALES, Pitt et al. [8] a pro eplerenon v roce 2003 ve studii EPHESUS [9] a dále ve studii EMPAHIS-HF [10]. Ve všech těchto studiích byly MRA podávány spolu s léky RAAS. Zatímco v uvedených klinických studiích byli pacienti pravidelně vyšetřováni a kalémie byla pečlivě sledována, v běžné lékařské praxi byla situace jiná. První důkladný rozbor situace v reálné klinické praxi provedli Wrenger et al. v roce 2003 [11] a o rok později zveřejnili Juurlink et al. 2004 [12] výsledky rozsáhlé populační studie. Po zveřejnění studie RALES preskripce spironolaktonu stoupla ze 34/1000 na 149/1000 pacientů, úmrtí na hyperkalémii stouplo z 0,3/1000 na 2,0/1000 pacientů, což by v Kanadě (kde sledování proběhlo) znamenalo 171 úmrtí na hyperkalémii navíc (!). V roce 2010 Wei et al. [13] v jednom z regionů Skotska po publikaci RALES zjistili nárůst mírné hyperkalémie (do 6 mEq/l), avšak nikoliv statisticky významný nárůst závažnější hyperkalémie. Autoři to přisuzují pečlivějšímu monitorování kalémie než v jiných zemích (což by bylo možno přisoudit lepší podpoře účelné farmakoterapie, kterou Národní zdravotní služba ve Velké Británii provádí). Do tohoto optimistického obrazu příliš nezapadá zjištění provedené v jiné části Velké Británie, v okolí města Swansea (Wales), publikované Dinsdale C. et al. [14]: u 64 seniorů starších 75 let (průměrně 85 let) léčených ACE-I a spironolaktonem zmínění autoři nalezli kalémii 5,5 mEq/l a více u 23 pacientů (36 %), nad 6,0 mEq/l u 7 pacientů (11 %). Pouze u 45 % pacientů bylo prováděno monitorování urey, kreatininu a elektrolytů podle stejného rozvrhu jako ve studii RALES. Z toho vyplývá, že když dva dělají totéž, není to totéž a výsledky mohou být rozdílné.
Ukázalo se, že v běžné klinické praxi je riziko vzniku závažné hyperkalémie vyšší než ve studiích klinických, proto autoři Zannad et al. [15] zkoumali důvody tohoto rozdílu. Zjistili, že populace pacientů zařazených do klinických studií byla mladší, renální funkce a kalémie byly pečlivě monitorovány a pacientům reagujícím na léčbu hyperkalémií spironolaktonem byla dávka spironolaktonu včas snížena, nebo bylo podávání spironolaktonu ukončeno (tab. 1).
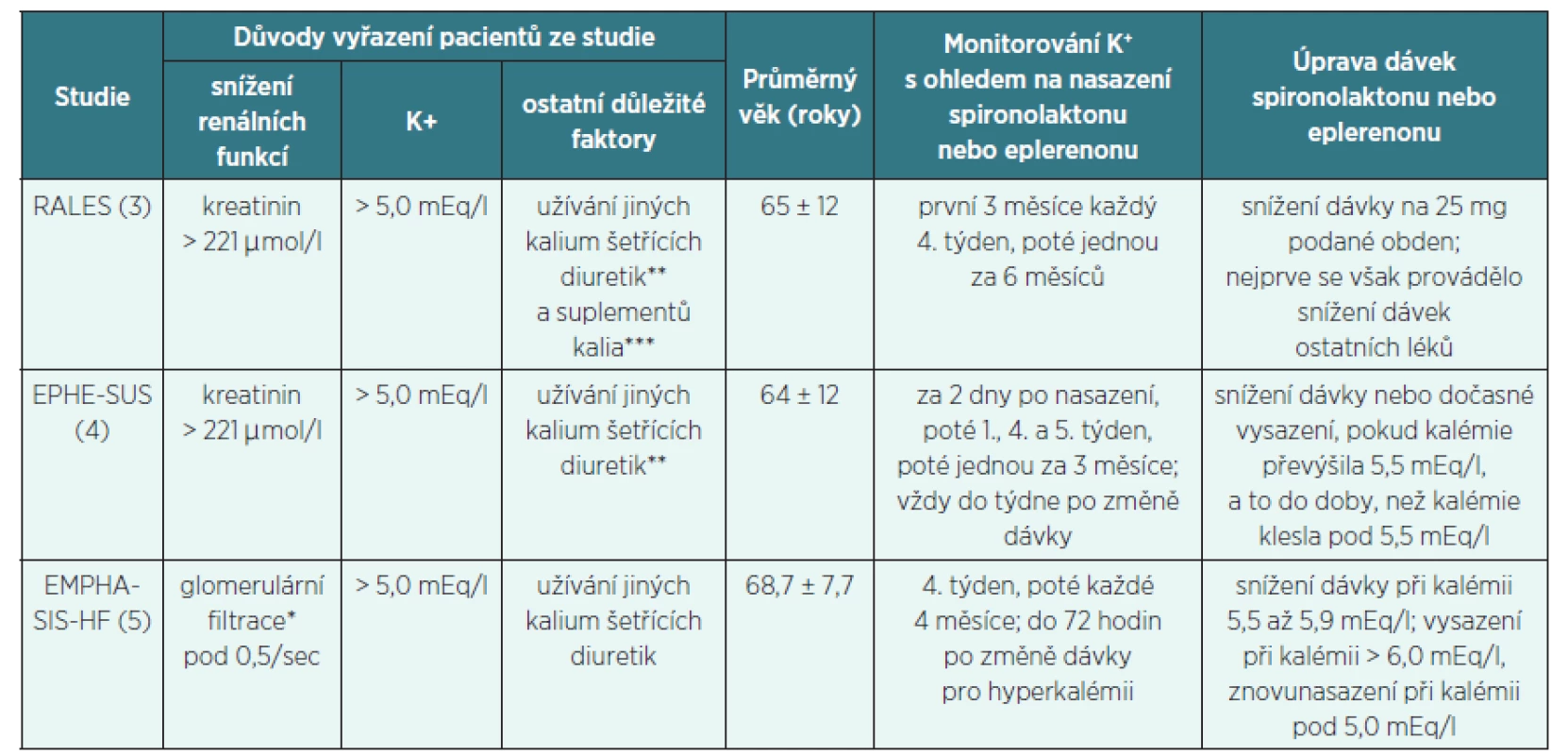
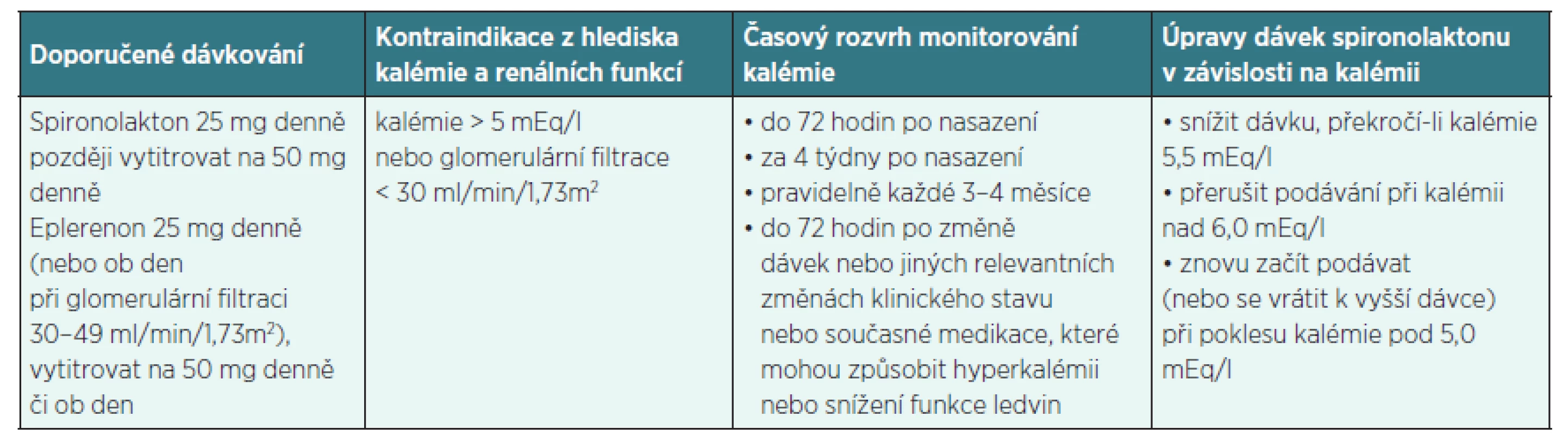
Doporučený postup České kardiologické společnosti [16] uvádí, že spironolakton i eplerenon by měly byt používány u nemocných s adekvátní renální funkcí a normální kalémií. Po zahájení jejich podávání je nezbytné pravidelné monitorování renálních funkcí a sérových elektrolytů. Jak často je třeba tato vyšetření provádět není specifikováno ani doporučenými postupy, ani SPC jednotlivých přípravků, určité vodítko poskytuje tabulka 2, vytvořená podle výše zmíněné práce Zannada et al. [15].
ZAHRANIČNÍ ZKUŠENOSTI S MONITOROVÁNÍM LABORATORNÍCH VYŠETŘENÍ
Na webových stránkách PubMed lze nalézt řadu studií, které se zabývají rozbory preskripce a podporou účelné a bezpečné farmakoterapie. Uvádíme dvě taková sdělení pojednávající o frekvenci provádění potřebných laboratorních vyšetření u pacientů užívajících léky, které ovlivňují plazmatické koncentrace kalia, v reálné klinické praxi.
V prvním sdělení autoři Bootsma et al. [17] v Nizozemí v oblasti Groesbeek s 19 000 obyvateli zjišťovali, jak často lékaři vyšetřují kalémii a hodnoty plazmatického kreatininu u pacientů, jimž jsou nově nasazena léčiva ovlivňující RAAS, tedy ACE-inhibitory a ARB. Bylo zjištěno 202 pacientů průměrného věku 63 let, u nichž byl v roce 2006 poprvé podán takový lék, a to především pro hypertenzi a pro srdeční selhání. Sledovaní lékaři ve zvláštním dotazníku tvrdili, že u svých pacientů pravidelně kontrolují kreatinin do dvou týdnů od nasazení takových léků a 88 % lékařů uvedlo, že považují takové vyšetření za důležité nebo velmi důležité. Objektivně však bylo zjištěno, že v období tří měsíců před nasazením ACE-inhibitoru nebo ARB byl kreatinin vyšetřen pouze u 60 % pacientů a kalémie pouze u 56 % pacientů a že do tří měsíců po nasazení uvedených léků byl kreatinin vyšetřen pouze u 53 % pacientů a kalémie pouze u 46 % pacientů, což ostře kontrastuje s údaji poskytnutými samotnými lékaři.
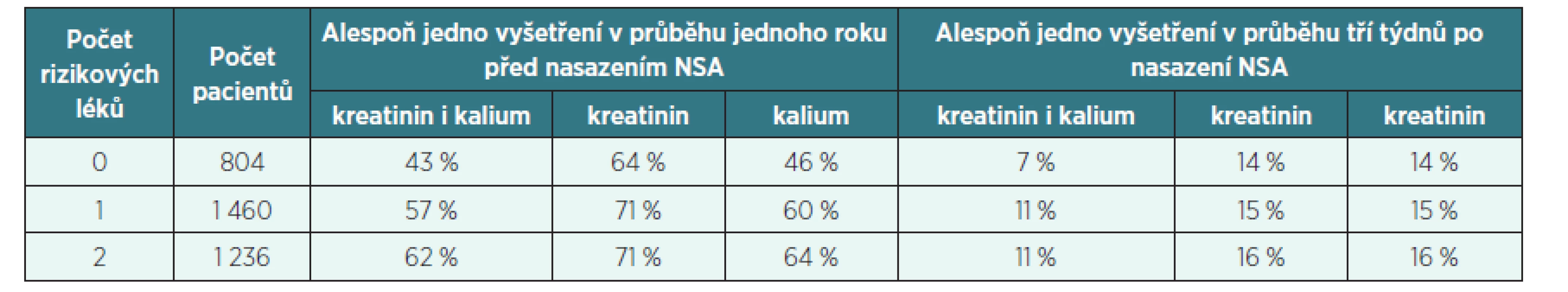
Ve druhém sdělení autoři Fournier et al. [18] popisují frekvenci vyšetřování kalémie a plazmatického kreatininu u pacientů s hypertenzí, u nichž byla nově nasazena léčba NSA. Tato vyšetření je totiž vhodné provádět zejména v případě, že je podávání NSA nově započato u pacientů dlouhodobě užívajících léky RAAS a/nebo diuretika, neboť uvedená kombinace zvyšuje frekvenci renálního selhání, a to 5,27krát při podání dvou z uvedených skupin léků a 16,46krát při podání všech tří lékových skupin současně, jak naposled prokázali Fournier et al. [19]. Navíc podávání NSA je přídatným rizikovým faktorem pro vznik hyperkalémie při podávání léků RAAS. Nad Francouzskou databází účtů zdravotních pojišťoven v regionu s 2,6 miliony obyvatel bylo proto zjišťováno, jak často u takových pacientů lékaři vyšetřují hodnoty plazmatického kreatininu a kalémii. Tabulka 3 ukazuje frekvenci těchto vyšetření jak u pacientů bez rizikových faktorů, tak u pacientů s jedním rizikovým lékem (s diuretikem nebo s lékem RAAS) a u pacientů se dvěma či více rizikovými léky (s diuretikem a s jedním nebo více léky RAAS). Z tabulky 3 je patrné, že laboratorní vyšetření byla indikována nedostatečně a že by bylo vhodné lékaře o lékových rizicích lépe informovat.
DISKUSE A POZNÁMKY PRO PRAXI
Z výše uvedených zahraničních studií vyplývá, že lékaři podceňují léková rizika a že přeceňují své schopnosti indikovat potřebná laboratorní vyšetření. Někteří se mylně domnívají, že podávání kalium-šetřícího diuretika s thiazidovým diuretikem nebo furosemidem je zárukou normálních hladin kalia nebo že přidání thiazidu ke kombinaci ACE-I se spironolaktonem zabrání hyperkalémii, opakovaně byl prokazován opak takových tvrzení. Tak jako v zahraničí i u nás se řada lékařů účastní vzdělávacích akcí provozovaných zejména lékařskými organizacemi, ale je otázkou, zda jsou na nich dostatečně probírány nejen přínosy léků (na což výrobci kladou důraz), ale i léková rizika a zda lékaři doporučená opatření skutečně uplatní ve své každodenní praxi. Ve vyspělých státech byl opakovaně potvrzen efekt vzdělávacích akcí v případě, že lékaři současně obdrželi rozbor své preskripce, který každému lékaři ukázal, do jaké míry postupuje podle doporučených postupů a kde by mohl svou práci ještě zlepšit. Řada lékařů má totiž pocit, že předepisují vždy 100% správně a bezpečně. Bohužel provádění rozborů preskripce se (až na výjimky) v ČR neděje, a tak data zdravotních pojišťoven zůstávají v tomto směru nevyužita. Do jisté míry je to i proto, že odborné společnosti i jiné profesní organizace lékařů někdy pohlíží s nedůvěrou na údaje zdravotních pojišťoven a neuvědomují si, že lékaři potřebují zpětnou vazbu toho, co činí. Stejně tak, jako zpětnou vazbu potřebují všichni ostatní lidé, kteří touží po zdokonalování se, ať jsou to učitelé, řidiči, ředitelé bank, piloti a jiní. Navázání a udržování kontaktů mezi zdravotními pojišťovnami a lékaři je součástí zdravotní politiky zdravotních pojišťoven a tedy přesahuje kompetence jednotlivých revizních lékařů. V případě pozitivního rozhodnutí vedení pojišťovny by však mohli revizní lékaři vnést racionalitu do takového konání, přičemž se nesmí se zapomínat na následující body:
- Pečlivě si akci naplánovat s ohledem na možnosti výpočetního systému konkrétní pojišťovny a času jejich pracovníků.
- Konzultovat příslušné odborné společnosti a dopracovat podrobnosti (podobně jako v případě kontroly ne příliš jasných indikačních omezení „P“).
- Vytvořit algoritmus hledání a identifikace situací, kdy laboratorní vyšetření evidentně mělo být provedeno a nebylo.
- Interpretace nálezů a vhodný způsob informování příslušných lékařů.
- Návaznost na ostatní vzdělávací programy lékařů nebo podobné akce; izolované a jednorázové akce pojišťoven mohou sice přinést zajímavé výsledky, ale trvání dosažených zlepšení preskripce je sporné.
Závěrem autoři tohoto sdělení děkují čtenářům, že dočetli článek až do konce a přejí jim, aby tuto inspiraci mohli ve své praxi uplatnit.
Adresa pro korespondenci:
MUDr. Michal Prokeš
INFOPHARM
Hvožďanská 2053/3
148 00 Praha 4
Zdroje
1. McKibbin, J. K. et al. Br. Heart J., 1984, 51, p. 157–162.
2. Digby, G. et al. Cardiology Journal, 2010, 17, p. 184–188.
3. Morgan, D. B., Davidson, C. Br. Med. J., 1980, 280, p. 905–908.
4. Bibawy, J. N. et al. Circ. Arrhythm. Electrophysiol., 2013, 6, e17-e19. doi: 10.1161/CIRCEP.112.000101.
5. Hoorn, E. J. et al. Am. J. Kidney Dis., 2010, 56, p. 112–116.
6. Luk, C. P., Parsons, R., Lee, Y. P., Hughes, J. D. Proton pump inhibitor-associated hypomagnesemia: what do FDA data tell us? Ann. Pharmacother., 2013, 47, 6, p. 773–780.
7. Zipursky, J. et al. PLOS Med., 2014, 11, 9, e1001736, http://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1001736.
8. Pitt, B., Zannad, F., Remme, W. J. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N. Engl. J. Med., 2009, 341, p. 709-717.
9. Pitt, B., Remme, W. J., Zannad, F. et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N. Engl. J. Med., 2003, 348, p. 1309–1321.
10. Zannad, F., McMurray, J. J., Krum, H. et al. Eplerenone in patiens with systolic heart failure and mild symptoms. N. Engl. J. Med., 2011, 364, p. 11–21.
11. Wrenger, E., Müller, R., Moesenthin, M. et al. Interaction of spironolactone with ACE-inhibitors or angiotensin receptor blockers: analysis of 44 cases. BMJ, 2003, 327, p. 147–149, http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1126510/.
12. Juurlink, D. N., Mamdani, M. M., Lee, D. S. et al. Rates of hyperkalemia after publication of the randomized aldactone evaluation study. N. Engl. J. Med., 2004, 351, p. 543–551.
13. Wei, L., Strthers, A. D., Fahey, T. et al. Spironolactone use an renal toxicity: population based longitudinal analysis. BMJ, 2010, 340, c1768.
14. Dinsdale, C., Wani, M., Steward, J. et al. Tolerability of spironolactone as adjunctive treatment for heart failure in patients over 75 years of age. Age Aging, 2005, 34, p. 395–398.
15. Zannad, F., Stough, W. Q., Rossignol, P. et al. Mineralocorticoid receptor antagonists for heart failure with reduced ejection fration: integrating evidence into clinical practice. Eur. Heart J., 2012, 33, p. 2782–2795.
16. Česká kardiologická společnost: Souhrn doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání – 2012. http://www.kardio.cz/index.php?&desktop=clanky&action=view&id=1119.
17. Bootsma, J. E. M., Warlé-van Herwaarden, M. F., Verbeek, A. L. M. et al. Adherence to biochemical monitoring recommendation in patients starting with renin-angiotensin systém inhibitors: a retrospective cohort study in the Netherlands. Drug Saf., 2011, 34, 7, p. 605–614.
18. Fournier, J. P., Lapeyere-Mestre, M., Sommet, A. et al. laboratory monitoring of the patients treated with antihypertensive drugs and newly exposed to non steroidal anti-inflammatory drugs: A cohort study. PLoS One, 2012, 7, 3, e34187. doi: 10.1371/journal.pone.0034187. Epub 2012 Mar 27. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0034187
19. Fournier, J. P., Sommet, A., Durrieu, G. et al. More on the „Tripple Whammy“: antihypertensive drugs, non-steroidal anti-infalmmatory agents and scute kidney injury – a case/non-case study in the French pharmacovigilance database. Renal Fail, 2014, 36, 7, 1166–1168.
Štítky
Posudkové lekárstvo Pracovné lekárstvoČlánok vyšiel v časopise
Revizní a posudkové lékařství

2015 Číslo 2
Najčítanejšie v tomto čísle
- Chronická obstrukční plicní nemoc a astma bronchiale v posudkovém lékařství
- Léky a doporučená laboratorní vyšetření – máme vše skutečně pod kontrolou?
- Průkazy osob se zdravotním postižením a jiné otazníky
- Některé problémy lékařské posudkové služby z pohledu právníka
