Metachronní plicní metastázy mamárního karcinomu nebo duplexní malignita? Pohled chirurga a onkologa − kazuistika
Metachronous lung metastases of mammary carcinoma, or dual malignancy? A surgeon’s and oncologist’s point of view − case report
Synchronous and metachronous metastases significantly diminish the possibility of remission from cancer. Therefore, therapy needs to be highly effective and strictly individualised. The authors present a case report of a female patient after radical mastectomy due to breast cancer with incidental detection of peripheral lung carcinoid. The aim of the case report is to inform about current trends in primary lung carcinoid therapy through a surgeon’s and oncologist’s point of view.
Keywords:
breast carcinoma – metastasectomy − lung carcinoid − surgical and oncological therapy
Autori:
M. Benej 1; H. Čoupková 2; I. Čapov 1; S. Haruštiak 3; J. Wechsler 1; J. Halámková 2
Pôsobisko autorov:
I. chirurgická klinika LF MU a FN u sv. Anny v Brně, přednosta: prof. MUDr. I. Čapov, CSc.
1; Klinika komplexní onkologické péče, MOÚ, ředitel: prof. MUDr. J. Vorlíček, CSc., Dr. h. c.
2; Klinika hrudníkovej chirurgie FNsPBA – Ružinov, Bratislava, SR, přednosta: prof. MUDr. S. Haruštiak, CSc.
3
Vyšlo v časopise:
Rozhl. Chir., 2014, roč. 93, č. 10, s. 516-519.
Kategória:
Kazuistika
Práce je věnována prof. MUDr. Svetozárovi Haruštiakovi, CSc. k významnému životnímu jubileu.
Súhrn
Synchronní a metachronní metastázy výrazně zhoršují pravděpodobnost dosažení remise onkologického onemocnění. Jejich terapie proto musí být maximálně účelná a přísně individuální. Autoři prezentují kazuistiku pacientky po radikální mastektomii pro karcinom prsu s incidentálním záchytem periferního plicního karcinoidu. Cílem práce je formou kazuistiky poukázat na aktuální trendy v léčbě primárního plicního karcinoidu očima chirurga a onkologa.
Klíčové slova:
karcinom prsu – metastazektomie − plicní karcinoid − chirurgická a onkologická léčba
Úvod
Problematika onkologických onemocnění je komplexní medicínský problém, který vyžaduje multioborový přístup. Synchronní a metachronní metastázy výrazně zhoršují pravděpodobnost dosažení remise [1,2,6,8]. I přes rozvoj „farmakoonkologie“ v posledních letech zůstává chirurgie ústředním pilířem ve strategii léčby. Základním principem v plicní „metastazektomii“ je resekce ložiska s dostatečným bezpečnostním lemem při snaze o maximální protekci reziduálního parenchymu [11,16,17,19,22,23]. Anatomické resekce ve smyslu lobektomie nebo pneumonektomie (raritně) se provádějí jenom u centrálně lokalizovaných metastáz, které nelze ošetřit extraanatomickou resekcí. Jako nezbytné se v současné době jeví kryotomová peroperační histologizace, která má potenciál vyloučit duplexní malignitu.
Kazuistika
66letá pacientka po radikální pravostranné mastektomii v roce 2010 pro multicentrický invazivní lobulární karcinom pravého prsu (se složkou LCIS a DCIS G2 s diskontinuálním charakterem růstu, bez lymfangioinvaze se střední proliferační aktivitou, bez overexprese HER-2 proteinu), byla pooperačně dispenzarizována onkologem. V čase stanovení diagnózy byla bez známek diseminace onemocnění. V následné době byl opakovaně proveden restaging onemocnění, který byl rovněž bez záchytu lokoregionální recidivy nebo vzdálené metastázy. Pooperačně byla pacientka zajištěna anostrozolem. V roce 2013 dochází k rozvoji nespecifického kašle, v důsledku kterého bylo doplněno vyšetření plic pomocí výpočetní tomografie (CT), kde byla nalezena 2 kulovitá ložiska bez spikulace, která jsou lokalizována na obou stranách v oblasti rozhraní IV. a V. segmentu [Obr. 1,2]. Doplněno vyšetření pomocí pozitronové emisní tomografie (PET) s následnou fúzí s CT, které potvrzuje hypermetabolickou aktivitu ložiska vlevo [Obr. 3]. Dle radiologa se nejpravděpodobněji jedná o metastázy. Vzhledem k nutnosti jejich histologické verifikace a snaze o miniinvazivitu byla provedena sekvenčně punkční biopsie ložisek pod CT, avšak histologicky byla v punktátu přítomna pouze fibrózně demarkovaná nekrotická tkáň. V důsledku patologické akumulace 18F-fluordeoxyglukózy (FDG) na PET vyšetření s předpokladem přítomnosti viabilních nádorových buněk i CT charakteristickým obrazem bylo rozhodnuto o torakoskopické revizi zleva. Ložisko se však v hloubce parenchymu nepodařilo lokalizovat, proto byla provedena minitorakotomie s následnou palpační verifikací ložiska. Vzhledem k „mediastinálnímu“ uložení se jenom obtížně daří provést extraanatomickou resekci ložiska pomocí stapleru, v podstatě ve smyslu „lingulektomie“. Výkon je proto dokončen i podvazem lingulárních arterií a vény. Resekát odeslán k akutnímu kryotomovému vyšetření, kde patolog nalézá přítomnost maligních buněk karcinomu, které však neodpovídají buňkám primárního plicního karcinomu. Operační výkon proto dále nerozšiřován a ukončen. Pooperační období bylo bez komplikací a pacientka byla 4. den propuštěna do domácí péče. Dle definitivní histologie se překvapivě nejednalo o metachronní metastázu mamárního karcinomu, ale o periferní typický karcinoid (T1aN0Mx dle TNM 7. revize). Po domluvě s onkology nebyla indikována následná lobektomie s časovým odstupem. Vzhledem k obavám pacientky stran etiologie kontralaterálního ložiska byla za 5 týdnů od primární operace provedena klínovitá, extraanatomická resekce ložiska na pravé straně. Histologicky se jednalo o demarkované nekrotické ložisko. Pacientka je nyní 6 měsíců od operace nadále v onkologickém sledování bez známek recidivy onemocnění.
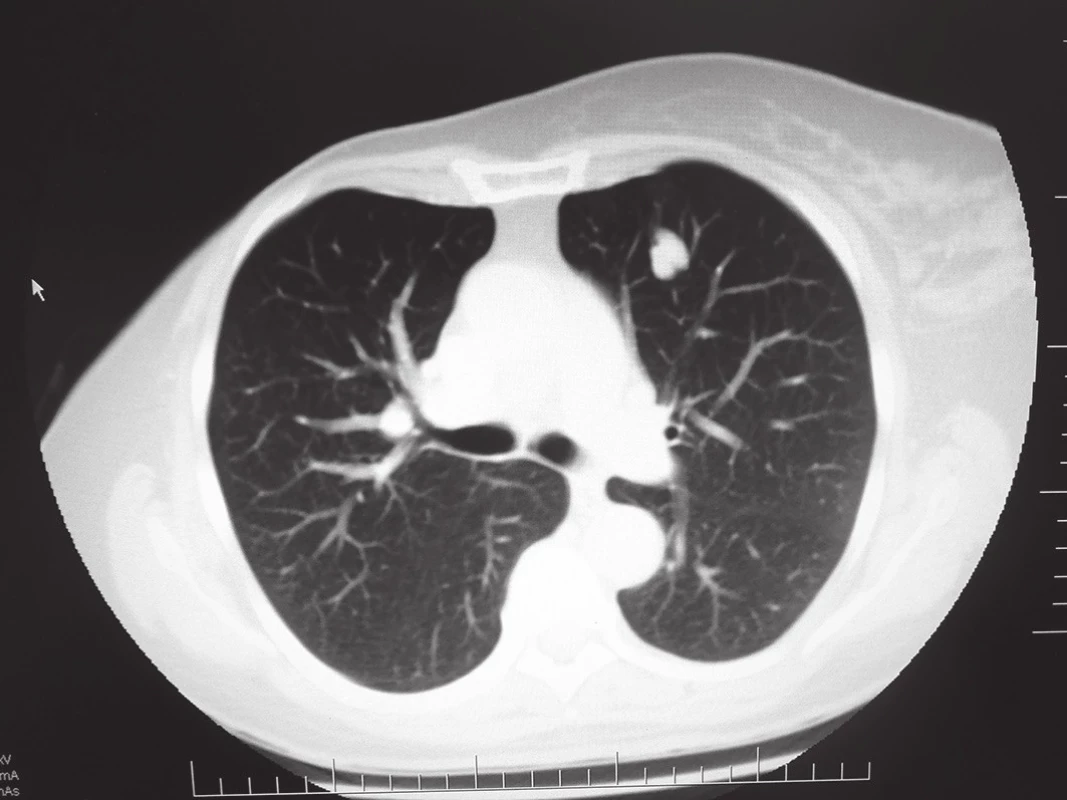
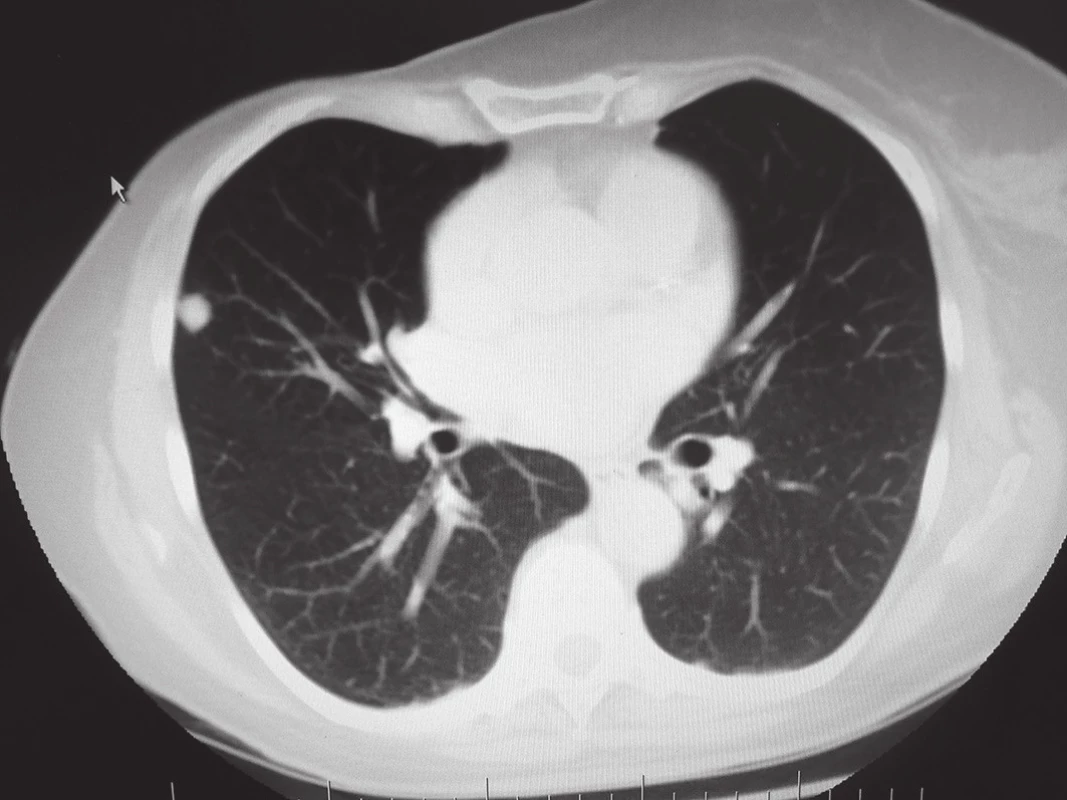
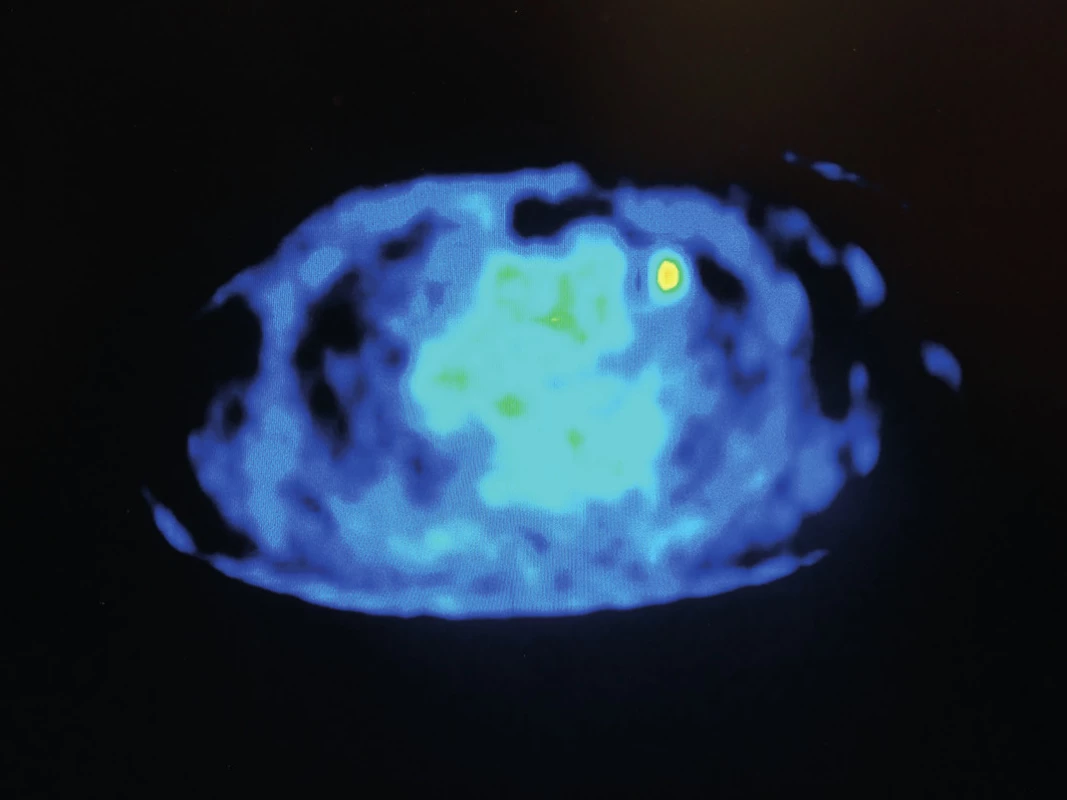
Historie
Vzhledem k poměrné vzácnosti výskytu nádoru a obtížnosti histopatologické diagnostiky je historie karcinoidu relativně mladá. Vůbec první záznam o „nádoru“, který se liší od konvenčního plicního karcinomu, pochází z roku 1831 od Laenneca, avšak detailní histopatologický opis zaznamenal v roce 1888 Lubarsch [2,14]. Samotný termín karcinoid byl však zaveden Oberdorferem až v roce 1907, kdy byl popsán jako tumor plicního origa s nízkým maligním potenciálem. Pochopení jeho „biologického chování“ umožnilo rozpracovat chirurgickou strategii léčby. Prvenství je přisuzováno americkému hrudnímu chirurgovi Leovi Eloesserovi, který jako první úspěšně provedl resekci tumoru z bronchotomie v roce 1939 [14,16,28].
Diskuze
Plicní karcinoidy jsou maligní nádory patřící k neuroendokrinním tumorům (NET). Jsou poměrně vzácné, tvoří 1−2 % všech plicních tumorů s incidencí 1,35/100 000 obyvatel. Pro neuroendokrinní nádory je typická schopnost produkovat biologicky aktivní látky hormonální povahy. Prekurzorovou lézí je hyperplazie buněk neuroendokrinního systému a tumorlet. Od typického karcinoidu se liší velikostí (hyperplazie do 2 mm, tumorlet 2−5 mm). Z histologického hlediska se v rámci plicních neuroendokrinních tumorů vyskytuje typický karcinoid (TC), atypický karcinoid (AC), malobuněčný karcinom (SCLC) a velkobuněčný neuroendokrinní karcinom (LNEC). Typický karcinoid je nízce maligní tumor (NEC grade I), u něhož mitotická aktivita nepřesahuje 2 mitózy/10 HPF (2 mm2), bez přítomnosti nekróz. Atypický karcinoid (AC) je nádor středního stupně malignity (NEC grade II), s mitotickou aktivitou 2−10 mitóz /10 HPF (2 mm2), s vyšší proliferační aktivitou Ki67. Velkobuněčný neuroendokrinní karcinom (LNEC) je nádor o vysokém stupni malignity (NEC grade III), s velkými atypickými nádorovými buňkami a mitotickou aktivitou více než 10 mitóz /10 HPF (2 mm2). Malobuněčný karcinom (SCLC) je nádor s vysokou mitotickou aktivitou, s proliferační aktivitou Ki67 přesahující 80 %, s přítomností rozsáhlých nekróz [8,28]. Klinický obraz je dán lokalizací primárního nádoru, rozsahem onemocnění a funkčním stavem nádoru. Převážná část karcinoidů je lokalizována ve velkých dechových cestách a působí nespecifické příznaky způsobené jejich obstrukcí: dušnost, kašel, hemoptýzu, vznik bronchopneumonie za stenózou, bolest na hrudníku. U plicních karcinoidů je vzácný funkční nádor, prezentující se tzv. karcinoidovým syndromem (flush – záchvatovitý erytém obličeje, krku a horní části hrudníku s tachykardií, dušností, poklesem krevního tlaku). Karcinoidový syndrom vzniká při uvolňování hormonálně aktivních látek přímo do systémového oběhu nebo do portálního systému. Je častější u karcinoidů trávicího traktu, kde bývá také provázen průjmy, bolestmi břicha a patologickými kožními projevy. Vzácně se u pacientů objevuje Cushingův syndrom, podmíněný produkcí ektopického adrenokortikotropního hormonu (ACTH). Diagnóza NET je stanovena na základě histologického vyšetření vzorku odebraného z primárního tumoru (event. z metastázy) bronchoskopicky, transthorakální biopsií nebo jinou vhodnou metodou. Součástí histologického vyšetření je imunohistochemický průkaz neuroendokrinní diferenciace (chromogranin, synaptofyzin, CD56). Cytologie není dostatečná pro stanovení diagnózy NET [8]. Stadium onemocnění se určuje podle TNM klasifikace bronchogenních nádorů (t. č. TNM klasifikace zhoubných nádorů – 7. vydání), na základě výsledků zobrazovacích vyšetření. Provádí se RTG a CT vyšetření, octreoscan (scintigrafické zobrazení somatostatinových receptorů), u nízce diferencovaných nádorů může být užitečné vyšetření pozitronovou emisní tomografií (PET), u symptomatických pacientů i scintigrafie skeletu. Z laboratorních metod se vyšetřují nespecifické markery (chromogranin A, neuron-specifická enoláza) a specifické markery (stanovení kyseliny 5-hydroxyindoloctové v moči/24 hodin) u pacientů s vyjádřeným karcinoidním syndromem. U nemocných s Cushingovým syndromem lze vyšetřit kortizol v moči, ACTH v séru, u pacientů s akromegalií somatoliberin (GHRH), insulin-like GF-1 [18].
Léčba NET je volena na základě histologického typu, gradingu, rozsahu onemocnění a funkčního stavu nádoru. U lokalizovaných forem je zvažován chirurgický zákrok, u SLCL a LNEC spíše výjimečně (jen u periferních forem T1-2, N0, M0). U disseminovaných onemocnění je indikována systémová léčba. U dobře diferencovaných, pomalu progredujících metastatických nádorů s vyjádřeným karcinoidovým syndromem je vhodná léčba analogy somatostatinu. U nízce diferencovaných nádorů se používá systémová chemoterapie, její výsledky však nejsou dosud uspokojivé. U nádorů SCLC, LNEC je účinná kombinace platinového derivátu a etoposidu, u TC a AC jsou vhodné kombinace se streptozotocinem, 5-fluorouracilem, capecitabinem, doxorubicinem, dacarbazinem nebo temozolomidem. Nové léky (sunitinib, everolimus) se u plicních karcinoidů v běžné klinické praxi neindikují, byly použity jen u malého počtu nemocných v rámci klinických studií NET [18,17,3]. Prognóza TC je příznivá s 5letým přežitím v 87–90 %, i když vzdálené metastázy u resekovaných tumorů se mohou objevit i po mnoha letech. AC je spojen s horší prognózou s 5letým přežitím v 44–78 %. 5leté přežití u LCNEC se pohybuje v rozmezí 15–57 %, u SCLC jen u 5 % nemocných [18].
Chirurgická léčba
Chirurgická léčba plicního karcinoidu je indikována u lokalizovaných forem onemocnění [7,8,9,10,24,26]. Vždy záleží zejména na histologickém typu karcinoidu. U SCLC a LNEC je chirurgická léčba indikována pouze výjimečně u včasných a lokalizovaných forem, avšak i po radikální resekci je prognóza nepříznivá. Jiná je situace u typického (TC) a atypického karcinoidu (AC), kde je resekabilita podstatně vyšší [21,22]. V minulosti se v závislosti na lokalizaci a velikosti nádoru doporučoval výkon minimálně v rozsahu lobektomie, bilobektomie nebo pneumonektomie [1,10,14]. Je to podmíněno i typickou centrální lokalizací tumoru, často uvnitř velkých dechových cest [15]. Periferní drobné karcinoidy se vyskytují spíše raritně [4]. Vzhledem k jejich „biologickému chování“ je nejen u centrálních tumorů snaha o parenchym šetřící výkony [15]. Typickým výkonem u centrálních forem plicních karcinoidů je tzv. „manžetová neboli sleeve resekce“ tumoru přes bronchotomii s resekcí části hlavní průdušky a následnou bronchoplastikou. Nejčastější formou je „manžetová resekce“ levého horního laloku [9,10,12,14,29]. Další formou sublobárních resekcí jsou segmentární resekce. Původně jsou rezervovány pro funkčně limitované pacienty, kteří nebyli schopni podstoupit rozsáhlejší anatomickou resekci. I přes to, že se jedná o technicky „náročnější“ operaci, lze pak dosáhnout celkového výraznějšího benefitu pro pacienta. Rozměrově větší tumory je možno odstranit i resekcí více segmentů najednou. Horní trisegmentektomie a dolní bisegmetektomie, tedy „lingulektomie“ u levého horního laloku, je typickým příkladem [4,6,22,23,25]. U histologicky prokázaného lokálně pokročilého karcinoidu je možno provést i extenzivnější výkony na velkých dechových cestách ve smyslu resekce trachey, nebo i „segmentální karinální resekce“ bez obav o dostatečnou onkologickou radikalitu. V současné době je diskutabilní rozsah resekce u malých periferních typických karcinoidů. Problémem je i jejich předoperační, nebo intraoperační histologizace, kdy patolog často nedokáže odlišit buňky karcinoidu od buněk karcinomu u peroperačního kryotomového vyšetření [28,29].
Závěr
Duplexní malignity představují multidisciplinární terapeutickou výzvu. Vyžadují důsledné zvážení jednotlivých kroků „diagnosticko-terapeutického procesu“ se snahou dosáhnout co nejvýraznějšího benefitu pro pacienta. U karcinoidů je prognóza onemocnění závislá na histologickém subtypu, prorůstání do okolních struktur a eventuální přítomnosti vzdálených metastáz v čase diagnózy [6,14,22,27]. K dosažení remise, nebo alespoň onkologické stabilizace onemocnění je nutná individualizace terapie a cílená kooperace jednotlivých složek onkologického týmu. Proto je vhodné tyto pacienty „koncentrovat“ do onkologických center s dostatečnou zkušeností s managementem tohoto onemocnění.
MUDr. Michal Benej
Herčíková 16
612 00 Brno
e-mail: michalbenej@gmail.com
Zdroje
1. Alper T, Zusuf B. Bronchial sleeve resections for carcinoid tumor in the first decade of life: Interactive Cardiovascular and Thoracic Surgery 2004;3:280−282.
2. Arrigoni MG, Woolner LB. Atypical carcinoid tumors of the lung. J Thorac Cardiovasc Surg 1972;64:413−421.
3. Bajetta E, et al. 5-Fluorouracil, dacarbazine, and epirubicin in the treatment of patients with neuroendocrine tumors. Cancer 1998;83:372−378.
4. Bini A, Brandolini J, Cassanelli N. Typical and atypical pulmonary carcinoids: our institutional experience. Interact Cardio Vasc Thorac Surg 2008;7:415−418.
5. Cardillo G, Sera F, Martino Di. Bronchial carcinoid tumors: nodal status and long term survival after resection. Ann Thorac Surg 2004;77:1781−1788.
6. Čapov I, a spol. Chirurgie orgánových metastáz. Praha, Galén 2008:181.
7. Detterbeck F, Puchalski J, Rubinowitz A, Cheng D. Classification of the Thoroughness of Mediastinal Staging of Lung cancer. Chest 2010;137:436−442.
8. Dundr P, Hornychová H, Matěj R, Ryška A, Staněk L, a spol. Doporučený postup pro histologické vyšetření karcinomu plic. Společnost českých patologů, ČLS JEP 2013.
9. Granberg D, Eriksson B, Wilander E. Experience in treatment of metastatic pulmonary carcinoid tumors. Ann Oncol 2001;12:1383−1391.
10.. Hage R, Brutel de la Riviere A, Seldenrijk C, et al. Update in pulmonary carcinoid tumors: A review article. Annals of Surgical Oncology 2003;10:697−704
11. Hornbech K, Ravn J, Steinbruechel DA. Current Status of Pulmonary Metastasectomy. Eur J Cardiothorac Surg 2011;39: 955−962.
12. Internullo E, Cassivi SD, Van Raemdonck D, et al. Pulmonary Metastasectomy. J Thorac Oncol 2008;3:1257−1266.
13. Jaklitsch MT, Mery CM, Lukanich JM, et al. Sequential Thoracic Metastasectomy Prolongs Survival by Re-establishing Local Control Within the Chest. J Thorac Cardiovasc Surg 2001;121:657−667.
14. Janík M, Lučenič M, Krajč T, Benej R, Haruštiak S. Karcinoid pľúc z pohľadu torakochirurga. Respiro 2008;4:26−31.
15. Mehran RJ, Deslauriers J. Survival related to nodal status after sleeve resection for lun cancer. J Thorac Cardiovasc Surg 1994;107:576−583.
16. Mountain CF, McMurtrey MJ, Hermes KE. Surgery for Pulmonary Metastasis: A 20-Year Experience. Ann Thorac Surg 1984;38:323−330.
17. Öberg K, et al. Cytotoxic treatment in patients with malignant carcinoid tumors. Response to streptozotocin – alone or in combination with 5-FU. Acta Oncol 1987;26:429−432.
18. Öberg K, et al. Neuroendocrine Bronchial and Thymic Tumours: ESMO Clinical Practice Guidelines. Ann Oncol 2012;23 (Suppl 7):120−123.
19. Pastorino U, Buyse M, Friedel G, et al. Long-Term Results of Lung metastasectomy: Prognostic Analyses Based on 5206 Cases. J Thorac Cardiovasc Surg 1997;113:37−49.
20. Pastorino U, Grunenwald D. Surgical Resection of Pulmonary Metastase: Pearson´s Thoracic and Esophageal Surgery. Third Edition, Churchill Livinstone 2008;1795.
21. Pelosi G, Rodriguez J, Viale G, et al. Typical and atypical pulmonary carcinoid tumor overdiagnosed as small-cell carcinoma on biopsy specimens. American Journal of surgical pathology 2005;29:179−187.
22. Pfannschmidt J, Klode J, Muley T, et al. Nodal Involment at the Time of Pulmonary Metastasectomy. Ann Thorac Surg 2006; 81: 448−454.
23. Pfannschmidt J, Muley T, Hoffmann H, Dienemann H. Prognostic Factors and Survival after Complete Resection of Pulmonary Metastases from Colorectal Carcinoma: Experiences in 167 Patients. J Thorac Cardiovasc Surg 2003;126:732−739.
24. Rea F, Rizzardi G, Zurin A, et al. Outcome and surgical strategy in bronchial carcinoid tumors: single institution experience with 252 patients. European Journal of Cardio-thoracic Surgery 2007;31:186−191.
25. Robert JH, Ambrogi V, Mermillod B, et al. Factors Influencing Long-term Survival After Lung Metastasectomy: Ann Thorac Surg 1997;63:777−784.
26. Schützner J, Pafko P, Stolz, A. Rakovina plic − zlepšila se operabilita a prognóza? Praktický lékař 2000;80:533−534.
27. Swensen S, Jett J, Sloan J, et al. Screening for lung cancer with low-dose spiral computed tomography. American journal of respiratory and critical care medicine 2002;165:508−513.
28. Travis WD, Brambilla E, Riely GJ. New Pathologic Classification of Lung Cancer: Relevance for clinical Practice and Clinical Trials. J Clin Oncol 2013; 31:992−1001.
29. Van Schil PE, Schepens MA. Late results of sleeve resection for typical bronchial carcinoid:. Eur J Cardiothor Surg 1994;8:118−21.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicínaČlánok vyšiel v časopise
Rozhledy v chirurgii

2014 Číslo 10
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
Najčítanejšie v tomto čísle
- Pilonidální sinus – možnosti operačního řešení
- Sinus pilonidalis – možnosti chirurgické léčby
- Proč je tumor karotického glomu nebezpečný?
- Laparoskopická modifikovaná Sugarbakerova plastika parastomální hernie u pacientů po abdominoperineální amputaci rekta – pilotní zkušenosti
