-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ireverzibilní elektroporatizace v léčbě lokálně pokročilého karcinomu pankreatu
Irreversible electroporation in the treatment of locally advanced pancreatic cancer
Introduction:
Irreversible electroporation (IRE) is a quite novel method of tissue ablation. Its mechanism of action that does not use thermal energy is the most important feature of the method. Current experience with IRE in animal studies and in clinical practice are summarized in the paper. In particular, the paper is focused on using IRE in locally advanced pancreatic carcinoma.Method:
The basic principle of IRE is that it causes micropores in the phospholipid membrane of cells. This leads to an impairment of cellular homeostasis and programmed cell death – apoptosis. Because of absence of protein denaturation this method spares tubular structures like vessels and ducts. This is the key feature that allows to use IRE in the pancreas where common thermic ablative procedures cannot be used for difficult anatomic circumstances and resulting injury of surrounding structures.Pre-clinical and clinical studies:
The ability to spare vascular structures and ducts was confirmed in many animal studies. Subsequently, IRE was safely utilized also in human liver, pancreas, lung and kidneys. IRE in the treatment of advanced pancreatic cancer: Most experience with IRE ablation has been gathered for locally advanced pancreatic carcinoma where clinical studies published in the recent 5 years have provided encouraging results.Conclusion:
Irreversible electroporation is a safe method used to decrease tumour mass in pancreatic cancer. Further studies are needed to determine its therapeutic efficiency.Key words:
irreversible electroporation − advanced pancreatic cancer
Autori: P. Záruba 1
; D. Hoskovec 2; J. Lacman 3; J. Hořejš 4; Z. Krška 2; M. Ryska 1,5
Pôsobisko autorov: Chirurgická klinika 2. LF Univerzity Karlovy, ÚVN, Praha přednosta: prof. MUDr. M. Ryska, CSc. 1; 1. chirurgická klinika VFN v Praze 1 a 1. LF Univerzity Karlovy přednosta: prof. MUDr. Z. Krška, CSc. 2; Radiodiagnostiké oddělení, ÚVN Praha primář: MUDr. T. Belšan, CSc. 3; Radiodiagnostická klinika VFN v Praze 1 a 1. LF Univerzity Karlovy přednosta: prof. MUDr. J. Daneš, CSc. 4; Fakulta zdravotníctva a sociálnej práce, Trnavská Univerzita, Trnava děkan: prof. MUDr. J. Slaný, CSc. 5
Vyšlo v časopise: Rozhl. Chir., 2015, roč. 94, č. 12, s. 504-509.
Kategória: Souhrnné sdělení
Súhrn
Úvod:
Ireverzibilní elektroporatizace (IRE) je relativně nová metoda tkáňové ablace. Hlavním atributem a největší výhodou oproti jiným metodám je mechanismus působení, který nevyužívá tepelné energie. V tomto souborném sdělení jsou uvedeny současné zkušenosti s experimentálním a klinickým použitím této metody. Cíleně se pak zabývá jejím použitím u lokálně pokročilého karcinomu pankreatu.Metoda:
Podstatou mechanismu je vznik mikropórů v membráně buňky, které poruší nitrobuněčnou homeostázu, to vede k řízené smrti buňky – apoptóze. Absence tepelné denaturace bílkovinných struktur chrání cévy a vývody v okolí ablace. Tato vlastnost je klíčová pro použití této metody u pankreatické tkáně, kde pro komplikované anatomické poměry ostatní, termické metody selhávaly pro vysokou periprocedurální morbiditu a mortalitu.Preklinické a klinické studie:
Schopnost šetřit cévní struktury a žlázové vývody byla ověřena celou řadou animálních experimentů. V klinické, humánní medicíně pak byla bezpečnost metody ověřena na tkáních jater, ledvin, plic a pankreatu. IRE v léčbě pokročilého karcinomu pankreatu: Největší zkušenosti s použitím ireverzibilní elektroporatizace jsou u lokálně pokročilého karcinomu pankreatu, kde klinické studie z posledních 5 let přinášejí povzbudivé výsledky.Závěr:
Ireverzibilní elektroporatizace je bezpečnou metodou použitelnou ke zmenšení tumorózní masy u karcinomu pankreatu. Stanovení její efektivity v léčbě vyžaduje další studie.Klíčová slova:
pokročilý karcinom pankreatu − ireverzibilní elektroporatizaceÚvod
Karcinom pankreatu je zhoubným onemocněním s nepříznivou prognózou. Jde o druhé nejčastější nádorové onemocnění trávicího traktu a Česká republika je na prvním místě incidence v Evropě [1]. Ta má trvale vzrůstající tendenci. Jediným potenciálně kurabilním postupem je radikální chirurgická resekce doplněná o adjuvantní nebo neoadjuvantní terapii. Tento postup přináší nejlepší léčebné výsledky [2]. Průměrné přežití v této skupině se i tak pohybuje kolem 24 měsíců a 5leté přežívání je udáváno do 15 % nemocných. Naneštěstí je takto léčitelných méně než 20 % nemocných. Jedná se o I. a II. klinické stadium. Většina nemocných je diagnostikována ve IV. klinickém stadiu s prokázanou generalizací onemocnění [3,4]. V závislosti na klinickém stavu je u této skupiny pacientů podávána paliativní chemoterapie. Důraz je kladen na symptomatickou terapii. Medián přežití je kolem 6 měsíců. Pro tyto dvě skupiny klinického stadia onemocnění platí způsob léčby uvedený v tzv. Modré knize České onkologické společnosti. III. klinické stadium lokálně pokročilého karcinomu pankreatu, pro které je charakteristická tepenná invaze do společné hepatické tepny, a/nebo horní mezenterické tepny. Je diagnostikováno u 20 až 30 % nemocných. Z léčebného pohledu přitahuje toto stadium značnou pozornost. Jednak proto, že část nálezů v tomto stadiu je možné po agresivní neoadjuvantní chemoterapii nebo chemoradioterapii úspěšně operovat, a proto, že pacienti v tomto stadiu mají delší přežití než ve IV. stadiu. Mimo konvenční postupy systémové a radiační léčby nebo jejich kombinace se v posledních 5 letech objevilo několik publikací o použití nové ablativní metody ireverzibilní elektroporatizace (IRE).
V tomto souhrnném sdělení prezentujeme současné zkušenosti s experimentálním a klinickým použitím této metody. Cíleně se pak zabýváme jejím použitím u lokálně pokročilého karcinomu pankreatu.
Metoda
IRE je netermická ablativní metoda založená na působení krátkých pulzů stejnosměrného proudu o vysokém napětí. Pulzy jsou do tkáně přiváděny dvěma monopolárními nebo jednou bipolární elektrodou. Elektrické pole vysokého napětí vede ke vzniku pórů v buněčné fosfolipidové membráně [5]. Přerušením fyziologického gradientu dojde k narušení homeostázy buněčného prostředí a k řízené smrti buňky − apoptóze. Absence chemicky nebo fyzikálně indukované nekrózy tkáně je jednou z nejdůležitějších vlastností této metody. Pro zajištění nevratného poškození buněčné membrány poratizací je nutná dostatečná energie elektrického pole. V opačném případě dojde k poškození reverzibilnímu. To je používáno k usnadnění průniku léčiv do nitrobuněčného prostoru [6]. Další vlastností IRE je schopnost šetřit tkáně s vysokým podílem pojivové tkáně. Tato vlastnost vyniká v oblasti slinivky břišní, která je pro svůj těsný anatomický vztah ke žlučovodu, portální žíle, horní mezenterické tepně a jaterní tepně pro klasické ablativní postupy nevhodná pro riziko poranění těchto struktur. IRE tyto struktury šetří, a nedochází tak k závažným komplikacím, jako jsou trombóza portální žíly, perforace žlučovodu nebo uzávěr tepenných struktur. Protože metoda nevyužívá tepelné destrukce, odpadá problém s ochlazováním tkáně v blízkosti cévních struktur s vysokým průtokem (heat sink effekt), jako je tomu u radiofrekvenční ablace [7]. Podmínkou pro užití IRE je celková anestezie nemocného s myorelaxací k omezení větších svalových kontrakcí. K malým svalovým záškubům během aplikace může však docházet. Jednotlivé výboje jsou synchronizovány s EKG.
Technické aspekty
„Nanoknife“ je komerčním názvem systému pro provádění IRE, zatím jediným vyráběným firmou Angiodynamics (USA). Sestává z počítačem řízeného generátoru (Obr. 1), součástí je i modul ke snímání EKG k zajištění synchronizace pulzů s absolutně refrakterní fází srdeční kontrakce. Generátor dodává pulzy stejnosměrného proudu o napětí 3000 V a proudu 25−45 A. Každý pulz trvá 20–100 mikrosekund. Jednotlivé pulzy jsou generovány ve skupinách mezi 6−20. Mezi jednotlivými skupinami je interval několika vteřin. Pulzy jsou přiváděny do aplikačních elektrod, jedné bipolární nebo dvou monopolárních (Obr. 2). Úspěch ablace je závislý na jejich správné poloze. Častěji jsou používány monopolární elektrody. Jejich průběh by měl být paralelní, jejich vzdálenost by měla být maximálně 1,5 až 2 cm (Obr. 3). Maximální možná délka exponované části elektrody v její dlouhé ose je také 1−1,5 cm. Oblast ablace při jediné poloze elektrod je pak plochou o průměru 2−3 cm a výšce asi 1 cm [8]. Tato skutečnost nutí často k použití více elektrod a ke změnám jejich polohy [9]. V případě IRE ablací cestou laparotomie je správná poloha elektrod ověřována peroperační ultrasonografií. U perkutánně prováděných ablací (Obr. 4) je poloha elektrod kontrolována UZ nebo CT navigací [10,11]. Doba hospitalizace nemocného se liší podle techniky provedení a přítomnosti komplikací. U perkutánně provedených výkonů je v řádu dní. U ablací otevřenou cestou jsou nemocní hospitalizováni 1−2 týdny v závislosti na výskytu komplikací.
Obr. 1. Generátor elektrických pulzů IRE (Angiodynamics, USA) Fig. 1. Electrical pulses generator of IRE (Angiodynamics, USA) 
Obr. 2. Monopolární elektrody Fig. 2. Monopolar probes 
Obr. 3. Překročení kritické vzdálenosti elektrod vede k porušení homogenity zóny ablace Fig. 3. Homogenity of ablated area is impaired when critical distance of probes is exceeded 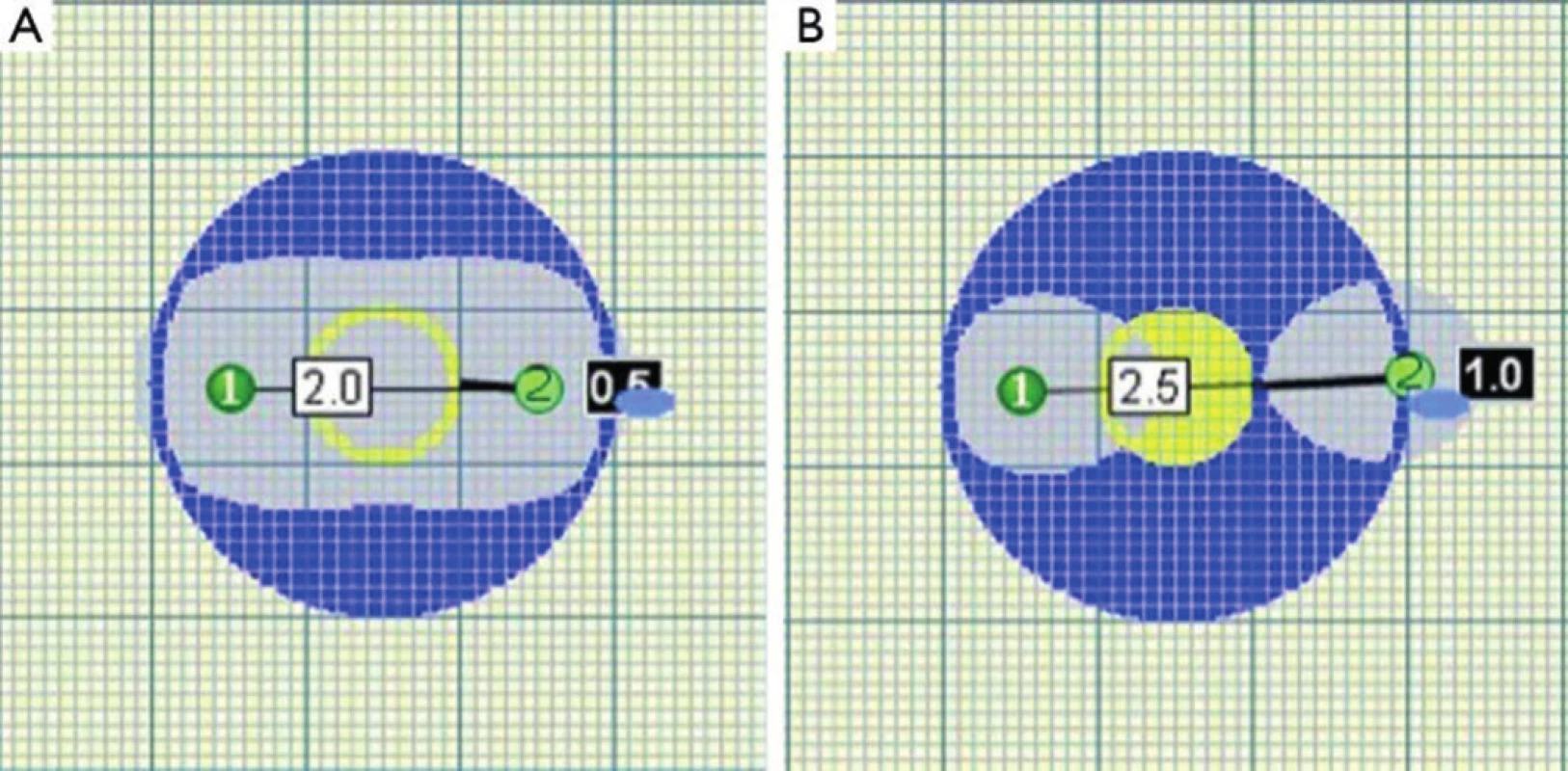
Obr. 4. Perkutánní CT navigovaná IRE ablace Fig. 4. Percutaneous CT guided IRE ablation 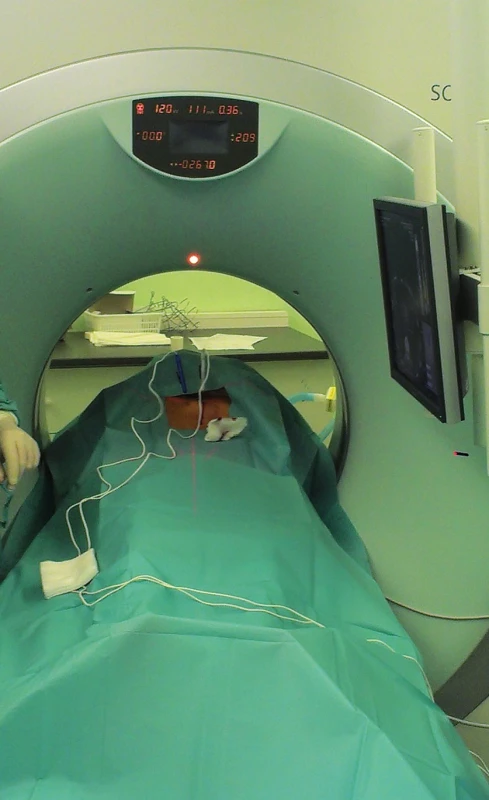
Preklinické studie
Charpentier et al. [12] prezentoval v roce 2011 výsledky aplikace IRE na pankreas u prasečího modelu. V souboru nedošlo k úmrtí, nebyla zaznamenána komplikace spojená s ablací. Z práce vyplynulo, že efektivní poratizace je významně závislá na správném postavení elektrod, respektive jejich vzdálenosti. Již po dvou hodinách od výkonu byla v histologickém obraze patrná zóna ablace. Po 2 týdnech ukázaly preparáty nahrazení abladované tkáně vazivem. Histologická vyšetření také potvrdila odolnost vaskulárních struktur a pankreatického vývodu na působení IRE. Fritz et al. [13] na prasečím modelu při ablaci zdravé pankreatické tkáně hlavy a těla potvrdil bezpečnost této metody. U žádného z probandů nebyla zaznamenána komplikace nebo úmrtí po ablaci. Nebyla zaznamenána pankreatická píštěl, jak dokládá minimální aktivita amyláz v nevýznamném ascitu nalezeném při autopsii. CT provedená již po 60 minutách od ablace ukázala změny parenchymu po působení poratizace. Dunki-Jacobs et al. [14] studoval tepelné změny tkáně během poratizace. Teplota tkáně ve všech místech měření přesáhla teplotu tělesnou. Nejvyšší teplota byla zaznamenána v nejmenší vzdálenosti od ablační elektrody. Multivariační analýza identifikovala ledvinnou tkáň, délku zavedení elektrody a přítomnost kovového materiálu v blízkosti elektrody jako proměnné signifikantně zvyšující riziko termického postižení. Charpentier et al. [7] v dalším experimentu zkoumal nejen pankreatickou tkáň, ale také periferní jaterní tkáň a oblast jaterního hilu po působení IRE. V periferní jaterní tkáni potvrdil experiment absenci „heat sink“ efektu, když byly tkáňové změny způsobené poratizací patrné bezprostředně v okolí velkých žilních struktur. Okrsek ablace měl pravidelný tvar v důsledku homogenity tkáně na periferii jater. Naopak ablace v oblasti hilu jater vedla díky většímu podílu pojivové tkáně a tubulárních struktur k nepravidelnému tvaru zóny ablace. Žádná ze struktur jaterního hilu (portální pedikl, žlučovod, tepna) nebyla poratizací poškozena. Philips et al. [15] zaměřil svůj experimentální model na důsledek neefektivní – částečné ablace tumoru. K experimentu vytvořila skupina model heterotopického karcinomu pankreatu aplikací kultury Panc-1 buněk a devitalizovaných buněk lidského karcinomu pankreatu do zadní končetiny myši. Ablace nádorové tkáně v dostatečném rozsahu vedla k odúmrtí nádorových buněk a jejich náhradě jizvou. Částečná ablace maligní tkáně („debulking“) naopak zapříčinila téměř v 70 % exulceraci tumoru. Ta byla vyhodnocena jako statisticky významný faktor rekurence. Recidiva nádoru pak byla příčinou akcelerované mitotické aktivity, růstové progrese nádoru ve srovnání s neléčenými nádory.
Klinické zkušenosti s IRE
Po příznivých výsledcích experimentálních studií byla IRE použita také v klinických indikacích. Thomson et al. [16] provedl IRE u 25 pacientů s nádory jater. Zaznamenali kompletní odpověď nádorové tkáně v 50 %. Metoda selhala u nádorů větších než 5 cm. Ve studii nebyla zaznamenána žádná vážná komplikace, a to ani v případě ablace provedené v blízkosti velkých cévních struktur nebo žlučovodů. Cannon et al. [17] hodnotil retrospektivně soubor 44 pacientů po IRE ablaci tumorů jater. Jeden rok bez recidivy bylo 60 % pacientů ze souboru, statisticky významné riziko rekurence bylo spojeno s velikostí nádoru nad 4 cm. V souboru nebyla zaznamenána komplikace. IRE – Kazuistická sdělení byla věnována použití IRE u plicních tumorů. Thomson et al. [16] provedl u 4 nemocných ablaci metastáz kolorektálního karcinomu, metastázy tumoru prsu a nemalobuněčného karcinomu plic. U dvou pacientů byl po výkonu diagnostikován plášťový klinicky nevýznamný pneumotorax, který se spontánně resorboval. U všech pacientů byla při kontrole po 3 měsících zaznamenána progrese onemocnění. I další práce popisuje progresi nálezu 6 měsíců od provedení ablace [18]. IRE ablace ložisek v plicním parenchymu je spojena s několika problémy. Obtížné nasměrování elektrod při respiračních pohybech a vynucená pozice elektrod v důsledku přítomnosti žeber komplikují dosažení ideální vzdálenosti a směru nutných k dosažení efektivní ablace. Matematický model IRE ablace v plicní tkáni ukázal na rozdíly ve vodivosti tkání mezi tumorem, plicním parenchymem a vzduchem, které vedou k nehomogenní ablaci a nepravidelnému tvaru zóny ablace [19].
Úspěšné pokusy s IRE ablací pankreatu na zvířecích modelech otevřely cestu ke klinickému použití. Martin et al. [20] v jedné ze svých prvních prací prezentoval výsledky ablace lokálně pokročilého karcinomu pankreatu u 54 pacientů provedených otevřenou cestou při laparotomii. Zaznamenal jedno úmrtí pacienta během 90 dní od výkonu. Výkon byl ve dvou případech komplikován biliární píštělí, v dalších dvou případech duodenální píštělí a byly zaznamenány i dvě píštěle pankreatické. Narayanan et al. [10] publikoval v roce 2012 celkem 14 perkutánně provedených ablací karcinomu pankreatu. Kontrastní CT provedené 24 hodin po výkonu prokázalo plnou průchodnost všech vaskulárních struktur u všech pacientů. Celkové 6měsíční přežití v souboru bylo 70 %. V době publikace studie nebyla další data o přežívání k dispozici. Mimo lehkou akutní pankreatitidu nebyla v souboru zaznamenána jiná závažná komplikace nebo úmrtí.
IRE v léčbě lokálně pokročilého karcinomu pankreatu
IRE byla v léčbě lokálně pokročilého karcinomu pankreatu použita poprvé v roce 2009 [21]. V již výše citované prospektivní práci Martina et al. [20] byla mezi lety 2009 a 2010 provedena lokální ablace u 54 pacientů. Minimální mortalita a minimální časná morbidita byly jedním z výstupů práce. V intervalu 90 dní od provedené ablace bylo zaznamenáno jediné úmrtí v důsledku progrese trombózy portální žíly. U dvou pacientů byl výkon komplikován duodenální a u dvou pankreatickou píštělí. Z 54 pacientů devatenáct podstoupilo resekci s ablací resekčních okrajů podezřelých z infiltrace nádorem. U zbytku byla po chirurgické exploraci a definitivním rozhodnutí o neresekabilitě provedena ablace celého tumoru. IRE byla prováděna cestou laparotomie, jen ve dvou případech laparoskopicky. Celkem 47 nemocných ze skupiny IRE podstoupilo adjuvantní systémovou chemoterapii, z nich 10 navíc radioterapii. Interval do lokální progrese byl ve skupině IRE s chemo/radioterapií ve srovnání s retrospektivní skupinou 84 nemocných léčených standardně: 14 vs. 6 měsíců (p=0,01), k prodloužení došlo i v intervalu do vzdálené progrese: 15 vs. 9 měsíců (p=0,02) a v celkovém přežití 20,2 vs. 11 měsíců (p=0,03). Další retrospektivní práce sledovala 14 provedených perkutánních ablací u jedenácti pacientů s lokálně pokročilým nádorem, u tří s generalizovaným onemocněním. Zaznamenány byly dvě nezávažné komplikace. Nebylo zaznamenáno úmrtí. 2 pacienti podstoupili s časovým odstupem od ablace laparotomii s R0 resekcí. U 2 pacientů nedošlo po 5 a 6 měsících k progresi. Lokální progrese byla prokázána u 2 pacientů po 1 a 7 měsících. U jednoho pak došlo ke generalizaci po 4 měsících [17]. V roce 2014 byly publikovány výsledky ultrazvukem navigované ablace lokálně pokročilého tumoru u 5 pacientů. V tomto malém souboru nebyla zaznamenána mortalita v průběhu 30 dní od IRE ani komplikace spojené s výkonem [11].
Podmínkou provedení bezpečné ablace s benefitem pro pacienta je jeho správný výběr. Léčba by měla být zahájena 4 měsíce trvající systémovou chemoterapií nebo chemoradioterapií. Dojde tak k selekci pacientů s časnou generalizací a těch, kteří léčbu špatně tolerují, nebo se při ní prudce zhoršuje jejich zdravotní stav. To bývá známkou špatné prognózy. Po 4 měsících neadjuvantní léčby je stadium onemocnění znovu přehodnoceno. Celkový stav pacienta musí umožnit celkovou anestezii a provedení laparotomie (v případě otevřené IRE). Nemocní by neměli trpět závažnou poruchou rytmu pro riziko indukce arytmie během ablace [7]. Z některých prací plyne, že velikost tumoru by v kranio-kaudálním a předozadním rozměru neměla přesáhnout 3,5 cm [22].
V recentní publikaci o použití IRE ablace v léčbě lokálně pokročilého karcinomu pankreatu Martin et al. [23] komentuje data registru ablace měkkých tkání (http://www.ablationregitry.com). Sběru dat se účastnila 4 americká pracoviště. Celkem podstoupilo ablaci 200 nemocných. Z nich u 150 bylo provedeno IRE otevřenou cestou. 50 pacientů po zhodnocení peroperačního nálezu podstoupilo resekci pankreatu s atenuací resekčních okrajů pomocí IRE. V 63 % případů, kdy byl karcinom lokalizován v hlavě pankreatu, nebylo možné resekci provést a výkon byl omezen pouze na provedení IRE. Naopak u karcinomu lokalizovaného v těle a kaudě bylo možné častěji provést výkon kombinovaný, tj. resekci s doplněním IRE resekčních okrajů – v 75 %. Všichni nemocní podstoupili indukční chemoterapii (v režimu FOLFIRINOX nebo Gemcitabin). U poloviny z nich byla chemoterapie doplněna radiační léčbou. IRE ablace byla zatížena celkovým počtem 100 komplikací, které se projevily u 54 pacientů. Drtivou část z nich tvořily nezávažné dyspeptické projevy. Během 90 dní sledování po výkonu zemřeli tři nemocní (90denní letalita dosáhla 2 %). Jeden pacient zemřel na krvácení do trávicího traktu z exulcerovaného tumoru. Další zemřel 45 dní po IRE na jaterní selhání v důsledku portální trombózy. Ve skupině kombinace resekce s IRE nebylo zaznamenáno žádné úmrtí. Medián doby sledování byl 29 měsíců. U 3 nemocných bylo při kontrole po 3 měsících zaznamenáno selhání ablace, u 6 byla zaznamenána rekurence onemocnění v místě ablace. Celkem se recidiva onemocnění projevila u 58 (29 %) pacientů se střední dobou do progrese 12,4 měsíce (4,4−38,9). Střední doba do vzdálené progrese – generalizace byla 16,8 měsíce (1,3−55). Střední doba přežití ve skupině in situ IRE ablace byla 23,2 měsíce (4,9−76,1), ve skupině kombinace resekce s IRE byla 28,3 (9,2−85). Celková doba přežití nemocných s lokálně pokročilým nádorem pankreatu byla 24,9 měsíce (12,4−85).
Atenuace resekčních okrajů IRE ablací
Vzdálenost nádoru od resekčního okraje je významným faktorem ovlivňujícím délku přežívání nemocných. Snaha o standardizaci zpracování preparátů stejným systémem, dnes známým pod názvem Leedský protokol, vedla mimo jiné ke zjištění, že za R0 resekci lze považovat jen tu, kde je nádor vzdálený od resekčních okrajů více než 1 mm. Tam, kde není při zpracování a vyšetření preparátu této podmínky dosaženo, je statisticky významně nižší přežívání pacientů [24]. Pozornost chirurgů se tak přirozeně zaměřuje zejména na dosažení R0 resekce, což není vždy možné zajistit ani extenzivním chirurgickým výkonem. IRE může být použita nejen jako součást multimodální léčby lokálně pokročilého tumoru s cílem redukce nádorové tkáně, oddálení lokální i vzdálené progrese, redukce příznaků lokálního růstu, ale i peroperačně k doplnění resekčního výkonu tam, kde má chirurg podezření, že neprovedl R0 resekci. IRE může být tak v určité fázi operačního výkonu použita k ablaci tkáně v bezprostřední blízkosti resekčních okrajů nebo nádoru. První zmínka o takovém použití IRE je v citované práci Martina et al., kde při chirurgické exploraci byl nález hodnocen jako resekabilní a během výkonu byla IRE použita k ošetření resekčních okrajů u 19 pacientů [14]. O 2 roky později pak Kwon [25] prezentoval prospektivně sledovaný soubor pacientů, kteří podstoupili resekční výkon doplněný o IRE ze dvou pracovišť. V sestavě je zařazeno i výše zmíněných 19 pacientů z předchozí práce. Celkem 48 pacientů s lokálně pokročilým nebo tzv. „borderline“ resekabilním nádorem bylo indikováno k resekci s ošetřením resekčních okrajů IRE. Všichni pacienti v souboru byli před výkonem léčeni chemoterapií nebo chemoradioterapií. 4 až 6 týdnů po ukončení neoadjuvantní terapie bylo opakováno CT vyšetření. Nebyla-li zaznamenána progrese onemocnění a velikost nádoru v axiální rovině nepřesahovala 3,5 cm, byli pacienti indikováni k provedení resekce s IRE ablací. IRE atenuace resekčních okrajů nebyla provedena tam, kde šlo zjevně o R2 resekci. Ihned po protnutí krčku pankreatu, v době, kdy ještě nebyla provedena disekce tkáně podél horní mezenterické tepny a žíly, byly zaváděny monopolární elektrody v kranio-kaudálním směru pod UZ kontrolou: v případě borderline resekabilních lézí do tkáně postero-laterálně od horní mezenterické tepny, v případě lokálně pokročilých tumorů cirkumferentně kolem horní mezenterické tepny nebo kolem truncus coeliacus. Tímto způsobem bylo v období 2010 a 2013 ošetřeno 48 pacientů. Komplikace v průběhu 90 dní od výkonu se objevily u 38 % operovaných. 11 % komplikací bylo bezprostředně spojeno s IRE. Během této doby nebyla zaznamenána žádná lokální recidiva při kontrolních CT hodnocených dle RECIST kritérií. Více než polovina nemocných (65 %) pokračovala v adjuvantní chemoterapii nebo v radioterapii. Střední doba intervalu mezi výkonem a adjuvancí byla 2,4 měsíce. Po 24 měsících byla u 28 pacientů (58 %) diagnostikována vzdálená progrese či generalizace, nejčastěji do jater a po peritoneu. U 3 nemocných byla potvrzena lokální recidiva. Celková střední doba přežití v souboru byla 22 měsíců (95%CI), doba do progrese 11 měsíců (95%CI).
Závěr
Duktální adenokarcinom pankreatu je onemocnění s velmi nepříznivou prognózou. Radikální chirurgická resekce nádoru doplněná o systémovou chemoterapii nebo chemoradioterapii je jedinou metodou s potenciálně kurativním cílem. Většina nemocných je diagnostikována v chirurgicky neřešitelném III. a IV. klinickém stadiu. Ve třetím klinickém stadiu lokalizovaného pokročilého onemocnění se otevírá možnost pro použití ablativní léčby. Většina dosud použitých metod pracovala s termickým poškozením tkáně (mikrovlnná ablace, kryoablace, radiofrekvenční ablace), které v případě komplikovaného vztahu tkáně slinivky k tepnám, žilám a žlučovým cestám vedlo k závažným komplikacím. Relativně novou metodou je ireverzibilní elektroporatizace využívající k destrukci tkáně mikropóry v buněčné membráně, které vznikají během působení krátkých pulzů stejnosměrného elektrického pole o vysokém napětí na tkáň. Bezpečnost a efekt poratizace byla prokázána jak na animálních modelech, tak i v klinické praxi. Nicméně jednoznačný přínos IRE pro pacienta dosud prokázán nebyl. Jasné vymezení použití této metody přinesou až další práce.
Podpořeno IGA MZČR NT 13263 a MO1012.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Pavel Záruba
Chirurgická klinika 2. LF UK a ÚVN, Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: pavel.zaruba@uvn.cz
Zdroje
1. Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015;136:E359−86.
2. Záruba P, Ryska M. Surgical treatment of pancreatic carcinoma. Rozhl Chir 2012;91 : 702−9.
3. Dušek L, Mužík J, Malušková D, et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2014;27 : 406−23.
4. Dušek L, Mužík J, Pavlík T, et al. Epidemiologie zhoubných nádorů trávicího traktu v České republice – Současný stav a predikce. Gastroenterol Hepatol 2012;66 : 331−9.
5. Lee EW, Wong D, Prikhodko SV, et al. Electronmicroscopic demonstration and evaluation of irreversible electroporation-induced nanopores on hepatocyte membranes. J Vasc Interv Radiol 2012;23 : 107−13.
6. Mir LM, Morsli N, Garbay JR, et al. Electrochemotherapy: a new treatment of solid tumors. J Exp Clin Cancer Res 2003;22,Suppl):145−8.
7. Charpentier KP, Wolf F, Noble L, et al. Irreversible electroporation of the liver and liver hilum in swine. HPB (Oxford) 2011.
8. Wimmer T, Srimathveeravalli G, Gutta N, et al. Comparison of simulation-based treatment planning with imaging and pathology outcomes for percutaneous CT-guided irreversible electroporation of the porcine pancreas: a pilot study. J Vasc Interv Radiol 2013;24 : 1709−18.
9. Lu DS, Kee ST, Lee EW. Irreversible electroporation: ready for prime time? Tech Vasc Interv Radiol 2013;16 : 277−86.
10. Narayanan G, Hosein PJ, Arora G, et al. Percutaneous irreversible electroporation for downstaging and control of unresectable pancreatic adenocarcinoma. J Vasc Interv Radiol. 2012;23 : 1613−21.
11. Månsson C, Bergenfeldt M, Brahmstaedt R, et al. Safety and preliminary efficacy of ultrasound-guided percutaneous irreversible electroporation for treatment of localized pancreatic cancer. Anticancer Res 2014;34 : 289−93.
12. Charpentier KP, Wolf F, Noble L, et al. Irreversible electroporation of the pancreas in swine: a pilot study. HPB (Oxford) 2010;12 : 348−51.
13. Fritz S, Sommer CM, Vollherbst D, et al. Irreversible electroporation of the pancreas is feasible and safe in a porcine survival model. Pancreas 2015;44 : 791−8.
14. Dunki-Jacobs EM, Philips P, Martin RC 2nd. Evaluation of thermal injury to liver, pancreas and kidney during irreversible electroporation in an in vivo experimental model. Br J Surg 2014;101 : 1113−21.
15. Philips P, Li Y, Li S, et al. Efficacy of irreversible electroporation in human pancreatic adenocarcinoma: advanced murine model. Mol Ther Methods Clin Dev 2015;2 : 15001.
16. Thomson KR, Cheung W, Ellis SJ, et al. Investigation of the safety of irreversible electroporation in humans. J Vasc Interv Radiol 2011;22 : 611−21.
17. Cannon R, Ellis S, Hayes D et, al. Safety and early efficacy of irreversible electroporation for hepatic tumors in proximity to vital structures. J Surg Oncol 2013;107 : 544−9.
18. Usman M, Moore W, Talati R, et al. Irreversible electroporation of lung neoplasm: a case series. Med Sci Monit 2012;18:CS43−7.
19. Srimathveeravalli G, Wimmer T, Solk M, et al. Treatment planning considerations for IRE in the lung: placement of the elektrodes is critical. J Vasc Interv Radiol 2013,24:S22.
20. Martin RC, McFarland K, Ellis S, et al. Irreversible electroporation in locally advanced pancreatic cancer: potential improved overall survival. Ann Surg Oncol 2013;20,Suppl 3:S443−9.
21. Martin RC 2nd, McFarland K, Ellis S, et al. Irreversible electroporation therapy in the management of locally advanced pancreatic adenocarcinoma. J Am Coll Surg 2012;215 : 361−9.
22. Martin RC 2nd. Irreversible electroporation of locally advanced pancreatic head adenocarcinoma. J Gastrointest Surg 2013;17 : 1850−6.
23. Martin RC 2nd, Kwon D, Chalikonda S, et al. Treatment of 200 locally advanced (Stage III) pancreatic adenocarcinoma patients with irreversible electroporation: Safety and efficacy. Ann Surg 2015;262 : 486−94.
24. Hlavsa J, Procházka V, Mazanec, J et al. Standardization of pancreatic cancer specimen pathological examination. Rozhl Chir 2014;93 : 132−8.
25. Kwon D, McFarland K, Velanovich V, et al. Borderline and locally advanced pancreatic adenocarcinoma margin accentuation with intraoperative irreversible electroporation. Surgery 2014;156 : 910−20.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2015 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Desetileté jubileum Chirurgické kliniky 2. LF UK a ÚVN, Praha
- Maligní nádory duodena
- Ireverzibilní elektroporatizace v léčbě lokálně pokročilého karcinomu pankreatu
- Chirurgie hiátové kýly a refluxní choroby jícnu, Nissen, nebo Toupet?
- Třetí vydání monografie o štítné žláze
- Biliární leak po jaterních resekcích: retrospektivní analýza vlastního souboru
- Oznámení
- „Liver first approach“ u synchronních metastáz kolorektálního karcinomu: Předběžné výsledky nerandomizované studie
- Da Vinci asistovaná léčba karcinomu rekta – průběžné výsledky nerandomizované studie
- Urgentní chirurgické řešení volvulu žaludku při „upside-down stomach syndrome“
- Za profesorem Larsem Påhlmanem
- Raritní situace při ošetřování polytraumatizovaných pacientů – kazuistická sdělení
- Komentář
- XIX. Národní kongres ČSOT 2015
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chirurgie hiátové kýly a refluxní choroby jícnu, Nissen, nebo Toupet?
- Urgentní chirurgické řešení volvulu žaludku při „upside-down stomach syndrome“
- Maligní nádory duodena
- Biliární leak po jaterních resekcích: retrospektivní analýza vlastního souboru
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



