-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Radiací indukovaný (postiradiační) angiosarkom prsu – možnosti chirurgické léčby a přehled literatury
Breast angiosarcoma induced by radiotherapy – surgical treatment options and review of literature
Introduction:
Radiation-induced angiosarcoma is a rare but very aggressive tumour. The highest risk of sarcoma development is in patients after breast-conserving surgery.Case 1:
The 66 years old patient underwent radical mastectomy with axillary dissection because of ductal carcinoma with consequent radiotherapy, chemotherapy and hormonal therapy. After 6 years, high-grade angiosarcoma was diagnosed and resected with negative resection margins. Within subsequent 24 months, additional three radical re-excisions were performed because of repeated sarcoma recurrence. 29 months from the diagnosis of the first sarcoma, another radical re-excision was performed, this time with positive resection margins and with consequent disease progression. The patient died three years after the first angiosarcoma diagnosis.Case 2:
The 68 years old patient underwent breast-conserving surgery with axillary dissection because of ductal carcinoma and radiotherapy. Breast colour changes were observed 6 years later; radical mastectomy was performed after additional 16 months due to locally advanced angiosarcoma. Given positive resection margin, radical re-excision with musculocutaneous musculus latissimus dorsi flap was done. 24 months later, a small sarcoma recurrence was detected near the upper resection margin, which was managed by radical re-excision. 52 months after radical operation, a metastasis was diagnosed by means of PET/CT in the contralateral axilla. Radical axillary dissection was performed (two metastases were found in axillary lymph nodes). According to follow-up, the patient has been free of any recurrence for 66 months from the radical surgery.Conclusion:
Recommendations regarding the management of radiotherapy induced breast angiosarcoma are very vague due to limited evidence. Radical surgical excision with negative resection margins (potentially with complementary flap reconstruction) presents the fundamental approach to breast angiosarcoma.Key words:
radiation-induced angiosarcoma – breast cancer – surgery
Autori: O. Kubala 1; J. Prokop 1; L. Petráš 2; P. Ihnát 1; P. Jelínek 1; P. Ostruszka 1
Pôsobisko autorov: Chirurgická klinika, FN LF Ostravské univerzity, Ostrava přednosta: doc. MUDr. I. Penka, CSc. 1; Popáleninové centrum FN Ostrava primářka: MUDr. Z. Němečková Crkvenjaš, MBA 2
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 8, s. 353-358.
Kategória: Kazuistika
Súhrn
Úvod:
Radiací indukovaný angiosarkom je velmi vzácný, ale vysoce maligní nádor. Riziko vzniku je nejvyšší u pacientek v ozářeném prsu po záchovných operacích prsu.Kazuistika 1:
Pacientka v 66 letech podstoupila mastektomii s disekcí axily pro duktální (NST) karcinom s následnou radioterapií, chemoterapií a hormonoterapií. Po 6 letech verifikován a excidován high-grade angiosarkom s těsnou resekční hranicí. V průběhu následujících 24 měsíců 3krát reexcize, přesto diseminace v okolí jizvy. 29 měsíců od prvních projevů snaha o radikální reexcizi s krytím defektu stopkovaným lalokem, ale již pozitivní resekční hranice, sekundární hojení a rychlá progrese nemoci. Tři roky od prvních projevů nemoci exitus letalis.Kazuistika 2:
68letá pacientka po konzervativní záchovné operaci prsu s disekcí axily pro duktální (NST) karcinom a následné radioterapii. 6 let po operaci barevné změny operovaného prsu, za dalších 16 měsíců provedena maximálně radikální mastektomie pro lokálně pokročilý angiosarkom. Pro pozitivní resekční okraj následovala radikální reexcize s krytím defektu muskulokutánním lalokem m. latissimus dorsi, resekční okraje široce volné. 24 měsíců od radikální operace prokázána drobná recidiva při horním okraji resekce, provedena radikální reexcize. 52 měsíců od radikální operace na PET/CT meta v kontralaterální axile. Provedena radikální disekce (meta ve 2 uzlinách). Nyní dále dispenzarizována, 66 měsíců od radikální operace bez známek nemoci.Závěr:
Ačkoliv jsou doporučení k léčbě tohoto raritního onemocnění v literatuře poměrně limitovaná, jednoznačně základní léčebnou modalitou je široká chirurgická excize s dostatečnými volnými okraji, v případě nutnosti s využitím lalokových posunů ke krytí vzniklých defektů.Klíčová slova:
radiací indukovaný angiosarkom prsu – karcinom prsu – chirurgická léčbaÚVOD
Karcinogenní efekt ionizujícího záření je znám již dlouhou dobu. Případy kožních nádorů u pracovníků vystavených chronicky ionizujícímu záření byly popsány již počátkem 20. století [1]. Radioterapie je integrální součástí léčby pacientů s primárním karcinomem prsu, dle zavedených standardů, zvláště u pacientů po konzervativních operacích prsu (Breast conserving surgery – BCS). Radiačně indukované sarkomy jsou vzácným onemocněním. Jako nejčastější je udáván maligní fibrózní histiocytom [2,3]. Radiačně indukované angiosarkomy (RIAS) jsou velmi vzácné, ale na druhé straně jde o jednu z nejčastějších forem vyskytujících se v terénu ozářeného prsu [4,5,6,7]. Primární angiosarkom prsu je naopak extrémně vzácný. Incidence primárního (sporadického) angiosarkomu ve srovnání se sekundárním (postiradiačním) sarkomem je asi 1 : 10 [8].
Sekundární radiací indukované angiosarkomy jsou v posledních letech stále častěji popisovány v terénu prsu zvláště po konzervativních záchovných operacích prsu a následné adjuvantní radioterapii [5,7,8]. Angiosarkomy mohou vycházet z endotelu lymfatických cév (lymfangiosarkomy) nebo endotelu krevních cév (hemangiosarkomy) [9]. Kožní lymfangiosarkomy vznikají na podkladě lymfedému končetiny nejčastěji po mastektomii s disekcí axily (Stewart-Trevesův syndrom) [10]. Jejich počet vzhledem k omezení radikálních chirurgických postupů v léčbě karcinomu prsu a zavedení metody sentinelové biopsie spíše klesá. Výskyt sekundárních radiací indukovaných hemangiosarkomů prsu po operacích prsu s adjuvantní radioterapii spíše přibývá [9]. Pacienti s karcinomem prsu léčení radioterapií mají podle některých studií až 5krát vyšší riziko RIAS než pacienti, kteří radioterapii neabsolvovali [11]. Incidence radiací indukovaných angiosarkomů prsu léčených radioterapií je ale pouze okolo 0,2 % [12,13,14,15,16]. Při desetiletém follow-up je uváděna kumulativní věkově standardizovaná incidence sekundárních angiosarkomů všech lokalizací 0,02/1000 pacientů neléčených radioterapií [11]. Naproti tomu pacienti léčení radioterapií případně i chemoterapií mají v jiné práci kumulativní incidenci sekundárních angiosarkomů 0,06/1000 pacientů [2]. Relativně vyšší riziko vzniku sekundárních radiací indukovaných sarkomů mají zvláště pacienti léčení kombinací radio i chemoterapie [17]. Ve studiích porovnávajících riziko vzniku RIAS po BCS a mastektomiích s následnou radioterapií nebyl nalezen signifikantní rozdíl [17,18,19–24]. Riziko vzniku RIAS je ale velmi nízké, ve srovnání s potenciálním benefitem radioterapie [25,26]. V našem souboru jsme v posledních 10 letech zaznamenali 2 případy angiosarkomů po operaci prsu s následnou radioterapií.
Kazuistika 1
66letá pacientka podstoupila v roce 2000 mastektomii s disekcí axily vlevo pro invazivní duktální karcinom pT1 N0 M0 G2. (Již v roce 1998 byla léčena pro duplexní malignitu – Ca corporis uteri T1b NX M0 G2, pro který byla provedena hysterektomie s adenexektomií, následnou radioterapií LD 40 Gy a brachyterapií 8 Gy). Po mastektomii následovala lokoregionální radioterapie v LD 50 Gy a chemoterapie FAC. Poté léčba Tamoxifenem do 02/06. V 08/2004 následovala excisionální biopsie pro ložiska lobulární hyperplazie pravého prsu. V 02/2005 byla na vlastní žádost pacientky doplněna preventivní pravostranná mastektomie. Následně ve 12/2006 byla exstirpována erytematózní indurace v jizvě po mastektomii vlevo. Histologicky se jednalo o high-grade hemangiosarkom s těsnou resekční hranicí. Proto byla provedena v 03/2007 reexcize se sekundárním hojením, bez průkazu hemangiosarkomu. V 07/2007 následovala další reexcize pro suspektní recidivu – histologicky byla popsána jako pseudoangiomatózní stromální hyperplazie. Radioterapie v obtížně se hojícím terénu nebyla indikována, chemoterapie byla vzhledem ke kardiálním rizikům kontraindikována. V 10/2008 došlo k recidivě kožní léze, proto byla provedena další excize s průkazem recidivy hemangiosarkomu. V 02/2009 se objevuje kožní diseminace v okolí jizvy. Po doplnění PET/CT, kde nebyla prokázána generalizace, konzultaci s kardiologem a plastickým chirurgem byla v 07/2009 indikována další reexcize s krytím defektu paraskapulárním stopkovaným lalokem. Hranice resekce byly však již pozitivní, rána se hojila sekundárně, posléze s nekrózou části laloku. Dochází k rychlé lokální a celkové progresi nemoci s opakovaně krvácejícími exulcerovanými exofytickými tumorózními masami (Obr. 1). Následovala pouze paliativní léčba, ve 12/2009 exitus letalis cca 3 roky od prvních projevů angiosarkomu.
Obr. 1. lokálně pokročilý radiací indukovaný angiosarkom prsu Fig. 1: locally advanced radiation-induced angiosarcoma of the breast 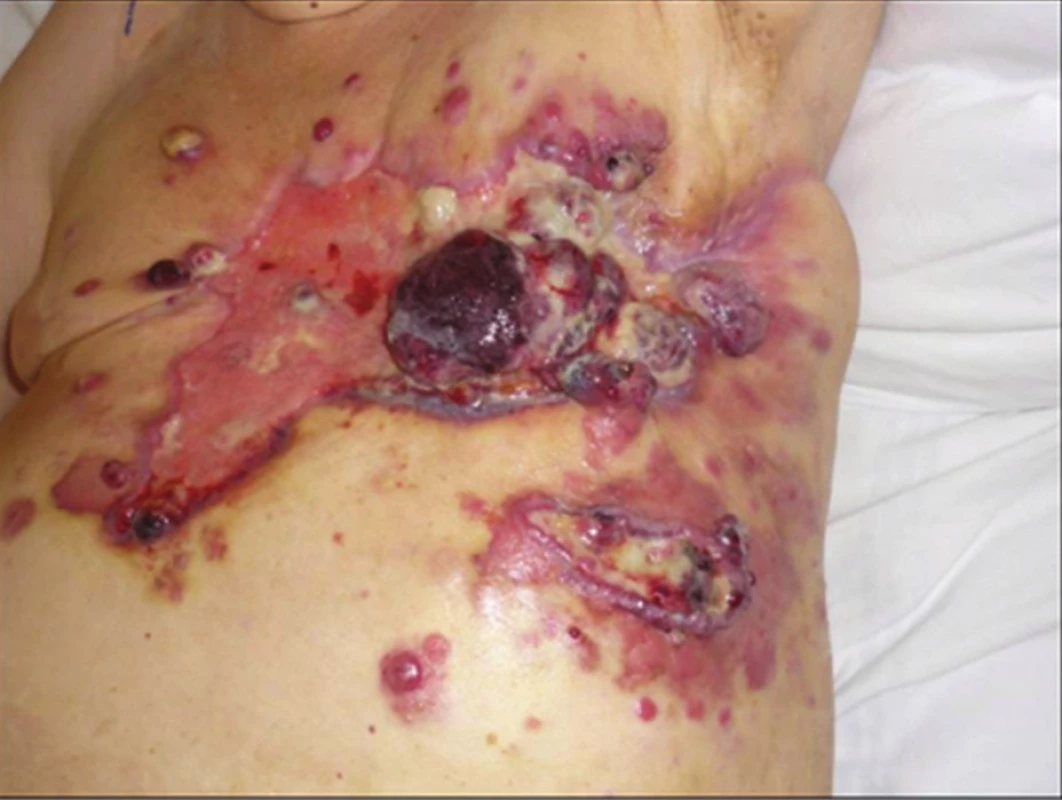
Kazuistika 2
68letá žena podstoupila v roce 2003 na jiném pracovišti pro časný duktální invazivní karcinom pT1a N0 M0 lumpectomii s disekcí axily. Následovala radioterapie do LD 64 Gy (50 +14). Asi od konce roku 2009 pozorovala drobné zarudlé barevné změny levého prsu kolem jizvy. Dispenzarizující onkolog jim nevěnoval dostatečnou pozornost. V první polovině roku 2011 dochází k výrazné progresi, vzniku výrazných fialových až černých nodulů. Proto byla odeslána na kožní oddělení FN Ostrava, kde byl z biopsie potvrzen high-grade hemangiosarkom. V 08/2011 byla již na našem pracovišti provedena maximálně radikální mastektomie, axila po disekci bez postižených a zvětšených uzlin. Snesený prs byl s vícečetnými uzly hemangiosarkomu (Obr. 2). Histologicky byly zachyceny ve 2 řezech horní resekční linie v cévách struktury RIAS. Proto po konzultaci s onkology a plastickým chirurgem byla indikována maximálně radikální reexcize s krytím defektu muskulokutánním lalokem z musculus latissimus dorsi (operace v 10/2011) (Obr. 3). Pooperační průběh byl bez komplikací, pacientka se zhojila primárně (Obr. 4 a 5). Histologicky byla ve 2 řezech v jizvě po předchozí mastektomii nalezena 2 ložiska RIAS do 1 mm velká, okraje byly široce volné. V 10/2013 (24 měsíců od radikální reoperace) jsme při kontrole objevili 2 drobné uzlíky nad horním okrajem laloku. Byla provedena chirurgická excisionální biopsie s potvrzením recidivy hemangiosarkomu. Na PET/CT bez dalších vzdálených ložisek, proto byla v 03/2014 provedena radikální reexcize s minimálně 3cm lemem proximálně nad lalokem. Histologie byla již negativní. V 01/2016 byla prokázána na PET/CT viabilní nádorová tkáň v uzlinách pravé axily, proto jsme ve 2/2016 (52 měsíců od radikální reoperace) provedli disekci pravé axily (popsáno 10 uzlin, ve 2 meta angiosarkomu). Pooperačně se objevil recidivující abscedující serom v axile. Po zhojení je pacientka bez obtíží. Při dalších kontrolách je klinicky i paraklinicky (USG, MMG, MRI i PET/CT) 66 měsíců od radikální reoperace bez známek choroby. V posledním roce se u 82leté pacientky projevují známky počínající Alzheimerovy demence.
Obr. 2. Snesený prs s mnohočetnými uzly angiosarkomu Fig. 2: Multiple nodes of angiosarcoma in ablated breast 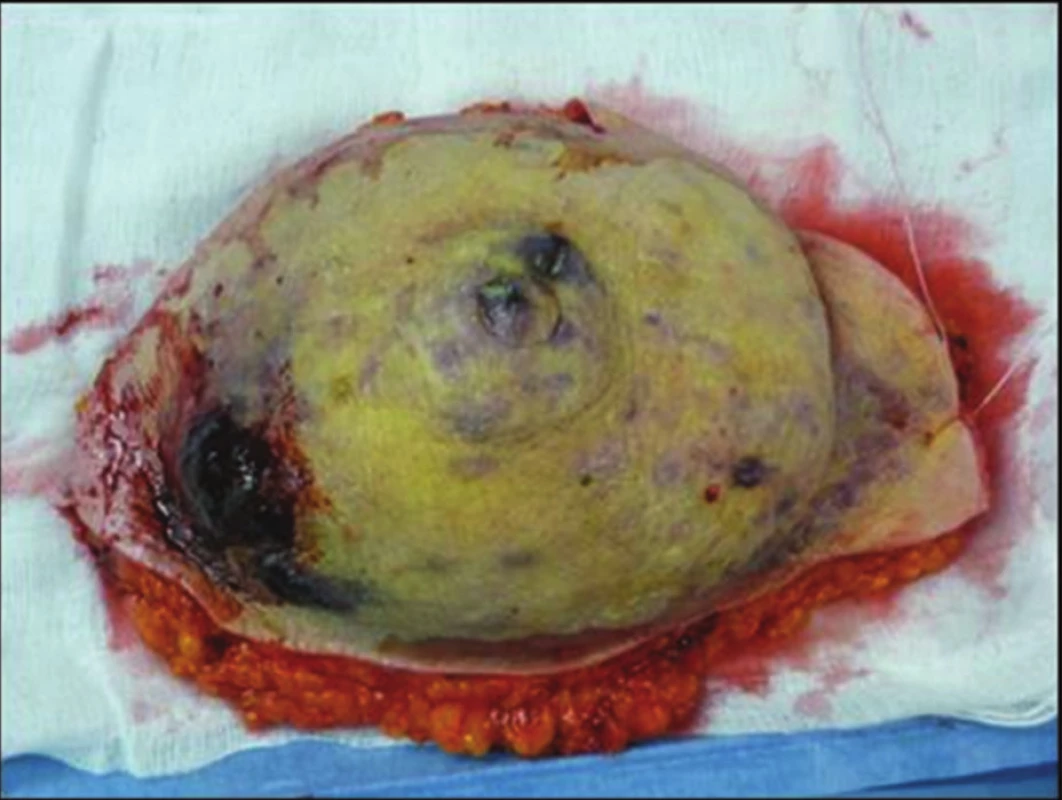
Obr. 3. Radikální reexcize jizvy po mastektomii s krytím defektu lalokem m. latissimus dorsi Fig. 3: Radical re-excision of mastectomy scar covered with musc. latissimus dorsi flap 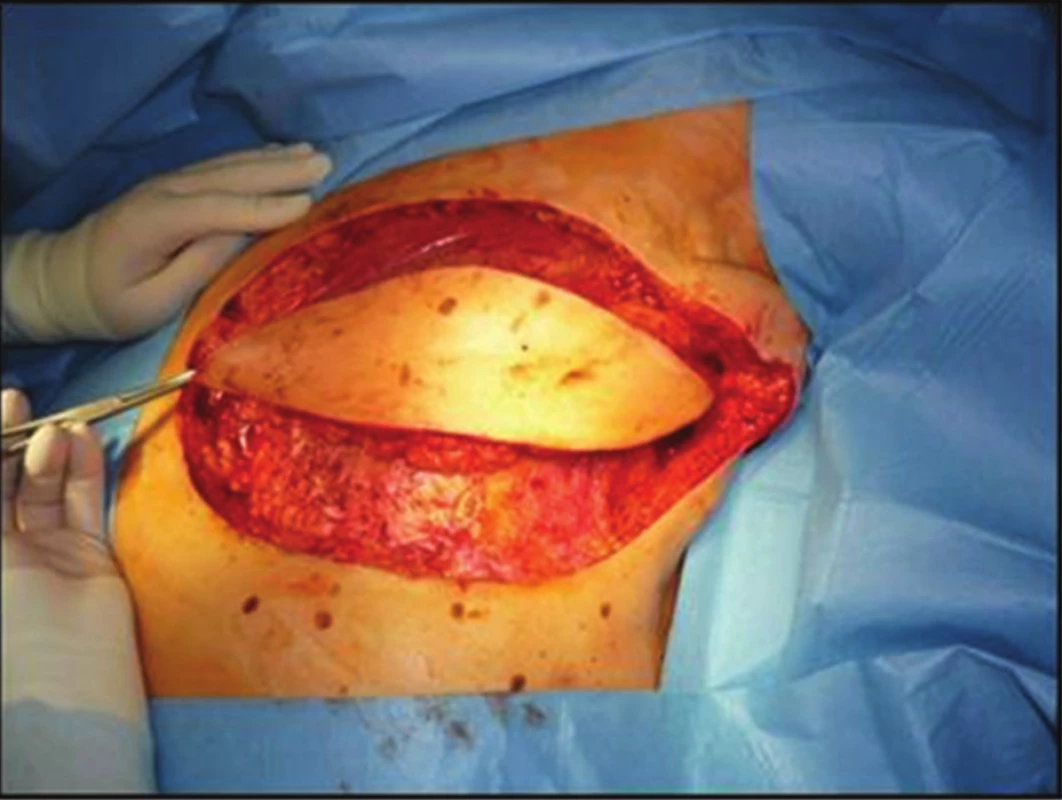
Obr. 4 a 5: Stav po zhojení laloku Figs. 4 and 5: Condition after healing of the flap 
DISKUZE
Kazuistiky postiradiačních angiosarkomů po operacích prsu pro karcinom se objevují v literatuře častěji v posledních cca 25 letech. Jejich zvyšující se počet je dáván do souvislosti s rozvojem BCS s následnou rutinní radioterapií operovaných prsů. Aby bylo možno angiosarkom prsu označit za radiací indukovaný (postiradiační), měl by určitě splňovat Cahanova kritéria radiací indukovaného sarkomu. To je histologicky potvrzený sarkom rostoucí v ozářené oblasti po různě dlouhé periodě latence [27]. Průměrná doba od léčby pro karcinom prsu po diagnózu angiosarkomu je udávána v různých pracích v relativně širokém rozmezí od 4,1 roku [4], 4,4 roku [9], 5,2 roku [5], 6,2 roku [28] až po 8 let [29]. V našich případech byla diagnóza stanovena 6 a 8 let od léčby pro karcinom prsu. Etiologicky je možná příčinná souvislost mezi edematózně fibrotickým prsem s ovlivněním lymfatické drenáže prsu operací a následnou radioterapií [30,31]. Toto je však jistě významnějším faktorem při vzniku postiradiačních lymfangiosarkomů nežli hemangiosarkomů. Pochopení a možnosti ovlivnění působení vaskulárního endoteliálního růstového faktoru (VEGF), který byl prokázán v angiosarkomech a je významným angiogenním faktorem [32,33], by mohlo vést i ke zlepšení terapeutických výsledků.
Klinický průběh může být zpočátku dosti nenápadný – jako nebolestivé erytematózní infiltráty, eventuálně posléze červené až modrofialové či černé noduly v oblasti kůže prsu. Sekundární angiosarkom je zpočátku obtížně diagnostikovatelný, protože se může projevovat pouze jako ztluštění a změny barvy kůže, což může vést ke zpoždění stanovení diagnózy [34,35], jak jsme zaznamenali i u naší druhé pacientky. V rámci diferenciální diagnostiky je nutno vyloučit inflamatorní karcinom prsu, edém prsu, fibrózní histiocytom a celulitidu [36,37,38,39].
Ložiska mohou být jednotlivá i mnohočetná [28]. Pacienti s mnohočetnými kožními lézemi mají mnohem horší prognózu, 24 měsíční přežití je v jedné práci udáváno 0 % [40], naopak s jednotlivými lézemi bylo 50 % [28]. Rovněž velikost tumoru je velmi důležitý prognostický faktor. Pacienti s tumory menšími než 2 cm měli medián přežití 80 měsíců, u tumorů větších než 5 cm bylo celkové přežití jen 20 měsíců [20]. Za jeden z nejdůležitějších prognostických faktorů je považován grade tumoru [40]. Bohužel až 80 % radiačně indukovaných sarkomů je high-grade, naproti tomu primárních sarkomů měkkých tkání je high-grade pouze asi 40 % [41]. Růst je většinou agresivní, časté jsou lokální recidivy, diseminace do druhého prsu a okolí na hrudníku [7]. Metastazují do plic, jater, kostí, případně lymfatických uzlin [28,42,43].
Zobrazovací metody jsou často nepřínosné. Na mamografu (MG) může být popsáno pouze zesílení kožního krytu [7,28], ale asi 33 % pacientek má na MG negativní nález [44]. Významnější přínos může mít magnetická rezonance (MRI) [7]. V rámci dispenzarizace, zvláště k průkazu diseminace a viabilní nádorové tkáně, je velmi přínosné PET/CT. Základem úspěchu v diagnostice je však bioptická verifikace, nejlépe reprezentativní excisionální biopsií [21,45]. Nejdůležitější je však časná klinická detekce suspektních lézí. Dispenzarizující lékař však musí na možnost sekundárního angiosarkomu myslet [2]!
I když chirurgická léčba zůstává nejúčinnější léčbou pro pacienty s radiací indukovaným angiosarkomem, samotná chirurgická terapie má své limity, pokud jde o celkové přežití a rizika místní recidivy. Proto se v literatuře zdůrazňuje potřeba lepší multidisciplinární terapie [20,46]. V léčbě je základem úspěchu dostatečně radikální excize s negativními resekčními okraji. Thijssens se spolupracovníky [17] ve své práci dokládají, že R0 resekce (mikroskopicky čisté resekční okraje) má signifikantně lepší přežití nežli resekce R1 (mikroskopicky pozitivní hranice resekce) nebo R2 (makroskopicky pozitivní hranice resekce). Přičemž nenalezli rozdíly v přežití mezi resekcemi R1 a R2. Některé retrospektivní studie zdůrazňují, že chirurgické bezpečnostní lemy 2–4 cm jsou nezbytné pro správnou lokální kontrolu onemocnění u pacientů s postiradiačním sarkomem [47,48,49], i když jiná studie uvádí, že bezpečnostní lem 1 cm je dostatečný k úspěšné lokální kontrole nemoci [50]. Erel se spolupracovníky ve své práci uvádějí, že chirurg by měl odstranit v rámci dostatečné radikality i anatomickou vrstvu tkáně přiléhající na tkáň, ve které se nachází radiací indukovaný sarkom [51]. En bloc resekce hrudní stěny jsou doporučovány pouze u některých pacientů se sarkomy v ozářeném poli s rozsáhlou infiltrací tkání [20]. I přes špatné celkové přežití pacientů, kteří podstoupili resekci hrudní stěny, může být tento rozsáhlý výkon odůvodněn nízkou pooperační morbiditou a nedostatkem jiných možností účinné léčby [52]. U všech pacientů s diagnostikovaným RIAS by měla být provedena minimálně totální mastektomie [43,53,54,55,56]. Colville se spolupracovníky doporučují široký bezpečnostní lem až 5 cm [57]. Někteří autoři doporučují radikální mastektomii s disekcí axily [58]. Jiní navrhují vyhnout se axilární disekci, aby se zabránilo pooperačnímu lymfedému [20]. U sarkomů se obvykle neočekává, že by metastazoval do regionálních lymfatických uzlin. Proto podle některých autorů axilární lymfadenektomie nemá u pacientů s postiradiačním sarkomem žádný význam [20]. Naše zkušenost s druhou prezentovanou pacientkou však ukazuje, že i RIAS může metastázovat do axilárních uzlin. Pokud nelze dostatečnou radikalitu zajistit mastektomií, lze jako alternativu zvážit dostatečně časně provedenou širokou radikální excizi s krytím eventuálního rozsáhlého defektu lalokovým posunem.
K dalšímu zajištění lokální kontroly je možno využít pooperační radioterapii [4]. Dle literárních údajů se jeví jako přínosná akcelerovaná hyperfrakcionovaná radioterapie, vzhledem k velké růstové frakci v nádorové populaci [59].
Možnosti a přínos chemoterapie jsou nejednoznačné. Řada studií popisuje neuspokojivé výsledky celkového přežití i výskytu lokálních recidiv po kombinaci chirurgické léčby a standardní adjuvantní chemoterapie [17,60,61]. Jiní referují, že není rozdílné přežití u pacientů léčených pouze chirurgicky a chirurgicky v kombinaci s chemoterapií [62]. Další autoři však popisují možný benefit z chirurgické excize s širokými negativními okraji a adjuvantní chemoterapie v různých kombinacích [19,20,43,46,59].
Prognóza sekundárního angiosarkomu je vzhledem k často dosti pozdní diagnóze, high-grade tumoru a časné hematogenní, případně lymfogenní diseminaci vesměs velmi špatná. Pětileté přežití u radiací indukovaných sarkomů prsu se pohybuje mezi 27–48 % [51,63]. Pětiletý disease-free survival v jedné z prací byl 35 % [64].
Závěr
Radiací indukované angiosarkomy prsu jsou vzácným, ale vysoce maligním onemocněním. Jednou z možností zlepšení léčebných výsledků může být kromě včasné diagnostiky i dostatečně radikální chirurgická léčba. To znamená R0 resekci s široce volnými okraji a dostatečným bezpečnostním lemem. Pokud tuto podmínku nelze zajistit mastektomií, je vhodné přistoupit ke krytí rozsáhlejších defektů lalokovými posuny. Pokud při první operaci není zajištěna dostatečná radikalita, je vhodné výkon rozšířit ve druhé době. Pooperačně je nutno pacienta velmi pečlivě dispenzarizovat. V případě podezření na lokoregionální recidivu je nutno ji co nejdříve ověřit biopsií a dle technických možností i tyto recidivy radikálně excidovat.
Vzhledem k vysoké malignitě a velké vzácnosti onemocnění se nám jeví v případě této diagnózy vhodné nasměrovat tyto pacientky na pracoviště, kde je možno zajistit dostatečně radikální výkon případně v součinnosti zkušeného mamárního a plastického chirurga.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Otakar Kubala, PhD.
Ivana Sekaniny 1801/9
708 00 Ostrava-Poruba
e-mail: otakar.kubala@fno.cz
Zdroje
1. Porter CA, White CJ. Multiple carcinomata following chronic x-ray dermatitis. Ann Surg 1907;46 : 649−71.
2. Vojtíšek R, Kinkor Z, Fínek J. Sekundární angiosarkomy po konzervativní léčbě nádorů prsu. Klin Onkol 2011;24 : 382−8.
3. Turner WH, Greenall MJ. Sarcoma induced by radiotherapy after breast conservation surgery. Br J Surg 1991;78 : 1317−8.
4. Fineberg S, Rosen PP. Cutaneous angiosarcoma and atypical vascular lesions of the skin and breast after radiation therapy for breast carcinoma. Am J Clin Pathol 1994;102 : 757−63.
5. Hodgson NC, Bowen-Wells C, Moffat F, et al. Angiosarcomas of the breast: a review of 70 cases. Am J Clin Oncol 2007;30 : 570−3.
6. Polgár C, Orosz Z, Szerdahelyi A, et al. Postirradiation angiosarcoma of the chest wall and breast: issues of radiogenic origin, diagnosis and treatment in two cases. Oncology 2001;60 : 31−4.
7. Monroe AT, Feigenberg SJ, Mendenhall NP. Angiosarcoma after breast-conserving therapy. Cancer 2003;97 : 1832−40.
8. Sessions SC, Smink RD Jr. Cutaneous angiosarcoma of the breast after segmental mastectomy and radiation therapy. Arch Surg 1992;127 : 1362−3.
9. Cozen W, Bernstein L, Wang F, et al. The risk of angiosarcoma following primary breast cancer. Br J Cancer 1999;81 : 532−6.
10. Stewart FW, Treves N. Lymphangiosarcoma in postmastectomy lymphedema; a report of six cases in elephantiasis chirurgica. Cancer 1948;1 : 64−81.
11. Virtanen A, Pukkala E, Auvinen A. Angiosarcoma after radiotherapy: a cohort study of 332,163 Finnish cancer patients. Br J Cancer 2007;97 : 115−7.
12. Pierce SM, Recht A, Lingos TI, et al. Long-term radiation complications following conservative surgery (CS) and radiation therapy (RT) in patients with early stage breast cancer. Int J Radiat Oncol Biol Phys 1992;23 : 915−3.
13. Chen KTR, Hoffman KD, Hendricks EJ. Angiosarcoma following therapeutic irradiation. Cancer 1979;44 : 2044−8.
14. Hardy TJ, An T, Brown PW, et al. Postirradiation sarcoma (malignant fibrous histiocytoma) of axilla. Cancer 1978;42 : 118−24.
15. Tsuneyoshi M, Enjoji M. Postirradiation sarcoma (malignant fibrous histiocytoma) following breast carcinoma: An ultrastructural study of a case. Cancer 1980;45 : 1419−23.
16. Edeiken S, Russo DP, Knecht J, et al. Angiosarcoma after tylectomy and radiation therapy for carcinoma of the breast. Cancer 1992;70 : 644−7.
17. Thijssens KM, van Ginkel RJ, Suurmeijer AJ, et al. Radiation-induced sarcoma: A challenge for the surgeon. Ann Surg Oncol 2005;12 : 237−45.
18. Blanchard DK, Reynolds C, Grant CS, et al. Radiation-induced breast sarcoma. Ann J Surg 2002;184 : 356−8.
19. Rosen PP, Kimmel M, Ernsberger D. Mammary angiosarcoma. The prognostic significance of tumor differentiation. Cancer 1988;62 : 2145−51.
20. Barrow BJ, Janjan NA, Gutman H, et al. Role of radiotherapy in sarcoma of the breast – a retrospective review of the M.D. Anderson experience. Radiother Oncol 1999;52 : 173−8.
21. Biswas T, Tang P, Muhs A, et al. Angiosarcoma of the breast: A rare clinicopathological entity. Am J Clin Oncol 2009;32 : 582−6.
22. Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: An overview of the randomised trials. Lancet 2005;366 : 2087−106.
23. Kirova YM, Vilcoq JR, Asselain B, et al. Radiation-induced sarcomas after radiotherapy for breast carcinoma: A large-scale single-institution review. Cancer 2005;104 : 856−63.
24. McGowan TS, Cummings BJ, O´Sullivan B, et al. An analysis of 78 breast sarcoma patients without distant metastases at presentation. In J Radiat Oncol Biol Phys 2000;46 : 383−90.
25. Yap J, Chuba PJ, Thomas R, et al. Sarcoma as a second malignancy after treatment for breast cancer. Int J Radiat Oncol Biol Phys 2002;52 : 1231−7.
26. Fisher B, Anderson SJ. The breast cancer alternative hypothesis: Is there evidence to justify replacing it? J Clin Oncol 2010;28 : 366−74.
27. Cahan WG, Woodward HQ, Highinbotham NL, et al. Sarcoma arising in irradiated bone: report of eleven cases. Cancer 1948;1 : 3−29.
28. Fodor J, Orosz Z, Szabó E, et al. Angiosarcoma after conservation treatment for breast carcinoma: our experience and a review of the literature. J Am Acad Dermatol 2006;54 : 499−504.
29. Kim MK, Huh SJ, Kim DY, et al. Secondary angiosarcoma following irradiation-case report and review of the literature. Radiat Med 1998;16 : 55−60.
30. Del Mastro L, Garrone O, Guenzi M, et al. Angiosarcoma of the residual breast after conservative surgery and radiotherapy for primary carcinoma. Ann Oncol 1994;5 : 163−5.
31. Clarke D, Martinez A, Cox RS, et al. Breast edema following staging axillary node dissection in patients with breast carcinoma treated by radical radiotherapy. Cancer 1982;49 : 2295−9.
32. Zietz C, Rössle M, Haas C, et al. MDM-2 oncoprotein overexpression, p53 gene mutation, and VEGF up-regulation in angiosarcomas. Am J Pathol 1998;153 : 1425−33.
33. McLaughlin ER, Brown LF, Weiss SW, et al. VEGF and its receptors are expressed in a pediatric angiosarcoma in a patient with Aicardi´s syndrome. J Invest Dermatol 2000;114 : 1209−10.
34. Solnic Z, Salopek D, Jazvic M, et al. Parenchymal post-irradiation angiosarcoma: A case report. Acta Clin Croat 2009;48 : 433−7.
35. Sener SF, Milos S, Feldman JL, et al. The spectrum of vascular lesions in the mammary skin, including angiosarcoma, after breast conservation treatment for breast cancer. J Am Coll Surg 2001;193 : 22−8.
36. Bolin DJ, Lukas GM. Low-grade dermal angiosarcoma of the breast following radiotherapy. Am Surg 1996;62 : 668−72.
37. Lamblin G, Oteifa M, Zinzindohoue C, et al. Angiosarcoma after conservative treatment and radiation therapy for adenocarcinoma of the breast. Eur J Surg Oncol 2001;27 : 146−51.
38. Lucas DR. Angiosarcoma, radiation-associated angiosarcoma, and atypical vascular lesion. Arch Pathol Lab Med 2009;133 : 1804−9.
39. Mermershtain W, Cohen AD, Koretz M, et al. Cutaneous angiosarcoma of breast after lumpectomy, axillary lymph node dissection, and radiotherapy for primary breast carcinoma: Case report and review of the literature. Am J Clin Oncol 2002;25 : 597−8.
40. Edge SB, Byrd DR, Compton CC, et al. AJCC soft tissue sarcoma. New York, Springer 2010 : 291−8.
41. De Smet S, Vandermeeren L, Christiansens MR, et al. Radiation-induced sarcoma: Analysis of 46 cases. Acta Chir Belg 2008;108 : 574−9.
42. Brennan MF, Winter S, Maki RG. Sarcomas of the soft tissues and bone. In: DeVita, Hellman and Rosenberg´s Cancer: Principles and Practice of Oncology. 8th ed. Philadelphia, Lippincott Williams & Wilkins 2008 : 1741−93.
43. Marchal C, Weber B, de Lafontan B, et al. Nine breast angiosarcomas after conservative treatment for breast carcinoma: a survey from French comprehensive cancer centers. Int J Radiat Oncol Biol Phys 1999;44 : 113−9.
44. Liberman L, Dershaw DD, Kaufman RJ, et al. Angiosarcoma of the breast. Radiology 1992;183 : 649−54.
45. Williams EV, Banerjee D, Dallimore N, et al. Angiosarcoma of the breast following radiation therapy. Eur J Surg Oncol 1999;25 : 221−2.
46. Brenin CM, Small W Jr, Talamonti MS, et al. Radiation-induced sarcoma following treatment of breast cancer. Cancer Control 1998;5 : 425−32.
47. Rao J, Dekoven JG, Beatty JD, et al. Cutaneous angiosarcoma as a delayed complication of radiation therapy for carcinoma of the breast. J Am Acad Dermatol 2003;49 : 532−8.
48. Plotti F, Di Donato V, Zullo MA, et al. An unusual case of secondary fibrosarcoma after treatment for breast cancer. Gynecol Oncol 2006;103 : 1133−6.
49. Borman H, Safak T, Ertoy D. Fibrosarcoma following radiotherapy for breast carcinoma: A case report and review of the literature. Ann Plast Surg 1998;41 : 201−4.
50. Fant J, Grant M, May S, et al. Angiosarcoma of the breast: Mammographic, clinical, and pathologic correlation. Breast J 2003;9 : 252−3.
51. Erel E, Vlachou E, Athanasiadou M, et al. Management of radiation-induced sarcomas in a tertiary referral centre: A review od 25 cases. Breast 2010;19 : 424−7.
52. Chapelier AR, Bacha EA, de Montpreville VT, et al. Radical resection of radiation-induced sarcoma of the chest wall: Report of 15 cases. Ann Thorac Surg 1997;63 : 214−9.
53. West JG, Quershi A, West JE, et al. Risk of angiosarcoma following breast conservation: A clinical alert. Breast J 2005;11 : 115−23.
54. Bjerkehagen B, Smeland S, Walberg L, et al. Radiation-induced sarcoma: 25-year experience from the Norwegian Radium Hospital. Acta Oncol 2008;47 : 1475−82.
55. Adhikari D, Hajdu SI, Levine D. Post-radiation angiosarcoma and bilateral mastectomy. Ann Clin Lab Sci 2002;32 : 428−33.
56. Wijnmaalen A, van Ooijen B, va Geel BN, et al. Angiosarcoma of the breast following lumpectomy, axillary node dissection, and radiotherapy for primary breast cancer: Three case reports and a review of the literature. Int J Radiat Oncol Biol Phys 1993;26 : 135−9.
57. Colville RJ, Ramsden A, Malcolm A, et al. Angiosarcoma of the breast after quadrantectomy and postoperative radiotherapy for carcinoma. Br J Plast Surg 1991;78 : 1317−8.
58. Turner WH, Greenall MJ. Sarcoma induced by radiotherapy after breast conservation surgery. Br J Surg 1991;78 : 1317−8.
59. Feigenberg SJ, Mendenhall NP, Reith JD, et al. Angiosarcoma after breast-conserving therapy: Experience with hyperfractionated radiotherapy. Int J Radiat Oncol Biol Phys 2002; 52 : 620−6.
60. Brady MS, Gaynor JJ, Brennan MF. Radiation-associated sarcoma of bone and soft tissue. Arch Surg 1992;127 : 1379−85.
61. Kuten A, Sapir D, Cohen Y, et al. Postirradiation soft tissue sarcoma occuring in breast cancer patients: Report of seven cases and results of combination chemotherapy. J Surg Oncol 1985;28 : 168−71.
62. Lagrange JL, Ramaioli A, Chateau MC, et al. Sarcoma after radiation therapy: Retrospective multiinstitutional study of 80 histologically confirmed cases. Radiation Therapist and Pathologist Groups of the Fédération Nationale des Centres de Lutte Contre le Cancer. Radiology 2000;216 : 197−205.
63. Quadros CA, Vasconcelos A, Andrade R, et al. Good outcome after neoadjuvant chemotherapy and extended surgical resection for a large radiation-induced high-grade breast sarcoma. Int Semin Surg Oncol 2006;3 : 18.
64. Strobbe LJ, Peterse HL, van Tinteren H, et al. Angiosarcoma of the breast after conservation therapy for invasive cancer, the incidence and outcome. An unforeseen sequela. Breast Cancer Res Treat 1998;47 : 101−9.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Vývoj mamologie v Čechách
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2017 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Vývoj mamologie v Čechách
- Můžeme se vyhnout disekci axilárních lymfatických uzlin?
- Vnitřní mamární uzliny u časného karcinomu prsu
- Spokojenost a celková kvalita života BRCA pozitivních žen po profylaktických výkonech
- Mikroskopické nádorové reziduum v reexcidované tkáni po konzervativních výkonech na prsu pro karcinom
- Magnetická rezonance v předoperační diagnostice invazivních lobulárních karcinomů prsu – analýza 230 případů
- Nový pohled na exenteraci axily při metastáze v sentinelové uzlině
- Radiací indukovaný (postiradiační) angiosarkom prsu – možnosti chirurgické léčby a přehled literatury
- XXIV. Pražské chirurgické dny 2017
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nový pohled na exenteraci axily při metastáze v sentinelové uzlině
- Můžeme se vyhnout disekci axilárních lymfatických uzlin?
- Spokojenost a celková kvalita života BRCA pozitivních žen po profylaktických výkonech
- Magnetická rezonance v předoperační diagnostice invazivních lobulárních karcinomů prsu – analýza 230 případů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




