-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu po neoadjuvantní chemoterapii: prospektivní multicentrická studie
The importance of sentinel lymph node biopsy following neoadjuvant chemotherapy in patients with breast cancer: prospective multicentre trial
Introduction: The role of sentinel lymph node biopsy (SLNB) in patients with breast cancer after neoadjuvant chemotherapy (NAC) is currently under discussion. The aim of our study was to determine the false negativity rate (FNR) of SLNB, the accuracy of ultrasound examination in the evaluation of the status of lymph nodes and the accuracy of perioperative cryobiopsy of the sentinel lymph node (SLN).
Methods: Prospective multicentre study, which took place in years 2018−2020 at three centres in the Czech Republic. A total of 59 patients were evaluated.
Results: The FNR of SLNB in the group of patients with cN1 before NAC and ycN0 after NAC was 12.5%. The FNR of perioperative histological examination of the SLN was 38.5%. The FNR of ultrasound examination of axillary lymph nodes in patients after NAC was 35.5%, and the false positivity rate was 16.7%. The incidence of inflammatory complications in our cohort was 3.3%.
Conclusion: The FNR of SLNB in the group of patients with cN1 before NAC and ycN0 after NAC exceeds the tolerable limit of 10%. The FNR of perioperative histological examination of the SLN is high; definitive histological examination of the SLN may change the original diagnostic-therapeutic plan. Ultrasound examination of the axillary lymph nodes in patients after NAC is a method with high false negativity and positivity and may not correspond with the perioperative finding. The incidence of inflammatory complications in our cohort in patients after NAC is comparable to literature data on the frequency of complications in patients without NAC.
Keywords:
breast cancer − sentinel lymph node biopsy − neoadjuvant chemotherapy − axillary dissection
Autori: J. Žatecký 1,2,3
; O. Kubala 1,4; O. Coufal 2,5
; M. Kepičová 4; J. Gatěk 6
; J. Prokop 1,4; M. Lerch 3; M. Peteja 1,3
Pôsobisko autorov: Katedra chirurgických oborů, Lékařská fakulta, Ostravská univerzita, Ostrava 1; Klinika operační onkologie, Masarykův onkologický ústav, Brno 2; Chirurgické oddělení, Slezská nemocnice v Opavě, p. o., Opava 3; Chirurgická klinika, Fakultní nemocnice Ostrava, Ostrava 4; Klinika operační onkologie, Lékařská fakulta, Masarykova univerzita, Brno 5; Chirurgické oddělení, EUC Klinika Zlín, Zlín 6
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 6, s. 271-276.
Kategória: Původní práce
doi: https://doi.org/10.33699/PIS.2021.100.6.271–277Súhrn
Úvod: Role chirurgické biopsie sentinelové uzliny (SLNB) u pacientek s karcinomem prsu po neoadjuvantní chemoterapii (NAC) je v současné době předmětem diskuzí. Cílem naší práce bylo zjistit falešnou negativitu (FNR) SLNB, přesnost ultrazvukového vyšetření při hodnocení stavu lymfatických uzlin a přesnost peroperační kryobiopsie sentinelové uzliny (SLN).
Metody: Prospektivní multicentrická studie, která probíhala v letech 2018−2020 na třech pracovištích v ČR. Celkem bylo hodnoceno 59 pacientek.
Výsledky: Falešná negativita SLNB u skupiny pacientek cN1 před NAC a ycN0 po NAC byla 12,5 %. FNR peroperačního histologického vyšetření SLN byla 38,5 %. FNR ultrazvukového vyšetření axilárních lymfatických uzlin u pacientek po NAC byla 35,5 %, falešná pozitivita byla 16,7 %. Incidence zánětlivých komplikací v našem souboru byla 3,3 %.
Závěr: Falešná negativita SLNB u skupiny pacientek cN1 před NAC a ycN0 po NAC přesahuje tolerovatelnou hranici 10 %. FNR peroperačního histologického vyšetření SLN je vysoká, definitivní histologické vyšetření SLN může změnit původní diagnosticko-terapeutický plán. Ultrazvukové vyšetření axilárních lymfatických uzlin je u pacientek po NAC metoda s vysokou falešnou negativitou i pozitivitou, a nemusí tedy korespondovat s peroperačním nálezem. Incidence zánětlivých komplikací v našem souboru u pacientek po NAC je srovnatelná s literárními údaji o četnosti komplikací pacientek bez NAC.
Klíčová slova:
karcinom prsu − chirurgická biopsie sentinelové uzliny − neoadjuvantní chemoterapie − axilární disekce
ÚVOD
Chirurgická biopsie sentinelové uzliny (SLNB) je dlouhodobě prověřenou metodou u pacientek s primárně chirurgicky léčeným karcinomem prsu a klinicky negativním nálezem na uzlinách. Oproti disekci I. a II. etáže axilárních lymfatických uzlin (AD) se SLNB vyznačuje nižší morbiditou [1]. Z onkologického hlediska jsou SLNB a AD srovnatelné u pacientek s klinicky negativními axilárními uzlinami v parametrech celkového přežití, přežití bez nemoci a v incidenci lokoregionální recidivy [2].
Dlouhodobě je známo možné využití neoadjuvantní chemoterapie (NAC) ke zmenšení primárního nádoru a snížení radikality výkonu v oblasti prsu. Během posledního desetiletí však sílí diskuze o možném využití NAC i ke snížení radikality výkonů na spádových uzlinách u pacientek s primárně metastatickými uzlinami (N1). V případě regrese po NAC by se i tyto pacientky mohly vyhnout axilární disekci, nicméně názory na optimální chirurgický přístup se různí, respektive není jednoznačně zodpovězena otázka, jestli je SLNB u těchto pacientek onkologicky bezpečná. Otázce se věnovaly dvě velké studie – SENTINA a ACOSOG Z1071 [3,4]. Shodně uvádějí, že využití SLNB u pacientek po NAC je omezeno falešnou negativitou (FNR) přesahující tolerovatelných 10 %, a to zvláště u skupiny pacientek cN1 před NAC a ycN0 po NAC [3,4]. Studie SENTINA udává u této skupiny pacientek FNR 14,2 % [3]. Řešením ke snížení FNR se ukázalo buď vyhodnocení 3 a více sentinelových uzlin, což ale není možné vždy a u všech pacientek, nebo použití cílené axilární disekce, kterou v roce 2016 publikovali Caudle a kol. a která snížila FNR pouze na 2 % [5].
Peroperační histologické vyšetření sentinelové uzliny je metoda s udávanou falešnou negativitou v rozmezí od 0 % do 56 % [6]. Tato metoda může pacienta ušetřit dalšího operačního zákroku, některá pracoviště ji však nepoužívají právě pro zmíněnou vysokou FNR.
Hodnocení axilárních lymfatických uzlin ultrazvukovým vyšetřením u pacientek po NAC je limitováno falešnou negativitou i pozitivitou metody [7]. Část pacientek je tedy před operací vyhodnocena nesprávně, což může ovlivnit další terapeutický postup.
Naše prospektivní multicentrická studie měla za úkol vyhodnocení falešné negativity chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu a cN1 před NAC a ycN0 po NAC, zjištění přesnosti ultrazvukového vyšetření při hodnocení klinického stavu lymfatických uzlin a přesnosti peroperační kryobiopsie sentinelové uzliny.
METODY
Studie byla konstruována jako prospektivní a multicentrická, probíhala od 1. 1. 2018 do 30. 11. 2020 ve třech mamárních centrech, a to na Chirurgické klinice Fakultní nemocnice Ostrava, Chirurgickém oddělení Slezské nemocnice v Opavě, p.o., a Chirurgickém oddělení EUC Kliniky Zlín. Poslední jmenované centrum bylo zapojeno od 1. 4. 2020. Studie byla schválena Etickou komisí Lékařské fakulty Ostravské univerzity a lokálními etickými komisemi jednotlivých zapojených center. Registrace studie byla provedena v online registru klinických studií www.clinicaltrials.gov pod označením NCT03556397.
Vstupní kritéria pro zařazení pacientek do studie byly diagnóza karcinomu prsu potvrzená bioptickým vyšetřením, léčba neoadjuvantní chemoterapií, po které následovala chirurgická léčba, a dále vyšetření axilárních uzlin klinicky i ultrazvukovým vyšetřením před i po NAC.
Do studie nebyly zařazovány pacientky s diagnózou inflamatorního karcinomu prsu, pacientky s inkompletní neoadjuvantní chemoterapií a s předchozí chirurgickou biopsií sentinelové uzliny na stejné straně.
Sledované parametry byly věk pacientek, velikost, typ a lokalizace tumoru v prsu, klinické stadium, stav axilárních uzlin před a po NAC, metoda zjištění stavu axilárních uzlin (ultrazvukové vyšetření, biopsie, klinické vyšetření), metoda zobrazení SLN (radiokoloid, patentní modř), typ chirurgického výkonu, výsledek histologického vyšetření, komplikace, výskyt lokálních či regionálních recidiv a vzdálených metastáz.
Indikace pacientek s diagnózou karcinomu prsu potvrzenou core cut biopsií k operačnímu výkonu i onkologické léčbě probíhala na základě doporučení multidisciplinárních mamárních onkologických týmů jednotlivých zapojených center. Všechny pacientky splňující vstupní kritéria byly seznámeny s možností účasti ve studii. Pacientky byly podrobně informovány o navrhované léčbě a poskytly písemný informovaný souhlas s operačním výkonem i s účastí ve studii.
V rámci stagingu a předoperační přípravy byla provedena standardní vyšetření. Při zvažování možnosti cílené axilární disekce byla na doporučení mamárního onkotýmu před začátkem NAC označena patologická lymfatická uzlina v axile markerem. Označení lymfatické uzliny i ultrazvukové vyšetření prsu a axily provedl radiolog specializující se na tuto problematiku. Při nástupu k hospitalizaci nebo v den operace bylo aplikováno 99mTc do oblasti nádoru k lokalizaci sentinelové uzliny. U pacientek s nehmatnými tumory prsu a plánovaným prs šetřícím výkonem bylo předoperačně provedeno ultrazvukově (UZ) navigované označení tumoru Frankeho vodičem.
Dle zvyklostí jednotlivých pracovišť byla u některých pacientek použita k ozřejmění sentinelové uzliny kromě 99mTc i druhá látka, a to patentní modř. Aplikace byla provedena po úvodu do celkové anestezie za aseptických kautel periareolárně či peritumorózně, aplikovány byly 2 ml s následnou 5 minut trvající masáží místa vpichu. V první části operace byla v axile pomocí gamma sondy a event. i modrého zbarvení detekována jedna nebo více sentinelových uzlin, které byly v indikovaných případech dle zvyklostí pracoviště odeslány na peroperační histologické vyšetření. Dle výsledku bylo dále pokračováno na základě doporučení mamárního onkotýmu v samplingu, cílené axilární disekci, limito - vané axilární disekci (axilární disekci I. etáže) či axilární disekci I. i II. etáže, které byly rozděleny a hodnoceny patologem zvlášť. Následně bylo přistoupeno k operaci na prsu. Dle velikosti tumoru, preferencí pacientky a dalších souvisejících faktorů, jako např. chronické onemocnění pacientky, byl indikován mamárním onkotýmem buď prs šetřící výkon, nebo mastektomie. Extirpace tumoru při prs šetřícím výkonu byla provedena elektrokauterem s dodržením bezpečnostního lemu zdravé tkáně kolem tumoru. Po odstranění tumoru byla kavita palpačně vyšetřena k vyloučení hmatných nádorových reziduí a bylo aplikováno několik kovových klipů k označení lůžka tumoru. Extirpát s tumorem i celý prs byl standardně označen k zachování orientace preparátu k histologickému vyšetření. Do dutiny po extirpaci nebo po mastektomii byl obvykle aplikován drén. Pooperačně byly pacientky sledovány za hospitalizace na chirurgickém oddělení.
Po dimisi byly pacientky periodicky zvány do onkologické ambulance nebo ambulance pro onemocnění prsu příslušné nemocnice. Sledované údaje byly vyhledávány ze zdravotnické dokumentace zapojenými lékaři v jednotlivých centrech a průběžně doplňovány do zdrojového souboru.
K výpočtu statistické analýzy byl použit program R 4.0.2 s knihovnami „rstatix“ a „survival“. K charakteristice souboru byly použity základní matematické metody – aritmetický průměr, medián, modus, absolutní četnost, relativní četnost.
VÝSLEDKY
Do studie bylo zařazeno 59 pacientek, dvě pacientky měly prokázaný oboustranný karcinom prsu, dohromady se tedy jedná o 61 karcinomů prsu s provedeným operačním výkonem. Průměrný věk pacientek byl 48,3 roku, medián 48 let a modus 56 let. Nejnižší věk v souboru byl 23 let, nejvyšší 77 let. Dle TNM klasifikace byl nejčastěji v souboru zastoupen karcinom prsu T2 ve 33 případech (54,1 %) a nádorové postižení lymfatických axilárních uzlin N1 ve 44 případech (72,1 %). Největší podskupinou byly pacientky s cN1 před NAC a ycN0 po NAC v 23 případech (37,7 %). Jedna pacientka měla v době diagnózy prokázány vzdálené metastázy (1,6 %). Rozdělení souboru dle TNM klasifikace je uvedeno v Tab. 1.
Tab. 1. Rozdělení pacientek dle TNM klasifikace před NAC
Tab. 1: Distribution of patients according to TNM classification before NAC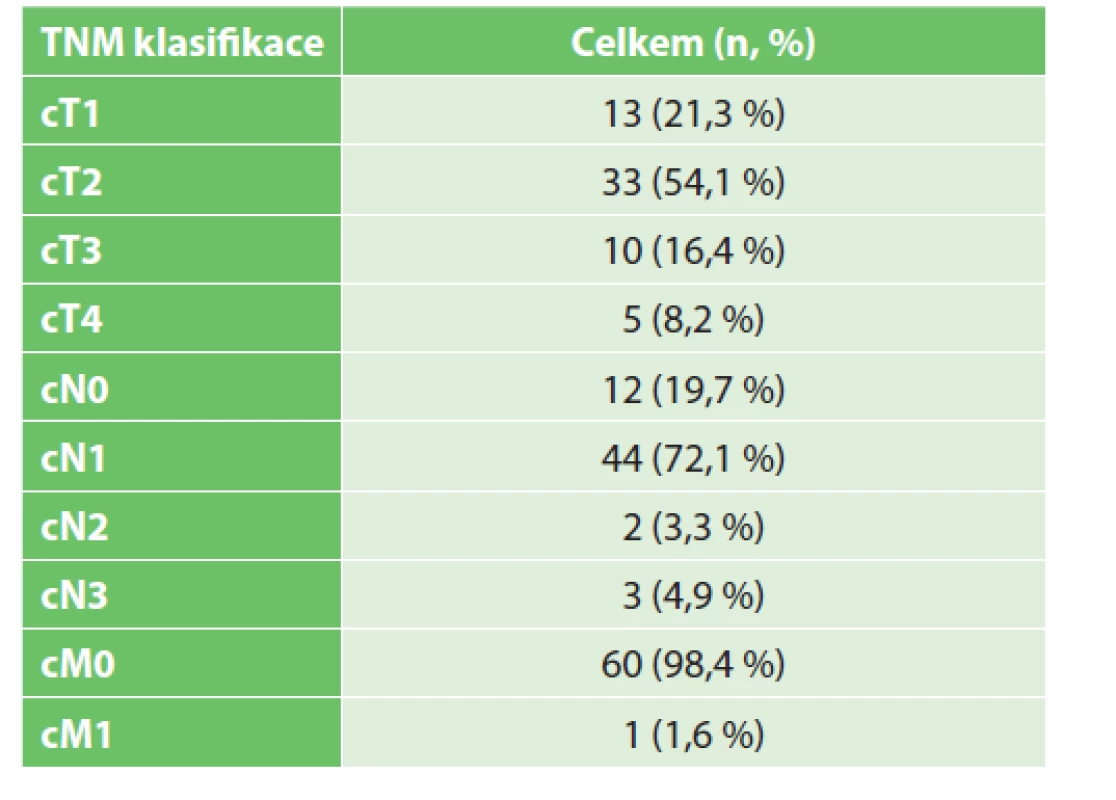
Při rozdělení dle typu tumoru byl nejvíce zastoupen karcinom NST v 51 případech (83,6 %), druhým nejčastějším typem byl lobulární karcinom v 6 případech (9,8 %). Dle diferenciace tumoru byl v souboru nejčastěji diagnostikován středně diferencovaný karcinom prsu (G2) ve 34 případech (55,7 %) – viz Tab. 2. Dle molekulárně biologické klasifikace byl v souboru pacientek nejvíce zastoupen triple negativní karcinom prsu ve 20 případech (32,8 %), dále pak karcinomu prsu typu luminal B v 18 případech (29,5 %), HER2 pozitivní karcinom prsu v 16 případech (26,2 %) a karcinom prsu typu luminal A v 7 případech (11,5 %).
Tab. 2. Rozdělení pacientek dle typu a stupně diferenciace tumoru.
Tab. 2: Distribution of patients according to tumour type and grade.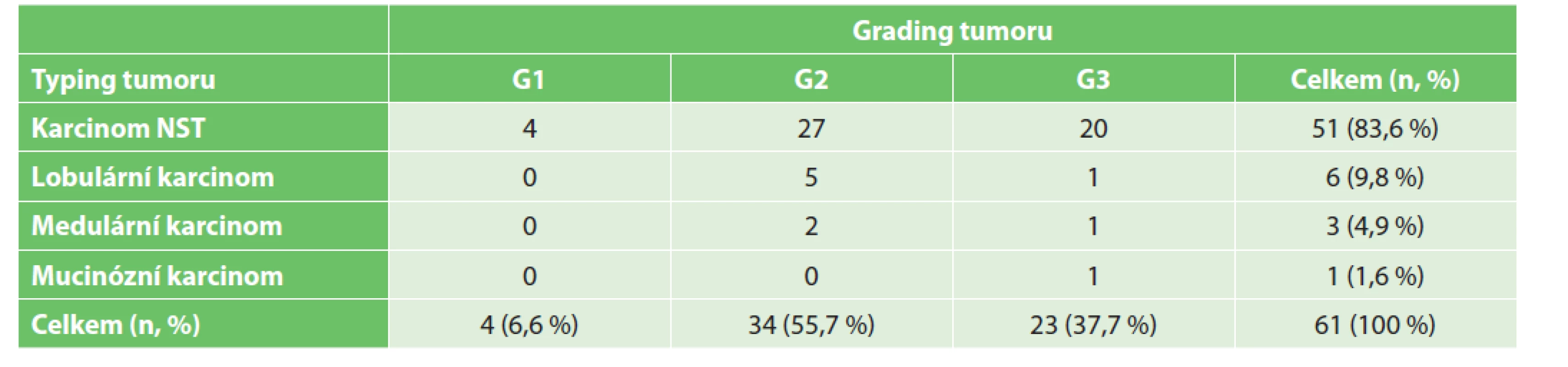
Po neoadjuvantní chemoterapii byl u všech pacientek indikován operační výkon na prsu a v axile. V oblasti prsu se nejčastěji jednalo o mastektomii, a to ve 44 případech (72,1 %), v axile byla nejvíce zastoupena axilární disekce I. a II. etáže ve 31 případech (53,5 %). Chirurgická biopsie sentinelové uzliny byla provedena ve 40 případech, v dalších 5 případech nebyla uzlina nalezena. Průměrný počet odebraných sentinelových uzlin byl 1,9, medián 1, minimum 1 a maximum 6. K úspěšné detekci sentinelové uzliny byla ve 24 případech použita scintigrafie, ve 13 případech kombinace scintigrafie a patentní modři a ve 3 případech pouze patentní modř. Průměrný počet nalezených uzlin u jednotlivých metod byl 2,0 při použití scintigrafie, 2,0 při použití kombinace scintigrafie a patentní modři a 1,0 při použití samotné patentní modři. Pro nízký počet pacientek nelze tento výsledek jednoznačně interpretovat jako nízkou úspěšnost poslední zmíněné metody.
V souboru byla sledována falešná negativita chirurgické biopsie sentinelové uzliny u podskupiny pacientek s cN1 před NAC a ycN0 po NAC. Do analýzy bylo zařazeno 16 pacientek s provedením chirurgické biopsie sentinelové uzliny a následně dalším výkonem v axile (axilární disekce I. a II. etáže, disekce I. etáže, sampling) s nálezem nádorové infiltrace sentinelové uzliny nebo nonsentinelových axilárních lymfatických uzlin. Průměrný počet sentinelových uzlin v této analýze byl 2,44, medián 1,5, minimum 1 a maximum 6. Ve 12 případech byly při pozitivní SLN postiženy i další uzliny v axile, ve 2 případech byly nonsentinelové uzliny bez nádorové infiltrace, přičemž sentinelová uzlina byla pozitivní. U dvou pacientek s negativní SLN došlo k nálezu nádorové infiltrace nonsentinelových uzlin. Falešná negativita této metody byla tedy 12,5 %.
Dále jsme u pacientek porovnávali soulad peroperačního histologického vyšetření SLN s definitivním vyšetřením. Soubor tvořilo celkem 33 případů. Ve 20 případech byla SLNB negativní dle peroperačního i definitivního hodnocení. Ve třinácti případech byly v sentinelových uzlinách nalezeny nádorové buňky. Z těchto 13 případů bylo 8 odhaleno i peroperačním vyšetřením, zatímco v 5 případech bylo peroperační hodnocení negativní a nádorové struktury byly nalezeny až při definitivním histopatologickém vyšetření. Z toho dvakrát se jednalo o ITC, dvakrát šlo o mikrometastázu a jednou dokonce o makrometastázu (Tab. 3). Falešná negativita peroperačního vyšetření SLN byla tedy 38,5 %.
Tab. 3. Porovnání výsledku peroperačního a definitivního vyšetření sentinelové uzliny
Tab. 3: Comparison of peroperative and definitive examination of the sentinel lymph node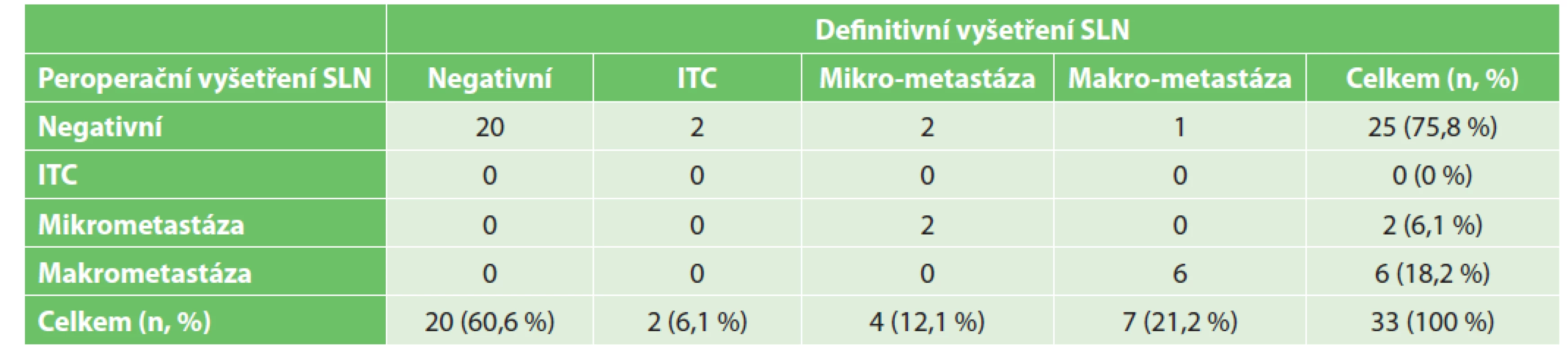
V souboru jsme sledovali falešnou negativitu a pozitivu UZ vyšetření axilárních lymfatických uzlin u pacientek po NAC. Do analýzy bylo zařazeno 61 případů, u kterých bylo po neoadjuvantní terapii provedeno UZ vyšetření axilárních uzlin, následně operační výkon v axile a histologické vyhodnocení resekátu. Z výsledků vyplývá, že v 11 případech nebylo při UZ vyšetření nalezeno postižení uzlin, dle histologického vyhodnocení však uzliny postiženy byly, falešná negativita tedy činila 35,5 %. V 5 případech bylo popsáno při UZ vyšetření postižení axilárních lymfatických uzlin, histologické vyhodnocení však postižení nenalezlo, falešná pozitivita byla 16,7 % (Tab. 4).
Tab. 4. Porovnání stavu lymfatických uzlin po NAC dle UZ vyšetření a dle histologického vyšetření.
Tab. 4: Comparison of the lymph node status after NAC according to US examination and histological examination.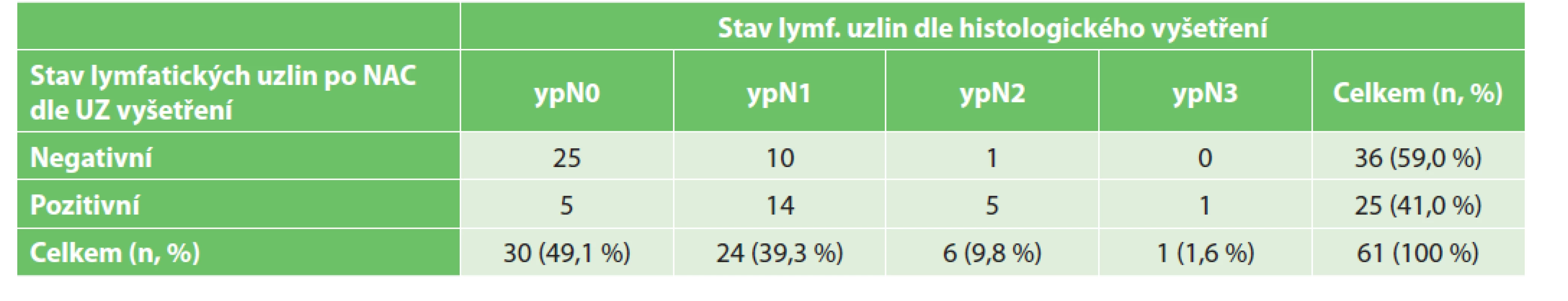
Pooperačně byla sledována incidence komplikací v souboru všech 61 operačních výkonů. Zánětlivé komplikace se vyskytovaly ve 2 případech (3,3 %), serom v ráně v 17 případech (27,9 %), lymfedém končetiny v 1 případě (1,6 %) a omezení pohybu končetiny v 1 případě (1,6 %). Celková incidence komplikací v souboru byla 34,4 %, komplikace se nevyskytovaly u 65,6 % pacientek.
DISKUZE
Falešná negativita SLNB u podskupiny pacientek s cN1 před NAC a ycN0 po NAC byla v naší studii 12,5 %, výsledek se tedy shoduje se studiemi SENTINA i ACOSOG Z1071 a překračuje tolerovatelných 10 % případů [3,4]. Doporučení vyplývající ze studie SENTINA ke snížení FNR je simultánně používat dva způsoby označení sentinelové uzliny – 99mTc a patentní modř – k nalezení a vyhodnocení 3 a více sentinelových uzlin [3]. Ke snížení falešné negativity SLNB u zmiňované podskupiny pacientek je možno použít metodu cílené axilární disekce, tedy označení původně patologické uzliny před NAC a její vyhodnocení spolu se sentinelovou uzlinou. V tomto případe je udávána FNR pouze 2 % [5].
Falešná negativita peroperačního histologického vyšetření sentinelové uzliny ve srovnání s definitivním vyšetřením byla v naší studii 38,5 %. Dle literatury je FNR peroperačního vyšetření udávána v rozmezí od 0 % do 56 % [6]. Wong a kol. udávají nejvyšší FNR při výskytu izolovaných nádorových buněk (ITC) v sentinelové uzlině, a to až 79,3 %, u mikrometastázy 59,8 % a u makrometastázy pouze 3,1 % [8]. Vysoká FNR u ITC a mikrometastázy vychází z principu samotné metody peroperačního vyšetření tzv. „na zmrzlo“. Peroperačně je většinou vyšetřena pouze část uzliny, zbytek je ponechán k definitivnímu vyšetření, při kterém je doplněno imunohistochemické vyšetření k lepší vizualizaci nádorových buněk. Některá pracoviště od této metody upouštějí právě pro vysokou falešnou negativitu [9]. Nevýhodou je, že po definitivním vyhodnocení sentinelové uzliny a indikaci k doplnění nejčastěji axilární disekce I. a II. etáže musí část pacientek podstoupit druhý operační výkon s celkovou anestezií [10].
Falešná negativita UZ vyšetření při hodnocení axilárních uzlin u pacientek po NAC byla v naší studii 35,5 %, falešná pozitivita 16,7 %. Dle odborné literatury je falešná negativita UZ v oblasti axily u pacientek s karcinomem prsu udávána až 38,6 %, falešná pozitivita pak 18 % [7]. U pacientek po NAC mohou být tyto parametry dle studií ještě vyšší. Coufal a kol. publikovali retrospektivní analýzu – ve skupině pacientek po NAC se vyskytovala falešná pozitivita v 6,1 % a falešná negativita v 48,7 % [11]. Hieken a kol. uvádějí ve své studii u pacientek po NAC s perzistujícím nádorovým postižením axilárních uzlin falešnou negativitu UZ 30,2 % a falešnou pozitivitu 41,9 % [12]. UZ vyšetření je metoda subjektivnější než jiné zobrazovací metody, a závisí tedy na zkušenostech provádějícího radiologa. Výsledky a s tím související falešná negativita a pozitivita se z tohoto důvodu mohou individuálně lišit.
Z důvodu zmíněné falešné pozitivity UZ vyšetření dochází u části pacientek k nesprávnému vyhodnocení stavu původně patologických axilárních uzlin po NAC, což může ovlivnit terapeutický postup. Pacientky s axilárními uzlinami považovanými za ycN1 mohou být primárně indikovány k AD místo SLNB, přičemž definitivní histologické vyšetření nemusí najít nádorové postižení lymfatických uzlin. Řešením u této skupiny pacientek by mohlo být použití cílené axilární disekce, u které je vyhodnocena podezřelá lymfatická uzlina spolu se sentinelovou uzlinou.
Incidence zánětlivých komplikací v našem souboru pacientek po NAC byla 3,3 %. Za zánětlivou komplikaci jsme považovali inflamaci či absces v operační ráně zaznamenané pooperačně během hospitalizace nebo v průběhu ambulantních kontrol. Bowen a kol. uvádějí ve své studii z r. 2017 incidenci zánětlivých komplikací ve skupině pacientek s NAC 2,24 %, ve skupině bez NAC 2,45 %, statisticky nebyl mezi skupinami prokázán významný rozdíl [13]. Xue a kol. uvádějí ve své metaanalýze, že NAC u pacientek nezvyšuje riziko zánětlivých komplikací po operaci [14]. Na základě těchto studií i našich výsledků můžeme říci, že incidence zánětlivých komplikací u pacientek bez NAC je srovnatelná s pacientkami s NAC.
ZÁVĚR
Falešná negativita SLNB u skupiny pacientek cN1 před NAC a ycN0 po NAC přesahuje tolerovatelnou hranici 10 %. Falešná negativita peroperačního histologického vyšetření SLN ve srovnání s definitivním histologickým vyšetřením je 38,5 %, po definitivním histologickém vyhodnocení SLN se může změnit na základě rozdílného výsledku diagnosticko-terapeutický plán. Incidence zánětlivých komplikací v našem souboru u pacientek po NAC je srovnatelná s některými literárními údaji o četnosti komplikací pacientek bez NAC. Ultrazvukové vyšetření axilárních lymfatických uzlin je u pacientek po NAC metoda s vysokou falešnou negativitou i pozitivitou, a nemusí tedy korespondovat s peroperačním nálezem.
Podpořeno MZ ČR – RVO (MOÚ, 00209805) a studentskou grantovou soutěží specifického vysokoškolského výzkumu Ostravské univerzity (SGS04/LF/2018-2019). Studie byla podkladem pro klinickou část disertační práce hlavního autora článku.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Jan Žatecký, PhD.
Slezská nemocnice v Opavě, p.o.
Olomoucká 470/86 746 01 Opava
e-mail: jan.zatecky@snopava.cz
ORCID: 0000-0002-0415-0853
Zdroje
1. Mansel RE, Fallowfield L, Kissin M, et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial. Journal of the National Cancer Institute 2006;98(9):599−609.
2. Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary - lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. The Lancet Oncology [online] 2010;11(10):927−933. doi: 10.1016/ S1470-2045(10)70207-2.
3. Kuehn T, Bauerfeind I, Fehm T, et al. Sentinel - lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. The Lancet Oncology 2013;14(7):609−618. doi: 10.1016/S1470-2045(13)70166-9.
4. Boughey JC, Suman VJ, Mittendorf EA, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA 2013;310(14):1455−1461. doi:10.1001/jama.2013.278932.
5. Caudle AS, Yang WT, Krishnamurthy S, et al. Improved axillary evaluation following neoadjuvant therapy for patients with node-positive breast cancer using selective evaluation of clipped nodes: Implementation of targeted axillary dissection. Journal of Clinical Oncology [online] 2016;34(10):1072−1078. doi: 10.1200/ JCO.2015.64.0094.
6. Liu LC, Lang JE, Lu Y, et al. Intraoperative frozen section analysis of sentinel lymph nodes in breast cancer patients: a meta - analysis and single-institution experience. Cancer 2011; 117(2):250−258. doi: 10.1002/cncr.25606.
7. Wyld L, Markopoulos C, Leidenius M, et al. Breast cancer management for surgeons: A European multidisciplinary textbook. B.m.: Springer International Publishing 2018.
8. Wong J, Yong WS, Thike AA, et al. False negative rate for intraoperative sentinel lymph node frozen section in patients with breast cancer: a retrospective analysis of patients in a single Asian institution. Journal of Clinical Pathology 2015;68(7):536−540. doi: 10.1136/jclinpath - 2014-202799.
9. Godazande G, Moradi S, Naghshvar F, et al. Is necessary intraoprative frozen section in sentinel lymph node biopsy for breast cancer patients? Asian Pacific Journal of Cancer Prevention [online]. 2020, 21(3):647−665.
10. Almarzooq R, Alrayes A, Saeed A, et al. Accuracy of intraoperative frozen section evaluation of sentinel lymph node biopsy in breast cancer: Our experience in Bahrain. The Gulf Journal of Oncology 2018;1(28):46−51.
11. Coufal O, Zapletal O, Gabrielová L, et al. Cílená axilární disekce a sentinelová biopsie u pacientek s karcinomem prsu po neoadjuvantní chemoterapii − retrospektivní studie. Rozhledy v chirurgii 2018;97(12):551−557.
12. Hieken TJ, Boughey JC, Jones KN, et al. Imaging response and residual metastatic axillary lymph node disease after neoadjuvant chemotherapy for primary breast cancer. Annals of Surgical Oncology [online] 2013;20(10):3199−3204. doi: 10.1245/ s10434-013-3118-z.
13. Bowen ME, Mone MC, Buys SS, et al. Surgical outcomes for mastectomy patients receiving neoadjuvant chemotherapy: A propensity-matched analysis. Annals of Surgery 2017;265(3):448−456. doi: 10.1097/SLA.0000000000001804.
14. Xue DQ, Quian C, Yang L, et al. Risk factors for surgical site infections after breast surgery: a systematic review and meta-analysis. European Journal of Surgical Oncology 2012;38(5):375−381. doi: 10.1016/j.ejso.2012.02.179.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2021 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Chirurgie prsu – důležitá součást onkochirurgie
- První zkušenosti s použitím jódových zrn pro lokalizaci nehmatných lézí v mamární chirurgii
- Mukokéla apendixu z perspektivy radiologa
- Význam chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu po neoadjuvantní chemoterapii: prospektivní multicentrická studie
- Komentář k článku: Žatecký J., et al. Význam chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu po neoadjuvantní chemoterapii: prospektivní multicentrická studie
- Předoperační CT pro plánování pooperační radioterapie karcinomu prsu
- Komentář k článku A. Hlávky a kol. Předoperační CT pro plánování pooperační radioterapie karcinomu prsu
- Úloha radiologa při neoadjuvantní systémové terapii karcinomu prsu
- Fyloidní tumor a jeho malignizace v invazivní duktální karcinom prsu − kazuistika
- Aneuryzma pankreatikoduodenální arkády při syndromu ligamentum arcuatum mediale – kazuistika a přehled literatury
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- První zkušenosti s použitím jódových zrn pro lokalizaci nehmatných lézí v mamární chirurgii
- Mukokéla apendixu z perspektivy radiologa
- Fyloidní tumor a jeho malignizace v invazivní duktální karcinom prsu − kazuistika
- Aneuryzma pankreatikoduodenální arkády při syndromu ligamentum arcuatum mediale – kazuistika a přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



