-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Carfilzomib
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. Supplementum, p. 33-36.
Kategória: Diagnostika a léčba mnohočetného myelomu
Carfilzomib je inhibitor proteazomu druhé generace. Jeho protinádorový účinek je zprostředkován selektivní a ireverzibilní inhibicí proteazomu v myelomových buňkách. Proteazom je zapojen do proteinového metabolismu buňky. Důsledkem jeho inhibice je hromadění nefunkčních proteinů a zásah do signálních drah, který způsobí narušení adheze myelomových buněk, potlačení angiogeneze, zastavení buněčného cyklu, omezení reparace genomové DNA a indukci apoptózy nádorových buněk.
Carfilzomib má díky své odlišné chemické struktuře, biologickým vlastnostem, mechanismu účinku a ireverzibilitě inhibice proteazomu oproti inhibitoru první generace (bortezomib) několik výhod v podobě zvýšené účinnosti a bezpečnosti lékového profilu s absencí významnější neurotoxicity (Jagannath, 2010; Lonial, 2011; Siegel, 2013). Překonání rezistence k bortezomibu v preklinických studiích (Kuhn, 2007; Demo, 2007; Suzuki, 2009) bylo potvrzeno i v klinických studiích fáze I/II (Lonial, 2011).
Carfilzomib (Kyprolis®, Onyx Pharmaceuticals) byl v červenci 2012 v USA schválen Federálním úřadem pro kontrolu léčiv (FDA) pro léčbu pacientů s relabujícím nebo refrakterním MM (RRMM), kteří absolvovali nejméně dvě předchozí linie léčby včetně bortezomibu a imunomodulační látky, a u kterých došlo k progresi onemocnění do 60 dnů od ukončení poslední terapie. V současné době probíhají přípravy registrace léku pro léčbu nemocných s RRMM Evropskou lékovou agenturou. V České republice se připravuje použití carfilzomibu u RRMM po schválení SÚKL v rámci Specifického léčebného programu.
Klinické studie u mnohočetného myelomu
1 Carfilzomib u pacientů s relabujícím nebo refrakterním MM (RRMM)
MONOTERAPIE
Účinnost a bezpečnost carfilzomibu v dávce 20–27 mg/m² v monoterapii byla u nemocných s RRMM testována v řadě klinických studií fáze II. PX-171-003-A1 byla klíčovou studií pro registraci léku v USA pro léčbu RRMM. Účinnost carfilzomibu v monoterapii byla potvrzena na souboru 266 významně předléčených nemocných (průměrně 5 léčebných linií) bortezomibem a imunomodulační látkou (thalidomid nebo lenalidomid). Většina pacientů byla refrakterní na poslední použitý režim. Celkové léčebné odpovědi dosáhlo 24 % nemocných. Medián doby trvání léčebné odpo-vědi (Duration of Response; DOR) byl 7,4 měsíce (Siegel, 2010).
V rámci klinické studie fáze II byl hodnocen efekt monoterapie carfilzomibem u pacientů s RRMM, kteří v předchozích liniích léčby bortezomibem léčeni nebyli (Vij, 2012). Těmto nemocným byla podávána fixní dávka carfilzomibu 20 mg/m² i.v. (kohorta 1; n = 59) nebo zvyšující se dávka carfilzomibu 20 mg/m² i.v. v prvním cyklu a 27 mg/m² i.v. ve všech následujících cyklech (kohorta 2; n = 70). V kohortě 1 dosáhlo celkové léčebné odpovědi (ORR) 42,4 % pacientů, medián TTP 8,3 měsíce, medián DOR 13,1 měsíce. V kohortě 2 ORR 52,2 %, medián TTP a DOR nebyl dosažen. Dávka 27 mg/m²se vstupním testovacím podáním 20 mg/m² byla doporučena pro první randomizovanou studii.
Randomizovaná klinická studie fáze III – FOCUS studovala protinádorový efekt carfilzomibu v dávce 27 mg/m² v monoterapii u významně předléčených pacientů s RRMM proti podávání nejlepší podpůrné léčby (BSC). U skupiny léčené carfilzomibem se statisticky významně zvýšil počet nemocných s dosažením léčebné odpovědi ORR 19,1 % vs. 11,4 % (p = 0,0305). U vysoce předléčené skupiny nemocných se nepodařilo dosáhnout prodloužení celkového přežití (10,2 vs. 10,0 měsíců) a přežití bez progrese onemocnění (3,7 vs. 3,3 měsíce) pomocí monoterapie v nízké dávce oproti kombinované paliativní léčbě. Jedním z nepřímých výstupů této studie je i doporučení používat carfilzomib ve vstupní vyšší dávce a v kombinovaném režimu nejméně s glukokortikoidy. To je předmětem dalších studií (Ludwig, 2014).
Výsledky léčby carfilzomibem u pacientů s RRMM jsou uvedeny v tabulce 3.
KOMBINOVANÉ REŽIMY
K dispozici jsou výsledky několika klinických studií fáze I/II u RRMM hodnotící carfilzomib v kombinovaných režimech s jinými léky. Režimy dosahují podle míry předléčení léčebné odpovědi v 33–87 % případů. Zásadní jsou výstupy z randomizované studie fáze III – ASPIRE, ve které byl carfilzomib v kombinaci s lenalidomidem a dexametazonem (C/LEN/DEX) porovnán s režimem LEN/DEX. Ve skupině C/LEN/DEX bylo dosaženo vyššího počtu ORR (87,4 % vs. 66,9 %) a delšího mediánu DOR (28,6 vs. 21,2 měsíce). Výstupy interní analýzy potvrdily statisticky významné prodloužení PFS ve skupině léčené C/LEN/DEX (26,3 vs. 17,6 měsíce; p < 0,0001). U celkového přežití ve dvou letech je patrný trend k prodloužení při použití režimu C/LEN/DEX (Stewart, 2014).
Jiná závažná pozorování
Výraznou předností carfilzomibu je, že nezpůsobuje závažnou polyneuropatii ani nezhoršuje polyneuropatii související s předchozí neurotoxickou léčbou. Carfilzomib je tedy možné podávat nemocným s pre-existující polyneuropatií (Jagannath, 2010; Siegel, 2013).
Účinnost carfilzomibu byla potvrzena i u významně předléčených pacientů s RRMM, jejichž předchozí léčba zahrnovala bortezomib a imunomodulační látku (thalidomid nebo lenalidomid) (Siegel, 2010). Carfilzomib nevykazuje zkříženou rezistenci s bortezomibem (Lonial, 2011). Výhodou léku je rychlý nástup léčebné odpovědi (Wang, 2011).
Carfilzomib lze bezpečně podávat u pacientů s renálním selháním bez nutnosti redukovat dávku léku (Badros, 2010).
Stále není ujasněno optimální dávkování. Novější studie používají dávky až 56 mg/m² a nejnovější studie ověřují možnost jedné týdenní dávky.
Vedlejší účinky a tolerance carfilzomibu
Carfilzomib má příznivý profil bezpečnosti bez vyskytující se kumulativní toxicity a neurotoxicity (Siegel, 2010; Vij, 2012; Jagannath, 2010, 2012). Nejčastějším nežádoucím účinkem je hematologická toxicita, únava, nevolnost, průjem, dušnost a horečka. V randomizované studii fáze III ASPIRE (C/LEN/DEX vs. LEN/DEX) byly s použitím carfilzomibu spojeny tyto specifické nehematologické vedlejší účinky: průjem (42,3 % vs. 33,7 %), únava (32,9 % vs. 30,6 %) a kašel (28,8 % vs. 17,2 %). K srdečnímu selhání došlo u 6,4 % nemocných. Výskyt významné periferní neuropatie – stupně ≥ 3 byl nízký (2,6 %) (Stewart, 2014).
Většina nežádoucích účinků carfilzomibu je zvládnutelná pomocí vhodných profylaktických opatření, přerušením podávání, případně úpravou dávky léku. Upřesňuje se vliv carfilzomibu na srdeční funkce, zvláště u nemocných s preexistujícím postižením srdce. Do vydání guidelines však není k dispozici žádná závazná analýza (Wang, 2013).
Optimální dávka carfilzomibu není stanovena. Dle SPC léku registrovaného v USA se carfilzomib podává intravenózně den 1, 2, 8, 9, 15 a 16 v 28denních cyklech. V prvním cyklu je lék podáván v dávce 20 mg/m² i.v. V případě tolerance léku se od druhého cyklu dávka zvyšuje na 27 mg/m². Léčba pokračuje do progrese onemocnění. Redukční kroky v případě výskytu toxicity jsou 20 mg/m² a 15 mg/m².
Ke snížení rizika rozvoje renální insuficience a syndromu nádorového rozpadu při podávání carfilzomibu je doporučena dostatečná hydratace – pitným režimem a podáním 250–500 ml fyziologického roztoku i.v. před a podle potřeby po aplikaci carfilzomibu. Před aplikací carfilzomibu je ke snížení rizika systémové reakce po infuzi doporučeno podat premedikaci dexametazonem 4 mg p.o. nebo i.v., pokud není dexametazon součástí kombinovaného chemoterapeutického režimu. Je doporučena profylaxe herpetických infekcí (acyklovir) (Kyprolis® SPC, 2012).
Doporučení pro léčbu carfilzomibem
- Carfilzomib je indikován k léčbě dospělých pacientů s relabovaným a refrakterním mnohočetným myelomem. Doposud není registrován v EU a jeho indikací v době do registrace je progredující refrakterní onemocnění po vyčerpání dostupné léčby (stupeň doporučení C, úroveň důkazu IV).
- Carfilzomib nemá být používaný v monoterapii (stupeň doporučení A, úroveň důkazu Ib), ale nejméně s dexametazonem (stupeň doporučení C, úroveň důkazu IV). Nejúčinnější kombinací v relapsu onemocnění s prokázaným přínosem je kombinace s dexametazonem a lenalidomidem (stupeň doporučení A, úroveň důkazu Ib).
- Carfilzomib se podává intravenózně den 1, 2, 8, 9, 15 a 16 v 28denních cyklech. V prvním cyklu je lék podáván v dávce 20 mg/m² i. v. V případě tolerance léku se od druhého cyklu dávka zvyšuje na 27 mg/m². Léčba pokračuje do progrese onemocnění dle SPC léku (stupeň doporučení A, úroveň důkazu Ia).
- U pacientů je doporučena profylaxe herpetických infekcí (acyklovir) (stupeň doporučení A, úroveň důkazu Ia).
- Použití carfilzomibu nezpůsobuje ani nezhoršuje polyneuropatii související s předchozí neurotoxickou léčbou. Carfilzomib je možné podávat nemocným s preexistující polyneuropatií (stupeň doporučení A, úroveň důkazu Ia).
Tab. 1. Některé klinické studie s použitím carfilzomibu u pacientů s RRMM. 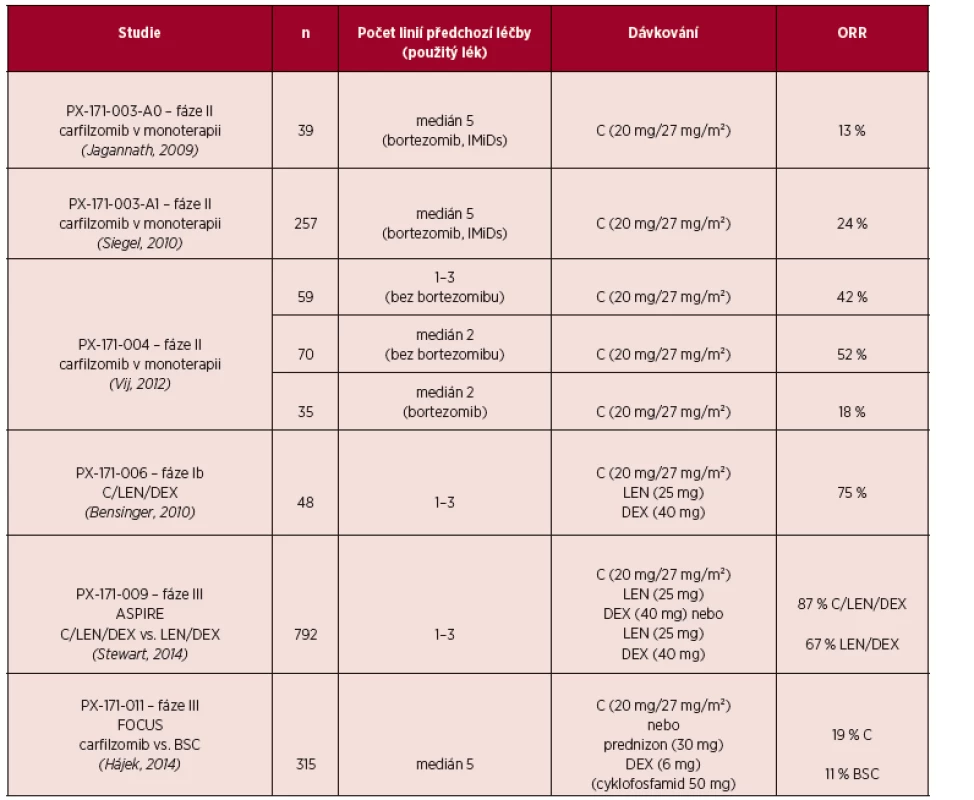
Zkratky: BSC – nejlepší podpůrná léčba, C-carfilzomib, DEX – dexametazon, IMiDs – imunomodulační látky, LEN – lenalidomid
Zdroje
1. Badros AZ, Vij R, Martin T, et al. Phase II study of carfilzomib in patients with relapsed/refractory multiple myeloma and renal insufficiency. J Clin Oncol 2010; 28(Suppl 15s): Abstr: 8128.
2. Bensinger W, Wang M, Orlowski RZ, et al. Dose-escalation study of carfilzomib (CFZ) plus lenalidomide (LEN) plus low-dose dexamethasone (Dex) (CRd) in relapsed/refractory multiple myeloma (R/R MM). J Clin Oncol 2010; 28(15): 8029.
3. Demo SD, Kirk CJ, Aujay MA, et al. Antitumor activity of PR -171, a novel irreversible inhibitor of the proteasome. Cancer Res 2007; 67(13): 6383–6391.
4. Hajek R, Masszi T, Petrucci MT, et al. Carfilzomib versus best supportive care for patients with relapsed and refractory multiple myeloma (FOCUS): A randomized, open-label, phase 3 study. ASH Annual Meeting Abstracts 2014.
5. Jagannath S, Vij R, Kaufman JL, et al. Long-term treatment and tolerability of the novel proteasome inhibitor carfilzomib (CFZ) in patients with relapsed and/or refractory multiple myeloma (R/R MM) ASH Annual Meeting Abstracts. 2010; 116(21): Abstr: 1953.
6. Jagannath S, Vij R, Martin TM, et al. Carfilzomib is associated with a low rate of typically mild to moderate, non-dose limiting treatment-emergent peripheral neuropathy. European Hematological Association Annual Meeting. 2012; Abstr: 0857.
7. Jagannath S, Vij R, Stewart K, et al. Final results of PX-171-003-A0, part 1 of an open-label, single-arm, phase II study of carfilzomib (CFZ) in patients (pts) with relapsed and refractory multiple myeloma (MM) J Clin Oncol 2009; 27(Suppl 15s): Abstr 8504.
8. Jakubowiak AJ, Siegel DS, Singhal S, et al. Unfavorable cytogenetic characteristics do not adversely impact response rates in patients with relapsed and/or refractory multiple myeloma treated with single-agent carfilzomib on the 003 (A1) study. ASH Annual Meeting Abstracts 2011; 118(21): Abstr: 1875.
9. Kuhn DJ, Chen Q, Voorhees PM, et al. Potent activity of carfilzomib, a novel, irreversible inhibitor of the ubiquitin-proteasome pathway, against preclinical models of multiple myeloma. Blood 2007; 110(9): 3281–3290.
10. Lonial S, Boise LH. Current advances in novel proteasome inhibitor – based approaches to the treatment of relapsed/refractory multiple myeloma. Oncology 2011; 25(2).
11. Ludwig H, Masszi T, Petrucci M, et al. Carfilzomib (K) vs low-dose corticosteroids and optional cyclophosphamide (Cy) in patients (pts) with relapsed and refractory multiple myeloma (RRMM): Results from a phase 3 study (FOCUS). ESMO Meeting Abstracts. 2014.
12. Onyx Pharmaceuticals, Inc. Kyprolis® (carfilzomib) prescribing information. South San Francisco, CA, USA; Onyx Pharmaceuticals, Inc. 2012.
13. Siegel DS, Martin T, Nooka A, et al. Integrated safety profile of single-agent carfilzomib: experience from 526 patients enrolled in 4 phase II clinical studies. Haematologica 2013 Nov; 98(11): 1753-61.
14. Siegel DS, Martin T, Wang M, et al. Results of PX-171-003-A1, an open-label, single-arm, phase 2 (Ph2) study of carfilzomib (CFZ) in patients (pts) with relapsed and refractory multiple myeloma (MM). ASH Annual Meeting Abstracts 2010; 116: Abstract 985.
15. Stewart AK, Rajkumar SV, Dimoploulos MA, et al. Carfilzomib, lenalidomide, and dexamethasone vs lenalidomide and dexamethasone in patients with relapsed multiple myeloma: interim results from ASPIRE, a randomized, open-label, multicenter phase 3 study. ASH Annual Meeting Abstracts 2014.
16. Suzuki E, Demo S, Arastu-Kapur S, et al. Bortezomib resistant cell lines have increased proteasome levels but remain sensitive to carfilzomib. Blood 2009; 114: Abstr. 2852.
17. Vij R, Wang M, Kaufman JL, et al. An open-label, single-arm, phase 2 (PX-171-004) study of single-agent carfilzomib in bortezomib-naive patients with relapsed and/or refractory multiple myeloma. Blood 2012; Jun 14; 119 (24): 5661-70.
18. Wang L, Siegel DS, Jakubowiak AJ, et al. The speed of response to single-agent carfilzomib in patients with relapsed and/or refractory multiple myeloma: An exploratory analysis of results from 2 multicenter phase 2 clinical trials. ASH Annual Meeting Abstracts. 2011; 118 (21): Abstr: 3969.
19. Wang M, Cheng J. Overview and Management of Cardiac and Pulmonary Adverse Events in Patients With Relapsed and/or Refractory Multiple Myeloma Treated With Single-Agent Carfilzomib. Oncology (Williston Park). 2013 Dec 1; 27(12 Suppl 3). pii: 189776. Review.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek ÚvodníkČlánek Změny od roku 2012Článek PomalidomidČlánek ÚvodníkČlánek Souhrn doporučení 2014
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo Supplementum- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Nabídka klinické studie pro pacienty s Waldenströmovou makroglobulinémií
- Úvodník
- Diagnostika a léčba mnohočetného myelomu - Autoři
- Změny od roku 2012
- Pomalidomid
- Úvodník
- Carfilzomib
- Klub pacientů mnohočetný myelom
- Česká myelomová skupina, nadační fond (CMG NF)
- 11. Hematologie a transfuzní lékařství
- Diagnostika a léčba Waldenströmovy makroglobulinemie - Autoři
- Diagnostika a léčba Waldenströmovy makroglobulinemie - Obsah guidelines
- Souhrn doporučení 2014
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Souhrn doporučení 2014
- Carfilzomib
- Diagnostika a léčba mnohočetného myelomu - Autoři
- 11. Hematologie a transfuzní lékařství
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



