-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Inkontinence u pacientů po prostatektomii: přehled současných možností vyšetřování a léčby
POST PROSTATECTOMY INCONTINENCE: A REVIEW OF CURRENT ASSESSMENT AND MANAGEMENT
The significance of incontinence post radical prostatectomy has risen with the increased use of the procedure. While rates are high in the initial postoperative period, in the majority of patients symptoms become manageable with time. In those with persistent impairment careful clinical assessment is required and both conservative and surgical management options exist. While the artificial urinary sphincter has been the gold standard in surgical management many alternatives exist and are still being developed. The timing, choice and patient selection for surgical management remains a challenge.
Key words:
incontinence, radical prostatectomy, artificial urinary sphincter
Autori: S. J. S. Grimsley; Z. Almallah
Vyšlo v časopise: Urol List 2013; 11(3): 13-17
Súhrn
Spolu s častějším prováděním radikální prostatektomie se zvětšuje význam inkontinence vyskytující se u pacientů podstupujících tento výkon. Ačkoli bezprostředně po operaci je míra výskytu inkontinence vysoká, u většiny pacientů symptomy spolu s časem ustupují. U jedinců, u nichž tato porucha přetrvá, je nutné pečlivé klinické vyšetření. K dispozici je v tomto případě jak konzervativní, tak operační léčba. Za zlatý standard v rámci operační léčby se stále považuje implantace umělého močového svěrače, k dispozici je však celá řada dalších alternativ a další modality jsou ve fázi vývoje. Vhodné načasování léčby, volba správné modality a výběr vhodného pacienta tak nadále představují náročný úkol.
Klíčová slova:
inkontinence, radikální prostatektomie, umělý močový svěračÚvod
Inkontinence vyskytující se po radikální prostatektomii (hlavní modalitě pro léčbu lokalizovaného karcinomu prostaty) (PPI) je komplikací, která může mít potenciálně zničující dopad na pacientovo fyzické i duševní zdraví i jeho společenský život. Míra incidence PPI se vzhledem k rozdílným definicím skutečné inkontinence v literatuře významně liší, pohybuje se v rozmezí 1–87 % [1]. Gacci et al [2] při vyšetřování 1 972 pacientů jeden měsíc po operaci zaznamenali následující výsledky: 32,7 % pacientů bylo plně kontinentních, 41,1 % pacientů užívalo 0–1 vložku denně a 26,3 % pacientů vyžadovalo použití více než jedné vložky denně. Tato komplikace však má tendenci spontánního ústupu u značného procenta pacientů – v rozmezí od 60 % krátce po operaci až po 15 % po 15 měsících (data z jedné retrospektivní studie) [3]. Lepor et al [4] uvádějí po dvou letech po operaci 98,5% míru kontinence.
Základní postup při léčbě PPI bezprostředně po operaci spočívá v posilování svaloviny pánevního dna. Pokud se však tato metoda prokáže jako nedostačující, k dispozici je celá řada možností operační léčby. Za zlatý standard se nadále považuje implantace umělého močového svěrače (AUS, Artificial Urinary Sphincter), využívají se však i další alternativy. Spolu s častějším prováděním prostatektomie se zvyšuje i míra inkontinence po tomto výkonu (rozmezí 1–10 %) [5]. Velká retrospektivní analýza uvádí po pěti letech po výkonu 2,6% míru PPI, která se zvyšuje na 5 % po 15 letech [6]. Analýza údajů SEER uvádí v průměru 20 měsíců po operaci 6% míru inkontinence [7].
Patofyziologie
V naprosté většině případů bývá PPI připisována nedostatečnosti svěrače v důsledku poranění rabdosfinkteru během preparace apexu [8]. Mostwin [9] navrhuje jako možnou příčinu PPI různé mechanizmy, k nimž dochází při operační léčbě – např. ischemii, imobilizaci jizvou, atrofii, přímé poranění pudendálního nervu a zkrácení funkční části močové trubice. Walsh et al [10] připisují anatomickým faktorům během preparace a anastomózy zásadní roli a domnívají se, že na PPI se může podílet rovněž poškození svěrače během radioterapie anebo denervace.
Jako další příčiny se uvádějí například dysfunkce močového měchýře včetně hyperaktivity detruzoru (DO), zhoršená compliance a snížená kontraktilita po denervaci močového měchýře [11]. Další možností je obstrukce výtoku z močového měchýře v důsledku stenózy anastomózy, patofyziologie může spočívat v hyperaktivním detruzoru v důsledku obstrukce nebo rigidní kontraktury, jež zamezuje účinnému uzávěru zachovaného svěrače [12]. Groutz et al [13] při analýze výsledků videourodynamické studie u 83 pacientů s PPI zjistili jako nejčastější příčinu nedostatečnost vnitřního svěrače (88 % pacientů), u 34 % pacientů byl identifikován hyperaktivní detruzor a u 30 % pacientů byla přítomna zhoršená compliance močové trubice způsobená jizvením.
Rizikové faktory
Bylo prokázáno, že řada faktorů souvisejících s operační léčbou a parametrů pacienta zvyšují riziko PPI. Nam identifikoval následující prediktory vyššího rizika PPI: věk pacienta, adjuvantní radioterapie a malý počet provedených výkonů (49 výkonů/rok). Jako rizikové faktory související s operační léčbou se uvádí užití techniky se šetřením nervů a krevní transfuze [14], ačkoli retrospektivní analýza tyto faktory nepotvrdila [15]. Gacci et al ve své studii uvádějí, že zachování hrdla močového měchýře, kratší délka katetrizace a menší průměr užitého katetru jsou spojeny s lepší kontinencí jeden měsíc po výkonu, což však nebylo prokázáno při technice se šetřením nervových svazků. Rizikové parametry na straně pacientů zahrnují věk, anamnézu TURP, diabetes, index tělesné hmotnosti [1], velikost prostaty a dobrou sexuální funkci [2].
Následující techniky umožňují lepší zachování kontinence po výkonu: periuretrální suspenze, zachování laterální prostatické fascie nebo rekonstrukce zadní stěny močové trubice [16]. K lepšímu výsledku přispívá rovněž časné odhalení a odstranění anastomotické sutury umístěné v zachovaném svěrači [17].
Vyšetření
Úspěšné řešení PPI spočívá v časném odhalení tohoto onemocnění a pečlivé léčbě, ideálně v terciárním zdravotnickém zařízení. Podrobná anamnéza by se měla zaměřovat na dobu a povahu nástupu PPI, detaily týkající se předchozích chirurgických výkonů, souvisejících symptomů a hodnocení závažnosti úniku moči a jeho dopadu na kvalitu života pacienta. Pomocí validovaných dotazníků, jako je např. ICIQ-SF (International Consultation on Incontinence Questionnaire – zkrácená verze), lze standardizovat klasifikování závažnosti symptomů. Vyšetření by mělo zahrnovat detekci hmatného měchýře, DRE a neurologické vyšetření S2–4.
Doporučuje se rozbor moči, kultivace, měření objemu postmikčního rezidua, vedení mikčního diáře pacientem po dobu 2–7 dní a test s vážením vložek (pad test), jenž slouží k objektivnímu posouzení závažnosti úniku moči. Dále je třeba provést cystouretroskopii, jež umožní detekovat případnou stenózu hrdla močového měchýře. Pro potvrzení patofyziologie (ať už se jedná o nedostatečnost svěrače, nebo dysfunkci močového měchýře) je důležité provedení multikanálové videourodynamické studie. Hrdlo močového měchýře během jímací fáze, Valsalvova manévru i močení lze vizualizovat pomocí fluoroskopie.
Konzervativní léčba a farmakoterapie
Účinek posilování svaloviny pánevního dna (PFMT) při léčbě ženské stresové inkontinence (SUI) byl impulzem pro zavedení této techniky v rámci léčby PPI (před i po operační léčbě). Ačkoli jednotlivé studie prokazují benefit tohoto postupu, Cochrane metaanalýza [18] ukazuje, že počáteční zlepšení zaznamenané ve srovnání s kontrolní skupinou netrvá déle než šest měsíců. Rovněž nebyla dosud u mužů stanovena optimální technika PFMT. Floratos et al [19] prokázali lepší výsledky u pacientů, kterým bylo posilování důkladně slovně popsáno. Anglická studie, v níž byli pacienti s PPI randomizováni k terapii se školeným fyzioterapeutem nebo jim byly poskytnuty pouze obecně dostupné informace o PFMT, však neprokázala 12 měsíců po výkonu žádný rozdíl v kontinenci [20].
Jako doplňující metody k PFMT se užívají biofeedback a elektrická/magnetická stimulace pánevního dna. U 96 % pacientů bylo po 12 měsících provádění biofeedbacku v kombinaci s PFMT zaznamenáno významné zlepšení kontinence (ve srovnání s kontrolní skupinou) [21]. Studie zahrnující tři studijní větve uvádí po čtyřech týdnech elektrické nebo magnetické stimulace zmírnění úniku moči, tento benefit však netrval déle než šest měsíců.
Ačkoli anticholinergika mají své pevné místo v rámci léčby hyperaktivního detruzoru a mohou být indikována, pokud urodynamická studie prokáže, že hyperaktivní detruzor přispívá k inkontinenci, nebyla tato léčba schválena pro léčbu běžněji se vyskytující PPI u pacientů s oslabeným svěračem. Duloxetin, inhibitor zpětného vychytávání serotoninu/noradrenalinu, vyvolává relaxaci detruzoru a současně zvyšuje tonus hladké svaloviny močové trubice prostřednictvím Onufova jádra. Tento preparát byl schválen pro léčbu SUI u žen. Studie zahrnující 20 mužů se SUI prokázala při užívání 40 mg duloxetinu dvakrát denně redukci počtu užitých vložek, u šesti pacientů se však vyskytly závažné vedlejší účinky [22]. Jedna randomizovaná kontrolovaná studie [23] prokázala redukci počtu užitých vložek a zlepšení kvality života související s inkontinencí po 16 týdnech.
Preparáty podávané injekčně
Injekční aplikace periuretrálních implantátů (bulking agens) zvyšuje odpor v močové trubici a koaptaci svěrače. Užívají se různé látky, např. teflon, kolagen, makroplast, silikon nebo autologní tuk. Ačkoli několik studií prokázalo počáteční zlepšení při této léčbě, obvykle se jednalo o malé studie bez kontrolních skupin a v případě delší periody sledování účinek nepřetrval delší dobu. Martins et al [24] při aplikaci kolagenu u 46 pacientů zaznamenali zlepšení u 65 % jedinců. Větší studie testující léčbu kolagenem u 322 mužů s nedostatečností vnitřního svěrače rovněž prokázala, že pro zachování účinku je nutná opakovaná aplikace injekce [25]. Makroplast se užívá při léčbě mužské i ženské stresové inkontinence. Schneider et al [26] zaznamenali zlepšení u 93 % pacientů s inkontinencí prvního nebo druhého stupně a pouze u 59 % pacientů s inkontinencí třetího stupně. Slabší účinek byl zaznamenán u pacientů, u nichž byla léčba podávána později než jeden rok po primárním výkonu.
Cochrane analýza [27] randomizovaných studií zabývajících se léčbou PPI odhalila pouze jediné použitelné srovnání makroplastu a AUS – umělý svěrač byl účinnější, ovšem pouze u pacientů se závažnější formou inkontinence. Obecně platí, že u pacientů se závažnější formou inkontinence dosahuje aplikace bulking agens horšího výsledku než implantace AUS a účinek přetrvá pouze krátkou dobu. Z tohoto důvodu se tato léčba doporučuje pouze pacientům s mírnou formou PPI. U pacientů s PPI s významnou komponentou DO lze zvážit injekční aplikaci botulotoxinu do detruzoru.
Umělý močový svěrač
Implantace umělého močového svěrače se již nějakou dobu považuje za zlatý standard při léčbě PPI, vzhledem k tomu, že o této modalitě máme k dispozici nejvíce poznatků a dosahuje nejspolehlivějších výsledků u pacientů s PPI. Umělý močový svěrač byl poprvé představen v roce 1973, v roce 1983 byl na trh uveden prototyp AUS 800 (American Medical Systems), který se ovšem stále běžně užívá. AUS se skládá ze tří částí: nafukovací manžety, která se umístí kolem bulbární části močové trubice prostřednictvím perineální incize, zásobníku umístěného v suprapubické oblasti a pumpičky umístěné obvykle v povrchové části skrota, jež převádí tekutinu mezi manžetou a zásobníkem skrze spojující hadičku. V nafouknutém stavu manžeta stlačuje močovou trubici, díky čemuž je dosaženo kontinence. AUS lze lehce modifikovat změnou velikosti manžety (od 3,5 do 4,5 cm), potahovým materiálem manžety a použitím spojovací hadičky bez ligatury, což prodlužuje životnost zařízení [28].
Míra účinnosti AUS se pohybuje v rozmezí od 59 % do 90 % (viz tabulku) [1]. Počet spokojených pacientů obvykle převyšuje počet zcela kontinentních pacientů, což svědčí o tom, že léčba vede k významnému zlepšení i v případě, že pacient pociťuje určitý únik moči [29]. V jedné z největších studií [32] zahrnující 218 pacientů, jimž byl implantován AUS (176 z nich mělo PPI), Lai et al uvádějí po 3,1 letech 69% úspěšnost. Raj [30] uvádí po 68 měsících 90% míru kontinence u 435 pacientů, jimž byl AUS implantován poprvé a 82% míru kontinence u 119 pacientů, kteří podstoupili opakovanou implantaci AUS.
Tab. 1. Přehled větších studií zabývajících se implantací AUS. 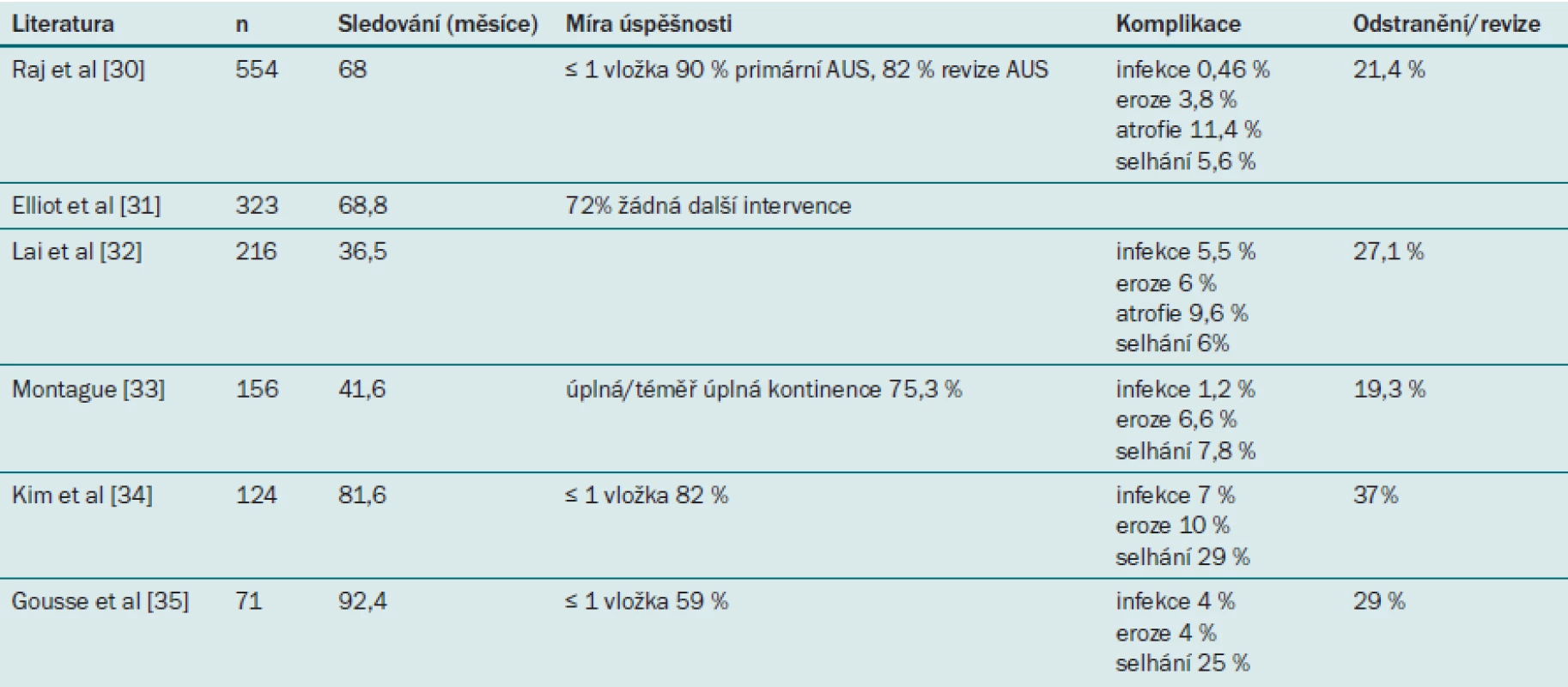
Hlavní komplikace spojené s implantací AUS zahrnují vznik infekce v umělém svěrači, uretrální erozi a mechanické selhání. Nejlepšího výsledku lze v takovém případě dosáhnout odstraněním nebo nahrazením části zařízení. V literatuře se uvádí míra revize/odstranění svěrače v rozmezí od 21 % do 37 % [28]. Při první implantaci se výsledek bez nutnosti opakovat výkon po pěti letech podle Kaplan-Meierovy metody pohybuje v rozmezí od 50 % do 79 % a po deseti letech v rozmezí 64 % až 72 %.
Literatura uvádí protichůdné údaje s ohledem na výsledek implantace AUS u pacientů po radioterapii – Walsh et al uvádějí vyšší míru eroze, uretrální atrofie a infekce (41 % po radioterapii, 11 % bez radioterapie) [36], ovšem Gomha et al [37] nezaznamenali žádný rozdíl.
K dispozici jsou nejrůznější moderní varianty AUS [38]. Systém FlowSecureTM (RBM-Med) sestává z jediné části, která zahrnuje dva zásobníky umístěné v paravezikálním prostoru, periuretrální manžety a pumpičky uložené ve skrotu, které se zavádějí skrze perineální/suprapubickou incizi. Druhý zásobník uvolňuje stresový tlak při zvýšení intra-abdominálního tlaku. Systém Periurethral Constrictor (Silimed) je zařízení skládající se ze dvou částí. Manžeta je připevněna k podkožní chlopni, která se aktivuje 6–8 týdnů po implantaci. Systém ZSI375 (ZEPHYR Surgical Implants) je AUS sestávající z jedné části, skládá se z nafukovací modifikovatelné manžety, skrotální pumpičky se zabudovanou tlakovou nádobkou, jež umožňuje svěrač precizně seřídit in situ. Systém Tape Mechanical Occlusive Device (GT Urological) je pružinové zařízení s okluzivní páskou kolem močové trubice, jež je připevněna pomocí pásky k vypínači umístěnému v šourku, který vyvíjí tlak na linie sutury probíhající skrze pásky. V současné době očekáváme výsledky týkající se těchto zařízení.
Mužský sling
Implantace slingu představuje méně invazivní alternativu, jež neklade na pacienta požadavky v podobě dostatečné zručnosti, mentální kapacity a ochoty manipulace s pumpičkou nebo vypínačem při každém močení. Sling v zásadě stlačuje močovou trubici na ventrální straně, čímž zvyšuje její odpor (na rozdíl od AUS, který je umístěn kolem močové trubice). Dorzální a laterální krevní zásobení je tak ponecháno intaktní, čímž se snižuje riziko eroze. Slingy se dělí na suprapubické suspenze, slingy ukotvené do kosti, transobturatorní suspenze s doplňkovým systémem, kdy je koaptace dosaženo stlačením balónků na obou stranách močové trubice. Slingy se vyrábějí z nejrůznějších materiálů – přírodních, syntetických materiálů, ale i jejich kombinací.
Suprapubický sling se umístí pod bulbární část uretry a jeho konce jsou protaženy skrze fascii m. rectus abdominis, kde jsou následně uvázány, díky čemuž lze upravovat tah. Jedna ze studií uvádí, že společensky přijatelné kontinence bylo dosaženo u 77 % pacientů po třech měsících, u 67 % pacientů po jednom roce a u 63 % pacientů po třech letech [39]. Systém ReMeex Male Adjustable System® (MRS, Neomedic International) je tvořen dvěma monofilamentózními trakčními vlákny, která spojují suburetrální sling a mechanický regulátor tahu, který je umístěn v suprapubické oblasti. Studie zahrnující 51 pacientů [40] uvádí, že po 32 měsících bylo u 65 % pacientů dosaženo úplného vyléčení a u 6 % pacientů byla nutná výměna systému. Síťka ukotvená ke skeletu se zavádí skrze perineální incizi přes bulbospongiózní sval s minimální preparací a následně je pomocí titanových šroubků ukotvena k raménku kosti ischiopubické. Studie zahrnující 48 pacientů, jimž byl implantován systém InVance (American Medical Systems) uvádí, že po 48 měsících došlo k úplnému vyléčení u 65 % pacientů, ke zlepšení u 20 % pacientů a k selhání zařízení u 15 % pacientů [41].
Transobturatorní sling se zavádí skrze perineální incizi a incizi v třísle, následně je sling přistehován k bulbu močové trubice a ramena jsou protažena přes obturátorové otvory pomocí zaváděcích jehel. Výrobce systému AdVance system (American Medical Systems) uvádí, že tento systém nabízí alternativní způsob repozice bulbární uretry, místo pouhé komprese. Cornu et al [42] publikovali jednu z největších studií (n = 136), kde uvádějí 61% míru vyléčení a 16,2% míru zlepšení po dvou letech. Zařízení ProACTTM (Uromedica Inc) sestává ze dvou silikonových balónků umístěných parauretrálně, které jsou spojeny titanovými porty ve skrotu, jež umožní modifikaci tlaku balónku. Studie zahrnující 117 pacientů uvádí, že po jednom roce došlo ke zlepšení u 92 % pacientů a 88 % pacientů bylo zcela nebo částečně kontinentních. Avšak 28 pacientů muselo následně podstoupit implantaci AUS [43].
Komplikace spojené se zaváděním pásky zahrnují bolest v perineu, infekci, poranění močového měchýře/cév, močovou retenci a osteomyelitidu. Eroze močové trubice a potřeba odstranit zařízení jsou však mnohem méně časté než při implantaci AUS [2]. Počáteční vysoká míra dislokace balónku, perforace a revize uváděná zpočátku při užívání zařízení ProACTTM [43] se postupně snižuje.
Načasování, volba, záchranná léčba
Vzhledem k možnosti přirozeného spontánního zlepšení PPI má načasování operace zásadní význam. Zpravidla se operační léčba zvažuje v případě, že i po roce konzervativní terapie přetrvává závažná forma PPI. Zdaleka největší množství důkazů podporuje implantaci zařízení AUS 800. Tento typ se doporučuje u pacientů se závažnou formou úniku moči, neboť se jedná o jedinou intervenci, u níž byla u této specifické populace prokázána účinnost oproti ostatním modalitám [27]. Je zajímavé, že při výběru slingu nebo AUS [44] si všichni pacienti, jimž byla nabídnuta implantace slingu, zvolili tuto možnost, ovšem 25 % pacientů, jimž byla nabídnuta implantace AUS, si vybrali raději sling.
Forma záchranné léčby po selhání primární procedury není v literatuře jasně definována, většina publikací však doporučuje implantaci AUS. Jedna ze studií [45] a Raj et al [30] uvádějí, že předchozí aplikace kolagenového implantátu (bulking agens) nemá vliv na výsledek implantace AUS. V rámci stejné instituce nebyl zaznamenán žádný rozdíl ve výsledku mezi 119 případy implantace AUS v rámci „záchranné terapie“ po nejrůznějších primárních výkonech a primární implantací AUS.
Závěr
V současné době narůstá význam inkontinence v důsledku prostatektomie v rámci celkové populace, a zvětšuje se tak její dopad na jedince. PPI vyžaduje pečlivé vyšetření – naše instituce je regionální terciární centrum pro léčbu PPI a nabízí standardizovanou péči. Pakliže není pomocí konzervativních opatření dosaženo adekvátní kontinence, doporučuje se operační léčba. Implantace AUS představuje nejlepší volbu pro pacienty s PPI se závažnou nedostatečností svěrače, u pacientů s mírnou až středně závažnou formou inkontinence lze zvolit léčbu v závislosti na individuálních parametrech.
Samuel J. S. Grimsley, FRCS Urol, MSc
University Hospital of Birmingham, Edgbaston, Birmingham, UK, B15 2TH
s.grimsley@nhs.net
Zdroje
1. Kim JC, Cho KJ. Current Trends in the Management of Post-Prostatectomy Incontinence. Korean J Urol 2012; 53 : 511–518.
2. Gacci M, Carini M, Simonato A et al. Factors predicting continence recovery 1 month after radical prostatectomy: Results of a multicenter survey. Int J Urol 2011; 18 : 700–708.
3. Van Kampen M, De Weerdt W, Van Poppel H et al.: Urinary incontinence following transurethral, transvesical and radical prostatectomy. Retrospective study of 489 patients. Acta Urol Belg 1997; 65 : 1–7.
4. Lepor H, Kaci L. The impact of open radical retropubic prostatectomy on continence and lower urinary tract symptoms: a prospective assessment using validated self-administered outcome instruments. J Urol 2004; 171 : 1216–1219.
5. Reynolds WS, Patel R, Msezane L et al. Current use of artificial urinary sphincters in the United States. J Urol 2007; 178 : 578–583.
6. Nam RK, Herschorn S, Loblaw DA et al. Population Based Study of Long-Term Rates of Surgery for Urinary Incontinence After Radical Prostatectomy for Prostate Cancer. J Urol 2012; 188 : 502–506.
7. Kim PH, Pinheiro LC, Atoria CL et al. Trends in the use of incontinence procedures after radical prostatectomy: a population based analysis. J Urol 2013; 189 : 602–608.
8. Ficazzola MA, Nitti VW. The etiology of post-radical prostatectomy incontinence and correlation of symptoms with urodynamic findings. J Urol 1998; 160 : 1317–1320.
9. Mostwin JL. Urinary incontinence. J Urol 1995; 153 : 352–353.
10. Walsh PC, Partin AW, Epstein JI. Cancer control and quality of life following anatomical radical retropubic prostatectomy: Results at 10 years. J Urol 1994; 152 : 1831–1836.
11. Porena M, Mearini E, Mearini L et al. Voiding dysfunction after radical retropubic prostatectomy: more than external urethral sphincter deficiency. Eur Urol 2007; 52 : 38–45.
12. Ramchandani P, Banner MP, Berlin JW et al. Vesicourethral anastomotic strictures after radical prostatectomy: efficacy of transurethral balloon dilation. Radiology 1994; 193 : 345–349.
13. Groutz A, Blaivas JG, Chaikin DC et al. The pathophysiology of post-radical prostatectomy incontinence: A clinical and video urodynamics study. J Urol 2000; 163 : 1767–1770.
14. Yang BS, Ye DW, Peng JY et al. Analysis of risk factors for urinary continence after radical prostatectomy. Zhonghua Yi Xue Za Zhi 2011; 91: 2239–2242.
15. Peterson AC,Chen Y. Patient reported incontinence after radical prostatectomy is more common than expected and not associated with the nerve sparing technique: results from the Center for Prostate Disease Research (CPDR) database. Neurourol Urodyn 2012; 31 : 60–63.
16. Walsh PC, Partin AW, Epstein JI. Cancer control and quality of life following anatomical radical retropubic prostatectomy: Results at 10 years. J Urol 1994; 152 : 1831–1836.
17. Gerullis H, Georgas E, Quast S et al. Early endoscopic detection and subsequent removal of sphincter penetrating anastomotic sutures may prevent irreversible urinary incontinence after radical prostatectomy. J Endourol 2012; 26 : 889–894.
18. Hunter KF, Moore KN, Glazener CMA. Conservative management for postprostatectomy urinary incontinence. Cochrane Database Syst Rev 2007; 2:CD005654.
19. Floratos DL, Sonke GS, Rapidou CA et al. Biofeedback vs verbal feedback as learning tools for pelvic muscle exercises in the early management of urinary incontinence after radical prostatectomy. BJU Int 2002; 89 : 714–719.
20. Glazener C, Boachie C, Buckley B et al. Urinary Incontinence in men after formal on-to-one pelvic-floor muscle training following radical prostatectomy or transurethral resection of the prostate (MAPS). Lancet 2011; 378 : 328–337.
21. Ribeiro LH, Prota C, Gomes CM et al. Long-term effect of early postoperative pelvic floor biofeedback on continence in men undergoing radical prostatectomy: a prospective, randomized, controlled trial. J Urol 2010; 184 : 1034–1039.
22. Schlenker B, Gratzke C, Reich O et al. Preliminary results of the off-label use of Duloxetine for the treatment of stress incontinence after radical prostatectomy or cystectomy. Eur Urol 2006; 49 : 1075–1078.
23. Filocamo MT, Li M, V, Del Popolo G et al. Pharmacologic treatment in postprostatectomy stress urinary incontinence. Eur Urol 2007; 51(6): 1559–1564.
24. Martins FE, Bennett CJ, Dunn M et al. Adverse prognostic features of collagen injection therapy for urinary incontinence following radical retropubic prostatectomy. J Urol 1997; 158 : 1745–1749.
25. Westney OL, Bevan-Thomas R, Palmer JL et al. Transurethral collagen injections for male intrinsic sphincter deficiency: The University of Texas-Houston experience. J Urol 2005; 174 : 994–997.
26. Schneider T, Sperling H, Rossi R et al. Do early injections of bulking agents following radical prostatectomy improve early continence? World J Urol 2005; 23(5): 338–342.
27. Silva LA, Andriolo RB, Atallah AN et al. Surgery for stress urinary incontinence due to presumed sphincter deficiency after prostate surgery. Cochrane Collaboration 2011; CD008306.
28. Montague DK. Artificial Urinary Sphincter: Long-Term Results and Patient Satisfaction. Adv Urol 2012; 2012 : 835290.
29. Litwiller SE, Kim KB, Fone PD et al. Post-prostatectomy incontinence and the artificial urinary sphincter: a long-term study of patient satisfaction and criteria for success. J Urol 1996; 156(6): 1975–1980.
30. Raj GV, Peterson AC, Toh KL et al. Outcomes following revisions and secondary implantation of the artificial urinary sphincter. J Urol 2005; 173(4): 1242–1245.
31. Elliott DS, Barrett DM. Mayo Clinic long-term analysis of the functional durability of the AMS 800 artificial urinary sphincter: a review of 323 cases. J Urol 1998; 159(4): 1206–1208.
32. Lai HH, Hsu EI, Teh BS et al. 13 years of experience with artificial urinary sphincter implantation at Baylor College of Medicine. J Urol 2007; 177(3): 1021–1025.
33. Montague DK. The artificial urinary sphincter (AS 800): experience in 166 consecutive patients. J Urol 1992; 147(2): 380–382.
34. Kim SP, Sarmast Z, Daignault S et al. Long-term durability and functional outcomes among patients with artificial urinary sphincters: a 10-year retrospective review from the University of Michigan, J Urol 2008; 179(5):1912–1916.
35. Gousse AE, Madjar S, Lambert MM et al. Artificial urinary sphincter for post-radical prostatectomy urinary incontinence:long-term subjective results. J Urol 2001; 166 : 1755–1758.
36. Walsh K, Williams SG, Mahendra V et al. Artificial urinary sphincter implantation in the irradiated patient: safety, efficacy and satisfaction. BJU Int 2002; 89(4): 364–368.
37. Gomha MA, Boone TB. Artificial urinary sphincter for post-prostatectomy incontinence in men who had prior radiotherapy: a risk and outcome analysis. J Urol 2002; 167(2): 591–596.
38. Vakalopoulos I. Kampantais S. Laskaridis L. New Artificial Urinary Sphincter Devices in the Treatment of Male Iatrogenic Incontinence. Adv Urol 2012; 2012 : 439372.
39. Migliari R, Pistolesi D, Leone P et al. Male bulbourethral sling after radical prostatectomy: intermediate outcomes at 2 to 4-year followup. J Urol 2006; 176 : 2114–2118.
40. Sousa-Escando A, Cabrera J, Mantovani F et al. Adjustable sub urethral sling (Male Remeex System) in the treatment of male stress urinary incontinence: A multicentric European study. Eur Urol 2007; 52 : 1473–1480.
41. Comiter CV. The male perineal sling; intermediate-term results. Neurourol Urodyn 2005; 24 : 648–653.
42. Cornu N, Sebe P, Ciofu C. Mid-term evaluation of the transobturator male sling for postprostatectomy incontinence: focus on prognostic factors. BJU Int 2011; 108 : 236–240.
43. Hubner WA, Schlarp OM. Treatment of incontinence after prostatectomy using a new minimally invasive device: Adjustable continence therapy. BJU Int 2005; 96 : 587–594.
44. Kumar A, Litt E, Ballert KN et al. Artificial urinary sphincter versus male sling for post-prostatectomy incontinence: What do patients choose? J Urol 2009; 181 : 1231–5.
45. Gomes CM, Broderick GA, Sánchez-Ortiz RF et al. Artificial urinary sphincter for post-prostatectomy incontinence: impact of prior collagen injection on cost and clinical outcome. J Urol 2000; 163(1): 87–90.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2013 Číslo 3- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Inkontinence u pacientů po prostatektomii: přehled současných možností vyšetřování a léčby
- XTANDI (enzalutamid): nová léčba metastazujícího karcinomu prostaty, rezistentního na kastrační léčbu
- Jaký prospěch přináší denosumab (XGEVA®) pacientům s kostními metastázami solidních nádorů?
- Léčba symptomatické benigní prostatické hyperplazie pomocí holmium laseru
- Úvodní slovo
- Prognostické faktory, molekulární markery a prediktivní instrumenty pro hodnocení uroteliálního karcinomu horních cest močových
- Endometrióza urogenitálního traktu
-
Guidelines AUA pro řešení benigní hyperplazie prostaty (BPH)
1. část - Definice vhodného kandidáta s karcinomem prostaty pro pozorování a pro cílenou fokální terapii
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Endometrióza urogenitálního traktu
- Jaký prospěch přináší denosumab (XGEVA®) pacientům s kostními metastázami solidních nádorů?
- XTANDI (enzalutamid): nová léčba metastazujícího karcinomu prostaty, rezistentního na kastrační léčbu
- Inkontinence u pacientů po prostatektomii: přehled současných možností vyšetřování a léčby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



