-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Antikoagulační léčba flebotrombóz v ambulantní praxi
Anticoagulant treatment of deep vein thrombosis in ambulatory practice
A classical anticoagulation therapy in acute phases of venous thromboses is especially based on low-molecular weight heparin (LMWH) administration today. Treatment with non-fractionated heparin is indicated only exclusively, in particular in situations where the increased risk of bleeding or the necessity of performing surgery or other intervention is being expected. LMWH administration resulted in general improvement of the care for patients with deep vein thromboses. We reach an efficient therapy in most patients without necessity of laboratory monitoring, only with dosage depending on patient's body weight. Subcutaneous administration 1-times or 2-times daily is simple and more comfortable for patients compared to continual infusion. Some defined cases of deep vein thromboses are indicated to administration of thrombolytic treatment (younger patients with the first attack of ileofemoral thrombosis without significant associated diseases). In rare cases of contraindications of anticoagulant (and concurrently thrombolytic) treatment it is possible to consider surgical thrombectomy in the case of recent thrombosis, however low-molecular weight heparins are currently the basis of treatment in most patients. A finding that walk does not increase the risk of pulmonary embolism occurrence and simultaneously leads to faster oedema and pain regression enabled treatment transfer of the part of non-complicated patients to the ambulatory scope.
Key words:
thromboembolic disease – low-molecular weight heparin – ambulatory treatment of thromboses
Autori: D. Karetová
Pôsobisko autorov: II. interní klinika kardiologie a angiologie 1. lékařské fakulty UK a VFN, Praha, přednosta prof. MUDr. Michael Aschermann, DrSc., FESC
Vyšlo v časopise: Vnitř Lék 2005; 91(7 a 8): 790-794
Kategória: 128. internistický den – XXI. Vanýskův den, Brno 2005
Súhrn
Klasická antikoagulační terapie v akutních fázích léčby žilních trombóz se v současnosti opírá o podání nízkomolekulárních heparinů (LMWH). Léčba nefrakcionovaným heparinem je indikována pouze výlučně, zejména v situacích, kdy je zvýšené riziko krvácení nebo lze očekávat nutnost provedení chirurgického nebo jiného intervenčního výkonu. Aplikace LMWH vedla k celkovému zlepšení péče o nemocné s flebotrombózami. Účinné léčby dosahujeme u většiny nemocných bez nutnosti laboratorní monitorace, pouze s dávkováním dle hmotnosti nemocného. Subkutánní aplikace 1krát nebo 2krát denně je jednoduchá a pro nemocného komfortnější oproti kontinuální infuzi. Některé vymezené případy flebotrombóz jsou indikací k podání trombolytické léčby (mladší nemocní s prvou atakou ileofemorální trombózy, bez významných přidružených chorob). Ve vzácných případech kontraindikace antikoagulační (a současně trombolytické) léčby je možno uvažovat u čerstvé trombózy o chirurgické tromboektomii, nicméně základem léčby u většiny nemocných jsou v současnosti nízkomolekulární hepariny. Poznání, že chůze nezvyšuje riziko vzniku plicní embolie a současně vede k rychlejší regresi otoku i bolesti, umožnilo přesun léčby části nekomplikovaných nemocných do ambulantní sféry.
Klíčová slova:
tromboembolická nemoc – nízkomolekulární hepariny – ambulantní léčba trombózÚvod
Hluboká žilní trombóza neboli flebotrombóza (FT) je součástí širšího pojmu tromboembolické nemoci (TEN). Její roční incidence se ve většině studií pohybuje kolem 1 případu na 1 000 nemocných, přičemž incidence narůstá s věkem. Před érou nízkomolekulárních heparinů (Low Molecular Weight Heparins – LMWH) se léčba 50 let opírala o nitrožilní podání nefrakcionovaného heparinu (Unfractionated Heparin – UFH), zpočátku intermitentně, posléze přísně kontinuálně. Parenterální aplikace mohla probíhat pouze v nemocnici a součástí léčby bylo i omezení pohybu nemocných – prvé dny trávili výlučně na lůžku. Doba podání kolísala mezi 7–14 dny, ke konci tohoto období se teprve nastavovala perorální léčba (pelentanizace). Léčba nefrakcionovaným heparinem byla monitorována pomocí testu aktivovaného parciálního tromboplastinového času (aPTT), stanovovaného 1krát nebo 2krát denně, nicméně i při úpravě dávek dle testu byl aPTT během léčby trvale v terapeutickém rozmezí u přibližně poloviny léčených. Důvodem je vysoká interindividuální i intraindividuální variabilita účinku, daná zejména vazbou heparinu na bílkoviny plazmy (zejména bílkoviny akutní fáze) a povrchy řady buněk (zejména endotelie a makrofágy). Kromě ne zcela předvidatelného antikoagulačního efektu je též určitým problémem tzv. heparinová rezistence u části léčených, kteří k prodloužení aPTT potřebují nezvykle vysoké dávky heparinu (> 40 000 IU za den). Příčinou může být deficience antitrombinu III, zvýšená clearance heparinu, zvýšení bílkovin vážících heparin nebo vzestup hladiny VIII. koagulačního faktoru. Také podávání nitroglycerinu bylo uváděno jako možná příčina nedostatečné odpovědi [1].
Dalším problémem aplikace heparinu je možnost navození trombocytopenie (Heparin Induced Thrombocytopenia – HIT). Imunologicky podmíněný typ je dán vznikem protilátek proti komplexu heparin-destičkový faktor 4. Kromě vzniku trombocytopenie může zavinit paradoxní extenzi trombu, nebo dokonce vznik nových trombů, tepenných i žilních. Vyskytuje se u 1–3 % léčených nemocných a objevuje po 1 týdnu aplikace heparinu. Problémem dlouhodobého podávání heparinu, například u těhotných, byla i osteopenie daná vazbou na osteoblasty s následnou aktivací osteoklastů.
Nefrakcionovaný heparin má dosud svoje místo v situacích, kdy lze předpokládat zvýšené riziko krvácení nebo hrozí nutnost chirurgického výkonu. UFH je proto často podáván především na jednotkách intenzivní péče, kde může být výhodou právě krátký poločas (1–2 hodiny) a možnost negace účinku protaminsulfátem.
Postavení nízkomolekulárních heparinů v léčbě žilních trombóz
Nevýhody „klasického“, nefrakcionovaného heparinu vedly k vyvinutí nízkomolekulárních heparinů. Jejich výhody jsou vztahovány právě k nižší molekulové hmotnosti a menší délce polysacharidového řetězce – tyto vlastnosti vedou k menší nespecifické vazbě na buněčné povrchy a proteiny. Díky vyšší biologické dostupnosti je zavedeno podání 1krát nebo 2krát denně (i v léčebných indikacích), podkožně, s fixní dávkou dle hmotnosti nemocného. U většiny pacientů navíc není nutná monitorace efektu pomocí stanovení hladiny antiXa.
Jednotlivé LMWH se liší ve svých farmakokinetických vlastnostech, a nejsou proto zcela klinicky zaměnitelné. Nicméně nebyly nikdy v klinických studiích vzájemně srovnávány, a není tedy možno říci, zda je některý z nich účinnější nebo bezpečnější než druhý. Při jejich výběru je důležitá skutečnost, zda má určitý nízkomolekulární heparin schválenou indikaci pro stav nebo chorobu, kterou hodláme léčit (prevence TEN – léčba TEN – akutní koronární syndromy apod).
I u nízkomolekulárních heparinů ale zůstává limitace inaktivovat trombin již vázaný fibrinem, proto také není dosahováno vždy plné disoluce trombu (tab. 1).
Tab. 1. Výhody a nevýhody nízkomolekulárních heparinů. 
Teprve po prověření, že léčba nízkomolekulárními hepariny je ve srovnání s nefrakcionovaným heparinem stejně efektivní a bezpečná v nemocničním režimu (v 90. letech minulého století), se pokročilo kmyšlence léčby trombóz v ambulantní sféře [2,3,4,5].
Zpočátku se připustila možnost ambulantní léčby distálních trombóz – lokalizovaných v bérci, s dalšími zkušenostmi se přistoupilo i k léčbě proximálních flebotrombóz (femoropopliteálních). Kromě průkazu srovnatelné efektivity nízkomolekulárních heparinů s nefrakcionovaným heparinem byl ambulantní režim léčby umožněn i studiemi, týkajícími se porovnání efektu a bezpečnosti léčby při absolutním tělesném klidu proti léčbě se zachováním pohybu nebo dokonce s nabádáním k němu.
Klid na lůžku nebrání plicní embolizaci
Princip imobilizace se opíral o domněnku, že tímto postupem je možno zabránit odloučení trombu – plicní embolizaci.
Dvě randomizované kontrolované studie ukázaly, že ve vzniku nové plicní embolizace nebyly statisticky významné rozdíly mezi nemocnými chodícími a ležícími. Studie potvrdily již v minulosti konstatovanou skutečnost, že plicní embolizace se vyskytuje tak často, s jakou intenzitou je po ní pátráno. Studie Anschwandena ukázala, že již vstupně je přítomna asymptomaticky probíhající plicní embolie u poloviny nemocných s flebotrombózou. Při srovnání ambulantního a nemocničního režimu počtem nových plicních embolií bylo kontrolní scintigrafií doloženo (po 4 dnech), že nové plicní embolizace vznikly u 10 % ležících a 14,4 % chodících, přičemž veškeré byly opět asymptomatické [6]. Stejně tak studie Schellonga prokázala, že klid na lůžku není schopen zabránit plicní embolizaci (opět v absolutní většině klinicky asymptomatické) [7].
Komprese končetiny a chůze je lepší než klid na lůžku v ústupu otoku a vlivu na kvalitu života
Existují studie, které se snažily prokázat, že stávající medikamentózní léčba (LMWH a antagonista K-vitaminu) doplněná důkladnou kompresí končetiny a ponecháním pohyblivosti nemocných má větší význam na regresi symptomů trombózy proti klidu na lůžku. Ve studii Blattlera bylo 53 nemocných s proximálně uloženou flebotrombózou léčeno dalteparinem a následně kumarinem. Pacienti byli náhodně rozděleni randomizací do 3 skupin: neelastické pevné bandáže, elastické kompresní punčochy a klid na lůžku bez komprese. Kromě míry otoku a dotazníků na kvalitu života byla provedena v den 0 a den 9 sonografie žil a plicní scintigrafie. Ve všech skupinách postupně klesala bolest v končetině, ale celkový pocit návratu zdraví byl promptnější ve skupinách s kompresí – nemocní postupně byli schopni až 4 km chůze denně. Otok klesal rychleji při kompresi. Ultrazvukem posuzovaná velikost trombu měla nejhorší výsledek v imobilizované skupině (zjištěn i nárůst velikosti trombů), scintigrafické výsledky v den 9 nevykazovaly mezi skupinami rozdíl [8].
Klid na lůžku působí progresi trombózy
Je nepochybné, že klid na lůžku působí stázu krve a může být příčinou propagace trombu. V již zmíněné Blattlerově studii byla měřena velikost trombu ve femorální žíle po 9 dnech léčby a porovnána se vstupními parametry. Nárůst velikosti trombu se objevil ve 40 % léčených na lůžku a u 28 % v ambulantním režimu – statisticky významně vyšší progrese trombu tedy byla v imobilizované skupině. Nicméně nárůst trombu v obou skupinách léčených dalteparinem a perorálním antagonistou K-vitaminu není zvláště dobrým výsledkem antikoagulační medikace.
Dávkování LMWH a délka jeho podání, warfarinizace
Bezprostředně po průkazu trombózy volíme v současnosti 1 ze 3 nejčastěji užívaných nízkomolekulárních heparinů – podáváme podkožně buď 0,1 ml enoxaparinu (Clexane) na 10 kg hmotnosti nemocného 2krát denně, nebo 0,1 ml na 10 kg hmotnosti nadroparinu (Fraxiparine) též 2krát denně, nebo stejné dávkování nadroparinu o vyšší koncentraci v 1 ml 1krát denně (Fraxiparine forte) nebo 100–120 IU dalteparinu (Fragmin) 2krát denně.
Obvyklejší je dávkování 2krát denně pod dobu alespoň 5 dnů, ve kterých již současně aplikujeme perorální antagonisty vitaminu K a LMWH vysazujeme ve chvíli, kdy INR dosáhne hodnoty nad 2,0 ve 2 po sobě jdoucích dnech. Obvyklá doba aplikace nízkomolekulárního heparinu je kolem 7 dnů, neměla by se vysazovat před 5. dnem ani v situaci, kdy je INR již v terapeutickém rozmezí (tab. 2).
Tab. 2. Nízkomolekulární hepariny užívané k léčbě hluboké žilní trombózy. 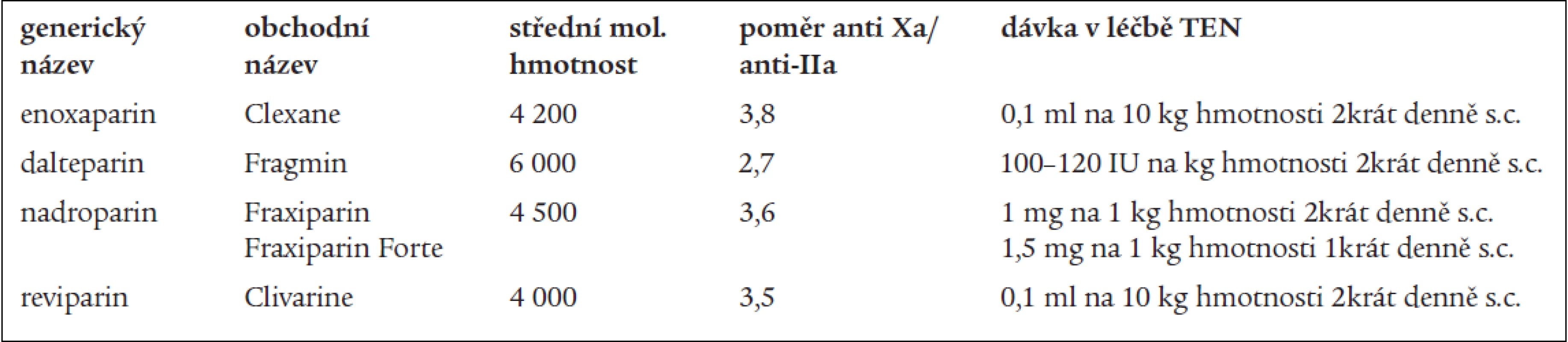
Současně podáváme warfarin, který je nejběžněji používaným přípravkem u nás i ve světě. Výroba českého originálního přípravku ethyl–biskumacetátu (Pelentan, Pelentanettae) skončila. Warfarin je rychle absorbován z gastrointestinálního traktu, jídlo prodlužuje dobu absorpce, ale nesnižuje její míru. Jeho poločas je 36–42 hodin. Různá odezva na dávku je u jednotlivců ovlivněna geneticky, jde omožnou mutaci genu pro 1 z běžných enzymů cytochromu P450 (CYP2C9), čímž je dána aktivita hepatálního enzymu odpovědného za metabolizmus S-izomeru.
Různá odpověď na podání warfarinu závisí krom genetických faktorů i na přidružených chorobných stavech, medikaci a dietních zvyklostech. Efekt je ovlivněn na úrovni absorpce a degradace. Prochází placentou, není však vylučován do mateřského mléka. Warfarin dosahuje plného účinku za 2–7 dnů od počátku podání (v tomto období se vylučují koagulační faktory již dříve syntetizované), proto se také podává několik dnů souběžně s heparinem.
Antikoagulační efekt warfarinu je zásadně ovlivněn i množstvím vitaminu K v dietě, stejně tak dysfunkce hepatocytů je spojena s výraznější odezvou na léčbu vzhledem k porušené tvorbě koagulačních faktorů. Odpověď na podání warfarinu zvyšují dále hypermetabolické syndromy nebo tyreotoxikóza. Velké množství léků vykazuje interakce s warfarinem, čímž dochází ke snížení nebo zvýšení jeho účinku.
V době překryvné léčby heparinem a warfarinem by neměla být warfarinizace příliš agresivní (dříve se běžně zahajovalo dávkami 10–15 mg, což je dnes považováno za chybu), protože se zdá, že dochází ke „spotřebování“ i antikoagulačně působících proteinů (proteinu C a S). Proto se nyní dává přednost zahájení aplikace warfarinu průměrnou udržovací dávkou (5 mg) s umožněním postupného rozvoje účinku. Obvyklou denní udržovací dávkou je 1,5–10 mg, ale u některých jedinců je nutno podávat k udržení žádoucí hodnoty INR i dávky vysoké (až 20 mg). Menší dávky jsou naopak obvyklé u jedinců nad 80 let, se vstupně vyšší hodnotou INR, známou jaterní lézí, srdečním selháním apod. Z léků, které potencují efekt warfarinu, jde především o většinu antibiotik, antimykotika, nesteroidní antirevmatika, statiny, amiodaron, antiulceróza. Mezi léky inhibující působení warfarinu patří barbituráty, karbamazepin, cholestyramin, cyklosporin, estrogeny a další.
Praktické aspekty léčby flebotrombózy ambulantně
Ambulantní léčba trombóz vyžaduje správnou selekci pacientů s danou diagnózou, jejich edukaci, udržování denního kontaktu s nemocnými a možnost pravidelného odebírání krevních vzorků.
Ambulantně léčený nemocný musí být důkladně informován o vlastní diagnóze, cílech léčby a možných nejobvyklejších komplikacích. Pro ambulantní lékaře jde o organizačně náročnější akci v porovnání s organizací transportu do nemocnice. Nicméně se jedná o jednoznačně se šířící trend, množí se práce sledující „neadekvátní“ hospitalizaci nemocných s touto diagnózou. Postup je možný díky uvolnění preskripce nízkomolekulárních heparinů na recept, bez nutnosti schválení revizním lékařem.
Klinická kritéria výběru nemocného pro ambulantní terapii:
- potvrzená diagnóza bércové nebo femoropopliteální trombózy;
- dospělý dobře spolupracující pacient;
- nemocný hemodynamicky stabilní, bez klinických známek plicní embolizace;
- nemocný bez recentní anamnézy krvácení, většího chirurgického výkonu, porodu, ap;
- není známa pokročilejší renální insuficience;
- není alergie na heparin.
Organizační zajištění
Důležité je rodinné zázemí poskytující péči v době ztížené mobility. Musí být zajištěna aplikace nízkomolekulárního heparinu nemocným, příbuzným, případně docházkou zdravotní sestry. Vzdálenost bydliště od ambulance by neměla být velká, aby byl umožněn pravidelný laboratorní monitoring po zahájení aplikace perorálních antikoagulancií. Nemocný musí mít k dispozici telefon a ledničku pro uložení léků.
Krom těchto organizačních aspektů je velmi důležité, aby byl nemocný informován o rizicích své choroby, musí znát základní příznaky plicní embolizace (dušnost, hemoptýza, respiračně vázaná bolest na hrudi) a vědět, že hlavním rizikem aplikované léčby je krvácení.
K ambulantní léčbě se uvádí, že je vhodných přibližně 60 % nemocných s touto diagnózou. Stále tedy existuje podstatná část nemocných, kteří nejsou k ambulantní léčbě indikováni (tab. 3).
Tab. 3. Nemocní s flebotrombózou nevhodní k ambulantní léčbě. 
Tab. 4. Komplexní léčba nemocných s flebotrombózou. 
Určení etiologie trombózy
I při ambulantním režimu léčby nezapomínáme na pokus o určení etiologie trombózy, zda jde o trombózu sekundární – tzn. vznikající při známém disponujícím faktoru nebo chorobě (zejména vrozené nebo získané trombofilii, imobilizaci, obezitě, maligním onemocnění, graviditě nebo poporodním období, při rozsáhlých varixech končetin, u stavů po již prodělané flebotrombóze, v pooperačním období, u těžších infekcí, hormonální léčbě, pokročilých onemocnění srdce, u poruch hybnosti končetin po iktech, při nespecifických střevních zánětech, myeloproliferativních onemocněních, autoimunních chorobách).
Při zcela nejasném disponujícím faktoru vzniku trombózy mluvíme o idiopatické formě, a vede nás ke screeningu okultně probíhajícího nádorového procesu. U těchto nemocných, zejména mladších, by měl být též proveden náběr krve na stanovení přítomnosti geneticky podmíněné trombofilie (optimálně vstupně, před započetím warfarinizace – která vede ke snížení hladiny proteinů C a S, případně lze náběr doplnit dodatečně).
Závěr
Nejdůležitější při rozvaze o způsobu léčby akutní flebotrombózy je, zda léčit konzervativně – hepariny, nebo agresivně – fibrinolytiky (mladší jedinci bez rizika krvácení, s ileofemorální trombózou). Teprve poté, rozhodneme-li se pro konzervativní postup, přichází rozhodnutí, zda nízkomolekulární heparin podávat ambulantně, nebo zda léčit za hospitalizace.
Nízkomolekulární hepariny dávají možnost léčby velké části nemocných (asi 60 %) s končetinovou flebotrombózou v domácím režimu, čímž v řadě zemí, kde byly porovnávány náklady na ambulantní a hospitalizační léčbu, došlo k podstatné redukci nákladů v případě ambulantní léčby. Některé stavy vylučují ambulantní léčbu flebotrombóz, u některých nemocných není také správná léčba v domácím režimu zaručena. Stavy komplikované plicní embolizací jsou nadále určeny k léčbě za hospitalizace.
Nejjednodušším a současně ekonomicky výhodným způsobem péče o nemocného je kombinace krátkodobé hospitalizace (48–72 hod) a následné léčby doma.
MUDr. Debora Karetová, CSc.
www.lf1.cuni.cz
e-mail: dkare@lf1.cuni.cz
Doručeno do redakce: 22. 3. 2005
Přijato k otištění: 22. 3. 2005
Zdroje
1. Levine MN, Hirsh J, Gent M et al. A randomized trial comparing activated thromboplastin time with heparin assay in patients with acute venous thromboembolism requiring large daily doses of heparin. Arch Intern Med 1994; 154 : 49–56.
2. Simonneau G, Charbonnier B, Decousus H et al. Subcutaneous low molecular weight heparin compared with continuous intravenous unfractionated heparin in the initial treatment proximal vein thrombosis. Arch Intern Med 1993 : 153 : 1541–1546.
3. Lensing AWA, Prins MH, Davidson BL et al. Treatment of deep venous thrombosis with low-molecular-weight heparins. Arch Intern Med 1995; 155 : 601–607.
4. Gould MK, Dembitzer AD, Doyle RL et al. Low molecular weight heparin compared with unfractionated heparin for the treatment of acute deep vein thrombosis: a meta-analysis of randomised controlled trials. Ann Intern Med 1999; 130 : 800–809.
5. Schraibman IG, Mine AA, Royle EM. Home versus in-patient treatment for deep vein thrombosis. Cochrane Database Syst Rev 2001; 2: CD003076.
6. Anschwanden M, Labs KH, Engel H et al. Acute deep vein thrombosis: early mobilization does not increase the frequency of pulmonary embolism. Thromb Haemost 2001; 85 : 42–46.
7. Schellong SM, Schwarz TH, Krapp J et al. Bed rest in deep vein thrombosis and the incidence of scintigraphic pulmonary embolism. Thromb Haemost 1999; 82 : 127–129.
8. Blattler W, Partsch H. Leg compression and ambulation is better than bed rest for the traetment of acute deep venous thrombosis. Int Angiol 2003; 22 : 393–400.
9. Crowther MA, Ginsberg JS, Hirsh J. Practical Aspects of Anticoagulant Therapy. From Hemostasis and Thrombosis. New York: Williams and Wilkins 2001 : 1497–1517.
10. Ginsberg JS, Hirsh J Treatment of Venous Thromboembolism. From Hemostasis and Thrombosis. New York: Williams and Wilkins 2001 : 1405–1413.
11. Hirsh J, Anand SS, Halperin JL et al. Guide to Anticoagulant Therapy: Heparin. Circulation 2001, 103 : 2994–3018.
12. Hirsh J. Low-molecular weight heparin for the treatment of venous thromboembolism. Am Heart J 1998, 135: S336–S342.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Trombofilní stavyČlánek Protidestičková léčbaČlánek Trombocytopenické purpuryČlánek Trombocytózy a trombocytemieČlánek Anémie chronických chorobČlánek Potransfuzní reakceČlánek HemovigilanceČlánek Z odborné literatury
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 7 a 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Úvodní slovo k přednáškám z XXI. Vanýskova dne
- Ohlédnutí a perspektivy současné hematologie
- Primární antitrombotická prevence žilní trombózy ve vnitřním lékařství
- Antikoagulační léčba flebotrombóz v ambulantní praxi
- Invazivní kontrolovaná léčba hluboké žilní trombózy
- Sepsa a Československé fórum pre sepsu
- Fenotypová a genotypová analýza vrodenej hypofibrinogenémie a dysfibrinogenémie
- Antifosfolipidový syndrom – diagnostika a léčba
- Trombofilní stavy
- Protidestičková léčba
- Glykoproteiny destičkové membrány z hlediska jejich genetických změn
- Glykoprotein Ia/IIa destičkové membrány z hlediska jeho genetických změn
- Glykoprotein IIb/IIIa destičkové membrány z hlediska jeho genetických změn
- Trombocytopenické purpury
- Trombocytózy a trombocytemie
- Antitrombotická léčba v etiologii akutní posthemoragické anémie
- Anémie chronických chorob
- Autoimunitní hemolytické anémie
- Některé vzácnější formy hereditárních anémií vyskytující se v dospělé populaci v ČR - β-talasemie a nestabilní hemoglobinové varianty
- Zajištění spolehlivosti vyšetření krevních obrazů
- Hemoterapie a její bezpečnost
- Potransfuzní reakce
- Refrakterita k trombocytovým transfuzním přípravkům
- Hemovigilance
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Potransfuzní reakce
- Trombocytózy a trombocytemie
- Antifosfolipidový syndrom – diagnostika a léčba
- Protidestičková léčba
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



