-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Myokardiální dysfunkce v sepsi – diagnostika a terapie
Myocardial dysfunction in sepsis – diagnostics and therapy
Incidence of myocardial dysfunction in studies with severe sepsis patients is up to two thirds of patients. On the other side, patients with normal echocardiography have some type of myocardial injury, which can be detected by elevated serum levels of troponins and natriuretic peptides. Strong prognostic value of these markers regarding morbidity and mortality of septic patients indicates an important role of this „occult“ myocardial injury. Therapeutical interventions should take place only in situation in that low cardiac output is not capable to ensure metabolic demands of tissues. Nowadays, because of detrimental effects of classical inotropes, new strategies are under investigation. Namely levosimendan is promising alternative, not only related to its inotropic effects. Early diagnostics, assessment of prognosis and therapeutic strategy in patients with SMD are challenging for continuing research and for clinicians of different specialities.
Key words:
sepsis – myocardial dysfunction – troponin – BN – echocardiography – inotropes – levosimendan
Autori: J. Maláska; M. Slezák; K. Muriová; J. Stašek; P. Ševčík
Pôsobisko autorov: Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Pavel Ševčík, CSc.
Vyšlo v časopise: Vnitř Lék 2010; 56(3): 226-232
Kategória: Přehledné referáty
Súhrn
Dysfunkce myokardu jako součást multiorgánového selhání postihuje až 2/ 3 pacientů v těžké sepsi. Je zajímavé, že i u pacientů s normálním echokardiografickým nálezem můžeme prokázat elevaci sérové hladiny troponinů a natriuretických peptidů. Prokázaná prognostická síla těchto markerů na morbiditu a mortalitu pacientů ukazuje na významnou roli skrytého poškození myokardu v sepsi. Terapeuticky zasahujeme až v případě, kdy nízký srdeční výdej není schopen uspokojit metabolické potřeby tkání. V současné době jsou vzhledem ke známým nežádoucím účinkům klasických inotropik zkoumány nové terapeutické přístupy. Jedná se zejména o použití levosimendanu, který představuje slibnou alternativu, a to nejen kvůli svému inotropnímu účinku. Včasná diagnostika, stanovení prognózy a léčebné strategie u pacientů se SMD poskytuje široké pole pro další výzkum a představuje výzvu pro klinické pracovníky různých oborů.
Klíčová slova:
sepse – myokardiální dysfunkce – troponin – BNP – echokardiografie – inotropika – levosimendanDiagnostické a prognostické ukazatele myokardiální dysfunkce
Sepsí indukovaná dysfunkce myokardu, spojená se strukturálním poškozením kardiomyocytů, je sledovatelná v biochemických parametrech. Souhrn těchto markerů detekujících myokardiální dysfunkci a dalších, které poskytují prognostickou informaci u septických pacientů, představuje tab. 1 [1 – 3].
Tab. 1. Souhrn studií o biochemických ukazatelích sepse a myokardiální dysfunkce. 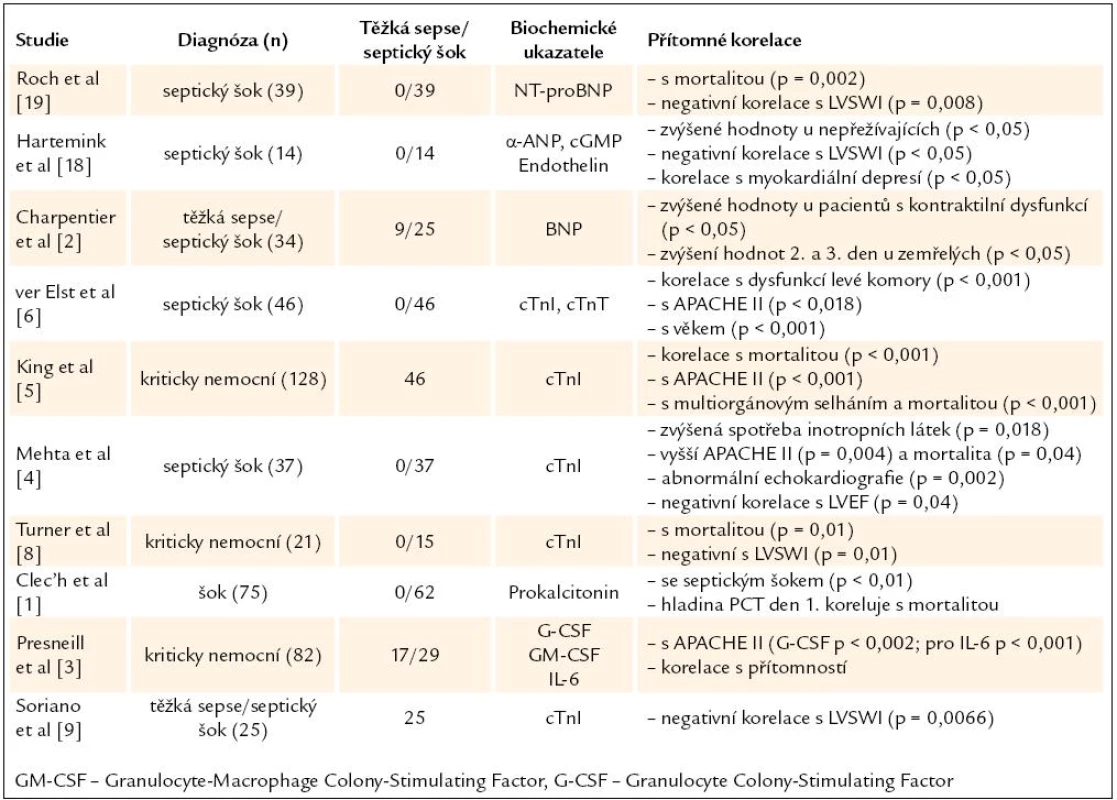
Cirkulující faktory v septickém šoku vedou k tzv. minimálnímu poškozenímyokardiálních buněk. Prokázán je přímý cytotoxický efekt endotoxinu, který cestou aktivace kaspázy 3 vede ke štěpení kontraktilních proteinů, předpokládá se vliv cytokinů a kyslíkových radikálů. TNF-α zvyšuje permeabilitu endotelu – podobná alterace permeability probíhá i v membráně myocytů a vede k uvolnění cTnI [4]. Stanovení hladin cTnI a cTnT je standardem pro diagnostiku a stanovení rizika u pacientů s akutním koronárním syndromem. Zvýšené hladiny ale pozorujeme i u srdečního selhání neischemického původu, u plicní embolie, renálního selhání a u heterogenní populace kriticky nemocných [5,6]. Zvýšená koncentrace byla popsána i v plazmě pacientů v sepsi a septickém šoku v asociaci se vzestupem mortality. V studii Mehty et al byla sérová hladina cTnI elevována až u 43 % pacientů se septickým šokem [4]. Výše zmíněné studie zaměřené na kriticky nemocné poukázaly na zvýšenou mortalitu u pacientů se sérovou hladinou cTnI > 1,0 ng/ ml v porovnání s pacienty, kteří měli troponin negativní, nezávisle na příčině pozitivity. Pacienti s elevovanými hladinami troponinu měli větší sklon k hypotenzi, vyšší spotřebu vazoaktivních látek, hodnoty APACHE II skóre, častěji byla nutnost umělé plicní ventilace a zůstávali hospitalizováni déle na jednotkách intenzivní péče [7]. Elevace hladin cTnI též koreluje s poklesem funkce levé komory (pokles LVSWI – Left Ventricular Stroke Work Index), a to i u pacientů bez koronární léze. Ver Elst et al zjistili statisticky významnou asociaci mezi přítomností těchto specifických a senzitivních ukazatelů poškození kardiomyocytů a dysfunkcí levé komory objektivizované transezofageální echokardiografií (TEE). cTnI byl senzitivnější marker než cTnT nebo CK-MB, ale všechny tyto kardiospecifické markery korelovaly s poškozením kardiomyocytů [6]. Dále Turner et al ve své studii zjistili, že hladiny cTnI byly zvýšené u většiny pacientů se septickým šokem, měly ale tendenci k návratu do normálu u pacientů, kteří přežili [8]. Stále je věcí diskuze, zda uvolnění troponinu u pacientů se sepsí odpovídá ireverzibilnímu myokardiálnímu poškození nebo reverzibilní myokardiální depresi. Zatímco u myokardiálního infarktu jsou hladiny troponinů zvýšené několik dní, u septických pacientů bylo pozorováno jen krátkodobé přechodné zvýšení. To předpokládá uvolnění troponinu bez přítomnosti myokardiální nekrózy a tomu odpovídají i nálezy z autopsií [9]. V poškození myokardu může dále hrát roli mikrovaskulární trombóza při sepsí indukované disseminované intravaskulární koagulopatii. Možnost podílu mikroinfarktů s uvolněním troponinu na rozvoji SMD nelze vyloučit.
Poselstvím výše zmíněných studií bylo upozornění na korelaci zvýšených hladin kardiálních troponinů u septických pacientů se závažností myokardiální dysfunkce a horší prognózou. cTnI je tedy možno využít jako časného markeru závažnosti a průběhu onemocnění.
Natriuretické peptidy
Natriuretické peptidy – BNP (Brain Natriuretic Peptide) a NT-proBNP (N-Terminal pro Brain Natriuretic Peptide) – byly původně nazvány podle místa objevu – v mozku prasete, nicméně u člověka je téměř výhradně produkován v srdci, především v myokardu komor [10, 11]. Prohormon pro BNP je syntetizován ventrikulárními myocyty jako odpověď na mechanické protažení a štěpí se na aktivní BNP a biologicky inaktivní NT - proBNP. Na rozdíl od ANP (Atrial Natriuretic Peptide), BNP a NT-proBNP nejsou intracelulárně skladovány, ale po expresi genu pro BNP se nárazově syntetizují. BNP má natriuretické a vazodilatační efekty a působí komplementárně k renin angiotenzin aldosteronovému systému (RAAS) [2]. Hlavním stimulem pro syntézu a uvolnění BNP je distenze komory, sérové hladiny korelují s tíží srdečního selhání. Při hodnotách BNP < 100 pg/ ml v séru pacienta je diagnóza kongestivního srdečního selhání nepravěpodobná, nad hranicí 500 pg/ ml naopak téměř jistá. Intermediální, tzv. šedá zóna BNP – mezi 100 a 500 pg/ ml – zahrnuje např. stabilní dysfunkci levé komory a některá nekardiální onemocnění [10].
Několik studií se zabývalo otázkou, zda BNP správně koreluje s levostrannými plnícími tlaky a jaká je jeho prognostická hodnota u pacientů se sepsí. Závěry byly rozporuplné. Studie Witthauta et al [12] zjistila negativní korelaci mezi BNP a srdečním indexem (CI – Cardiac Index), ale nebyla nelezena žádná korelace mezi BNP a tepovým objemem (SV – Stroke Volume), LVSWI (Left Ventricular Stroke Work Index) a PAOP (Pulmonary Capillary Wedge Pressure). V další studii zaměřené na pacienty s těžkou sepsí a septickým šokem byly hladiny BNP 1. – 4. den signifikantně vyšší u pacientů se zhoršenou systolickou funkcí levé komory než u těch, kde zůstala systolická funkce zachována; závěr této studie rovněž poukázal na prognostickou hodnotu BNP. Hladina BNP v séru > 190 pg/ ml oddělovala přežívající pacienty se 70% senzitivitou a 67% specificitou [2]. Nicméně další studie dospěly k opačným závěrům [13], kdy přežívající měli vyšší hladiny BNP nebo práce neprokázaly prognostický význam hladin BNP u kriticky nemocných pacientů [14,15]. BNP tedy není jasným a spolehlivým prediktorem systolické dysfunkce myokardu vyjádřené změnou LV EF u pacientů se sepsí.
V porovnání se systolickou funkcí levé komory je korelace mezi diastolickou funkcí levé komory a hladinou BNP jasná – narušená relaxace, restriktivní porucha [16]. Jelikož u pacientů se sepsí pozorujeme i narušenou diastolickou funkci levé komory, můžeme najít zvýšení BNP, ale zachovanou LV EF [17]. Navíc u septických pacientů může stoupat vaskulární plicní rezistence na podkladě souběžného plicního postižení typu ARDS (Acute Respiratory Distress Syndrome). I přes použití protektivní ventilace vzniká u asi 25 % pacientů s ARDS akutní cor pulmonale, co je pravděpodobně asociováno s elevací hladinami BNP (ANP). V těchto případech je obtížné rozlišit jen na základě izolované hodnoty BPN, jaký je podíl sepse a jaký připadá na zvýšenou plicní vaskulární rezistenci [18,19]. V této situaci může být výhodná monitorace pacienta pomocí plicnicového katétru a echokardiografie.
Významné zvýšení hodnot u nepřežívajících pacientů se septickým šokem je pozorováno i u NT-proBNP. Hodnota > 13 600 pg/ ml predikuje mortalitu u kriticky nemocných se 73% senzitivitou a 83% specificitou, rovněž platí negativní korelace s LVSWI [19]. Výhoda měření NT-proBNP oproti BNP spočívá v jeho delším biologickém poločasu. Může tak odrážet hemodynamické a zánětlivé stimuly za delší periodu a ukazuje se být vhodnějším markerem myokardiální dysfunkce, a tedy prognózy pacienta.
ANP (Atrial Natriuretic Peptide)
U pacientů se septickým šokem byly také zjištěny zvýšené hladiny ANP. Tyto hodnoty byly asociovány např. s vysokými plnícími tlaky, s LVSWI a RVSWI [20]. Podobné závislosti byly zjištěny i u prohormonu pro-ANP při zkoumání souboru septických pacientů [21].
Závěrem lze říci, že BNP, NT - proBNP a ANP, jejichž zvýšená hladina má prediktivní význam již po 24 hod od rozvoje septického šoku, mohou být užitečné k detekci myokardiální dysfunkce ve včasné fázi sepse, spíše však jako komplementární laboratorní markery k základním diagnostickým metodám – hemodynamickému a echokardiografickému monitoringu.
Hemodynamický monitoring
Nezbytnou součástí intenzivní péče o septického pacienta je dosažení a udržení základních hemodynamických cílů odpovídajících současným doporučením, koncentrovaným např. v dokumentu „Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock“ [22]. V iniciální fázi jde především o udržení centrálního žilního tlaku – Central Venous Pressure (CVP) v rozmezí 8 – 12 mm Hg, středního arteriálního tlaku – Mean Arterial Pressure (MAP) nad 65 mm Hg. Pokud tohoto cíle není dosaženo v prvních 6 hod navzdory adekvátní tekutinové resuscitaci a je nutno podávat vazopresory, je indikována invazivní monitorace hemodynamických parametrů.
Základní metodou první volby je zavedení periferního arteriálního katétru, jež umožní nejen spolehlivé měření krevního tlaku, ale ve spojení s monitory založenými na technologii analýzy pulzové křivky otvírá široké možnosti minimálně invazivního měření užitečných parametrů – srdečního výdeje (CO, CI), systémové vaskulární resistence (SVR), extravaskulární plicní vody (EVLW), global end diastolic volume (GEDV). U pacientů na umělé ventilaci je možné navíc hodnotit i dynamické parametry – variace tepového objemu a tlaku (SVV, PPV), které odráží adekvátnost preloadu. Výhodou je minimální invazivita, rychlá a kontinuální informace o hemodynamických parametrech, hodnoty jsou však stanoveny nepřímo, matematickým algoritmem. A v případech, kdy jsou přítomné arytmie a je přítomna spontánní dechová aktivita, nelze tyto metody použít vůbec.
Stále diskutovanou je otázka indikací a přínosu plicnicového katétru – Pulmonary Artery Catheter (PAC), který navzdory invazivitě a s vědomím některých limitů při interpretaci hodnot – pacienti na umělé ventilaci, chlopenní vady – zůstává „zlatým standardem“ hemodynamického monitorování. Základním parametrem vedle srdečního výdeje je tlak v zaklínění – PAOP (Pulmonary Artery Occlusion Pressure), jehož cílová hodnota u septických pacientů by měla být 12 – 15 mm Hg, nezastupitelnou hodnotu pro posouzení dodávky a spotřeby kyslíku má saturace smíšené venózní krve – SvO2. Nevýhodou plicnicového katétru je zvýšená invazivita, měl by být vyhrazen pro oběhově nestabilní pacienty nereagující na standardní terapii a použit jen po nezbytně nutnou dobu.V žádné ze studií zabývajících se sepsí nebyl prokázán benefit PAC řízené terapie.
Cílem invazivního monitoringu by měla být správná interpretace zjištěných hodnot – preloadu (CVP, PAOP, SVV), kontraktility (CO), afterloadu (SVR), včasná identifikace problému a především cílená intervence – inotropika, vazokonstriktory, tekutiny – směřující k optimalizaci makro a mikrohemodynamických parametrů.
Echokardiografie
Echokardiografie má v diagnostice septické myokardiální dysfunkce nezastupitelnou roli. Nejde jen o včasné zachycení poruchy a její terapii, ale trend výkonnosti levé komory je významný i prognosticky – jak již bylo zmíněno, u přežívajících pacientů dochází k normalizaci během 10 dní od rozvoje septického stavu. Zajímavým fenoménem u přežívajících je výrazná dilatace komory – nárůst left ventricle end diastolic area (LVEDA) – zachovávající tepový objem navzdory zhoršené ejekční frakci, naopak pacienti, kteří sepsi nepřežili, měli rozměry levé komory normální [23].
Mezi vhodné echokardiografické parametry s určitým prognostickým impaktem patří např. left ventricular stroke work index (LVSWI), left ventricular fractional area (LVFA) při použití TEE nebo early diastolic mitral annular velocity jako známka poruchy relaxace. Echokardiografické vyšetření u pacientů v sepsi přináší cenné informace použitelné v každodenním rozhodování o léčebné strategii. Základní parametry – enddiastolické rozměry levé komory, výpočet LV EF, echokardiografické známky poruchy relaxace – by tedy bylo žádoucí vyšetřovat denně, minimálně však 1., 3., 5., 7. a 10. den, v ideálním případě stejným zkušeným kardiologem – echokardiografistou.
Je nutno septickou myokardiální dysfunkci léčit?
Základním obecným předpokladem zvládnutí sepse je její včasné rozpoznání a neodkladná terapie, založená na rychlém iniciálním podání an-tibiotik, efektivní chirurgické eradikaci zdroje infekce, tekutinové resuscitaci a podpůrných opatřeních, jako je umělá plicní ventilace, hemodynamickým monitoringem řízená farmakologická podpora oběhu a další. V experimentálních studiích byly zkoušeny četné preparáty, cílené proti vystupňované proinflamatorní odpovědi organizmu (kortikosteroidy, antiendotoxinové protilátky, antagonisté TNF, antagonisté IL-1 receptoru, anti-LPS protilátky). V následných klinických studiích však nedošlo k poklesu mortality, naopak, často byla mortalita v intervenované skupině pacientů signifikantně vyšší a lékové studie byly předčasně zastavovány. Tato fakta jen potvrzují multifaktoriální patogeneze sepse a nutnost komplexního přístupu.
Terapie
Základním terapeutickým cílem je korekce sepsí indukované hypotenze. Spočívá v optimalizaci preloadu infuzní terapií (CVP, echokardiografie, PAOP), při přetrvávající hypotenzi po korekci systémové vaskulární resistence vazokonstriktory je indikována inotropní podpora myokardu. Otázka léčby SMD per se je složitější. Pokud SMD považujeme za adaptační reakci organizmu, terapeuticky zasahujeme až v případě, kdy nízký srdeční výdej není schopen uspokojit metabolické potřeby tkání a dochází k nárůstu laktátu. V situaci, kdy volumoterapie a vazopresory nezajistí přijatelné makrohemodynamické parametry, je na místě aplikace inotropika, nejčastěji dobutaminu. Pokud selže i tato kombinace, může být dalším krokem zvážení nasazení adrenalinu. Při podávání katecholaminů je však nutno mít na paměti jejich společné nežádoucí účinky – poruchy rytmu, zvýšení spotřeby O2 myokardem [24], nárůst rezistence k inzulinu. V tomto směru jsou zajímavé studie s inhibitory PDE (Phospho - diesterase, fosfodiesteráza), které kromě terapie srdečního selhání vykazují zajímavé účinky na inhibici TNF-α endotoxinem indukovaného orgánového selhání.
Noradrenalin
Vazopresorem první volby u pacientů se septickým šokem je noradrenalin. Jeho dominantně α-agonistické účinky zvyšují periferní cévní rezistenci a střední arteriální tlak (MAP – Mean Arterial Pressure) bez velkého efektu na srdeční výdej, v kombinaci s malým inotropním β-mimetickým efektem není vzestup afterloadu levé komory nepřiměřený. Podávání noradrenalinu v septickémšoku je tedy spojeno se vzestupem MAP i systémového průtoku krve. Z experimentálních septických modelů však vyplývají závěry o selhání noradrenalinu při obnově mikrovaskulární perfuze a tkáňové oxygenace, zejména ve splanchnické části cirkulace [25]. Např. Krejčí et al na prasečím modelu septického šoku sledováním mikrocirkulace pomocí laser - dopplerovské flowmetrie zjistili snížený krevní průtok v jejunu a v pankreatu u zvířat, kterým byl aplikován noradrenalin [26]. V dalším septickém, tentokrát krysím endotoxemickém modelu, byla signifikantně snížená tkáňová oxygenace v mukóze ilea a zvýšená hodnota laktátu v séru [27]. Tato a další data podtrhují nežádoucí účinky noradrenalinu na regionální perfuzi, oxygenaci a metabolický distres v septickém šoku.
Vazopresin
Vazopresin (antidiuretický hormon, terlipressin, ADH) je silným vazokonstriktorem a sehrává ústřední roli v odpovědi organizmu na hypotenzi. Způsobuje vzestup SVR, pokles srdeční frekvence a má i antidiuretický účinek. Landry et al zjistili deficit vazopresinu v septickém šoku. Následná infuze relativně malých dávek zlepšila odpověď na katecholaminy u pacientů v septickém šoku s refrakterní hypotenzí, často umožňující redukci jejich podávání [28]. Signifikantní přínos byl prokázán při kombinaci ADH s noradrenalinem na dlouhodobém animálním modelu sepse [29]. ADH má i nežádoucí účinky, např. pokles CO a tepové frekvence. Dále k nim patří arytmie, myokardiální, mezenterická a digitální ischemie [30].
Levosimendan
V patogenezi SMD sehrává důležitou úlohu porucha metabolizmu kalcia v kardiomyocytech. Fosforylace myofilament redukuje senzitivitu myofibril na kalcium, což vede k redukci myokardiální kontraktility způsobenou změněnou interakcí cTnI a cTnC [31]. Dalším mechanizmem je snížení hustoty rhodaninových receptorů na sarkoplazmatickém retikulu (SR) v kardiomyocytu. Toto vede k následnému snížení uvolňování kalcia ze SR a ke snížení kontraktility [32]. Levosimendan je kalciový senzitizér, který zlepšuje srdeční kontraktilitu a vede ke koronární a periferní vazodilataci [33]. Tento efekt je zprostředkován Ca - dependentní vazbou na troponin C za vzniku silnější kontrakce kardiomyocytu bez vzestupu intracelulární koncentrace kalcia a žádného nebo jen malého vzestupu konzumpce kyslíku myokardem. Jeho účinek je dobře prozkoumán v terapii srdečního selhání.
Z experimentálních dat se v animálním modelu endotoxemie jako výhodná ukázala kombinace levosimendanu s noradrenalinem [34]. V jiném zvířecím modelu sepse (CLP – cecal ligation and puncture) bylo porovnáváno podání levosimendanu a noradrenalinu. Oba preparáty měly srovnatelný efekt na zlepšení CO bez signifikantního ovlivnění mikrocirkulace. Jedině levosimendan však jednoznačně zlepšil tkáňový parciální tlak O2 a snížil hladinu laktátu v séru, což ukazuje na mechanizmus nezávislý na makrohemodynamice. Diskutuje se o několika možnostech, z nichž přímý protizánětlivý efekt a snížení utilizace O2 periferními tkáněmi patří k nejvíce pravděpodobným [35]. Dubin et al v experimentálním ovčím modelu sepse prokázal, že levosimendan (oproti dobutaminu) zachovává regionální dodávku O2 v mezenteriální cirkulaci [36].
První klinické použití levosimendanu bylo poprvé popsáno Matějovičem v roce 2005 [37]. Od té doby byly popsány další aplikace levosimendanu v léčbě refrakterního septického šoku v rámci podání u jednotlivého pacienta či malých skupin pacientů. Bylo shodně referováno zlepšení hemodynamiky, zejména zvýšení CO a VO2 (globální dodávky kyslíku), zlepšení metabolizmu a snížení spotřeby vazopresorů [38,39]. První randomizovanou klinickou studii publikoval Morelli et al. Soubor 30 pacientů byl randomizován do 2 skupin. První k podávání standardní terapie užívající jako inotropikum dobutamin a druhé byl aplikován levosimendan 0,2 μg/ kg/ min bez úvodního bolusu. Skupina s levosimendanem měla jednoznačně lepší CI, LV EF, VO2 a DO2 a v porovnání s dobutaminem i LVEDV, LVSWI a snížení hodnoty laktátu v séru [40]. Další klinickou randomizovanou studií bylo zhodnocení levosimendanu u pacientů se septickým šokem a ARDS se selháním pravé komory. 35 pacientů bylo randomizováno k podání 24hodinové infuze levosimendanu (0,2 µg/ kg/ min bez úvodního bolusu) nebo k placebu. Výsledky studie potvrdily zlepšení globální hemodynamiky. Došlo též ke snížení MPAP (Mean Pulmonary Artery Pressure), redukci afterloadu pravé komory s následným zlepšením RVEF. Podstatným klinickým pozorováním bylo zvýšení DO2 a SvO2, což jen potvrdilo závěry předchozích studií, ve kterých levosimendan vykazoval pozitivní efekt na globální tkáňovou oxygenaci [41].
Nežádoucí účinky při podání levosimendanu jsou zejména způsobené jeho vazodilatačním efektem. Zahrnují hlavně systémovou hypotenzi, bolesti hlavy a nevolnost. Jsou přinejmenším částečně spojené s dávkovacích schématem levosimendanu (původně se podával bolus a vyšší dávky v kontinuální infuzi – 0,4 µg/ kg/ min). V obou klinických studiích z Morelliho skupiny, při nichž byl podáván levosimendan u pacientů se septickým šokem, nedošlo k výrazné změně MAP a tepové frekvence. Dalším důvodem, proč nežádoucí účiny nebyly tak vyjádřené, je jistě i adekvátní tekutinová resuscitace a konkomitantní podávání noradrenalinu.
Data, která máme v současné době k dispozici stran podávání levosimendanu u pacientů v septickém šoku, podporují jeho aplikaci jako bezpečnou a účinnou alternativu u pacientů s vyjádřenou SMD a nedostatečnou účinností dobutaminu. Jeho podání je však podmíněno předchozí korekcí těžké hypotenze pomocí volumoterapie a vazopresorů na hodnoty systolického tlaku 90 – 100 mm Hg a vynecháním úvodní bolusové dávky. Nesmíme rovněž zapomínat, že z hlediska EBM (Evidence-based medicine) se stále jedná o off-label indikaci.
Experimentální možnosti terapie
S vědomím klíčové role NO v rozvojiseptické kardiomyopatie se objevujíprvní humánní lékové studie s neselektivním blokátorem inducibilní NO syntázy – tilarginin acetátem – a zatím nepřinesly očekávaný benefit, první z citovaných byla dokonce předčasně ukončena pro vysoký výskyt nežádoucích účinků (plicní hypertenze, srdeční selhání) [42,43]. Na zvířecím modelu sepse s nízkým srdečním výdejem byla zkoumána i možnost podpory oběhu intraaortální balónkovou kontrapulzací, výsledkem bylo delší přežití a nižší spotřeba vazopresorů [44]. Jsou popsány i jednotlivé kazuistiky úspěšné aplikace této metody v humánní medicíně.
Závěr
Součástí generalizované inflamatorní reakce organizmu na přítomnost infekčního agens je syntéza a uvolnění excesivního množství cirkulujících faktorů – TNF, IL-1 a následně oxidu dusnatého, které mají klíčovou roli v rozvoji septické dysfunkce myokardu. Do tohoto procesu však vstupuje i řada dalších mechanizmů – porucha signalizace β-receptorů, změny mikrocirkulace s následnou mitochondriální dysfunkcí, degradace kontraktilního aparátu kardiomyocytů. Přítomnost a dynamika myokardiální dysfunkce je významným prognostickým ukazatelem průběhu těžké sepse a septického šoku. Reverzibilita adaptivní odpovědi, normalizace kontraktility a ejekční frakce během 7. – 10. dne je příznivou známkou. Terapeutické experimenty s monoklonálními protilátkami proti jednotlivým cytokinům (např. anti-TNF), inhibitory NOS, nepřinesly zatím benefit a potvrzují multifaktoriální patogenezi sepse a myokardiální deprese. V současné době jsou proto diskutovány nové terapeutické přístupy k pacientům se septickou myokardiální dysfunkcí. Jedná se zejména o použití levosimendanu, který představuje slibnou alternativu, a to nejen kvůli svému pozitivně inotropnímu účinku.
Práce byla podpořena grantem IGA MZČR NR9297 - 3.
MUDr. Jan Maláska, Ph.D.
www.fnbrno.cz
e-mail: jmalaska@fnbrno.cz, jan@malaska.czDoručeno do redakce: 21. 10. 2009
Přijato po recenzi: 25. 1. 2010
Zdroje
1. Clec’h C, Ferriere F, Karoubi P et al. Diagnostic and prognostic value of procalcitonin in patients with septic shock. Crit Care Med 2004; 32 : 1166 – 1169.
2. Charpentier J, Luyt CE, Fulla Y et al. Brain natriuretic peptide: A marker of myocardial dysfunction and prognosis during severe sepsis. Crit Care Med 2004; 32 : 660 – 665.
3. Presneill JJ, Waring PM, Layton JE et al. Plasma granulocyte colony ‑ stimulating factor and granulocyte ‑ macrophage colony ‑ stimulating factor levels in critical illness including sepsis and septic shock: relation to disease severity, multiple organ dysfunction, and mortality. Crit Care Med 2000; 28 : 2344 – 2354.
4. Mehta NJ, Khan IA, Gupta V et al. Cardiac troponin I predicts myocardial dysfunction and adverse outcome in septic shock. Int J Cardiol 2004; 95 : 13 – 17.
5. King DA, Codish S, Novack V et al. The role of cardiac troponin I as a prognosticator in critically ill medical patients: a prospective observational cohort study. Crit Care 2005; 9: R390 – R395.
6. ver Elst KM, Spapen HD, Nguyen DN et al. Cardiac troponins I and T are biological markers of left ventricular dysfunction in septic shock. Clin Chem 2000; 46 : 650 – 657.
7. Parker MM. Myocardial dysfunction in sepsis: injury or depression? Crit Care Med 1999; 27 : 2035 – 2036.
8. Turner A, Tsamitros M, Bellomo R. Myocardial cell injury in septic shock. Crit Care Med 1999; 27 : 1775 – 1780.
9. Soriano FG, Nogueira AC, Caldini EG et al. Potential role of poly (adenosine 5’ ‑ diphosphate ‑ ribose) polymerase activation in the pathogenesis of myocardial contractile dysfunction associated with human septic shock. Crit Care Med 2006; 34 : 1073 – 1079.
10. Maeder M, Fehr T, Rickli H et al. Sepsis‑associated myocardial dysfunction: diagnostic and prognostic impact of cardiac troponins and natriuretic peptides. Chest 2006; 129 : 1349 – 1366.
11. Singh S, Evans TW. Organ dysfunction during sepsis. Intensive Care Med 2006; 32 : 349 – 360.
12. Witthaut R, Busch C, Fraunberger P et al. Plasma atrial natriuretic peptide and brain natriuretic peptide are increased in septic shock: impact of interleukin‑6 and sepsis‑associated left ventricular dysfunction. Intensive Care Med 2003; 29 : 1696 – 1702.
13. Cuthbertson BH, Patel RR, Croal BL et al. B‑type natriuretic peptide and the prediction of outcome in patients admitted to intensive care. Anaesthesia 2005; 60 : 16 – 21.
14. Forfia PR, Watkins SP, Rame JE et al. Relationship between B‑type natriuretic peptides and pulmonary capillary wedge pressure in the intensive care unit. J Am Coll Cardiol 2005; 45 : 1667 – 1671.
15. Jefic D, Lee JW, Savoy ‑ Moore RT et al. Utility of B‑type natriuretic peptide and N‑terminal pro B‑type natriuretic peptide in evaluation of respiratory failure in critically ill patients. Chest 2005; 128 : 288 – 295.
16. Lubien E, DeMaria A, Krishnaswamy P et al. Utility of B ‑ natriuretic peptide in detecting diastolic dysfunction: comparison with Doppler velocity recordings. Circulation 2002; 105 : 595 – 601.
17. Poelaert J, Declerck C, Vogelaers D et al. Left ventricular systolic and diastolic function in septic shock. Intensive Care Med 1997; 23 : 553 – 560.
18. Hartemink KJ, Groeneveld AB, de Groot MC et al. Alpha ‑ atrial natriuretic peptide, cyclic guanosine monophosphate, and endothelin in plasma as markers of myocardial depression in human septic shock. Crit Care Med 2001; 29 : 80 – 87.
19. Roch A, Allardet ‑ Servent J, Michelet P et al. NH2 terminal pro‑brain natriuretic peptide plasma level as an early marker of prognosis and cardiac dysfunction in septic shock patients. Crit Care Med 2005; 33 : 1001 – 1007.
20. Mitaka C, Hirata Y, Makita K et al. Endothelin‑1 and atrial natriuretic peptide in septic shock. Am Heart J 1993; 126 : 466 – 468.
21. Morgenthaler NG, Struck J, Christ ‑ Crain M et al. Pro‑atrial natriuretic peptide is a prognostic marker in sepsis, similar to the APACHE II score: an observational study. Crit Care 2005; 9: R37 – R45.
22. Dellinger RP, Levy MM, Carlet JM et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Intensive Care Med 2008; 34 : 17 – 60.
23. Parker MM, Shelhamer JH, Bacharach SL et al. Profound but reversible myocardial depression in patients with septic shock. Ann Intern Med 1984; 100 : 483 – 490.
24. Singer M. Catecholamine treatment for shock ‑ equally good or bad? Lancet 2007; 370 : 636 – 637.
25. Duranteau J, Sitbon P, Teboul JL et al. Effects of epinephrine, norepinephrine, or the combination of norepinephrine and dobutamine on gastric mucosa in septic shock. Crit Care Med 1999; 27 : 893 – 900.
26. Krejci V, Hiltebrand LB, Sigurdsson GH. Effects of epinephrine, norepinephrine, and phenylephrine on microcirculatory blood flow in the gastrointestinal tract in sepsis. Crit Care Med 2006; 34 : 1456 – 1463.
27. Pullamsetti SS, Maring D, Ghofrani HA et al. Effect of nitric oxide synthase (NOS) inhibition on macro ‑ and microcirculation in a model of rat endotoxic shock. Thromb Haemost 2006; 95 : 720 – 727.
28. Landry DW, Levin HR, Gallant EM et al. Vasopressin deficiency contributes to the vasodilation of septic shock. Circulation 1997; 95 : 1122 – 1125.
29. Barrett LK, Orie NN, Taylor V et al. Differential effects of vasopressin and norepinephrine on vascular reactivity in a long‑term rodent model of sepsis. Crit Care Med 2007; 35 : 2337 – 2343.
30. Russell JA. Vasopressin in vasodilatory and septic shock. Curr Opin Crit Care 2007; 13 : 383 – 391.
31. Takeuchi K, del Nido PJ, Ibrahim AE et al. Increased myocardial calcium cycling and reduced myofilament calcium sensitivity in early endotoxemia. Surgery 1999; 126 : 231 – 238.
32. Dong LW, Wu LL, Ji Y et al. Impairment of the ryanodine ‑ sensitive calcium release channels in the cardiac sarcoplasmic reticulum and its underlying mechanism during the hypodynamic phase of sepsis. Shock 2001; 16 : 33 – 39.
33. Cariello C, Guarracino F, Giannecchini Let al. Hemodynamic and cardiac peptide in septic myocardial depression: the effects of calcium sensitizer. Critical Care 2007; 11 (Suppl 2): P39.
34. Faivre V, Kaskos H, Callebert J et al. Cardiac and renal effects of levosimendan, arginine vasopressin, and norepinephrine in lipopolysaccharide‑treated rabbits. Anesthesiology 2005; 103 : 514 – 521.
35. Kevelaitis E, Peynet J, Mouas C et al. Opening of potassium channels: the common cardioprotective link between preconditioning and natural hibernation? Circulation 1999; 99 : 3079 – 3085.
36. Dubin A, Murias G, Sottile JP et al. Effects of levosimendan and dobutamine in experimental acute endotoxemia: a preliminary controlled study. Intensive Care Med 2007; 33 : 485 – 494.
37. Matejovic M, Krouzecky A, Radej J et al. Successful reversal of resistent hypodynamic septic shock with levosimendan. Acta Anaesthesiol Scand 2005; 49 : 127 – 128.
38. Noto A, Giacomini M, Palandi A et al. Levosimendan in septic cardiac failure. Intensive Care Med 2005; 31 : 164 – 165.
39. Powell BP, De Keulenaer BL. Levosimendan in septic shock: a case series. Br J Anaesth 2007; 99 : 447 – 448.
40. Morelli A, De Castro S, Teboul JL et al. Effects of levosimendan on systemic and regional hemodynamics in septic myocardial depression. Intensive Care Med 2005; 31 : 638 – 644.
41. Morelli A, Teboul JL, Maggiore SM et al. Effects of levosimendan on right ventricular afterload in patients with acute respiratory distress syndrome: a pilot study. Crit Care Med 2006; 34 : 2287 – 2293.
42. Bakker J, Grover R, McLuckie A et al. Administration of the nitric oxide synthase inhibitor NG ‑ methyl ‑ l ‑ arginine hydrochloride (546C88) by intravenous infusion for up to 72 hours can promote the resolution of shock in patients with severe sepsis: Results of a randomized, double‑blind, placebo ‑ controlled multicenter study (study no. 144 – 002)*. Crit Care Med 2004; 32 : 1 – 12.
43. Lopez A, Lorente JA, Steingrub J et al. Multiple ‑ center, randomized, placebo ‑ controlled, double‑blind study of the nitric oxide synthase inhibitor 546C88: effect on survival in patients with septic shock. Crit Care Med 2004; 32 : 21 – 30.
44. Solomon SB, Minneci PC, Deans KJ et al. Effects of intra ‑ aortic balloon counterpulsation in a model of septic shock. Crit Care Med 2009; 37 : 7 – 18.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Nealkoholová steatóza a steatohepatitida – editorial
- Léčba dospělých pacientů s akutní lymfoblastickou leukemií dle protokolu GMALL 07/ 2003 a její výsledky – první zkušenosti v České republice
- Prevalencia markerov poškodenia pečene u pacientov s metabolickými rizikovými faktormi
- Léčba AL‑ amyloidózy – výsledky jednoho pracoviště a přehled publikovaných zkušeností s novými léky (bortezomibem, thalidomidem a lenalidomidem) u AL‑ amyloidózy
- Kombinační léčba hypertenze v běžné klinické praxi. Výsledky studie KOHYBA
- Příspěvek k diferenciální diagnostice chronických břišních bolestí
- Myokardiální dysfunkce v sepsi – charakteristika a patogenetické mechanizmy
- Myokardiální dysfunkce v sepsi – diagnostika a terapie
- Kardiovaskulárne následky po transplantácii kmeňových krvotvorných buniek
- Více než 10 let trvající kompletní remise monoklonální gamapatie nejistého významu a vymizení nefrotického syndromu vzniklého na podkladně light chain deposition disease po léčbě vinkristinem, adriamycinem a vysokými dávkami dexametazonu (VAD)
- Pretrvávajúce symptómy, diastolická dysfunkcia a nízka koronárna rezerva u pacientky po úspešnej korekcii rekoarktácie aorty
-
9. kongres Spoločnosti balkánskych miest pre nefrológiu, dialýzu, transplantáciu a umelé orgány
(BANTAO), 18.– 22. novembra 2009, Antalya (Turecko) - V. jubilejný medicínsko‑literárny memoriál Franza Kafku, 18. septembra 2009, Tatranské Matliare a Tatranská Lomnica, Vysoké Tatry
- In memoriam – za docentem MUDr. Zdeňkem Churým, CSc.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Příspěvek k diferenciální diagnostice chronických břišních bolestí
- Pretrvávajúce symptómy, diastolická dysfunkcia a nízka koronárna rezerva u pacientky po úspešnej korekcii rekoarktácie aorty
- Léčba dospělých pacientů s akutní lymfoblastickou leukemií dle protokolu GMALL 07/ 2003 a její výsledky – první zkušenosti v České republice
- Nealkoholová steatóza a steatohepatitida – editorial
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



