Možnosti antikoagulačního zajištění metod mimotělní náhrady funkce ledvin u kriticky nemocných
Anticoagulation for extracorporeal renal replacement therapy in the critically ill
Anticoagulation of the extracorporeal circuit is usually required to prevent its clotting during renal replacement therapy. However, anticoagulants may cause significant bleeding and critically ill patients are at increased risk of it. This article analyses the implementation, efficacy and safety of anticoagulation strategies in renal replacement therapy in the critical care setting and gives a summary of the causes of extracorporeal circuit blood clotting.
Keywords:
anticoagulation – renal replacement therapy – critically ill
Authors:
Kroužecký Aleš; Novák Ivan; Raděj Jaroslav; Sýkora Roman; Chvojka Jiří; Karvunidis Thomas; Matějovič Martin
Authors‘ workplace:
JIP, I. interní klinika, Fakultní nemocnice a LF UK, Plzeň
Published in:
Anest. intenziv. Med., 19, 2008, č. 3, s. 154-158
Category:
Intesive Care Medicine - Review Article
Overview
Použití antikoagulancií je u kriticky nemocných při léčbě technikami mimotělní náhrady funkce ledvin obvykle nezbytné. Na druhou stranu však přináší pro pacienta signifikantní rizika. Článek se zabývá příčinami vysrážení krve v mimotělním okruhu a možnostmi, jak těmto příčinám předejít. Především však předkládá přehled možností, jak krev protisrážlivě ošetřit s ohledem na stav nemocného.
Klíčová slova:
antikoagulace – náhrada funkce ledvin – kriticky nemocný
Úvod
Použití mimotělních eliminačních technik pro náhradu/podporu funkce ledvin (RRT) u kriticky nemocných je obvykle spojené s nutností použití antikoagulace, jejímž cílem je zabránit vysrážení krve v mimotělním oběhu, optimalizovat délku použitelnosti filtru a zabránit krevním ztrátám způsobeným sražením krve v okruhu [1]. Navíc špatně vedená antikoagulace (i když nevede přímo ke klinicky zjevnému vysrážení krve v okruhu) může aktivací koagulačních kaskád nepříznivě zasáhnout do křehké a již tak často značně narušené koagulační rovnováhy nemocného. Neopominutelnou skutečností je též zbytečný nárůst nákladů na mimotělní eliminaci tam, kde je třeba často provádět výměny setů a filtrů. Na druhou stranu použití antikoagulace může způsobit krvácení, zvláště u kriticky nemocných, kteří jsou ve zvýšeném riziku. Z těchto všech důvodů je nezbytné problematice koagulace v mimotělním oběhu a způsobům, jak jí zabránit, věnovat náležitou pozornost.
Příčiny srážení krve v mimotělním okruhu
Samotné selhání ledvin je často spojeno s prokoagulačním stavem [2]. Kontakt krve s více či méně bioinkompatibilními povrchy mimotělního oběhu koagulaci nepochybně aktivuje [3, 4]. V průběhu kritického onemocnění též dochází k aktivaci koagulace (cesta tkáňového faktoru, snížení přirozených antikoagulancií-antitrombin, aktivovaný protein C, inhibitor cesty tkáňového faktoru). Stav je navíc potencován inhibicí fibrinolýzy [5]. Na prokoagulačním stavu se dále může podílet zvýšení počtu červených krvinek či destiček, ať již související s vlastním onemocněním či s jejich dodáním formou transfuze. Klinicky jsou dobře známé situace, kdy krátce po transfuzi červených krvinek či destiček dojde k vysrážení dosud dobře fungujícího mimotělního okruhu.
Jedním z nejběžnějších problémů, se kterými se klinik při užití mimotělní eliminace setkává, je špatné nasávání krve do katétru. To je samozřejmě velmi významně ovlivněno charakteristikou vlastního katétru: jeho diametrem a délkou (čím širší a kratší, tím lépe) a také jeho geometrií (cílem je omezit turbulentní proudění na minimum) [6]. Nicméně i katétr se sebelepším průtokem může selhávat, pokud je zalomený, je ve špatné pozici a přisává se ke stěně cévy či špatně nasává krev, protože je nedostatečná intravaskulární náplň nemocného nebo nemocný generuje příliš nízký či vysoký nitrohrudní tlak (poloha nemocného, dušnost, kašel). Také v katétru se – stejně jako kdekoliv jinde v okruhu – může utvořit krevní sraženina.
Velmi důležitou roli v udržení „životnosti“ okruhu sehrávají jednak míra průtoku krve okruhem, jednak frekventní zástavy či snížení tohoto průtoku [7]. Obecně platí, že čím rychlejší je průtok krve okruhem, tím menší je pravděpodobnost, že dojde k vysrážení. Dříve používané nízké krevní průtoky 100–150 ml . min-1 (s myšlenkou na hemodynamickou toleranci) jsou dnes již opuštěny a víme, že u většiny nemocných lze bezpečně použít průtoky 200 ml . min-1 a více. Takového průtoku je však třeba dosáhnout jeho postupným navyšováním, nikoliv okamžitým nastavením. Jako vysloveně nevhodné se ukazují opakované zástavy průtoku krve okruhem, např. při špatném sání z katétru, při polohování nemocného atd. V tomto směru je třeba zdůraznit úlohu sestry, a to především její reakční čas na alarm přístroje, rychlost řešení situace a včasné reference o opakovaném problému lékaři (který např. vymění špatně fungující katétr). Významnou úlohu sehrává též zahušťování krve na hemofiltru při ultrafiltraci. Souhru těchto okolností vyjadřuje tzv. filtrační frakce (FF), kdy:
FF (%) = [ultrafiltrace/přítok tekutiny do filtru (průtok plasmy + eventuálně substituce při prediluci)] . 100.
Hodnota FF by neměla překročit 20 % [8].
Indukci krevního srážení lze jistě též ovlivnit charakteristikou filtrů a setů (materiály, geometrie, délka, povrch). Zda budou v klinické praxi hrát významnou úlohu materiály, které mají na svém povrchu navázán heparin nebo budou minimálně trombogenní, nebylo dosud jednoznačně vyřešeno.
Možnosti protisrážlivého ošetření krve
Výše uvedená opatření je třeba chápat spíše jako pomocná a u většiny nemocných je nezbytné použít antikoagulaci, aby bylo možné udržet mimotělní náhradu funkce ledvin dobře funkční. Antikoagulancia interferují s humorální koagulací a funkcí krevních destiček a mohou mít více či méně závažný dopad na systémovou koagulační rovnováhu – krvácení je během RRT s antikoagulací popisováno u 5–25 % pacientů [9]. Je proto třeba hledat při výběru konkrétního antikoagulancia rozumnou rovnováhu mezi jeho bezpečností, efektivitou, praktičností použití a samozřejmě též cenou. Pokud to charakter daného preparátu dovoluje, je nezbytné provádět opakovanou kontrolu koagulačních parametrů nemocného. V neposlední řadě je třeba se pokud možno vyvarovat kombinací léků (zvláště neúmyslných), které do koagulačních kaskád zasahují.
Podle způsobu aplikace lze použití antikoagulancií rozdělit do 4 podskupin:
- systémová antikoagulace,
- minimální systémová antikoagulace,
- regionální antikoagulace,
- žádná antikoagulace.
1. Systémová antikoagulace
Nefrakcionovaný heparin (UFH)
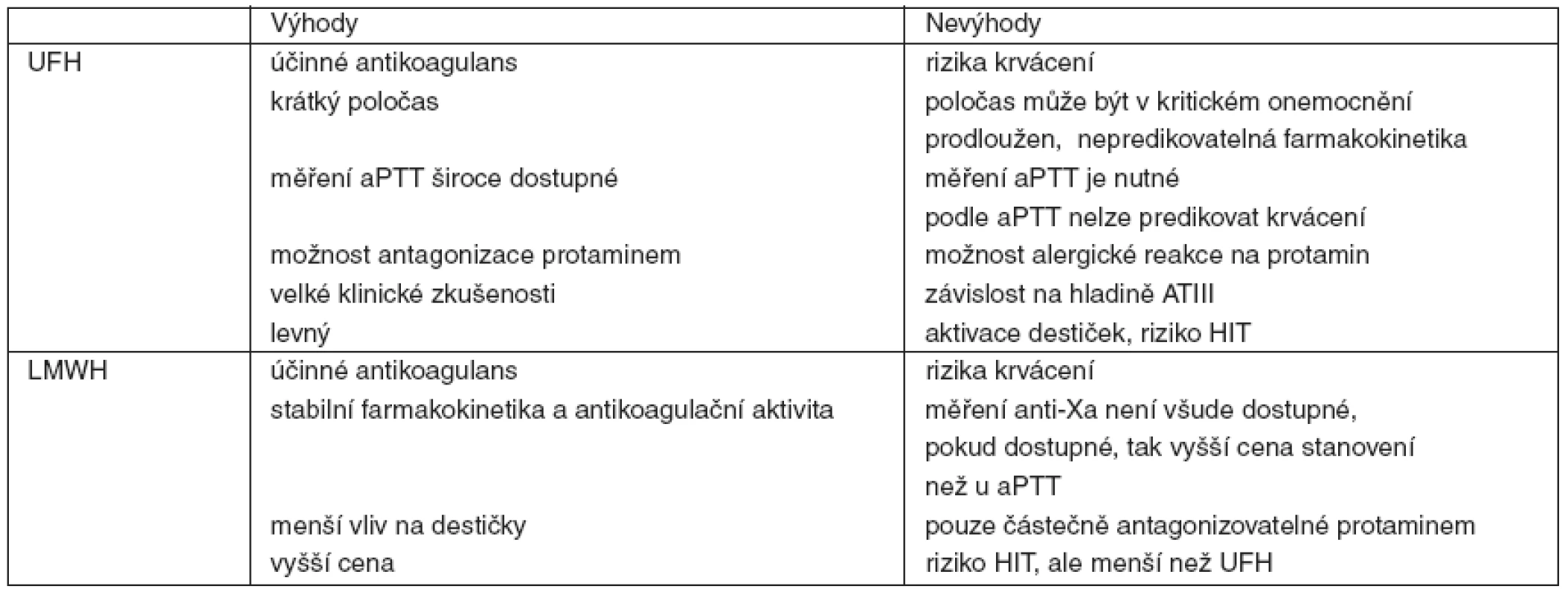
Nefrakcionovaný heparin je nejčastěji používaným antikoagulanciem u CRRT. Název nefrakcionovaný je vyjádřením, že UFH je směsí molekul heparinu o rozdílné velikosti (5–30 kDa). Zatímco velké fragmenty inhibují především aktivitu faktoru IIa (trombinu), tak jeho malé fragmenty inhibují aktivitu faktoru Xa. UFH funguje tak, že až tisícinásobně zvyšuje aktivitu přirozeného antikoagulantu – antitrombinu. Heparin je metabolizován v játrech a tyto metabolity jsou pak eliminovány ledvinami, přičemž plasmatický poločas se pohybuje mezi 30–180 minutami.
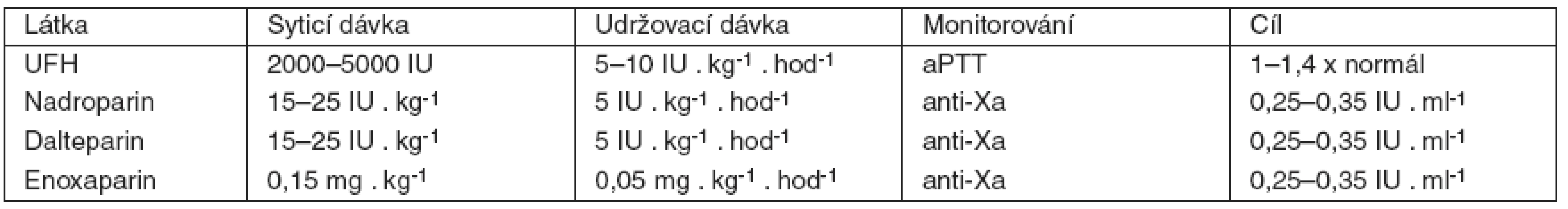
UFH je levným antikoagulanciem, navíc monitorování jeho účinku pomocí aPTT (aktivovaný parciální tromboplastinový čas) je jednoduché, klinicky snadno dostupné a relativně levné. Na druhou stranu je však použití UFH u kriticky nemocných spojeno s některými klinicky relevantními problémy. Řada kriticky nemocných má významně sníženou hladinu antitrombinu, což může navodit „rezistenci“ vůči podávanému heparinu s nepredikovatelnými efekty na koagulaci. V klinice pak lékař opakovaně zvyšuje dávku heparinu bez žádoucího efektu na aPTT. Situace se může stát zvláště nebezpečnou, pokud je v tomto okamžiku nemocnému infundován antitrombin při neznalosti jeho interakce s UFH. Navíc velké fragmenty heparinu s anti-IIa aktivitou jsou z těla odstraňovány rychleji než menší fragmenty s anti-Xa aktivitou. Protože je aPTT mnohem citlivější ke změnám v IIa, může dojít k situaci, že sice měříme normální aPTT, ale přesto UFH má již (nebo stále ještě v závislosti na situaci) významný antikoagulační efekt (anti-Xa účinek), se kterým nemusí být v dané klinické situaci kalkulováno [10]. Výhodou UFH však je, že na rozdíl od řady jiných antikoagulancií lze jeho efekt dobře antagonizovat protaminem. Aby bylo riziko krvácení při použití UFH u rizikových pacientů sníženo, doporučuje se dosáhnout prodloužení 1–1,4násobku normálu aPTT [11]. Pokud je nemocný indikován k systémové antikoagulaci z jiného důvodu (trombóza, plicní embolie atd.), mělo by být prodloužení aPTT větší.
Nízkomolekulární hepariny (LMWH)
LMWH jsou tvořeny směsí kratších heparinových řetězců vzniklých depolymerací UFH. Zatímco UFH působí inhibici faktorů IIa a Xa v poměru 1 : 1, u LMWH se v závislosti na preparátu tento poměr pohybuje od 1 : 1,9 až asi po 1 : 4,2 i více, ve prospěch inhibice faktoru Xa. Krátké heparinové řetězce jsou ve srovnání s UFH v mnohem menší míře vázány na plasmatické bílkoviny a buněčné povrchy, proto mají delší plasmatický poločas s predikovatelným antikoagulačním účinkem úměrným dávce. Normální poločas LMWH je 2–4 hodiny. Vylučování ledvinami se pohybuje mezi 5–10 %. Několikrát byla popsána závažná spontánní krvácení u pacientů s chronickým selháním ledvin léčených LMWH [12], proto je z bezpečnostních důvodů u těchto nemocných doporučeno monitorování anti-Xa aktivity. Domníváme se, že stejnou praxi je vhodné používat i u kriticky nemocných s akutním selháním ledvin na RRT. U UFH a LMWH je třeba vždy myslet na možnost rozvoje heparinem indukované trombopenie (HIT). Srovnání UFH a LMWH uvádí tabulka 1. Doporučení pro dávkování UFH a některých LMWH u pacientů v riziku krvácení je v tabulce 2.
Heparinoidy
Danaparoid se získává z prasečí střevní mukózy a má mimořádně vysokou anti-Xa aktivitu a nízkou anti-IIa aktivitu (poměr 28 : 1). Přestože je někdy používán při léčbě heparinem indukované trombocytopenie, dokáže ji sám vyvolat. Nemá žádného antagonistu, při selhání ledvin se jeho poločas významně prodlužuje (z 25 hod až na 48 hod). Použití danaparinoidu během CVVH bylo popsáno nedostatečně, přičemž jeho použití bylo spojeno s vysokým výskytem krvácení [13].
Inhibitory faktoru Xa
Inhibitory faktoru Xa přímo inhibují faktor Xa, tato inhibice je závislá na antitrombinu. Zástupcem je fondaparinux, který nereaguje s jinými koagulačními faktory, a tak nevede k prodloužení aPTT. Přestože fondaparinux může indukovat tvorbu anti-heparin/PF4 protilátek, tak heparinem indukovanou trombocytopenii díky malé délce molekuly nezpůsobuje. Mohlo by proto být vhodné jeho použití u pacientů s HIT. Fondaparinux se odstraňuje hlavně ledvinami, proto je nutné zvláště při selhání ledvin sledovat anti-Xa. Zkušenosti s jeho použitím během CRRT jsou zatím malé.
Přímé inhibitory trombinu
Hirudin a argatroban se váží na trombin a nereagují s anti-heparin/PF4 protilátkami. Zatímco hirudin je vylučován především ledvinami a jeho poločas se při selhání ledvin významně prodlužuje (z 1hod na 50 hod), tak argatroban je vylučován především játry. Použití hirudinu při RRT je proto problematické [14], argatroban by v tomto směru mohl být výhodnější, ale klinická zkušenost s jeho použitím v této indikaci je nedostatečná. Ke sledování účinku léčby přímými inhibitory trombinu se používá aPTT, u hirudinu je ale prodlužování aPTT závislé na dávce jen při použití nízkých dávek léku. Přímé inhibitory trombinu mohou mít uplatnění při léčbě HIT.
2. Minimální systémová antikoagulace
Prostaglandiny
Prostaglandiny (PG) inhibují aktivaci destiček a jejich agregabilitu. U rizikových pacientů jsou proto někdy používány buď samostatně, či jako přídavek ke snížené dávce heparinu. Pokud jsou PG podávány před filtr, tak významně snižují agregabilitu destiček v mimotělním okruhu [15], zatímco v systémové cirkulaci prodlužují krvácivý čas jen málo. Incidence krvácivých komplikací je proto při použití PG ve srovnání s UFH nižší [16]. Bohužel použití pouze prostaglandinu u nemocného, který nemá jiný koagulační defekt, nemusí být dostatečné ve smyslu dosažení adekvátní antikoagulace v okruhu, a tak může vést k předčasnému vysrážení. Navíc PG mají vazodilatační aktivitu, takže použití vyšších dávek může vést u kriticky nemocných k navození nežádoucí hypotenze. Při použití prostaglandinů byl též popsán nárůst nitrolebního tlaku. Cena antikoagulace CRRT za pomoci PG není nezanedbatelná.
Aktivovaný protein C
Rekombinantní lidský aktivovaný protein C (rhAPC) inhibuje tvorbu trombinu tím, že degraduje faktory Va a VIII. Byl popsán úspěšný průběh RRT bez nutnosti další antikoagulace u pacientů, kteří rhAPC dostávali z důvodu sepse. Podávání rhAPC z důvodu sepse se však zdá být v poslední době minimálně komplikované, přičemž cena rhAPC je mimořádná [17]. Nelze tedy předpokládat, že by rhAPC jako antikoagulans pro CRRT byl významněji využíván.
3. Regionální antikoagulace
U části kriticky nemocných nelze s ohledem na rizika systémovou antikoagulaci (aktivní krvácení, pooperační stav, stav po traumatu, koagulační porucha) použít. U takových pacientů je při nutnosti RRT vhodné použít regionální antikoagulaci, tzn. že je antikoagulačně ošetřena krev pouze v mimotělním okruhu, krev v nemocném je srážlivá normálně.
Protamin-heparinová regionální antikoagulace
Logikou tímto způsobem vedené antikoagulace je heparinem navozená nesrážlivost krve v mimotělním okruhu, kdy při návratu takto ošetřené krve je antikoagulační efekt heparinu rušen podáním protaminu. Cílem je dosáhnout dvojnásobného prodloužení aPTT v okruhu, zatímco v krvi nemocného je aPTT normální. Podání protaminu může indukovat aktivaci zánětlivých mediátorů, může navodit hypotenzi, destičkovou dysfunkci. Navíc se zdá, že komplexy heparin-protamin mohou tvořit depozita v cévách [18]. Z těchto důvodů se použití této metody nedoporučuje.
Citrátová regionální antikoagulace
Vzhledem k tomu, že ionizované kalcium hraje významnou roli v krevní srážlivosti, jeho vyvázání citrátem vede k inhibici koagulace [19]. K tomu, aby byla krevní srážlivost potlačena v mimotělním okruhu, je citrát podáván do mimotělního okruhu před hemofiltr. Komplex kalcium/citrát je pak eliminován jednak částečně difuzí/konvekcí v hemofiltru, jednak částečně vstupuje do systémové cirkulace. Zde dochází ke zvýšení kalcémie krve odcházející z přístroje naředěním systémovou krví, dodávkou kalcia infuzí a uvolněným kalciem, především z komplexu kalcium/citrát, který metabolizuje v játrech. Systémový antikoagulační efekt citrátu je tak zanedbatelný. Podávání citrátu však může mít významné metabolické důsledky [20]:
- Výsledkem metabolizace jedné molekuly citrátu jsou tři molekuly bikarbonátu, proto citrát navíc funguje jako pufr. Nadměrná dávka citrátu může tedy způsobit metabolickou alkalózu. Při významném postižení jaterních funkcí nemusí být citrát dostatečně metabolizován a může dojít k rozvoji metabolické acidózy.
- Citrát infundujeme v podobě sodné soli, proto jeho podávání může vést ke zvýšení natrémie.
- Během citrátové antikoagulace dochází kromě chelace kalcia též k vyvazování magnézia, proto může být důsledkem nejen hypokalcémie, ale také hypomagnezémie (je nutná adekvátní suplementace těchto iontů).
Klinická zkušenost s použitím citrátové antikoagulace je velmi dobrá. Zdá se, že pokud je metodicky dobře zvládnuta, tak je frekvence komplikací velice nízká, přičemž životnost mimotělního okruhu je lepší než při použití UFH při snížení frekvence krvácivých komplikací. Je však třeba zmínit, že finanční nákladnost citrátové antikoagulace je značná.
Protokolů, jak vést citrátovou antikoagulaci u CRRT, byla vypracována řada a bohužel žádné z těchto schémat není univerzálně použitelné. Vždy záleží na metodě, která je antikoagulována (IHD, CVVH, CVVHD, CVVHDF atd.), záleží na koncentraci citrátu a kalcia v preparátu, který je na pracovišti k dispozici, zda je či není přítomna jaterní insuficience/selhání, důležitý je typ substitučního/dialyzačního roztoku a rychlosti jeho substituce a také rychlost krevního průtoku i způsob měření antikoagulačních účinků (ionizované kalcium, ACT). Obecně platí, že k dosažení dostatečného antikoagulačního účinku je potřeba snížit ionizované kalcium v mimotělním okruhu pod 0,30–0,35 mmol . l-1. Z důvodu bezpečnosti nemocného by hladina ionizovaného kalcia v jeho krvi neměla klesnout pod 0,8 mmol . l-1. Podle našeho názoru je klíčem k úspěchu erudice v problematice všech možných komplikací a především frekventní laboratorní (4–6krát denně Ca2+ z krve z mimotělního okruhu za dialyzátorem a z krve nemocného, ASTRUP, 2krát denně Na, Mg, koagulační vyšetření). Při proceduře je pak nutné dávku citrátu a kalcia upravovat podle výsledků. Běžné dávky se na našem pracovišti pohybují u citrátu mezi 200–400 ml . h-1 preparátu ACD-A (Baxter) a u kalcia mezi 10–20 ml . h-1 preparátu calcium gluconicum (pokud je použito kalcium chloratum, tak je dávka asi 3krát nižší).
4. Žádná antikoagulace
Ve vybraných případech lze uvážit a úspěšně provést mimotělní očišťovací proceduru bez použití antikoagulancia [21]. Jedná se především o nemocné s výraznou koagulační poruchou související se základním onemocněním pacienta (jaterní selhání, DIC, těžká trombopenie apod.). Pokud je metoda vedena bez antikoagulancia, je obzvláště nutné se vyvarovat opakovanému zastavování průtoku krve přístrojem a je vhodné dosáhnout co nejvyššího krevního průtoku, který systém a stav pacienta dovolí.
U pacientů s vysokým rizikem krvácení a normálním koagulačním stavem, u kterých není možné použít regionální citrátovou antikoagulaci (nedostupnost metody, zkušenosti pracoviště atd.), lze často úspěšně vést intermitentní proceduru zcela bez antikoagulancia s frekventními proplachy mimotělního okruhu – např. každých 20–30 minut 200 ml fyziologického roztoku.
Praktické poznámky
Při kontinuálních metodách je vhodné zvažovat použití predilučního uspořádání mimotělního okruhu, tj. podání substitučního roztoku před hemofiltr. Ve srovnání s postdilučním uspořádáním takto podaný roztok ředí krev před filtrem, a tak snižuje míru zahuštění krve ve filtru při ultrafiltraci a zlepšuje její reologické vlastnosti. Tato praxe prodlužuje přežití filtru a díky ní je možné snížit dávku antikoagulancií. Toto zlepšení je však vykoupeno určitým snížením očišťovací účinnosti metody [22]. Toto snížení účinnosti ale zřejmě není klinicky významné. Pokud je přesto třeba dosáhnout vyšší účinnosti, lze např. zvýšit substituci/ultrafiltraci či některé přístroje pro CRRT umožňují souběžné uspořádání, a tak využití výhod obou metod.
Při citrátové antikoagulaci je doporučováno použít roztok bez kalcia, ale v praxi je vyzkoušeno, že i roztoky s kalciem je možné použít – je však třeba zvýšit dávku podávaného citrátu [23].
Při nutnosti použít citrátovou antikoagulaci u jaterního selhání není tato metoda zcela vyloučena. Je nutné stav nemocného a jeho homeostázu pečlivě sledovat a dávku citrátu volit co nejnižší [24]. Vzhledem k tomu, že citrát je malá molekula, která se intenzivně odstraňuje difuzí, je vhodné u takových nemocných volit formu CRRT s dialyzační složkou – CVVHD či CVVHDF. Dále se za této situace doporučuje sledovat v krvi nemocného nejen hladinu ionizovaného kalcia, ale také hladinu celkového kalcia a z hodnot pak vypočítávat poměr Ca celkové/Ca2+. Pokud je tento poměr vyšší než 2,5, je velmi pravděpodobná kumulace citrátu [25]. Nejjednodušším způsobem by bylo přímo měřit koncentraci citrátu v krvi, bohužel ale tato metoda obvykle není dostupná.
Proplachování okruhu heparinem před procedurou nemá smysl ani u IHD, ani u CRRT [26, 27].
Podpořeno výzkumným záměrem MSM 0021620819 Náhrada a podpora funkce některých životně důležitých orgánů.
Došlo 19. 2. 2008.
Přijato 31. 3. 2008.
Adresa pro korespondenci:
MUDr. Aleš Kroužecký, Ph.D.
JIP, I. interní klinika, FN a LF UK Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: krouzecky@fnplzen.cz
Sources
1. Cutts, M. W. et al. Transfusion requirements during continuous veno-venous haemofiltration: the importance of filter life. Intensive Care Med., 2000, 26, 11, p. 1694–1697.
2. Davenport, A. The coagulation system in the critically ill patient with acute renal failure and the effect of an extracorporeal circuit. Am. J. Kidney Dis., 1997, 30, 5, Suppl 4, p. S20–S27.
3. Opatrný, K. Jr. Biokompatibilita dialyzačních mebrán. Plzeň: Euroverlag Plzeň, s. r. o., III/2000.
4. Cardigan, R. A. et al. Activation of the tissue factor pathway occurs during continuous venovenous hemofiltration. Kidney Int., 1999, 55, 4, p. 1568–1574.
5. Levi, M., Opal, S. M. Coagulation abnormalities in critically ill patients. Crit. Care, 2006, 10, 4, p. 222.
6. Jean, G. et al. Central venous catheters for haemodialysis: looking for optimal blood flow. Nephrol. Dial. Transplant., 1997, 12, 8, p. 1689–1691.
7. Baldwin, I. et al. Blood flow reductions during continuous renal replacement therapy and circuit life. Intensive Care Med., 2004, 30, 11, p. 2074–2079.
8. Mehta, R. Anticoagulation for continuous renal replacement therapies. In Ronco, C., Bellomo, R. Critical Care Nephrology. Dordrecht: Kluwer Academic Publisher, 1998, p. 1199–1211.
9. Ronco, C. et al. Effects of different doses in continuous veno-venous haemofiltration on outcomes of acute renal failure: a prospective randomised trial. Lancet, 2000, 1, 356, 9223, p. 26–30.
10. Hirsh, J. et al. Heparin and low-molecular-weight heparin: mechanisms of action, pharmacokinetics, dosing, monitoring, efficacy, and safety. Chest, 2001, 119, 1 Suppl, p. 64S–94S.
11. Oudemans-van Straaten, H. M. et al. Anticoagulation strategies in continuous renal replacement therapy: can the choice be evidence based? Intensive Care Med., 2006, 32, 2, p. 188–202.
12. Farooq, V. et al. Serious adverse incidents with the usage of low molecular weight heparins in patients with chronic kidney disease. Am. J. Kidney Dis., 2004, 43, 3, p. 531–537.
13. Lindhoff-Last, E. et al. Use of a low-molecular-weight heparinoid (danaparoid sodium) for continuous renal replacement therapy in intensive care patients. Clin. Appl. Thromb. Hemost., 2001, 7, 4, p. 300–304.
14. Vargas Hein, O. et al. Hirudin versus heparin for anticoagulation in continuous renal replacement therapy. Intensive Care Med., 2001, 27, 4, p. 673–679.
15. Kozek-Langenecker, S. A. et al. Effect of prostacyclin on platelets, polymorphonuclear cells, and heterotypic cell aggregation during hemofiltration. Crit. Care Med., 2003, 31, 3, p. 864–868.
16. Kozek-Langenecker, S. A. et al. Anticoagulation with prostaglandin E1 and unfractionated heparin during continuous venovenous hemofiltration. Crit. Care Med., 1998, 26, 7, p. 1208–1212.
17. Dellinger, R. P. et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med., 2008, 36, 1, p. 296–327.
18. Rossmann, P. et al. Protamine-heparin aggregates. Their fine structure, histochemistry, and renal deposition. Virchows Arch., 1982, 40, 1, p. 81–98.
19. Mehta, R. L. et al. Regional citrate anticoagulation for continuous arteriovenous hemodialysis in critically ill patients. Kidney Int., 1990, 38, 5, p. 976–981.
20. Gabutti, L. et al. Citrate anticoagulation in continuous venovenous hemodiafiltration: a metabolic challenge. Intensive Care Med., 2002, 28, 10, p. 1419–1425.
21. Tan, H. K. et al. Continuous veno-venous hemofiltration without anticoagulation in high-risk patients. Intensive Care Med., 2000, 26, 11, p. 1652–1657.
22. van der Voort, P. H. et al. Filter run time in CVVH: pre - versus post-dilution and nadroparin versus regional heparin-protamine anticoagulation. Blood Purif., 2005, 23, 3, p. 175–180.
23. Gupta, M. et al. Regional citrate anticoagulation for continuous venovenous hemodiafiltration using calcium-containing dialysate. Am. J. Kidney Dis., 2004, 43, 1, p. 67–73.
24. Kramer, L. et al. Citrate pharmacokinetics and metabolism in cirrhotic and noncirrhotic critically ill patients. Crit Care Med., 2003, 31, 10, p. 2450–2455.
25. Meier-Kriesche, H. U. et al. Increased total to ionized calcium ratio during continuous venovenous hemodialysis with regional citrate anticoagulation. Crit Care Med., 2001, 29, 4, p. 748–752.
26. Opatrny, K. Jr et al. A clinical study to assess the effect of heparin in dialyzer rinsing solutions. Int. J. Artif. Organs., 1997, 20, 2, p. 112–118.
27. Opatrny, K. Jr et al. The effect of heparin rinse on the biocompatibility of continuous veno-venous hemodiafiltration. Int. J. Artif. Organs., 2002, 25, 6, p. 520–528.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2008 Issue 3
-
All articles in this issue
- Selektivní intubace dětí tracheální rourkou UniventR
- Distraction osteogenesis in the head and neck region
- Hemoragicko-traumatický šok po teroristickém útoku – léčba v Polní nemocnici Armády České republiky ROLE II+, Kábul
- Možnosti prevence nozokomiální pneumonie ventilovaných nemocných – aktuální stav
- Možnosti antikoagulačního zajištění metod mimotělní náhrady funkce ledvin u kriticky nemocných
- O výzkumné činnosti v oboru anesteziologie a resuscitace v druhé polovině dvacátého století
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hemoragicko-traumatický šok po teroristickém útoku – léčba v Polní nemocnici Armády České republiky ROLE II+, Kábul
- Selektivní intubace dětí tracheální rourkou UniventR
- Možnosti prevence nozokomiální pneumonie ventilovaných nemocných – aktuální stav
- O výzkumné činnosti v oboru anesteziologie a resuscitace v druhé polovině dvacátého století
