Fatální komplikace tracheostomie u třináctiletého pacienta s Duchenneovou svalovou dystrofií – kazuistika
A fatal complication of tracheostomy in a 13-year-old patient with Duchenne Muscular Dystrophy – case report
The authors describe a case of a 13-year-old boy suffering from Duchenne muscular dystrophy. Permanent mechanical ventilation was necessary due to the patient’s progressive chronic respiratory insufficiency. A surgical tracheostomy was complicated by the development of tracheal stenosis managed with special types of tracheostomy tubes. A tracheo-arterial fistula developed as a result of progression of skeletal chest deformities and the tracheal stenosis. The patient died of massive arterial haemorrhage from the fistula formed between the trachea and the brachiocephalic trunk.
Keywords:
Duchenne Muscular Dystrophy – tracheostomy – tracheomalacia – tracheostenosis – tracheo-arterial fistula
:
Stříteská Jana 1; Pařízková Renata 1; Dostál Pavel 1; Hoffmann Petr 2; Černý Vladimír 1
:
Klinika anesteziologie, resuscitace a intenzivní medicíny, UK v Praze, LF v Hradci Králové, Fakultní nemocnice Hradec Králové
1; Radiologická klinika, Fakultní nemocnice Hradec Králové
2
:
Anest. intenziv. Med., 20, 2009, č. 2, s. 107-112
:
Intesive Care Medicine - Case Report
Autoři popisují případ třináctiletého chlapce s Duchenneovou svalovou dystrofií, u něhož došlo při progresi základního onemocnění k rozvoji chronické respirační insuficience s nutností trvalé ventilační podpory. Provedená tracheostomie byla komplikována zúžením průdušnice, řešeném konzervativně speciálními typy tracheostomických kanyl. Při progresi deformit skeletu hrudníku a zúžení průdušnice došlo ke vzniku tracheoarteriální komunikace. Pacient zemřel v důsledku masivního arteriálního krvácení z píštěle mezi průdušnicí a truncus brachiocephalicus.
Klíčová slova:
Duchenneova svalová dystrofie – tracheostomie – tracheomalacie – stenóza průdušnice – tracheoarteriální píštěl
Úvod
Duchenneova svalová dystrofie (Duchenne Muscular Dystrophy, DMD) je geneticky podmíněné onemocnění, charakterizované redukcí svalové hmoty a progresivní ztrátou funkce svalů u chlapců v dětském věku. Onemocnění se vyskytuje s incidencí jednoho případu na 3500 narozených chlapců, ženy jsou zpravidla asymptomatickými nositelkami zmutovaného genu [1, 2, 3, 4]. Jedná se o gonozomálně recesivní onemocnění, způsobené mutacemi v genu pro svalový protein dystrofin, důležitou strukturální komponentu membrány svalových buněk [5]. Je známo 8 izoforem dystrofinu, svalová izoforma je exprimována v kosterní, srdeční i hladké svalovině (M-dystrofin) [4]. Hlavní funkcí M-dystrofinu je zajištění mechanické stability membrán svalových vláken během opakujících se cyklů kontrakce a relaxace svalu. Absence dystrofinu vede k excesivnímu vstupu kalcia do buněk, s následnou nekrózou buněk [1, 4, 6].
Progredující svalová slabost, typická pro DMD, je způsobena degenerací svalových vláken, která jsou postupně nahrazena tukovou a vazivovou tkání [5, 6]. Klinicky se choroba manifestuje obvykle do věku 3 let slabostí proximálních svalů dolních končetin a pánve, později jsou postiženy všechny svalové skupiny včetně dýchacích svalů a srdeční svaloviny. Pseudohypertrofie lýtkových svalů způsobená fibrotizací svalové tkáně, obtíže při postavení do stoje (Gowersův příznak) a chůzi po schodech jsou typickými časnými známkami onemocnění [1, 2, 5]. Z pozdních symptomů dominuje abnormální vývoj kostí s deformitami skeletu, svalovými kontrakturami, skoliózou páteře. V důsledku postižení dýchacích svalů a deformit skeletu hrudníku dochází k rozvoji respirační insuficience s ventilačním selháním, onemocnění bývá často sdruženo s dilatační kardiomyopatií [1, 5]. Pacienti s Duchenneovou chorobou obvykle umírají před dosažením třicátého roku věku, nejčastěji na kardiopulmonální komplikace onemocnění [1, 3].
Z laboratorních vyšetření se k diagnostice onemocnění využívá stanovení hladiny kreatinkinázy v séru, která je nespecifickou známkou poškození svalové tkáně; elektromyogram rozliší myogenní a neurogenní myopatie [3, 5, 6]. S postupným vývojem metod testování DNA je méně často nutná svalová biopsie k potvrzení diagnózy DMD, kdy je v odebraném vzorku tkáně zjišťována přítomnost proteinu dystrofinu [5, 6]. V rámci genetického testování se v současné době v České republice nejvíce provádí přímá diagnostika velkých delecí a bodových mutací [4].
Vzhledem k absenci kauzální terapie jsou léčebné postupy u DMD zaměřeny na podpůrnou a symptomatickou léčbu [2, 5]. V dnešní době lze prodloužit délku a zlepšit kvalitu života pacientů, dříve umírajících zejména na ventilační selhání, mimo jiné i možností trvalé ventilační podpory v domácím prostředí.
Kazuistika
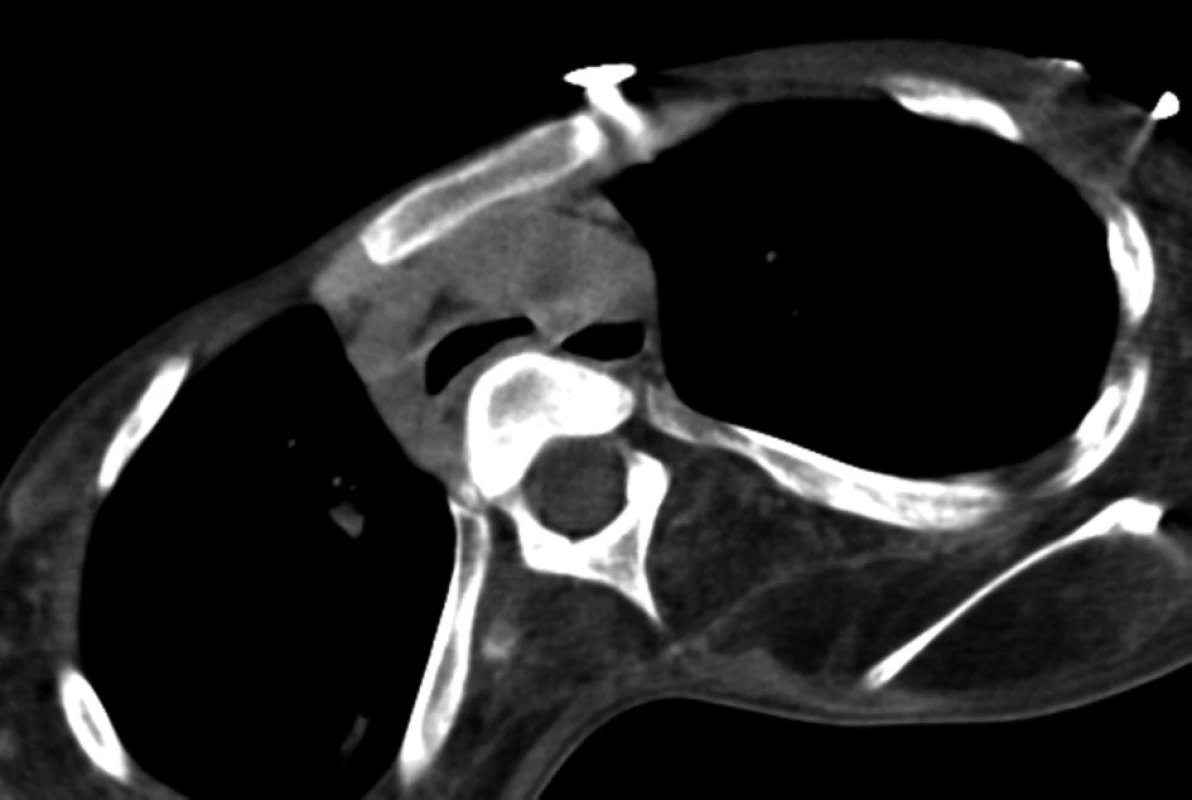
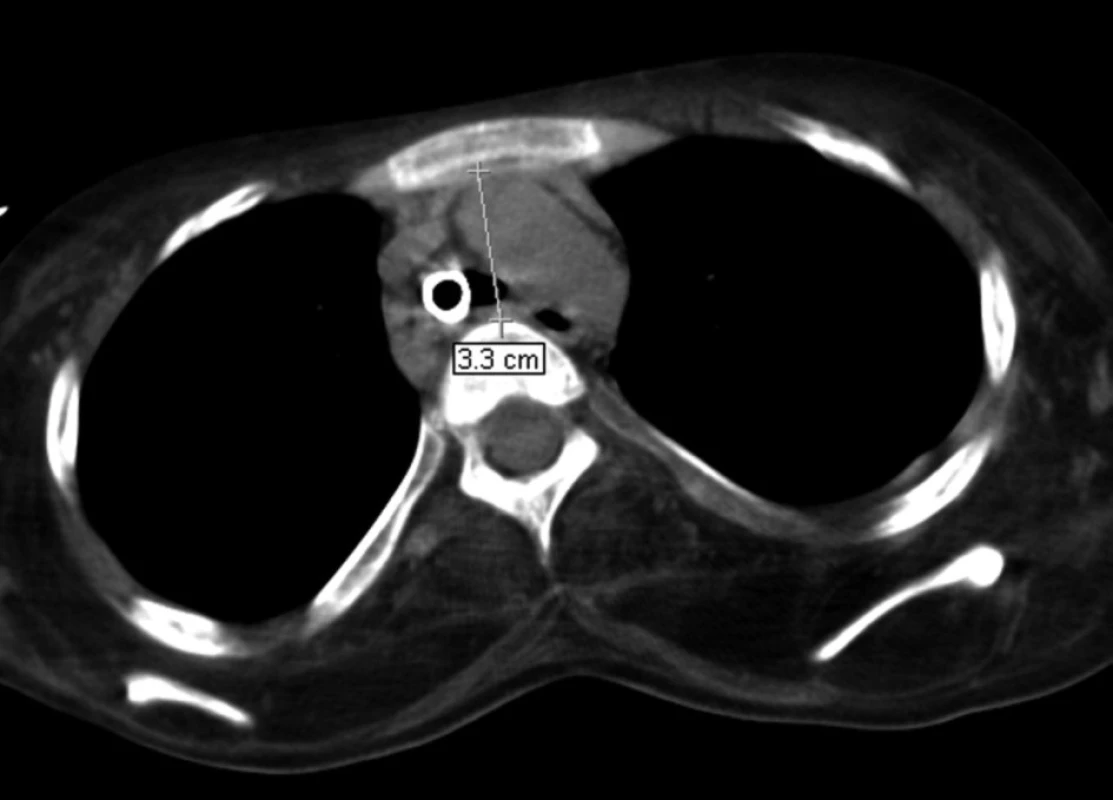
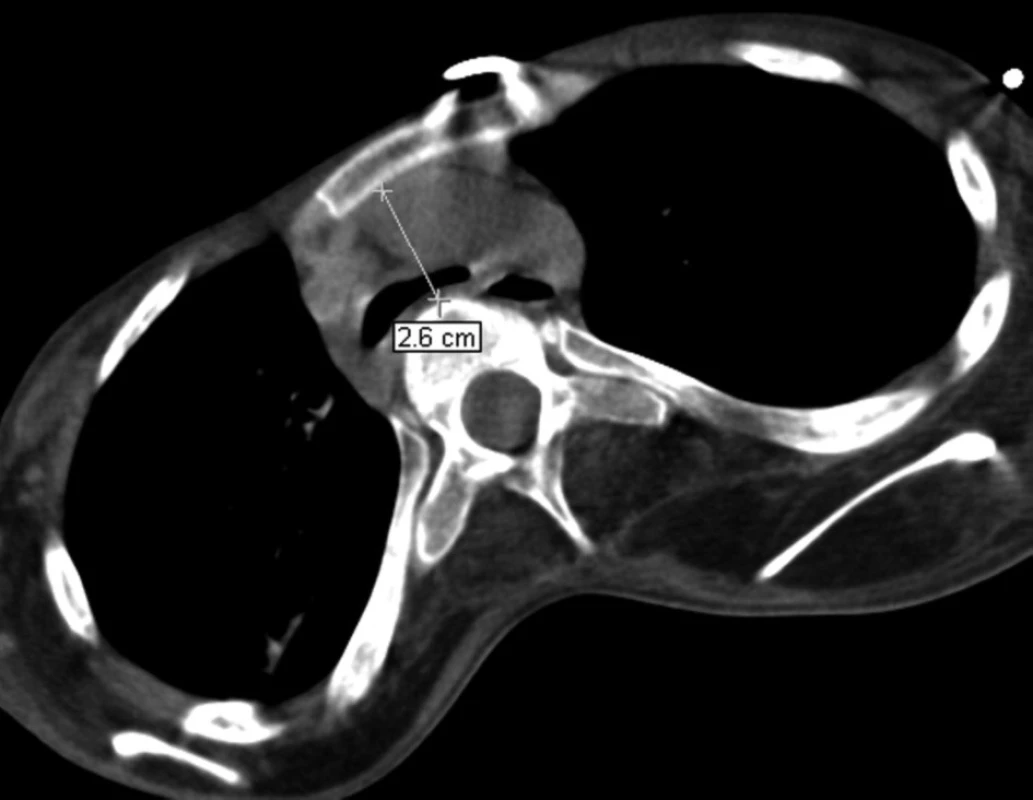
Třináctiletému chlapci s negativní rodinnou anamnézou dědičných onemocnění byla v prvním roce života diagnostikována Duchenneova svalová dystrofie. V dalších letech progredovala svalová slabost, chlapec byl od sedmi let odkázán na invalidní vozík. Na našem oddělení byl poprvé hospitalizován v dubnu 2007 pro akutní respirační insuficienci s nutností umělé plicní ventilace v důsledku infekce dýchacích cest a aspirace. V klinickém neurologickém nálezu dominovala u dosud spontánně ventilujícího pacienta difuzní svalová slabost, byla zachována pouze reziduální hybnost prstů horních končetin a pohyby hlavou. Přes úspěšnou terapii respirační infekce a zlepšení oxygenační funkce plic přetrvávala nutnost ventilační podpory při trvalé progresi základního onemocnění. Byla provedena chirurgická tracheostomie mezi 2. a 3. prstencem průdušnice (včetně fixace okrajů stěny průdušnice stehy ke kůži) a zavedena tracheostomická kanyla (TSK) standardního typu (Portex). Opakovaně docházelo k dislokacím TSK a obtížím při její fixaci. Při endoskopickém vyšetření bylo patrné trychtýřovité zúžení průdušnice na 7–9 mm v předozadním směru (substomicky), které bylo klinicky hodnoceno jako tracheomalacie vzniklá pravděpodobně při útlaku stěny průdušnice koncem TSK. Zúžení průdušnice zasahovalo i suprastomicky k prstenčité chrupavce, kde se rozpadla přední stěna prvních dvou tracheálních prstenců. Ve snaze o přemostění substomické stenózy průdušnice byla zavedena TSK Mallinckrodt s nastavitelnou hloubkou zavedení. CT vyšetření hrudníku (obr. 1 a 2) prokázalo deformaci průsvitu průdušnice po odstranění TSK od tracheostomatu až po bifurkaci (ventrodorzálně z 12 na 4 mm v úseku dlouhém asi 3 cm), beze změny průsvitu hlavních bronchů. Ultrazvukové vyšetření srdce, provedené pro doplnění diagnostiky základního onemocnění, vyloučilo srdeční patologii.
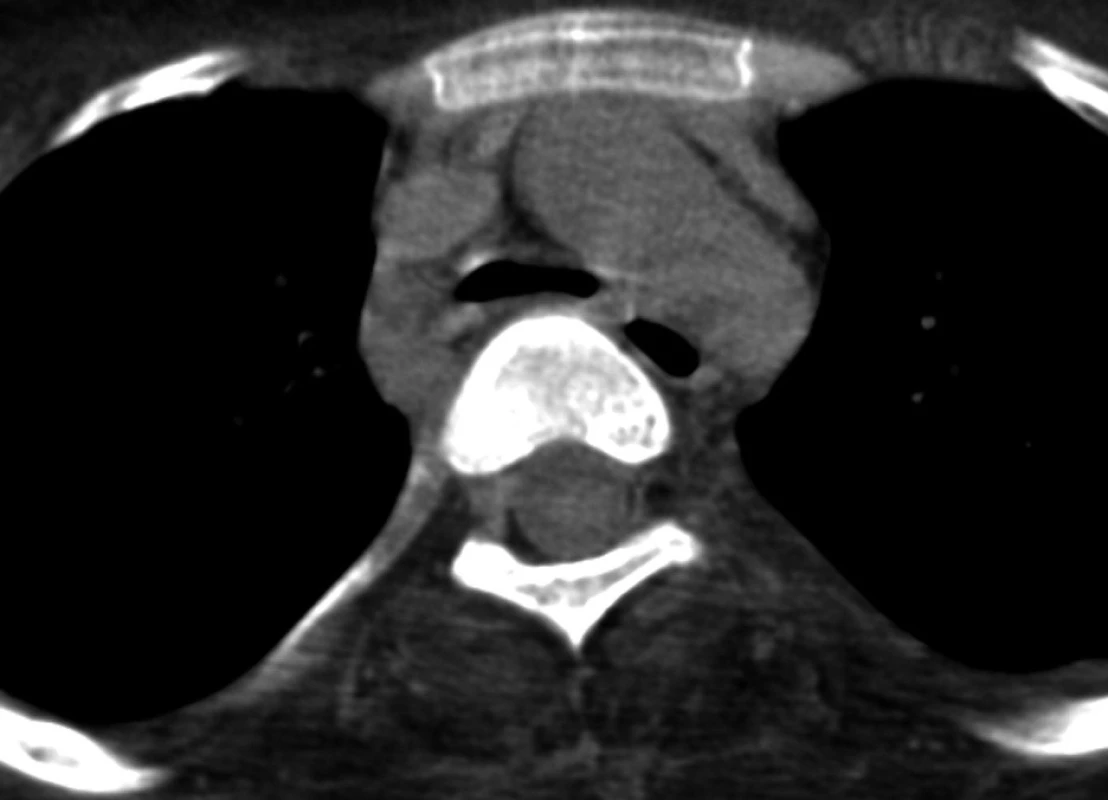
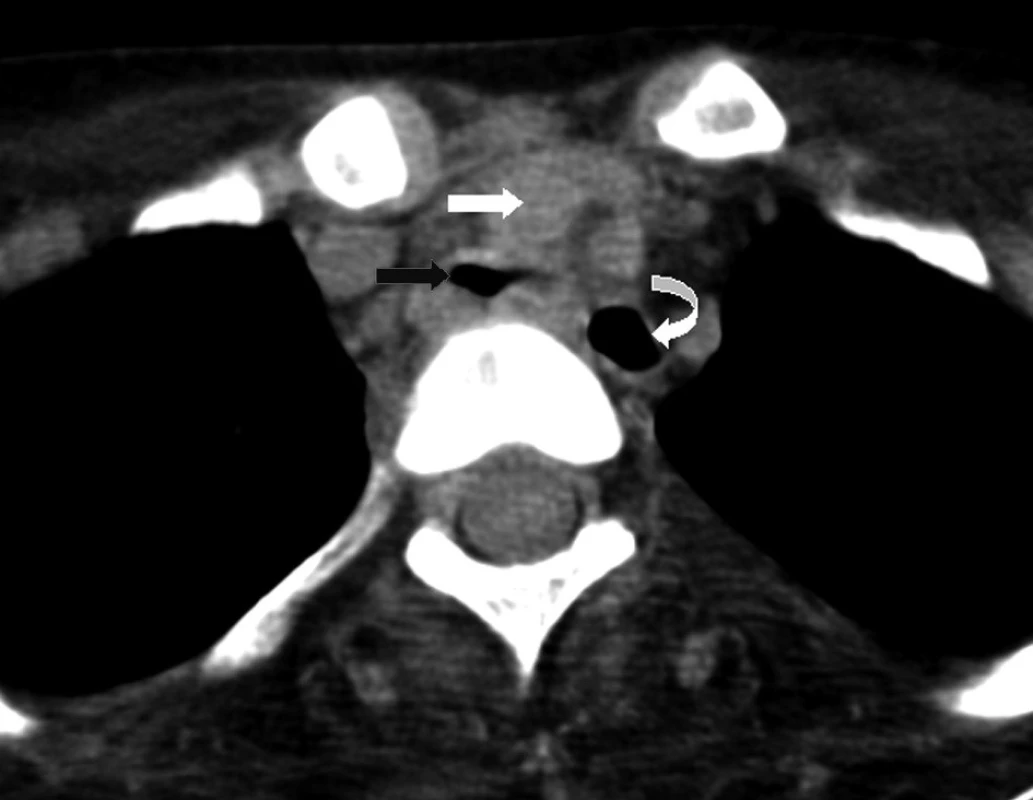
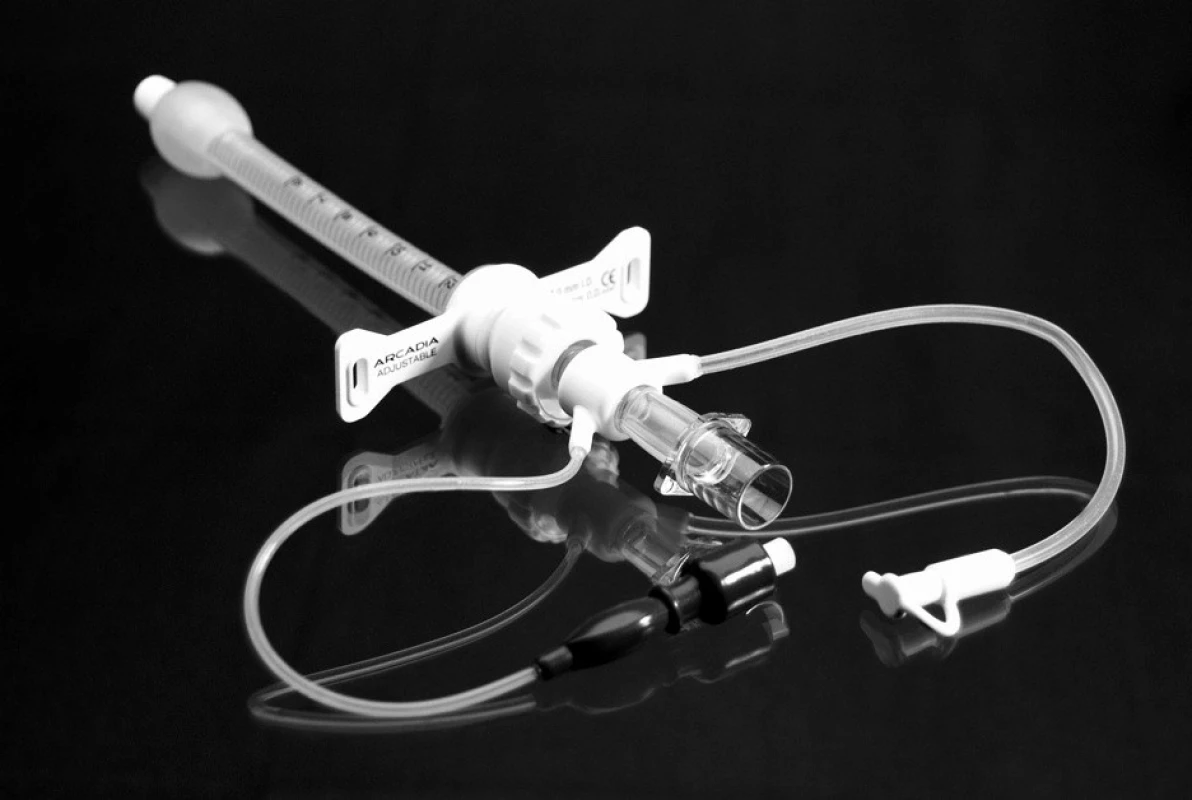
Jako možnost definitivního řešení stenózy průdušnice bylo zvažováno endoskopické ošetření se zavedením stentu, které však nebylo pro vysoké riziko komplikací indikováno. Operační řešení zevním vyztužením průdušnice či tracheoplastikou bylo hrudním chirurgem hodnoceno jako krajní řešení, které se vzhledem k náročnosti výkonu a spornému přínosu pro pacienta jevilo jako neúnosné a po multioborové konzultaci s pneumology, hrudními chirurgy a otorinolaryngology bylo rozhodnuto o konzervativním postupu. Dýchací cesty byly zajištěny speciální armovanou TSK Arcadia č. 6, s nízkotlakou nízkoobjemovou manžetou a nastavitelnou hloubkou zavedení (obr. 3). Hlavní výhodou této kanyly bylo – kromě nastavitelné hloubky zavedení – také přizpůsobení tvaru kanyly pacientově průdušnici při její stávající deformitě (kanyla je při zachovaném průsvitu zcela flexibilní bez pevného úhlu zakřivení). V srpnu 2007 byl pacient po splnění všech podmínek a schválení domácí umělé plicní ventilace propuštěn do domácí péče.
Dvě krátké hospitalizace pro akutní respirační insuficienci následovaly v lednu a březnu 2008, kdy se na příčině stavu podílela částečná obstrukce dýchacích cest při dislokacích TSK po výměnách v domácím prostředí. Klinická ani laboratorní vyšetření neprokázala akutní infekci dýchacích cest. Bronchoskopie ozřejmila úzký průsvit levého hlavního bronchu, bylo vysloveno podezření na stenózu bronchu při progresi stenózy průdušnice a upravena poloha armované TSK Arcadia.
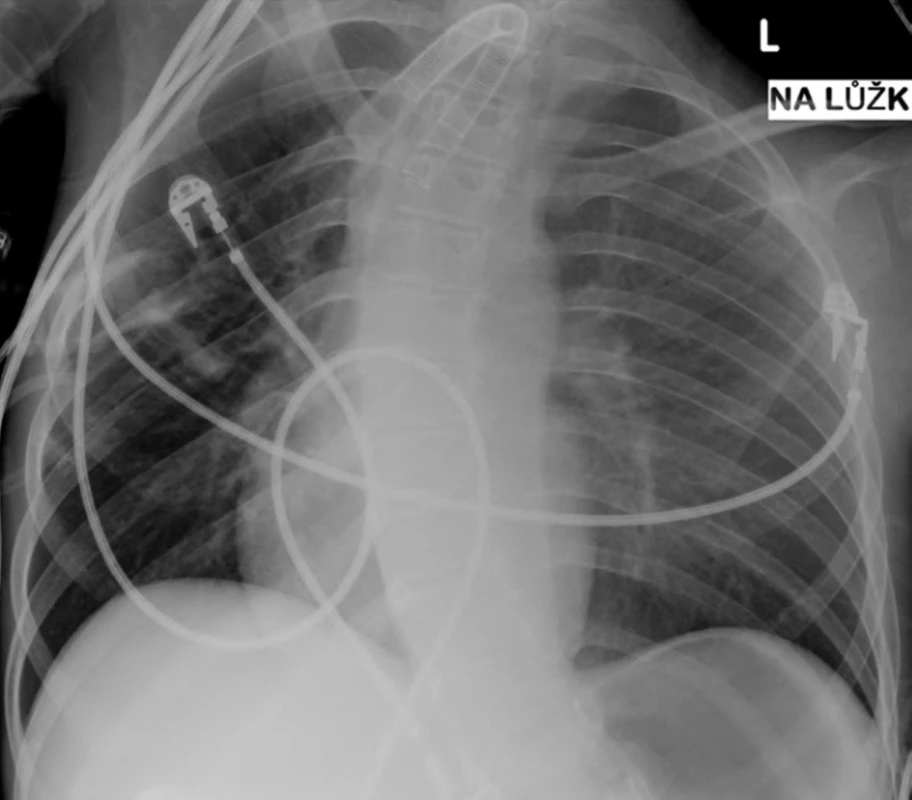
Od dubna 2008 byl nemocný opakovaně hospitalizován pro akutní respirační insuficienci při obstrukci konce kanyly zaschlými krustami sekretu, zatékajícího z oblasti horních dýchacích cest kolem TSK a vysychajícího při ventilaci. Četnost bronchoskopických kontrol s toaletou dýchacích cest pro dušnost a zhoršení oxygenace a ventilace pacienta se zvyšovala – byla prováděna každých 24–48 hodin. Pro zhoršující se stav pacienta s četnými hospitalizacemi byla znovu provedena série zobrazovacích vyšetřovacích metod s nálezem progrese zúžení průdušnice přecházejícího na levý hlavní bronchus, které bylo hodnoceno jako možná progrese malacie nebo důsledek mechanické komprese okolními strukturami při deformitě hrudníku. Předozadní rentgenový snímek hrudníku prokázal významnou skoliózu (obr. 4), na CT vyšetření (viz obr. 1, obr. 5) byla patrná komprese průdušnice a levého hlavního bronchu mezi páteří a ascendentní aortou při progredující deformitě hrudního koše s ventrodorzálním zúžením při patologickém zakřivení páteře (obr. 6 a 7). Vyšetření flexibilním bronchoskopem potvrdilo štěrbinovité zúžení průdušnice pod koncem TSK, přecházející na levý hlavní bronchus, který byl opakovaně obturován sputem. Po odsátí sekretu byla ozřejmena stenóza levého hlavního bronchu v celé jeho délce. Ve snaze řešit progredující postižení dýchacích cest bylo znovu zvažováno zavedení Y-stentu či kovového stentu do levého bronchu, popř. chirurgická výztuha průdušnice. Po multioborové konzultaci, kdy byl zvážen celkový zhoršující se stav nemocného, progredující deformity hrudníku, kachexie a lokální nález v dýchacích cestách, nebyly invazivní výkony indikovány pro neúměrné riziko a sporný přínos pro pacienta. Jako paliativní výkon bylo zvažováno zavedení kovového stentu do levého bronchu, ale malé rozměry stentu, absence kašlacího reflexu s rizikem zasychání sputa s následnou obstrukcí stentu a těsné naléhání aorty na průdušnici s rizikem vzniku tracheoarteriální píštěle vedly ke kontraindikaci výkonu.
Vzhledem k opakujícím se obstrukcím dýchacích cest zateklými a zaschlými hlenovými krustami byla indikována změna typu TSK za kanylu s nízkotlakou vysokoobjemovou manžetou (Mallinckrodt, velikost č. 7). Při rozhodování o dalším postupu bylo uváženo i riziko dekubitu tracheální stěny při dlouhodobém trvalém zavedení TSK s manžetou, měřené hodnoty tlaků v insuflační manžetě TSK byly menší než 10 cm H2O. Od změny kanyly se však nedalo očekávat vyřešení rizika obturace levého hlavního bronchu a následné atelektázy levé plíce.
Pacient byl v květnu 2008 propuštěn do domácí péče, po pěti dnech byl však znovu přijat pro silné „bolesti plic“, bolesti na hrudníku a dušnost. Při bronchoskopii nebyla nalezena dislokace ani obstrukce TSK. Pro předpoklad podílu zavedené TSK na bolestech byla provedena výměna za TSK Mallinckrodt Seal Guard. Třetí den hospitalizace došlo k náhlému masivnímu krvácení z TSK a stomatu, které rychle progredovalo do hemoragického šoku. Při masivním krvácení a nepříznivých anatomických poměrech se nedařilo najít ošetřitelný zdroj krvácení, ani ve spolupráci s urgentně přivolaným otorinolaryngologem. Ve snaze zjistit možný zdroj krvácení byla desuflována manžeta TSK, následovaná prudkým zhoršením krvácení; byla provedena okamžitá insuflace manžety s přechodným snížením krvácení. Urgentně provedená bronchoskopie vyloučila krvácení z dolních dýchacích cest, bylo vysloveno podezření na aorto-tracheální komunikaci vzhledem ke krvácení arteriálního charakteru a nálezu intimního kontaktu těchto struktur na CT hrudníku (viz obr. 5 a 7). Přes intenzivní objemové náhrady došlo k rozvoji bezpulzové elektrické aktivity, byla zahájena kardiopulmonální resuscitace. Vzhledem k progresi základního onemocnění, nálezu při zobrazovacích vyšetřeních a klinickému stavu prudce se rozvíjejícího hemoragického šoku se zástavou oběhu byla hodnocena prognóza nemocného jako zcela nepříznivá, bez možnosti ovlivnění základní příčiny stavu. Urgentní chirurgický či angiografický výkon v rámci snahy o zástavu krvácení se jevil jako zcela marný a neúčelný, a nebyl tudíž indikován. Kardiopulmonální resuscitace byla neúspěšná, pacient zemřel pod obrazem hemoragického šoku při masivním arteriálním krvácení.
Provedená pitva prokázala kromě známek progredujícího základního onemocnění významné předozadní oploštění průdušnice a levého hlavního bronchu při kompresi mezi páteří a aortou. Malatické postižení průdušnice nebylo prokázáno. Byl nalezen vředový defekt vzhledu dekubitu průměru 8 mm na přední stěně průdušnice 25 mm nad bifurkací s penetrací do truncus brachiocephalicus (zde defekt ve stěně průměru 1 mm, 5 mm pod odstupem arteria carotis communis dextra a arteria subclavia dextra). Vedlejším nálezem byla dilatace a lehká hypertrofie pravé srdeční komory.
Diskuse
Komplikace tracheostomie
Při progresi DMD dochází k rozvoji chronické respirační insuficience s nutností ventilační podpory. Umělá plicní ventilace s invazivním zajištěním dýchacích cest je realizována u pacientů s poruchou bulbárních funkcí, při selhání neinvazivních technik či jejich intoleranci pacientem [2, 7, 8]. Pacienti s tracheostomií a ventilační podporou přežívají v průměru 7 let [2]. U našeho nemocného byla pro progresi chronické respirační insuficience při základním onemocnění a poruše bulbárních funkcí indikována tracheostomie.
Tracheostomie je invazivní výkon, který je zatížen řadou komplikací [9, 10, 11]. Tracheomalacie, změknutí stěny průdušnice způsobené snížením počtu a/nebo atrofií podélných elastických vláken membranózní části průdušnice, je jednou z nejčastějších pozdních komplikací tracheostomie (nejčastější jsou tvorba granulační tkáně a stenóza průdušnice, dalšími jsou tracheoezofageální píštěl, pneumonie, aspirace a vzácně tracheoarteriální píštěl) [10]. Riziko vzniku tracheomalacie se snížilo 10krát po nahrazení TSK s vysokotlakými nízkoobjemovými manžetami za nízkotlaké vysokoobjemové [10], avšak ani používání TSK bez manžet neeliminuje riziko vzniku tracheomalacie; případné dekubity tracheální stěny mohou být způsobeny koncem TSK samotné [12].
Tracheomalacie – možnosti léčby
Léčba tracheomalacie se odvíjí od závažnosti obstrukce dýchacích cest v exspiriu, u mírných forem je doporučován maximálně možný konzervativní postup [10, 13]. U závažných případů spadají do terapeutických možností: dlouhé TSK přemosťující postižené místo průdušnice, implantace stentu do průdušnice, resekce průdušnice či tracheoplastika [10]. Mortalita pacientů se závažným stupněm tracheobronchomalacie přesahuje 80 % [9]. U našeho pacienta nebyla pracovní diagnóza tracheomalacie při pitvě prokázána.
U chlapce jsme se v multioborovém konsenzu (anesteziolog, intenzivista, pneumolog, otorinolaryngolog, hrudní chirurg) rozhodli pro konzervativní postup s použitím speciální TSK. Bylo přihlédnuto i k nepříznivým anatomickým poměrům, kdy po tzv. vyšití tracheostomie a při deformitě hrudníku bylo stoma s tracheou deviované v předozadním i bočním směru natolik, že běžné druhy TSK s pevným tubusem a neměnným úhlem zakřivení byly nevyhovující (vedly ke zhoršení lokálního nálezu v tracheostomatu, dekubitu na zadní stěně trachey a deformaci přední stěny proximálního tracheálního prstence s rizikem proležení do krikoidní chrupavky). Byla použita speciální armovaná kanyla Arcadia firmy BioVendor s upravenou nízkotlakou manžetou (viz obr. 3), která mimo nastavitelné hloubky zavedení měla zcela flexibilní tvar. Manžeta kanyly při minimální insuflaci vzduchem netěsnila tracheu, což po řadu měsíců mělo spíše příznivý efekt, kdy ventilace s mírným „leakem“ vzduchu byla pacientem dobře tolerována; nemocný byl schopen částečně fonace a toaleta dýchacích cest s intermitentním odsáváním byla dostačující.
Ke změně typu TSK jsme byli nuceni vzhledem k opakujícím se atakám dyspnoe se závažnou akutní respirační insuficiencí při parciální obstrukci TSK (krustami vznikajícími zasycháním stékajícího sekretu mezi stěnou kanyly a průdušnice při ventilaci) s nutností četných bronchoskopických toalet dýchacích cest. Byla zavedena TSK Mallinckrodt s nastavitelnou hloubkou zavedení a nízkotlakou vysokoobjemovou manžetou ve snaze předcházet zatékání sekretu z horních dýchacích cest. Užívané insuflační tlaky byly minimální s cílem snížit riziko vzniku tlakové nekrózy stěny průdušnice a zároveň zvýšit stabilitu umístění dané kanyly bez nadměrného posouvání a pohybu v průdušnici, což jsou rizikové faktory pro vznik erozí sliznice, popř. tracheoarteriální píštěle [10, 12, 14, 15]. Výměna TSK měla zpočátku dobrý efekt, obtíže s obstrukcí zasychajícími sekrety vymizely, při bronchoskopické kontrole byl však nalezen počínající dekubitus v oblasti přední stěny průdušnice. Současné rozšíření stenózy průdušnice na levý hlavní bronchus změnou typu TSK vyřešeno nebylo. Na CT hrudníku byla nově popsána progrese anatomické deformity hrudníku s kompresí průdušnice mezi aortou a páteří při zkrácení sternovertebrální vzdálenosti (viz obr. 6 a 7). Tento nález vysvětloval progresi zúžení průdušnice a levého hlavního bronchu, současně bylo zjevné riziko vzniku tracheoarteriální píštěle.
O možnosti zavedení stentu do průdušnice nebo chirurgickém výkonu v době před vznikem akutního krvácení do dýchacích cest se opakovaně diskutovalo, se závěrem převahy rizik výkonu nad přínosem pro pacienta. Zavedení Y-stentu do průdušnice by bylo obtížné při malém předozadním rozměru hrudníku s rizikovým přechodem do tracheostomické kanyly (hrozba uzavření dýchacích cest při případné desaxaci), zavedení kovového stentu do levého bronchu bylo shledáno rizikovým z hlediska retence sekretu, chronické infekce, přerůstání konců stentu granulační tkání a následně obtížné až nemožné extrakce stentu při překrytí jeho konců sliznicí. Nicméně při přetrvávání atelektázy levé plíce by zavedení stentu do levého bronchu bylo u celkově progredujícího stavu indikováno jako maximálně možné řešení a tedy jako paliativní výkon ke zlepšení již tak nízké kvality života nemocného. Nejvýznamnějším argumentem proti implantaci stentu byl známý intimní vztah aorty, průdušnice a levého bronchu při progredující deformitě hrudníku, zvyšující riziko vzniku dekubitální nekrózy stěny průdušnice s následnou tracheo - anebo bronchoarteriální píštělí.
Tracheoarteriální píštěl – možnosti léčby
Tracheoarteriální píštěl (tracheoarterial fistula, TAF) je vzácnou komplikací tracheostomie [8, 10, 11, 14, 15, 16, 17, 18, 19]. Vyskytuje se s menší než 1% incidencí u pacientů s tracheostomií [8, 14, 15, 16]; uváděná mortalita dosahuje téměř 100 %. V literatuře je popsáno několik případů přežití při urgentním terapeutickém zásahu [8, 10, 12, 14, 16, 17, 18, 19]. Jedná se nejčastěji o komunikaci mezi průdušnicí a truncus brachiocephalicus (tracheoinnominate-artery fistula, TIF), méně často arteria carotis communis, arteriae thyroideae či obloukem aorty při aneurysmatu aorty. Rizikovým faktorem pro vznik píštěle je tracheostomie, vysoké tlaky v insuflační manžetě TSK s následnou ischémií tracheální stěny, slizniční trauma způsobené koncem TSK, excesivní pohyby TSK během dlouhodobé ventilace, malnutrice, deformity páteře, vysoko uložený truncus brachiocephalicus (TB) [8, 10, 14, 15, 18]. Pacienti s Duchenneovou svalovou dystrofií jsou více ohroženi vznikem TAF [8, 15, 19]. U více než 50 % pacientů s masivním krvácením z píštěle je popisováno předchozí varovné krvácení z průdušnice, CT angiografie může pomoci v diagnostice TAF, je limitována urgencí stavu [8, 16]. Bronchoskopické vyšetření je kontroverzní, některé práce jej doporučují využít v diagnostice [14, 16], jiné uvádějí riziko výrazného zhoršení krvácení [8, 17]. Při vzniku masivního krvácení je doporučena nadměrná insuflace manžety TSK, popř. orotracheální intubace s insuflací manžety distálně od tracheostomatu a přímá digitální komprese TB s cílem snížit krvácení před provedením urgentní sternotomie a chirurgického ošetření TB [8, 16, 17, 18]. Jsou popsány i sporadické případy úspěšného zavedení stentu do TB [8] a plánovaný podvaz TB u pacientů s DMD, kteří mají vysoké riziko vzniku TAF [15].
Při vzniku krvácení z dýchacích cest u pacienta byl zvažován angiografický, eventuálně chirurgický urgentní výkon. O chirurgickou zástavu krvácení se pokoušel otorinolaryngolog přímo na lůžku, kde se pro masivní krvácení a nepříznivé anatomické poměry nedařilo najít zdroj krvácení. Po pečlivém zhodnocení anamnézy, dosavadního vývoje základního onemocnění a existence TAF v kontextu progredujícího, léčebně neřešitelného krvácení vedoucího k zástavě oběhu, byla resuscitace pacienta ukončena.
Deformity skeletu jako rizikový faktor
Významným faktorem, podílejícím se na závažnosti stavu pacienta, byla nepochybně progrese skoliózy, postihující více než 50 % pacientů s DMD [20]. Podílí se na progresi chronické respirační insuficience – snižuje již tak nízkou FVC (forced vital capacity) o 4 % ročně [3]. Optimální čas pro operační řešení skoliózy je v době, kdy jsou plicní funkce ještě uspokojivé a případné kardiální onemocnění asymptomatické [2]. Je doporučeno ozřejmit případné deformity hrudníku CT vyšetřením u pacientů s DMD ještě před provedením chirurgické tracheostomie, s cílem vzdálit zakládané stoma od sousedících tepen [19]. Ačkoliv měl náš pacient výraznou skoliózu (viz obr. 4), hospitalizován byl již ve chvíli těžké respirační insuficience a indikace stabilizace páteře by byla minimálně sporná. Možností zůstává konzervativní terapie korzetem, avšak progrese skoliózy u pacientů s DMD je popisována až v 94 % případů i přes užívání korzetu [3], který by navíc velmi ztížil rehabilitaci a manipulaci s pacientem v domácím prostředí.
Závěr
Autoři předkládají popis případu pacienta s Duchenneovou svalovou dystrofií, u kterého došlo ke vzniku tracheoarteriální píštěle jako pozdní komplikace tracheostomie. Hlavními faktory, které přispěly ke vzniku píštěle, byly s maximální pravděpodobností progredující skolióza a deformity hrudního koše, s následnou změnou anatomických poměrů uvnitř hrudníku vedoucí k útlaku průdušnice a levého hlavního bronchu. Masivní krvácení z tracheoarteriální píštěle je vzácnou komplikací, která však ve většině případů končí fatálně.
Došlo 15. 12. 2008.
Přijato 21. 1. 2009.
Adresa pro korespondenci:
MUDr. Jana Stříteská
Klinika anesteziologie, resuscitace a intenzivní medicíny
Fakultní nemocnice Hradec Králové
Sokolská 581
Hradec Králové 500 05
e-mail: striteska@fnhk.cz, jana.striteska@email.cz
Sources
1. Hayes, J., Veyckemans, F., Bissonnette, B. Duchenne muscular dystrophy: an old anesthesia problem revisited. Paediatr Anaesth., 2008, 18, 2, p. 100–106.
2. Finsterer, J. Cardiopulmonary support in Duchenne muscular dystrophy. Lung, 2006, 184, 4, p. 205–215.
3. Karol, L. A. Scoliosis in patients with Duchenne muscular dystrophy. J. Bone Joint Surg. Am., 2007, 89, 1, p. 155–162.
4. Návrh směrnice správné laboratorní praxe: Molekulárně genetické vyšetřování Duchennovy a Beckerovy muskulární dystrofie (DMD a BMD, resp. D/BMD). Dostupný na WWW: http://www.uhkt.cz/nrl/nrl-dna/nrl-dna/glp_dmd.html
5. Duchenne muscular dystrophy. In Wikipedia, the free encyclopedia. Dostupný na WWW: http://en.wikipedia.org/wiki/ Duchenne_muscular_dystrophy.
6. Rüdel, R. Kosterní sval. In Fölsch, U. R., Kochsiek, K., Schmidt, R. F. Patologická fyziologie. Praha: Grada Publishing, 2003, p. 459–476.
7. Simonds, A. K. Recent Advances in Respiratory Care for Neuromuscular Disease. Chest, 2006, 130, 6, p. 1879–1886.
8. Vianello, A., Ragazzi, R., Mirri, L. Arcaro, G., Cutrone, C., Fitta, C. Tracheoinnominate fistula in a Duchenne muscular dystrophy patient: successful management with an endovascular stent. Neuromuscul. Disord., 2005, 15, 8, p. 569–571.
9. Carden, K. A., Boiselle, P. M., Waltz, D. A., Ernst, A. Tracheomalacia and tracheobronchomalacia in children and adults. Chest, 2005, 127, 3, p. 984–1005.
10. Epstein, S. K. Late complications of tracheostomy. Respir. Care, 2005, 50, 4, p. 542–549.
11. Chrobok, V., Astl, J., Komínek, P. et al. Tracheostomie a koniotomie, techniky, komplikace a ošetřovatelská péče. 1. vyd. Praha: Maxdorf, 2004, 170 s. ISBN 80-7345-031-3.
12. Baydur, A., Kanel, G. Tracheobronchomalacia and tracheal hemorrhage in patients with Duchenne muscular dystrophy receiving long-term ventilation with uncuffed tracheostomies. Chest, 2003, 123, 4, p. 1307–1311.
13. Antón-Pacheco, J. L., Cabezalí, D. et al. The role of airway stenting in pediatric tracheobronchial obstruction. Eur. J. Cardiothorac. Surg., 2008, 33, 6, p. 1069–1075.
14. Scalise, P., Prunk, S. R., Healy, D., Votto, J. The incidence of tracheoarterial fistula in patients with chronic tracheostomy tubes: a retrospective study of 544 patients in a long-term care facility. Chest, 2005, 128, 6, p. 3906–3909.
15. Iodice, F., Brancaccio, G., Lauri, A., Di Donato, R. Preventive ligation of the innominate artery in patients with neuromuscular disorders. Eur. J. Cardiothorac. Surg., 2007, 31, 4, p. 747–749.
16. Ghai, B., Makkar, J. K. et al. Survival of a child without sequelae after tracheoarterial fistula. Paediatr. Anaesth., 2007, 17, 6, p. 588–591.
17. Hamano, K., Kumada, S., Hayashi, M. et al. Hemorrhage due to tracheoarterial fistula with severe motor and intellectual disability. Pediatr. Int., 2008, 50, 3, p. 337–340.
18. Hung, J. J., Hsu, H. S. et al. Tracheoesophageal fistula and tracheo-subclavian artery fistula after tracheostomy. Eur. J. Cardiothorac. Surg., 2007, 32, 4, p. 676–678.
19. Saito, T., Sawabata, N., Matsumura, T., Nozaki, S., Fujimura, H., Shinno, S. Tracheo-arterial fistula in tracheostomy patients with Duchenne muscular dystrophy. Brain Dev., 2006, 28, 4, p. 223–227.
20. Simonds, A. K. Home ventilation. Eur. Respir. J. Suppl., 2003, 47, p. 38S–46S.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2009 Issue 2
-
All articles in this issue
- Anaphylaxis after induction to general anaesthesia: Four case reports
- Anterior spinal artery syndrome as a complication of neuroaxial blocade – successful treatment with prostacyclin (case report)
- Erythropoietin and other erythropoiesis-stimulating drugs and bloodless medicine – a new era in the management of anaemia?
- The influence of continuous positive pressure ventilation on the degree of inflammatory reaction and organ function – experimental study
- Hypocholesterolaemia on the medical intensive care unit: The process of cholesterol synthesis and absorption is altered in the acute phase of disease
- Evaluation of changes in brain tissue oxygen levels (PbtO2) for detection of vasospasm in patients after subarachnoid haemorrhage
- A fatal complication of tracheostomy in a 13-year-old patient with Duchenne Muscular Dystrophy – case report
- Assoc. Prof. MUDr. Josef Hoder, CSc., in the memories of his colleagues and friends
- Assoc. Prof. MUDr Josef Hoder, CSc. (1912–1987)
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Anaphylaxis after induction to general anaesthesia: Four case reports
- Erythropoietin and other erythropoiesis-stimulating drugs and bloodless medicine – a new era in the management of anaemia?
- Anterior spinal artery syndrome as a complication of neuroaxial blocade – successful treatment with prostacyclin (case report)
- A fatal complication of tracheostomy in a 13-year-old patient with Duchenne Muscular Dystrophy – case report
