Perioperační optimalizace hemodynamiky*
Perioperative haemodynamic optimization
Hemodynamic optimization of high-risk surgical patients has been increasingly used in the peri-operative setting. The benefit of this approach for the morbidity and mortality reduction in the postoperative period has been proved by many studies. In this article we summarize and comment on the articles published on perioperative goal-directed therapy.
Keywords:
hemodynamic optimization – perioperative fluid therapy – goal-directed therapy
:
Beneš Jan; Chytra Ivan
:
Anesteziologicko-resuscitační klinika, Fakultní nemocnice Plzeň
:
Anest. intenziv. Med., 22, 2011, č. 2, s. 96-102
:
Anesthesiology - Review Article
Optimalizace hemodynamiky rizikových chirurgických nemocných nachází v perioperační medicíně stále větší uplatnění. V současné době je k dispozici mnoho důkazů potvrzujících úspěšnost tohoto postupu v prevenci vzniku pooperačních komplikací a snížení mortality. V článku je uveden souhrn a komentář recentních publikací se vztahem k problematice hemodynamické optimalizace v perioperačním období.
Klíčová slova:
optimalizace hemodynamiky – perioperační tekutinová léčba – cílená hemodynamická léčba
*Souborná práce byla ze své části obsahem vyzvané přednášky „Perioperační hemodynamická stabilizace“ uvedené na XVII. kongresu ČSARIM ve Zlíně dne 9. 9. 2010.
Úvod
Morbidita a mortalita spojená s anesteziologickou péčí je v celkové populaci velmi nízká. Podle dostupných dat bylo v ČR v roce 2009 zaznamenáno 893 časných úmrtí (do 24 hodin) při celkovém počtu 842 015 podaných anestezií (mortalita 0,11 %) [1]. V rizikových skupinách může být ale úmrtnost několikanásobně vyšší, např. u výkonů delších dvou hodin činí již 0,35 %. Ze statistik z Velké Británie [2] vyplývá, že 80 % z celkové mortality tvoří relativně malá skupina rizikových nemocných (přibližně 12 %). Individuální úmrtnost pak převyšuje 5 %. Z mnoha studií a metaanalýz je zřejmé, že cílené postupy směřující k optimalizaci hemodynamických parametrů (GDT – Goal Directed Therapy) mohou u těchto nemocných významně zlepšit průběh perioperačního období. Přes množství pozitivních výsledků však není otázka GDT zcela uzavřena a k běžnému užití těchto léčebných postupů je nutno zodpovědět celou řadu sporných otázek. Tento článek je zaměřen na přehled současné problematiky optimalizace hemodynamiky rizikových chirurgických nemocných.
Současný stav problému
Do současné doby bylo v impaktovaných časopisech publikováno více než 30 studií zabývajících se optimalizací hemodynamiky chirurgických nemocných. Z těchto studií jsou pouze 2 multicentrické [3, 4] a jedna zabývající se dlouhodobým výstupem (15letá mortalita) [5]. Metodiky a vědecká úroveň jednotlivých studií se významně liší. Publikované studie zahrnují kompletní spektrum monitorovacích technik (plicnicový katétr, jícnový doppler, analýza tepové křivky) a cílových parametrů. Pravděpodobně nejucelenější představu o vlivu GDT na pooperační průběh u rizikových chirurgických pacientů poskytují dvě nedávno publikované metaanalýzy italských autorů [6, 7].
Brienza et al. [6] sledovali výskyt renálního selhání u 20 vybraných studií zahrnujících 4220 nemocných. Po pečlivé analýze jednotlivých studií s ohledem na jejich kvalitu a hodnocení sledované komplikace je zřejmý významný podíl GDT na snížení rizika vzniku pooperační renální insuficience [poměr šancí (Odds Ratio, OR) 0,64; 95 % interval spolehlivosti (95% CI – Confidence Interval) 0,5–0,83; p = 0,0007]. Snížení rizika vzniku pooperačního renálního selhání bylo patrné i při subanalýze s ohledem na časování intervence (před operací, v jejím průběhu nebo těsně po operaci), i na stanovené hemodynamické cíle (supranormální i normální). Riziko úmrtí při užití GDT je rovněž nižší [OR 0,5; 95% CI 0,31–0,8; p = 0,004], ale heterogenita jednotlivých hodnocených studií je velká. Druhá metaanalýza této skupiny autorů [7] se zabývala hodnocením gastrointestinálních (GIT) komplikací. Bylo do ní zařazeno 16 studií s celkovým počtem 3410 pacientů. Incidence závažných i méně závažných GIT komplikací byla v intervenčních skupinách významně snížena [OR 0,42; (95% CI 0,27–0,65), respektive OR 0,29 (95% CI 0,17–0,5)]. Mortalita nebyla hodnocena.
Významnost prevence vzniku pooperačních komplikací zdůraznila rozsáhlá retrospektivní studie [8], v níž byl u souboru téměř 106 tisíc amerických veteránů identifikován vznik komplikací do třicátého dne po operaci jako nezávislý faktor mortality, který vedl ke snížení mediánu přežití v 8letém horizontu o 69 %. Tyto výsledky pak potvrdila aktuálně otištěná analýza 15letého přežití [5] u populace původní studie Boyda et al. [9]. Medián přežití pacientů v intervenční skupině byl o 1107 dní delší [1781 vs 684; p = 0,005]. K významným faktorům ovlivňujícím přežití patřil vedle věku a zařazení do GDT protokolu také výskyt kardiálních komplikací do třicátého pooperačního dne.
I přes příznivé výsledky výše zmíněných analýz nepatří GDT u rizikových pacientů stále k běžným postupům. Užití GDT doporučují zatím pouze národní guidelines Velké Británie [10], jejichž zavedení však bylo provázeno výraznou kritikou [11]. Těmto doporučením předcházela pravděpodobně zatím jediná rozsáhlá cost/benefit analýza hemodynamické optimalizace [12]. K zásadním problémům GDT patří především nejednotnost a výše popsaná metodická rozdílnost jednotlivých prací. Lees et al. [13] definuje několik sporných bodů bránících širšímu užití GDT při chirurgických výkonech. Jsou to: nepřesná definice pojmu „rizikový pacient“, nejednotnost v užitých postupech (monitorovací technika, cíle hemodynamické intervence, odlišný čas a způsob jejich dosažení) a omezení lidskými i ekonomickými zdroji.
Definice vysoce rizikového chirurgického pacienta
Nedostatečná definice cílové populace, je jedním z důvodů, proč perioperační GDT zatím nedoznala celoplošného uznání anesteziologickou obcí. Rizikovost bývá často stanovena podle počtu zemřelých/postižených pacientů v kontrolní skupině. Již v jedné z prvních metaanalýz [14] můžeme nalézt v tomto parametru významnou disproporci. V historicky starších studiích mortalita často přesahuje 20 %, naopak v novějších často nedosahuje ani 15 %. Některé studie využívající méně invazivních monitorovacích prostředků, dokonce popisují nulovou mortalitu [15] a přínos GDT je prokazován pouze na tzv. měkčích cílech (snížení počtu komplikací, zkrácení doby hospitalizace apod.)
Boyd [16] navrhuje považovat za „vysoce rizikové“ nemocné s individuálním rizikem úmrtí vyšším než 5%, nebo pacienty podstupující operační výkon spojený s mortalitou vyšší než 5%. Kritéria pro zařazení do protokolu optimalizace navržená Shoemakerem [17] byla postupně upravována Pearsem [18] a dalšími. Praktické dělení na rizika vázaná na pacienta a vázaná na operační výkon navrhl v nedávno publikovaném přehledovém článku Kirov et al. [19] – tabulka 1. Na jejich podkladě navrhuje přizpůsobení monitorování pacienta (tab. 2, 3). Je nutno mít na paměti, že navržená klinická kritéria, jakkoli intuitivně přesvědčivá, jsou spíše orientační a jejich predikční hodnota nebyla nikdy blíže zkoumána. Stejně tak autoři neposkytují bližší upřesnění jednotlivých kategorií rizika vycházejícího z osoby pacienta a rizika operačního výkonu. Určitým vodítkem pro rozdělení operačního rizika může být studie Pearse et al. [2], podle které můžeme výkony s mortalitou pod 1 % považovat za málo rizikové (např. akutní apendektomie, elektivní transuretrální resekce prostaty či endoprotéza kyčle), a výkony s mortalitou nad 5 % pokládat za vysoce rizikové (neodkladné i plánované kombinované či cévní nitrobřišní a nitrohrudní výkony apod.). Pro stanovení rizika daného osobou nemocného je možno užít celou řadu skórovacích systémů zaměřených na predikci vzniku pooperačních komplikací (POSSUM [20], Goldmann [21], Lee [22]). Doporučené postupy americké kardiologické společnosti [23] navrhují stanovení funkční kardiální výkonnosti pomocí metabolických ekvivalentů (METs). Pomocí testu kardiopulmonální výkonnosti (CPX – Cardiopulmonary Exercise Test) je možné určit anaerobní práh [24]. Základní představu může poskytnout i běžná klasifikace rizika podle americké anesteziologické společnosti (ASA – American Society of Anesthesiologists), kdy hodnoty ASA I-II představují nízké riziko, ASA III střední riziko a ASA IV–V riziko vysoké. Přes toto množství skórovacích systémů (a možná i díky němu) je definice vysoce rizikového nemocného stále nezřetelná. Systém navržený Kirovem je pravděpodobně, i při zmíněném omezení, vhodným postupem při rozhodování o monitorování a léčebné péči u těchto nemocných.

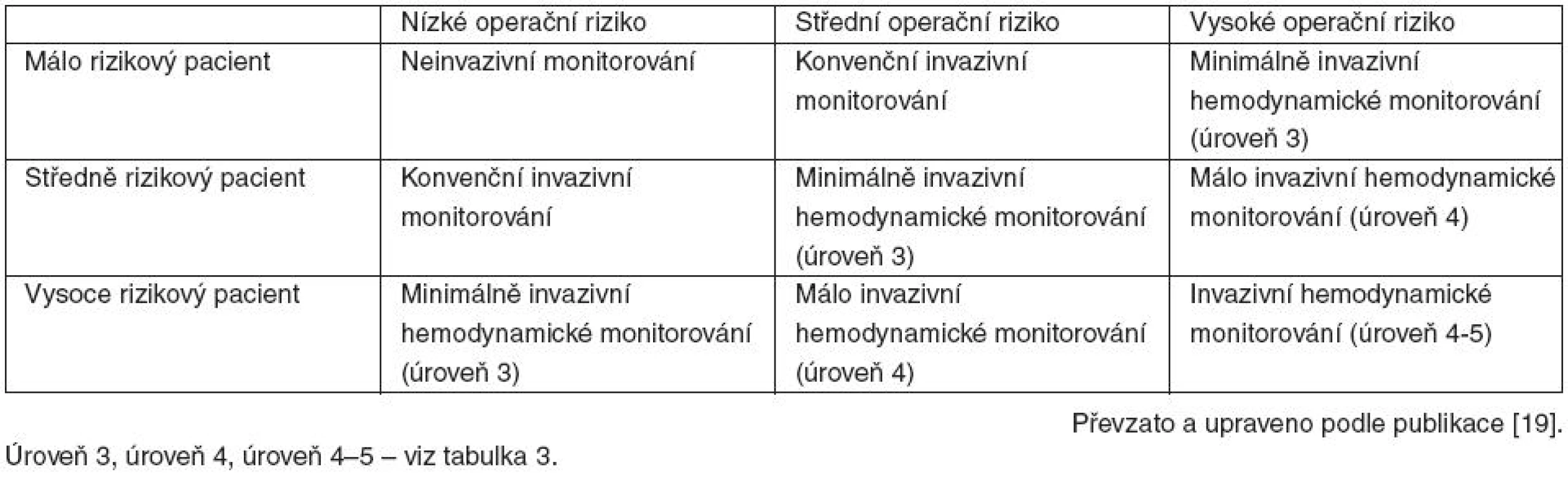
Dalším významným faktorem rozhodujícím o míře rizika je individuální reakce nemocného a jeho tolerance operační zátěže, která nemusí být z předoperačních vyšetření vždy předvídatelná. Včasné odhalení rizika hypovolémie, nízké cévní rezistence či sníženého srdečního výdeje z parametrů získaných zvolenou úrovní monitorování je nezbytným předpokladem pro okamžité zahájení náležité léčby. Běžné klinické parametry jako kapilární návrat, diuréza, krevní tlak či srdeční akce prokazatelně nemohou fungovat jako adekvátní cíle hemodynamické intervence [25]. Mohou ale, především ve spojení s laboratorními parametry (koncentrace laktátu či saturace žilní krve v horní duté žíle), upozornit na nutnost rozšíření hemodynamického monitorování.
Možnosti hemodynamického monitorování
Technické možnosti monitorování hemodynamiky za 40 let od průkopnických prací Shoemakera [26] zaznamenaly poměrně prudký vývoj, který reflektují historické i soudobé studie zabývající se problematikou optimalizace hemodynamiky. Ve výše zmíněné metaanalýze dvaceti studií [6] byl ve 12 případech pro hodnocení hemodynamiky užit plicnicový katétr, v 5 studiích jícnový doppler a jen ve 2 studiích byla užita analýza tepové křivky (LiDCO a Vigileo/FloTrac). Vedle plicnicového katétru je nejlépe popsáno užití jícnového dopplera, mimo jiné i díky systematickým analýzám jeho účinnosti [27] a ekonomického dopadu [12]. V britských národních doporučených postupech je navrženým prostředkem k dosažení maximalizace tepového objemu pro perioperační GDT tzv. „Flow based technology“ (level 1b) [10].
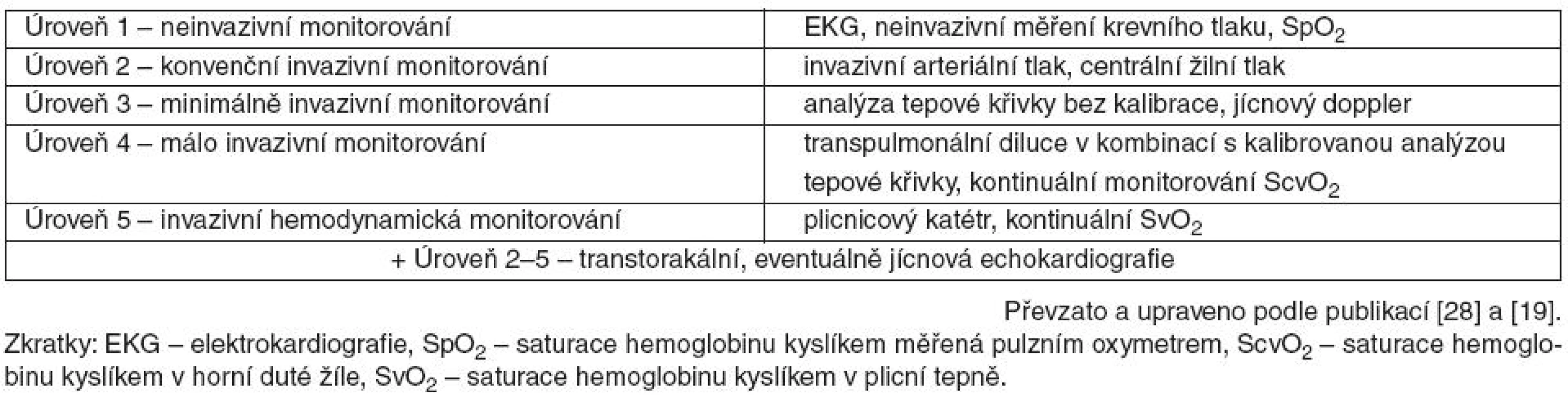
Volba monitorovací techniky by však měla zohlednit nejen přínos získaných informací, ale také riziko, které z užití dané techniky vyplývá. Tato zásada je zdůrazněna v „stupňovitém“ přístupu Hofera et al. [28] upraveném Kirovem [19]. Rozděluje monitorovací prostředky do pěti stupňů – od plně neinvazivních (běžně užívané EKG, neinvazivní měření krevního tlaku apod. – úroveň 1) až po maximálně invazivní (plicnicový katétr – úroveň 5) – viz tabulka 3. Na podkladě závažnosti pacientova stavu poté navrhuje navyšovat úroveň monitorování až do zisku adekvátních hemodynamických parametrů.
Otázka diskuse vlastní volby mezi jednotlivými monitory na podkladě jejich ekonomické dostupnosti a klinické spolehlivosti významně přesahuje rozsah této práce, proto odkazujeme na texty zabývající se touto problematikou [13, 19, 28].
Cíle a načasování optimalizace
Cílem hemodynamické optimalizace chirurgického pacienta je zajištění adekvátní dodávky kyslíku všem tkáním a zabránění práce na kyslíkový dluh. Původní Shoemakerova [29] „supranormální“ kritéria (srdeční index nad 4,5 l/min/m2, DO2I – Oxygen Delivery Index nad 600 ml/min/m2 a VO2I – Oxygen Consumption Index nad 170 ml/min/m2) byla stanovena jako medián, kterého spontánně dosáhli přeživší nemocní. Přiměřený stupeň hyperkinetické cirkulace po operačním traumatu je tedy zcela obvyklý. Důležité je rozlišit nemocné, kteří mají dostatečnou fyziologickou rezervu ke spontánnímu dosažení těchto cílů, a pacienty, jejichž kardiální výkonnost není dostatečná a vyžaduje intervenci.
U první skupiny pacientů pravděpodobně postačuje včasná a adekvátní náhrada cirkulujícího objemu tak, aby v okamžiku nutnosti zvýšení dodávky kyslíku vzestupem srdečního výdeje nedocházelo k nutnosti redistribuce objemu a kompenzatorním reakcím. U tohoto typu nemocných se při nedostatečné náhradě plazmatického objemu v perioperačním období spíše než s nárůstem mortality setkáváme se zvýšeným počtem orgánových a infekčních komplikací. Jejich příčinou často bývá regionální hypoperfuze. Cílem většiny GDT protokolů u této populace je snaha o dosažení maximálního tepového objemu s užitím různých ukazatelů pozitivní odpovědi na navýšení cirkulujícího objemu (tzv. fluid responsiveness). Postup spočívá v postupném podávání bolusů tekutin do dosažení ploché části Frank-Starlingovy křivky, tedy stavu optimálního srdečního výdeje a „euvolémie“. V souladu s Hoferovým „stupňovitým“ přístupem jsou v těchto protokolech užívány minimálně invazivní monitorovací techniky (jícnový doppler, přístroje založené na analýze tepové křivky).
Při užití jícnového dopplera [15, 30] je pro posouzení pozitivní odpovědi na navýšení plazmatického objemu užíván na srdeční frekvenci korigovaný ejekční čas levé komory (FTc – flow time corrected).
U přístrojů založených na analýze tepové křivky se uplatňuje sledování dynamického kolísání tepového objemu (SVV – Stroke Volume Variation) v průběhu řízené ventilace, nebo jeho koreláty – variace tlakové amplitudy (PPV – Pulse Pressure Variation) a variace systolického tlaku (SPV – Systolic Pressure Variation). Protokol užívající k hemodynamické optimalizaci PPV byl poprvé popsán u malé skupiny nemocných Lopesem et al. [31]. Příznivé výsledky užití automaticky stanovované variability tepového objemu (SVV přístrojem Vigileo/FloTrac) demonstrovala též nedávno publikovaná práce z našeho pracoviště [32].
Ačkoliv SVV a PPV jsou v současné době považovány za relativně přesné parametry hodnocení odpovědi na tekutinovou výzvu [33], je nutno při jejich užití splnit několik základních podmínek. Nemocní musí být řízeně ventilováni s dechovým objemem minimálně 8 ml/kg (hodnota PEEP a její vliv na měřené parametry nejsou dosud přesně stanoveny) [34] a srdeční rytmus musí být pravidelný (optimálně variabilita srdeční frekvence do 10 %) [35]. V úvahu je nutno brát též ovlivnění variace pulzního nebo systolického tlaku podáním vazopresorů [36]. Značně nesourodá jsou data definující optimální diskriminační hodnotu variace pro predikci příznivé odpovědi na tekutinovou výzvu. Z výše uvedené Marikovy metaanalýzy [33] vyplývá pro PPV a pro SVV optimální diskriminační hodnota variace 12,5 %, respektive 11,6 %. Zkušenosti však ukazují, že hodnoty SVV a PPV v rozmezí od 10 % do 15 % jsou pravděpodobně tzv. šedou zónou, kdy je jejich výpovědní hodnota nejistá. Dalším problémem je automatizovaná kalibrace přístrojů a vliv dalších, dosud ne zcela poznaných, faktorů [37–39]. S ohledem na veliké množství spolupodílejících se faktorů je k provedení zodpovědného rozhodnutí vždy nutné zahrnout tyto dynamické parametry do širšího obrazu hemodynamických změn.
Ostatní, tzv. statické či volumetrické parametry jako plnicí tlaky obou komor (CVP – Central Venous Pressure, PCWP – Pulmonary Capillary Wedge Pressure), index enddiastolické plochy levé komory (LVEDAI – Left Ventricular End-Diastolic Area Index), nebo index celkového enddiastolického objemu (GEDVI – Global End-Diastolic Volume Index), nevykazují pro užití tekutinové výzvy dostatečnou prediktivní schopnost [33, 40]. Samostatnou kapitolou posouzení vhodnosti podání objemu je tzv. test zvednutí nohou popsaný Lafanecherem [41], jehož užití v průběhu operačního výkonu je však značně omezeno.
U nemocných se sníženou kardiální rezervou nelze předpokládat, že v případě zvýšených nároků zabezpečí dostatečnou dodávku kyslíku pouhé doplnění cirkulujícího objemu. U těchto pacientů je k zajištění adekvátní dodávky kyslíku užití pozitivně inotropních látek (dobutamin, dopexamin) prakticky nevyhnutelné, a přináší větší úspěšnost GDT než podávání tekutin samotných [18, 42]. V nedávno publikované práci hemodynamická léčba cílená k optimalizaci tepového objemu sice zajistila udržení průtoku krve mikrocirkulací sublinguální sliznice a kůže, avšak pouze kombinace maximálního tepového objemu s nízkou dávkou dopexaminu (0,5 µg/kg/min) vedla ke zlepšení průtoku mikrocirkulací a zvýšení tkáňové tenze kyslíku [43]. Naproti tomu podávání vysokých dávek inotropik příznivý účinek optimalizace vlivem nežádoucích účinků ruší [44].
Při zajištění dodávky kyslíku je nutno kromě péče o hemodynamiku věnovat též náležitou pozornost optimalizaci koncentrace hemoglobinu a jeho saturace kyslíkem. Na vznik orgánové hypoperfuze může upozornit zvýšená koncentrace laktátu (nad 2 mmol/l) nebo pokles saturace žilní krve v horní duté žíle (ScvO2 pod 70 %). Ke stanovení optimální úrovně GDT je u těchto nemocných nezbytné užití odpovídajících technik monitorování hemodynamiky (transpulmonární termodiluce nebo plicnicový katétr).
Hledání individuální dynamické rovnováhy mezi aktuální spotřebou a dodávkou kyslíku se jeví jako nejlogičtější cíl optimalizace hemodynamiky vysoce rizikových nemocných [19]. Intervence vedoucí k optimalizaci by měla mírně předcházet, nebo být zahájena v okamžiku vzniku orgánové hypoperfuze. Nicméně pozitivní vliv na morbitidu může mít i GDT v časném pooperačním období [18, 30]. Příznivý efekt tohoto odloženého léčebného výkonu ovšem záleží na individuální toleranci orgánů k ischemicko-reperfuznímu inzultu.
Vliv způsobu dosažení cíle a volby roztoku k optimalizaci plazmatického objemu
Ne zcela jasným problémem perioperační optimalizace hemodynamiky je způsob, jak příslušných cílů dosáhnout. Tato otázka úzce souvisí s obecnou diskusí o volbě množství (liberální vs restriktivní) a typu (krystaloidy vs koloidy) tekutinových náhrad. Mnohými autory bylo opakovaně prokázáno, že množství tekutiny ztracené v důsledku evaporace či přesunů v rámci organismu je relativně malé a nepřesahuje 1 ml/kg za hodinu [45]. Navíc příliš velký přívod tekutin vede k jejich přestupu do intersticiálního prostoru s následným vznikem intersticiálního otoku, prodloužením difuzní dráhy pro kyslík a zhoršením tkáňové oxygenace [46]. Zásadní funkci pro ovlivnění filtrace tekutiny na úrovni mikrocirkulace má podle aktuálních poznatků endovaskulární glykokalyxová membrána, která zvyšováním onkotického tlaku na rozhraní vaskulárního lumen snižuje únik tekutiny do intersticia [47]. Na podkladě tohoto revidovaného Starlingova principu jsou popisovány dva druhy přesunu tekutiny. Typ 1 je fyziologický a vede k vyrovnání tlakových a koncentračních gradientů (známé přerozdělení krystaloidních náhrad v poměru 1 : 4). K druhému typu přesunu tekutin dochází v případě zvýšení vaskulární permeability při porušení glykokalyxové membrány a vede nejen ke ztrátám vody a iontů, ale také proteinů, a vymytí onkotického gradientu. K rozvolnění glykokalyxové membrány dochází jednak v důsledku zánětlivé reakce (operační trauma, ischemicko-reperfuzní postižení apod.), ale také v důsledku vyplavení atriálního natriuretického peptidu (ANP – Atrial Natriuretic Peptide) při akutní hypervolémii [48]. Předpokladem úspěchu optimalizace hemodynamiky je dosažení a udržení „euvolémie“ bez současného rozvoje intersticiálního edému, proto je nezbytné přesun tekutin do intersticia (1. i 2. typu) co nejvíce omezit. Někteří autoři [49, 50] proto navrhují racionální kombinaci přívodu minimální fixní dávky krystaloidů k pokrytí perspirace a ztrát diurézou (minimalizace úniku typu 1) s bolusy koloidu k udržení normovolémie užitím GDT principu (zabránění hypervolémie, a tedy aktivace úniku typu 2). Tento postup byl ve zvířecím experimentu spojen s významně zlepšeným průtokem mikrocirkulací tenkého i tlustého střeva, zvýšením tenze kyslíku ve stěně střeva i v tkáni v místě anastomózy [51, 52]. Problematika volby náhradních roztoků s ohledem na jejich chemické vlastnosti, vliv na acidobazickou rovnováhu a jaterní či ledvinné funkce přesahuje rámec naší práce, užití balancovaných roztoků poslední generace a izoonkotických koloidních náhrad se však jeví jako nejvhodnější.
Další spornou otázkou, spojenou s dosažením hemodynamických cílů, je užití katecholaminů a látek s pozitivně inotropním či vazodilatačním účinkem. Je zřejmé, že dosažení adekvátní dodávky kyslíku do tkání není bez užití inotropní podpory vždy možné. Některé již zmíněné práce prokazují jak lokální zlepšení tkáňové mikrocirkulace [43], tak příznivější pooperační výsledky u nemocných léčených kombinací objemové optimalizace a inodilatancia (dopexamin) [42].
Užití vazopresorů je naproti tomu v GDT protokolech zakotveno minimálně. Pouze protokol studie Mayera et al. [53] pracuje u pacientů s dostatečným srdečním výdejem s normalizací hodnoty středního arteriálního tlaku podáním infuze noradrenalinu. Podání vazopresorů, k udržení cévního tonu při reverzibilní vazodilataci navozené celkovou či regionální anestezií, je jako zábrana pooperační hypervolémie považováno za bezpečné a racionální [49]. Aplikaci vazopresorů by vždy měla předcházet snaha o zajištění dostatečného srdečního výdeje a měly by být podány jen k normalizaci patologicky snížené systémové vaskulární rezistence. Při monitorování hemodynamiky přístroji založenými na analýze tepové křivky [37] a variaci pulzního či systolického tlaku [36] je nutno též pamatovat na výše zmíněný vliv vazopresorů na výpovědní hodnotu měřených parametrů.
Závěr
Po téměř čtyřiceti letech od pionýrských prací Williama Shoemakera není otázka hemodynamické péče o chirurgické nemocné uzavřena. Přes velké množství prací, které se problematikou chirurgických rizikových pacientů zabývají, přetrvává v oblastech optimalizace hemodynamiky a tekutinové léčby několik kontroverzí. I tak je však zřejmý významný posun ve vnímání GDT, jako základního medicínského postupu. Tato změna paradigmatu je předpokladem k vytvoření obecných protokolů, které by se po náležitém ověření multicentrickými studiemi mohly stát základem pro vznik nadnárodních doporučení. Očekává nás pravděpodobně jedno z posledních kol tohoto maratónského běhu. Jak ale víme z problematiky neodkladné resuscitace, od první Safarovy práce do uveřejnění prvních národních doporučených postupů uplynulo 17 let a dalších 26 let pak trvalo vytvoření nadnárodních guidelines International Liaison Committee on Resuscitation. Naše pomyslná cílová rovinka může být ještě značně dlouhá.
Poděkování: Podpořeno výzkumným záměrem MSM 0021620819 „Náhrada a podpora funkce některých životně důležitých orgánů“.
Seznam užitých zkratek:
| ANP | – atriální natriuretický peptid (Atrial Natriuretic Peptide) |
| CI | – interval spolehlivosti (Confidence Interval) |
| CPX | – Cardiopulmonary Exercise test |
| CVP | – centrální žilní tlak (Central Venous Pressure) |
| DO2I | – index dodávky kyslíku (Oxygen Delivery Index) |
| FTc | – korigovaný ejekční čas komory (Flow Time corrected) |
| GDT | – Goal-Directed Therapy |
| GEDVI | – index celkového enddiastolického objemu (Global End-Diastolic Volume Index) |
| LVEDAI | – index enddiastolické plochy levé komory (Left Ventricle End-Diastolic Area Index) |
| METs | – metabolický ekvivalent |
| OR | – poměr šancí (Odds Ratio) |
| PCWP | – tlak v zaklínění (Pulmonary Capillary Wedge Pressure) |
| PEEP | – Positive Endexpiratory Pressure |
| POSSUM | – Physiologic and Operative Severity Score for the enUmeration of Mortality and morbidity |
| PPV | – variace tlakové amplitudy (Pulse Pressure Variation) |
| ScvO2 | – saturace kyslíkem v žilní krvi vena cava superior |
| SPV | – variace systolického tlaku (Systolic Pressure Variation) |
| SVV | – variace tepového objemu (Stroke Volume Variation) |
| VO2I | – index spotřeby kyslíku (Oxygen Consumption Index) |
Došlo dne 14. 10. 2010.
Přijato do tisku dne 3. 2. 2011.
Adresa pro korespondenci:
MUDr. Jan Beneš
Anesteziologicko-resuscitační klinika
Fakultní nemocnice Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: benesj@fnplzen.cz
Sources
1. Drábková, J. Statistika oboru anesteziologie a resuscitace ARO, KAR Česká republika 2009. Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny, 2010, 1, p. 5–12.
2. Pearse, R. M., Harrison, D. A., James, P., Watson, D., Hinds, C., Rhodes, A. et al. Identification and characterisation of the high-risk surgical population in the United Kingdom. Crit. Care, 2006, 10, p. R81.
3. Sandham, J. D., Hull, R. D., Brant, R. F., Knox, L., Pineo, G. F., Doig, C. J. et al. A randomized, controlled trial of the use of pulmonary-artery catheters in high-risk surgical patients. N. Engl. J. Med., 2003, 348, p. 5–14.
4. Donati, A., Loggi, S., Preiser, J. C., Orsetti, G., Munch, C., Gabbanelli, V. et al. Goal-directed intraoperative therapy reduces morbidity and length of hospital stay in high-risk surgical patients. Chest, 2007, 132, p. 1817–1824.
5. Rhodes, A., Cecconi, M., Hamilton, M., Poloniecki, J., Woods, J., Boyd, O. et al. Goal-directed therapy in high-risk surgical patients: a 15-year follow-up study. Intensive Care Med., 2010, 36, p. 1327–1332.
6. Brienza, N., Giglio, M. T., Marucci, M., Fiore, T. Does perioperative hemodynamic optimization protect renal function in surgical patients? A meta-analytic study. Crit Care Med., 2009, 37, p. 2079–2090.
7. Giglio, M. T., Marucci, M., Testini, M., Brienza, N. Goal-directed haemodynamic therapy and gastrointestinal complications in major surgery: a meta-analysis of randomized controlled trials. Br. J. Anaesth., 2009, 103, p. 637–646.
8. Khuri, S. F., Henderson, W. G., DePalma, R. G., Mosca, C., Healey, N. A., Kumbhani, D. J. Determinants of long-term survival after major surgery and the adverse effect of postoperative complications. Ann. Surg., 2005, 242, p. 326–341.
9. Boyd, O., Grounds, R. M., Bennett, E. D. A randomized clinical trial of the effect of deliberate perioperative increase of oxygen delivery on mortality in high-risk surgical patients. JAMA, 1993, 270, p. 2699–2707.
10. Powell-Tuck, J., Gosling, P., Lobo, D. N., Allison, S. P., Carlson, G. L., Gore, M. et al. British Consensus Guidelines on Intravenous Fluid Therapy for Adult Surgical Patients – GIFTASUP. Dostupné na www: http://www.bapen.org.uk/ pdfs/bapen_pubs/giftasup.pdf . 2010. Ref Type: Electronic Citation.
11. Liu, B., Finfer, S. Intravenous fluids in adults undergoing surgery. BMJ, 2009, 338, p. b2418.
12. Mowatt, G., Houston, G., Hernandez, R., de VR, Fraser, C., Cuthbertson, B. et al. Systematic review of the clinical effectiveness and cost-effectiveness of oesophageal Doppler monitoring in critically ill and high-risk surgical patients. Health Technol. Assess., 2009, 13, p. iii-xii, 1.
13. Lees, N., Hamilton, M., Rhodes, A. Clinical review: Goal-directed therapy in high risk surgical patients. Crit. Care, 2009, 13, p. 231.
14. Kern, J. W., Shoemaker, W. C. Meta-analysis of hemodynamic optimization in high-risk patients. Crit. Care Med., 2002, 30, p. 1686–1692.
15. Wakeling, H. G., McFall, M. R., Jenkins, C. S., Woods, W. G., Miles, W. F., Barclay, G. R. et al. Intraoperative oesophageal Doppler guided fluid management shortens postoperative hospital stay after major bowel surgery. Br. J. Anaesth., 2005, 95, p. 634–642.
16. Boyd, O., Jackson, N. How is risk defined in high-risk surgical patient management? Crit. Care, 2005, 9, p. 390–396.
17. Shoemaker, W. C., Wo, C. C., Thangathurai, D., Velmahos, G., Belzberg, H., Asensio, J. A. et al. Hemodynamic patterns of survivors and nonsurvivors during high risk elective surgical operations. World J. Surg., 1999, 23, p. 1264–1270.
18. Pearse, R., Dawson, D., Fawcett, J., Rhodes, A., Grounds, R. M., Bennett, E. D. Early goal-directed therapy after major surgery reduces complications and duration of hospital stay. A randomised, controlled trial [ISRCTN38797445]. Crit. Care, 2005, 9, p. R687–R693.
19. Kirov, M. Y., Kuzkov, V. V., Molnar, Z. Perioperative haemodynamic therapy. Curr. Opin. Crit. Care, 2010, 16, p. 384–392.
20. Copeland, G. P., Jones, D., Walters, M. POSSUM: a scoring system for surgical audit. Br. J. Surg., 1991, 78, p. 355–360.
21. Goldman, L., Caldera, D. L., Nussbaum, S. R., Southwick, F. S., Krogstad, D., Murray, B. et al. Multifactorial index of cardiac risk in noncardiac surgical procedures. N. Engl. J. Med., 1977, 297, p. 845–850.
22. Lee, T. H., Marcantonio, E. R., Mangione, C. M., Thomas, E. J., Polanczyk, C. A., Cook, E. F. et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation, 1999, 100, p. 1043–1049.
23. Fleisher, L. A., Beckman, J. A., Brown, K. A., Calkins, H., Chaikof, E., Fleischmann, K. E. et al. ACC/AHA 2006 guideline update on perioperative cardiovascular evaluation for noncardiac surgery: focused update on perioperative beta-blocker therapy: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2002 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery): developed in collaboration with the American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Rhythm Society, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society for Vascular Medicine and Biology. Circulation, 2006, 113, p. 2662–2674.
24. Older, P., Hall, A., Hader, R. Cardiopulmonary exercise testing as a screening test for perioperative management of major surgery in the elderly. Chest, 1999, 116, p. 355–362.
25. Meregalli, A., Oliveira, R. P., Friedman, G. Occult hypoperfusion is associated with increased mortality in hemodynamically stable, high-risk, surgical patients. Crit. Care, 2004, 8, p. R60–R65.
26. Shoemaker, W. C., Montgomery, E. S., Kaplan, E., Elwyn, D. H. Physiologic patterns in surviving and nonsurviving shock patients. Use of sequential cardiorespiratory variables in defining criteria for therapeutic goals and early warning of death. Arch. Surg., 1973, 106, p. 630–636.
27. Abbas, S. M., Hill, A. G. Systematic review of the literature for the use of oesophageal Doppler monitor for fluid replacement in major abdominal surgery. Anaesthesia, 2008, 63, p. 44–51.
28. Hofer, C. K., Cecconi, M., Marx, G., Della R. G. Minimally invasive haemodynamic monitoring. Eur. J. Anaesthesiol., 2009, 26, p. 996–1002.
29. Shoemaker, W. C., Appel, P. L., Kram, H. B., Waxman, K., Lee, T. S. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients. Chest, 1988, 94, p. 1176–1186.
30. Chytra, I., Pradl, R., Bosman, R., Pelnar, P., Kasal, E., Zidkova, A. Esophageal Doppler-guided fluid management decreases blood lactate levels in multiple-trauma patients: a randomized controlled trial. Crit. Care, 2007, 11, p. R24.
31. Lopes, M. R., Oliveira, M. A., Pereira, V. O., Lemos, I. P., Auler, J. O., Jr., Michard, F. Goal-directed fluid management based on pulse pressure variation monitoring during high - -risk surgery: a pilot randomized controlled trial. Crit. Care, 2007, 11, p. R100.
32. Benes, J., Chytra, I., Altmann, P., Hluchy, M., Kasal, E., Svitak, R. et al. Intraoperative fluid optimization using stroke volume variation in high risk surgical patients: results of prospective randomized study. Crit. Care, 2010, 14, p. R118.
33. Marik, P. E., Cavallazzi, R., Vasu, T., Hirani, A. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: a systematic review of the literature. Crit. Care Med., 2009, 37, p. 2642–2647.
34. De, B. D., Heenen, S., Piagnerelli, M., Koch, M., Vincent, J. L. Pulse pressure variations to predict fluid responsiveness: influence of tidal volume. Intensive Care Med., 2005, 31, p. 517–523.
35. Umgelter, A., Reindl, W., Schmid, R. M., Huber, W. Is supra-ventricular arrhythmia a reason for the bad performance of the FlowTrac device? Crit. Care, 2007, 11, p. 406.
36. Kubitz, J. C., Forkl, S., Annecke, T., Kronas, N., Goetz, A. E., Reuter, D. A. Systolic pressure variation and pulse pressure variation during modifications of arterial pressure. Intensive Care Med., 2008, 34, p. 1520–1524.
37. Kubitz, J. C., Annecke, T., Forkl, S., Kemming, G. I., Kronas, N., Goetz, A. E. et al. Validation of pulse contour derived stroke volume variation during modifications of cardiac afterload. Br. J. Anaesth., 2007, 98, p. 591–597.
38. Lahner, D., Kabon, B., Marschalek, C., Chiari, A., Pestel, G., Kaider, A. et al. Evaluation of stroke volume variation obtained by arterial pulse contour analysis to predict fluid responsiveness intraoperatively. Br. J. Anaesth., 2009, 103, p. 346–351.
39. Perel, A. Automated assessment of fluid responsiveness in mechanically ventilated patients. Anesth. Analg., 2008, 106, p. 1031–1033.
40. Solus-Biguenet, H., Fleyfel, M., Tavernier, B., Kipnis, E., Onimus, J., Robin, E. et al. Non-invasive prediction of fluid responsiveness during major hepatic surgery. Br. J. Anaesth., 2006, 97, p. 808–816.
41. Lafanechere, A., Pene, F., Goulenok, C., Delahaye, A., Mallet, V., Choukroun, G. et al. Changes in aortic blood flow induced by passive leg raising predict fluid responsiveness in critically ill patients. Crit. Care, 2006, 10, R132.
42. Lobo, S. M., Lobo, F. R., Polachini, C. A., Patini, D. S., Yamamoto, A. E., de Oliveira, N. E. et al. Prospective, randomized trial comparing fluids and dobutamine optimization of oxygen delivery in high-risk surgical patients [ISRCTN42445141]. Crit. Care, 2006, 10, R72.
43. Jhanji, S., Vivian-Smith, A., Lucena-Amaro, S., Watson, D., Hinds, C. J., Pearse, R. M. Haemodynamic optimisation improves tissue microvascular flow and oxygenation after major surgery: a randomised controlled trial. Crit. Care, 2010, 14, R151.
44. Pearse, R. M., Belsey, J. D., Cole, J. N., Bennett, E. D. Effect of dopexamine infusion on mortality following major surgery: individual patient data meta-regression analysis of published clinical trials. Crit. Care Med., 2008, 36, p. 1323–1329.
45. Lamke, L. O., Nilsson, G. E., Reithner, H. L. Water loss by evaporation from the abdominal cavity during surgery. Acta Chir. Scand., 1977, 143, p. 279–284.
46. Holte, K., Sharrock, N. E., Kehlet, H. Pathophysiology and clinical implications of perioperative fluid excess. Br. J. Anaesth., 2002, 89, p. 622–632.
47. Chappell, D., Jacob, M., Hofmann-Kiefer, K., Conzen, P., Rehm, M. A rational approach to perioperative fluid management. Anesthesiology, 2008, 109, p. 723–740.
48. Bruegger, D., Jacob, M., Rehm, M., Loetsch, M., Welsch, U., Conzen, P. et al. Atrial natriuretic peptide induces shedding of endothelial glycocalyx in coronary vascular bed of guinea pig hearts. Am. J. Physiol. Heart Circ. Physiol., 2005, 289, H1993-H1999.
49. Jacob, M., Chappell, D., Hollmann, M. W. Current aspects of perioperative fluid handling in vascular surgery. Curr. Opin. Anaesthesiol., 2009, 22, p. 100–108.
50. Bundgaard-Nielsen, M., Secher, N. H., Kehlet, H. ‘Liberal’ vs. ‘restrictive’ perioperative fluid therapy – a critical assessment of the evidence. Acta Anaesthesiol. Scand., 2009, 53, p. 843–851.
51. Hiltebrand, L. B., Kimberger, O., Arnberger, M., Brandt, S., Kurz, A., Sigurdsson, G. H. Crystalloids versus colloids for goal-directed fluid therapy in major surgery. Crit. Care, 2009, 13: R40.
52. Kimberger, O., Arnberger, M., Brandt, S., Plock, J., Sigurdsson, G. H., Kurz, A. et al. Goal-directed colloid administration improves the microcirculation of healthy and perianastomotic colon. Anesthesiology, 2009, 110 : 496-504.
53. Mayer, J., Boldt, J., Mengistu, A., Rohm, K. D., Suttner, S. Goal-directed intraoperative therapy based on autocalibrated arterial pressure waveform analysis reduces hospital stay in high-risk surgical patients: a randomized, controlled trial. Crit. Care, 2010, 14: R18.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2011 Issue 2
-
All articles in this issue
- Neuromuscular blockade during general anaesthesia in the Czech Republic 2010 – a one-day, prospective, observational survey
- Comparison of the cost of balanced anaesthesia maintained with or without nitrous oxide at a university hospital
- Perioperative haemodynamic optimization
- Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo controlled trial
- Summary of the most important changes in the Guidelines for cardiopulmonary resuscitation
- Potential impact of criminal charges and claims of inadequate health care on the physicians‘ performance
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Summary of the most important changes in the Guidelines for cardiopulmonary resuscitation
- Perioperative haemodynamic optimization
- Neuromuscular blockade during general anaesthesia in the Czech Republic 2010 – a one-day, prospective, observational survey
- Potential impact of criminal charges and claims of inadequate health care on the physicians‘ performance
