Ťažký priebeh Stillovej choroby s multiorgánovým zlyhávaním a závažnou pečeňovou dysfunkciou
Severe course of Still’s disease with multiple organ failure with predominant liver failure
Still’s Disease is a disease of unknown aetiology and pathogenesis. It is characterized by fever, arthritis, salmon-coloured rash and organ failure in severe cases. This is a case report of a 31-year old female patient on long-term steroid treatment who suffered from adult Still’s disease. She was admitted to the Clinic of Anaesthesiology and Intensive Care with fever up to 40 °C, unconsciousness and signs of multi-organ failure (liver, acute kidney failure, cardiovascular system, lungs, and disseminated intravascular coagulation). A complex of examinations did not confirm the cause to be sepsis, malignancy, a haematological disease or an infectious disease (repeated blood cultures were negative). We concluded this was an acute exacerbation of adult Still’s disease complicated by the syndrome of oversize macrophage activation with secondary multi-organ failure. The patient’s condition required pulse steroid therapy, hepato-protective therapy and supplementary nutrition inclusive of parenteral selenium supplementation, antibiotics, mechanical ventilation and extra-corporeal elimination therapy. The therapy continued at the Clinic of Internal Medicine. The complex therapy resulted in great regression of the liver insufficiency. After 28 days of hospitalization the patient was discharged in an improved condition.
Key words:
Still’s disease – systemic inflammatory response syndrome – selenium – enteral nutrition – parenteral nutrition – glutathione peroxidase
Authors:
Kočan Ladislav 1; Vašková Janka 4; Vaško Ladislav 4; Hoková Hana 3; Majerník Miloš 1; Krištofová Beáta 2; Šimonová Jana 1; Firment Jozef 1
Authors‘ workplace:
I. klinika anestéziológie a intenzívnej medicíny, UN LP, Košice, SR
1; I. interná klinika, UN LP, Košice, SR
2; Klinika anestéziológie, resuscitácie a intenzívnej medicíny ÚVN SNP Ružomberok – FN, SR
3; Ústav lekárskej chémie, biochémie a klinickej biochémie, LF UPJŠ, Košice, SR
4
Published in:
Anest. intenziv. Med., 22, 2011, č. 6, s. 337-342
Category:
Intesive Care Medicine - Case Report
Overview
Stillova choroba je ochorenie neznámej etiológie a patogenézy. Je charakterizovaná febrilitami, artritídou, exantémom a možným postihnutím ďalších orgánov. Kazuistika sa zaoberá popisom akútnej exacerbácie a liečby Stillovej choroby u 31-ročnej pacientky dlhodobo liečenej kortikoidmi. Pacientka bola prijatá na I. kliniku anestéziológie a intenzívnej medicíny pre febrility do 40 °C, s kvantitatívnou poruchou vedomia (sopor) a s prejavmi multiorgánového zlyhávania (pečene, akútneho zlyhávania obličiek, kardiovaskulárneho systému, dýchania a disseminovanej intravaskulárnej koagulopatie). Komplexnými vyšetreniami sa však zdroj sepsy, malignita, hematologické ochorenia a ani infekčné agens nezistili (opakované vyšetrenia vzoriek krvi boli negatívne). Stav bol definovaný ako akútna exacerbácia Stillovej choroby dospelých v. s. komplikovaná syndrómom nadmernej aktivácie makrofágov so sekundárnym multiorgánovým zlyhaním. Do liečby bolo zahrnuté podávanie pulznej kortikoterapie, hepatoprotektív, doplnkovej umelej výživy vrátane parenterálnej suplementácie selénu, širokospektrálnych antibiotík (ATB), umelej ventilácie pľúc a mimotelovej eliminačnej liečby, v ktorej sa po stabilizácii stavu pokračovalo na Internej klinike. Komplexný terapeutický prístup viedol k významnej regresii hepatálnej insuficiencie. Pacientka bola po 28 dňoch hospitalizácie vo významne zlepšenom stave prepustená do ambulantnej starostlivosti.
Kľúčové slová:
Stillova choroba – syndróm systémovej zápalovej odpovede – selén – enterálna výživa – parenterálna výživa – glutatión peroxidáza
Úvod
Kriticky chorí pacienti sú zaťažení dysfunkciou rôznych orgánových systémov. Rozdielnosti v metabolických pochodoch si vyžadujú špecifický terapeutický prístup adekvátne reagujúci na metabolické požiadavky organizmu. Existencia širokého spektra enterálnych a parenterálnych nutričných prípravkov poskytuje účinné terapeutické možnosti zvrátenia nepriaznivej metabolickej situácie. Obzvlášť závažná situácia nastáva pri stavoch spojených so zlyhávaním pečene. Ide o chorobné stavy, akými sú napríklad systémové, hematologické ochorenia, sepsa a Stillova choroba. Stillova choroba dospelých je akútny febrilný syndróm dospelých, typicky postihujúci niekoľko orgánov s klinickými a laboratórnymi abnormalitami, pričom k plnému rozvoju príznakov môže dôjsť až v priebehu niekoľkých týždňov či mesiacov. Stanovenie diagnózy je obtiažne a nasleduje až po vylúčení ostatných príčin systémových prejavov, ako sú horúčky, vyrážky, hepatosplenomegália, lymfadenopatia a sérozitída. Artritída, ktorá sa môže objaviť kedykoľvek v priebehu ochorenia, má rôzny charakter. Asi v polovici prípadov prebieha ako ťažká, deštruktívna polyartritída. Medzi ostatné príčiny systémových prejavov patria infekčné a systémové afekcie a malignita. Liečba spočíva v podávaní nesteroidných antireumatík, glukokortikoidov, liekov modifikujúcich ochorenie a u ťažších foriem je indikovaná aj biologická liečba. Toto ochorenie bolo po prvýkrát popísané anglickým pediatrom Ericom Bywatersem v r. 1971 [1], ktorý zaznamenal 14 prípadov Stillovej choroby.
Dôležitou úlohu v patogenéze chorobných stavov u kriticky chorých pacientov (syndróm systémovej zápalovej odpovede, sepsa a hepatálne zlyhávanie) zohrávajú voľné kyslíkové radikály a reaktívne kyslíkové častice (ROS, reactive oxygen species). Za normálnych okolností vzniká superoxidový radikál (O2.-) monovalentnou redukciou molekulárneho kyslíka v každom živom systéme, najmä v reakciách spojených s mitochondriálnym elektrónovým transportom. Dizmutáciou O2.- sa tvorí peroxid vodíka (H2O2), ktorý nie je voľným radikálom, avšak vedie k tvorbe hydroxylových radikálov (.OH), ktoré sú považované vôbec za najreaktívnejšie [2]. Produkcia ROS však v organizme môže byť zámerná a mohutná ako v prípade aktivácie neutrofilov a je súčasťou antimikrobiálnej ochrany. Ovplyvnenie ale aj zvládnutie oxidačného stresu je teda významné z hľadiska ovplyvnenia patofyziológie daných ochorení [3].
Parenterálne sa na podporu antioxidačného systému využíva suplementácia selénu [4], ktorý je kofaktorom antioxidačného enzýmu glutatión peroxidázy (GPx). Mnohé štúdie potvrdzujú priamu súvislosť medzi hladinou selénu v plazme, selenoenzýmov a závažnosťou septického stavu [5]. Etiológia Stillovej choroby je dosiaľ neznáma. Najpravdepodobnejšou hypotézou je prehnaná reakcia organizmu na infekčné agens alebo určitý toxický substrát komplexnou interakciou. Popisovaný prípad približuje úspešnosť zvolenej terapie pri Stillovej chorobe komplikovanej systémovým prejavom zápalu spojeným zo zlyhávaním pečene.
Metodika
Vykonané terapeutické postupy sú na našej klinike rutinne používané. Pacienti, ktorým boli stanovené aktivity antioxidačných enzýmov, boli zaradení do štúdie Se-AOX schválenej Etickou komisiou Univerzitnej nemocnice L. Pasteura.
Kazuistika
Pacientka vo veku 31 rokov s dlhodobou imunosupresívnou liečbou kortikoidmi a s dokumentovanou Stillovou chorobou bola hospitalizovaná pre vertebroalgický syndróm v cervikálnej a lumbosakrálnej oblasti na neurologickom oddelení okresnej nemocnice. Priebeh hospitalizácie bol komplikovaný febrilitami a rozvojom šokového stavu, syndrómom systémovej zápalovej odpovede (SIRS) nejasnej etiológie a multiorgánovým zlyhávaním. U pacientky došlo k rozvoju diseminovanej intravaskulárnej koagulopatie (DIC). Pre zhoršujúci sa stav bola pacientka preložená na I. kliniku anestéziológie a intenzívnej medicíny (I. KAIM) Univerzitnej nemocnice L. Pasteura v Košiciach za účelom ďalšej intenzívnej terapie. Ihneď po prijatí na KAIM sa realizovala adjuvantná antioxidačná terapia kontinuálnou suplementáciou selénu v dávke 750 µg/24 hodín počas nasledujúcich šiestich dní. Výživa bola zabezpečená podávaním nutrientov enterálnym i parenterálnym prístupom. Nutričné prípravky obsahovali vyšší podiel rozvetvených esenciálnych aminokyselín (valín, leucín, izoleucín) a prekurzorov glutatiónu (cysteín, glutamín). Pravidelne boli merané aktivity antioxidačných enzýmov, ako aj štandardné zápalové parametre (tab. 1). Bola začatá oxygenoterapia a empirická kombinovaná širokospektrálna antimikrobiálna liečba. Pre cirkulačnú instabilitu si stav vyžiadal vazopresorickú podporu noradrenalínom v dávke 0,06 µg . kg-1 . min-1. V laboratórnom skríningu pri prijatí dominovali elevované aminotransferázy, hyperbilirubinémia, zvýšená hladina urey v sére, anémia, leukocytóza, hypokoagulačný stav s trombocytopéniou v rámci DIC a zvýšené zápalové markery C-reaktívny proteín (CRP) a prokalcitonín (PCT) – viď tabuľka 1. Po konzultácii s hematológom bola realizovaná substitučná hemoterapia. Vzhľadom na rozvíjajúcu sa oligúriu, po konzultácii s nefrológom, bola indikovaná mimotelová eliminačná liečba (MEL) formou kontinuálnej veno-venóznej hemodialýzy (CVVHD, Ci-Ca modul). Do terapie boli zaradené hepatoprotektíva a vitamínová liečba. Po konzultácii s internistom stav hodnotený ako exacerbácia Stillovej choroby a následne aplikovaná pulzná liečba metylprednisolonom (iniciálne 500 mg i. v. počas 4 dní). Na 3. deň hospitalizácie bola pacientka pre progresiu respiračnej insuficiencie intubovaná a prechodne napojená na umelú ventiláciu pľúc (UVP). Boli realizované pomocné zobrazovacie vyšetrenia v rámci detekcie zdroja ťažkej sepsy. CT vyšetrenie brucha nevylúčilo kolitídu v cékoascendentnej oblasti a v oblasti pravého colon transversum. Zároveň bolo prítomné edematózne presiaknutie oboch obličiek. CT vyšetrenie pľúc potvrdilo obojstranný fluidotorax a infiltratívne zmeny v dorzobazálnych častiach oboch pľúcnych krídel. Pre meningeálny syndróm a kvadruspasticitu bola realizovaná lumbálna punkcia, vyšetrenie likvoru však bolo negatívne. Po aplikovanej liečbe došlo k parciálnemu zlepšeniu laboratórnych parametrov. Naďalej pretrvávala anúria, boli nutné denné nefrologické konzília pre vyžadujúcu MEL, postupne z CVVHD zmenenej na intermitentnú hemodialýzu. Po týždni hospitalizácie na I. KAIM bol pacientkin celkový zdravotný stav zlepšený, pacientka bola afebrilná, so spontánnym dýchaním, parametre acidobázickej rovnováhy boli v norme, preto bola extubovaná, hemodynamicky stabilná bez nutnosti pokračovania v katecholamínovej liečbe. ATB liečba bola ukončená, antimykotikum ponechané len v profylaktickej dávke. Nutrícia bola naďalej zabezpečená kombináciou enterálnej a parenterálnej výživy. Po šiestich dňoch bolo parenterálne podávanie selénu ukončené. Pacientku sme v stabilizovanom stave preložili na jednotku intenzívnej starostlivosti I. internej kliniky UNLP.
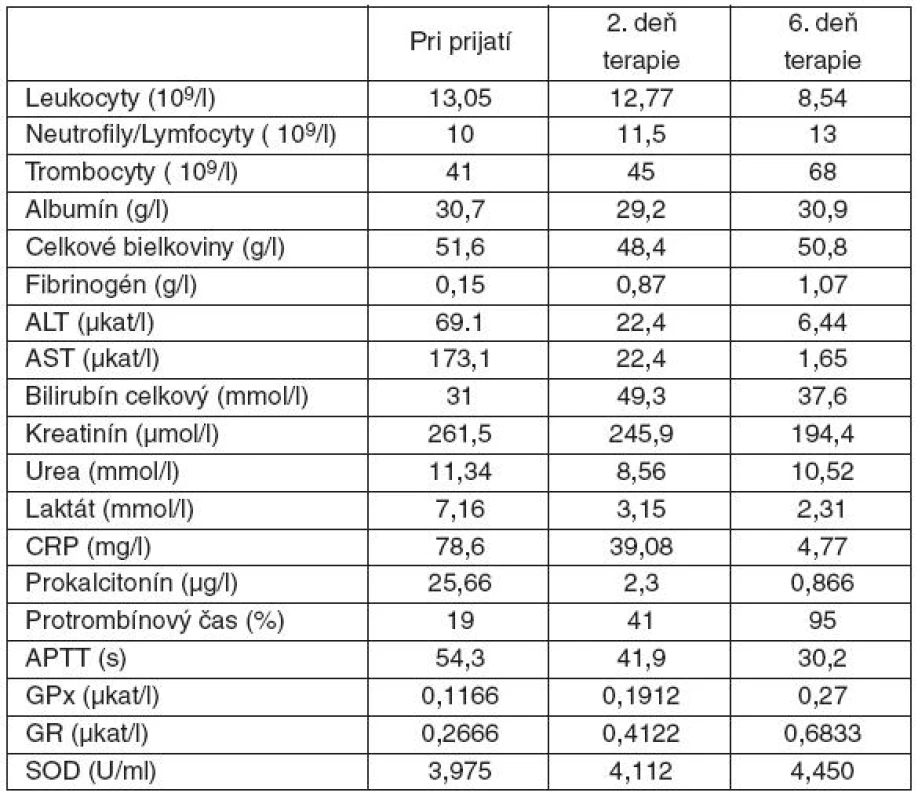
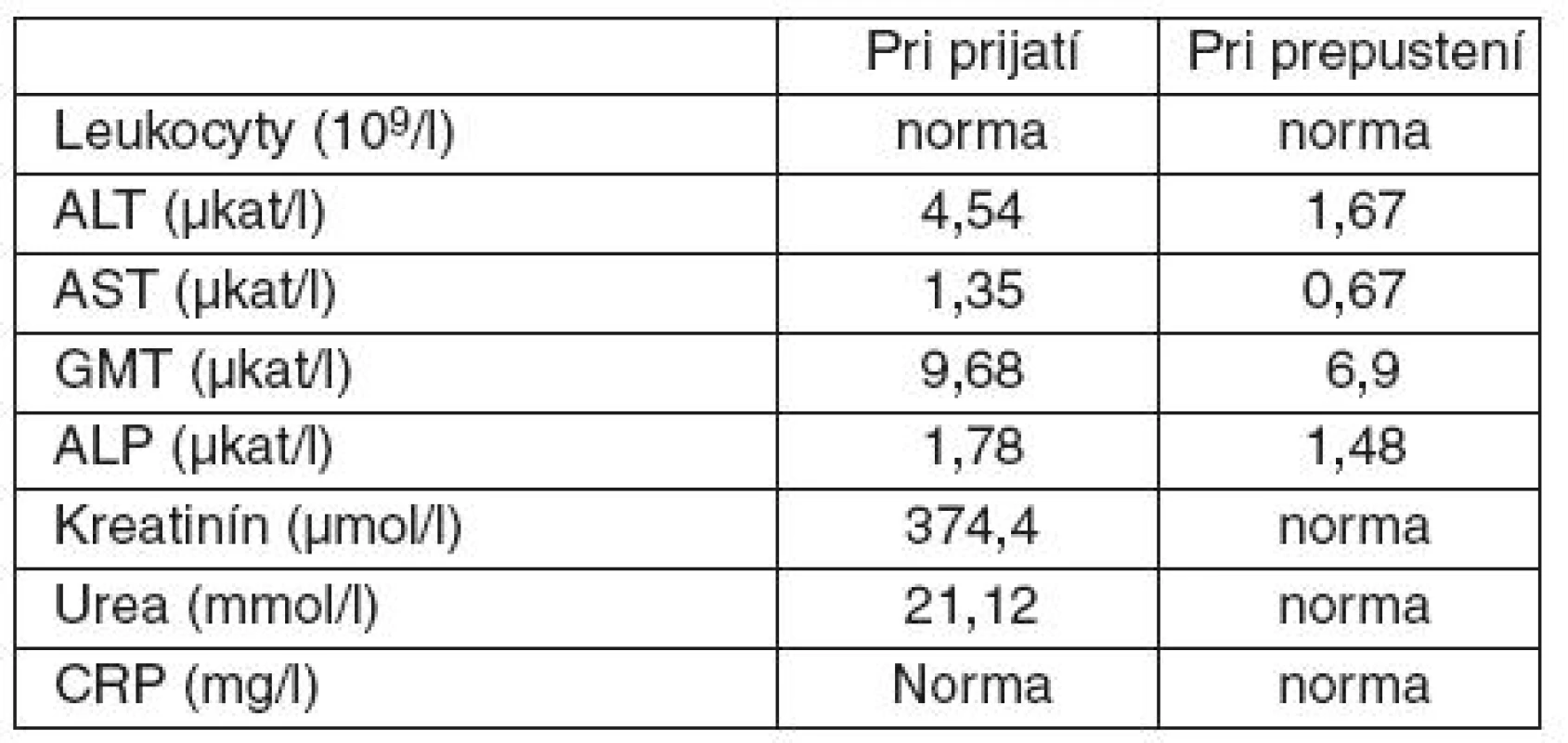
Pri príjme na internú kliniku bola pacientka pri vedomí, afebrilná, bez prejavov respiračnej insuficiencie, hemodynamicky stabilná, naďalej pretrvávala anúria. Výsledky vstupných laboratórnych vyšetrení sú uvedené v tabuľke 2. Realizované kompletné mikrobiologické vyšetrenia vrátane hemokultúr boli negatívne. Pre akútne obličkové zlyhanie sme naďalej pokračovali v mimotelovej eliminačnej liečbe, s postupnou úpravou kreatinínu na 135,9 µmol . l-1. Taktiež sme pokračovali v pulznej kortikoterapii (v dávke 250 mg metylprednisolonu na deň) s postupnou redukciou dávky až prechodom na perorálnu liečbu prednisonom v dávke 40 mg na deň. Pacientke bol odstránený centrálny venózny katéter, nutrícia bola zabezpečená už len enterálnou formou. Anemický syndróm sme korigovali krvnými prevodmi. Vzhľadom na postihnutie pečene bola pacientke počas hospitalizácie podávaná hepatoprotektívna liečba zahájená už na KAIM, pri ktorej došlo k parciálnemu poklesu aminotransferáz (tab. 2). Stav pacientky sa po celkovo 28 dňoch hospitalizácie výrazne zlepšil a pacientku sme prepustili do ambulantnej starostlivosti.
Diskusia
Exacerbácia Stillovej choroby u pacientky bola vyvolaná neznámou príčinou. Infekčná etiológia nebola potvrdená, po diagnostikovaní kritérií SIRS a odobratí hemokultúr boli preventívne podávané širokospektrálne antibiotiká. Laboratórne boli po príjme potvrdené známky rozvíjajúceho sa hepatálneho zlyhávania, enormne zvýšené aktivity hepatálnych enzýmov, pokles koagulačných parametrov a opakovaný sklon k hypoglykémiam. Stav si vyžiadal podávanie pulznej kortikoterapie, hepatoprotektív, umelú pľúcnu ventiláciu, mimotelovú eliminačnú liečbu a špecifickú nutričnú podporu, formou enterálnej a parenterálnej výživy rešpektujúcej hepatálne poškodenie.
Dôležitou úlohou terapie je ovplyvnenie SIRS, kedy dochádza k masívnej produkcii voľných kyslíkových radikálov (ROS) v organizme. ROS zohrávajú významnú amplifikačnú úlohu v úvodnej fáze SIRS. Ak produkcia reaktívnych foriem kyslíka ďaleko prevyšuje ich vychytávanie, dochádza k spúšťaniu kaskád imunitných a zápalových dejov, súborne označovaných ako oxidačný stres [6]. Ovplyvniť oxidačný stres podporou metabolizmu závisí aj od optimálne zvolenej parenterálnej a enterálnej výživy, ktorá okrem iného aktivuje antioxidačnú obranu organizmu a doplní chýbajúce stopové prvky a spotrebované zásoby vitamínov. U kriticky chorých sa zdá byť obzvlášť prospešná parenterálna suplementácia selénu ako aj prekuzorov glutatiónu. Štúdie potvrdili zlepšenie klinických výsledkov pri podávaní selénu, ktorý napomáhal zlepšovaniu zdravotného stavu pacientov pri infekciách a orgánovom zlyhaní. Pri podávaní glutamínu v rozsiahlych štúdiách sa potvrdilo zníženie infekčných komplikácií u kriticky chorých pacientov [7].
Pečeň je ústredným metabolickým orgánom s exkrečnými, metabolickými, detoxikačnými, hematologickými, hemostatickými funkciami a radou ďalších dôležitých funkcií. V začiatočnej fáze hepatálneho zlyhania dochádza k vyššiemu metabolizmu proteínov s prevahou katabolických dejov. Ústrednú úlohu pri týchto dejoch zohrávajú katabolické hormóny. Prvotným inzultom zodpovedným za nasledujúce deje sú noxy rôznej etiológie, ako napríklad infekcie, sepsa a vplyv rôznych toxínov. Dochádza k akcelerácii zápalovej odpovede, do obehu sa uvoľňujú mediátory zápalu a zvyšuje sa tvorba proteínov akútnej fázy. Táto fáza je do určitej miery reverzibilná, za podmienky dostatočných kompenzačných mechanizmov, zahrňajúcich imunitné, metabolické a terapeutické faktory.
Umelá výživa u kriticky chorých je limitovaná funkčnosťou gastrointestinálneho traktu z hľadiska voľby výživy enterálnej, doplnkovej alebo parenterálnej. Druhou limitáciou je utilizácia živín v pečeni, ktorá pri hepatálnom zlyhávaní môže byť nedostatočná a je nevyhnutné podávať synteticky pripravené základné stavebné makromolekuly živín. Orgánovo špecifická výživa pri hepatálnom zlyhávaní je založená na využití anaplerotických (AS) a špecificky nutričných substrátov (ŠS) [8]. Narušením jednej čiastkovej reakcie dochádza k zastaveniu celej metabolickej cesty. Suplementáciou AS sa doplní substrát za prerušenou reakciou, čím môže sled biochemických reakcií ďalej pokračovať. Suplementácia ŠS za daných podmienok je výhodná z hľadiska lepšej utilizácie a zlepšenia energetickej rovnováhy [8]. Výhodnou alternatívou sa zdá byť výživa doplnková. Dôležitým nutrientom, ktorý by mala obsahovať enterálna výživa, sú mastné kyseliny. Predstavujú významný zdroj pre regeneráciu hepatocytov. Vhodné je aj podávanie prebiotík (laktulózy), respektive probiotík v rámci enterálnej výživy, z dôvodu zvrátenia hnilobných procesov v čreve na kvasné. Pri parenterálnej výžive je vhodné pacientom podávať 40–45 % rozvetvených aminokyselín, ako aj vyššie množstvá esenciálnych aminokyselín s výnimkou aromatických, ktorých príjem je potrebné redukovať [9].
Za priaznivých podmienok dochádza k obnoveniu fyziologických funkcií pečeňového tkaniva a dochádza k reparácii narušených pečeňových lalôčikov ad integrum. Pri nadmernom pôsobení noxy, môže táto fáza prekročiť kompenzačné limity a stať sa ireverzibilnou a vyústiť do fulminantného hepatálneho zlyhania [8]. Dôležitú úlohu v tomto procese zohrávajú aktivované Kupfferove bunky. Sú to mononukleárne makrofágy, ktoré pod vplyvom noxy uvoľňujú enormné množstvo voľných radikálov (ROS) do svojho okolia. Tvorba ROS za fyziologických podmienok prebieha kontinuálne v rámci aeróbneho metabolizmu. ROS slúžia podobne ako aj v iných tkanivách na elimináciu baktérií a sú spúšťačom uvoľňovania signálnych molekúl. Tkanivá sú voči ROS chránené antioxidačným systémom. ROS v pečeni účinkujú na všetky dôležité biomolekuly, proteíny, lipidy a nukleové kyseliny. Poškodenie bunkových membrán hepatocytov je spôsobené ich lipoperoxidáciou ako aj sekundárnym poškodením vznikajúcimi produktami lipoperoxidácie. ROS sú zodpovedné za zvýšenie aktivity fosfolipázy-A2, čím dochádza k štepeniu fosfolipidov bunkových membrán a poruchám intracelulárnej homeostázy Ca2+ [9].
Peroxidované lipidy sú následne rozložené na aldehydy, ketóny, alkoholy a laktóny, ktoré samotné majú toxické účinky. Dôležité je spomenúť rozklad hemoglobínu v pečeni, ktorý môže proces lipoperoxidácie iniciovať. Uvoľnená skupina hému, ktorá obsahuje ióny železa má katalytický účinok na tvorbu peroxidov. Podľa laboratórnych výsledkov dochádzalo k zvýšenej dekompozícii hemoglobínu, čím sa zvýšil aj obsah hemoproteínov, respektive iónov kovov, ktoré proces peroxidácie organických substrátov urýchľovali. Zvýšenie aminotransferáz, bilirubínu, zníženie albumínov potvrdzuje poškodenie pečene. Okrem klinických príznakov poškodenia obličiek to potvrdzujú aj zvýšenia kreatinínu a močoviny v krvi. Pritom nie je možné vylúčiť ani postihnutie svalov, nakoľko aminotransferázy sú súčasťou každej bunky včítane svalov a na zvýšení hodnôt sa mohli podieľať aj svalové aminotransferázy. Podobne kreatinín vzniká vo svaloch odbúravaním kreatínfosfátu, ale na zvýšení kreatinínu v sére môže pôsobiť znížené vylučovanie obličkami. Spomínané látky sa ale dialýzou odstraňujú.
Za fyziologických okolností je glykogén uskladnený v pečeni ľahko mobilizovateľný, a je preto dôležitým zdrojom glukózy pre ostatné orgánové systémy. Narušením funkcie glykogenfosforylázy dochádza k poklesu jeho premeny na D-glukózu. Pacienti s hepatálnym zlyhávaním sú preto náchylní na hypoglykémiu. Dochádza k poklesu proteosyntézy, čo sa prejavuje znížením hladín celkových bielkovín a dochádza najmä k poklesu plazmatického albumínu, prealbumínu, transferínu, transkortínu a retinol-viažúceho proteínu [9]. U pacientky z kazuistiky boli zaznamenané znížené hladiny celkových bielkovín a najmä albumínu v krvi počas hospitalizácie na I. KAIM. Ďalej dochádza pri hepatálnom zlyhaní k výraznému zvýšeniu plazmatickej koncentrácie aromatických kyselín fenylalanínu, tyrozínu a tryptofánu, ktoré sú za fyziologických podmienok metabolizované prevažne v pečeni. Narušenie metabolických ciest vedie k ich akumulácii v krvi. Narušenie ureosyntézy spôsobuje vzostup amoniaku v krvi, ktorý sa v pokročilých štádiách ochorenia podieľa na rozvoji hepatálnej encefalopatie [8].
Esenciálne aminokyseliny s rozvetveným uhľovodíkovým reťazcom valín, leucín a izoleucín sú len nepatrne metabolizované v pečeni. Sú významným zdrojom energie pre svaly, ktoré ich aktívne vychytávajú z krvi a môžu nahrádzať energiu pochádzajúcu z glukózy. Ich aminoskupiny tlmia acidózu tým, že sa premenia na NH4+ a sú vylučované obličkami. Podávanie spomínaných aminokyselín do výživy preto mohlo pozitívne vplývať aj na regeneráciu svalov a kompenzovanie acidózy, ktorá sa prejavila v danom prípade aj zvýšením laktátu v krvi. Podávanie glutamínu, ktorého syntéza v organizme vyžaduje ATP tiež mohlo významne pozitívne vplývať na regeneračné procesy, pretože glutamín je východiskovou látkou pri syntéze pyrimidínových a purínových báz, ktoré sú základnými bázami nukleových kyselín, ale aj energeticky bohatých trifosfátov ako ATP, GTP, UDP atď. Tie majú významnú úlohu okrem syntetických dejov i v regulácii metabolizmu prenosom signálov a usmerňovaním metabolizmu, napr. druhý poslovia (cAMP, cGMP). Prebytočný glutamín nevyužitý k syntéze spomenutých báz môže poskytnúť amoniak, ktorý pribratím H+ kompenzuje acidózu, podobne ako amoniak z rozvetvených aminokyselín.
Selén sa uplatňuje ako kofaktor enzýmu glutatión peroxidázy, ktorý patrí do skupiny enzýmov vykazujúcich peroxidázovú aktivitu [10]. Jej hlavnou úlohou je ochrana bunkových štruktúr pred oxidačným poškodením. Biochemická funkcia GPx je redukovať lipidové peroxidy na im korešpondujúce alkoholy a redukovať voľný peroxid vodíka na vodu. Substrátom pre túto reakciu je glutatión (GSH) [11, 12]. Suplementáciou glutamínu alebo jeho prekurzorov sa zvyšuje efektivita účinku GPx. Regenerácia oxidovanej formy glutatiónu (GSSG) na GSH je katalyzovaná glutatión reduktázou (GR). Priame meranie dynamiky antioxidačných enzýmov u pacientky z kazuistiky poukazuje na ich aktiváciu suplementovanými mikronutrientmi. U pacientky z kazuistiky dochádza aj k zvýšeniu aktivity GR, čo je možné vysvetliť súčasným podávaním prekurzorov syntézy GSH. Zvýšená hodnota GPx v šiesty deň od aplikácie prvej dávky selénu a glutamínu svedčí o zvýšenej aktivite antioxidačného systému. Zabudovanie selénu do selenoproteínu, akým je GPx, a zvýšenie jej aktivity má význam v zabránení monoredukcie peroxidov na .OH, čo nie je enzymatická reakcia, ale môže byť značne urýchlená prítomnosťou kovov, napr. z porušených molekúl, kde sa ióny kovov často nachádzajú v ich aktívnom centre. Metaloproteínom je aj superoxid dizmutáza (SOD), ktorá je ďalším dôležitým antioxidačným enzýmom. Jeho funkciou je rýchla dizmutácia O2. - na kyslík a peroxid vodíka. V prostetickej skupine tohto enzýmu sa nachádza meď, zinok alebo horčík. Pred zahájením liečby bola aktivita tohto enzýmu znížená. Počas liečby došlo k zvýšeniu aktivity aj u tohto enzýmu. Biochemické parametre iných metaloproteínov sledované neboli. Tento jav bol sprevádzaný poklesom plazmatickej hladiny CRP, čo je známkou efektívnej terapie systémovej zápalovej odpovede. Pomer neutrofilov a lymfocytov má priaznivú klesajúcu tendenciu aj napriek stúpajúcej hodnote leukocytov. Pomer neutrofilov a lymfocytov jednoducho a spoľahlivo vystihuje mieru závažnosti oxidačného stresu a systémového zápalu. Predošlé štúdie popisujú súvislosť medzi závažnosťou klinického stavu a mierou neutrofílie a lymfocytopénie [13]. Výsledky tejto kazuistiky potvrdzujú priaznivý vplyv suplementácie selénu na SIRS a obnovu hepatálnej funkcie. Zvýšenie aktivít antioxidačných enzýmov u pacientky z kazuistiky poukazuje na ich aktiváciu suplementovanými mikronutrientmi.
Záver
Stillova choroba je ochorenie neznámej etiológie, vyžadujúce dlhodobú imunosupresívnu liečbu. Akútna exacerbácia ochorenia môže viesť k rôznym orgánovým dysfunkciám a z nich vyplývajúcim klinickým prejavom. Jedným z najzávažnejších je akútna hepatálna insuficiencia, ktorá pri neadekvátnej terapii môže viesť k fulminantnému zlyhaniu pečene. Liečba je vysoko komplexná, vyžadujúca multidisciplinárny prístup. Pochopenie patofyziologických pochodov pri stavoch spojených so zlyhávaním pečene má kľúčovú úlohu pri výbere orgánovo špecifickej nutrície, ktorá adekvátne reaguje na metabolické potreby organizmu. Využitie podpornej antioxidačnej terapie formou selénových preparátov a prekurzorov glutatiónu sa zdá byť výhodné pri ovplyvnení systémovej zápalovej odpovede a zlepšení klinického stavu.
Použité skratky:
AS – anaplerotický nutričný substrát
ATB – antibiotiká
ATP – adenozíntrifosfát
Ci-Ca – modul citrátový – kalciový modul
cAMP – cyklický adenozínmonofosfát
cGMP – cyklický guanozínmonofosát
CVVHD – Continuous venovenous hemodiafiltration
CRP – C-reaktívny proteín
DIC – disseminovaná intravaskulárna
koagulopatia
GCS – Glasgow coma scale
GPx – glutatión peroxidáza
GR – Glutatión reduktáza
GSH – redukovaná forma glutatiónu
GSSG – oxidovaná forma glutatiónu
GTP – guanozíntrifosfát
MEL – mimotelová eliminačná liečba
O2.- – superoxid
.OH – hydroxylový radikál
PCT – prokalcitonín
ROS – reaktívne formy kyslíka
SIRS – Systemic Inflammatory Response Syndrome
SOD – superoxid dismutáza
ŠS – špecifický nutričný substrát
UDP – uridíntrifosfát
UVP – umelá ventilácia pľúc
Došlo dne 11. 8. 2011.
Přijato dne 11. 11. 2011.
Adresa pro koresponddenci:
MUDr. Ladislav Kočan
I. klinika anestéziológie a intenzívnej medicíny
Univerzitná nemocnica L. Pasteura
Trieda SNP 1
041 90 Košice
Slovenská republika
e-mail: kocanladislav@yahoo.com
Sources
1. Bywaters, E. G. L. Still´s disease in the adult. Ann. Rheum. Dis., 1971, 30, p. 121–132.
2. Keher, J. P. Free radicals as mediators of tissue injury and disease. Critical rev. Toxicol., 1993, 23, p. 21–48.
3. Geoghegan, M., Mcauley, D., Eaton, S., Powel-Tuck, J. Selenium in critical illness. Critical Care, 2006, 12, p. 136–141.
4. Kočan, L., Firment, J., Šimonová, J., Vašková, J., Guzy, J. Suplementácia selénu u pacientov s ťažkou akútnou pankreatitídou. Rozhl. v Chirurgii, 2010, 89, 1, p. 518–521.
5. Gartner, R., Albrich, W., Angustwurm, M. W. The effect of selenium supplementation on the outcome of patients with severe systemic inflammation, burn and trauma. Biofactors, 2001, 14, p. 199–204.
6. Imlay, J. Pathways of oxidative damage. Annual Review of Microbiology, 2003, 57, p. 395–418.
7. Andrews, P. J. Selenium and glutamine supplements: where are we heading? A critical care perspective. Current Opinion in Clinical Nutrition and Metabolic Care, 2010, 13, p. 192–197.
8. Zadák, Z. Umělá výživa při poškození jater. In Zadák, Z. Výživa v intenzivní péči. Grada Publishing a.s. : Praha, 2008, p. 359–365, ISBN: 978-80-247-2844-5.
9. Turecký, L. Poškodenie pečene voľnými radikálmi. In Ďuračková, Z. Voľné radikály a antioxidanty v medicíne II. Slovac Academic Press s.r.o. 1999, p. 210-218,ISBN: 80-88908-46-9.
10. Berger, M., Chiolero, R. Antioxidant supplementation in sepsis and systematic inflammatory response syndrome. Critical Care Medicine, 2007, 35 p. 584–590.
11. Forceville, X. Seleno-enzymes and seleno-compounds: the two faces of selenium. Critical Care, 2006, 10, p. 180.
12. Muller, F. L., Lustgarten, M. S., Jang, Y., Richardson, A., Van Remmen, H. Trends in oxidative aging theories. Free Radic. Biol. Med., 2007, 43, p. 477–503.
13. Záhorec, R. Pomer neutrofilov a lymfocytov – rýchly a jednoduchý ukazovateľ systémového zápalu a stresu u pacientov v kritických stavoch. Bratislavské Lekárske Listy, 2001, 102, p. 5–14.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2011 Issue 6
-
All articles in this issue
- Fasciální koncept
- Chladit či nechladit? Úskalí zavedení léčebného protokolu terapeutické hypotermie
- Vliv terlipresinu na perfuzi vitálně důležitých orgánů při kardiopulmonální resuscitaci – experimentální studie TERCA (Terlipressin in Cardiac Arrest)
- Ťažký priebeh Stillovej choroby s multiorgánovým zlyhávaním a závažnou pečeňovou dysfunkciou
- Principy umělé plicní ventilace u chronické obstrukční plicní nemoci
- Dvousté výročí J. Y. Simpsona
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Principy umělé plicní ventilace u chronické obstrukční plicní nemoci
- Ťažký priebeh Stillovej choroby s multiorgánovým zlyhávaním a závažnou pečeňovou dysfunkciou
- Fasciální koncept
- Chladit či nechladit? Úskalí zavedení léčebného protokolu terapeutické hypotermie
