Vliv terlipresinu na perfuzi vitálně důležitých orgánů při kardiopulmonální resuscitaci – experimentální studie TERCA (Terlipressin in Cardiac Arrest)
The effect of terlipressin on vital organ perfusion in cardiopulmonary resuscitation – experimental study TERCA (Terlipressin in Cardiac Arrest)
Objective:
Vasoactive drugs are used in cardiopulmonary resuscitation to increase vital organ perfusion. The aim of this study was to compare the haemodynamic effects of synergistically acting terlipressin and adrenaline vs. adrenaline alone in a porcine model of ventricular fibrillation (VF).
Design:
Randomized, double-blinded, placebo controlled experimental study.
Setting:
Department of Anaesthesiology and Intensive Care Medicine, University Hospital; Animal Research Laboratory, Faculty of Military Health Sciences
Materials and methods:
Fourteen domestic pigs were randomly assigned into group TER (n = 7) and ADR (n = 7). VF was induced using an intra-cardiac pacing lead. After 5 min of untreated arrest, compression-only resuscitation was applied for 10 min, followed by advanced life support. Terlipressin in a single-dose of 30 μg ·kg-1 was added to the first dose of adrenaline in group TER, while placebo was given in group ADR. Coronary (CorPP) and cerebral (CPP) perfusion pressures were calculated from the right atrial, aortic and intracerebral pressures. Data were analysed using repeated measurements ANOVA and a Fisher’s protected LSD post hoc test.
Results:
Terlipressin/adrenaline maintained CorPP higher than 10 mm Hg for 17.7 min longer than adrenaline alone (P = 0.003). CorPP (mean ± SD) measured at 35, 45, and 55 min after the onset of VF was 12.2 ± 4.0, 11.0 ± 6.2, and 9.6 ± 4.5 mm Hg in group TER; and 5.8 ± 3.8, 0.6 ± 4.9, and -1.0 ± 4.5 mm Hg in group ADR (P = 0.03, < 0.001, and < 0.001). CPP measured at the same times was 23.0 ± 7.2, 20.4 ± 6.9, and 23.1 ± 6.7 mm Hg in group TER; and 13.3 ± 6.5, 6.2 ± 5.3, and 5.6 ± 6.5 mm Hg in group ADR (P = 0.01, < 0.001, and < 0.001).
Conclusion:
A single dose of terlipressin, when added to adrenaline in cardiopulmonary resuscitation, was effective for achieving significantly higher cerebral and coronary perfusion pressures compared to adrenaline alone, which was unable to prevent severe refractory hypoperfusion.
Keywords:
cardiopulmonary resuscitation – cardiac arrest – ventricular fibrillation – therapy – terlipressin – cerebral perfusion pressure – coronary perfusion pressure
Authors:
Truhlář Anatolij 1,2; Turek Zdeněk 1; Škulec Roman 1,3; Černý Vladimír 1,4
Authors‘ workplace:
Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové
1; Zdravotnická záchranná služba Královéhradeckého kraje, Hradec Králové
2; Územní středisko záchranné služby Středočeského kraje, Beroun
3; Department of Anesthesia, Dalhousie University, Halifax, Nova Scotia, Canada
4
Published in:
Anest. intenziv. Med., 22, 2011, č. 6, s. 328-336
Category:
Intensive Care Medicine - Original Paper
Overview
Cíl studie:
Léky s vazoaktivními účinky jsou při kardiopulmonální resuscitaci používány pro zlepšení perfuze vitálně důležitých orgánů. Cílem studie provedené na prasečím modelu fibrilace komor (VF) bylo porovnat hemodynamické účinky synergicky působícího terlipresinu s adrenalinem vůči samotnému adrenalinu.
Typ studie:
Randomizovaná, dvojitě slepá, placebem kontrolovaná, experimentální studie.
Typ pracoviště:
Klinika anesteziologie, resuscitace a intenzivní medicíny Fakultní nemocnice; Centrum pokročilých studií Fakulty vojenského zdravotnictví.
Materiál a metoda:
Čtrnáct prasat domácích bylo náhodně rozděleno do dvou skupin, ADR (n = 7) a TER (n = 7). VF byla navozena prostřednictvím intrakardiální stimulační elektrody. Po pěti minutách neléčené zástavy oběhu byla zahájena desetiminutová resuscitace samotnými kompresemi hrudníku, po níž následovala rozšířená neodkladná resuscitace. Ve skupině TER byl s první dávkou adrenalinu aplikován terlipresin v dávce 30 μg . kg-1 a ve skupině ADR placebo. Koronární (CorPP) a mozkový (CPP) perfuzní tlak byly počítány z monitorovaných tlaků v pravé síni, aortě a z hodnot nitrolebního tlaku. Data byla zpracována metodou ANOVA pro opakovaná měření a pomocí Fisherova LSD post hoc testu.
Výsledky:
Terlipresin v kombinaci s adrenalinem udržel CorPP nad hodnotou 10 mm Hg o 17,7 minuty déle než samotný adrenalin (p = 0,003). CorPP (průměr ± SD) měřený v čase 35, 45 a 55 minut od vzniku VF byl 12,2 ± 4,0, 11,0 ± 6,2 a 9,6 ± 4,5 mm Hg ve skupině TER, na rozdíl od 5,8 ± 3,8, 0,6 ± 4,9 a -1,0 ± 4,5 mm Hg ve skupině ADR (p = 0,03, < 0,001 a < 0,001). CPP měřený ve stejných časech byl ve skupině TER 23,0 ± 7,2, 20,4 ± 6,9 a 23,1 ± 6,7 mm Hg, zatímco ve skupině ADR pouze 13,3 ± 6,5, 6,2 ± 5,3 a 5,6 ± 6,5 mm Hg (p = 0,01, < 0,001 a < 0,001).
Závěr:
Terlipresin aplikovaný při kardiopulmonální resuscitaci s první dávkou adrenalinu významně zvýšil mozkový a koronární perfuzní tlak oproti samotnému adrenalinu, který při resuscitaci nezabránil těžké refrakterní hypoperfuzi.
Klíčová slova:
kardiopulmonální resuscitace – zástava oběhu – fibrilace komor – terapie – terlipresin – mozkový perfuzní tlak – koronární perfuzní tlak
Úvod
Výsledky léčby nemocných s mimonemocniční náhlou zástavou oběhu (NZO) stále nejsou zcela uspokojivé [1]. Již od počátků moderní kardiopulmonální resuscitace (KPR) v 60. letech minulého století jsou při NZO používány léky s vazopresorickými účinky [2]. Nepřímá srdeční masáž generuje pouze 25–30 % normálního srdečního výdeje, proto je cílem jejich podání především zvýšit diastolický tlak v aortě, a dosáhnout tak lepšího průtoku krve vitálně důležitými orgány při prováděné srdeční masáži [3]. Koronární perfuzní tlak (CorPP) při KPR predikuje pravděpodobnost úspěšné defibrilace a návrat spontánního oběhu (ROSC, return of spontaneous circulation), zatímco mozkový perfuzní tlak (CPP) ovlivňuje rozsah ischemického poškození mozku [4, 5].
Evropská resuscitační rada (ERC, European Resuscitation Council) doporučuje při KPR podání adrenalinu v opakovaných dávkách, ačkoliv neexistuje žádná klinická studie splňující kritéria „evidence based medicine“, která by prokázala, že tento lék zvyšuje pravděpodobnost dlouhodobého přežití NZO [6]. Nejčastěji používaným alternativním vazopresorem je neadrenergní hormon vazopresin [8-arginin vasopresin], který však není v injekční aplikační formě v Evropě běžně dostupný [7–10]. Některé recentní práce prokázaly příznivý efekt na odvrácení závažné hypotenze během KPR rovněž u terlipresinu [triglycyl-lyzin-vasopresinu], který je syntetickým analogem vazopresinu [11–16]. Ačkoliv terlipresin patří mezi látky se silnými vazokonstrikčními účinky, jeho potenciální úloha v léčbě nejčastější příčiny mimonemocniční NZO, fibrilace komor, dosud nebyla systematicky zkoumána [17].
Cílem studie TERCA (Terlipresin in Cardiac Arrest) bylo na prasečím modelu navozené fibrilace komor porovnat účinky terlipresinu s adrenalinem vůči placebu s adrenalinem na mozkový (CPP) a koronární perfuzní tlak (CorPP) v průběhu KPR.
Soubor a metoda
Prospektivní, randomizovaná, dvojitě slepá, placebem kontrolovaná experimentální studie byla provedena na čtrnácti zdravých samicích prasete domácího (Sus scrofa f. domestica) o hmotnosti 30–35 kg (32,0 ± 1,8 kg). Experiment byl realizován na operačním sále vivária Fakulty vojenského zdravotnictví Univerzity obrany. Protokol studie byl schválen etickou komisí Univerzity obrany v Brně, Fakulty vojenského zdravotnictví v Hradci Králové a Resortní komisí pro ochranu zvířat Ministerstva obrany ČR v Praze. Zvířata byla před pokusem ponechána přes noc nalačno, ale měla zajištěný přístup k vodě. Veškerá instrumentace byla prováděna v celkové anestezii.
Příprava experimentálních zvířat
Anestezie byla zahájena intramuskulární injekcí azaperonu [neuroleptikum] (2 mg. kg-1; Jannsen Pharmaceutica, Beerse, Belgie), atropinu (0,02 mg . kg-1; Hoechst-Biotika, Martin, Slovensko) a ketaminu (20 mg . kg-1; Spofa AS, Praha, Česká republika) přibližně 30 minut před intubací. Po úvodu do anestezie byla zvířata umístěna na zádovou desku resuscitačního přístroje AutoPulse Model 100 (Zoll Medical Corp., Chelmsford, MA, USA) a do obou ušních žil byl zaveden periferní žilní katétr 18 G pro podávání léků a tekutin. Kontinuálně bylo monitorováno EKG. Tracheální intubace byla provedena při spontánní ventilaci rourkou s těsnicí manžetou (velikost 7,0 ID; SIMS Portex sro, Kent, Velká Británie). Během zajišťování dýchacích cest byla anestezie doplněna podle potřeby nitrožilní aplikací thiopentalu (1–3 mg . kg-1; ICN Czech Pharma, Praha, Česká republika). Po intubaci a napojení na ventilátor Siemens-Elema, Model SV 900C (Siemens-Elema AB, Solna, Švédsko) byla zahájena umělá plicní ventilace (19 dechů za minutu s FiO2 0,4). Cílem ventilace bylo udržení normokapnie (EtCO2 35–40 mm Hg).
Udržování anestezie bylo zajištěno kontinuální aplikací midazolamu (0,3 mg . kg-1 . hod-1; Roche, Praha, Česká republika), fentanylu (5–20 μg . kg-1 . hod-1; Torrex Chiesi Pharma, Vídeň, Rakousko) a pancuronia [myorelaxans] (0,5 mg . kg-1 . hod-1; Organon, Oss, Nizozemí) v lineárních dávkovačích. Hloubka anestezie byla posuzována podle hodnoty tepové frekvence a krevního tlaku. Infuze Ringerfundinu (B. Braun, Melsungen, Německo, 10 ml . kg-1 . hod-1) sloužila k úhradě ztrát tekutin a udržování pozitivního centrálního žilního tlaku (CVP).
Vitální funkce byly monitorovány pomocí dvou monitorů Datex-Ohmeda S/5 (Datex-Ohmeda Instrumentarium Corp., Helsinki, Finsko) a defibrilátoru Zoll M Series (Zoll Medical Corp., Chelmsford, MA, USA). V případě potřeby byl k udržení tělesné teploty v rozmezí 37,5–38,5 °C používán ohřívač Warm Touch Model 5100 (Mallinckrodt Inc, Cincinnati, OH, USA).
Monitorování
Po indukci celkové anestezie byla provedena kanylace hrudní aorty cestou krční tepny pomocí katétru 7 F 200 mm Certofix Duo (B. Braun Melsungen AG, Melsungen, Německo) za účelem monitorování aortálního krevního tlaku a odebírání vzorků arteriální krve. Sheath Intro-Flex 8,5F (Edwards Lifesciences LLC, Irvine, CA, USA) byl zaveden přes vnitřní jugulární žílu do horní duté žíly k měření tlaku v pravé síni (RAP), který byl pro účely tohoto experimentu považován za centrální žilní tlak (CVP). Průchodnost vstupů byla udržována infuzí fyziologického roztoku s heparinem (5 IU . ml-1) rychlostí 3 ml . hod-1. Elektronické snímače tlaku Gabarith PMSET (Becton Dickinson, Franklin Lakes, NJ, USA) byly umístěny na úrovni pravé srdeční síně. CorPP levé komory byl definován jako tlakový rozdíl mezi tlakem v aortě a pravou síní během diastoly a byl kalkulován z měřených hodnot diastolického aortálního tlaku (DAP) a tlaku v pravé síni (RAP) podle vzorce CorPP = DAP – RAP.
Kraniotomie k zavedení čidla pro měření nitrolebního tlaku (ICP) byla provedena v horní části frontální kosti, asi 10 mm paramediánně k sagitálnímu švu [18]. Intraparenchymové ICP čidlo Codman Microsensor (Codman, Johnson&Johnson, Raynham, MA, USA) bylo zavedeno do čelního laloku do hloubky 20 mm a vyvedeno tunelizovaným kanálem v podkoží (obr. 1). Hodnota CPP byla kalkulována z hodnot středního aortálního tlaku (MAP), nitrolebního tlaku (ICP) a centrálního žilního tlaku (CVP) podle vzorce:
CPP = MAP – (ICP + CVP) [19].
Veškeré hodnoty byly zaznamenávány v minutových intervalech.
Po ukončení instrumentace následovala stabilizace stavu po dobu 45 minut (obr. 2).
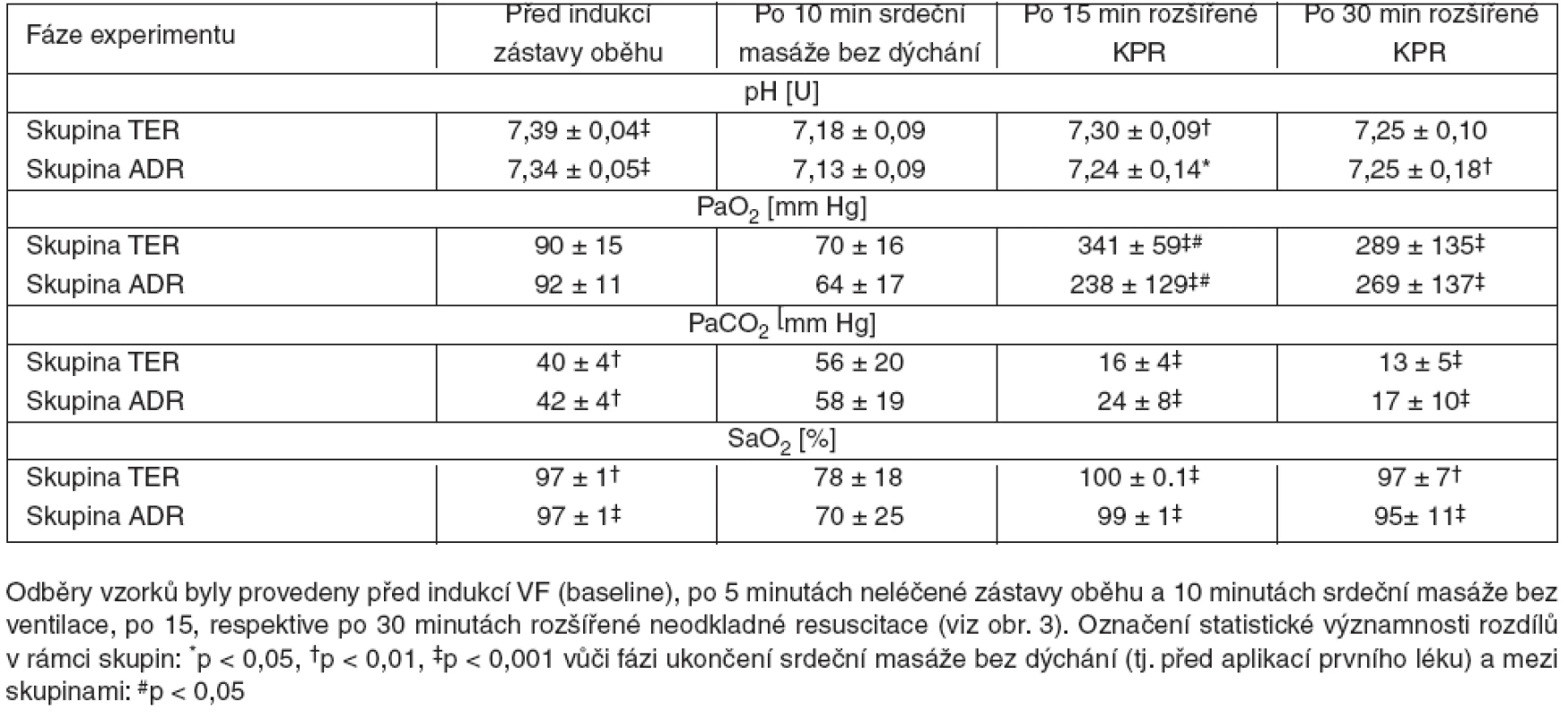
Vzorky k vyšetření arteriálních krevních plynů (ABG, arterial blood gas) byly odebírány po 15 minutách. Sledovány byly hodnoty pH, parciální tlaky kyslíku a oxidu uhličitého (PaO2 a PaCO2), saturace hemoglobinu kyslíkem (SaO2) a deficit bazí (BE, base excess). Krevní plyny byly vyšetřovány v analyzátoru AVL Omni 6 (Roche Diagnostics, Graz, Rakousko) s korekcí výsledků podle tělesné teploty.
Experimentální protokol
Časový průběh experimentu je zobrazen na obrázku 3. Pět minut před indukcí zástavy oběhu (T = -5) byl aplikován heparin v dávce 5000 IU k prevenci vzniku intrakardiálních trombů, bylo ukončeno podávání všech anestetik a zahájena ventilace vzduchem bez příměsi kyslíku. Zároveň byly zaznamenány výchozí hodnoty sledovaných oběhových parametrů a ICP (baseline).
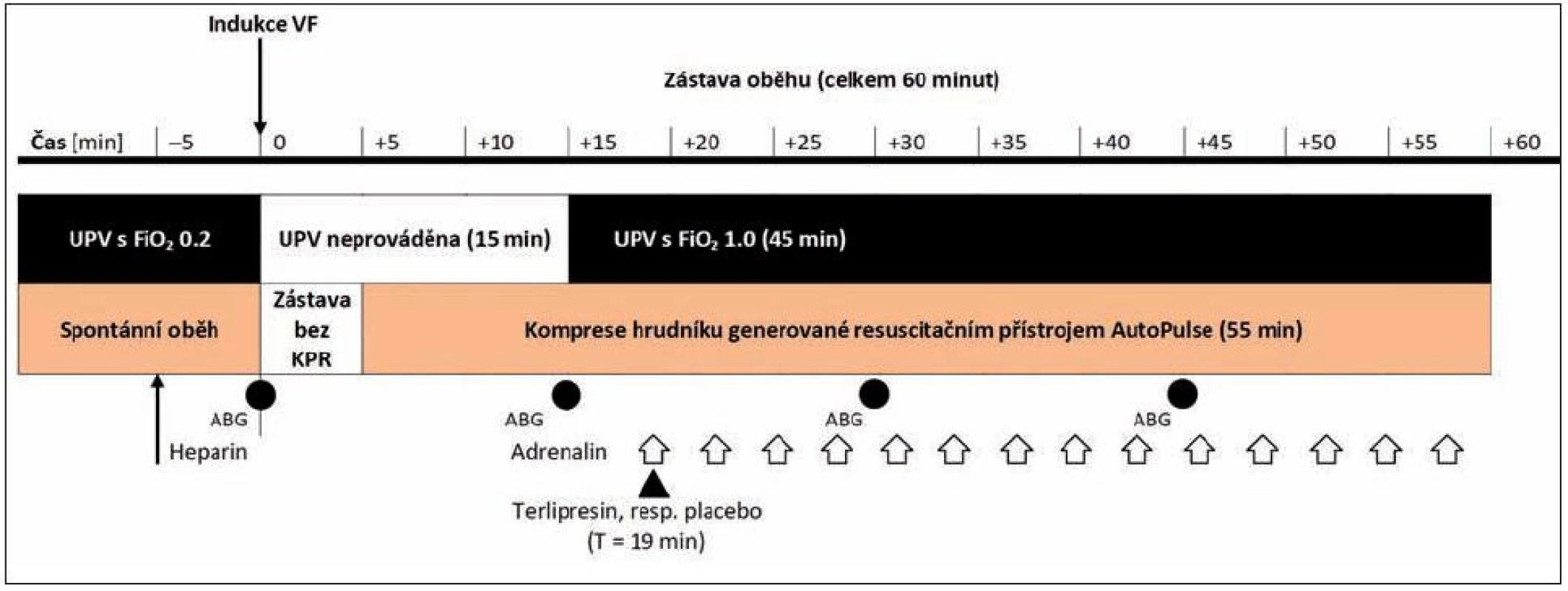
Fibrilace komor byla navozena střídavým proudem o napětí 5–10 V prostřednictvím intrakardiální bipolární stimulační elektrody VascoStim (Arrow Int. Europe, Tongeren, Belgie) zavedené cestou centrálního žilního katétru do hrotu pravé srdeční komory. Čas zástavy oběhu (T = 0) byl definován jako čas vyrovnání aortálního a centrálního žilního tlaku při přítomnosti fibrilace komor nebo asystolie na monitoru.
Po pěti minutách neléčené zástavy oběhu (T = 5) byla zahájena nepřímá srdeční masáž frekvencí 80/min pomocí mechanického resuscitačního přístroje AutoPulse. Přístroj po úvodní kalibraci zajišťuje konstantní 20% redukci předozadního průměru hrudníku [20].
Po 15 minutách od zástavy oběhu (T = 15) byla zahájena rozšířená neodkladná resuscitace včetně umělé plicní ventilace (FiO2 = 1,0, VT 8 ml . kg-1, RR 10/min), která pokračovala po dobu dalších 45 minut.
Zvířata byla randomizována do dvou shodných skupin TER (n = 7) a ADR (n = 7). Randomizační schéma bylo generováno webovou aplikací ‘Randomization.com’ (ke stažení na http://www.randomization.com) metodou náhodných permutovaných bloků o velikosti 6 a 8. Léky byly dodávány do vivária naředěné ve fyziologickém roztoku v očíslovaných 10 ml injekčních stříkačkách. Přípravu stříkaček provedl personál, který se experimentu přímo nezúčastnil. Randomizační schéma nebylo personálu vivária k dispozici do dokončení statistického zpracování dat.
První vazopresor byl v obou skupinách podán teprve po uplynutí 19 minut od indukce VF (T = 19). Ve skupině TER byl spolu s první dávkou adrenalinu (Zentiva, Praha, Česká republika) aplikován terlipresin (Ferring-Léčiva, Jesenice u Prahy, Česká republika), obojí v dávce 30 μg . μkg-1. Ve skupině ADR bylo s první dávkou adrenalinu podáno placebo (10 ml fyziologického roztoku). Všechny léky byly podávány nitrožilně cestou periferního žilního vstupu na uchu a propláchnuty roztokem Ringerfundinu. V obou skupinách byla stejná dávka adrenalinu opakována každé 3 minuty.
Záznam vybraných oběhových parametrů a ICP byl prováděn v pravidelných minutových intervalech. Odběry arteriální krve k vyšetření ABG byly provedeny v čase T = -1 (baseline), T = 15 (po 5minutovém období neléčené zástavy a 10minutovém období resuscitace bez ventilace), T = 30 a T = 45 (po 15, respektive 30 minutách probíhající rozšířené neodkladné resuscitace).
Experiment byl ukončen po 60 minutách trvání zástavy oběhu. Pro případ ROSC byl k dispozici veterinární preparát T 61 (Intervet International, Boxmeer, Nizozemí) k bezexcitační eutanazii zvířat.
Všechna zvířata byla pitvána k ověření správné polohy katétrů a posouzení rozsahu poranění hrudníku a vnitřních orgánů po mechanické srdeční masáži, zejména případné krevní ztráty s možným vlivem na monitorované hodnoty.
Statistické zpracování dat
Statistické zpracování dat bylo provedeno pomocí softwaru Statistica 9.0 (StatSoft Inc, Tulsa, OK, USA) ve spolupráci s Oddělením výpočetní techniky Lékařské fakulty v Hradci Králové. Testovanou nulovou hypotézou bylo tvrzení, že terlipresin přidaný k první dávce adrenalinu během KPR nezmění CorPP a CPP ve srovnání s placebem. Kolmogorovův-Smirnovův test byl použit k ověření Gaussova rozdělení dat. Rozdíly uvnitř a mezi skupinami byly analyzovány metodou oboustranné analýzy rozptylu (ANOVA) pro opakovaná měření. Fisherův LSD (least significant diference) test byl použit k testování post hoc a k identifikaci rozdílů mezi skupinami. Základní charakteristiky souboru a časové intervaly byly analyzovány pomocí dvouvzorkového t-testu pro kontinuální proměnné. Ke srovnávání proporcí byl používán exaktní Fisherův test. Všechny údaje jsou vyjadřovány jako průměr ± směrodatná odchylka (SD). Za statisticky významnou byla považována hodnota p < 0,05.
Výsledky
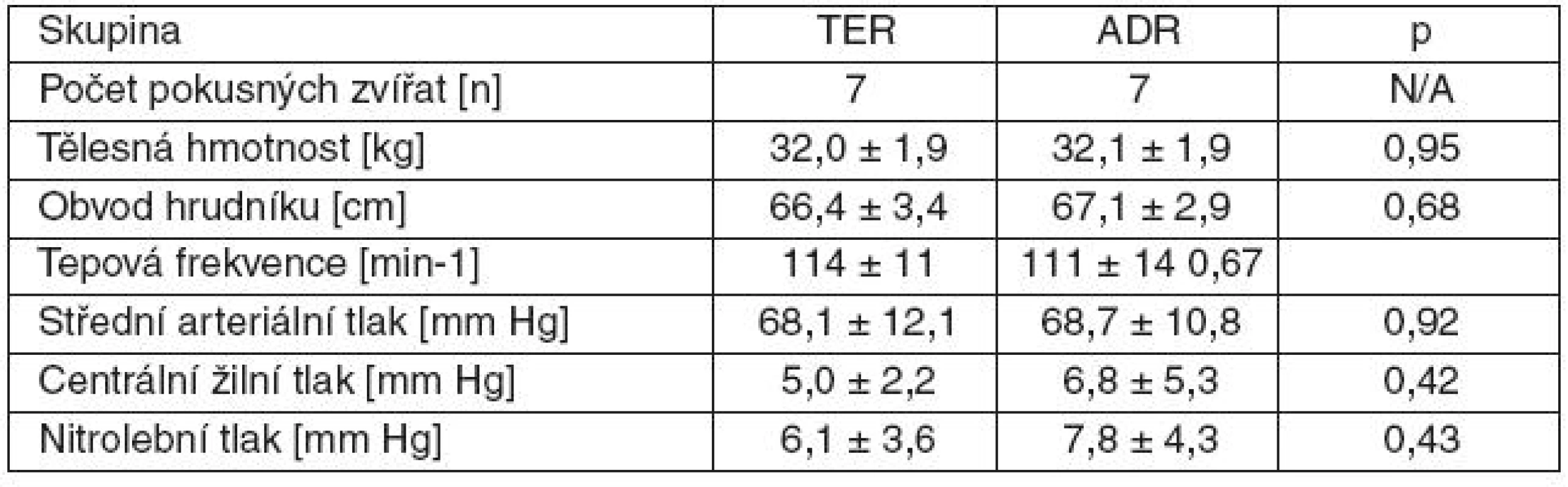
Před indukcí zástavy oběhu nebyly zjištěny rozdíly v anatomických parametrech, ani ve vybraných hodnotách fyziologických funkcí mezi skupinami TER a ADR (tab. 1).
Po zahájení srdeční masáže (T = 15) došlo ke statisticky významnému vzestupu CorPP i CPP ve srovnání s obdobím neléčené fibrilace komor (T = 5) u všech pokusných zvířat (9,5 ± 5,5 vs. -1,3 ± 1,0 mm Hg pro CorPP, respektive 20,9 ± 7,3 vs. -13,5 ± 3,8 mm Hg pro CPP, p < 0,001). Na konci fáze resuscitace bez umělého dýchání, tzn. před zahájením rozšířené neodkladné resuscitace, nebyly mezi skupinami TER a ADR zjištěny žádné rozdíly v celkové dávce podaných léků, v hodnotách nitrolebního tlaku, arteriálního ani centrálního žilního tlaku, ani ve výsledcích vyšetření krevních plynů.
Rozdílný vazokonstrikční účinek obou léků podávaných během resuscitace vyjadřují změny systolického tlaku v aortě (graf 1). Po aplikaci první dávky vazopresoru došlo v obou skupinách okamžitě k vzestupu CorPP, ale jeho hodnoty zůstaly po celou dobu experimentu vyšší ve skupině TER ve srovnání se skupinou ADR. V časech 35, 45 a 55 minut od začátku fibrilace komor byl CorPP 12 ± 4, 11 ± 6 a 10 ± 5 mm Hg ve skupině TER na rozdíl od 6 ± 4, 1 ± 5 a -1 ± 4 mm Hg ve skupině ADR (p = 0,03, < 0,001 a < 0,001). Přidání terlipresinu k první dávce adrenalinu umožnilo udržet CorPP na hodnotě vyšší než 10 mm Hg, respektive CPP vyšší než 20 mm Hg, po významně delší dobu než při léčbě adrenalinem s placebem (27,9 ± 11,0 vs. 10,1 ± 5,8 minut pro CorPP, p = 0,003; 3,6 ± 2,5 vs. 0,1 ± 0,4 min pro CPP, p = 0,004). V čase 20 minut od prvního podání léku převýšil CorPP hodnotu 10 mm Hg u 6 ze 7 zvířat (85,7%) ve skupině TER, zatímco samotný adrenalin nebyl schopen dosáhnout této hodnoty u žádného zvířete ve skupině ADR (P = 0,005) (graf 2).


Mozkový perfuzní tlak (CPP) v čase 35, 45 a 55 minut po vzniku zástavy oběhu byl ve skupině TER 23 ± 7, 20 ± 7 a 23 ± 7 mm Hg a ve skupině ADR 13 ± 7, 6 ± 5 a 6 ± 7 mm Hg (p = 0,01, < 0,001 a < 0,001). Hodnota CPP byla signifikantně vyšší ve skupině TER ve srovnání se skupinou ADR a perfuzní tlak zde převyšoval 20 mm Hg až do velmi pozdní fáze KPR (viz graf 2).
Analýza krevních plynů neprokázala žádné statisticky významné rozdíly mezi skupinami. Hodnota pH byla v době neléčené fibrilace komor i v období resuscitace bez ventilace nižší než 7,2 považovaná za hranici účinnosti katecholaminů. Ke zvýšení pH v obou skupinách došlo až po zahájení rozšířené neodkladné resuscitace s ventilací (p = 0,01 a p = 0,02 pro T = 30 vs. T = 15). Mezi skupinami nebyly zjištěny žádné rozdíly pH v časech T = 30 a T = 45 (7,30 vs. 7,24, P = 0,26, respektive 7,25 vs. 7,25, p = 0,92). U prasat léčených terlipresinem byla dosažena vyšší hodnota PaO2 v období 10 minut po podání prvního léku ve srovnání se zvířaty léčených pouze adrenalinem (341 vs. 238 mm Hg, p = 0,03) (tab. 2).
K obnovení spontánního oběhu (ROSC) nedošlo u žádného zvířete. U všech prasat došlo ke změně srdečního rytmu v asystolii ještě před ukončením pokusu. Prognosticky příznivější fibrilace komor s možností léčby elektrickým výbojem však trvala ve skupině TER 47,4 ± 8,9 minut oproti 40,3 ± 11,4 minut ve skupině ADR (p = 0,22).
Pitva potvrdila u všech zvířat správnou polohu katétrů. U dvou zvířat ze 14 (14,3%) byla nalezena nezávažná poranění hrudníku: 1krát zlomeniny žeber a jednostranný hemotorax s krevní ztrátou odhadnutou na méně než 100 ml ve skupině TER, 1krát zlomeniny žeber ve skupině ADR.
Diskuse
Podání terlipresinu s první dávkou adrenalinu v experimentálním, časově realistickém modelu fibrilace komor zvýšilo CorPP i CPP. Vyšší perfuzní tlaky vitálně důležitých orgánů byly udržovány až do pozdní fáze KPR při celkovém trvání zástavy oběhu 60 minut. Dalším příznivým důsledkem podání terlipresinu bylo dosažení lepší oxygenace organismu a delšího trvání fibrilace komor před změnou srdečního rytmu v asystolii.
Terlipresin je syntetickým analogem vazopresinu s velmi podobným farmakologickým profilem, ale prodlouženým účinkem [10, 17]. Deficit přirozeného hormonu vazopresinu v organismu způsobuje při některých kritických stavech, např. při septickém šoku nebo u nemocných po kardiochirurgických operacích, závažnou hypotenzi [17, 21]. Možnost využití vazopresinu v léčbě NZO byla akceptována již před vydáním prvních ucelených doporučených postupů (guidelines) pro KPR v roce 2000 [22]. Vazopresin potencuje účinek adrenergních látek prostřednictvím stimulace V1 receptorů v hladké svalovině cév [23, 24]. Kombinace vazopresinu s adrenalinem při srovnání se samotným adrenalinem však ve francouzské multicentrické studii publikované v roce 2008 nevedla k lepšímu výsledku resuscitací [9]. Z důvodu absence důkazů o jeho prokazatelném přínosu pro pacienty, ERC na rozdíl od American Heart Association nikdy nepřijala vazopresin jako lepší vazopresor pro léčbu NZO a jeho rutinní používání nedoporučila [6].
Nedávno bylo zjištěno, že chemicky podobný terlipresin není jen prekurzorem, který se v organismu metabolizuje na vysoce účinný lysin-vazopresin, ale je velmi rychle působícím vazokonstriktorem sám o sobě [10, 25]. Do současné doby bylo publikováno jen několik případů dokumentujících jeho úspěšné použití v léčbě NZO ve specifických situacích, např. při intoxikaci amitriptylinem a diklofenakem [11–16]. Injekce terlipresinu (1 mg IV) způsobila vzestup krevního tlaku i přes těžkou acidózu (pH 7,03) a vedla k ROSC po dlouhotrvající KPR refrakterní na léčbu adrenalinem [11]. V experimentálním modelu asfyktické srdeční zástavy vedlo podání terlipresinu v dávce 20 μg. kg-1 s adrenalinem k častějšímu dosažení ROSC [15]. Španělská studie z prostředí dětské intenzivní péče dokumentuje použití terlipresinu u sedmi dětí ve věku do 5 let s celkem osmi epizodami srdeční zástavy nereagujícími na konvenční léčbu. ROSC bylo dosaženo po přidání terlipresinu v šesti případech [13]. Zatím však nejsou k dispozici žádné informace o jeho možném využití při fibrilaci komor, která způsobuje nejvíce případů NZO v klinické praxi [1].
Současná guidelines doporučují pokračovat v KPR po dobu trvání defibrilovatelného rytmu a v některých případech jsou již dnes nemocní transportováni za kontinuální resuscitace do katetrizační laboratoře. Udržení dostatečného krevního tlaku po celou dobu KPR je však velmi obtížné [6]. S cílem zlepšit perfuzi orgánů, které rozhodují o klinickém výsledku, jsou proto rutinně používány opakované dávky adrenalinu. Ani pro adrenalin však neexistují důkazy prokazující jeho přínos na dlouhodobé přežití [5, 6, 26, 27]. V našem experimentu bylo zjištěno, že adrenalin v kombinaci s placebem nezabránil rozvoji těžké hypotenze a během déletrvající KPR nedokázal udržet přijatelný krevní tlak.
Někteří autoři byli kritizováni, že design svých experimentálních studií nepřizpůsobili podmínkám mimonemocniční NZO [28, 29]. Rozpor mezi výsledky experimentů a klinických studií je přisuzován zejména nerespektování reálných časů, které provázejí pacienty s NZO mimo nemocnici včetně prodlevy do přivolání pomoci, neochoty laiků provádět resuscitaci nebo umělé dýchání, dojezdového času záchranné služby, doby do zajištění žilního vstupu apod. Experimentální modely, které neodpovídají skutečnosti, mohou být příčinou selhání mnoha studií a omezené využitelnosti jejich výsledků v praxi. Obvyklá doba do prvního podání léku je v experimentech pouze 9,5 minuty, zatímco v reálných situacích je první lék podán v čase 19,4 minuty od kolapsu [28]. Protokol našeho experimentu jsme proto přizpůsobili reálným časovým intervalům [28]. Po prvních 5 minutách neléčené fibrilace komor následovalo období resuscitace bez umělého dýchání [1]. První lék byl podán v 19. minutě od indukce zástavy, v průběhu tzv. metabolické fáze srdeční zástavy, kdy je účinek adrenalinu již značně omezený. Příčinou je desenzibilizace adrenergních receptorů v důsledku těžké respirační acidózy a globální hypoxie [23, 30]. Výsledky naší studie tento předpoklad podporují. Průměrná hodnota pH byla po 15 minutách trvání fibrilace pouze 7,15 ± 0,09. Za těchto podmínek adrenalin nedokázal zvýšit krevní tlak navzdory prováděným přístrojovým kompresím hrudníku. Terlipresin na druhou stranu udržel CorPP po významně delší dobu nad 10 mm Hg, což je u prasečího modelu považováno za optimum k dosažení ROSC [31]. Práce rovněž potvrdila dříve publikované zjištění, že se hodnota CorPP během KPR dramaticky snižuje z důvodu poklesu arteriálního tonu a vzestupu tlaku v pravé srdeční síni [32]. Negativní hodnoty CorPP, částečně dané způsobem jeho výpočtu i mechanikou přístrojových kompresí hrudníku, lze hodnotit jako úplnou absenci perfuze.
Pro správnou interpretaci výsledků naší práce je nutné uvést několik limitací. Ve studii TERCA nebyla hodnocena úspěšnost defibrilace ani sledováno dlouhodobé přežití, což bude při opakování studie s podobným designem nezbytné. Naší snahou bylo sledování účinku dvou způsobů farmakologické léčby po celou dobu trvání experimentu (60 minut), zejména pak v jeho pozdní fázi, kdy je ovlivnění krevního tlaku obtížné. Navzdory fibrilaci komor proto nebyla prováděna defibrilace ani podávána antiarytmika. Obnovení spontánního oběhu nebylo cílem studie. Za druhé, odlišnost vazopresinových receptorů u prasat (lysin-vazopresin) a u člověka (arginin-vazopresin) mohou vést k odlišným závěrům podobné studie u lidí. Za třetí, ve studii byly hodnoceny pouze tlakové veličiny, nikoliv průtok jednotlivými orgány. Experimenty však ukazují, že průtok krve myokardem na úrovni mikrocirkulace, která je zodpovědná za dodávku kyslíku do tkání, úzce koreluje s hodnotou CorPP [33]. Za čtvrté, nebyla sledována závislost dávka-účinek, protože pro terlipresin v této indikaci neexistuje žádné doporučené dávkování. Při studiích u dětí bylo používáno dávkování v rozmezí 10–20 ug . kg-1 [16]. Za páté, přístrojová srdeční masáž nahradila manuální, aby bylo dosaženo konstantní hloubky kompresí u všech zkoumaných zvířat. AutoPulse nebyl velikostně přizpůsoben a dosahované vzestupy nitrohrudního tlaku mohly ovlivnit sledované parametry. Ačkoliv způsob provádění kompresí mohl vést k nižším absolutním hodnotám perfuzních tlaků, na srovnání obou způsobů léčby pravděpodobně neměl vliv. Pro výpočet CPP bylo nutné použít modifikovaný vzorec, protože hodnota ICP byla u některých zvířat během prováděných kompresí hrudníku vyšší než hodnota CVP a naopak [19]. Z metodologických důvodů proto nebylo možné pro kalkulaci CPP použít obvyklejší vzorce MAP-RAP nebo MAP-ICP v závislosti na vyšší hodnotě, protože hodnoty zjištěné u jednotlivých zvířat by nebyly vzájemně srovnatelné. Pro porovnání obou skupin tento fakt neměl vliv, ale reálné hodnoty CPP by byly u člověka pravděpodobně vyšší.
Výsledky léčby nemocných s mimonemocniční NZO jsou považovány za klíčový ukazatel kvality přednemocniční neodkladné péče i následné resuscitační péče v nemocnici. Hledání alternativní farmakologické podpory je pro současnou resuscitační medicínu výzvou, protože je jednou z cest k možnému zlepšení léčby NZO. Terlipresin je velmi účinným vazopresorem používaným obvykle v léčbě krvácení z jícnových varixů nebo septického šoku nereagujícího na katecholaminy [34, 35]. Hlavními výhodami terlipresinu je jeho dlouhotrvající účinek, který přes abnormální metabolické podmínky nevyžaduje opakování dávky, a dostupnost ve většině zemí na rozdíl od vazopresinu. Možné zhoršení myokardiální dysfunkce po srdeční zástavě a další nežádoucí účinky, zejména ischemického charakteru, zatím nejsou ve vztahu k jeho použití při KPR známé.
Závěr
Podání terlipresinu v kombinaci s první dávkou adrenalinu vedlo na použitém experimentálním modelu zástavy oběhu k dosažení vyššího koronárního a mozkového perfuzního tlaku ve srovnání se samotným adrenalinem a zajistilo udržení perfuzních tlaků na vyšších hodnotách až do pozdní fáze prováděné resuscitace.
Poděkování: Bc. Dana Kodejšková a Bc. Jitka Suchánková (KARIM, Fakultní nemocnice Hradec Králové) se podílely se na přípravě materiálu a poskytování ošetřovatelské péče v průběhu experimentu. Na statistickém zpracování dat spolupracovala RNDr. Eva Čermáková (Oddělení výpočetní techniky LF v Hradci Králové). Přípravu operačního sálu a experimentálních zvířat zajistil tým MVDr. Stanislava Špeldy (vivárium Fakulty vojenského zdravotnictví Hradec Králové).
Studie TERCA byla podpořena grantem IGA MZ ČR NS10383-2/2009 a výzkumným záměrem MZO 00179906.
Předběžné výsledky byly prezentovány formou posteru na 29th International Symposium on Intensive Care and Emergency Medicine v Bruselu (Belgie). Finální výsledky byly publikovány v časopise Signa Vitae: Truhlář, A. et al. Terlipressin/adrenaline is better than adrenaline alone in a porcine model of prolonged ventricular fibrillation: a randomized controlled study. Signa Vitae, 2011 (v tisku). Části původního textu jsou v českém jazyce zveřejněny se souhlasem redakce a vydavatele časopisu Signa Vitae.
Došlo dne 7. 7. 2011.
Přijato dne 11. 11. 2011.
Adresa pro korespondenci:
MUDr. Anatolij Truhlář
Klinika anesteziologie, resuscitace a intenzivní medicíny
Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: anatolij.truhlar@gmail.com
Sources
1. Nolan, J. P., Soar, J., Zideman, D. A., Biarent, D., Bossaert, L. L., Deakin, C. et al., on behalf of the European Resuscitation Council Guidelines Writing Group European Resuscitation Council Guidelines for Resuscitation 2010. Section 1. Executive summary. Resuscitation, 2010, 81, p. 1219–1276.
2. Safar, P. Community-wide cardiopulmonary resuscitation. J. Iowa Med. Soc., 1964, 54, p. 629–635.
3. Del Guercio, L. M. R., Coomaraswany, R., State, D. Cardiac output and other hemodynamic variables during external massage in man. N. Engl. J. Med., 1963, 269, p. 1398.
4. Paradis, N. A., Martin, G. B., Rivers, E. P., Goetting, M. G., Appleton, T. J., Feingold, M., Nowak, R. M. Coronary perfusion pressure and the return of spontaneous circulation in human cardiopulmonary resuscitation. JAMA, 1990, 263, p. 1106–1113.
5. Ebmeyer, U., Katz, L. M., Guerci, A. D. Methods to improve cerebral blood flow and neurological outcome after cardiac arrest. In: Paradis, N. A., Halperin, H. R., Kern, K. B., Wenzel, V., Chamberlain, D. A. Cardiac arrest: The science and practice of resuscitation medicine. 2nd ed. New York: Cambridge University Press, 2007, p. 389–394.
6. Deakin, C. D., Nolan, J. P., Soar, J., Sunde, K., Koster, R. W., Smith, G. B., Perkins, G. D. European Resuscitation Council guidelines for resuscitation 2010. Section 4. Adult advanced life support. Resuscitation, 2010, 81, p. 1305–1352.
7. Lindner, K. H., Dirks, B., Strohmenger, H. U., Prengel, A. W., Lindner, A. W., Lurie, K. G. A randomised comparison of epinephrine and vasopressin in patients with out-of-hospital ventricular fibrillation. Lancet, 1997, 347, p. 535–537.
8. Wenzel, V., Krismer, A. C., Arntz, H. R., Sitter, H., Stadlbauer, K. H., Lindner, K. H. A comparison of vasopressin and epinephrine for out-of-hospital cardiopulmonary resuscitation. N. Engl. J. Med., 2004, 350, p. 105–113.
9. Gueugniaud, P. Y., David, J. S., Chanzy, E., Hubert, H., Dubien, P. Y., Mauriaucourt, P. et al. Vasopressin and epinephrine vs. epinephrine alone in cardiopulmonary resuscitation. N. Engl. J. Med., 2008, 359, p. 21–30.
10. Leone, M. Terlipressin or Europressin? Crit. Care, 2009, 13, p. 192.
11. Zuidema, X., Dünser, M. W., Wenzel, V., Rozendaal, F. W., de Jager, C. P. Terlipressin as an adjunct vasopressor in refractory hypotension after tricyclic antidepressant intoxication. Resuscitation, 2007, 72, p. 319–323.
12. Rocq, N., Favier, J. C., Plancade, D., Steiner, T., Mertes, P. M. Successful use of terlipressin in post-cardiac arrest resuscitation after an epinephrine-resistant anaphylactic shock to suxamethonium. Anesthesiology, 2007, 107, p. 166–167.
13. Matok, I., Vardi, A., Augarten, A., Efrati, O., Leibovitch, L., Rubinshtein, M., Paret, G. Beneficial effects of terlipressin in prolonged pediatric cardiopulmonary resuscitation: a case series. Crit. Care Med., 2007, 35, p. 1161–1164.
14. López-Herce, J., Gil-Antón, J., Morteruel, E., Carrillo, A., Rodríguez-Núñez, A. Terlipressin for paediatric cardiac arrest refractory to advanced resuscitation. Resuscitation, 2008, 77, p. S32.
15. Fernández, B., Mencía, S., López-Herce, J., Sánchez, C., Urbano, J., Rodríguez-Núñez, A. Resuscitation from post-asphyxial cardiac arrest with adrenaline and terlipressin in a paediatric animal model. Resuscitation, 2008, 77, p. S32.
16. Gil-Antón, J., López-Herce, J., Morteruel, E., Carrillo, A., Rodríguez-Núñez, A. Pediatric cardiac arrest refractory to advanced life support: Is there a role for terlipressin? Pediatr. Crit. Care Med., 2010, 11, p. 139–141.
17. Kam, P. C. A., Williams, S., Yoong, F. F. Y. Vasopressin and terlipressin: pharmacology and its clinical relevance. Anaesthesia, 2004, 59, p. 993–1001.
18. Kaiser, G. M., Frühauf, N. R. Method of intracranial pressure monitoring and cerebrospinal fluid sampling in swine. Lab. Anim., 2007, 41, p. 80–85.
19. Bricker, S. (Raised) Intracranial pressure. In Bricker, S. The Anaesthesia Science Viva Book, 2nd ed. Cambridge: Cambridge University Press, 2005, p. 124–128.
20. Krep, H., Mamier, M., Breil, M., Heister, U., Fischer, M., Hoeft, A. Out-of-hospital cardiopulmonary resuscitation with the AutoPulse system: A prospective observational study with a new load-distributing band chest compression device. Resuscitation, 2007, 73, p. 86–95.
21. Morelli, A., Ertmer, C., Rehberg, S., Lange, M., Orecchioni, A., Cecchini, V. et al. Continuous terlipressin versus vasopressin infusion in septic shock (TERLIVAP): a randomized, controlled pilot study. Crit. Care, 2009, 13, p. R130.
22. Kern, K. B., Halperin, H. R., Field, J. R. New guidelines for cardiopulmonary resuscitation and emergency cardiac care: changes in the management of cardiac arrest. JAMA, 2001, 285, p. 1267–1269.
23. Meybohm, P., Cavus, E., Dörges, V., Steinfath, M., Sibbert, L., Wenzel, V. et al. Revised resuscitation guidelines: adrenaline versus adrenaline/vasopressin in a pig model of cardiopulmonary resuscitation – a randomised, controlled trial. Resuscitation, 2007, 75, p. 380–388.
24. Delmas, A., Leone, M., Rousseau, S., Albanèse, J., Martin, C. Clinical review: Vasopressin and terlipressin in septic shock patients. Crit. Care, 2005, 9, p. 212–222.
25. Ryckwaert, F., Virsolvy, A., Fort, A., Murat, B., Richard, S., Guillon, G., Colson, P. Terlipressin, a provasopressin drug exhibits direct vasoconstrictor properties: consequences on heart perfusion and performance. Crit. Care Med., 2009, 37, p. 876–881.
26. Olasveengen, T. M., Sunde, K., Brunborg, C., Thowsen, J., Steen, P. A., Wik, L. Intravenous drug administration during out-of-hospital cardiac arrest: a randomized trial. JAMA, 2009, 302, p. 2222–2229.
27. Spöhr, F., Wenzel, V., Böttiger, B. W. Thrombolysis and other drugs during cardiopulmonary resuscitation. Curr. Opin. Crit. Care, 2008, 14, p. 292–298.
28. Reynolds, J. C., Rittenberger, J. C., Menegazzi, J. J. Drug administration in animal studies of cardiac arrest does not reflect human clinical experience. Resuscitation, 2007, 74, p. 13–26.
29. Mader, T. J. Prolonged cardiac arrest: a revised model of porcine ventricular fibrillation. Resuscitation, 2008, 76, p. 481–484.
30. Weisfeldt, M. L., Becker, L. B. Resuscitation after cardiac arrest: a 3-phase time-sensitive model. JAMA, 2002, 288, p. 3035–3038.
31. Gazmuri, R. J., Correa, B. M. Cardiovascular function and vascular tone: Physiology for ECC. In: Paradis, N. A., Halperin, H. R., Kern, K. B., Wenzel, V., Chamberlain, D. A. Cardiac arrest: The science and practice of resuscitation medicine. 2nd ed. New York : Cambridge University Press, 2007, p. 395–409.
32. Sharff, J. A., Pantley, G., Noel, E. Effect of time on regional organ perfusion during two methods of cardiopulmonary resuscitation. Ann. Emerg. Med., 1984, 13, p. 649–656.
33. Fries, M., Tang, W., Chang, Y. T., Wang, J., Castillo, C., Weil, M. H. Microvascular blood flow during cardiopulmonary resuscitation is predictive of outcome. Resuscitation, 2006, 71, p. 248–253.
34. Ioannou, G., Doust, J., Rockey, D. C. Terlipressin for acute esophageal variceal hemorrhage. Cochrane Database Syst. Rev., 2003, 1, p. CD002147.
35. Leone, M., Albanèse, J., Delmas, A., Chaabane, W., Garnier, F., Martin, C. Terlipressin in catecholamine-resistant septic shock patients. Shock, 2004, 22, p. 314–319.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2011 Issue 6
-
All articles in this issue
- Fasciální koncept
- Chladit či nechladit? Úskalí zavedení léčebného protokolu terapeutické hypotermie
- Vliv terlipresinu na perfuzi vitálně důležitých orgánů při kardiopulmonální resuscitaci – experimentální studie TERCA (Terlipressin in Cardiac Arrest)
- Ťažký priebeh Stillovej choroby s multiorgánovým zlyhávaním a závažnou pečeňovou dysfunkciou
- Principy umělé plicní ventilace u chronické obstrukční plicní nemoci
- Dvousté výročí J. Y. Simpsona
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Principy umělé plicní ventilace u chronické obstrukční plicní nemoci
- Ťažký priebeh Stillovej choroby s multiorgánovým zlyhávaním a závažnou pečeňovou dysfunkciou
- Fasciální koncept
- Chladit či nechladit? Úskalí zavedení léčebného protokolu terapeutické hypotermie
