Získaná hemofilie A s těžkým průběhem - kazuistika
A severe course of acquired haemophilia A – case report
Circulating anticoagulants are endogenous substances interfering in the coagulation cascade, which may even lead to severe bleeding. In the vast majority of cases, these substances are immunoglobulins, production of which may be induced by the administration of coagulation factor concentrates, e. g. in haemophilia patients. However, they can also be associated with malignant neoplasms, drug interactions and old age. The authors present a case report of an 84-years-old female patient in whom factor VII inhibitor was detected following urological surgery. Although diagnostic tests for anticoagulants were negative prior to surgery, the patient developed coagulation inhibitors afterwards – most probably due to numerous blood transfusions. The patient died on the 5th day in spite of early detection of anticoagulant production and subsequent complex therapy.
Keywords:
case report – coagulation – circulating anticoagulant – factor VIII inhibitor
Authors:
M. Chobola; V. Šrámek; J. Hruda
Authors‘ workplace:
Anesteziologicko-resuscitační klinika, FN u sv. Anny v Brně, Lékařská fakulta Masarykovy Univerzity Brno
Published in:
Anest. intenziv. Med., 23, 2012, č. 2, s. 97-100
Category:
Intesive Care Medicine - Case Report
Overview
Cirkulující antikoagulancia jsou endogenně produkované substance, které zasahují na různých úrovních do procesu krevního srážení, a mohou tak vést i ke klinicky závažnému krvácení. V naprosté většině případů se jedná o imunoglobuliny, které se mohou začít tvořit v souvislosti s transfuzí koncentrátů koagulačních faktorů, např. při léčbě hemofilie. Mohou se však vyskytnout i v jiných případech, často ve spojení s malignitami, lékovými interakcemi a vyšším věkem.
Předkládáme kazuistiku 84leté pacientky, u které byl diagnostikován inhibitor faktoru VIII po opakovaných urologických operacích. Přestože předoperačně byla laboratorní diagnostika negativní, došlo v pooperačním průběhu k indukci inhibitoru, pravděpodobně v souvislosti s léčbou krvácivých projevů masivními převody krevních derivátů. I přes časnou detekci cirkulujícího antikoagulans a plnou terapii s podáním rekombinantních faktorů srážení, pacientka zemřela 5. den hospitalizace.
Klíčová slova:
kazuistika – koagulace – cirkulující antikoagulans – inhibitor faktoru VIII
Úvod
Endogenní inhibitory krevního srážení mohou zasahovat na různých úrovních koagulační kaskády, a způsobit tak i klinicky velmi závažná krvácení. Vzhledem k nízké incidenci těchto stavů však bývají v diferenciální diagnostice opomenuty a následné terapeutické snahy o ovlivnění krvácivých projevů mohou v tomto případě stav pacienta ještě zhoršit. Předkládáme kazuistiku pacientky, u které byl diagnostikován inhibitor faktoru VIII po opakovaných urologických operacích.
Kazuistika
Osmdesátičtyřletá pacientka byla přijata na urologické oddělení pro makroskopickou hematurii a lumbalgie; doposud se léčila pouze pro hypertenzi, hyperlipidémii a Menierův syndrom, v chronické medikaci užívala enalapril (Enap), isosorbid-mononitrát (Mono Mack Depot), cinnarizin (Cinarizin), atorvastatin (Tulip) a felodipinum (Presid).
Na základě ultrasonografického a CT vyšetření, které neprokázaly žádnou patologii, bylo rozhodnuto o konzervativním postupu. Při vstupním hematologickém vyšetření byl zjištěn Hb 106 g/l, aPTT 66 sec a aPTT-R 2,06, ostatní hodnoty včetně Quickova testu (1,04) a trombocytů (368 x 109/l) byly v normě. Hematologické konzilium nález hodnotí jako poztrátovou anémii a prodloužení aPTT jako projev defektu vnitřního systému koagulace. Bylo navrženo rozšíření hematologické diagnostiky o odběry na lupus antikoagulans, cirkulující antikoagulans (CIRKA), agregaci trombocytů, retrakci koagula a dobu krvácení (DK-PFA). Tato vyšetření neprokázala výskyt inhibitoru ani patologii destičkových funkcí. Doporučeno podání mražené krevní plazmy ke korekci prodlouženého aPTT a vysloveno podezření na poruchu faktoru XII s eventuálním pozdějším došetřením ambulantní cestou. I přes hrazení však zůstávalo aPTT-R nad 2 i při opakovaných kontrolách.
Osmý den hospitalizace došlo k náhlému poklesu koncentrace hemoglobinu ze 110 g/l na 84 g/l; ostatní laboratorní vyšetření byla bez výraznějších změn (trombocyty 319 109/l, INR 0.97, aPTT-R 2.10, fibrinogen 4.50 g/l, trombinový čas 19 s) – tabulka 1. Současně se nově objevilo výrazné zhoršení lumbalgie s omezením hybnosti LDK. Při neurologickém konziliu byl stav uzavřen jako lumboischiadický iritačně-zánikový syndrom v distribuci kořene L4; možnou etiologií je i útlak femorálního plexu v důsledku expanze. Bylo proto indikováno akutní vyšetření CT břicha s angiografií s nálezem objemného hematomu retroperitonea bez zobrazení zřetelného zdroje krvácení.
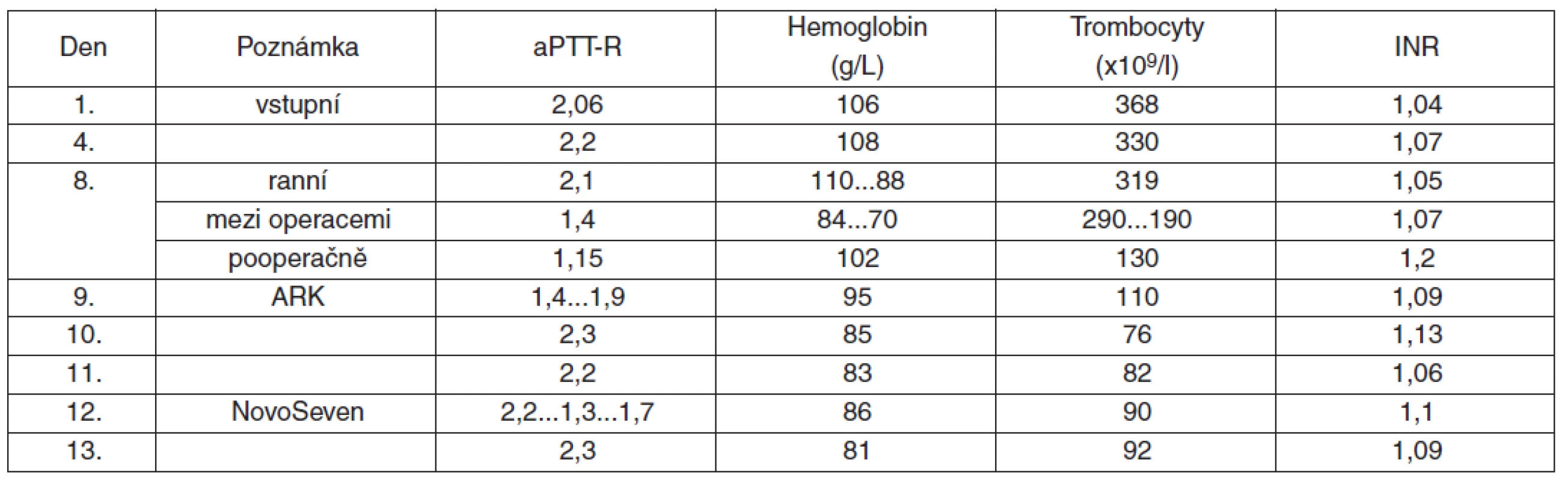
Bylo rozhodnuto o neodkladné operační revizi. Před výkonem byly podány 2 EBR a 3 ČMP, další 3 EBR a 3 ČMP podány během výkonu. Byla provedena evakuace hematomu v retroperitoneu, žádný větší zdroj krvácení ale nebyl nalezen. Menší zdroje byly ošetřeny, byl zajištěn centrální žilní a arteriální katétr. Po celou dobu výkonu byla pacientka oběhově stabilní, pouze přechodně byla nutná podpora oběhu malou dávkou katecholaminů. Po operaci byla pacientka plně při vědomí, spontánně ventilující, extubována a předána na urologickou JIP, kde byly na základě laboratorních nálezů (Hb 70 g/l, INR 1,35) podány další 2 TU EBR a 2 TU ČMP. Dochází však k rozvoji hypotenze a centralizace oběhu, rostou odpady do drenů a přistupuje se k další operační revizi. Byla provedena nefrektomie, ošetřeny zdroje krvácení, operační rána tamponována rouškami a uzavřena. Během operace byla nutná podpora oběhu malou dávkou katecholaminů, krevní ztráty hrazeny dalšími dvěma TU EBR a dvěma TU ČMP. Pacientka ponechána na UPV s analgosedací a přeložena na ARK ke stabilizaci vitálních funkcí. Bezprostředně po operaci bylo aPTT-R 1,15, pravděpodobně v důsledku masivního hrazení krevních ztrát.
Na ARK byl stav pacientky stabilizován s malou dávkou katecholaminů; byla odtlumena a bez obtíží extubována a kontrolní odběry byly bez pozoruhodností. V dalším průběhu došlo opět k postupnému prodlužování aPTT a na doporučení hematologa bylo provedeno vyšetření hladin jednotlivých faktorů vnitřní kaskády. Vyšetření prokázalo extrémně nízkou hladinu F VIII (F VIII 1,2 %, F XII 47%, vWF 200%). Byl proto znovu proveden test na cirkulující antikoagulans, který bylo tentokrát pozitivní. Později byla určena i síla inhibitoru – 7,32 BU (Bethesda Units; jedna Bethesda jednotka udává snížení aktivity faktoru o 50 % v 1 ml plazmy inkubované při 37 °C po dobu 2 hodin). Mezitím byly během krátké celkové anestezie vyňaty roušky z operační rány a do retroperitonea byl zaveden drén – pacientka byla opět bez obtíží extubována a zůstala dále hospitalizována na ARK.
Po výkonu bylo z důvodů krvácivých projevů a přítomnosti cirkulujícího antikoagulans rozhodnuto z hematologické indikace o podání Novo Seven® v dávce (90 μg/kg), tj. 7,2 mg i. v. Přes krátkodobé zlepšení aPTT-R na 1,3 dochází posléze opět k jeho postupnému prodlužování a rozvoji krvácivých komplikací. Stav byl komplikován rozvojem pneumonie a sepse progredující do multiorgánového selhání. Pacientka zemřela 5. den hospitalizace na ARK.
Diskuse
Epidemiologie
Inhibitory krevního srážení se mohou objevit u hemofiliků léčených koncentráty daného krevního faktoru. Jejich výskyt je u nemocných bez anamnézy léčby koncentráty krevních faktorů výrazně nižší. Incidence se udává 1,48/1 milion obyvatel a stoupá s věkem [1, 3, 4]. S výjimkou vyšší incidence u žen ve věku 20 až 40 let v důsledku gravidity [1, 2, 5] není výskyt onemocnění závislý na pohlaví či rase. Vznik inhibitorů je v 60 % případů idiopatický, v ostatních případech bývá často spojen s autoimunitními onemocněními, lymfoproliferativními chorobami, solidními tumory a lékovými interakcemi [1, 3, 4]. Jedná se většinou o protilátky třídy IgG, s nejčastějším zastoupením skupiny IgG4, a v důsledku odbourávání kinetikou II. řádu vede inhibitor jen zřídka k nulové hladině faktoru F VIII [2].
Klinický obraz
Nejčastěji to jsou různé krvácivé projevy od ekchymóz, epistaxe, hematurie, po krvácení do GIT a další. Naopak intraartikulární krvácení typická pro vrozené hemofilie jsou méně častá [1, 3].
Diagnostika
V laboratorní vyšetření bývá izolované prodloužení aPTT na hodnoty R = 2,0–3,0, bez známek jiných patologií. Ve směsném testu nedochází ke korekci po přidání normální plazmy. Je snížená aktivita FVIII, u silných inhibitorů bývá sekundárně přítomno snížení i jiných faktorů vnitřní kaskády [1, 3]. Síla specifického inhibitoru se udává v BU (Bethesda jednotkách – 1 BU představuje snížení aktivity faktoru o 50 % v 1 ml plazmy inkubované při 37 °C po dobu 2 hodin [2, 6].
Léčba
Vedle léčby vyvolávající příčiny terapie zahrnuje také zástavu krvácení a eradikaci inhibitoru. První linií léčby pro zástavu krvácení jsou přípravky obcházející aktivitu faktoru VIII. V současné době jsou k dispozici dva přípravky, a sice NovoSeven® a FEIBA® (Factor Eight Inhibitor Bypassing Activity) [1, 2, 7]. Při nižších titrech inhibitoru mohou být použity i jiné preparáty jako koncentrovaný faktor VIII, DDAVP nebo antifibrinolytika [8, 9].
NovoSeven® se v této indikaci podává v dávkách 90–120 μg/kg, každé 2–3 hodiny do zástavy krvácení. Použití vyšších dávek je spojeno se vznikem trombózy [10, 11]. Další možností je užití FEIBA®, což je přípravek používaný k léčbě inhibitorů VIII a IX u pacientů s hemofilií A a B a k léčbě získaných inhibitorů faktorů VIII, XI a XII u nehemofilických pacientů. Dávka je 75 IU/kg po 8–12 hodinách, s průměrným užitím 10 dávek k zástavě krvácení [1, 2]. Použití DDAVP je možné při nižších titrech inhibitoru pod 3 BU. Jeho podání vyvolává zvýšení titru FVIII a neutralizaci protilátek [3, 5]. Koncentrát faktoru VIII lze užít ve vysokých dávkách při nízkém titru inhibitoru do 5 BU [5, 11] a bývá také součástí komplexních léčebných strategií k eliminaci faktoru [5].
K eradikaci inhibitoru by mělo být přistoupeno co nejdříve po zjištění diagnózy. Existuje několik postupů: lze použít samotné kortikosteroidy – nejčastěji používaným je prednison v dávce 1 mg/kg, který vyvolává remisi až u 75 % nemocných. Z cytostatik je podáván cyklofosfamid, který může v kombinaci s prednisonem navodit remisi až u 79 % nemocných. Medián navození remise je u obou těchto režimů v horizontu 5–7 týdnů [1]. Cyklosporin A je považován za lék druhé volby [2, 12]. Při použití monoklonální protilátky proti CD20 lymfocytům – rituximabu – nastává remise v 80–88 % případů a bývá někdy doporučována jako léčba první volby [1, 12] či u nemocných se závažným průběhem [13]. Imunoadsorpce s podáním FVIII vede současně k léčbě krvácení i eradikaci. Obvykle nastává rychlá kontrola krvácení bez detekce inhibitoru v mediánu 3 dnů a k navození kompletní remise v 88 % případů dochází v mediánu 14 dnů [14].
Závěr
Pacientka měla týden před přijetím na ARK negativní vyšetření na cirkulující antikoagulans, s odstupem jednoho týdne po opakovaných operačních revizích a intenzivní substituci krevními deriváty bylo prokázáno cirkulující antikoagulans o síle přes 7 BU. Je zřejmé, že k navýšení hladiny inhibitoru došlo po opakovaném podání ČMP. Ačkoliv podaná ČMP přechodně mírně korigovala aPTT, docházelo k nárůstu inhibitoru v důsledku imunitní odpovědi a následně ke stále se zhoršujícímu krvácení. Rozvinutý stav již nepomohlo vyřešit ani podání přípravku NovoSeven®, i když po jeho podání došlo ke krátkodobé korekci aPTT. Opakované podání NovoSeven® jsme vzhledem k celkovému stavu nemocné neindikovali. Podání prednisonu jsme vzhledem k rozsáhlé operační ráně a rozvíjející se těžké sepsi nepovažovali za přínosné.
Získaná hemofilie A je vzácné, ale léčitelné onemocnění. Při diagnostice krvácivých projevů je nutné na tuto diagnózu nezapomínat – na možnost inhibitoru koagulace upozorní izolovaně prodloužené aPTT. Postup léčby je nutné konzultovat s hematologickým pracovištěm, které má s diagnostikou a léčbou daného onemocnění zkušenosti. Je třeba mít na paměti, že podání mražené plazmy může ve výsledku daný stav paradoxně zhoršit. Je vždy nutné zvážit přínos léčby pro pacienta z důvodů medicínských i ekonomických, neboť se jedná o terapii stále velmi nákladnou.
Do redakce došlo dne 10. 2. 2012.
Do tisku přijato dne 10. 3. 2012.
Adresa pro korespondenci:
MUDr. Miloš Chobola
Anesteziologicko-resuscitační klinika, FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: milos.chobola@fnusa.cz
Sources
1. Shander, A., Walsh, C. E., Cromwell, C. Acquired hemophilia: a rare but life - threatening potential cause of bleeding in the intensive care unit. Intensive Care Med., 2011, 37, p. 1240–1249.
2. Shetty, S., Bhave, M., Ghosh, K. Acquired hemophilia A: Diagnosis, aetiology, clinical spectrum and treatment options. Autoimmunity Reviews, 2011, 10, p. 311–316.
3. Buliková, A., Smejkal, P., Zavřelová, J., Chlupová, G., Penka, M. Získané inhibitory krevního srážení. Interní Med., 2008, 10, 7 a 8, p. 336–339.
4. Collins, P. W., Hirsh, S., Baglin, T. P. et al. Acquired hemophilia A in the United Kingdom a 2-year national surveillance study by the United Kingdom Hemophilia Centre Doctor’s Organisation. Blood, 2007, 109, p. 1870–1877.
5. Ma, A. D., Carrizosa, D. Acquired factor VIII inhibitors: pathophysiology and treatment. Hematology, (Am Soc Hematol Educ Program) 2006, p. 432–437.
6. Lak, M., Sharifian, R. A., Karimi, K., Mansouritorghabeh, H. Acquired hemophilia A: clinical features, surgery and treatment of 34 cases, and experience of using recombinant factor VIIa. Clin. Appl. Thromb. Hemost., 2010, 16. p. 294–300.
7. Sallah, S. Treatment of acquired hemophilia with factor eight inhibitor bypassing activity. Haemophilia, 2004, 10, p. 169–73.
8. Cattaneo, M. Review of clinical experience of desmopressin in patients with congenital and acquired bleeding disorders. Eur. J. Anaesthesiol., 1997, 14, p. 10–14.
9. Abshire, T., Kenet, G. Recombinant factor VIIa: review of efficacy, dosing regimens and safety in patients with congenital and acquired factor FVIII or IX inhibitors. J. Thromb. Haemost., 2004, 2, p. 899–909.
10. Collins, P. W. Treatment of acquired hemophilia A. J. Thromb. Haemost., 2007, 5, p. 893–900.
11. Gandini, G., Franchini, M., Manzato, F., Lippi, G., Aprili, G. A combination of prednisone, high-dose intravenous immunoglobulin and desmopressin in the treatment of acquired hemophilia A with high-titer inhibitor. Haematologica, 1999, 84, p. 1054.
12. Hay, CH. R. M., Collins, P. W., Keeling, D. M., Liesner, R. The diagnostics and management of factor VIII and IX inhibitors: a guideline from the United Kingdom Haemophilia Centre Doctors Organisation. Br. J. Haematol., 2006, 133, p. 591–605.
13. Franchini, M., Veneri, D., Lippi, G., Stenner, R. The efficacy of rituximab in the treatment of inhibitor-associated haemostatic disorders. Thromb. Haemost., 2006, 96, p. 119–125.
14. Zeitler, H., Ulrich-Merzenich, G., Hess, L. et al. Treatment of acquired haemophilia by the Bonn-Malmö protocol: documentation of an in vivo immunomodulation concept. Blood, 2005, 105, p. 2287–2293.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine Surgery Internal medicine Cardiology Clinical oncology Trauma surgery LaboratoryArticle was published in
Anaesthesiology and Intensive Care Medicine

2012 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Průběh cytokinové odezvy u zvířecího modelu nitrobřišní sepse modifikované imunosupresí
- Získaná hemofilie A s těžkým průběhem - kazuistika
- Validace faktorů predikce obtížné intubace
- Kvalita života pacientů jeden rok po propuštění z intenzivní péče
- Trefoil factor 1 jako ukazatel poškození střevní sliznice během septických stavů u dětí
- Audit použití supraglotické pomůcky i-gel při celkové anestezii se spontánní a řízenou ventilací – vliv ventilačního režimu a zkušenosti lékaře na sledované parametry
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Validace faktorů predikce obtížné intubace
- Kvalita života pacientů jeden rok po propuštění z intenzivní péče
- Získaná hemofilie A s těžkým průběhem - kazuistika
- Audit použití supraglotické pomůcky i-gel při celkové anestezii se spontánní a řízenou ventilací – vliv ventilačního režimu a zkušenosti lékaře na sledované parametry
