Sugammadex z pohledu medicíny založené na důkazech
Sugammadex from the perspective of evidence-based medicine
Sugammadex is a novel drug for reversal of rocuronium or vecuronium-induced neuromuscular blockade. Compared to neostigmine, its mechanism of action (encapsulation) is not influenced by cholinesterase activity. In this article, the authors summarize the current indications of sugammadex, its advantages over neostigmine and its value in specific situations during anaesthesia.
Keywords:
neuromuscular blockade – rocuronium – encapsulation – sugammadex
:
Adamus Milan 1; Herold Ivan 2
:
Klinika anesteziologie, resuscitace a intenzivní medicíny
Fakultní nemocnice a Lékařská fakulta Univerzity Palackého v Olomouci
1; Anesteziologicko-resuscitační oddělení, Oblastní nemocnice Mladá Boleslav, a. s.
2
:
Anest. intenziv. Med., 23, 2012, č. 5, s. 237-241
:
Anesthesiology - Review Article
Sugammadex je nová látka, určená k reverzi nervosvalového bloku po podání rokuronia nebo vekuronia. Ve srovnání s neostigminem má odlišný mechanismus účinku (enkapsulace), který nezávisí na enzymatické aktivitě cholinesterázy. Na základě medicíny založené na důkazech autoři shrnují současné indikace sugammadexu, jeho výhody i význam při specifických situacích během anestezie.
Klíčová slova:
nervosvalový blok – rokuronium – enkapsulace – sugammadex
Sugammadex je látka označovaná jako SRBA (selective relaxant-binding agent). Chemicky se jedná o gama-cyklodextrin, který specificky antagonizuje myorelaxační efekt rokuronia (méně vekuronia), pro reverzi bloku po podání benzylisochinolinů nebo suxamethonia je neúčinný. Účinek sugammadexu je založen na chemické interakci s relaxanciem (NMBA, neuromuscular blocking agent), není podmíněn funkcí enzymatických systémů ani interakcí s receptory. Po intravenózním podání sugammadex váže rokuronium pevně do lipofilní dutiny ve své molekule mechanismem enkapsulace. Takto vzniklý komplex je extrémně stabilní bez rizika opětovného uvolnění rokuronia z vazby a následné rekurarizace. Navázáním rokuronia na sugammadex vzniká koncentrační gradient mezi biofází a centrálním kompartmentem a NMBA se z biofáze uvolňuje do centrálního kompartmentu. Nikotinové receptory se tak stávají opět dostupné pro acetylcholin a dochází k obnovení nervosvalového přenosu. Hydrofilní komplexy rokuronia a sugammadexu nepodléhají metabolismu a jsou vylučovány ledvinami. Reverze bloku sugammadexem není ovlivněna typem podané anestezie – sugammadex je stejně účinný během inhalační i totální intravenózní anestezie (TIVA), lze ho použít u seniorů i dětí starších 2 let. Při správném dávkování lze sugammadexem zvrátit rokuroniem navozený blok jakékoli hloubky, což pomocí neostigminu není možné [1].
Během posledních 15 let nebyla kromě sugammadexu uvedena do anesteziologické praxe žádná nová látka se vztahem ke svalové relaxaci a celkové anestezii. Neostigmin byl syntetizován v roce 1931 a k dokumentované antagonizaci kurare při anestezii byl použit již v roce 1942. I moderní svalová relaxancia s intermediární délkou účinku jsou používána delší dobu [2, 3]: vekuronium (1979), atrakurium (1980), rokuronium (1990), cisatrakurium (1995). I když vývoj sugammadexu započal dříve, první publikace o něm v recenzovaném časopise pochází až z roku 2002 [4]. Od podzimu 2009 je sugammadex (Bridion®, MSD) dostupný v České republice, celosvětově je k dispozici ve dvou baleních (10 × 200 mg, 10 × 500 mg), do ČR jsou dodávána jen menší z nich. Během necelých tří let od registrace bylo v ČR dodáno celkem 630 balení Bridionu® [08/2009–04/2012, data MSD]. Splnil sugammadex naše očekávání?
Můj učitel farmakologie na LF UP v Olomouci, prof. Lenfeld (1924–1994), doprovázel své přednášky množstvím bonmotů. Jeden z těch, které mi utkvěly v paměti, zněl: „Lék, který nemá nežádoucí účinky, není účinný.“ Sugammadex je nepochybně extrémně účinný lék a jeho vlastnosti se blíží požadavkům na ideální reverzní látku (tab. 1). Můžeme však sugammadex považovat za panaceu, jejíž podání dokáže vyřešit všechny problémy spojené s podáním aminosteroidních NMBA?
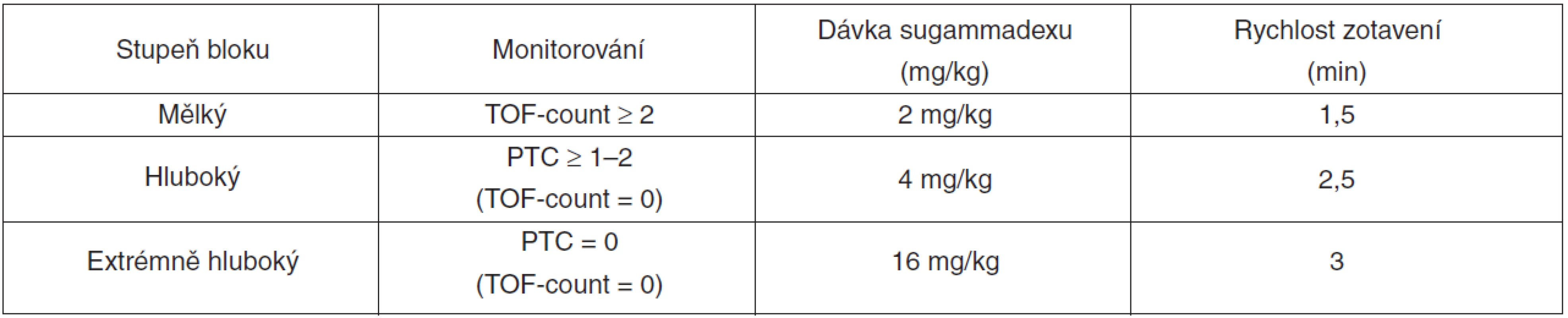
Ke svalové relaxaci je v současné anesteziologické praxi používáno stále častěji rokuronium jako nedepolarizující NMBA s nejrychlejším nástupem účinku (při standardním dávkování). Zda k tomu přispívá i dostupnost sugammadexu jako specifického reverzního farmaka není jisté. Nepochybně však máme v sugammadexu látku, jež je schopna spolehlivě antagonizovat rokuroniem navozený blok jakékoli hloubky. Doporučené dávkování sugammadexu vychází z hloubky bloku, který antagonizujeme (tab. 2). Zatímco podání vyšší dávky, než je uvedena v doporučeném dávkovacím schématu, není provázeno vyšším výskytem nežádoucích účinků, poddávkování sugammadexu je spojeno s rizikem nedostatečného účinku [5, 6] nebo rekurarizace [7].
Rokuronium lze podle doporučení výrobce (SPC) u obézních pacientů bezpečně dávkovat podle ideální hmotnosti při zachované rychlosti nástupu účinku a také srovnatelné kvalitě intubačních podmínek po 90 s [8]. Data o dávkování sugammadexu podle ideální hmotnosti jsou rozporuplná. Existují údaje, že je možno morbidně obézním pacientům podávat sugammadex podle ideální hmotnosti [9]. Jiné práce bezpečnost dávkování na základě ideální hmotnosti při reverzi mělkého (TOF-count 1–2) i hlubokého (PTC 1–2) bloku po rokuroniu zpochybňují [10]. Z hlediska bezpečnosti tedy nelze v současnosti dávkování sugammadexu podle ideální tělesné hmotnosti doporučit.
Unikátní vlastností sugammadexu je schopnost zvrátit extrémně hluboký blok, který nastane po úvodu do celkové anestezie během 60–120 s po podání rokuronia ve standardní (0,6 mg/kg) nebo vysoké (1,2 mg/kg) dávce. Pokud po aplikaci této dávky rokuronia nejsme schopni nemocného zaintubovat a ventilovat (CICV, can’t intubate, can’t ventilate), stav může vyústit v hypoxii, která nemocného ohrožuje přímo na životě. Podání vysoké dávky sugammadexu (16 mg/kg) 3 minuty po aplikaci rokuronia v tomto případě urychlí nástup spontánní ventilace. I když je zvrat velmi hlubokého bloku po podání rokuronia sugammadexem rychlejší (6,2 ± 1,8, rozmezí 4,2–14,6 min pro dosažení T1 > 0,9) než spontánní zotavení po podání 1,0 mg/kg suxamethonia (10,7 ± 2,4, rozmezí 5,0–16,2 min, p < 0,001) [11], není toto urychlení dostatečné v prevenci závažné desaturace při nemožnosti prodechnout nemocného. Bisshops et al. [12] upozornili, že k intervalu od podání sugammadexu do nástupu plného účinku je nutno přičíst i organizační a logistické faktory. V klinické studii, která simulovala požadavek na podání sugammadexu za situace CICV, byl interval od rozhodnutí podat sugammadex do jeho intravenózní aplikace 6,7 ± 1,5 min. Hlavními příčinami tohoto „zdržení“ byly pomalá dosažitelnost sugammadexu, čas na donesení a výpočet potřebné dávky a doba pro natažení velkého množství sugammadexu do stříkačky. Ani rychlý zvrat blokády nemusí zabránit hypoxii, jestliže při pokusech o intubaci došlo k otoku dýchacích cest v hrtanovém vchodu. Závěr je jasný: pokud po podání rokuronia nastane situace CICV, nemůže být podání sugammadexu jediným opatřením a vždy je zároveň nutné zahájit zajištění oxygenace jinými prostředky.
Jednou ze závažných komplikací nesprávného použití NMBA je pooperační reziduální kurarizace PORC (post-operative residual curarization), kdy je spontánně dýchající nemocný předáván po ukončení anestezie z operačního sálu se zbytkovou relaxací [13]. Pokud není nervosvalový přenos monitorován, je výskyt PORC po použití nedepolarizujících NMBAs udáván mezi 5–50 % [14]. PORC zvyšuje riziko pooperačních plicních komplikací (hypoventilace, mikroaspirace) [15, 16] i výskyt kritických respiračních situací spojených s desaturací v pooperačním období [17].
Výhody monitorování svalové relaxace jsou známy [18–20] a i když existuje dostupná metoda pro stanovení hloubky relaxace, její použití bohužel nepatří v anesteziologii mezi rutinně používané postupy [21, 22].
Pokud nervosvalový přenos neměříme, usuzujeme na hloubku bloku (a případnou přítomnost PORC) na konci anestezie u naprosté většiny relaxovaných nemocných na základě dvou předpokladů:
- Uplynutí dostatečné doby od podání relaxancia zaručuje adekvátní zotavení z účinku. Tento názor je chybný. Debaenne et al. [23] prokázali, že po podání jednorázové dávky intermediárního NMBA a vynechání reverze, je PORC velmi častá, a to dokonce i po více než dvou hodinách od aplikace relaxancia.
- Dostatečnost odeznění účinku NMBA můžeme určit podle klinických známek. Tento názor je chybný. Neexistuje klinický test, který by spolehlivě odhalil reziduální kurarizaci. Cammu et al. [24] prokázali, že běžně prováděná vyšetření svalové síly na konci anestezie (stisk ruky, zvednutí hlavy, horní nebo dolní končetiny po 5 s, normální dechové objemy, plazení jazyka) mají pozitivní prediktivní hodnotu kolem 50 %. Při této hodnotě proto nelze reziduální blok vyloučit.
Nežádoucí účinky sugammadexu jsou velmi vzácné, a proto se o nich dozvídáme pouze z kazuistik. Většina intravenózně podaných látek přináší riziko alergických reakcí. Dosud byla popsána a následnými pin-prick testy prokázána jedna alergická reakce na nízkou dávku (3,2 mg/kg) sugammadexu (erytém hrudníku, otok rtů a očních víček, bronchospasmus) [25]. Celkově reakce neměla závažný charakter a byla zvládnuta standardní léčbou. Zajímavá je myšlenka léčby alergické reakce na rokuronium podáním sugammadexu. I když dosud není objasněn přesný mechanismus tohoto postupu [26], bylo popsáno úspěšné podání sugammadexu v této indikaci [27]. Clarke et al. [28] sledovali, zda je sugammadex schopen zabránit kožní reakci po intradermálním podání rokuronia nemocným se známou hypersenzitivitou na toto relaxans. Pokud se alergická reakce po rokuroniu rozvinula, sugammadex byl při následném intradermálním podání neúčinný. Pokud však byl sugammadex intradermálně podán před aplikací rokuronia, nemocní byli na komplex rokuronium-sugammadex anergičtí. K jednoznačnému průkazu efektivity sugammadexu v této indikaci je potřeba dalších studií, proto v současnosti nelze sugammadex jako lék volby při alergické reakci na rokuronium doporučit (patří mezi off-label indikace).
Dobré zkušenosti se sugammadexem jsou popisovány při reverzi bloku po podání rokuronia nemocným s nervosvalovými onemocněními (zejména myasthenia gravis). Pokud nemocný s myasthenií musí být relaxován, efektivita kombinace rokuronia a sugammadexu je podobná jako u jiných pacientů [29, 30].
Vzhledem k podobnosti molekul existují potenciální biologické interakce sugammadexu s některými perorálními kontraceptivy, flukloxacilinem, toremifenem a kyselinou fusidovou. Byla popsána i farmaceutická interakce s protaminem (precipitace) [31], proto je vhodné sugammadex podávat vždy odděleně od jiných farmak.
Opravňují výjimečné vlastnosti sugammadexu k jeho liberálnímu používání? I když je podání sugammadexu s konzistentním účinkem možné všem nemocným relaxovaným rokuroniem (nebo vekuroniem), v současnosti tak nepochybně postupovat nemůžeme. Cena samotného sugammadexu je totiž natolik vysoká, že může převýšit náklady na podanou anestezii. Tento názor je prezentován v našem [32] i světovém písemnictví [33].
„Anesteziolog, který má to štěstí, že má k dispozici neostigmin i sugammadex, stojí na konci anestezie před rozhodnutím, kterou látku k reverzi použít“ [33].
Obecně má každý podávaný lék svoji indikaci a dávkování, platí to i pro farmaka k antagonizování účinku NMBAs. Pro kvalifikovanou úvahu je před případnou reverzí potřebné objektivně znát hloubku bloku [20], protože právě ta významně určuje volbu a dávkování antagonisty. Doporučené dávkování sugammadexu je známé (viz tab. 2), indikace pro jeho podání jsou v současnosti stanoveny volněji (tab. 3).
Rychlost nástupu účinku, spolehlivost v antagonizaci bloku a naprosto minimální množství nežádoucích účinků sugammadexu nastolují legitimní a pochopitelnou otázku. Jaký je poměr cena-efektivita při podání tohoto drahého léku [32]? I když existují metaanalýzy, které se touto problematikou zabývají, jednoznačná odpověď chybí a závěry těchto studií končí často v rovině úvah [34–36]. Chambers et al. [34] uzavírají, že při srovnání s neostigminem může být sugammadex nákladově efektivní při reverzi mělkého i hlubokého bloku. Kombinace rokuronium + sugammadex může představovat náhradu suxamethonia při bleskovém úvodu (a reverzi bloku), ale nemusí být cenově efektivní volbou u všech nemocných. Při současné ceně sugammadexu není jisté, zda nepochybné medicínské výhody mohou být zúročeny v každodenní klinické praxi. Paton et al. [35] sledovali výhodnost reverze sugammadexem při zkrácení délky zotavení z bloku. Prokázali, že čas uspořený podáním sugammadexu může být cenově efektivní zkrácením pobytu nemocného na operačním sále (odhadované personální náklady 4,44 £/min), ale už ne na dospávacím pokoji (odhadované personální náklady 0,33 £/min). Zároveň přiznávají, že tyto výsledky jsou zatíženy extrémně vysokou nepřesností. Nepochybně vždy závisejí na konkrétních podmínkách a úspora času získaná podáním sugammadexu je zpravidla snadno „devalvována“ jinými faktory, které určují průchodnost operačního sálu [32].
Sugammadex je mocný nástroj. Jeho dostupnost a spolehlivý účinek však nesmějí svádět k tomu, že budeme aminosteroidní NMBAs podávat nesprávným způsobem [32].
Prohlášení o střetu zájmů: Autoři byli členy poradního sboru MSD Česká republika, s. r. o., a jejich přednášková činnost byla honorována.
Do redakce došlo dne 10. 7. 2012.
Do tisku přijato dne 30. 7. 2012.
Adresa pro korespondenci:
Doc. MUDr. Milan Adamus, Ph.D.
Kaštanová 11
772 00 Olomouc
e-mail: milan.adamus@seznam.cz
Sources
1. Adamus, M. Svalová relaxace v anesteziologii – nová koncepce antagonizování nervosvalového bloku. Lékařské listy, 2010, 59, 21, s. 14–15.
2. Fink, H., Blobner, M., Jeevendra Marty, J. A. Neuromuscular blocking agents and reversal drugs. In Evers, A. S., Maze, M. (editors) Anesthetic Pharmacology. Physiological Principles and Clinical Practice: A Companion to Miller’s Anesthesia. 1. vydání. Philadelphia, Pennsylvania: Elsevier, 2004, p. 586.
3. Herold, I. Svalová relaxancia v anesteziologii a intenzivní péči. Praha: Maxdorf, 2004, 268 s.
4. Bom, A., Bradley, M., Cameron, K., Clark, J. K., Van Egmond, J., Feilden, H., MacLean, E. J., Muir, A. W., Palin, R., Rees, D. C., Zhang, M. Q. A novel concept of reversing neuromuscular block: chemical encapsulation of rocuronium bromide by a cyclodextrin-based synthetic host. Angew. Chem. Int. Ed. Engl., 2002, 41, 2, p. 266–270.
5. Eleveld, D. J., Kuizenga, K., Proost, J. K., Wierda, J. M. A temporary decrease in twitch response during reversal or rocuronium-induced muscle relaxation with small dose of sugammadex. Anesth. Analg., 2007, 104, 3, p. 582–584.
6. Fuchs-Buder, T. Less is not always more: sugammadex and the risk of underdosing. Eur. J. Anaesthesiol., 2010, 27, 10, p. 849–854.
7. Le Corre, F., Nejmeddine, S., Fatahine, C., Tayar, C., Marty, J., Plaud, B. Recurarization after sugammadex reversal in an obese patient. Can. J. Anaesth., 2011, 58, 10, p. 944–947.
8. Meyhoff, C. S., Lund, J., Jenstrup, M. T., Claudius, C., Sørensen, A. M., Viby-Mogensen, J., Rasmussen, L. S. Should dosing of rocuronium in obese patients be based on ideal or corrected body weight? Anesth. Analg., 2009, 109, 3, p. 787–792.
9. Van Lancker, P., Dillemans, B., Bogaert, T., Mulier, J. P., De Kock, M., Haspeslagh, M. Ideal versus corrected body weight for dosage of sugammadex in morbidly obese patients. Anaesthesia, 2011, 66, 8, p. 721–725.
10. Llauradó, S., Sabaté, A., Ferreres, E., Camprubí, I., Cabrera, A. Sugammadex ideal body weight dose adjusted by level of neuromuscular blockade in laparoscopic bariatric surgery. Anesthesiology, 2012, 117, 1, p. 93–98.
11. Lee, C., Jahr, J. S., Candiotti, K. A., Warriner, B., Zornow, M. H., Naguib, M. Reversal of profound neuromuscular block by sugammadex administered three minutes after rocuronium: a comparison with spontaneous recovery from succinylcholine. Anesthesiology, 2009, 110, 5, p. 1020–1025.
12. Bisschops, M. M., Holleman, C., Huitink, J. M. Can sugammadex save a patient in a simulated ‘cannot intubate, cannot ventilate’ situation? Anaesthesia, 2010, 65, 9, p. 936–941.
13. Naguib, M., Kopman, A. F., Ensor, J. E. Neuromuscular monitoring and postoperative residual curarisation: a meta-analysis. Br. J. Anaesth., 2007, 98, 3, p. 302–316.
14. Plaud, B., Debaene, B., Donati, F., Marty, J. Residual paralysis after emergence from anesthesia. Anesthesiology, 2010, 112, 4, p. 1013–1022.
15. Berg, H., Roed, J., Viby-Mogensen, J., Mortensen, C. R., Engbaek, J., Skovgaard, L. T., Kristel, J. J. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomised, and blinded study of postoperative pulmonary complications after atracurium, vecuronium and pancuronium. Acta Anaesthesiol. Scand., 1997, 41, 9, p. 1095–1103.
16. Murphy, G. S., Brull, S. J. Residual neuromuscular block: lessons unlearned. Part I: definitions, incidence, and adverse physiologic effects of residual neuromuscular block. Anesth. Analg., 2010, 111, 1, p. 120–128.
17. Murphy, G. S., Szokol, J. W., Marymont, J. H., Greenberg, S. B., Avram, M. J., Vender, J. S. Residual neuromuscular blockade and critical respiratory events in the postanesthesia care unit. Anesth. Analg., 2008, 107, 1, p. 130–137.
18. Murphy, G. S., Szokol, J. W., Avram, M. J., Greenberg, S. B., Marymont, J. H., Vender, J. S., Gray, J., Landry, E., Gupta, D. K. Intraoperative acceleromyography monitoring reduces symptoms of muscle weakness and improves quality of recovery in the early postoperative period. Anesthesiology, 2011, 115, 5, p. 946–954.
19. Donati, F. Neuromuscular monitoring: what evidence do we need to be convinced? Anesth. Analg., 2010, 111, 1, p. 6–8.
20. Miller, R. D., Ward, T. A. Monitoring and pharmacologic reversal of a nondepolarizing neuromuscular blockade should be routine. Anesth. Analg., 2010, 111, 1, p. 3–5.
21. Adamus, M., Herold, I., Cvachovec, K., Ševčík, P., Černý, V. Svalová relaxace během celkové anestezie v České republice 2010 – jednodenní prospektivní observační dotazníková studie. Anest. intenziv. Med., 2011, 22, 2, s. 82–89.
22. Naguib, M., Kopman, A. F., Lien, C.A., Hunter, J. M., Lopez, A., Brull, S. J. A survey of current management of neuromuscular block in the United States and Europe. Anesth. Analg., 2010, 111, 1, p. 110–119.
23. Debaene, B., Plaud, B., Dilly, M. P., Donati, F. Residual paralysis in the PACU after a single intubating dose of nondepolarizing muscle relaxant with an intermediate duration of action. Anesthesiology, 2003, 98, 5, p. 1042–1048.
24. Cammu, G., De Witte, J., De Veylder, J., Byttebier, G., Vandeput, D., Foubert, L., Vandenbroucke, G., Deloof, T. Postoperative residual paralysis in outpatients versus inpatients. Anesth. Analg., 2006, 102, 2, p. 426–429.
25. Menéndez-Ozcoidi, L., Ortiz-Gómez, J. R., Olaguibel-Ribero, J..M., Salvador-Bravo, M. J. Allergy to low dose sugammadex. Anaesthesia, 2011, 66, 3, p. 217–219.
26. Baldo, B. A., McDonnell, N. J, Pham, N. H. The cyclodextrin sugammadex and anaphylaxis to rocuronium: is rocuronium still potentially allergenic in the inclusion complex form? Mini Rev. Med. Chem., 2012, 12, 8, p. 701–712.
27. Kawano, T., Tamura, T., Hamaguchi, M., Yatabe, T., Yamashita, K., Yokoyama, M. Successful management of rocuronium-induced anaphylactic reactions with sugammadex: a case report. J. Clin. Anesth., 2012, 24, 1, p. 62–64.
28. Clarke, R. C., Sadleir, P. H., Platt, P. R. The role of sugammadex in the development and modification of an allergic response to rocuronium: evidence from a cutaneous model. Anaesthesia, 2012, 67, 3, p. 266–273.
29. Unterbuchner, C., Fink, H., Blobner, M. The use of sugammadex in a patient with myasthenia gravis. Anaesthesia, 2010, 65, 3, p. 302–305.
30. Blichfeldt-Lauridsen, L., Hansen, B. D. Anesthesia and myasthenia gravis. Acta Anaesthesiol. Scand., 2012, 56, 1, p. 17–22.
31. Alston, T. A. Precipitation of sugammadex by protamine. J. Clin. Anesth., 2011, 23, 7, p. 593.
32. Cvachovec, K. Nová farmaka – jak s nimi? Anest. intenziv. Med., 2011, 22, 4, s. 197–199.
33. Kopman, A. F. Neostigmine versus sugammadex: which, when, and how much? Anesthesiology, 2010, 113, 5, p. 1010–1011.
34. Chambers, D., Paulden, M., Paton, F., Heirs, M., Duffy, S., Craig, D., Hunter, J., Wilson, J., Sculpher, M., Woolacott, N. Sugammadex for the reversal of muscle relaxation in general anaesthesia: a systematic review and economic assessment. Health Technol. Assess., 2010, 14, 39, p. 1–211.
35. Paton, F., Paulden, M., Chambers, D., Heirs, M., Duffy, S., Hunter, J. M., Sculpher, M., Woolacott, N. Sugammadex compared with neostigmine/glycopyrrolate for routine reversal of neuromuscular block: a systematic review and economic evaluation. Brit. J. Anaesth., 2010, 105, 5, p. 558–567.
36. Fuchs-Buder, T., Meistelman, C., Schreiber, J. U. Is sugammadex economically viable for routine use. Curr. Opin. Anaesthesiol., 2012, 25, 2, p. 217–220.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2012 Issue 5
-
All articles in this issue
- How important are amino acids in the nutrition of critically ill patients?
- Sugammadex from the perspective of evidence-based medicine
- New role and rennaisance of branched chain aminoacids in intensive care
- Perforated peptic ulcer – pre-operative risks, postoperative morbidity and mortality, prophylaxis in intensive care and guidelines
- Pre-operative assessment
- What is calcyphylaxis and why we should not supplement calcium in patiens with hyperphosphatemia and phosphates in pateints with hypercalcemia?
- Difficult Airway Society Guidelines for the management of tracheal extubation
- Current concepts in cerebral oximetry for adult cardiac surgery
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Perforated peptic ulcer – pre-operative risks, postoperative morbidity and mortality, prophylaxis in intensive care and guidelines
- Sugammadex from the perspective of evidence-based medicine
- Pre-operative assessment
- What is calcyphylaxis and why we should not supplement calcium in patiens with hyperphosphatemia and phosphates in pateints with hypercalcemia?