14th Cardiac Anaesthesia Days
Published in:
Anest. intenziv. Med., 24, 2013, č. 1, s. 55-64
Category:
Congresses and Conferences
Pardubice 14.–15. 6. 2012
Editor: MUDr. Jan Kunstýř, Ph.D.
XIV. kardioanesteziologické vědecké dny s mezinárodní účastí a pod záštitou primátorky města Pardubic proběhly ve dnech 14. a 15. června 2012. Místem konání nebyl, jako v předchozích letech Dům hudby, ale moderní AFI Palác na konci pěší zóny v centru města. Součástí programu byly 2 satelitní odborné akce: čtvrteční echokurz pro anesteziology a intenzivisty s přednáškami a s praktickým nácvikem TTE, ultrazvuku hrudníku a kanylace centrálních žil na figurantech a s výukou TEE na simulátoru firmy Heartworks a páteční workshop zavádění permanentních žilních přístupů pod ultrazvukovou kontrolou.
Na odborných přednáškách pro kardioanesteziology se v pátek aktivně podílela téměř všechna kardiocentra v České republice a jako tradiční zahraniční hosté vystoupili s příspěvky i kolegové z Bratislavy a z Papworth Hospital, Cambridge. V příštím roce plánujeme již XV. setkání tohoto druhu a doufáme, že bude alespoň tak úspěšné, jako to letošní.
Miniinvazivní mimotělní oběh – 8leté zkušenosti
Frdlík J., Staszko M., Hájek T., Škorpil J.
Kardiochirurgické oddělení FN Plzeň
Užití mimotělního oběhu (MO) pro kardiochirurgické operace je spojeno s řadou jeho nežádoucích účinků, z nichž hlavní jsou rozvoj systémové zánětlivé reakce organismu a koagulopatie [1, 2]. I přes rozvoj „off-pump“ metod zůstává MO stále nezbytnou součástí většiny kardiochirurgických operací. Na místě je proto snaha, jeho nežádoucí účinky co nejvíce potlačit.
Základní koncepce miniinvazivního mimotělního oběhu je uzavřený okruh poháněný centrifugální pumpou. Snížením počtu komponent a zkrácením délky hadic dosáhneme snížení povrchu a náplně systému až o 2/3 oproti klasickému systému. Nahrazením otevřeného rezervoáru plastovým vakem a vynecháním koronárního sání nedochází ke kontaktu krve se vzduchem, což je jedním ze spouštěcích mechanismů nežádoucích účinků MO. Aktivní žilní drenáž namísto gravitační a absence otevřeného venózního rezervoáru zvyšuje riziko nasátí a embolizace vzduchu, což klade zvýšené nároky na chirurga a perfuziologa. Vývojem poloautomatického a automatického ultrazvukem řízeného systému odvzdušnění bylo toto riziko minimalizováno a došlo k výraznému zvýšení bezpečnosti miniinvazivního MO [3, 4].
Chybění koronárního sání a nemožnost ventování levé komory zpočátku předurčovala tyto systémy pouze k operacím aorto-koronárních bypassů. Příkladem tohoto systému je MECC (Jostra).
Přidáním malé okluzní pumpy a flexibilního rezervoáru vznikl systém umožňující ventování levé komory. Tím se otevřela možnost bezpečného operování na otevřeném srdci. Je-li potřeba, lze tento vent po uvolnění příčné svorky použít jako koronární sání. Příkladem tohoto systému jsou ROCSafe (Terumo) a RESTING HEART (Medtronik).
Po nabytí prvních vlastních zkušeností s miniinvazivním MO jsme na našem pracovišti provedli prospektivní, randomizovanou studii, do které bylo zahrnuto 100 pacientů operovaných na systému MECC, 100 pacientů operovaných na systému ROCSafe a 100 pacientů operovaných na klasickém MO v období od října 2006 do října 2007. Jednalo se o operace aortokoronárních bypassů včetně akutních výkonů. Operace prováděli všichni chirurgové, vylučujícími kritérii byly konvertované výkony původně plánované bez použití MO, resuscitace předoperačně, dialýza předoperačně a intraaortální kontrapulzace pooperačně. V demografických datech, euroskóre, ani v operačních parametrech nebyly mezi jednotlivými skupinami žádné statisticky významné rozdíly. Mezi jednotlivými skupinami nebyl prokázán statisticky významný rozdíl v pooperační krevní ztrátě do 24 hod, pooperační hladině hemoglobinu, době hospitalizace a výskytu perioperační ischémie. Ve všech ostatních sledovaných parametrech byl prokázán statisticky významný rozdíl ve prospěch obou minisystémů oproti klasickému MO: celková krevní ztráta(p = 0,05), délka pooperační umělé plicní ventilace (p < 0,05), počet revizí pro krvácení (p < 0,01), výskyt pooperační fibrilace síní (p < 0,01), perioperační hladina hemoglobinu (p < 0,05), počet podaných transfuzních jednotek erytrocytární masy a mražené plazmy (oboje p <0,05), počet podaných transfuzních jednotek trombocytů(p < 0,01). U minisystémů byla též zjištěna nižší hladina CRP za 48 hod. po operaci (p < 0,05), nižší hladina prokalcitoninu 3 dny po operaci (p < 0,05), nižší hladina troponinu 24 hod. po operaci (p < 0,05) a nižší potřeba dobutaminu do 48 hod. po operaci (p < 0,05). Rozdíly mezi oběma minisystémy byly minimální.
Na tuto studii navázala multicentrická studie ROCsafeRX, která na 6 pracovištích porovnávala celkem 480 pacientů s CABG operovaných buď na systému ROCSafe, nebo na klasickém MO. Výsledky byly obdobné. Opět byla ve prospěch minisystému konstatována nižší pooperační krevní ztráta(p < 0,05), nižší celková potřeba krevních derivátů (p < 0,01), kratší doba pooperační umělé plicní ventilace (p < 0,05), kratší doba celkové hospitalizace (p < 0,01), nižší pooperační hodnota CRP (p < 0,01) a nižší výskyt pooperační fibrilace síní, a to s i bez profylaktické léčby (oboje p < 0,01) [5].
Další multicentrická studie (Plzeň, Braunschweig, Hannover) již porovnávala operace aortální chlopně a ascendentní aorty, a to sólově či v kombinaci s CABG. Do studie bylo zahrnuto 85 pacientů operovaných na systému ROCSafe a 85 pacientů operovaných na standartním MO. I tato studie dospěla k obdobným výsledkům ve prospěch minisystému. Byla prokázána nižší potřeba transfuzí a mražených plazem(p < 0,05), kratší pobyt na JIP (p < 0,01) a nižší pooperační vzestup leukocytů a CRP (oboje p < 0,05) [6].
Při nezpochybnitelných výhodách miniinvazivního MO je potřeba zároveň poukázat na úskalí a rizika jeho používání. V první řadě tento systém klade větší nároky na chirurgickou techniku (šetrné operování s minimálním krvácením) a na spolupráci celého týmu.
Riziko zavzdušnění systému (air lock) při náhlém nasátí vzduchu bylo téměř dokonale odstraněno vývojem nejprve pasivního a později aktivního (poloautomatického a následně i plně automatického) odvzdušňovacího systému. Druhým nebezpečím může být prudká perioperační krevní ztráta při náhlé komplikaci. U systémů typu MECC nezbývá než hradit ztrátu náhradními roztoky (je důležité mít vždy připraven silný i. v. vstup), krev odsávat do předem připraveného rekuperátoru a následně vracet erytrocytární koncentrát. Tento systém již na našem pracovišti nepoužíváme. U systémů ROCsafe a RESTING HEART je jednoduchým a bezpečným řešením aktivace koronárního sání.
Na kardiochirurgickém oddělení FN Plzeň se minisystémy ROCsafe a RESTING HEART postupně staly každodenní rutinou a dnes jsou na nich operovány více než 2/3 všech operací na zavřeném srdci a více než 1/3 všech operací na otevřeném srdci, (tj. operace aortální, mitrální i trikuspidální chlopně a plánované operace vzestupné aorty).
Závěrem lze konstatovat:
- Miniinvazivní MO lze rutinně používat k bezpečnému provedení kardiochirurgických výkonů nejen na zavřeném, ale i na otevřeném srdci (tj. k operacím chlopní).
- Miniinvazivní MO je pro pacienty méně zatěžující než klasický MO a snižuje pooperační potřebu krevních derivátů.
Podmínkou je správná technika vedení perfuze, přizpůsobení operační techniky chirurga, pozornost anesteziologa a intenzivnější spolupráce a komunikace celého operačního týmu.
Literatura
1. Paparella, D., Yau, T. M., Young, E. Cardiopulmonary bypass induced inflammation: patho-physiology and treatment. An update. Eur. J. Cardiothorac. Surg., 2002, 21, p. 232–244.
2. Koster, A., Fischer, T., Praus, M. et al. Hemostatic activation and inflammatory response during cardiopulmonary bypass: impact of heparin management. Anesthesiology, 2002, 97, p. 837–841.
3. Kutschka, I., Schoenrock, U., El Essawi, A., Pahari, D., Anssar, M., Harringer, W. A new minimized perfusion circuit provides highly effective ultrasound controlled de-airing. Artif Organs, 2007, 31, p. 215–220.
4. Fromes, Y., Gaillard, D., Ponzio, O. et al. Reduction of the inflammatory response following coronary bypass grafting with total minimal extracorporal circulation. Eur. J. Cardiothorac. Surg., 2002, 22, p. 527–533.
5. El-Essawi, A., Hajek, T., Skorpil, J., Böning, A., Sabol, F., Ostrovsky, Y., Hausmann, H., Harringer, W. Are minimized perfusion circuits the better heart lung machines? Final results of a prospective randomized multicentre study. Presented at the 24th Annual Meeting of the European Association for Cardio-Thoracic Surgery, Geneva, Switzerland, September 11-15, 2010.
6. Skorpil, J., El Essawi, A., Hajek, T., Harringer, W. Beneficial effects of modern perfusion concepts in aortic valve and aortic root. Sumery I Kutschka. J. Perfusion., 2009, 24, p. 37.
Predikce velkých krevních ztrát po kardiochirurgickém výkonu v mimotělním oběhu
Hájek R.1 , Růžičková J.2, Zuščich O.1, Zapletalová J.3,Šimek M.1, Fluger I.1
1Kardiochirurgická klinika, Fakultní nemocnice Olomouc; 2Středomoravská nemocniční, a. s., Prostějov; 3Ústav biofyziky, Lékařská fakulta Univerzity Palackého Olomouc
Úvod: Krvácení v souvislosti s kardiochirurgickým výkonem zůstává závažným faktorem morbidity a mortality. Tromboelastografie (TEG) je v kardiochirurgii běžně užívanou metodou detekce poruch hemostázy a podle starších studií je významně lepším prediktorem krvácení než standardní laboratorní testy hemokoagulace.
Metody: V prospektivní studii byl sledován soubor 500 pacientů podstupujících elektivní kardiochirurgický výkon v mimotělním oběhu (MTO) se standardní antikoagulací – heparin 3 mg/kg monitorovanou pomocí ACT (Hemochron). Pacienti byli monitorováni pomocí TEG přístrojem Haemoscope 5000, kaolinem aktivovaný vzorek (1. odběr v úvodu do anestezie – nativní, 2. po povolení aortální svorky v průběhu MTO – heparináza, 3. a 4. na konci výkonu po podání protaminu – nativ i heparináza). Dále byl proveden soubor laboratorního vyšetření (Quickův test, aPTT, TT, fibrinogen, trombocyty) bezprostředně před výkonem a po výkonu. Byl sledován objem krevních ztrát peroperačně a do 24 h po výkonu. Jako velké ztráty byly považovány peroperační ztráty > 500 ml a poperační > 1000 ml. Ke statistickému zpracování dat byl použit software SPSS verze 15 (SPSS Inc., Chicago, USA). Normalita dat byla ověřena testem Kolmogorov-Smirnov. Vzhledem k nenormální distribuci hodnot měřených parametrů byl pro porovnání skupiny pacientů s velkou krevní ztrátou, se skupinou s přiměřenou krevní ztrátou, použit Mann-Whitney U-test. K identifikaci nezávislých významných prediktorů pro predikci velké krevní ztráty, byla použita logistická regresní analýza. U významných prediktorů byla provedena také ROC analýza. Všechny testy byly dělány na hladině signifikance 0,05.
Výsledky: Byla zpracována data 499 pacientů (věk 66,6 ± 9,7 let, podíl mužů 67,5 %). Průměrná hodnota krevních ztrát peroperačně byla 373 ± 351 ml, pooperačně 819 ± 519 ml, operační revize pro krvácení 1,6 %, průměrná dávka erytrocytárního koncentrátu 0,63 TU/pac, čerstvě zmrazené plazmy 0,34 TU/pac. a trombocytárního koncentrátu 0,01 TU/pac. Bylo identifikováno celkem 96 (19,2 %) pacientů s vyššími ztrátami. Významnými prediktory vyšších peroperačních ztrát byly detekovány vyšší hodnota MA1 – maximální amplituda v 1. vzorku TEG-(OR 1,046, p = 0,011) a nižší hodnota Quickova testu předoperačně (OR 0,98,p = 0,035). Predikční hodnota obou parametrů podle ROC je nízká. Významnými prediktory vyšších ztrát pooperačně byly vyšší hodnota TEG parametru K3 (OR 1,2546 p = 0,043), nižší MA3 (OR 0,963,p = 0,0032) a nižší předoperační počet trombocytů (OR 0,992, p = 0,0001). Predikční hodnota všech těchto parametrů je nízká. Dalšími detekovanými prediktory byl věk (s nárůstem o 1 rok se zvyšuje riziko velkého krvácení 1,056krát) a mužské pohlaví (zvýšení rizika 3,549krát).
Závěr: Tromboelastografie ani standardní laboratorní testy hemokoagulace nejsou dostatečně silnými prediktory velkých krevních ztrát u výkonů v mimotělním oběhu. Významným prediktorem je mužské pohlaví, riziko vyšších ztrát roste též s věkem pacienta.
Práce byla podpořena grantem IGA MZ ČR NA 7478-3.
Srovnání rotačního a centrifugálního pohonu mimotělního oběhu u pacientů podstupujících endarterektomii plícnice
Kunstýř J.
Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. LF UK a Všeobecná fakultní nemocnice v Praze
Úvod: Domníváme se, že použití centrifugálního pohonu mimotělního oběhu (MO) namísto rotačního u operací s dlouhým MO může mít pozitivní vliv na ukazatele hemolýzy, zánětlivou odpověď, renální funkce, stejně jako na krevní ztráty a celkový pooperační průběh.
Metody: Po získání informovaného souhlasu bylo od září 2010 do prosince 2011 zařazeno do studie 39 pacientů indikovaných k endarterektomii plícnice. Skupinu A tvořilo 20 pacientů, u kterých bylo použito rotační čerpadlo, skupinu B tvořilo 19 pacientů a u nich bylo k pohonu MO použito centrifugální čerpadlo. Demografická, laboratorní a klinická data byla porovnána mezi skupinami. Údaje s normálním rozložením byla analyzována za použití ANOVA s opakovaným měřením a s následným Fisherovým porovnáním. U hodnot bez normálního rozložení byl použit Mannův-Whitneyův test. Hodnoty jsou vyjádřeny jako střed ± směrodatná odchylka v případě normálního rozložení a jako průměr (min – max) pro hodnoty s nenormálním rozložením.
Výsledky: Mezi skupinami nebyl shledán statisticky významný rozdíl v hodnotách volného hemoglobinu (0,11 ± 0,01 vs. 0,11 ± 0,006 md . dl-1),C reaktivního proteinu [39 (19–58) vs. 38 (15–51) . mg∙l-1] a prokalcitoninu [1,9 (1,5–2,4) vs. 2,0 (1,4–2,4) µg . l-1]. Obdobně se ani kreatinin (130 ± 17 vs. 127 ± 10 µmol . l-1), krevní ztráty (1124 ± 109 vs. 1000±97 ml) či délka pobytu na pooperačním oddělení (7,3 ± 3,7 vs. 7,8 ± 3,2 dny) mezi skupinami nelišily. 24 hodiny po operaci jsme zaznamenali signifikantně nižší hladinu Interleukinu-6(IL-6) ve skupině B [436 (364 – 489) vs. 510 (449 – 544) ng∙l-1, p = 0.044].
Závěr: Naše výsledky ukazují, že použití centrifugální pumpy u dlouhého MO může snížit intenzitu systémové zánětlivé odpovědi organismu vyjádřené dynamikou IL-6. Nicméně, tyto laboratorní změny nemají vliv na klinické ukazatele.
Podpořeno grantem MZ ČR IGA NT 11210-4/2010.
Anestezie u thorakoskopických operací mitrální chlopně
Mošna F.
KAR FN Motol a 2. LF UK
V posledních 10 letech došlo k významnému rozvoji miniinvazivní srdeční chirurgie. V mnohých kardiocentrech se tak thorakoskopická operace mitrální chlopně (TOMCH) stala standardním postupem při řešení regurgitačních i stenotických vad. Užití miniinvazivní techniky vede ke zkrácení pooperační UPV, ke zkrácení pobytu na JIP i v nemocnici, k nižším krevním ztrátám, k menšímu počtu podaných krevních derivátů, ke snížení výskytu pooperační fibrilace síní a rané infekce. Z pohledu pacienta pak k většímu subjektivnímu uspokojení z výsledku operace – kratší výskyt bolesti, rychlejší mobilizace a lepší kosmetický efekt. Těchto výsledků je dosaženo bez negativního vlivu na dlouhodobý výsledek operace a bez navýšení četnosti reintervence. Na druhou stranu vede miniinvazivní technika k prodloužení délky aortální svorky a mimotělního oběhu (MTO) a operačního času, ke zvýšení rizika perioperační mozkové příhody, aortální disekce nebo poškození aorty a porušení n. phrenicus.
Přestože se jedná z chirurgického pohledu o přístup méně invazivní, z anesteziologického hlediska vyžaduje, ne-li více invazivní, tak přinejmenším jiný postup než při standardní kardiochirurgické operaci vedené přes sternotomii.
Poloha a příprava
Pacient je při thorakoskopické operaci mitrální chlopně (TOMCH) v poloze mírně na levém boku, zároveň je umožněn přístup k oběma tříslům z důvodů kanylace. Při TOMCH nelze naložit vnitřní defibrilační elektrody, proto jsou před začátkem operace nalepeny zevní defibrilační elektrody.
Anestezie
Vedení anestezie se podstatně neliší od standardního postupu v rámci fast track anestezie. Jsou volena krátce působíce anestetika, často v kombinaci s různými typy lokální anestezie. Epidurální anestezie poskytuje dobrou kardiovaskulární stabilitu během výkonu a ideální pooperační analgezii. Určitá nejistota stále panuje ohledně zavedení epidurálního katétru těsně před výkonem s následnou plnou heparinizací. Další možností je použití paravertebrálního bloku buď formou jednorázové blokády, nebo použitím katétru pro kontinuální podávání anestetika. Standardní je pak infiltrace operačních ran dlouhodobě působícím lokálním anestetikem.
V průběhu thorakoskopického výkonu je v období před MTO a po MTO nutná jednostranná ventilace. Obecně je preferována intubace dvouluminální rourkou z důvodů lepší fixace a stability při polohování pacienta. Při obtížném zajištění dýchacích cest nebo u pediatrických a malých pacientů lze použít orotracheální intubaci a bronchiální blokátor.
Kanylace
Z důvodů omezeného přístupu k horní a dolní duté žíle z operačního pole je chirurgy preferována kanylace dolní duté žíly z třísla a horní duté žíly cestou v. jugularis interna. Anesteziolog se tak přímo účastní na přípravě MTO. Kanylace je prováděna pod sonografickou kontrolou – jak místo punkce, tak umístění konce kanyly cca 2 cm nad vstupem do pravé síně. Stejně tak umístění kanyly v dolní duté žíle je kontrolováno echokardiograficky.
Arteriální kanyla pro MTO je zaváděna cestou a. femoralis. TEE kontrola polohy drátěného vodiče v sestupné aortě snižuje riziku disekce arterie.
Echokardiografie
Nedílnou součástí práce anesteziologa při TOMCH je úloha echokardiografisty. Vedle standardní perioperační echokardiografie se podíly na kanylaci a významnou roli hraje před odpojováním z MTO. Při TOMCH není prakticky možný přímý pohled na srdce, který by umožňoval hodnocení kinetiky a náplně srdečních oddílů. Sledování těchto parametrů echokardiograficky je tak nezbytnou součástí managementu při odpojování z MTO a v časném období po MTO. Dále kontrola dokonalého odvzdušnění před sejmutím aortální svorky pomocí TEE je úlohou anesteziologa.
Závěr
Přestože jsou thorakoskopické operace mitrální chlopně spojeny s celkově nižší operační zátěží pro pacienta, vyžadující od anesteziologa vyšší invazivitu při zajištění dýchacích cest i cévního řečiště. Nezbytnou součástí znalostí anesteziologa v rámci TOMCH je echokardiografie. Při TOMCH je oproti standardní kardiochirurgické operaci nutná ještě větší spolupráce celého operačního týmu.
Literatura
1. Kaplan, Joel A. et al. Kaplan’s Cardiac Anesthesia. 5th ed. Philadephia: Elsevier, 2006, 1276 s. ISBN 1-4160-0253-7.
2. Cheng, Davy C. H. et al. Minimally Invasive Versus Conventional Open Mitral Valve Surgery. Innovations, 2011;Volume 6, Number 2, p. 85–103.
Péče o pacienta s VAD hospitalizovaného na kardiochirurgickém pracovišti: weaning či transport k následné léčbě do transplantačního centra?
Říha H.1, 2, Kramář P.1, Syrovátka Pr.1, Pinďák M.1, Rzyman R.1,Netuka I.3, Malý J.3, Szárszoi Oj.3, Kotulák T.1, 2
1Klinika anesteziologie a resuscitace, Kardiocentrum IKEM, Praha; 2Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. LF UK, Praha; 3Klinika kardiovaskulární chirurgie, Kardiocentrum IKEM, Praha
Podpůrné systémy pro srdeční komory (ventricular assist device [VAD]) jsou nejširší skupinou aktivních mechanických srdečních podpor zaváděných při těžké dysfunkci myokardu po rozsáhlých kardiochirurgických operacích v indikaci bridge-to-recovery. Vliv VAD na myokard po kardiochirurgické operaci lze rozdělit do tří základních okruhů: dekomprese/unloading selhávající srdeční komory (pokles napětí ve stěně myokardu s poklesem spotřeby O2, pokles četnosti/vymizení maligních komorových arytmií); vysazení farmakologické inotropní podpory (pokles spotřeby O2 myokardem, upregulace ß-adrenergních receptorů); normalizace dodávky O2 do tkání (zvrat MODS/MOF, normalizace koncentrací působků neuroendokrinního systému, pozitivní vliv restituce nativní funkce ostatních orgánových systémů na obnovu funkce myokardu).
Z časového hlediska lze rozlišit tři fáze podpory VAD systémy. Iniciální fáze (24–72 hod.) je charakterizována maximálním průtokem krve zajišťovaným VAD (maximalizace dodávky O2 do tkání) při vstupním metabolickém rozvratu, objemovou terapií transfuzními přípravky při krvácení; často je zahajována kontinuální eliminační metoda (CRRT) pro akutní selhání ledvin, pokračuje umělá plicní ventilace (UPV) a vazopresorická podpora. Fáze stabilizace (dny, týdny, eventuálně měsíce) se vyznačuje určitým krevním průtokem nativními srdečními oddíly (minimalizace rizika vzniku trombů), ukončením farmakologické inotropní a vazopresorické podpory, antikoagulační terapií podle požadavků výrobce VAD, odpojením od UPV a postupnou obnovou funkce dalších orgánových systémů (játra, GIT, ledviny). Finální fázi představuje odvykání od VAD (weaning), jež trvá řádově dny.
Zahájit weaning VAD je možné při adekvátní obnově kontraktility komory podporované VAD (echokardiografické vyšetření probíhá při sníženém průtoku VAD na ~ 2 l/min.); podmínkou je také uspokojivý celkový stav pacienta a návrat funkce ostatních orgánových systémů. Weaning zahajujeme 24hodinovou infuzí levosimendanu; následuje snižování průtoku krve VAD systémem za detailního monitorování hemodynamiky [1] a laboratorních parametrů. Explantace VAD probíhá v celkové anestezii na operačním sále, kde je podána plná dávka heparinu a průtok VAD systémem snížen na ~ 0,5 l/min; následuje 30–60minutové echokardiografické sledování spolu s detailním monitorováním hemodynamiky [2].
V případě nemožnosti odpojit VAD systém u pacienta po kardiochirurgické operaci je jednou z možností kontaktovat transplantační centrum. Tam je možné pokusit se o weaning VAD v delším časovém odstupu (což je často úspěšná strategie) a v případě nemožnosti weaningu VAD zvážit další postup (při eventuálním splnění kritérií pro zařazení na čekací listinu pro transplantaci srdce např. implantace dlouhodobého systému VAD v indikaci bridge-to-transplantation).
Literatura
1. Říha, H., Kotulák, T., Syrovátka, P. et al. eComment: Hemodynamic monitoring with LiDCOplus system in the patients supported by isolated right ventricular assist device. Interact. Cardiovasc. Thorac. Surg.,
2011, 13, 1, p. 57.
2. Netuka, I., Malý, J., Szárszoi, O. et al.
Technika implantace a zkušenosti s dočasnou mechanickou srdeční podporou
při selhání pravé komory. Rozhl. Chir., 2011, 90, 2, s. 88–94.
Antibiotická profylaxe v kardiochirurgii
Samek J.1, Turek Z.1, Stříteská J.1, Černý V.1, Harrer J.2
1Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice v Hradci Králové; 2Kardiochirurgická klinika, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice v Hradci Králové
Profylaktické systémové podání antibiotik (ATB) v kardiochirurgii je jednoznačně doporučeným postupem v prevenci chirurgických (ranných) infekcí. Stále diskutovaným tématem je volba ATB a především doba profylaktického podání ATB. Trvání ATB profylaxe se mnohdy liší na různých kardiochirurgických pracovištích v rámci národních společností. Ne jinak tomu bude z největší pravděpodobnosti i u nás. Na rozdíl od jiných chirurgických oborů je tato problematika v kardiochirurgii stále diskutována. Jako příčina těchto rozdílných pohledů bývá označována absence dat stran délky ATB profylaxe, dále relativně nízká incidence ranných infekcí a v neposlední řadě určité podcenění negativního dopadu protrahované ATB profylaxe.
V rámci hodnocení délky trvání ATB profylaxe lze označit za nepodložené prodlužování ≥ 48 hodin. Jako krátkodobá ATB profylaxe bývá označována ≤ 24 hodin. Krátkodobý režim ATB profylaxe je spojen s vyšším výskytem ranných infekcí, a to bez ohledu na volbu ATB.
Při ATB profylaxi ≥ 48 hodin se uplatňuje negativní dopad prodlouženého podávání ATB v podobě antimikrobiální rezistence a relativně časný výskyt klostridiové superinfekce (CDAC – Clostridium difficile associated diarrhoea), která je spojena především s podáváním cefalosporinů.
Velice důležitým faktorem v ATB profylaxi je načasování iniciální dávky. ATB profylaxe je doporučena v intervalu 30–60 minut před kožním řezem. Jistě je důležité i dodržení časového intervalu zaručujícího dostatečnou sérovou koncentraci daného ATB. Mimotělní oběh vede ke snížení sérové koncentrace, a to na podkladě hemodiluce, zvýšení distribučního objemu či vychytávání na povrchu oxygenátoru atd. Více než sledování ATB sérové koncentrace je doporučováno dodržování dávkovacího schématu. Opakovaná dávka ATB je doporučována za 3–4 hodiny v případě otevřeného hrudníku, respektive operačního výkonu. Interval mezi iniciální a druhou dávkou odpovídá cca 2násobku biologického poločasu zvoleného ATB.
Nejčastějším profylaktickým ATB 1. volby je skupina beta-laktamů nebo glykopeptidů. Z beta-laktamových ATB je to jednak penicilinová řada, nebo cefalosporiny první, druhé či třetí generace. Při volbě cefalosporinů vyšší generace je antimikrobiální spektrum rozšířeno o gramnegativní flóru. Tento fakt je dáván do souvislosti s lepší prevencí ventilátorové pneumonie. Toto zdůvodnění, respektive indikace, je však zpochybnitelné z pohledu důkazy nepodložené ATB profylaxe ventilátorové pneumonie. Nejedná se o profylaktické, ale o terapeutické podání. Použití cefalosporinů není však akceptováno všemi odbornými společnostmi z důvodů nárůstu klostridiových superinfekcí a antimikrobiálních rezistencí. Alternativou beta-laktamových ATB jsou glykopeptidy, a to především při vyšším výskytu MRSA (methicilin rezistentní Stafylokokus aureus) v populaci. Glykopeptidy jsou kombinovány s aminoglykosidy, s cílem rozšíření antimikrobiálního spektra. Volba ATB je významně individuální a měla by odrážet aktuální epidemiologickou situaci na oddělení.
Současná praxe na kardiochirurgické klinice v Hradci Králové je taková, že lékem volby v ATB profylaxi je cefuroxim a v případě alergie klindamycin. Klademe důraz na podání ATB 30 minut před samotným začátkem operace (kožní řez). Peroperační interval je 4 hodiny a pooperačně dodržujeme interval 6–8 hodin. U nemocných po aortokoronárním bypassu trvá profylaxe 24 hodin a u nemocných po výkonu na chlopních, aortě či jiném rozsáhlejším výkonu ponecháváme profylaxi 48 hodin.
Velice důležitá je při volbě ATB strategie spolupráce s klinickým mikrobiologem, a to nejen při profylaktickém, ale i terapeutickém podání ATB. Dovolím si konstatovat, že se ve světle vlastního kardiochirurgického výkonu a v perioperačním období určité akcentaci především hemodynamické a ventilační stabilizaci nemocného, může jevit ATB terapie jako podřadná a méně důležitá. Nicméně prevence ranných infekcí a ATB léčba je důležitým faktorem, který určuje morbiditu, délku hospitalizace a celkové náklady za léčbu nemocných na všech kardiochirurgiích. Z tohoto pohledu si jistě i tato oblast perioperační péče naši pozornost zaslouží.
Literatura
1. Adi Lador Antibiotic prophylaxis in cardiac surgery: systematic review and meta-analysis. Journal of Antimicrobial Chemotherapy, 2012, 64, p. 541–550.
2. Fred H. Edwards The Society of Thoracic Surgeons Practice Guideline Series. Antibiotic Prophylaxis in Cardiac Surgery, 2006.
Renální denervace z pohledu anesteziologa
Vaněk T., Bednář F., Widimský P.
Kardiocentrum 3. LF UK a FNKV, Praha
Hypertenzní choroba je nejrozšířenějším kardiovaskulárním onemocněním. V České republice (ČR) žije asi 2,5 milionu hypertoniků, přičemž rezistentní/refrakterní formou hypertenze (navzdory podávání nejméně trojkombinace antihypertenziv včetně diuretik v adekvátních dávkách) trpí až 10 % z nich [1]. Pro tyto pacienty by mohla být nadějí relativně nová metoda katetrizační renální denervace, která snižuje aktivitu jak eferentního (eferentní vlákna – snížení prokrvení ledvin, stimulace tvorby reninu, zvýšení reabsorpce sodíku), tak aferentního (aferentní vlákna – zvýšení aktivity centrálního sympatiku) sympatického systému [2].
První pokusy o neselektivní chirurgickou sympatektomii (která byla nazývána subdiafragmatickou splanchnikektomií) proběhly již v 50. letech minulého století, tedy před érou efektivní farmakologické antihypertenzní terapie [3]. Tyto výkony byly doprovázeny řadou nežádoucích pooperačních účinků (ortostatická hypotenze a tachykardie, palpitace, dušnost, anhidróza, erektilní dysfunkce aj.) a též poměrně vysokou 5% perioperační mortalitou [4]. Se zvyšující se dostupností účinných perorálních antihypertenziv v 60. letech minulého století bylo od chirurgického řešení závažných hypertenzí postupně upuštěno.
O katetrizačně provedené renální denervaci referoval jako první v roce 2009 australský experimentální nefrolog Markus Schleich [5]. V témže roce byla uveřejněna multicentrická studie Symplicity HTN-1(45 pacientů), která ověřovala bezpečnost a účinnost metody [6], tato pak byla následována randomizovanou studií Symplicity HTN-2 (106 pacientů, randomizace 1 : 1) [7]. Výsledky obou studií jsou velmi nadějné, avšak zůstávají otázky, které dosud nejsou přesvědčivě zodpovězeny (nejasný dlouhodobý efekt – možný problém s prorůstáním eferentních vláken sympatiku, ovlivnění celkové kardiovaskulární mortality, dlouhodobá bezpečnost). V ČR provedl první katetrizační renální denervaci v červenci 2011 v Olomouci tým vedený Milošem Táborským, naše kardiocentrum zahájilo program renálních denervací v říjnu 2011.
Princip této selektivní, minimálně invazivní metody spočívá v tom, že jsou pomocí nízké radiofrekvenční energie (5–8 W) destruovány autonomní nervy probíhající v adventicii obou renálních arterií. Ablační katétr je zaváděn z třísla cestou a. femoralis postupně do obou renálních arterií a na každé straně je provedeno 4–6 lézí umístěných spirálovitě na stěnu tepny (přičemž krevní tok ochlazuje intimu a zabraňuje poškození endotelu). Ablace trvají 2 minuty (každá jednotlivá léze) a vyvolávají silnou difuzní abdominální bolest viscerálního typu, z toho důvodu je třeba výkon provádět v hluboké analgosedaci (např. benzodiazepiny + propofol kontinuálně + bolusové dávky opioidů před aplikací radiofrekvenční energie). Dalším možným periproceduálním nežádoucím účinkem je bradykardie během ablací (ve studii Symplicity HTN-2 13%), která reaguje na podání atropinu.
Katetrizační renální denervace bývají doménou intervenčních kardiologů (zkušenost s katetrizací a. femoralis) a arytmologů (zkušenost s radiofrekvenční ablací), vzhledem k analgosedaci je během výkonu též nezbytná přítomnost anesteziologa.
Literatura
1. Widimský, J. jr., Cífková, R., Špinar, J. et al. Doporučení diagnostických a léčebných postupů u arteriální hypertenze – verze 2007. Doporučení České společnosti pro hypertenzi. Cor Vasa, 2008, 50, s. K5–K22.
2. Widimský, P., Osmančík, P., Widimský, J. jr. Renální denervace: naděje pro nemocné s refrakterní hypertenzí? Cor Vasa, 2011, 53, s. 517–521.
3. Tam, G. M., Yan, B. P., Shetty, S. V., Lam, Y. Y. Transcatheter renal artery symphatetic denervation for resistant hypertension: an old paradigm revisited. Int. J. Cardiol., 2012, doi: 10.1016/j.ijcard.2012.01.048 [Epub ahead of print].
4. Azizi, M., Steichen, O., Frank, M., Bobrie, G., Plouin, P. F., Sapoval, M. Catheter-based radiofrequency renal-nerve abla-tion in patients with resistant hypertension. Eur. J. Vasc. Endovasc. Surg., 2012, 43, p. 293–299.
5. Schleich, M. P, Sobotka, P. A., Krum, H. et al. Renal sympathetic-nerve ablation for uncontrolled hypertension. N. Engl. J. Med., 2009, 361, p. 932–934.
6. Krum, H., Schlaich, M., Whitbourn, R. et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study. Lancet, 2009, 373, p. 1275–1281.
7. Esler, M. D., Krum, H., Sobotka, P. A. et al. Renal sympathetic denervation in patients with treatment resistant hyperten-sion (The Symplicity HTN-2 Trial): a randomized controlled trial. Lancet, 2010, 376, p. 1903–1909.
Ischemic conditioning – nové strategie myokardiální ochrany
Wagner R.
CKTCH Brno
Ischemic preconditioning (IPC) je termín pro vrozenou ochrannou reakci, kterou lze vyvolat krátkou ischémií myokardu před následným letálním ischemicko-reperfuzním poškozením. Kardioprotekce je dvoufázová: bezprostřední časná (trvá 3 hod.) a za 24 hod. nastupuje pozdní (trvá 3 dny). Navzdory slibným experimentálním výsledkům (záchrana 25 % myokardu) IPC nebyl zatím úspěšně přenesen do klinické praxe hlavně ze dvou důvodů. Požadavek aplikovat IPC stimulus před plánovanou ischémií myokardu omezovalo použití jen na srdeční operace. Klasická aplikace vyžadovala intervenci přímo na srdci, respektive na aortě, což prodlužovalo vlastní výkon a zvyšovalo riziko embolizace.
Tyto překážky byly odstraněny objevem nových aplikačních technik, jako jsou ischemic perconditioning (aplikace stimulu během ischémie), postconditioning (aplikace na začátku reperfuze) a především remote ischemic preconditioning (aplikace na jiný orgán, např. končetinu). V posledních 5 letech se objevilo několik desítek klinických studií typu „proof of concept“, které testovaly účinnost časné fáze kardioprotekce a ojediněle i pozdní fáze [1] jak v kardiochirurgii, tak v invazivní kardiologii. Pozitivní vliv vzdáleného předtrénování (menší vzestup troponinu) byl potvrzen i v nové metaanalýze 9 studií – 704 pacientů operovaných pro CABG (2).
Zdali tyto nové techniky zlepší také klinické výsledky u CABG bude objasněné probíhajícími multicentrickými studiemi: ERICCA 2010, RIPHeart 2010 a také v intervenční kardiologii: POSTEMI 2010, POSTAMI 2010.
Vzdálené ischemické předtrénování díky neinvazivnosti a snadnosti aplikace má potenciál ochrany před ischémii pro další orgány jako jsou ledviny, mozek či v transplantační nebo sportovní medicíně.
Literatura
1. Wagner, R., Piler, P., Adamek, P., Bedanova, H., Grodecka, L., Freiberger, T. Myocardial injury is decreased by late remote ischaemic preconditioning and aggravatedby tramadol in patients undergoing cardiac surgery.: a randomised controlled trial. ICVTS, 2010, 11, p. 758–62.
2. D’Ascenzo, F., Cavallero, E., Moretti, C., Omedè, P., Sciuto, F., Rahman, I. A., Bonser, R. S., Yunseok, Y., Wagner, R., Freiberger, F., Kunst, G., Marber, M. S., Thielmann, M., B. Ji, Y. M. Amr, M. G., Modena, G. B., Zoccai, I., Sheiban, F., Gaita. Remote ischemic preconditioning in coronary artery bypass surgery: a meta-analysis. Heart, 2012. in press.
Efekt suplementace oxidu dusnatého (N0) na mikrocirkulaci u operace srdce
Wagner R., Adámek P., Piler P., Nešporová J., Píchovcová B.
CKTCH Brno
Úvod a cíl: Původní koncepce objevitelů NO jako malého hormonu parakrinní povahy (působící v místě uvolnění) byla v poslední době rozšířena o endokrinní (systémové) účinky. NO z plicního endotelu se váže reverzibilně na cysteinové thiolové konce oxyhemoglobinu (S-nitrosothiol) a je transportován do mikrocirkulace, kde zvyšuje průtok (vazodilatace, inhibice trombocytů a leukocytů). V tomto smyslu je pohlíženo na NO jako na „třetí plyn“ respiračního cyklu [1]. Srdeční operace doprovází přechodná dysfunkce orgánů, na níž se podílí porucha mikrocirkulace. Jednou z příčin může být nedostatečný transport NO během fáze mimotělního oběhu (CPB). Ve studii z r. 2004 suplementace NO během srdeční operace zlepšovala ochranu myokardu měřené nižším uvolněním troponinu [2].
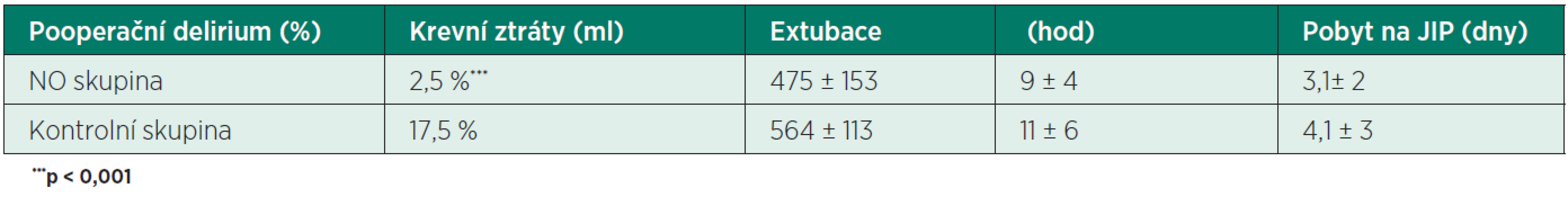
Primárním cílem této studie bylo zhodnocení suplementace NO na mozkovou dysfunkci (pooperační delirium) a na některé pooperační parametry jako krevní ztráty, délka pobytu na JIP, čas extubace.
Pacienti a metoda: Otevřená randomizovaná studie na 80 pacientech (40 NO + 40 kontrola). Pacienti se nelišili demograficky, ani v klinických parametrech: věk 74 ± 9 let, kombinované výkony, hypotermie 33 °C, CPB 96 ± 26 min., aortální svorka 58 ± 14 min.NO (40 ppm) byl aplikován do inhalační směsi ventilátoru a oxygenátoru Capiox. Pooperační mozková dysfunkce byla definována přítomností delirantního stavu, který vyžadoval sychofarmaka a/nebo kurtaci.
Výsledky uvádí tabulka 1.
Závěr: Suplementace NO během srdečních operací v CPB snižuje významně výskyt pooperačního deliria pravděpodobně zlepšením mozkové mikrocirkulace. Rozdíly v dalších sledovaných parametrech nedosahovaly statistické významnosti.
Literatura
1. Nitric oxide transport in blood: a third gas in the respiratory cycle. Comprehensive Physiology, 2011, p 1–84.
2. Supplemental NO and its effect on myocardial injury in patients undergoing cardiac surgery with extracorporeal circulation. J. Thorac. Cardiovasc. Surg., 2004, 127, p. 44–50.
Rossova operace – retrospektivní analýza 2002–2012
Zmeko D., Šulda M., Mokráček S.
Kardiocentrum Nemocnice České Budějovice, a. s., Česká republika
Úvod
Náhrada aortální chlopně mechanickou či biologickou protézou jsou nejčastější chirurgické výkony na patologicky změněné aortální chlopni. Tento typ operací si vynucuje trvalé doživotní podávání farmak, které ovlivňují krevní srážlivost a často vede k různým významným omezením v životním stylu operovaných. Současné biomedicínské technologie se konstrukcí nových typů chlopní snaží redukovat tyto nevýhody. Chirurgickou cestou jejich řešení jsou komplexnější chirurgické postupy:
- použití aortálního homograftu (aortální chlopeň z mrtvého dárce) nebo
- Rossova operace.
Rossova operace
Rossova operace – pulmonální autograft – v sobě skrývá velké dilema. Z operace na jedné chlopni (aortální) dělá operaci chlopní dvou (aortální a plícnicová). Poškozená aortální chlopeň je nahrazena pacientovi vlastní chlopní plícnicovou a na její místo je poté použit homograft. Zásadní předností je fakt, že jako jediná možná alternativa nahrazuje „nemocnou“ chlopeň vlastní, „živou“ chlopní plícnicovou, která si zachovává všechny výhody s tím související. Operace se provádí od novorozenců až k dospělé populaci.
Výhody: exkluzivní odolnost vůči infekci, odolnost vůči zvápenatění s předpokladem dlouhodobé perspektivy, minimální riziko tvorby krevních sraženin, zcela normální hemodynamické parametry, maximální šetrnost vůči krevním elementům, zcela nehlučný chod a schopnost růstu u dětí.
Nevýhodou je reálně vyšší operační riziko související s obtížností a rozsahem tohoto výkonu, dlouhým trváním mimotělního oběhu se všemi indukovanými dysfunkcemi a komplikacemi; existuje riziko degenerace.
Tato operace je určena zejména nemocným velmi mladého až středního věku, v dobré kondici, kteří ale mohou následně využít všech předností, které s sebou tato operace nese. Pacienti mohou vést normální život s plnou fyzickou zátěží, včetně zátěžových sportovních aktivit, ženy v těhotenství mají menší rizika krvácení, jsou omezeny důsledky trvalé antikoagulace včetně teratogenních a je menší možnost rizika infekce chlopně.
Echokardiografie
Echokardiografie je klíčové vyšetření. Byla prováděna jak předoperačně (TEE i TTE) u všech 75 pacientů, tak i pooperačně. Cílem je důkladné posouzení morfologie a diametrů aortální chlopně, ascendentní aorty, plícnice, funkce levé i pravé srdeční komory a morfologie cípatých chlopní.
Souhrnná data
Od roku 2002 do 2012 jsme provedli Rossovu operaci u 41 dospělých pacientů. Průměrný věk operovaných byl 38 let. Etiologie aortální vady byla infekční endokarditida, aortální stenóza, regurgitace a kombinovaná aortální vada.
Anestezie a pooperační péče
Předoperační hodnocení spočívala v podrobné klinické anamnéze s rutinním komplementem. Pacienti byli standardně perorálně premedikováni a perioperačně monitorováni. Anestezie proběhla jako kombinace hrudní epidurální v úrovni Th 2–4 intravenózní indukce s inhalačním vedením celkové anestezie.
ICVD
- Nepoužili jsme předoperační autologní odběr krve.
- Jako preantifibrinolytikum byl použit aprotinin nebo Exacyl. Srdeční zástavy byla dosaženo opakovaným podáváním studené krevní plegie ante - i retrográdně. Použita byla převážně normotermie nebo mírná hypotermie. Půměrná délka anestezie byla 416 minut, doba mimotělního oběhu 234 a svorky 183 minut.
Pooperační období
Všichni pacienti byli umístěni na pooperační JIP. Extubace proběhla průměrně v 188. minutě. Reintubováni byli 2 pacienti. Doba pobytu na JIP činila 2,6 dne a celková doba hospitalizace 9,9 dne. Pooperační krevní ztráty do 24 hodin byly 1254 ml, průměrně 1 273 ml. Dva pacienti byli revidováni pro krvácení. Tři pacienti v časném pooperačním období zemřeli a 3 pacienti byly v následujících letech reoperováni.
Diskuse
Rossova operace je alternativou k náhradě aortální chlopně protézou. Zrušení požadavku celoživotní systémové antikoagulace a absence imunologické degenerace autograftu je nejlepší volbou pro ženy v plodném věku a osoby s aktivním životním stylem. Nicméně, spolu s mnoha výhodami je Rossova operace dlouhotrvajícím mimotělním oběhem a nebezpečím ischémie myokardu. Vyžaduje vysoký stupeň technické dovednosti chirurga. Prodloužení času MO a rozsáhlé sutury významně zvyšují riziko o perioperační krvácení.
Echokardiografie má velký význam při Rossově operaci. Měřením plicního a aortálního anulu pomáhá v rozhodování o velikosti autograftu, stejně jako určuje výběr správné velikosti homograftu pro plicní chlopeň. Peroperační TEE je schopna zjistit aktuální situaci po našití chlopní, odhalit obstrukce RVOT, regurgitace a funkci auto - i homograftu. Dále hodnotí funkci pravé i levé komory, při možnosti vzniku akutní ischémie myokardu při možné újmě koronárních tepen.
Závěr
Rossova operace je řídce prováděný výkon na aortální chlopni, náročný hlavně pro chirurga. Při zvládnutí techniky může být reálnou alternativou náhrady aortální chlopně pro mladší pacienty vyžadující aktivní život. Operace si vynucuje těsnou součinnost až prolínání různých medicínských disciplín.
Použitie krátkodobo pôsobiacich betablokátorov počas mimotelového obehu
Žarnovická V., Olejárová, I.
OAIM NÚSCH, a.s., Bratislava, SR
Úvod: Krátkodobo pôsobiace betablokátory sa už dve desaťročia s úspechom používajú ako súčasť ochrany myokardu v perioperačnom období u kardiochirurgických pacientov. Negatívny inotropný a chronotropný efekt beta-blokátorov je v prípade krátkodobo pôsobiacich betablokátorov (ako napr. esmolol) minimalizovaný, a preto sú vhodné v perioperačnom období [1, 3].
Esmolol je ultra-krátkodobo pôsobiaci betablokátor, ktorého distribučný polčas sú 2 minúty a eliminačný polčas je 9 minút. Metabolizovaný je esterázami erytrocytov na neaktívny kyslý metabolit vylučovaný močom [1, 4]. Uvedené farmakokinetické vlastnosti ho predurčujú na perioperačné použitie u kardiochirurgických pacientov. Existujú rôzne schémy podávania esmololu počas kardiochirurgického výkonu – jednou z možností je podanie počas mimotelového obehu krvi (CPB), čo má pozitívny vplyv na zotavenie myokardu z CPB [1, 2, 3].
Súbor pacientov: V období od 14. 2. 2012 do 30. 5. 2012 sme podávali esmolol (Esmocard®) v dávke 1 mgna kg pred povolením klemu aorty u pacientov, ktorí podstúpili náhradu aortálnej chlopne pre aortálnu stenózu. Išlo o 22 pacientov (13 mužov, 9 žien), ktorým bola naimplantovaná biologická (17x) alebo mechanická (5x) aortálna protéza. Priemerný vek pacientov bol 69,7 ± 9,41 rokov, priemerné EuroScore bolo 2,33 ± 2,08 %. Sledovali sme výskyt komorovej fibrilácie po povolení klemu aorty, srdcový rytmus a spôsob odpojenia od mimotelového obehu.
Výsledky: Všetky výkony prebiehali štandardne, priemerný čas klemu aorty bol 51 minút (± 11,1 min.),priemerný čas mimotelového obehu krvi bol 62 minút (± 12,8 min.). Komorovú fibriláciu po povolení klemu aorty sme pozorovali u šiestich pacientov s nutnosťou elektrickej kardioverzie(1 x 10 J). U 12 pacientov bola po povolení klemu nutná externá stimulácia pre bradykardiu. Pri odpájaní od CPB sme externe stimulovali 7 pacientov (u piatich došlo k návratu sínusového rytmu s primeranou frekvenciou počas reperfúzie).
Odpájanie od CPB prebehlo u všetkých pacientov bez väčších problémov po krátkej (ø 11,5 ± 2,88 min.)reperfúzii. Všetci dostali na odpojenie bolusCaCl2 1 g i. v., 11 pacientom sme podali Efedrin 10 mg i. v. a 9 pacientom sme nasadili kontinuálnu infúziu noradrenalínu pre výraznú post-CPB vazodilatáciu.
Diskusia: Podávaním esmololu sme chceli znížiť výskyt fibrilácie komôr a ďalších závažných arytmií po aortálnom kleme v snahe ochrániť myokard, umožniť jeho zotavenie, a vytvoriť tak priaznivé podmienky na odpojenie pacienta od mimotelového obehu krvi. Nepozorovali sme pokles perfúzneho tlaku po podaní do CPB, výskyt závažných arytmií bol minimálny. Epizódy bradykardie s prechodnou externou stimuláciou možno pripísať vplyvu esmololu. Podanie esmololu počas klemu aorty nemalo negatívny inotropný efekt pri odpájaní pacienta od CPB.
Záver: Ochrana myokardu počas kardiochirurgického výkonu je v centre pozornosti kardiochirurgov a kardioanesteziológov, keďže sa výraznou mierou podieľa na celkovom výsledku operácie. Použitie beta-blokátorov pri kardiochirurgických výkonoch bolo limitované vzhľadom na ich negatívny inotropný efekt, ktorý sťažoval odpájanie od CPB. Ultrakrátko pôsobiaci esmolol skrýva v sebe pozitíva kardioprotektívneho účinku, pričom negatívny inotropný efekt sa vzhľadom na jeho farmakologické vlastnosti pri odpájaní od CPB neprejavuje [1, 3]. Vo fáze kardiologického zastavenia srdca dochádza k zvýšeniu hladín cirkulujúcich katecholamínov [3], a preto použitie esmololu počas aortálneho klemu môže znižovať výskyt myokardiálnej ischémie a arytmií, čo prispieva k zotaveniu myokardu po mimotelovom obehu krvi [1, 2, 3].
Literatura
1. Cork, R. C., Kramer, T. H. et al. The Effect of Esmolol Given During Cardiopulmonary Bypass. Anesth. Analg., 1995, 80,p. 28–40.
2. Sun, J. et al. Effect of short-acting beta blocker on the cardiac recovery after cardiopulmonary bypass. Journal of Cardiothoracic Surgery, 2011, 6, 99.
3. Zangrillo, A., Turi, S. et al. Esmolol reduces perioperative ischemia in cardiac surgery: a meta-analysis of randomized controlled studies. J. Cardio-thorac. Vasc. Anesth., 2009, 23, p. 625–632.
4. Sum, C. Y., Yacobi, A. et al. Kinetics of esmolol, an ultra-short-acting beta blocker, and of its major metabolite. Clin. Pharmacol. Ther., 1983, 34, p. 427–434.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2013 Issue 1
-
All articles in this issue
- Časopis Anesteziologie a intenzivní medicína v novém – tentokrát nejen „facelift“
- Neobvyklá příčina obtížného zajištění dýchacích cest – kazuistika
- Současné možnosti anestezie pro karotickou angiochirurgii
- Podíl neurodormance na klinickém projevu mozkových poruch a možnosti léčby aplikací zolpidemu
- Vliv kombinace pronační polohy a vysokofrekvenční oscilační ventilace na výměnu krevních plynů u experimentálního modelu syndromu akutní respirační tísně
- Bouveretův syndrom
- Lyellův syndrom
- Fyzikální principy ultrazvuku
-
2012 focused update of the ESC Guidelines for the managementof atrial fibrillation
An update of the 2010 ESC Guidelines for the managementof atrial fibrillation -
ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012
The Task Force for the Diagnosis and Treatment of Acuteand Chronic Heart Failure 2012of the European Society of Cardiology - 14th Cardiac Anaesthesia Days
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Fyzikální principy ultrazvuku
- Současné možnosti anestezie pro karotickou angiochirurgii
- Bouveretův syndrom
- Vliv kombinace pronační polohy a vysokofrekvenční oscilační ventilace na výměnu krevních plynů u experimentálního modelu syndromu akutní respirační tísně