Metabolické důsledky poškození střeva v intenzivní péči
Metabolic consequences of bowel damage in intensive care
The role of the bowel function in intensive care has for a long time been underestimated, but the metabolic or barrier function failure can have potentially fatal consequences. This review summarises the major causes and effects of functional and metabolic bowel damage with emphasis on critical care. The dominant factors are intestinal hypoperfusion consequent to systemic hypotension, restriction of blood flow in the mesenteric area due to partial obstruction of the mesenteric arteries, inflammation, toxicity of xenobiotics to enterocytes, infectious agents, lack of nutrients, ionizing radiation and mechanical bowel damage. The necessary tests for possible comorbidities, which further deteriorate bowel function, and specific intestinal laboratory examinations are described. These include saccharide absorption tests and determination of D-lactate or intestinal fatty acid binding protein.
The basic options for nutritional improvement of the intestinal function are listed, namely minimal enteral nutrition, the current recommendations for prevention of intestinal damage in critical care and the cholinergic vagal stimulation concept using choline precursors. Adherence to such regimens facilitates restoration or maintenance of the gut function.
Keywords:
gut barrier – multiorgan failure – intestinal fatty acid binding protein – sepsis – re-feeding
Authors:
Z. Zadák; A. Tichá; R. Hyšpler
Authors‘ workplace:
Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové
Published in:
Anest. intenziv. Med., 27, 2016, č. 1, s. 19-24
Category:
Intensive Care Medicine - Review Article
Overview
Role střeva byla po dlouhou dobu v intenzivní péči podceňována, může však vyústit až v poruchu metabolické a bariérové funkce s potenciálně fatálními důsledky. Článek shrnuje hlavní příčiny a důsledky funkčního a metabolického poškození střeva s důrazem na kritické stavy. Mezi hlavní faktory patří hypoperfuze střeva při systémovém poklesu krevního tlaku, omezení krevního průtoku v mezenteriální oblasti při částečném mechanickém uzávěru mezenterických arterií, dále vliv zánětu, xenobiotik s toxickým účinkem na střevo, vliv patogenů a virů, porucha přívodu nutrientů, vliv ionizujícího záření a mechanické poškození střeva. Jsou popsána potřebná vyšetření na přítomnost komorbidit zhoršujících funkci střeva i testy přímo detekující enterální dysfunkci. Jedná se o sacharidové absorpční testy, vyšetření koncentrací D-laktátu a intestinálního proteinu vázajícího mastné kyseliny.
Jsou vyjmenovány základní možnosti nutričního ovlivnění střevní funkce i minimální enterální výživou, současná doporučení k prevenci poškození střeva u kritických pacientů a koncept cholinergní a vagové stimulace pomocí prekurzorů cholinu. Respektování uvedených opatření vede k zachování nebo obnově funkce střeva (gut function maintenance regimen).
Klíčová slova:
střevní bariéra – multiorgánové selhání – intestinální mastné kyseliny vázající protein – sepse – realimentační syndrom
ÚVOD
Role střeva byla po dlouhou dobu v intenzivní péči podceňována a mnohem více pozornosti bylo věnováno podpoře systémové cirkulace, hemodynamickému monitorování, zlepšení integrálního průtoku v periferním řečišti včetně tkání a orgánů, které v perakutním stadiu kritického pacienta nemají vitální důležitost.
Zhoršení koronární cirkulace, perfuze ledvin, rozvoj šokové plíce a diseminované intravaskulární koagulace (DIC) jsou natolik v popředí klinického obrazu kritického pacienta, že stav mezenteriální cirkulace a porucha perfuze střeva dříve unikala pozornosti klinika [1]. Důsledkem bývá, že dokonce i po úpravě centralizace oběhu a zvládnutí multiorgánové dysfunkce není dostatečně energicky řešena porucha metabolické a bariérové funkce střeva, která mívá často fatální důsledky.
Střevo je velmi zranitelným orgánem, mimořádně citlivým na důsledky hypoperfuze a hypoxie. Vyplývá to ze skutečnosti, že tenké střevo, které představuje přibližně 2 % tělesné hmotnosti jedince, spotřebovává 20 % z celkového přívodu kyslíku do organismu a dále využívá 25 % krevního průtoku z celkové hodnoty minutového srdečního objemu.
Hlavním zdrojem energie pro enterocyt v oblasti tenkého střeva je glutamin a pro kolonocyt krátké mastné kyseliny (kyselina octová, propionová a máselná). Tyto specifické metabolické požadavky střeva významně rozhodují o riziku jeho poškození u nemocných v kritickém stavu [2].
Hlavní příčinou funkčního a metabolického poškození střeva jsou:
- malnutrice;
- vyloučení střeva z funkce (úplná parenterální výživa, zastavení přívodu nutrientů do lumen střeva);
- ischémie a hypoperfuze střevní sliznice;
- sepse;
- expozice ionizujícímu záření;
- toxiny, cytostatika, imunosupresiva;
- úrazové a operační trauma.
Tyto vlivy mohou být rozšířeny a souvisejí ještě s dalšími situacemi, jako je bakteriální a virová infekce gastrointestinálního traktu a zhoršení katabolismu.
Důsledkem těchto patologických nox jsou:
- atrofie střevní mukózy, zpomalení regenerace střevních buněk;
- zhroucení střevní bariéry;
- translokace endotoxinu a toxických peptidů do krve;
- uvolnění cytokinů, cytokinová „bouře“;
- rozvoj těžkého systémového katabolismu;
- translokační (neperforační) sepse;
- vznik poruch střevní pasáže (paralytický ileus) a rozvoj multiorgánové dysfunkce (MODS).
ZMĚNY FUNKCE STŘEVA V KRITICKÝCH STAVECH
V průběhu kritického stavu se uplatňuje větší množství vlivů, které podstatným způsobem narušují funkci střeva. Mezi hlavní faktory patří hypoperfuze střeva při celkovém systémovém poklesu krevního tlaku, omezení krevního průtoku v mezenteriální oblasti při částečném mechanickém uzávěru mezenterických arterií, dále vliv zánětu, xenobiotik s toxickým účinkem na střevo, vliv patogenů a virů, porucha přívodu nutrientů, vliv ionizujícího záření a mechanické poškození střeva (trauma, vliv operace, manipulace se střevem). Mezi nejzávažnější a rychle působící noxy patří hypoperfuze mezenteriální oblasti a z ní vznikající hypoxie střeva a acidóza [3, 4].
Vedle těchto přímých vlivů se uplatňuje i v případech rychlého obnovení krevního průtoku střevem reperfuzní poškození.
Rozsah strukturálního poškození hypoxií je největší na vrcholu klků, zatímco báze klků bývá hypoxií méně poškozena. Poškozená část střevní sliznice při rychlém obnovení perfuze a oxygenace se obvykle rychle anatomicky i funkčně reparuje. Mimo střevo vede splanchnická hypoperfuze k vzniku stresových vředů žaludku, selhání kyselé žaludeční sekrece s následným pomnožením bakteriálních patogenů, krvácení do lumen střeva.
NUTRIČNÍ OVLIVNĚNÍ STŘEVNÍ FUNKCE U KRITICKY NEMOCNÝCH
Vedle hypoperfuze a hypoxie střeva se negativním způsobem uplatňuje i snížení nebo vyloučení kontaktu nutrientů se střevní sliznicí. Je všeobecně známo, že dlouhodobá parenterální výživa, zejména u katabolického pacienta ohroženého kritickým stavem, vede nedostatek nutrientů v lumen střeva k anatomickému i funkčnímu postižení střeva. Z tohoto důvodu i poměrně nízký přívod nutričních substrátů do tenkého střeva sondou, které neovlivní významně celkovou energetickou bilanci, však zřetelně zlepší trofiku střevní stěny, sníží riziko zhroucení střevní bariéry a vlastním mechanismem zlepšuje mikrocirkulaci ve střevní stěně. Zhoršujícím vlivem v oblasti střevní perfuze je také použití sedativ, tracheální intubace a hypotenze. Mezi významné nutrienty se specifickým efektem, zlepšujícím funkci střeva, patří arginin, glutamin, nukleotidy, fermentovatelná vláknina a n-3 polyenové mastné kyseliny [5, 6].
FAKTORY ZHORŠUJÍCÍ FUNKCI STŘEVA
Nesmíme vedle hypoperfuze střeva a snížení kontaktu s nutrienty ve střevním lumen zapomínat i na další přídatné faktory, které zhoršují v kritickém stavu funkci střeva, vedou k jejímu ireverzibilnímu poškození a tím podstatně zhoršují i vyhlídky na reparaci i přežití nemocného. Patří sem následující přídatné vlivy:
- nešetrné zacházení se střevními kličkami v průběhu laparotomie;
- poškození míchy nebo nešetrné provedení spinální anestezie;
- celková anestezie s protrahovaným průběhem;
- léky (opiáty, fenothiaziny, antagonisté kalciových receptorů, sympatomimetika);
- poruchy iontové rovnováhy a přítomnost systémové acidózy.
Z iontových poruch se významně uplatňují hyponatrémie, hypokalcémie, hypokalémie a hypomagnezémie, kde iontová dysbalance může způsobovat rozvoj paralytického ileu. Mezi zásadní poruchy, které v oblasti iontové rovnováhy nesmí být přehlédnuty, jsou hypomagnezémie, případně hypokalémie rezistentní na léčbu jako důsledek přítomné hypomagnezémie.
Z endokrinních vlivů se uplatňuje hypotyreoidismus, jehož přítomnost v období ještě před vznikem akutního stavu může vést k výraznému zhoršení kvality střevní stěny ve všech jejich vrstvách.
VLIV REALIMENTAČNÍHO (RE-FEEDING) SYNDROMU NA FUNKCI STŘEVA
Nastartování přívodu nutrientů do střeva po období hladovění nebo protrahované malnutrice, zejména u katabolických pacientů, může vyvolat těžké elektrolytové dysbalance, deficit vitaminů a stopových prvků, závažnou intoleranci glukózy a retenci tekutin. Po dlouhodobějším katabolismu a hladovění, případně v důsledku úplné parenterální výživy, při kterém není zajištěn ani minimální přívod nutrientů do lumen střeva, dochází k významné atrofii klků, oslabení motility hladké svaloviny střeva, poruše sekrece a účinku trávicích enzymů a oslabení resorpčních pochodů ve střevě.
Pro postup, kterým se můžeme vyhnout re-feeding syndromu jsou dána pravidla, která jsou dnes již poměrně přesně definována [7, 8].
ZHROUCENÍ STŘEVNÍ BARIÉRY, TRANSLOKACE ENDOTOXINU A BAKTERIÍ DO KREVNÍHO OBĚHU
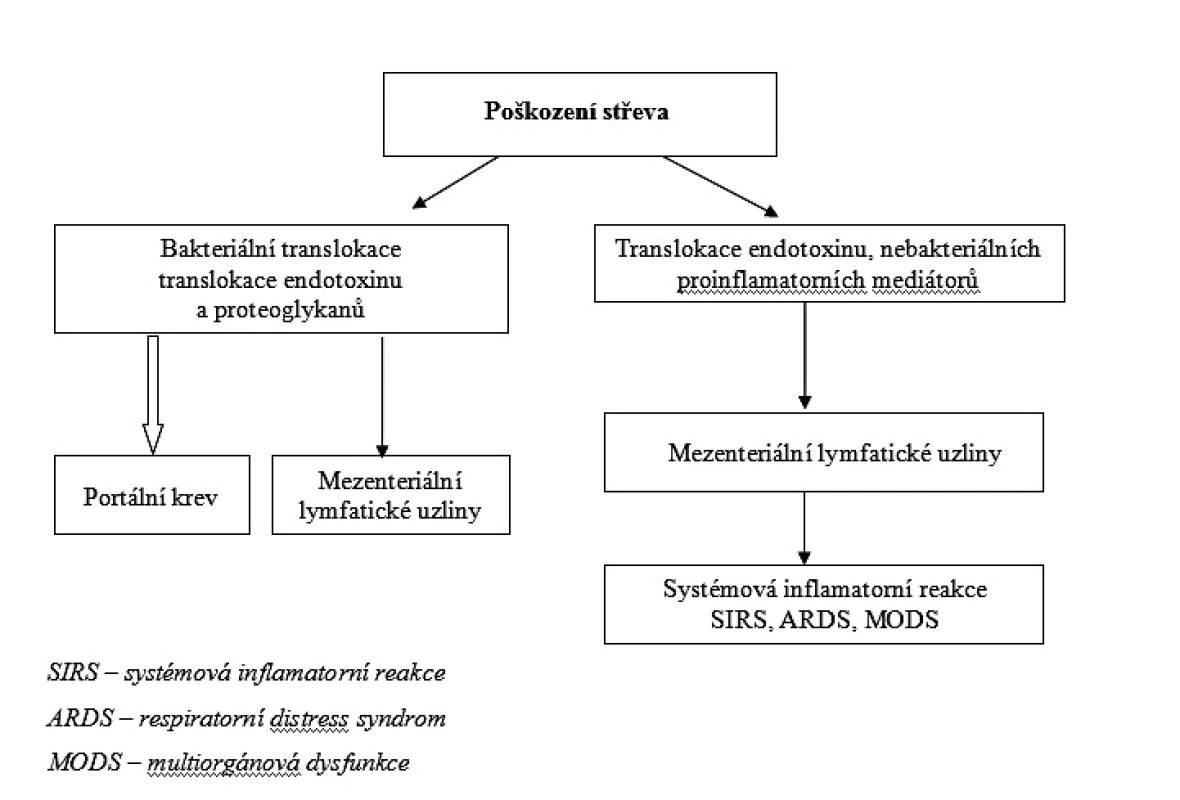
V posledních desetiletích je podrobně rozpracován koncept mechanismů vzniku bakteriální translokace a neperforační sepse střevního původu. Pokud se vyvine porucha bariérové funkce střeva, vzniká většinou stupňovitě a ne vždy musí translokace bakterií, endotoxinu a peptidoglykanů vést přímou cestou k neperforační sepsi střevního původu.
Střevo je velmi bohatým rezervoárem mikroorganismů (množství > 1010 mikroorganismů na 1 gram tkáně). Také toxické produkty typu endotoxinu jsou ve střevním obsahu obsaženy ve značné koncentraci.
Z teoretického i klinického hlediska musíme rozlišovat bakteriální translokaci, která je v současné době definována jako proces, při němž intestinální bakterie, eventuálně plísně, překonají střevní slizniční bariéru a dosáhnou oblasti mezenteriálních lymfatických uzlin, ve které mohou být prokázány [9, 10, 11, 12]. Neznamená to, že tyto mikroorganismy dosáhnou krevního oběhu a rozšíří se v systémovém oběhu s následnou generalizovanou infekcí. Naproti tomu střevní sepse neperforačního charakteru vznikající ze střeva, je definována jako proces, který vede k přestupu prozánětlivých mediátorů, mikroorganismů a toxických molekul do krevního oběhu [13]. To způsobí systémovou odezvu a na vývoji se podílejí systémová zánětlivá reakce, syndrom dechové tísně a multiorgánová dysfunkce. Schematicky je tento proces zachycen na obrázku 1.
PROJEVY POŠKOZENÍ STŘEVA V INTENZIVNÍ PÉČI A MOŽNOSTI DETEKCE
Vedle pečlivé klinické anamnézy je ke zjištění predispozice k selhání střeva nutné provést pečlivé klinické vyšetření, při kterém je nutné zaměřit se na přítomnost nebo chybění peristaltiky, normální pasáže, odchod stolice a větrů. Z anamnézy pátráme po endokrinopatiích, zejména přítomnosti a subklinicky probíhající hypotyreózy, např. u starších jedinců. Dalším významným anamnestickým údajem je předchozí alkoholismus, případně pravidelné konzumování alkoholických nápojů, zejména destilátů. Alkohol vede k eluci lipidů z ochranného střevního hlenu a tím činí střevní mukózu velmi zranitelnou. Povrch střevní mukózy ztrácí hydrofobní charakter, a je tak přístupný navíc i toxinům přímo ze střevního lumen.
Prostupnost střevní bariéry je možné měřit klinicky i využitím měření vzorku cukrů v moči po podání testovacího roztoku. K testování se používá směs cukrů, D-mannitol, sukralóza, laktulóza a sukróza [11, 14]. Test je nezatěžující a klinicky dobře detekuje i mírné poškození střevní bariéry, např. po podání chemoterapie nebo po ozáření [11].
Z biochemických ukazatelů má klinický význam zejména vyšetření hladiny D-laktátu a intestinálního proteinu vázajícího mastné kyseliny (i-FABP – intestinal fatty acid binding protein).
D-laktát je produkován výhradně bakteriemi gastrointestinálního traktu jako normální vedlejší produkt bakteriální fermentace. Během ischémie, pokud je poškozena střevní bariéra, se zvyšuje její permeabilita. Významné množství D-laktátu se translokuje přes střevní sliznici, přestupuje do krevního oběhu a do periferní krve. D-laktát je možné stanovit v žilní krvi, protože játra ani ostatní orgány nejsou schopny D-laktát metabolizovat [3]. Plazmatická hladina D-laktátu se pohybuje u zdravých jedinců v rozmezí 60 ± 15 µmol/l.
INTESTINÁLNÍ PROTEIN VÁZAJÍCÍ MASTNÉ KYSELINY (I-FABP)
Cytosolická mastná kyselina vázající protein (FABP) umožňuje vazbu a transport lipofilních volných mastných kyselin v cytosolu k buněčným organelám. V cytosolu enterocytů jsou exprimovány 2 typy proteinů i-FABP, konkrétně intestinální (I) a jaterní (L). Oba tyto proteiny jsou exprimovány ve vysokých koncentracích a představují 1 až 2 % celkových proteinů cytosolu [15]. Na rozdíl od jaterního typu je typ intestinální zcela specifickým proteinem pro enterocyty. Exprese i-FABP je řízena jinými mechanismy než exprese formy L a je limitována pouze na plně diferenciované epiteliální buňky tenkého střeva. Tyto nitrobuněčné přenašeče mají také přímý vztah ke stimulaci tvorby apolipoproteinu B-48, k jehož expresi je nezbytná stimulace volnými mastnými kyselinami. Základní nevýhodou vyšetření sérových koncentrací tohoto orgánově specifického proteinu je jeho omezené vstřebávání v případě odloučení enterocytů do lumen střeva. To je pravděpodobně důvodem jeho nepříliš vysoké výpovědní hodnoty pro ischemické poškození, jak vyplývá z dostupných metaanalýz studií [16].
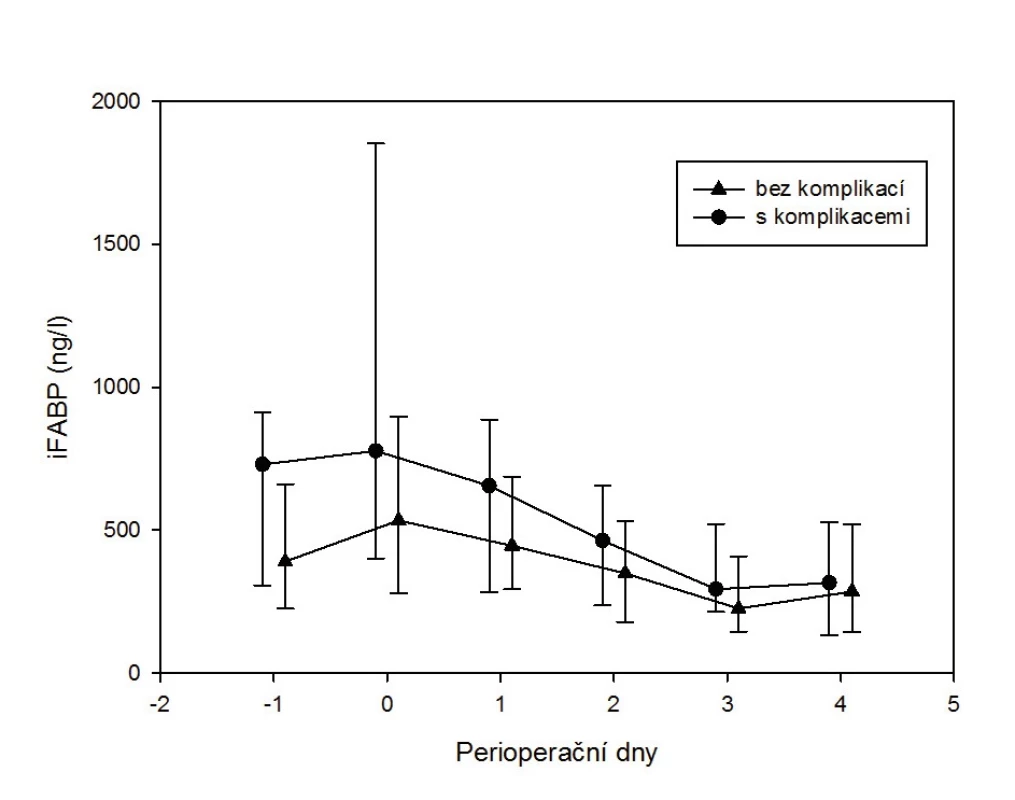
V naší studii provedené v rámci grantu MZ ČR hodnotící perioperační poškození střeva u 117 pacientů podstupujících resekci pro kolorektální karcinom byl zjištěn velmi zajímavý nález. Koncentrace i-FABP byly stanovovány předoperačně (den -1), dvě hodiny po operaci (den 0) a ve čtyřech následujících dnech (den 1–4). U dvaceti pěti pacientů došlo k rozvoji pooperační komplikace nitrobřišní nebo mimobřišní (21,3 %). Tito komplikovaní pacienti měli signifikantně vyšší koncentrace i-FABP předoperačně (p = 0,025) i těsně po operaci (p = 0,008) – obrázek 2. Předpokládáme, že tento nález ukazuje na vyšší obrat enterocytů, tedy chronické subklinické poškození střeva, které pacienty predisponuje k rozvoji pooperačních komplikací. Rovněž to svědčí pro určitý potenciál i-FABP jako prediktoru rizikovosti pacienta podstupujícího nitrobřišní operaci.
DOPORUČENÍ K PREVENCI POŠKOZENÍ STŘEVA U KRITICKÝCH PACIENTŮ
Principiální zásadou je rychlý postup, který vede k obnovení fyziologických potřeb střeva:
- rychlá objemová resuscitace, úprava pH a iontové dysbalance;
- obnovení mikrocirkulace a přívodu kyslíku;
- přívod nutrientů do jejuna buď formou šetrné maloobjemové enterální výživy, nebo zředěného roztoku nutrientů (např. přívod izotonického roztoku aminokyselin a glukózy);
- intenzivní nutriční podpora parenterální výživou, pokud enterální podání nutrientů není možné;
- šetrná korekce redistribuce krevního oběhu směrem do mezenteriální oblasti dobutaminem nebo nízkou dávkou dopaminu;
- využití nutričně farmakologických přípravků s obsahem specifických nutrientů (glutamin, arginin, polyenové mastné kyseliny řady n-3, úplná suplementace vitaminů a stopových prvků);
- cholinergní stimulace a koncept vagové modulace.
KONCEPT CHOLINERGNÍ A VAGOVÉ STIMULACE
Koncept vychází z protizánětlivého potenciálu nervus vagus a klíčové role acetylcholinu v „cholinergním protizánětlivém reflexu“, který směřuje do více orgánů. Nervus vagus zůstává důležitou spojkou mezi funkcí centrálního nervového systému a střevem za současné mediátorové systémové a lokální imunitní odpovědi.
Potencionálně se velmi nadějnou jeví suplementace cholinergních prekurzorů. Nejnověji byly dokončeny studie, které popisují příznivý efekt lipidových přípravků, které regulují zánětlivou odpověď cestou acetylcholinových regulací.
Dalším aspektem je dietní modulace syntézy acetylcholinu v epiteliálních buňkách a příprava nových prekurzorů, které stimulují syntézu acetylcholinu. Aktuálně probíhají nové studie založené na podání fosfatidylcholinu s řízením uvolňováním. Problém stimulace cholinergního systému není v současné době dořešen vzhledem k tomu, že podle recentních studií více než 50 % evropské populace může trpět genetickým polymorfismem, který u nich vytváří chronickou depleci cholinu a významnou redukci v tvorbě fosfatidylcholinu [17]. V současné době jsou ve výzkumu dietní faktory, které mohou být vhodnými substráty pro syntézu acetylcholinu jak v neuronální, tak extraneuronální cestě.
ZÁVĚR
Střevo je velmi zranitelným orgánem, mimořádně citlivým na důsledky hypoperfuze a hypoxie. Tenké střevo, které představuje přibližně 2 % tělesné hmotnosti jedince, spotřebovává 20 % z celkového přívodu kyslíku do organismu a dále využívá 25 % krevního průtoku z celkové hodnoty minutového srdečního objemu. V průběhu kritického stavu se uplatňuje větší množství vlivů, které podstatným způsobem narušují funkci střeva. Mezi hlavní faktory patří hypoperfuze střeva při celkovém systémovém poklesu krevního tlaku, omezení krevního průtoku v mezenteriální oblasti při částečném mechanickém uzávěru mezenterických arterií, dále vliv zánětu, chemických xenobiotik s toxickým účinkem na střevo, vliv patogenů a virů, porucha přívodu nutrientů, vliv ionizujícího záření a mechanické poškození střeva (trauma, vliv operace, manipulace se střevem). Vedle hypoperfuze a hypoxie střeva se negativním způsobem uplatňuje i snížení nebo vyloučení kontaktu nutrientů se střevní sliznicí.
V posledních desetiletích je podrobně rozpracován koncept mechanismů vzniku bakteriální translokace a neperforační sepse střevního původu. Pokud se vyvine porucha bariérové funkce střeva, vzniká většinou stupňovitě a ne vždy musí translokace bakterií, endotoxinu a peptidoglykanů vést přímou cestou k neperforační sepsi střevního původu. Z teoretického i klinického hlediska musíme rozlišovat bakteriální translokaci, která je v současné době definována jako proces, při němž intestinální bakterie, eventuálně plísně, překonají střevní slizniční bariéru a dosáhnou oblasti mezenteriálních lymfatických uzlin, ve které mohou být prokázány. Neznamená to, že tyto mikroorganismy dosáhnou krevního oběhu a rozšíří se v systémovém oběhu s následnou generalizovanou infekcí. Naproti tomu střevní sepse neperforačního charakteru vznikající ze střeva je definována jako proces, který vede k přestupu prozánětlivých mediátorů, mikroorganismů a toxických molekul do krevního oběhu.
Poškození střeva v intenzivní péči a některé metabolické možnosti detekce:
- Stanovení D-laktátu v žilní krvi. D-laktát je produkován výhradně bakteriemi gastrointestinálního traktu jako normální vedlejší produkt bakteriální fermentace. Během ischémie, pokud je střevní bariéra poškozena a je zvýšena její permeabilita, translokuje se významné množství D-laktátu a přes střevní sliznici přestupuje do krevního oběhu a do periferní krve.
- Stanovení intestinálního proteinu vázajícího mastné kyseliny (i-FABP). Jde o cytosolický protein, který je možno při poškození střeva prokázat v plazmě. Jde o zcela specifický protein enterocytů, který indikuje jeho poškození jakoukoliv noxou (ischémie, toxiny, zánět, mechanické poškození).
- Průkaz ischémií modifikovaného albuminu (IMA – ischemia modified albumin). Je obecně známkou ischemického poškození, jakéhokoliv původu a kteréhokoliv orgánu včetně střeva.
Hlavní opatření k zachování a případné obnově funkce střeva (gut function maintenance regimen):
- objemová resuscitace, úprava pH a iontové dysbalance;
- obnovení mikrocirkulace a přívodu kyslíku v mezenteriální oblasti;
- přívod nutrientů do lumen střeva a komplexní nutriční podpora (enterální, parenterální);
- využití nutričně farmakologických přípravků;
- nutriční cholinergní stimulace
Podpořeno MZ ČR NT13536-4/2012 a MZ ČR – RVO (FNHK, 00179906).
Čestné prohlášení autora a spoluautorů: Autor práce a spoluautoři prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů.
Práce nebyla publikována v jiném časopise.
Do redakce došlo 20. 8. 2015.
Do tisku přijato dne 28. 10. 2015.
Adresa pro korespondenci:
prof. MUDr. Zdeněk Zadák, CSc.
Úprkova 679
500 09 Hradec Králové 9
e-mail: zdenek.zadak@fnhk.cz
Sources
1. Dob, G. J. Focus on: Gut and nutritional failure in the critically ill – The role of the gut in critical illness. Current Anaesthesia and Critical Care, 1996, 7, p. 62–68.
2. Mittal, R., Coopersmith, C. M. Redefining the gut as the motor of critical illness. Trends in Molecular Medicine, 2014, 20, p. 214–223.
3. Shi, H., Wu, B., Wan, J., Liu, W., Su, B. The role of serum intestinal fatty acid binding protein levels and D-lactate levels in the diagnosis of acute intestinal ischemia. Clinics and Research in Hepatology and Gastroenterology, 2015, 39, p. 373–378.
4. Ridlon, J. M., Bajaj, J. S. The human gut sterolbiome: bile acid-microbiome endocrine aspects and therapeutics. Acta Pharmaceutica Sinica B, 2015, 5, p. 99–105.
5. Duca, F. A., Yue, J. T. Y. Fatty acid sensing in the gut and the hypothalamus: In vivo and in vitro perspectives. Molecular and Cellular Endocrinology, 2014, 397, p. 23–33.
6. Duan, R. D., Nilsson, A. Metabolism of sphingolipids in the gut and its relation to inflammation and cancer development. Progress in Lipid Research, 2009, 48, p. 62–72.
7. Zadák, Z. Výživa v intenzivní péči. 2. rozšířené aktuální vydání. Praha: Grada Publishing, 2008. ISBN 978-80-247-2844-5.
8. Zadák, Z., Havel, E. a kol. Intenzivní medicína na principech vnitřního lékařství. 1. vydání. Praha: Grada Publishing, 2007. ISBN 978-80-247-2099-9.
9. Sun, Z., Lasson, A., Olanders, K., Deng, X., Andersson, R. Gut barrier permeability, reticuloendothelial system function and protease inhibitor levels following intestinal ischaemia and reperfusion – effects of pretreatment with N-acetyl-L-cysteine and indomethacin. Digest Liver Dis, 2002, 34, p. 560–569.
10. Hackam, D. J., Good, M., Sodhi, Ch. P. Mechanisms of gut barrier failure in the pathogenesis of necrotizing enterocolitis: Toll-like receptors throw the switch. Seminars in Pediatric Surgery, 2013, 22, p. 76–82.
11. Kohout, P., Cerman, J., Brátová, M., Zadák, Z. Small Bowel Permeability in Patients With Cytostatic Therapy. Nutrition, 1999, 15, p. 546–549.
12. Qin, X., Deitch, E. A. Dissolution of lipids from mucus: A possible mechanism for prompt disruption of gut barrier function by alcohol. Toxicology Letters, 2015, 232, p. 356–362.
13. Deitch, E. A. Gut-origin sepsis: Evolution of a concept. The Surgeon, 2012, 10, p. 350–356.
14. Shaikh, M., Rajan, K., Forsyth, Ch. B., Voigt, R. M., Keshavarzian, A. Simultaneous gas-chromatographic urinary measurement of sugar probes to assess intestinal permeability: Use of time course analysis to optimize its use to assess regional gut permeability. Clinica Chimica Acta, 2015, 442, p. 24–32.
15. Gordon, J. I., Lowe, J. B. Analyzing the structures, functions and evolution of two abundant gastrointestinal fatty acid binding proteins with recombinant DNA and computational techniques. Chem. Phys. Lipids, 1985, 38, p. 137–158.
16. Evennett, N. J., Petrov, M. S., Mittal, A. Systematic Review and Pooled Estimates for the Diagnostic Accuracy of Serological Markers for Intestinal Ischemia. World J. Surg., 2009, 33, p. 1374–1383.
17. Dhawan, S., Cailotto, C., Harthoorn, L. F., de Jonge, W. J. Cholinergic signalling in gut imunity. Life Sciences, 2012, 91, p. 1038–1042.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2016 Issue 1
-
All articles in this issue
- Perioperační monitorování glykémie u dětských pacientů
- Adenosinem indukovaná zástava oběhu v průběhu operace mozkové tepenné výdutě – první zkušenost
- Metabolické důsledky poškození střeva v intenzivní péči
- Vedomie ako kozmický fenomén*
- Úloha transkraniálního ultrazvuku při stanovení smrti mozku
- Doporučení pro nejlepší klinickou praxi v diagnostickém postupu u pacientů s podezřením na akutní plicní embolii
- Doktrína „ztráty šance“ a současné změny v judikatuře a v náhledu soudů na principy zavinění a příčinné souvislosti u škod na zdraví
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Metabolické důsledky poškození střeva v intenzivní péči
- Adenosinem indukovaná zástava oběhu v průběhu operace mozkové tepenné výdutě – první zkušenost
- Vedomie ako kozmický fenomén*
- Doporučení pro nejlepší klinickou praxi v diagnostickém postupu u pacientů s podezřením na akutní plicní embolii
