Maligní hypertermie
Malignant hyperthermia
Malignant hyperthermia is a rare, life-threatening condition, usually triggered by exposure to certain drugs used for general anaesthesia – specifically volatile anaesthetics (halothane, isoflurane, sevoflurane) and neuromuscular blocking agents (esp. suxamethonium). In susceptible individuals, these drugs can induce a drastic and uncontrolled increase in oxidative metabolism in the skeletal muscle leading to muscle rigidity, which overwhelms the body’s capacity to supply oxygen, remove carbon dioxide and regulate body temperature, eventually leading to circulatory collapse and death if not immediately treated. This review article brings information about the pathophysiology, symptoms, treatment and prevention of malignant hyperthermia for a wide range of clinicians.
Keywords:
malignant hyperthermia – general anaesthesia
:
T. Vymazal
:
Klinika anesteziologie, resuscitace a intenzivní medicíny, 2. LF UK a FN v Motole, Praha
:
Anest. intenziv. Med., 27, 2016, č. 2, s. 71-74
:
Anesthesiology - Review Article
Maligní hypertermie (MH) je vzácné život ohrožující onemocnění, které je vyvoláno některými farmaky, která se používají v rámci celkové anestezie. Nejrizikovějšími jsou inhalační anestetika (halotan, izoflurane, sevofluran) a svalová relexancia, především sukcinylcholinjodid. Po jejich podání může u vnímavých jedinců dojít k prudkému a nekontrolovanému zvýšení kyslíkového metabolismu v kosterním svalstvu s projevy tkáňové hypoxie s kumulací oxidu dusného, svalové rigiditě a dramatické nadprodukci tepla. Pokud stav není léčen, může způsobit selhání oběhu a vést ke smrti. Tento přehledový článek přináší informace o patofyziologii, projevech, léčbě a prevenci maligní hypertermie nejen pro anesteziology.
Klíčová slova:
maligní hypertermie – celková anestezie
ÚVOD
Maligní hypertermie (MH) je jednou z nejobávanějších komplikací celkové anestezie, která může bezprostředně ohrozit život pacienta. Poprvé byla popsána v roce 1960 u jedenadvacetiletého mladíka, který podstoupil celkovou anestezii k repozici fraktury tibie. Za nevyjasněných okolností zemřelo deset jeho příbuzných v průběhu krátké éterové narkózy nebo krátce po ní, proto byl mladíkovi raději podán halotan. Přesto u něj došlo krátce po úvodu do celkové anestezie k náhlému vzniku tachykardie, hypotenze, cyanózy, vzestupu teploty a profuznímu pocení. Vyšetřením všech příbuzných a podrobným rozborem příčiny úmrtí u osmi z nich vznikl vědecký základ pro toto onemocnění [1, 2].
METODIKA
Na základě literární rešerše s využitím klíčových slov a indexu Medical Subject Heading (MeSH) jsem analyzoval články publikované od roku 2000 doposud v časopisech s impakt faktorem >1,000 v databázích Medline, PubMed a Google Scholar. Využity byly také informace ze tří monografií.
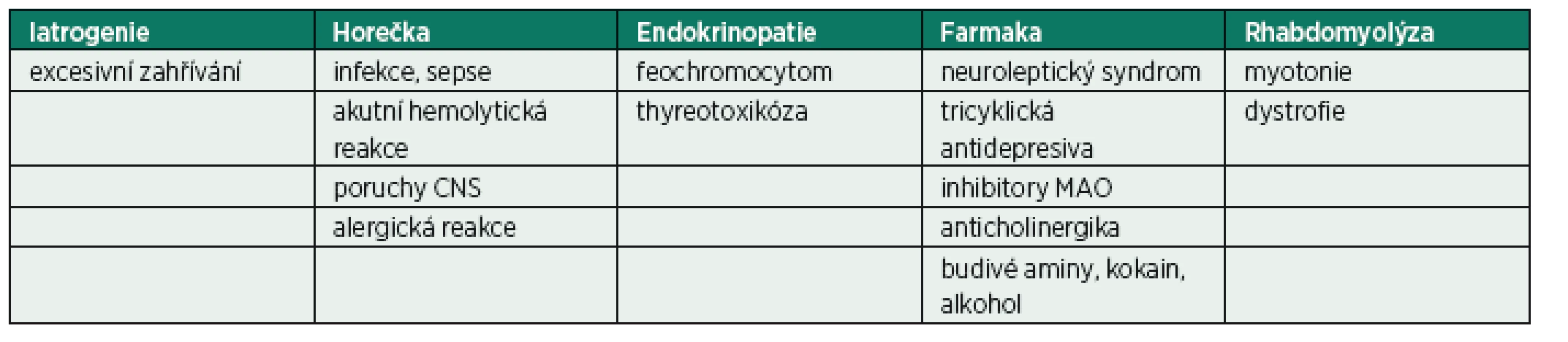
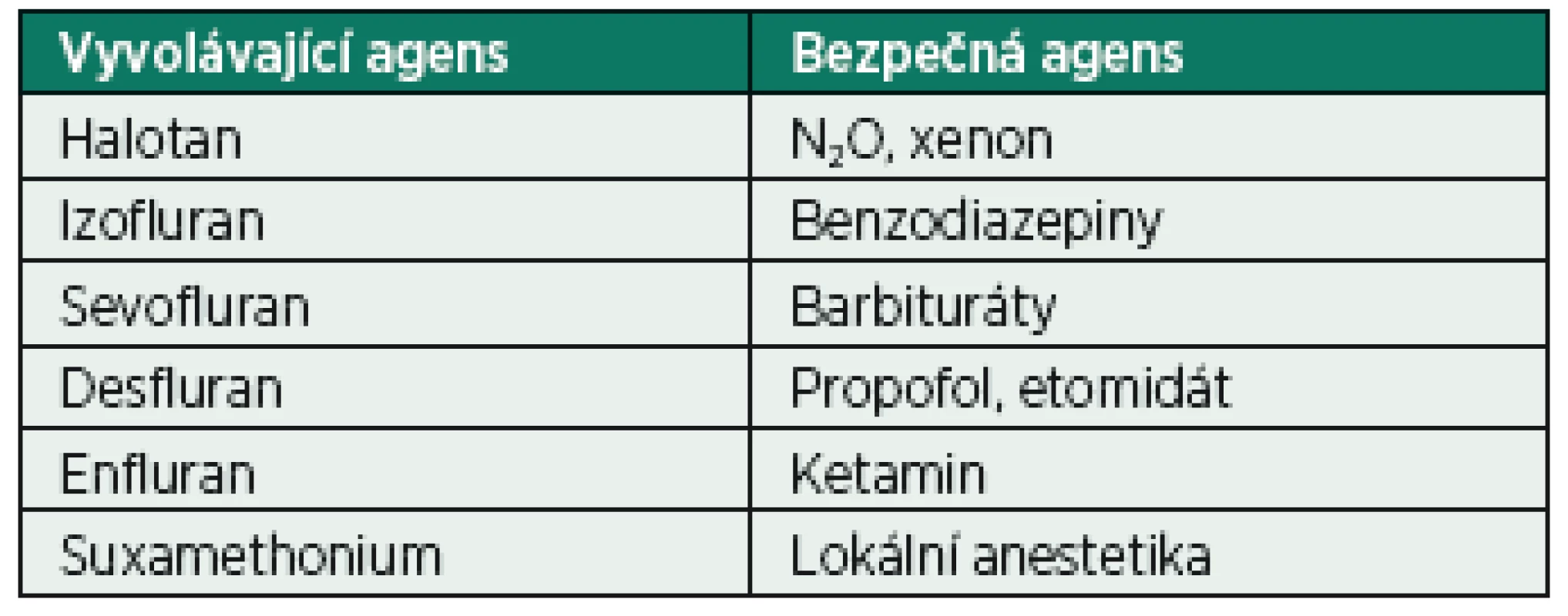
Základní informace – MH je autozomálně dominantně dědičné onemocnění. Jde o poruchu kalciového metabolismu svalové buňky. Mezi látky vyvolávající maligní hypertermii patří všechna v současné době používaná volatilní anestetika (včetne sevofluranu a desfluranu) a suxamethonium (depolarizující svalové relaxans) [3]. U predisponovaných jedinců dochází při kontaktu s vyvolávající látkou k nekontrolovatelné svalové kontrakci se spotřebou buněčného ATP, která vyvolá hypermetabolickou reakci organismu. Stoupá množství CO2, laktátu a tepla. Do oběhu je vyplaveno velké množství kalia, myoglobinu, fosfátu a kreatinkinázy. Může dojít k těžké rhabdomyolýze, multiorgánovému selhání až ke smrti. Incidence se pohybuje kolem 1 : 5000–12 000 anestezií u dětí a 1 : 30 000 až 50 000 anestezií u dospělých [4]. Vyvolávající a bezpečná agens jsou souhrnně uvedena v tabulce 1.
Etiologie – nebyla dosud plně objasněna. Nicméně bezprostřední příčinou akutního hyperkatabolismu je neřiditelné masivní uvolňování kalcia ze sarkoplazmatického retikula do myoplazmy, které je způsobené zvýšenou excitabilitou ryanodinového receptoru RyR1 (řídí vápníkový kanál v sarkoplazmatickém retikulu). Fyziologicky probíhá vlna depolarizace z nervosvalové ploténky přes transverzální tubulus na sarkoplazmatické retikulum, kde vyvolá uvolnění kalcia. Dihydropyridinový receptor umístěný ve stěně transverzálního tubulu zajišťuje jeho funkční spojení s ryanodinovým receptorem, a přenáší tak vlnu depolarizace z transverzálního tubulu na ryanodinový receptor ve stěně sarkoplazmatického retikula. Depolarizace otevírá přes ryanodinový receptor vápníkový kanál a intracelulární koncentrace ionizovaného volného kalcia v myoplazmě stoupá 500násobně [4]. To vede k odstranění troponinové inhibice z kontraktilních elementů. Tím dochází ke svalové kontrakci (kalcium se váže na troponin a mění jeho uspořádání a rotaci tak, že se na aktinu uvolní vazebná místa pro myozin). Intracelulární kalciové pumpy rychle transportují kalciové ionty zpět do sarkoplazmatického retikula a v okamžiku poklesu jejich koncentrace na klidovou hladinu dochází k relaxaci. Z toho vyplývá, že jak kontrakce, tak relaxace spotřebovávají energii v podobě ATP. U vnímavého svalu dochází při expozici provokujícím látkám a následnému snížení úrovně membránového potenciálu k protrahovanému uvolňování Ca2+ ze sarkoplazmatického retikula. Hlavní příčinou může být dysfunkce ryanodinového receptoru nebo jeho dysregulace. Zvýšená intracelulární koncentrace Ca2+ a následná protrahovaná svalová kontrakce způsobuje dramatický nárůst aerobního a později i anaerobního metabolismu. Spotřeba kyslíku se zvyšuje asi trojnásobně, hladina laktátu v séru stoupá patnácti - až dvacetinásobně a vzniká těžká metabolická acidóza. Poškození buněčné membrány svalové buňky vede k uvolnění svalové kreatinkinázy, laktátdehydrogenázy, myoglobinu a draslíku [1–6].
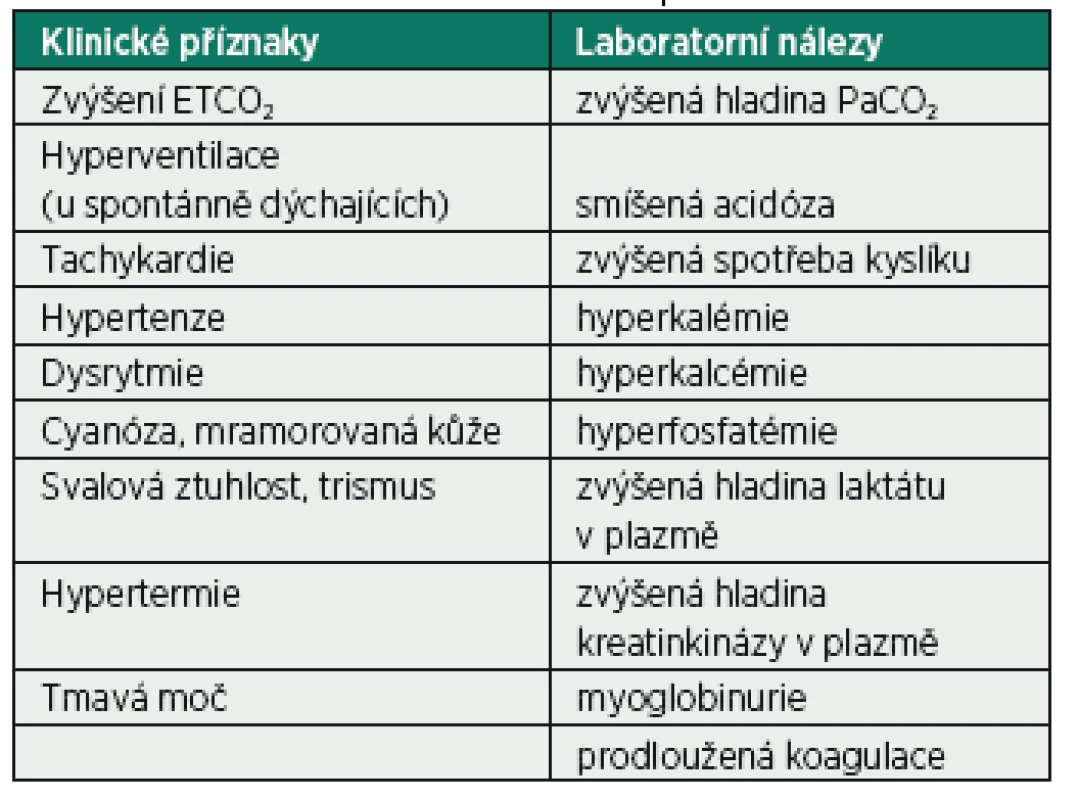
Klinické příznaky – začátek MH může být rychlý, částečně již během úvodu do anestezie s použitím inhalačních anestetik či suxamethonia. V některých situacích může být vznik klinických příznaků i o několik hodin opožděn, až do pooperačního období (zvláště při lehké hypotermii, užití barbiturátů nebo nedepolarizujících svalových relaxancií). Nejčastěji dochází k rozvoji příznaků ještě na operačním sále. Úvodním symptomem bývá u některých pacientů spasmus maseterů po intubační dávce suxamethonia. Postupně narůstá ETCO2, které je nejcitlivějším indikátorem MH. Vzestup ETCO2 bývá zpravidla dvoj - až trojnásobný při nezměněných ventilačních parametrech. K nárůstu může dojít velmi rychle, ale i v průběhu deseti až dvaceti minut. Je to důsledek hypermetabolismu svalových vláken, které spouštějí adrenergní reakci organismu. Následuje rychlý vzestup tělesné teploty, vzestup krevního tlaku a srdeční frekvence. Při spontánní ventilaci dochází k tachypnoe. Tyto příznaky bývají anesteziologem často chápány jako nedostatečná hloubka anestezie, případně analgezie. Varovným příznakem u těžších průběhů bývá celotělová svalová ztuhlost, která je nejspecifičtějším příznakem MH. Ta dále prohlubuje kombinovanou metabolickou a respirační acidózu, která může finálně způsobit až fatální srdeční arytmii. Výrazná hyperkalémie a myoglobinémie signalizují počátek ireverzibilní fáze oběhového šoku a masivního rozpadu svalových buněk. Dalšími známkami jsou mramorový vzhled kůže a cyanóza. Vzestup teploty může být i pozdním příznakem. Při rychlém vzniku těžké acidózy a šokového stavu nemusí k vzestupu teploty vůbec dojít [2–6]. Souhrnně jsou klinické a laboratorní příznaky uvedené v tabulce 2.
Léčba – její úspěch je absolutně závislý na včasné diagnóze. S postupným rozvojem patofyziologických mechanismů dochází k ireverzibilním změnám. Diferenciální diagnostika je uvedena v tabulce 3. Stanovení diagnózy je přitom často obtížnější než samotná terapie. Specifickým lékem je dantrolen, derivát difenylhydantoinu. Ten inhibuje uvolňování kalcia ze sarkoplazmatického retikula bez ovlivnění jeho zpětného vstřebávání. Před jeho zavedením v roce 1979 dosahovala mortalita MH 60–80 %. V případě, že jeho podání bylo opožděné o více než dvě hodiny, nastala smrt téměř u všech pacientů [7].
V současné době je mortalita MH menší než pět procent. Při podezření na MH je na místě přivolat pomoc. Rychlá a razantní léčba vyžaduje více rukou. Je nutno okamžitě ukončit přívod volatilních inhalačních anestetik a suxamethonia a co nejrychleji by měl být ukončen i operační výkon. Někteří autoři udávají, že není nutné měnit součásti dýchacího okruhu ani absorbér CO2. Odůvodňují to tím, že součásti anesteziologického přístroje obsahují mnohem menší množství anestetika, než kolik je ho obsaženo v těle pacienta. Podle jiných doporučení by se okruh i absorbér vyměnit měly [8]. Na našem pracovišti je výměna všech součástí anesteziologického přístroje samozřejmostí. Vlastní primární léčbu zahajujeme hyperventilací stoprocentním kyslíkem s vysokým průtokem (alespoň 10 l/min.) a prohloubením anestezie prostřednictvím intravenózních anestetik a relaxací nedepolarizujícím svalovým relaxanciem. Dantrolen aplikujeme v dávce 2,5 mg/kg i. v. jako počáteční bolus, podle potřeby opakujeme po patnácti minutách až do ústupu příznaků (vzestup ETCO2, tachykardie, svalová ztuhlost, vzestup tělesné teploty). Ampule po 20 mg se naředí v 60 ml sterilní vody. Doporučovanou maximální dávku 10 mg/kg je v indikovaných případech možno překročit. Dantrolen je možné dále podávat v dávkach 1–2 mg/kg á 4 hod. po dobu jednoho dne až tří dnů. Existuje i možnost jeho perorálního podávání. Sekundární terapie je spíše symptomatická: podáváme 8,4% NaHCO3 ke zmírnění excesivní metabolické acidózy (při poklesu pH pod 7,2), zpočátku naslepo 1–2 ml/kg. Dále podle aktuálního stavu aktivně chladíme za kontinuálního monitorování teploty tělesného jádra (pozor na hypotermii!), podáváme i. v. chladné roztoky (fyziologický roztok, ne Ringer-laktát, který obsahuje draslík), máme-li k dispozici přístroje k udržování tělesné teploty, jejich použití je výhodou. Samozřejmostí je zajištění spolehlivých periferních žilních vstupů. Po celou dobu monitorujeme krevní plyny, elektrolyty, CK, transaminázy, laktát, myoglobin a hodinovou diurézu. Dále sledujeme laboratorní hodnoty glykémie, hemokoagulace a ledvinové a jaterní funkce. Arytmie léčíme betablokátory nebo lidokainem (digitalis a Ca antagonisté jsou kontraindikovány!), u tachyarytmií je lékem volby amiodaron. K dalším terapeutickým opatřením patří zavedení arteriálního katétru a CŽK, forsírovaná diuréza s použitím furosemidu (cave: datrolen obsahuje manitol), monitorování možné renální insuficience při rhabdomyolýze a kontinuální kapnometrie. Při opakovaných vzestupech CO2 podáváme opakovaně bolus dantrolenu [3–5, 8].
CO DĚLAT V PŘÍPADĚ PODEZŘENÍ NA MOŽNÝ VZNIK MH?
Předoperační diagnostika – MH můžeme s jistotou stanovit pouze po proběhlé příhodě nebo v případě, že se tato komplikace již vyskytla v příbuzenstvu pacienta. U těchto pacientů je jediným uznaným laboratorním testem svalová biopsie a kontrakční kofeino-halotanový test. Další možností je určení genomu pacienta [6, 8–10].
Předoperační příprava – vždy bychom měli vyměnit náplň absorbéru, odstranit z anesteziologického přístroje všechny odpařovače, použít nový dýchací okruh a minimálně dvacet minut proplachovat celý anesteziologický přístroj čistým kyslíkem o vysokém příkonu (se zapnutým ventilátorem). Předoperačně by měla být pacientovi zkontrolována hladina CK, hemoglobinu, stanoven počet krevních destiček a hladiny základních iontů. Anesteziolog by měl vždy vědět, kde je deponován dantrolen. Na naší klinice je uložen na dětském resuscitačním oddělení. Profylaxe dantrolenem se nedoporučuje. Rozhodneme-li se pro ni, podává se 2,5 mg/kg intravenózně třicet minut před začátkem anestezie. Pro výkony v lokální anestezii není profylaxe potřebná. V premedikaci je velmi důležité minimalizovat nebezpečí stresu jako možného spouštěče MH, používáme benzodiazepiny v obvyklých dávkách, opioidy nebo i atropin [5, 6, 8].
Během operace – metodou první volby je svodná, regionální nebo infiltrační anestezie. Mezi bezpečná anestetika patří barbituráty, benzodiazepiny, opioidy, propofol, ketamin, etomidát, N2O, rokuronium, cisatrakurium, vekuronium a mivakurium. Zásadně se musíme vyvarovat použití všech volatilních anestetik a suxamethonia. U všech rizikových pacientů je nutné kontinuální monitorování krevního tlaku, tělesné teploty, EKG, pulzní oxymetrie, kapnometrie, vhodné je i invazivní měření TK a CVP. Kontraindikované jsou přípravky s kalciem, digitalis, blokátory kalciových kanálů, b2-sympatomimetika a ergotaminové preparáty. Katecholaminy by měly být použity jen v nezbytně nutném případě, vazopresorem volby je efedrin [5, 8, 10–12].
CAVE:
Zvýšené opatrnosti je potřeba dbát vždy, je-li:
- pozitivní rodinná anamnéza – suspektní syndrom MH u pokrevních příbuzných, výskyt myopatie, metabolických vad, elevace svalových enzymů v rodině;
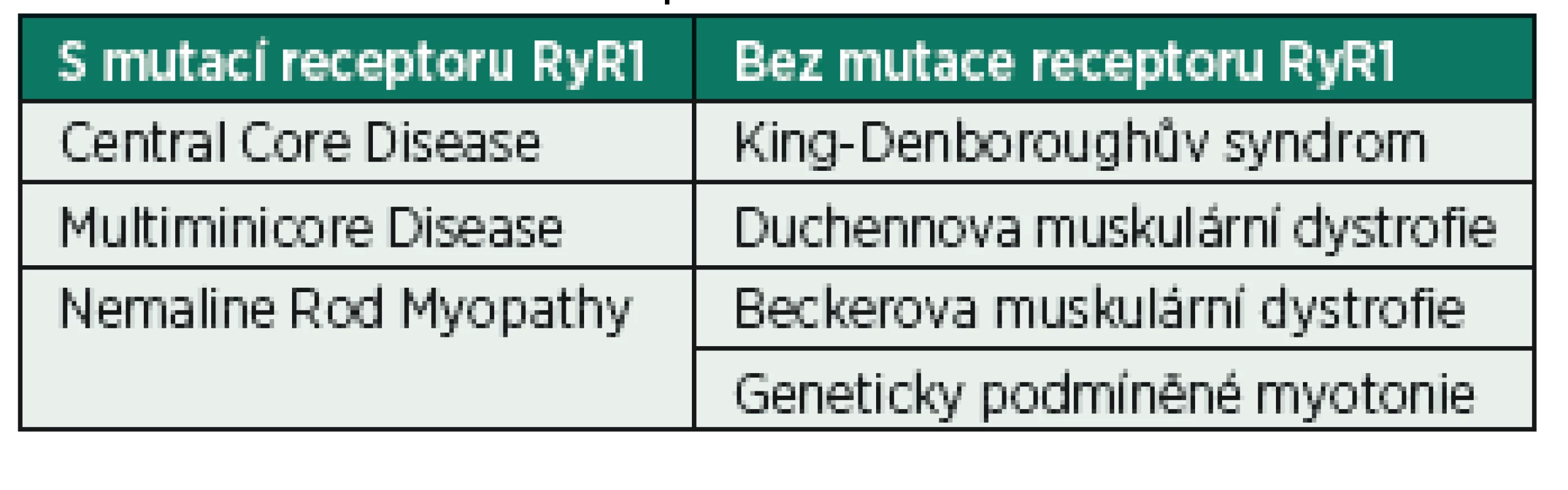
- pozitivní osobní anamnéza – komplikace předchozích anestezií bez uspokojivého vysvětlení, myopatie (s genetickou mutací receptoru RyR1 nebo s normálním receptorem RyR1, avšak zvýšenou citlivostí k inhalačním anestetikům a suxamethoniu) – tabulka 4, elevace svalových enzymů, genetické syndromy, jejichž součástí je zvýšené riziko MH, trismus při pití černé kávy;
- strabismus, zvýšený svalový tonus, spastické kontraktury;
- podezřelé komplikace při anestezii – tuhá čelist bránící intubaci, tachykardie, hypertenze po vyloučení běžných příčin, narůstající hyperkapnie při normoventilaci, svalová rigidita, vzestup teploty, hypoxie, laktátová acidóza [5, 6].
Střet zájmů: není.
Do redakce došlo dne 29. 10. 2015.
Do tisku přijato dne 2. 1. 2016.
Adresa pro korespondenci:
MUDr. Tomáš Vymazal, Ph.D., MHA
KARIM 2. LF UK a FN v Motole
V Úvalu 84, 150 00,
Praha 5
e-mail: tomas.vymazal@fnmotol.cz
Sources
1. Harrison’s Principles of Internal Medicine. 2008, p. 18, 419–20.
2. Civetta, Taylor & Kirby’s Critical Care. 2009, p. 1100–1101, 1331–1334.
3. David E: Longnecker. Anestesiology. 2008. p. 1964–1984.
4. Johannsen, S., Treves, S., Müller, C. R., Mögele, S., Schneiderbanger, D., Roewer, N., Schuster, F. Functional characterization of the RYR1 mutation p.Arg4737Trp associated with susceptibility to malignant hyperthermia. Neuromuscul. Disord., 2015, Nov 11. pii: S0960-8966(15)00770-1. doi: 10.1016/j.nmd.2015.11.001. [Epub ahead of print].
5. Miyamoto, Y., Miyashita, T., Takaki, S,, Goto, T. Perioperative considerations in adult mitochondrial disease: A case series and a review of 111 cases. Mitochondrion., 2015, Nov 19, 26, p. 26–32.
6. Campion, G. H., Hadi, A. S., Berman, A. J., Hoffman, R. S. Questions regarding the diagnosis of malignant hyperthermia. Anesthesiology, 2015, 123, 3, p. 731–732. doi: 10.1097/ALN.0000000000000760.
7. Petersen, B., Busch, T., Meinecke, C. D., Börge, B., Kluba, K., Kaisers, U. X., Rüffert, H. Telephone enquiries on the topic of malignant hyperthermia : Evaluation of the content and subsequent diagnostic results at the MH Center Leipzig. Anaesthesist, 2015, Oct 19. [Epub ahead of print].
8. Isaak, R. S., Stiegler, M. P. Review of crisis resource management (CRM) principles in the setting of intraoperative malignant hyperthermia. J. Anesth., 2015, Dec 17. [Epub ahead of print].
9. Lu, Z., Rosenberg, H., Brady, J. E., Li, G. Prevalence of Malignant Hyperthermia Diagnosis in New York State Ambulatory Surgery Center Discharge Records 2002 to 2011. Anesth. Analg. 2015, Nov 9. [Epub ahead of print].
10. http://www.mhaus.org/
11. http://www.hypertermie.estranky.cz/
12. http://www.mhinfo.cz/info/
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2016 Issue 2
-
All articles in this issue
- Malignant hyperthermia
- The role of antithrombin and thromboelastography in the management of early disseminated intravascular coagulopathy following peripartum hysterectomy
- Current opinion on caudal epidural blockade and its complications in children
- Sleep disturbances in perioperative and ICU patients – review
- Alarmins and their role in perioperative medicine
- Intravenous fluid therapy in intensive care
- Practice Guidelines for the Prevention, Detection, and Management of Respiratory Depression Associated with Neuraxial Opioid Administration: An Updated Report by the American Society of Anesthesiologists Task Force on Neuraxial Opioids and the American Society of Regional Anesthesia and Pain Medicine
- The Spireta Project
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Malignant hyperthermia
- Current opinion on caudal epidural blockade and its complications in children
- Intravenous fluid therapy in intensive care
- Sleep disturbances in perioperative and ICU patients – review