Několik poznámek klinických biochemiků k akutnímu poškození ledvin
A few comments by clinical biochemists on acute kidney injury
This review paper addresses the definition of acute kidney injury and other related nosologic units, criteria of function, and the RIFLE and AKIN classifications. The new clinical unit called subclinical acute kidney injury as well as kidney damage biomarkers are also focused on. Difficulties related to the examination of the kidney function – together with suggested solutions – are dealt with, e. g. the issue of measuring and estimating glomerular filtration rate (GFR), the issue of comparability and traceability of creatinine, urea, and cystatin C measurements in the serum, the issue of comparability of different estimated GFR values including the use of GFR estimation in intensive care, the issue of baseline serum creatinine, the influence of biological variability on interpretation, and finally, the issue of choosing and measuring the biomarkers of kidney injury.
Keywords:
acute kidney injury network (AKIN) – acute kidney injury (AKI); acute kidney disease (AKD); chronic kidney disease (CKD); glomerular filtration rate (GFR); Kidney Disease, Improving Global Outcome (KDIGO) – Neutrophil gelatinase-associated lipocalin (NGAL) – Risk, Injury, Failure, Loss-of-function, End-stage renal disease (RIFLE)
Authors:
A. Jabor 1,2; J. Franeková 1,2
Authors‘ workplace:
Pracoviště laboratorních metod, IKEM, Praha
1; 3. lékařská fakulta, Univerzita Karlova, Praha
2
Published in:
Anest. intenziv. Med., 27, 2016, č. 4, s. 228-236
Category:
Intesive Care Medicine - Special Article
Overview
Přehledná práce se zabývá definicí akutního poškození ledvin a dalších souvisejících nozologických jednotek, kritérii funkce a RIFLE, respektive AKIN klasifikací, novou jednotkou nazývanou subklinické poškození ledvin a biomarkery poškození ledvin.
Mezi problémy vyšetření funkce ledvin je – spolu s návrhem jejich řešení – uveden problém měření a odhadu glomerulární filtrace (GFR), problém srovnatelnosti a návaznosti měření kreatininu, urey a cystatinu C v séru, problém porovnatelnosti různých hodnot odhadu GFR včetně použití odhadu GFR v intenzivní péči, problém bazální hodnoty sérového kreatininu, biologické variability při interpretaci a konečně problém výběru a měření biomarkeru poškození ledvin.
Klíčová slova:
acute kidney injury network (AKIN) – akutní poškození ledvin (AKI) – akutní onemocnění ledvin (AKD) – chronické onemocnění ledvin (CKD) – glomerulární filtrace (GFR) – Kidney Disease, Improving Global Outcome (KDIGO) – lipokalin asociovaný s želatinázou neutrofilů (NGAL) – Risk, Injury, Failure, Loss-of-function, End-stage renal disease (RIFLE)
ÚVOD
Laboratorní vyšetření u chronického onemocnění ledvin zahrnuje širokou paletu metod. Naproti tomu jsou situace s akutním poškozením ledvin vázány na poměrně úzkou vyšetřovací paletu: sleduje se diuréza, opakovaně se monitoruje kreatinin, urea a osmolalita, vyšetřuje se moč chemicky a morfologicky, měří se ionty a acidobazické parametry s krevními plyny, používají se jednoduché výpočty. Určitým přelomem bylo definování akutního poškození ledvin a návrh RIFLE klasifikace, definování pěti typů kardiorenálního syndromu, vydání guidelines pro akutní poškození ledvin v roce 2012 (KDIGO 2012) a závěry konferencí ADQI (Acute Dialysis Quality Initiative,www.adqi.org; volně dostupné jsou závěry 10. a 11. konference, publikované knižně v roce 2013(https://www.karger.com/Book/Toc/259741, ISBN: 978-3-318-02406-7). Dalším mezníkem byl návrh nové klinické jednotky – subklinického akutního poškození ledvin, který vychází z poruchy funkce ledvin určené změnami biomarkerů, ale při dosud zachované funkci ledvin posouzené pomocí markerů charakterizujících glomerulární filtraci. V listopadu 2015 proběhla již 16. konference ADQI, která nepochybně další požadavky a principy upřesnila. Předkládané sdělení se zabývá silnými a slabšími stránkami využití laboratorních vyšetřovacích metod pro hodnocení funkce ledvin v intenzivní péči, především se zaměřením na vyšetření z oblasti klinické biochemie.
DEFINICE AKUTNÍHO POŠKOZENÍ LEDVIN
Definici akutního poškození ledvin (AKI) určuje guideline z roku 2012, známé pod názvem KDIGO Clinical Practice Guideline for Acute Kidney Injury (dále označujeme KDIGO AKI 2012, abychom odlišili od KDIGO guideline pro chronické onemocnění ledvin, které dále označujeme KDIGO CKD 2012, publikované v roce 2013) [1, 2].
Jako AKI se definuje kterákoli z následujících situací:
- vzestup sérového kreatininu o 26,5 µmol/l a více během 48 hodin, nebo
- vzestup sérového kreatininu na 1,5 a vícenásobek bazální hodnoty, kde se ví nebo předpokládá, že k němu došlo během 7 předchozích dnů, nebo
- diuréza pod 0,5 ml/kg a hodinu trvající 6 hodin (oligurie).
Kromě AKI jsou určeny i názvy pro další situace, které nelze zařadit podle výše uvedených podmínek. Tyto situace popisuje tabulka 1.
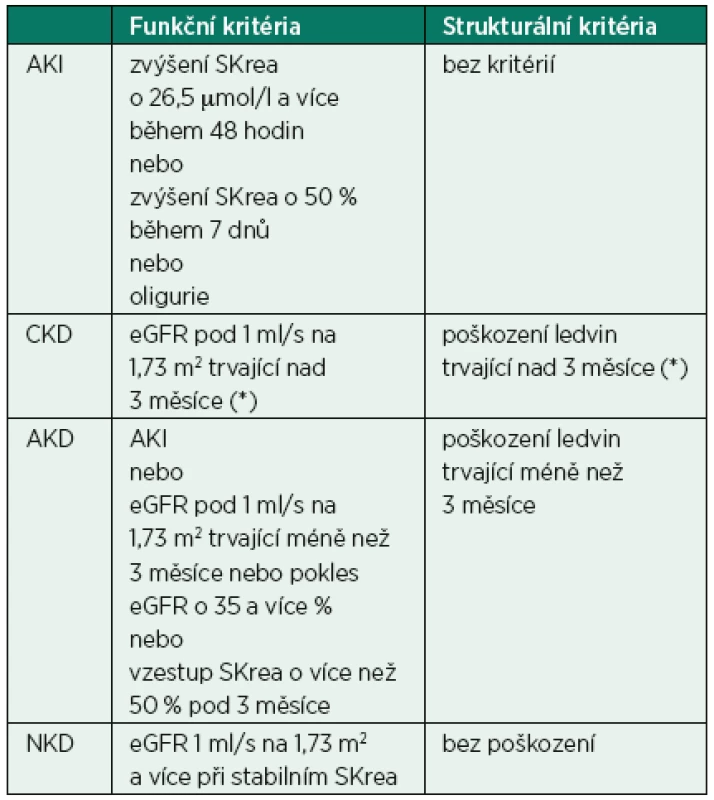
Kritéria funkce
Po původní klasifikaci akutního poškození ledvin RIFLE (Risk, Injury, Failure, Loss of function, End-stage renal disease) byla doporučena jednodušší klasifikace AKIN (Acute Kidney Injury Network, Stage 1–3). Klasifikace AKIN vychází pouze z diurézy a změn sérového kreatininu, zatímco klasifikace RIFLE má navíc jako kritérium hodnotu eGFR (tab. 2). Stadium ztráty funkce a konečné stadium onemocnění ledvin nemají odpovídající ekvivalent v AKIN systému a v roce 2007 byla ze systému klasifikace stadií odstraněna [3]. U pacientů, kteří byli léčeni náhradou funkce ledvin (RRT), se má za to, že splňují kritéria Stadia 3 v systému AKIN (bez ohledu na stadium, jež dosáhli před RRT).
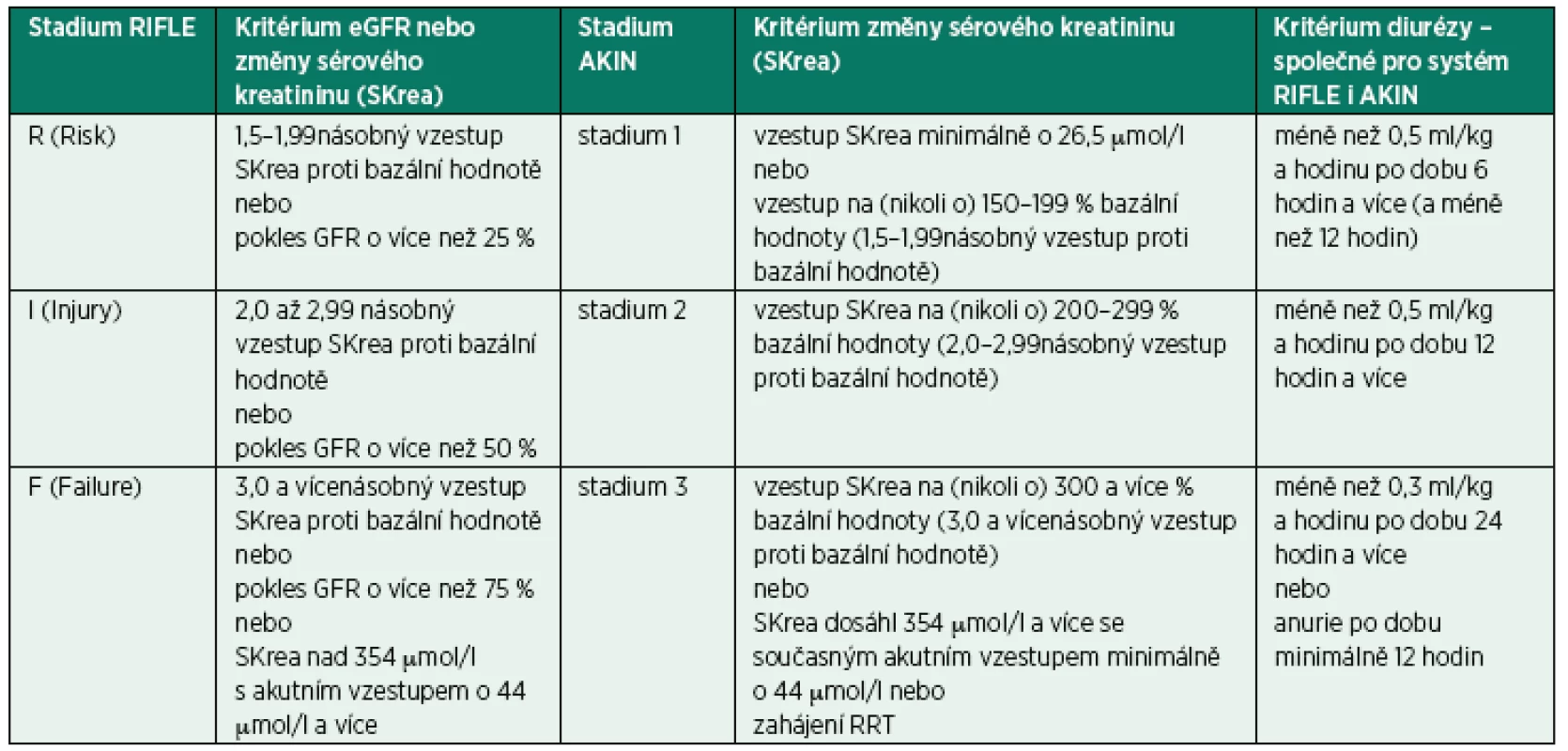
V obou systémech platí, že je-li podle jednoho kritéria pacient zařazen do vyššího stadia, bere se do úvahy toto prognosticky závažnější zařazení. Systém RIFLE byl konstruován tak, aby měl ve stadiích s nižší poruchou funkce vyšší senzitivitu záchytu a naopak ve vyšších stadiích poruchy vyšší specifičnost. Diagnostickou efektivitu obou klasifikačních systémů je možné porovnat: nemocniční mortalita pacientů, kteří podle systému RIFLE nemají AKI je 13,6 %, zatímco není-li AKI podle systému AKIN, je nemocniční mortalita 15,9 %. Analogicky stadium R má mortalitu 29,2 % a AKIN 1 mortalitu 34,5 %, stadium I má mortalitu 32,3 % a AKIN 2 mortalitu 29,0 % a konečně stadium F má mortalitu 42,6 % a AKIN 3 mortalitu 41,2 %.
Význam RIFLE nebo AKIN systému
Kromě terminologického významu s přesným obsahem přinesla klasifikace RIFLE také další výhody:
- umožnila porovnávání úrovně zdravotní péče, např. prostřednictvím srovnání mortality různých pracovišť v určité kategorii RIFLE nebo AKIN;
- umožnila zpřesnění komunikace mezi lékaři, např. při překládání pacienta na jiné pracoviště tím, že bylo jasné posouzení stupně závažnosti pacienta, délky fáze nemoci v určitém stadiu, změny v zařazení do určité kategorie s ohledem na léčebné postupy a podobně; zpřesnila metodologii klinických studií s lepším definováním kohort pacientů s různým postižením funkce ledvin;
- usnadnila provádění systematických přehledů a metaanalýz analogicky jako u metodologie klinických studií.
Kritérium poškození ledvin a subklinické AKI
Desátá konference ADQI [4] se detailněji zabývala novou klinickou jednotkou, subklinickým akutním poškozením ledvin (subclinical AKI). Jde o situaci, kdy jsou kritéria funkce v normě, ale je pozitivní biomarker poškození ledvin, například NGAL, lipokalin asociovaný s želatinázou neutrofilů [5]. Ke klasifikaci RIFLE nebo AKIN, zahrnující funkční kritéria glomerulární filtrace a diurézy, se přidávají kritéria poškození, která jsou zatím semikvantitativně určena hodnotou měřeného biomarkeru poškození. Nejsou ale zatím data nebo doporučení pro staging poškození na základě pevně určených hodnot cut-off příslušného biomarkeru, a nejsou ani doporučené biomarkery. Subklinické AKI se tedy definuje jako stav s dosud vyhovujícími funkčními charakteristikami (tj. GFR i diuréza nesplňují ani 1. stadium AKIN nebo RIFLE stadium R), ale je zjištěna pozitivita biomarkeru AKI. U subklinického AKI je zhoršená prognóza pacientů a zvýšené riziko přesunu do některé další kategorie s funkčním postižením.
BIOMARKERY POŠKOZENÍ LEDVIN
Část biomarkerů lze vyšetřovat v plazmě (např. NGAL), většinu ale v moči [6]. Původ močových biomarkerů poškození je následující:
- poškození bazální membrány glomerulů, zvýšený přestup proteinů do primární moče,
- porucha tubulární reabsorpce proteinů v proximálním tubulu,
- zvýšení syntézy proteinů tubulárním aparátem jako reakce na inzult,
- produkty poškození tubulárních buněk,
- proteiny syntetizované buňkami aktivovanými při zánětu nebo jiném poškození tubulů.
Některé proteiny se mohou do moče dostávat více mechanismy. Často studovanými nebo v praxi používanými proteiny jsou NGAL (Neutrophil gelatinase-associated lipocalin), alfa-1-mikroglobulin, beta-2-mikroglobulin, NAG (N-acetyl-beta-D-glukózaminidáza), KIM-1 (Kidney Injury Molecule 1), RBP (retinol-binding protein), IL18, albumin, cystatin C a mnoho dalších [6, 7, 8].
Nejlépe studovaným biomarkerem s velkou datovou základnou je NGAL. Je součástí antioxidačního renoprotektivního systému, který je aktivován řadou inzultů; je produkován v tubulech, ale i v dalších buňkách. Zvyšuje se o 1–2 dny dříve než kreatinin u pacientů s AKI a umožňuje včasnější a intenzivnější péči o pacienty s AKI, ale ani tento biomarker neidentifikuje jednoznačně přítomnost AKI. Patofyziologie je komplikovanější, na zvýšení v plazmě se mohou podílet ledviny, neutrofily i další tkáně, zvýšení v moči může být dáno poruchou tubulární reabsorpce (nefunkční megalin-cubulinové receptory), zvýšenou syntézou poškozenými (ale i ohroženými) tubulárními buňkami a uvolněním z infiltrujících neutrofilů. Navíc se NGAL ukázal jako prognostický biomarker u pacientů s akutním a chronickým srdečním selháním, uvažuje se o jeho využití u kardiorenálního syndromu, po trasplantacích, u systémových onemocnění a u dalších klinických stavů [9]. NGAL byl rovněž testován u septických pacientů, u kterých byla zjištěna vyšší koncentrace v plazmě i moči v porovnání s pacienty bez sepse, a to nezávisle na renálních parametrech [10]. Podstatný ale může být fakt, že NGAL je dobrým prediktorem v intenzivní péči hlavně u pacientů, u nichž byla před rozvojem akutního onemocnění fyziologická funkce ledvin [11]. Postavení NGAL v metaanalýzách ukazuje, že nejde o biomarker bez významu, nicméně s omezenou specifičností ve vztahu k ledvinám. Tabulka 3 ukazuje některé výsledky z přehledných studií [12, 13]. Nejde o práce jednoho autorského kolektivu – Haase (2009) analyzoval metaanalyticky 19 studií na 2 538 pacientech, Haase-Fielitzová (2014) analyzovala 58 prací s více než 16 500 pacienty; jde tedy o poměrně robustní údaje z více zemí a řady pracovišť.
![Postavení NGAL v metaanalytických studiích [12 a 13]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ce30da644886e2e46cd9a9a4515b4241.png)
Postoj k NGAL sumarizoval recentně Claudio Ronco, jeden z hlavních propagátorů tohoto biomarkeru a člen ADQI skupiny. Ve svém editorialu uzavírá problematiku výzvou k používání biomarkerů poškození ledvin v rutinní klinické praxi: “...routine clinical utilization of injury biomarkers will probably be the solution for real advancement in this area.“ [14]. Užitečnost NGAL v diagnostice skutečně prověří až praxe: zatím existují rozpaky způsobené spíše tím, že neumíme přesně NGAL interpretovat. Je totiž možné, že zvýšené koncentrace NGAL mohou informovat také o proběhlém inzultu ledvin s budoucím ohrožením jejich funkce.
PROBLÉMY VYŠETŘENÍ FUNKCE LEDVIN A JEJICH ŘEŠENÍ
1. Problém měření GFR
Jednotlivé způsoby měření GFR mají různou přesnost a různě vysokou váhu důkazů. Za nejspolehlivější se považují obecně renální clearance, za zlatý standard se považuje renální clearance inulinu (tj. měření inulinu při infuzní aplikaci, ve steady-state, se sběrem moče a odběrem krve na začátku a konci sběrného období). Vysokou kvalitu dále poskytují renální clearance 51Cr-EDTA nebo iothalamátu. Pro plazmatickou clearanci (tj. clearanci počítanou z jednorázové i. v. aplikace látky a ze sledování poklesu koncentrace látky v krvi) je při použití 51Cr-EDTA nebo iohexolu sice nižší váha důkazů, ale stále jde o měření s dostatečnou přesností. Ještě mírně nižší váhu důkazů má renální clearance s DTPA, iohexolová renální clearance a plazmatická clearance inulinu [15]. Tyto metody se obvykle označují jako “stříbrné” standardy, aby se odlišily od „zlatého” standardu, tj. renální clearance inulinu. Další komplikací mohou být postupy výpočtu, kdy například existuje více matematických modelů v případě plazmatické clearance aplikovaných látek.
Řešením problému je uvážlivé používání některého s uvedených principů měření (nikoli odhadu) glomerulární filtrace pro vědecké účely. V praxi je nutné vystačit s vhodnými způsoby odhadu GFR.
2. Problém odhadu GFR
Při interpretaci je nutné brát v úvahu skutečnost, že kreatinin i cystatin C může ovlivnit řada procesů a látek (exogenního i endogenního původu). Kreatinin je ovlivňován především změnami svalové hmoty, zatímco na cystatin C mají vliv některá onemocnění. Kreatinin i cystatin C jsou rovněž ovlivněny analytickými interferencemi. Značné množství interferencí vzniká při měření kreatininu “klasickou” Jaffého reakcí s alkalickým pikrátem. Měření kreatininu enzymovými metodami a měření cystatinu C imunoanalytickými postupy mohou být rovněž ovlivněna interferencí. Podrobnosti ukazuje tabulka 4, modifikovaná podle doporučení KDIGO 2012 pro chronické onemocnění ledvin [1].
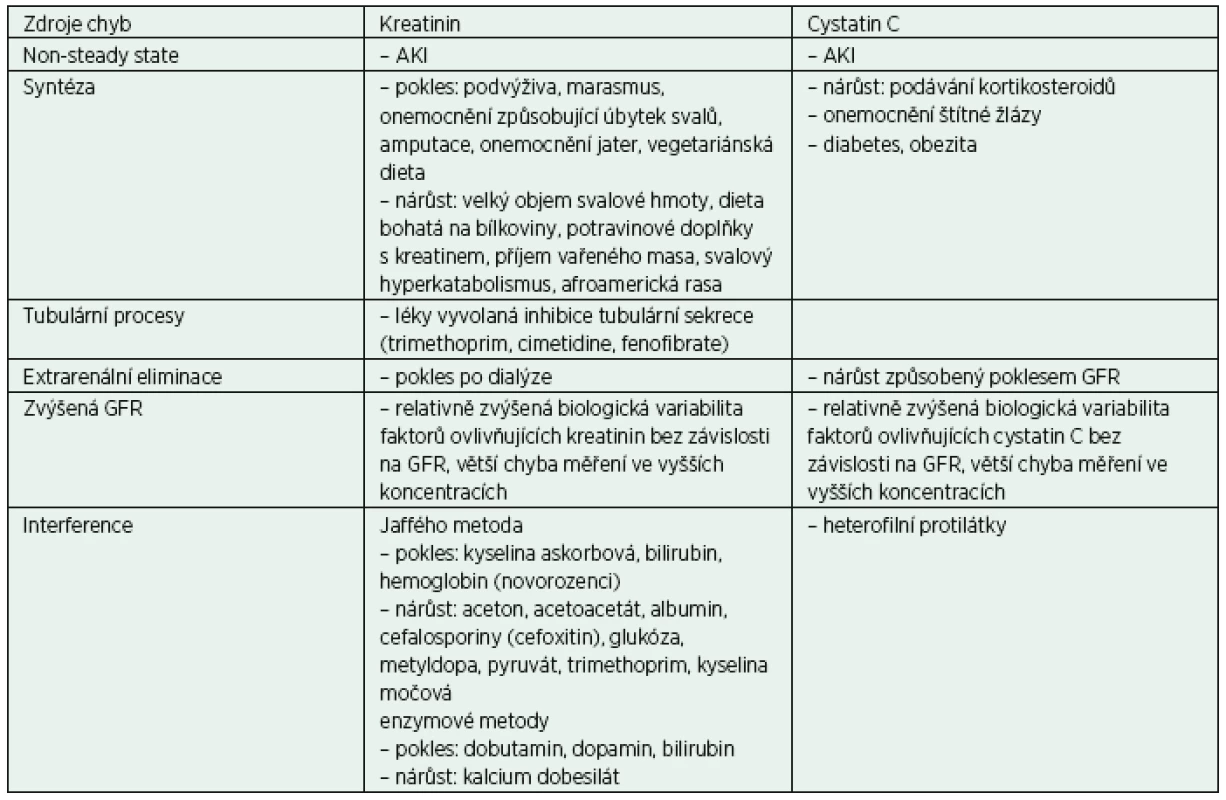
Zajímavým problémem v intenzivní péči je interference dobutaminu a dopaminu se stanovením kreatininu nebo obecně analytů, kde koncovou reakci při měření představuje tzv. Trinderova reakce. Je ovšem třeba poznamenat, že tyto látky interferují jen ve vyšších než terapuetických koncentracích, např. při kontaminaci vzorku dobutaminem při nesprávném odběru [16].
Řešení problému spočívá v přípravě pacienta na vyšetření (dieta, fyzická zátěž, vyloučení interferujících léků – je-li to možné), ve správném odběru (se zabráněním kontaminace vzorku na vyšetření aplikovanými léky) a v použití kvalitní analytické metody v laboratoři.
3. Problém srovnatelnosti a návaznosti měření kreatininu, urey a cystatinu C v séru
Enzymové stanovení kreatininu využívá kolem 40 % českých laboratoří (stav podle cyklů systému SEKK v roce 2015). Spolehlivost enzymového stanovení je vyšší než při použití klasické metody Maxe Eduarda Jaffého z roku 1886 [17]. V posledních třech kontrolních cyklech systému SEKK pro mezilaboratorní porovnávání je mezilaboratorní variační koeficient laboratoří pracujících s metodou Jaffé mezi 4,0–4,7 %, kdežto u laboratoří používajících enzymovou metodu je to 3,2–3,8 %. V případě stanovení urey je v podstatě ukončena unifikace stanovení, laboratoře v ČR používají enzymovou metodu s ureázou a glutamátdehydrogenázou s variačním koeficientem mezi laboratořemi v rozsahu kolem 4 %. Heterogenitu naopak vykazuje stanovení cystatinu C, na trhu je více výrobců různých diagnostických souprav a mezilaboratorní variační koeficient je kolem 8 %, ale některé systémy bohužel vykazují variaci až 10, nebo dokonce 15 %. Tyto údaje jsou veřejně dostupné například na stránkách www.sekk.cz.
Řešení problému spočívá v dobré komunikaci mezi klinickými pracovníky a laboratořemi, se společným důrazem na používání metod s kvalitními analytickými charakteristikami. Je potřebné více využívat enzymové metody stanovení kreatininu a kvalitní metody pro stanovení cystatinu C. Podmínkou kvality, kterou nelze v žádném případě obejít, je nastavení metod na mezinárodní referenční materiály, tj. materiál NIST-SRM 967 v případě měření koncentrace kreatininu, certifikovaný referenční materiál ERMDA-471/IFCC v případě měření koncentrace cystatinu C a materiál NIST SRM 912a pro stanovení urey.
4. Problém různých hodnot odhadů GFR
I při spolehlivém stanovení koncentrace kreatininu a cystatinu C v séru je nutné počítat s odchylkami vypočtených hodnot. Dlouho používaná rovnice podle Cockcrofta a Gaulta [18] se dnes považuje za obsoletní, podobně jako rovnice MDRD (Modification of Diet in Renal Diseases), kterou její autor Andrew Levey nahradil v roce 2009 novou rovnicí [19]. Značné uplatnění získaly postupně navrhované rovnice vycházející z cystatinu C [20, 21]. V současné době se doporučují tzv. rovnice CKD-EPI podle KDIGO 2012 [1]. Předpokládejme, že naším pacientem je 50letý muž kavkazské rasy, v séru kreatinin 100 µmol/l, urea 5,0 mmol/l, cystatin C 1,1 mg/l, v moči kreatinin 7,0 mmol/l, urea v moči 250 mmol/l, 24hodinový sběr moči (1440 minut), objem nasbírané moči 1 500 ml/den, hmotnost 75 kg, výška 180 cm, tělesný povrch 1,94 m2. Naměřené a vypočítané hodnoty jsou uvedeny v tabulce 5.
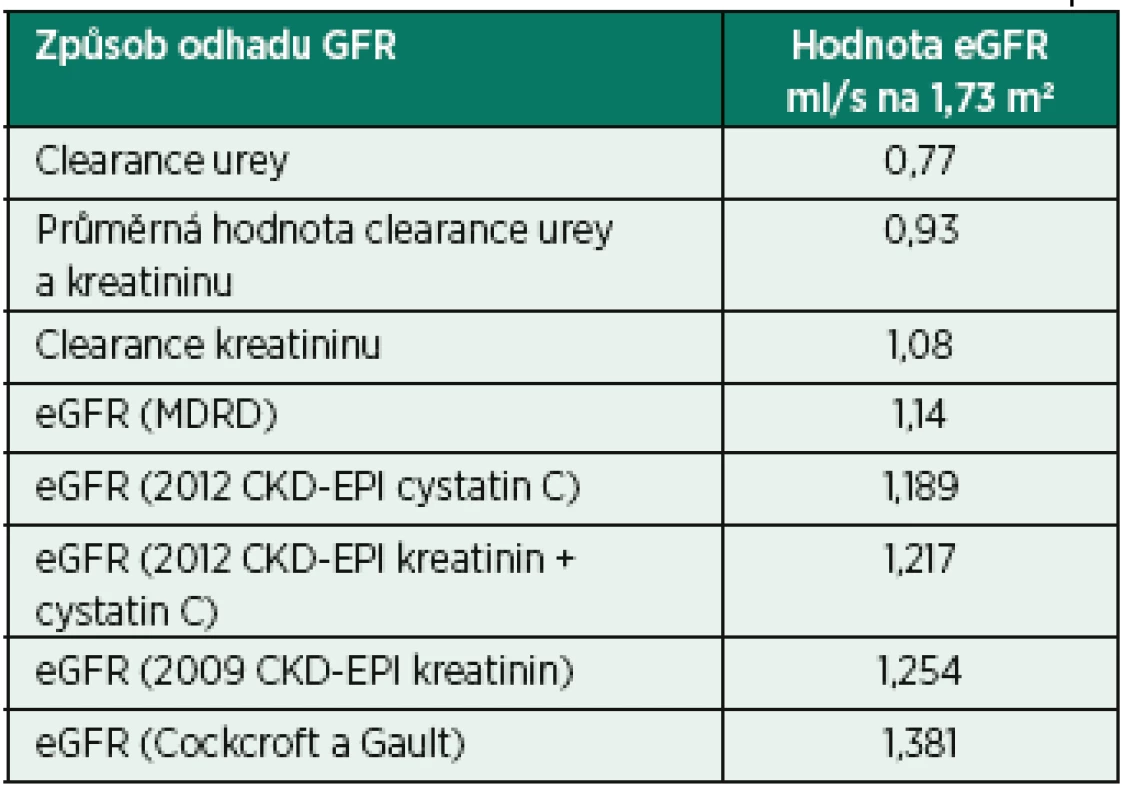
Rozdíly v odhadech GFR jsou přirozené, neboť různé rovnice jsou derivovány na různých populacích. V příkladu uvedeném v tabulce 5 je rozsah vypočtených hodnot od 0,77 (clearance urey) po 1,381 (Cockcroft a Gault) ml/s na 1,73 m2. Toto pořadí vypočtených hodnot neplatí univerzálně pro všechny pacienty, protože všeobecně clearance kreatininu nadhodnocuje odhad GFR a MDRD rovnice naopak podhodnocuje odhad GFR. Navíc platí, že některé rovnice lze dobře použít v intervalu “normální” GFR, jiné dávají spolehlivější výsledky při patologických stavech.
Řešení problému neexistuje, je nutné počítat s odchylkami různých metod odhadu GFR. V případě, že u pacienta lze předpokládat nižší spolehlivost využití kreatininu (svalový hyperkatabolismus, interference léků, malnutrice a kachexie – viz tabulka 4), je vhodné použít cystatin C. Naopak pokud pacient užívá kortikoidy, má diabetes, tyreopatii nebo hepatopatii, je vhodnější použít odhad z kreatininu.
5. Problém odhadu GFR v akutní péči
Lze předpokládat, že kreatinin nemusí být ideálním prediktorem GFR ze známých příčin (viz tab. 4). Lze ale také předpokládat, že změny kreatininu v čase budou odrážet změny glomerulární filtrace. Rovnice CKD-EPI [1] vycházejí ze sérového kreatininu, věku a pohlaví, případně ze sérového cystatinu C samostatně nebo z kombinace sérového kreatininu a cystatinu C. Diskuse o využití těchto rovnic v intenzivní péči není uzavřena, ale existují práce hodnotící jak význam sérového kreatininu, tak i sérového cystatinu C v intenzivní péči, přičemž:
- použití rovnice CKD-EPI je možné;
- porovnání s clearancí iohexolu není úplně uspokojivé;
- clearance iohexolu může být nižší i u pacientů se sérovým kreatininem 35–90 µmol/l, nejmenší absolutní odchylku od měření GFR (iohexol) má CKD-EPI z kreatininu a CKD-EPI kombinovaná;
- v pásmu ± 30 % od měřené hodnoty je pouze 60 % u JIP pacientů (CKD-EPI kreatinin), respektive 62 % (CKD-EPI kombinovaná);
- cystatin C se zdá být lepším prediktorem GFR než kreatinin u pacientů s eGFR pod 1 ml/s na 1,73 m2;
- CKD-EPI z cystatinu C může podhodnocovat skutečnou GFR [22].
Zvýšené koncentrace cystatinu C v séru mohou upozornit na horší prognózu pacientů. Zvýšení cystatinu C není pouze důsledkem poruchy glomerulárních funkcí, ale souvisí také s aktivací katepsinů a dalších proteáz v rámci cévní patologie i kardiovaskulárního rizika.
Řešení problému spočívá v opakovaném měření sérového kreatininu se sledováním trendů, stanovení cystatinu C pomůže „ukotvit“ hodnotu GFR a může přispět k hodnocení prognózy pacienta.
6. Problém „bazální hodnoty” sérového kreatininu
Jak RIFLE, tak AKIN používá při diagnostice AKI pojem “změna sérového kreatininu ... proti bazální hodnotě”. V intenzivní péči je pacient často přijat již s evidentním nebo předpokládaným poškozením funkce ledvin a není k dispozici bazální hodnota. Bellomo [23] navrhl způsob, jak odhadnout tuto hodnotu: využívá přitom zpětný výpočet sérového kreatininu z rovnice pro odhad GFR, pro zvolenou hodnotu 1,25 ml/s na 1,73 m2 (75 ml/min na 1,73 m2). Tyto údaje shrnuje tabulka 6, na rozdíl od Bellomem použité zastaralé rovnice MDRD je v tabulce použit výpočet podle současně doporučované rovnice CKD-EPI 2012.
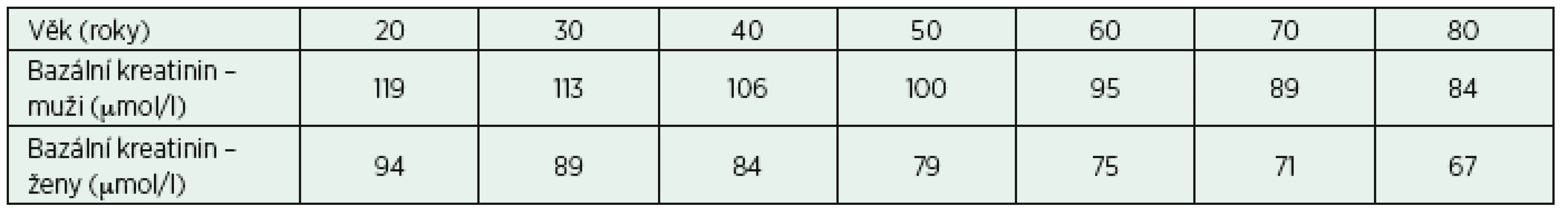
Příklad:
Šedesátiletý muž muž má první zjištěnou koncentraci kreatininu 125 µmol/l. Odhadovaná “bazální” koncentrace kreatininu při předpokládané hodnotě GFR 1,25 ml/s na 1,73 m2 je 95 µmol/l. Diference obou hodnot je 30 µmol/l, mohlo tedy dojít ke vzestupu sérového kreatininu nad mez 26,5 µmol/l, která je podle definice známkou přítomnosti AKI.
Řešení problému pomocí uvedeného postupu je jen podpůrné, individuální hodnoty je také možné získat z databáze historických výsledků pacienta. Někdy jsme ovšem odkázáni jen na sledování trendů sérového kreatininu od přijetí pacienta. Další možností je sledovat od počátku koncentrace biomarkerů AKI, jejichž zvýšení nad dohodnutou hodnotu (diagnostický cut-off) nebo trend změn koncentrace může odhalit riziko budoucího AKI i při absenci vzestupu sérového kreatininu [14].
7. Problém biologické variability při interpretaci
Biologická variabilita je parametr, který musí být nutně vzat do úvahy při interpretaci testu. Pro drtivou většinu laboratorních testů je analytická spolehlivost vysoká a fluktuaci výsledků způsobuje především biologická variabilita a další, preanalytické faktory [24]. Biologické variability jsou dostupné na stránkách www.westgard.com.
Intraindividuální variabilita odpovídá kolísání koncentrace „uvnitř” jedince, zatímco interindividuální variabilita odpovídá rozdílům „mezi” jedinci. Analytická spolehlivost musí reflektovat parametry biologické variability: čím nižší je biologická variabilita, tím vyšší musí být analytická kvalita. Analytická kvalita odvozená z biologických parametrů je reprezentována požadovanou precizností, maximální tolerovatelnou bias a celkovou přípustnou chybou. Pro správnou interpretaci dvou po sobě jdoucích měření a dosažení jejich významného rozdílu je zcela nezbytné použít tzv. kritickou hodnotu (reference change value, RCV): čím vyšší je biologická a analytická variabilita (CVa), tím vyšší je i potřebný rozdíl mezi dvěma po sobě jdoucími hodnotami, který je možné považovat za statisticky významný s požadovanou jistotou (obvykle 95%). Tabulka 7 tyto údaje shrnuje pro základní biomarkery funkce ledvin.
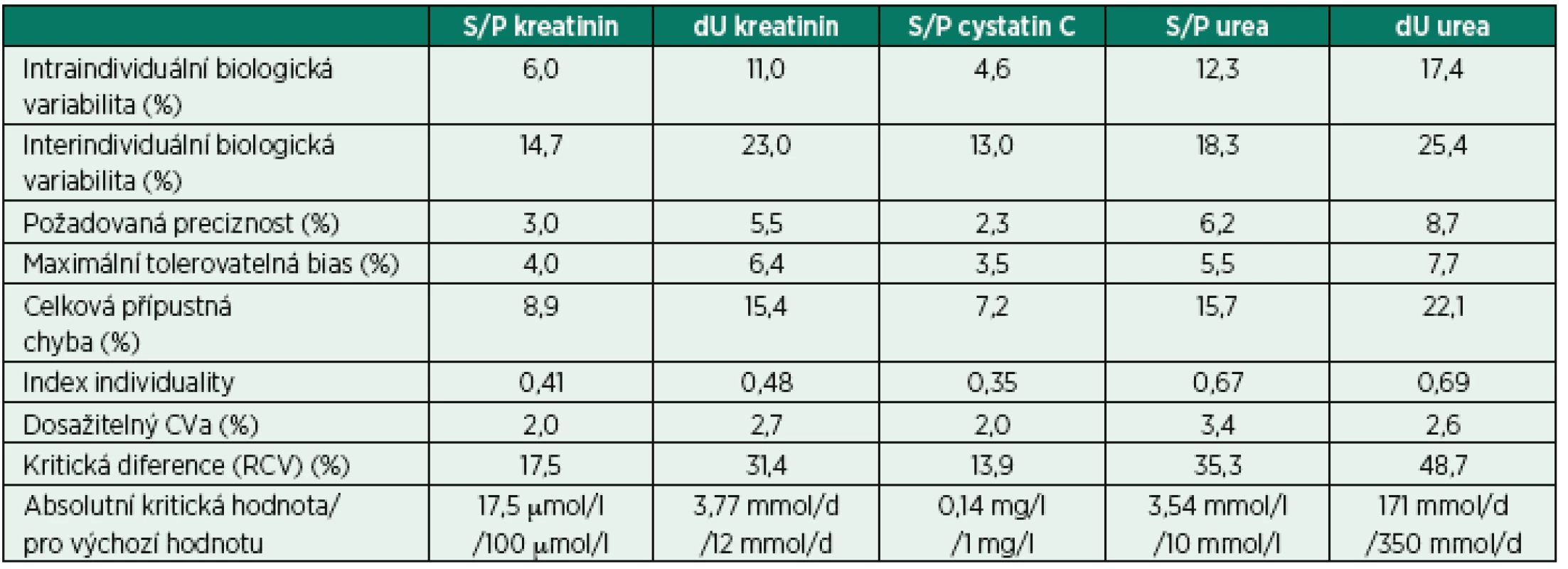
Řešení problému spočívá především ve znalosti problému a přístupu k informacím. Lékař intuitivně zná možné kolísání koncentrací vlivem biologických faktorů, ale obvykle jen ve své expertní oblasti. Ačkoli se zdá, že změny koncentrací mohou být ovlivněny nestabilní analytickou metodou, skutečnost ukazuje naopak na podstatně vyšší vliv variability biologické. Jen v situacích, kde se pracuje s domluvenými cut-off hodnotami, jsou požadavky na analytickou spolehlivost a mezilaboratorní porovnatelnost velmi vysoké.
8. Problém výběru a měření biomarkeru poškození
Desátá konference ADQI neudává hranice pro pozitivitu nebo pásma poškození pro žádný z kandidátních biomarkerů. K jednotlivým stupňům RIFLE nebo AKIN kritérií jsou semikvantitativně navržena pásma zvýšení některého z biomarkerů poškození, aby se zvýšila efektivita dosavadních systémů založených na změnách glomerulární filtrace, kreatininu v plazmě a diuréze. Není dosud vyřešena volba biomarkeru. Kromě typicky tubulárních biomarkerů (NGAL, KIM-1, alfa-1-mikroglobulin a další) lze používat i biomarkery dosud využívané jako biomarkery poškození glomerulů. Typickým příkladem je albuminurie (dříve mikroalbuminurie), dosud využívaná ve čtyřech hlavních indikacích: diagnostika diabetické nefropatie [25], klasifikace chronického onemocnění ledvin [1], vyšetření pacientů s hypertenzí a posouzení kardiovaskulárního rizika u pacientů bez hypertenze a bez diabetu. Albumin je jistě výrazněji filtrován poškozenými glomeruly, ale porucha reabsorbce albuminu v proximálním tubulu je rovněž možným mechanismem identifikace akutního poškození ledviny. Navíc je stanovení albuminurie běžně dostupné v laboratořích všech lůžkových zařízení. Jistě ale bude potřebné mít biomarker charakterizující poškození renálních tubulů nebo dokonce určité části nefronu s vysokou specifičností pro ledviny, bez produkce biomarkeru jinými tkáněmi. V rutinní praxi jsou běžně dostupná měření cystatinu C (kód VZP 81703), albuminu v moči (81675), beta-2-mikroglobulinu (91193) a alfa-1-mikroglobulinu v moči, NGAL v séru i v moči (81763). Všechna uvedená vyšetření lze provádět na automatických analyzátorech, ne všechny diagnostické firmy ale tato vyšetření nabízejí. Daleko méně se využívá stanovení N-acetyl-beta-D-glukózaminidáza (81555), jde o manuální metodu, podobně jako u dalších biomarkerů (KIM-1 a další).
Řešení problému spočívá ve spolupráci intenzivisty, nefrologa a klinického biochemika. Po volbě biomarkeru poškození pro danou instituci lze vypracovat lokální guideline pro používání biomarkeru tak, aby se získaná data mohla vyhodnocovat, a získat tak zkušenosti pro používání zvoleného biomarkeru. I když je pravděpodobně největší datová základna pro stanovení NGAL v moči nebo plazmě, určitou výpovědní hodnotu mohou poskytnout i močové biomarkery používané delší dobu, např. albumin, alfa-1-mikroglobulin nebo beta-2-mikroglobulin.
ZÁVĚRY
Velký pokrok v laboratorní diagnostice onemocnění srdce s identifikací tak významných molekul, jako jsou troponiny a natriuretické peptidy, nebyl paralelně následován v intenzivistické nefrologii. Přesto je v této oblasti významný pokrok v poznání patofyziologie akutního poškození ledvin, jsou nové klinické jednotky (kardiorenální syndrom, subklinické akutní poškození ledvin), jsou definována stadia akutního poškození ledvin a intezivně se sleduje význam biomarkerů poškození ledvin, zejména tubulárního aparátu. Je potřebné počítat s tím, že neoddělitelnou součástí výsledku je tzv. nejistota. Ta zahrnuje nejen vlivy analytické, ale také biologické variability nebo proces získání a zpracování vzorku před analýzou. Pro interpretaci je proto nutné zahrnout všechny „variability“ ve smyčce „brain-to-brain“ (od myšlenky lékaře na laboratorní vyšetření přes celý analytický proces až po zpracování informace mozkem lékaře). Velké spektrum možných molekul poškození ledvin povede jistě v blízké době k jejich zařazení do diagnostických postupů, budou určeny rozhodovací meze a navazující lékařské akce. Máme tedy před sebou oblast s velkým potenciálem pokroku.
Deklarace konfliktu zájmů
Autoři prohlašují, že v souvislosti s tímto sdělením nemají žádný konflikt zájmů.
Do redakce došlo dne 23. 10. 2015.
Do tisku přijato dne 27. 11. 2015.
Adresa pro korespondenci:
prof. MUDr. Antonín Jabor, CSc.
IKEM
Vídeňská 1958/9
140 21 Praha 4
e-mail: anja@ikem.cz
Sources
1. KDIGO CKD Work Group. KDIGO clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int. Suppl., 2013, 3, p. 1–150.
2. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Int. Suppl., 2012, 2, p. 1–138.
3. Mehta, R. L., Kellum, J. A., Shah, S. V., Molitoris, B. A., Ronco, C., Warnock, D. G. et al. Acute Kidney Injury Network: report of a initiative to improve outcomes in acute kidney injury. Crit Care, 2007, 11, R31.
4. Ronco, C. ADQI Consensus on AKI Biomarkers and Cardiorenal Syndromes. Contrib. Nephrol. Basel Karger, 2013, 182, p. 5–12.
5. Haase, M., Devarajan, P., Haase-Fielitz, A., Bellomo, R., Cruz, D. N., Wagener, G. et al. The outcome of neutrophil gelatinase-associated lipocalin-positive subclinical acute kidney injury: a multicenter pooled analysis of prospective studies. J. Am. Coll. Cardiol., 2011, 57, 17, p. 1752–1761.
6. Ho, J., Tangri, N., Komenda, P., Kaushal, A., Sood, M., Brar, R. et al. Urinary, Plasma, and Serum Biomarkers‘ Utility for Predicting Acute Kidney Injury Associated With Cardiac Surgery in Adults: A Meta-analysis. Am. J. Kidney Dis., 2015, pii: S0272-6386(15)00940-3. doi: 10.1053/j.ajkd.2015.06.018. [Epub ahead of print].
7. Urbschat, A., Obermüller, N., Haferkamp, A. Biomarkers of kidney injury. Biomarkers, 2011, 16 Suppl 1, S22–30.
8. Vanmassenhove, J., Vanholder, R., Nagler, E., Van Biesen, W. Urinary and serum biomarkers for the diagnosis of acute kidney injury: an in-depth review of the literature. Nephrol. Dial. Transplant., 2013, 28, 2, p. 254–273.
9. McCullough, P. A., Kellum, J. A., Haase, M., Muller, C., Damman, K., Murray, P. T. et al. Pathophysiology of the Cardiorenal Syndromes: Executive Summary from the Eleventh Consensus Conference of the Acute Dialysis Quality Initiative (ADQI). Blood Purif., 2014, 37, suppl, p. 2–13.
10. Bagshaw, S. M., Bennett, M., Haase, M., Haase-Fielitz, A., Egi, M., Morimatsu, H. et al. Plasma and urine neutrophil gelatinase-associated lipocalin in septic versus non-septic acute kidney injury in critical illness. Intensive Care Med., 2010, 36, 3, p. 452–461.
11. Matsa, R., Ashley, E., Sharma, V., Walden, A. P., Keating. L. Plasma and urine neutrophil gelatinase-associated lipocalin in the diagnosis of new onset acute kidney injury in critically ill patients. Crit Care, 2014, 18:R137.
12. Haase, M., Bellomo, R., Devarajan, P., Schlattmann, P., Haase-Fielitz, A. NGAL Meta-analysis Investigator Group. Accuracy of neutrophil gelatinase-associated lipocalin (NGAL) in diagnosis and prognosis in acute kidney injury: a systematic review and meta-analysis. Am. J. Kidney Dis., 2009, 54, 6, p. 1012–1024.
13. Haase-Fielitz, A., Haase, M., Devarajan, P. Neutrophil gelatinase-associated lipocalin as a biomarker of acute kidney injury: a critical evaluation of current status. Ann. Clin. Biochem., 2014, 51, Pt 3, p. 335–351.
14. Ronco, C. Biomarkers for acute kidney injury: is NGAL ready for clinical use? Crit. Care, 2014, 18 : 680.
15. Soveri, I., Berg, U. B., Björk, J., Elinder, C. G., Grubb, A., Mejare, I. et al. Measuring GFR: a systematic review. Am. J. Kidney Dis., 2014, 64, p. 411–424.
16. Sečník, P., Franeková, J., Komínková, M., Kotrbatý, J., Hunal, Z., Tlučhořová, D. et al. Interference dobutaminu při stanovení analytů s využitím Trinderovy reakce. Klinická biochemie a metabolismus, 2012, 20, 41, 1, p. 17–30.
17. Jaffé, M. Über den Niederschlag, welchen Pikrinsäure in normalen Harn erzeugt und über eine neue Reaction des Kreatinins. Z Physiol Chem., 1886, 10, p. 391–400.
18. Cockcroft, D. W., Gault, M. H. Prediction of creatinine clearance from serum creatinine. Nephron., 1976, 16, p. 31–41.
19. Levey, A. S., Stevens, L. A., Schmid, C. H., Zhang, Y. L., Castro, A. F. 3rd, Feldman, H. I. et al. A new equation to estimate glomerular filtration rate. Ann. Intern. Med., 2009, 150, p. 604–612.
20. Grubb, A., Nyman, U., Björk, J., Lindström, V., Rippe, B., Sterner, G. et al. Simple cystatin C-based prediction equations for glomerular filtration rate compared with the modification of diet in renal disease prediction equation for adults and the Schwartz and the Counahan-Barratt prediction equations for children. Clin. Chem., 2005, 51, p. 1420–1431.
21. Grubb, A., Horio, M., Hansson, L. O., Björk, J., Nyman, U., Flodin, M. et al. Generation of a new cystatin C-based estimating equation for glomerular filtration rate by use of 7 assays standardized to the international calibrator. Clin. Chem., 2014, 60, p. 974–986.
22. Delanaye, P., Cavalier, E., Morel, J., Mehdi, M,, Maillard, N., Claisse, G. et al. Detection of decreased glomerular filtration rate in intensive care units: serum cystatin C versus serum creatinine. BMC Nephrol., 2014, 15, 9.
23. Bellomo, R., Ronco, C., Kellum, J. A., Mehta, R. L., Palevsky, P. Acute Dialysis Quality Initiative workgroup. Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit. Care, 2004, 8, R204–212.
24. Jabor, A., Franeková, J. Principy interpretace laboratorních testů. Roche: Praha 2013, ISBN 978-80-260-5094-0.
25. American Diabetes Association (ADA). Standards of Medical Care in Diabetes-2015. Diabetes Care, 2015, 38, Suppl. 1, S1–S93.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2016 Issue 4
Most read in this issue
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Pooperační nauzea a zvracení u dětí
- Novinky v kardiopulmonální resuscitaci v porodnictví
