Endoteliální glykokalyx a tekutinová terapie v intenzivní a perioperační medicíně
The endothelial glycocalyx and fluid therapy in critical care and perioperative medicine
The endothelial glycocalyx represents a key component of the endothelial barrier on its intraluminal side. It is vital for the maintenance of vascular integrity in physiological conditions and most probably also in pathophysiological conditions. Due to its sugar-based structure, it is highly vulnerable and in the context of critical conditions of patients, the development of endothelial dysfunction is always linked to a certain degree of damage of the glycocalyx. The current state of knowledge favours determining a presumption of a relationship between the function of the glycocalyx and volume replacement therapy. Attempts to minimize damage (and to allow spontaneous recovery) are the only available rational concepts of maintaining integrity of the endothelium and reaching the maximal effect of infusion therapy. This narrative review article brings a summary of this topic and discusses arguments for consideration of the significance of the glycocalyx in the decision-making in fluid therapy.
Keywords:
endothelial glycocalyx – fluid therapy – microcirculation
:
D. Astapenko 1,2; J. Pouska 3,4; V. Černý 1,2,5,8; J. Beneš 3,4,9
:
Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové
1; Lékařská fakulta v Hradci Králové, Univerzita Karlova
2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Plzeň
3; Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta v Plzni, Univerzita Karlova
4; Klinika anesteziologie, perioperační a intenzivní medicíny, Masarykova nemocnice Ústí nad Labem, Univerzita J. E. Purkyně v Ústí nad Labem
5; Institut postgraduálního vzdělávání ve zdravotnictví
6; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové
7; Dept. of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Kanada
8; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova
9
:
Anest. intenziv. Med., 28, 2017, č. 5, s. 289-296
:
Intensive Care Medicine - Review Article
Endoteliální glykokalyx představuje klíčovou komponentu endoteliální bariéry na její intraluminální straně a má rozhodující úlohu při udržování vaskulární integrity za fyziologických a velmi pravděpodobně i patologických stavů. Biochemická struktura glykokalyx determinuje její vysokou vulnerabilitu, v kontextu kritických stavů je rozvoj endoteliální dysfunkce vždy spojen s určitým stupněm poškození glykokalyx. Současný stav poznání umožňuje formulovat předpoklad vztahu mezi funkcí glykokalyx a náhradou objemu v rámci tekutinové terapie. Minimalizace poškození (případně reparace již poškozené) glykokalyx představuje racionální klinický koncept k udržení/obnovení endoteliální integrity a dosažení maximální možné objemové efektivity tekutinové náhrady. Článek přináší shrnutí dané problematiky a diskutuje argumenty pro zohlednění významu glykokalyx při rozhodování o způsobu vedení tekutinové léčby.
Klíčová slova:
endoteliální glykokalyx – tekutinová terapie – mikrocirkulace
Úvod
Endoteliální glykokalyx (EG) je delikátní struktura pokrývající cévní výstelku celého lidského těla. Až do nedávné doby byl její význam pro lidskou fyziologii a patofyziologii opomíjen, mj. proto, že nebyly k dispozici jakékoli nástroje pro sledování její funkce, poškození a případné obnovy. V posledních letech se objevuje čím dále, tím více informací popisujících strukturu, funkci a význam EG pro náš organismus. Ukazuje se, že se jedná o stěžejní regulační mechanismus endoteliálních funkcí, strukturu, která ovlivňuje interakci cirkulujících látek a buněčných elementů s cévní stěnou. Endotel je vrstvou glykokalyxu významně chráněn před poškozením zevními vlivy, ať už fyzikálními či xenobiotiky. V neposlední řadě se ukazuje, že EG plní významnou funkci v míře propustnosti endotelu pro vodu a ionty a může být jedním z faktorů určujících způsob strategie tekutinové léčby. Cílem práce je shrnutí současného stavu problematiky a poukázání na význam glykokalyx ve vztahu k tekutinové léčbě.
Metodika práce
Studie a články vhodné pro sestavení přehledového sdělení byly identifikovány pomocí elektronického vyhledání v on-line databázi MEDLINE. Hledána byla následující klíčová slova: „endothelial glycocalyx“, „trauma“, „sepsis“, „fluids“, „critical care“. Nebylo provedeno žádné časové omezení, preferovaným jazykem byla angličtina. Celkově bylo k 1/2017 identifikováno 2625 článků. Relevantní publikace byly následně vybrány jednotlivými autory s ohledem na jejich vztah ke studované problematice.
Struktura a funkce endoteliální glykokalyx
Endoteliální glykokalyx je mikronová výstelka pokrývající endoluminální povrch cév, a jak ukazují recentní práce, patrně i membránu erytrocytů [1]. Složena je zejména z glykosaminoglykanů (např. heparan sulfát, hyaluronan) a proteoglykanů (např. syndekan 1), které ji zároveň kotví do membrány a cytoskeletu endoteliálních buněk (CD44) [2] (obr.1). Tyto jednotlivé komponenty tvoří složitou trojrozměrnou síť gelovité povahy, která v sobě uchycuje solubilní molekuly z plazmy nebo i z endotelu samotného. Mezi těmito molekulami a EG existuje dynamická rovnováha, která mění tloušťku glykokalyx dle aktuálních potřeb perivaskulárních tkání [3]. Ta je dále ovlivňována smykovým třením proudící krve a působením mnoha enzymů přítomných v plazmě. Ve výsledku se tloušťka EG pohybuje od několika desítek nanometrů v kapilárách až po několik mikrometrů v krčních tepnách [4]. Vysoká úroveň sulfatace v jejích komponentách a navázaný albumin [5] propůjčují EG negativní elektrický náboj. To má za následek odpuzování cirkulujících krevních elementů, a naopak vazbu sérových kationtů (zejména sodíku) a proteinů (hlavně orosomukoidu), které mohou dále modulovat její konformaci.
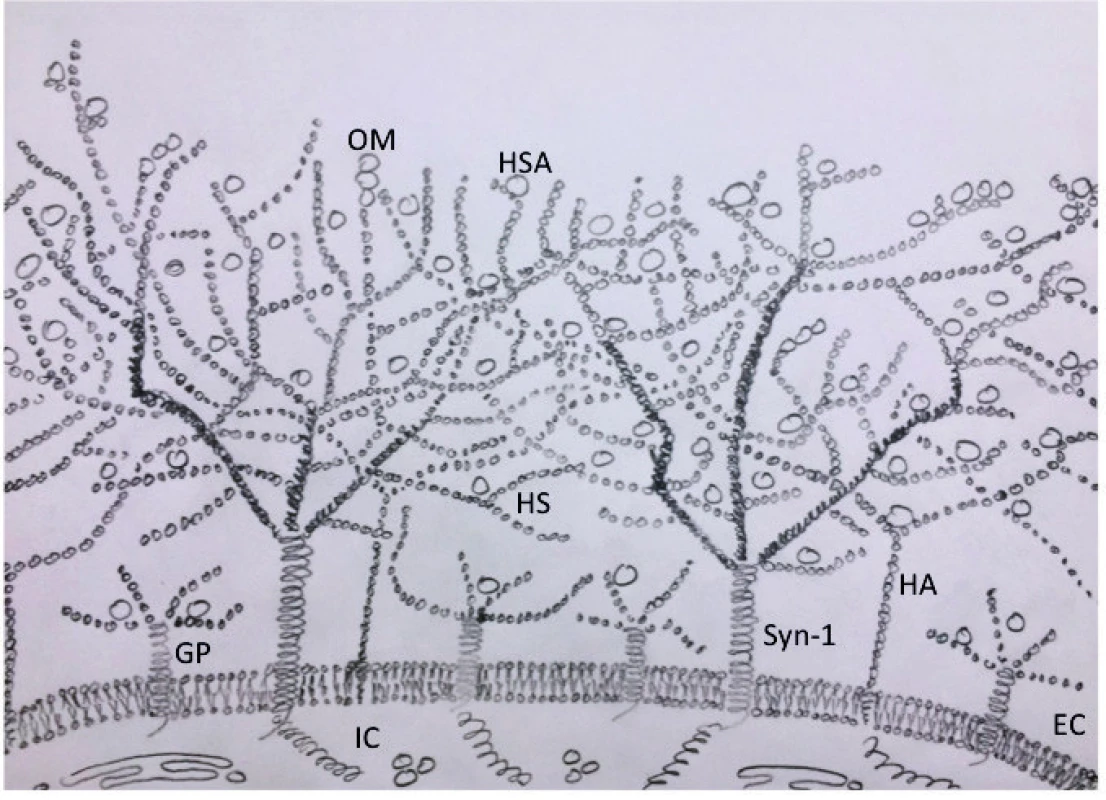
Svojí povahou a zakomponovanými solubilními molekulami je zodpovědná za některé fyziologické děje, které byly připisovány endotelu. EG do jisté míry reprezentuje acelulární intersticium v intravaskulárním prostředí, které umí mj. do své sítě pojmout velké množství sodíkových kationtů (např. při chronickém srdečním selhávání) [7]. Rozprostření základních stavebních prvků EG a jejich saturace navázanými onkoticky aktivními látkami významně určuje velikost molekul, které se dostanou k povrchu endotelu, čímž významnou mírou přispívá k řízení vaskulární permeability [8]. Tato funkce nabývá na extrémním významu ve specifických kapilárních sítích, jako jsou ledvinné glomeruly, kde určuje limitní velikost filtrovatelných molekul [9], nebo hematoencefalická bariéra. Přesný poměr jednotlivých stavebních komponent EG je závislý na typu kapilární sítě a funkce tkáně (parenchymatózní orgán vs. kožní mikrocirkulace). Navíc se zdá, že má význam i při nádorovém metastazování [10]. Transkapilární pohyby tekutin popsané Starlingem jsou velkou měrou řízeny právě EG při její správné funkci [11] – viz dále. Krevní elementy (erytrocyty a trombocyty) jsou od cévní stěny díky EG odpuzovány, dochází k ovlivnění hemokoagulace [12] a krevní reologie [13]. Interakce s leukocyty je ambivalentní: EG na jednu stranu minimalizuje kontakt leukocytů s endoteliálními buňkami, na druhou stranu jsou v její 3D síti skryty četné adhezivní molekuly (P-selektiny, ICAM-1, VCAM-1). Pomalým pohybem leukocytů podél stěny kapiláry dochází ovšem ke kompresi EG [14]. Glykokalyx má také významnou funkci v regulaci tonu hladké svaloviny cév prostřednictvím uvolnění NO [3, 15]. Zdá se, že kvalita smykového tření (sheer stress) sama o sobě moduluje složení a konformaci EG [2, 16]. Do jaké míry se endoteliální glykokalyx podílí také na regulaci spontánních cyklických oscilací průsvitu mikrocirkulace (tzv. vasomotion fenoménu), zatím není jasné [17], lze ovšem předpokládat významnou vzájemnou interakci. Všemi svými vlastnostmi EG tedy do značné míry kontroluje děje v mikrocirkulaci a v mikroprostředí tkání, čímž de facto plní funkce acelulární intersticiální mikrovrstvy uvnitř cév a kapilár. Působí „vaskuloprotektivně“ a ukotvenými enzymy moduluje hemokoagulaci, lipolýzu, antioxidační kapacitu a reguluje dráhy buněčných signalizací. Při určitém zjednodušení plní funkci „homeostatického nárazníku“ mezi intravaskulárním a intersticiálním prostorem (obr. 1).
Poškození glykokalyx v kritických stavech
Intravaskulární kompartment EG je svojí povahou velmi křehkou strukturou. Na jedné straně dochází k neustálé syntéze základních komponent v endoteliálních buňkách a na straně druhé k jejich kontinuální desintegraci. Rovnováha těchto dějů určuje aktuální tloušťku, potažmo funkci EG. Možnosti syntézy a reparace jsou v kritických stavech omezeny. Integrita EG může být narušena/poškozena řadou molekul, enzymů, imunitních a patofyziologických dějů. Například „pouhá“ hypernatrémie vede ke změnám náboje EG skrze ovlivnění sulfatace a navázáním na glykosaminoglykanové polymery zvyšuje „tuhost“ endotelu a snížení produkce NO [18]. Uvedený proces vede ke zvýšení arteriolární rezistence, zvýšení zátěže levé komory a v dlouhodobém měřítku k rozvoji chronického srdečního selhávání provázenému dalšími patofyziologickými ději (zánět, oxidační stres, enzymatická degradace, excesivní smykové tření) [3, 6]. Z fylogenetického hlediska je však řízená dezintegrace EG spolu se zvýšením kapilární permeability důležitou obrannou reakcí mikrocirkulace na noxu s cílem usnadnit průnik imunitních buněk do místa poškození tkáně a zahájení procesů neutralizace noxy a následné reparace.
V literatuře je popsáno chování (a poškození) EG z pohledu několika základních patofyziologických stavů. Je nutné si ale uvědomit, že terapií těchto vyvolávajících příčin může dojít i k jejímu sekundárnímu poškození:
Ischemicko reperfuzní syndrom – přestože míra poškození tkání přechodným nedostatkem kyslíku a nutričních substrátů není stejná, klíčovou roli v rozvoji reperfuzního syndromu hraje ve všech orgánech mikrocirkulace [19]. Ischemie a reperfuze navodí poškození endotelu a odlučování endoteliálních buněk od bazální membrány [20]. Intenzita oxidačního stresu rovněž poškozuje EG [21] s následnou expozicí adhezivních molekul pro leukocyty [22], výsledkem je porucha funkce kapilární membrány a vznik intersticiálního edému [23].
Sepse – při sepsi je EG velmi rychle degradována působením jak inflamatorního oxidačního stresu a mediátorů zánětu (TNFα, oxidované lipoproteiny, bakteriální lipopolysacharidy, hyperglykemie, trombin) [24], tak specifickými enzymy (např. heparináza, hyaluronidáza) z extrudovaných lyzozomů. Degradační produkty glykokalyx působí samy o sobě jako vnitřní nebezpečné molekulové vzory (tzv. Danger Associated Molecular Patterns – DAMPs), které umocňují systémovou zánětlivou odpověď skrze TLR-4 receptory [25]. Výsledkem je opět ztráta ochranné funkce endotelu, porucha cévní reaktivity a únik tekutiny extravaskulárně. Na druhou stranu – desintegrace EG při sepsi může mít podle některých autorů i svůj fyziologický význam – uvolněné aminoglykosaminy se totiž mohou podílet na antimikrobiální aktivitě plazmy [26].
Trauma – základním mechanismem poškození EG je systémová zánětlivá odpověď organismu na trauma. Hladina syndekanu-1 (jednoho z degradačních produktů glykokalyx) je u těchto pacientů zvýšená a úzce koreluje s mírou zánětlivé odpovědi a traumatem asociované koagulopatie [27]. Vedle toho byla shledána i jako nezávislý prediktor akutního selhání ledvin, ventilátorem asociované pneumonie a celkové mortality [12].
Operační výkon – poškození EG během operačního výkonu je velkou měrou dáno rozsahem výkonu (končetiny vs. dutinové operace) a stavem pacienta (ASA I vs. ASA V). Svoji roli na vlastnosti EG má pravděpodobně i volba anestezie. Perioperačně vzniklá hypervolémie může vést k významnému sekundárnímu poškození EG.
POŠKOZENÍ ENDOTELIÁLNÍ GLYKOKALYX A PATOFYZIOLOGIE VZTAHUJÍCÍ SE K TEKUTINOVÉ TERAPII
Tekutinová terapie představuje nedílnou součást léčby prakticky všech kritických stavů. V posledních letech došlo v důsledku lepšího poznání vlivu intravenózně podaných tekutin na globální hemodynamiku, mikrocirkulaci a EG k významné revizi postupů tekutinové léčby. Jak ukazuje celá řada prací [28–30], tekutinová terapie per se může sehrát významnou roli při vzniku endoteliální dysfunkce a poškození EG a následně akcelerovat rozvoj multiorgánové dysfunkce.
Endoteliální glykokalyx je složena z proteoglykanů a glykoproteinů nesoucích negativní elektrické vazebné místo. Za normálních podmínek jsou zde navázány molekuly bílkovin plazmy, převážně albumin [3]. Tato „směs“ makromolekul tvoří funkční bariéru nazývanou v angličtině endothelial surface layer (ESL). Přestože je bariéra jen několik μm tenká, za fyziologických podmínek v cévním řečišti celého organismu váže odhadem 1‒1,7 l tekutiny, tedy podstatnou část objemu plazmy [31]. Na těchto poznatcích je založeno nové fyziologické pochopení funkce endotelu, EG a ESL. Zatímco původní Starlingův zákon dával do souvislosti míru filtrace nebo resorpce tekutiny přes vaskulární bariéru k pozitivnímu či negativnímu rozdílu hydrostatických tlaků na konci kapiláry a onkotického tlaku plazmy [32], v současné době mluvíme o tzv. „revidovaném“ Starlingově zákonu, zahrnujícím fyziologii EG [11]. Ten je založen na faktu, že mezi glykokalyx a endoteliální buňkou vzniká extrémně tenká vrstvička (subglykokalyx), která je elektricky neutrální s téměř nulovým obsahem proteinů (ty jsou odtud „vymývány“ filtrátem přes póry endotelu). Tím je vytvořena efektivní, vysoce onkoticky aktivní bariéra bránící extravazaci intravaskulární tekutiny. Naopak subglykokalykální prostor s nízkým onkotickým tlakem oponuje hydrostatickým tlakům intersticia. Vzniklá bariéra tím minimalizuje filtraci tekutiny do intersticia – tzv. přesun tekutin 1. typu. Vzhledem k přítomnosti vrstvičky subglykokalyx bez proteinů při vnějším povrchu endoteliální buňky není onkotický tlak mezi lumen kapiláry a intersticiem dostatečný k přesunu tekutiny opačným směrem: k reabsorpci tekutiny do lumen kapiláry fyziologicky tedy ve většině případů nedochází [33].
Jednu z výjimek tvoří akutní hypovolémie. Náhlé prudké snížení hydrostatického tlaku v kapiláře má několik následků. Zaprvé ‒ míra filtračního gradientu tekutiny daná převážně rozdílem hydrostatických tlaků vně/uvnitř kapiláry klesá k nule, a zadruhé ‒ při nízkém filtračním gradientu dochází k nahromadění proteinů v subglykokalyx, které sem při nepřítomnosti filtrace difundují z intersticia. Následkem toho vzniká onkotický tlak mezi intersticiem a intravaskulárním prostorem a umožňuje dočasnou zpětnou absorpci tekutiny. Zvýšení vasomotion aktivity může dále hrát roli v adaptaci hydrostatických tlaků napomáhající mobilizaci intersticiální tekutiny a zároveň perfuzi tkání [17]. Tato fyziologická objemová „autotransfuze“ dosahuje u dospělého člověka přibližně 500‒1000 ml, uvedený mechanismus přestává fungovat v momentě dosažení rovnováhy, tj. vzroste hydrostatický tlak a zároveň dojde k odstranění molekul proteinů ze subglykokalyx.
Zachování integrity EG je jedním z předpokladů udržení cirkulujícího objemu a významně se podílí i na chování infundovaných roztoků různého složení (a onkotické aktivity). Hypoteticky tedy při hypovolémii, sníženém kapilárním tlaku a zachovalé integritě glykokalyx infuze roztoku koloidů zvětšuje pouze cirkulující (plazmatický) objem a infuze krystaloidů celý objem intravaskulární (tedy včetně objemu ESL). Ani v jednom případě nedochází k významné okamžité filtraci tekutiny. Tento model může částečně vysvětlit, proč při stavech se zachovalou funkcí EG (např. penetrující trauma, akutní normovolemická hemodiluce) je objemový efekt krystaloidu ku koloidu nízký, cca 1 : 2 [34]. Při porušení glykokalyx (například při sepsi či tupém traumatu) klesá její objem, a tedy dochází k vyrovnání plazmatického a intravaskulárního objemu, což vede k obdobnému objemovému efektu krystaloidů a koloidů [35]. Navíc v důsledku významně narušené filtrační bariéry ESL dochází k extravaskulárnímu úniku všech složek plazmy (tzv. přesun tekutin 2. typu). Akutní hypervolémie (nejčastěji iatrogenní) je jedním z významných mechanismů vedoucích k poškození EG. Zodpovědný je pravděpodobně ANP (atriální natriuretický peptid) [36] secernovaný mechanicky namáhanými kardiomyocyty při dilataci srdečních síní. Delikátní struktura je tímto působkem destruována aktivací metaloproteináz, což vede k jejímu ztenčení a disrupci s následnou extravazací tekutiny a vznikem intersticiálního edému.
Tekutinová léčba a endoteliální glykokalyx
Podání tekutin je jednou z nejčastějších intervencí v anesteziologii a intenzivní péči. Hlavním cílem je dosažení a/nebo udržení tzv. kardiovaskulární stability, které je v klinické praxi obvykle interpretováno jako dosažení určitých makrohemodynamických cílů (krevní tlak, srdeční výdej). Kardiovaskulární stabilita je ovšem závislá i na správné funkci mikrocirkulace, a tedy vrstvy glykokalyx. Jelikož dosud nemáme jednoznačně účinný prostředek, který by vedl k reparaci EG, mohou se naše snahy omezit pouze na prevenci poškození (pokud je ESL intaktní – například elektivní operační zákroky), případně eliminaci faktorů, které EG dále poškozují či brání reparaci (například sepse či trauma). Teoreticky má tekutinová terapie k poškození EG vztah jak příčiny, tak následku: poškozená EG ovlivňuje efektivitu podaných tekutin, a naopak neadekvátně vedená tekutinová terapie může její strukturu významně poškodit [36]. Množství experimentálních a klinických prací zabývajících se problematikou tekutinové terapie ve vztahu k EG je malé.
Experimentální studie
V experimentálních studiích můžeme přesně kopírovat klinický scénář poškození EG (hemoragický šok, oběhová zástava atd.) a testovat různé roztoky k náhradě ztraceného objemu se zaměřením na reparaci EG. Většina studií je ovšem prováděna na malých zvířatech a jejich plná přenositelnost do klinické praxe a podobnosti se zásadami pro randomizované klinické studie není možná [37].
Většina studií sleduje rozpadové produkty glykokalyx (např. heparan sulfát, syndekan-1) nebo metody mikroskopické (elektronová a/nebo fluorescenční mikroskopie). In vivo videomikroskopie využívající technologii Sidestream dark field (SDF) vyvinutá pro sledování mikrocirkulace a EG v sublingvální oblasti je pro malá zvířata obtížně použitelná. Dle dosavadních experimentálních prací by ideální tekutina pro resuscitaci a obnovu/ochranu mikrocirkulace a glykokalyx po hemoragickém šoku měla obsahovat hemoglobin, mít vysokou osmolaritu a viskozitu a mít tendenci potlačit systémovou zánětlivou odpověď [38]. Pati et al. prokázal pozitivní vliv resuscitace plazmou na funkce mikrocirkulace (endoteliální permeabilita, vaskulární stabilita) [39] v modelu hemoragického šoku. Poškození EG v modelu hemoragického šoku a protektivní vliv podané mražené plazmy byl prokázán i v několika dalších experimentálních pracích [40,41], obdobný protektivní vliv byl zaznamenán i po podání „čerstvých“ trombocytů (mladších 5 dní) [42]. Naopak, experimentální výzkum zatím neprokázal superiorní efekt krystaloidů či koloidů [40,43].
Klinické studie
Do současné doby nebylo provedeno mnoho klinických studií zabývajících se vztahem optimálně vedené tekutinové terapie (množství, charakter náhradního roztoku atp.) a integrity EG. Jedním z důvodu je zmíněná složitost metodiky stanovení funkce EG in vivo – zvláště pak v reálném čase – a dále pak nejasná standardizace těchto metod. Většina dosud publikovaných klinických studií se spíše zabývá možnostmi, jak lze poškození EG kvantifikovat, případně lze-li jej minimalizovat nebo mu zcela zabránit. Problematikou pozitivní modulace (tedy protektivního vlivu podané tekutiny) se v klinickém experimentu doposud zabývalo jen minimum autorů.
Chapell et al. [29] na skupině nerizikových pacientů podstupujících operační výkon dobře zdokumentoval, že podání tekutinového bolusu (20 ml/kg) vede u jinak zdravých pacientů k signifikantnímu nárůstu hodnot ANP (o 100 %, p < 0,05) a syndekanu-1 (o 80 %, p < 0,05) v krvi oproti pacientům, kterým byl podán stejný tekutinový bolus v rámci akutní normovolemické hemodiluce předoperačně. Obdobné známky poškození EG zaznamenal i Powell u rodiček podstupujících císařský řez, kterým byla podána preemptivní objemová expanze [30]. Významné zvýšení ANP ovšem v této práci nebylo pozorováno, což poukazuje i na možné jiné mechanismy poškození EG podanou tekutinou. Každopádně tato pozorování podporují v lidské medicíně hypotézu, že artificiálně navozená hypervolémie je pro zachování glykokalyx škodlivá. Brettner [44] navrhuje pojem „Glycocalyx shedding induced lung injury (GILI)“, poškození plicního endotelu vzniklé kombinací neadekvátní ventilace a hypervolémie během nitrohrudních operačních výkonů. Bruegger [28] zdokumentoval zvýšení hladin glykokalyx-degradačních produktů u 30 pacientů podstupujících kardiochirurgický operační výkon, přičemž hladina syndekanu-1 se pooperačně zvýšila až 15krát. Na malém vzorku dětských kardiochirurgických pacientů [45] byla prokázána slabá, ale signifikantní korelace mezi pooperační hypotermií (na níž se množství infuzí může významně podílet) a jedním z parametrů anatomické integrity glykokalyx měřených in vivo metodou SDF imaging (perfused vessel density, PVD).
Pokud je EG poškozena, může být další podání krystaloidů zatíženo zvýšeným množstvím vzniklých komplikací. Puskarich et al. [46] změřili syndekan-1 u 175 pacientů léčených pro sepsi. U skupiny pacientů s vyšší hladinou syndekanu-1 byla zjištěna statistická závislost mezi množstvím podaného krystaloidu a rizikem vzniku respiračního selhání. U skupiny pacientů s normální hladinou syndekanu-1 (ekvivalent neporušené glykokalyx) tato závislost pozorována nebyla. Zdá se tedy, že pro pacienty s již poškozenou EG je optimální vedení tekutinové terapie mnohem více důležité.
Stran potenciálního modulujícího vlivu podaných tekutin je nutno zmínit zatím jedinou klinickou studii zabývající se případným protektivním vlivem mražené lidské plazmy na EG. Práce navazuje na již zmíněná experimentální data: Stratt [47] studovala v prospektivní randomizované práci podání „protektivní“ dávky plazmy (12 ml/kg) kriticky nemocným před invazivním zákrokem se závěrem významného snížení hladiny syndekanu-1. Do jaké míry je protektivní vliv mražené plazmy (případně jiných transfuzních přípravků) na EG vyvážen jejich obecnými riziky, není zatím možno stanovit. Naopak efekt umělých koloidních náhrad (jmenovitě hydroxyethylškrobu) na glykokalyx nebyl v klinické medicíně zaznamenán [48].
Co umožňuje současný stav poznání formulovat ve vztahu k tekutinové terapii
Jak vyplývá z předchozího textu, je množství dat, na kterých by bylo možno postavit jasná doporučení pro „endothelial glycocalyx friendly“ tekutinovou léčbu, stále naprosto nedostatečné. Z makrohemodynamického pohledu data potvrzují význam časné tekutinové resuscitace a následné racionální tekutinové restrikce [49], na druhou stranu existuje evidentní disproporce mezi makro - a mikrocirkulací [50]. Glykokalyx a míra jejího poškození může určovat efektivitu tekutinové léčby a naopak ‒ tekutinová léčba může významně ovlivnit strukturu a funkci EG.
Vztah podání tekutin a EG lze charakterizovat jako tzv. kontext senzitivní [51], tzn. že klinický efekt stejného množství identického roztoku může být odlišný v závislosti na aktuálním stavu. Při volbě taktiky/způsobu tekutinové resucitace bychom měli vzít v úvahu mj. i následující aspekty:
- předpokládanou míru poškození EG a ESL v kontextu aktuální klinické situace,
- stav náplně krevního řečiště (ve smyslu odhadu účinnosti námi zamýšlené tekutinové výzvy / objemové náhrady),
- stav mikrocirkulace a kapilární tlak.
Tatara v nedávno publikovaném přehledovém článku [51] velmi podrobně popsal možnosti, které vznikají v klinické medicíně s ohledem na hodnoty kapilárního tlaku a onkotický tlakový rozdíl mezi vnitřkem cévy, štěrbinou v subglykokalyx a intersticiem.
Pravděpodobně nejdůležitější je uvědomit si, že v situacích sníženého kapilárního tlaku (např. akutní ztráta krve) se (bez ohledu na hodnoty onkotického tlaku) prakticky zastavuje transkapilární filtrace. Krystaloidní a koloidní roztoky mají v tomto kontextu jednoznačný objemový efekt [33]. Podání tekutin vede přes vzestup tlaku v mikrocirkulaci k postupné obnově transkapilární filtrace a uplatnění objemového efektu podaných roztoků ‒ teprve v tomto momentě se ale začne uplatňovat odlišný objemový efekt koloidů a krystaloidů.
Protože kapilární tlak je více závislý na venózním než na arteriolárním tlaku, chová se mikrocirkulace obdobně i v situacích, kdy dochází ke snížení postkapilárního tlaku (například vlivem přerozdělení mezi tzv. unstressed a stressed volume po úvodu do celkové anestezie vlivem vazodilatace navozené indukčními anestetiky). Infuze tekutiny v tomto případě vede k nárůstu jak na arteriální (méně), tak venózní (více) části kapiláry, a vede tedy k výraznějšímu nárůstu kapilárního tlaku, a tedy transkapilární filtrace [51]. Naopak, v případě užití vazopresorů dojde ke zvýšení více arteriálního a méně venózního tlaku, čímž je nárůst kapilárního tlaku (a tedy filtrace) menší i při vyšších tlacích v systémovém řečišti.
V případě, kdy jsou tlaky v žilním a kapilárním řečišti normální (nebo dokonce zvýšené), vede objemová expanze jednak k navýšení kapilárních tlaků a dále k narušení vrstvy EG/ESL, čímž je únik tekutin a onkoticky aktivních látek do intersticia významně urychlen. Ve stavech, kdy je glykokalyx poškozena patologickým procesem (např. sepse), je kapilární tlak snížen jak v důsledku poklesu arteriálního tlaku, tak zároveň při snížení venózních tlaků (mechanismem je především tzv. přerozdělení unstressed vs. stressed volume), nicméně i tyto nižší hodnoty postačí k transkapilární filtraci při poruše permeability kapilár. Důsledkem je další snížení kapilárního tlaku vlivem faktické hypovolémie. Kombinace odstranění noxy a přiměřená tekutinová náhrada (často s nutností podání vazopresorů pro dosažení cílových hodnot krevního tlaku, včetně obnovy tlaku v mikrocirkulaci) je v klinické medicíně jedinou dostupnou intervencí.
Stávající technologie neumožňují zhodnotit v běžné péči míru poškození EG/ESL, stejně tak jako neumožňují stanovení tlaků v kapilárním řečišti. V klinické praxi je tedy nutné vycházet z integrace dostupných údajů o pacientovi a jeho unikátního/individuálního klinického kontextu. Zabránění hypervolémii (byť i jen krátkodobé a přechodné na „vrcholu“ agresivně podaného bolusu) je jedním z nejdůležitějších aspektů „EG friendly“ přístupu k tekutinové terapii, přestože definovat ostrou hranici mezi nutným a nadměrným množstvím tekutin z pohledu dopadu na EG nelze. Současný stav poznání neumožní formulovat případný protektivní efekt některých objemových náhrad (hlavně albuminu) či transfuzních přípravků (dominantně plazmy), jakkoliv určitý signál v některých pracích podle našeho názoru existuje.
Závěr
Endoteliální glykokalyx hraje jednu z klíčových rolí v efektivitě tekutinové terapie. Funkce EG je podáním tekutin s velkou pravděpodobností ovlivněna. Aktuální stav poznání problematiky neumožňuje formulovat jednoznačná a univerzální doporučení pro klinickou praxi, zásadní význam z pohledu ovlivnění integrity EG má hypervolémie.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že v souvislosti s tématem práce nemají střet zájmů.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-31881A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Do redakce došlo dne 4. 4. 2017.
Do tisku přijato dne 3. 7. 2017.
Adresa pro korespondenci:
doc. MUDr. Jan Beneš, Ph.D.
benesj@fnplzen.cz
Sources
1. Oberleithner H. Vascular endothelium leaves fingerprints on the surface of erythrocytes. Pflügers Arch – Eur J Physiol. 2013;465 : 1451–1458.
2. Tarbell JM, Pahakis MY. Mechanotransduction and the glycocalyx. J Intern Med. 2006;259 : 339–350.
3. Reitsma S, Slaaf DW, Vink H, van Zandvoort MAMJ, oude Egbrink MGA. The endothelial glycocalyx: composition, functions, and visualization. Pflugers Arch. 2007;454 : 345–359.
4. Megens RTA, Reitsma S, Schiffers PHM, Hilgers RHP, De Mey JGR, Slaaf DW, et al. Two-photon microscopy of vital murine elastic and muscular arteries. Combined structural and functional imaging with subcellular resolution. J Vasc Res. 2007;44 : 87–98.
5. Huxley VH, Curry FE. Differential actions of albumin and plasma on capillary solute permeability. Am J Physiol. 1991;260(5 Pt 2):H1645–654.
6. Nijst P, Verbrugge FH, Grieten L, Dupont M, Steels P, Tang WHW, et al. The pathophysiological role of interstitial sodium in heart failure. J Am Coll Cardiol. 2015;65 : 378–388.
7. Korte S, Wiesinger A, Straeter AS, Peters W, Oberleithner H, Kusche-Vihrog K. Firewall function of the endothelial glycocalyx in the regulation of sodium homeostasis. Pflügers Arch Eur J Physiol. 2012;463 : 269–278.
8. Salmon AHJ, Satchell SC. Endothelial glycocalyx dysfunction in disease: albuminuria and increased microvascular permeability. J Pathol. 2012;226 : 562–574.
9. Rabelink TJ, de Zeeuw D. The glycocalyx – linking albuminuria with renal and cardiovascular disease. Nat Rev Nephrol. 2015;11 : 667–676.
10. Xiao H, Woods EC, Vukojicic P, Bertozzi CR. Precision glycocalyx editing as a strategy for cancer immunotherapy. Proc Natl Acad Sci. 2016;113 : 10304–10309.
11. Levick JR. Fluid exchange across endothelium. Int J Microcirc Clin Exp. 1997;17 : 241–247.
12. Gonzalez E, Moore EE, Moore HB, Theresa C, Chapman M, Ghasabyan A, et al. Syndecan-1 a Marker of Endothelial Injury is Associated with Increased Blood Product Requirement and Poor Outcomes in Trauma Patients. J Surg Res. Elsevier. 2014;186 : 588–589.
13. Pries AR, Secomb TW. Microvascular blood viscosity in vivo and the endothelial surface layer. Am J Physiol Heart Circ Physiol. 2005;289:H2657–2664.
14. Constantinescu AA, Vink H, Spaan JAE. Endothelial cell glycocalyx modulates immobilization of leukocytes at the endothelial surface. Arterioscler Thromb Vasc Biol. 2003;23 : 1541–1547.
15. Mochizuki S, Vink H, Hiramatsu O, Kajita T, Shigeto F, Spaan JAE, et al. Role of hyaluronic acid glycosaminoglycans in shear-induced endothelium-derived nitric oxide release. Am J Physiol Heart Circ Physiol. 2003;285:H722–726.
16. Gouverneur M, Spaan JAE, Pannekoek H, Fontijn RD, Vink H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am J Physiol Heart Circ Physiol. 2006;290:H458–462.
17. Pradhan RK, Chakravarthy VS. Informational dynamics of vasomotion in microvascular networks: a review. Acta Physiol (Oxf). 2011;201(2):193–218.
18. Oberleithner H, Riethmüller C, Schillers H, MacGregor GA, de Wardener HE, Hausberg M. Plasma sodium stiffens vascular endothelium and reduces nitric oxide release. Proc Natl Acad Sci U S A. 2007;104 : 16281–16286.
19. Seal JB, Gewertz BL. Vascular dysfunction in ischemia-reperfusion injury. Ann Vasc Surg. 2005;19 : 572–584.
20. Oliver MG, Specian RD, Perry MA, Granger DN. Morphologic assessment of leukocyte-endothelial cell interactions in mesenteric venules subjected to ischemia and reperfusion. Inflammation. 1991;15 : 331–346.
21. Rubio-Gayosso I. Reactive oxygen species mediate modification of glycocalyx during ischemia-reperfusion injury. AJP Hear Circ Physiol. 2006;290:H2247–2256.
22. Vollmar B, Glasz J, Menger MD, Messmer K. Leukocytes contribute to hepatic ischemia/reperfusion injury via intercellular adhesion molecule-1-mediated venular adherence. Surgery. 1995;117 : 195–200.
23. Kupinski AM, Shah DM, Bell DR. Transvascular albumin flux in rabbit hindlimb after tourniquet ischemia. Am J Physiol. 1993;264(3 Pt 2):H901–908.
24. Burke-Gaffney A, Evans TW. Lest we forget the endothelial glycocalyx in sepsis. Crit Care. 2012;16 : 121.
25. Goodall KJ, Poon IKH, Phipps S, Hulett MD. Soluble heparan sulfate fragments generated by heparanase trigger the release of pro-inflammatory cytokines through TLR-4. Srinivasula SM, editor. PLoS One. 2014;9:e109596.
26. Nelson A, Berkestedt I, Schmidtchen A, Ljunggren L, Bodelsson M. Increased levels of glycosaminoglycans during septic shock: relation to mortality and the antibacterial actions of plasma. Shock. 2008;30 : 623–627.
27. Johansson PI, Stensballe J, Rasmussen LS, Ostrowski SR. A high admission syndecan-1 level, a marker of endothelial glycocalyx degradation, is associated with inflammation, protein C depletion, fibrinolysis, and increased mortality in trauma patients. Ann Surg. 2011;254 : 194–200.
28. Bruegger D, Schwartz L, Chappell D, Jacob M, Rehm M, Vogeser M, et al. Release of atrial natriuretic peptide precedes shedding of the endothelial glycocalyx equally in patients undergoing on - and off-pump coronary artery bypass surgery. Basic Res Cardiol. 2011;106 : 1111–1121.
29. Chappell D, Bruegger D, Potzel J, Jacob M, Brettner F, Vogeser M, et al. Hypervolemia increases release of atrial natriuretic peptide and shedding of the endothelial glycocalyx. Crit Care. 2014;18 : 538.
30. Powell M, Mathru M, Brandon A, Patel R, Frölich M. Assessment of endothelial glycocalyx disruption in term parturients receiving a fluid bolus before spinal anesthesia: a prospective observational study. Int J Obstet Anesth. 2014;23 : 330–334.
31. Rehm M, Zahler S, Lötsch M, Welsch U, Conzen P, Jacob M, et al. Endothelial glycocalyx as an additional barrier determining extravasation of 6% hydroxyethyl starch or 5% albumin solutions in the coronary vascular bed. Anesthesiology. 2004;100 : 1211–1223.
32. Starling EH. On the Absorption of Fluids from the Connective Tissue Spaces. J Physiol. 1896;19 : 312–326.
33. Woodcock TE, Woodcock TM. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br J Anaesth. 2012;108 : 384–394.
34. James MFM, Michell WL, Joubert IA, Nicol AJ, Navsaria PH, Gillespie RS. Resuscitation with hydroxyethyl starch improves renal function and lactate clearance in penetrating trauma in a randomized controlled study: the FIRST trial (Fluids in Resuscitation of Severe Trauma). Br J Anaesth. Oxford University Press; 2011;107 : 693–702.
35. Guidet B, Martinet O, Boulain T, Philippart F, Poussel JF, Maizel J, et al. Assessment of hemodynamic efficacy and safety of 6% hydroxyethylstarch 130/0.4 vs. 0.9% NaCl fluid replacement in patients with severe sepsis: the CRYSTMAS study. Crit Care. 2012;16:R94.
36. Bruegger D, Jacob M, Rehm M, Loetsch M, Welsch U, Conzen P, et al. Atrial natriuretic peptide induces shedding of endothelial glycocalyx in coronary vascular bed of guinea pig hearts. Am J Physiol Heart Circ Physiol. 2005;289:H1993–1999.
37. Hooijmans CR, Rovers MM, de Vries RB, Leenaars M, Ritskes-Hoitinga M, Langendam MW. SYRCLE’s risk of bias tool for animal studies. BMC Med Res Methodol. 2014;14 : 43.
38. Naumann DN, Beaven A, Dretzke J, Hutchings S, Midwinter MJ. Searching For the Optimal Fluid to Restore Microcirculatory Flow Dynamics After Haemorrhagic Shock. SHOCK. 2016;46 : 609–622.
39. Pati S, Matijevic N, Doursout M-F, Ko T, Cao Y, Deng X, et al. Protective effects of fresh frozen plasma on vascular endothelial permeability, coagulation, and resuscitation after hemorrhagic shock are time dependent and diminish between days 0 and 5 after thaw. J Trauma. 2010;69 Suppl 1(Supplement):S55–63.
40. Kozar RA, Peng Z, Zhang R, Holcomb JB, Pati S, Park P, et al. Plasma restoration of endothelial glycocalyx in a rodent model of hemorrhagic shock. Anesth Analg. 2011; 112 : 1289–1295.
41. Peng Z, Pati S, Potter D, Brown R, Holcomb JB, Grill R, et al. Fresh Frozen Plasma Lessens Pulmonary Endothelial Inflammation and Hyperpermeability After Hemorrhagic Shock and Is Associated With Loss of Syndecan 1. Shock. 2013;40 : 195–202.
42. Baimukanova G, Miyazawa B, Potter DR, Muench MO, Bruhn R, Gibb SL, et al. Platelets regulate vascular endothelial stability: assessing the storage lesion and donor variability of apheresis platelets. Transfusion. 2016;56:S65–75.
43. Torres Filho IP, Torres LN, Salgado C, Dubick MA. Plasma syndecan-1 and heparan sulfate correlate with microvascular glycocalyx degradation in hemorrhaged rats after different resuscitation fluids. Am J Physiol Heart Circ Physiol. 2016;310:H1468–478.
44. Brettner F, von Dossow V, Chappell D. The endothelial glycocalyx and perioperative lung injury. Curr Opin Anaesthesiol. 2016;30 : 1.
45. Nussbaum C, Haberer A, Tiefenthaller A, Januszewska K, Chappell D, Brettner F, et al. Perturbation of the microvascular glycocalyx and perfusion in infants after cardiopulmonary bypass. J Thorac Cardiovasc Surg. 2015;150 : 1474–1481.
46. Puskarich MA, Cornelius DC, Tharp J, Nandi U, Jones AE. Plasma syndecan-1 levels identify a cohort of patients with severe sepsis at high risk for intubation after large-volume intravenous fluid resuscitation. J Crit Care. 2016;36 : 125–129.
47. Straat M, Müller MCA, Meijers JCM, Arbous MS, Spoelstra-de Man AME, Beurskens CJP, et al. Effect of transfusion of fresh frozen plasma on parameters of endothelial condition and inflammatory status in non-bleeding critically ill patients: a prospective substudy of a randomized trial. Crit Care. 2015;19 : 163.
48. Kim TK, Nam K, Cho YJ, Min JJ, Hong YJ, Park KU, et al. Microvascular reactivity and endothelial glycocalyx degradation when administering hydroxyethyl starch or crystalloid during off-pump coronary artery bypass graft surgery: a randomised trial. Anaesthesia. 2017;72 : 204–213.
49. Hoste EA, Maitland K, Brudney CS, Mehta R, Vincent J-L, Yates D, et al. Four phases of intravenous fluid therapy: a conceptual model. Br J Anaesth. 2014;113 : 740–747.
50. Moore JPR, Dyson A, Singer M, Fraser J. Microcirculatory dysfunction and resuscitation: why, when, and how. Hardman JG, editor. Br J Anaesth. 2015;115 : 366–375.
51. Tatara T. Context-sensitive fluid therapy in critical illness. J intensive care. 2016;4 : 20.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2017 Issue 5
-
All articles in this issue
-
Anestezie v Rakousko-Uhersku během I. světové války a po vzniku samostatného československého státu
Část II – Metody místní anestezie - Foetal anaesthesia and analgesia during intrauterine procedures: Review
- Neurotoxicity of anaesthetics on the developing brain
- The endothelial glycocalyx and fluid therapy in critical care and perioperative medicine
- Cognitive disorders in perioperative and intensive care
- Succesful use of methylene blue in a patient with refractory shock on veno-arterial extracorporeal membrane oxygenation
- Echocardiography in acute aortic syndromes
-
Anestezie v Rakousko-Uhersku během I. světové války a po vzniku samostatného československého státu
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Succesful use of methylene blue in a patient with refractory shock on veno-arterial extracorporeal membrane oxygenation
- Neurotoxicity of anaesthetics on the developing brain
- Cognitive disorders in perioperative and intensive care
- The endothelial glycocalyx and fluid therapy in critical care and perioperative medicine
