Specifika anestezie a intenzivní péče u pacientů s transplantovaným orgánem
Specifics of anaesthesia and intensive care in organ transplant patients
Solid organ transplantation is the only way to treat end-stage organ disease. Survival of the patients with a transplanted organ has improved significantly in the last decades. It has been mainly due to the careful selection of organ transplant candidates from the waiting lists, improved surgical techniques and advances in intensive care and immunosuppressive therapy. This has logically led to an increase in the number of these patients on the follow-up, treated in the emergency departments and admitted to hospitals and intensive care units. The anaesthetic and intensive care management of the transplant recipients is similar to standard practice but there are physiological and pharmacological specific aspects including the adverse effects of immunosuppression, the risk of infection and the risk of rejection which the anaesthetist and the intensivist should consider. One of the most common reasons for hospital admission of the transplanted patients is infection and sepsis, the most common cause of morbidity and mortality in these patients. The cornerstones in the treatment of sepsis are early pathogen identification, infection source control and supportive therapy including temporary withdrawal of the immunosuppressive therapy.
keywords
solid organ transplantation – immunosuppressive therapy – anaesthesia and intensive care, sepsis
:
E. Kieslichová
; E. Uchytilová; P. Píza; P. Vychodil
:
Klinika anesteziologie, resuscitace a intenzivní péče, Transplantcentrum, Institut klinické a experimentální medicíny
:
Anest. intenziv. Med., 29, 2018, č. 6, s. 328-337
:
Transplantace orgánů je standardní léčbou konečného selhání jejich funkce. Přežívání transplantovaných pacientů se v posledních letech významně zlepšuje zejména díky vývoji kritérií ve výběru příjemců orgánů, zdokonalení chirurgických technik spolu s novými postupy v anestezii a intenzivní péči a s pokroky v imunosupresivní terapii. Logickým důsledkem je nárůst počtu těchto pacientů sledovaných ambulantně, ošetřovaných na urgentních příjmech a přijímaných do nemocnic a na jednotky intenzivní péče. Zásady anestezie a intenzivní péče o transplantované pacienty jsou v souladu se standardní praxí, existuje ale mnoho specifických fyziologických a farmakologických aspektů, včetně nežádoucích účinků imunosuprese, rizika infekce a rejekce, které by měl anesteziolog a intenzivista při ošetřování těchto pacientů zvažovat. Jedním z nejčastějších důvodů hospitalizace transplantovaných je infekce a sepse, která patří k nejčastějším příčinám jejich morbidity a mortality. Nejdůležitějším faktorem při léčbě sepse je časná identifikace patogenu, kontrola zdroje infekce a podpůrná terapie včetně přechodné redukce imunosupresivní terapie.
klíčová slova
pacienti po transplantaci orgánů – imunosupresivní terapie – anestezie a intenzivní péče – sepse
ÚVOD
Transplantační medicína zaznamenává v posledních desetiletích značný rozvoj a transplantace orgánů (SOT ‒ solid organ transplantation) znamená záchranu života nebo zlepšení kvality života pacientů s nezvratným orgánovým selháním. Zlepšení péče o dárce orgánů, vývoj kritérií pro výběr pacientů zařazovaných k transplantaci, zdokonalení chirurgických technik spolu s novými postupy v anestezii a intenzivní péči a zejména pokroky v imunosupresivní terapii vedly během posledních let ke zlepšení přežívání příjemců transplantovaného orgánu [1, 2]. Počet těchto pacientů sledovaných ambulantně, ošetřovaných na urgentních příjmech a přijímaných do nemocnic a na jednotky intenzivní péče tak postupně narůstá [3‒6].
Za posledních 10 let (2007–2017) bylo v České republice provedeno celkem 7 657 orgánových transplantací (www.kst.cz), transplantace jsou prováděny celkem v sedmi transplantačních centrech (TC) (tab. 1). Orgány jsou transplantovány jednotlivě nebo v kombinacích, v některých případech podstupuje jeden pacient postupně několik transplantací. Přežívání transplantovaných se liší podle typu transplantovaného orgánů a závisí na předtransplantačním stavu pacienta a přítomnosti dalších komorbidit v okamžiku provedení transplantace [7‒12].
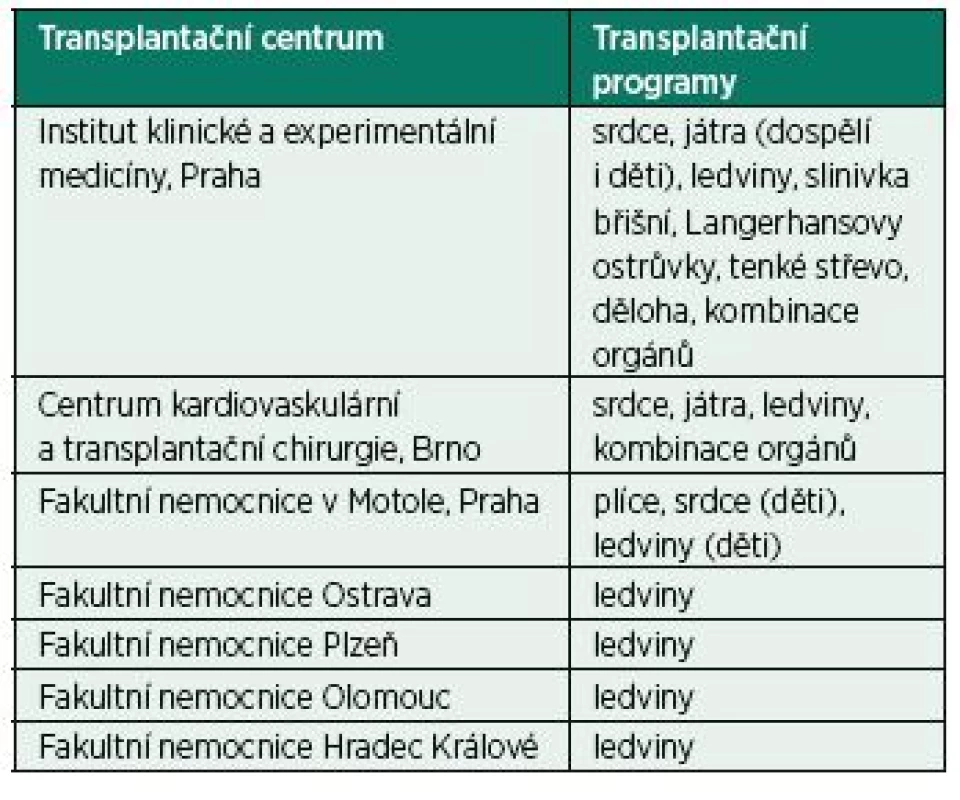
Pacienti po SOT jsou sledováni v TC a u příslušných ambulantních specialistů, kde podstupují pravidelná kontrolní vyšetření, ale anesteziologové a intenzivisté se s nimi mohou setkat ve své praxi i mimo TC. Je proto důležité vědět o zvláštnostech, které péče o tuto skupinu nemocných přináší. Je třeba získat především informaci o funkci transplantovaného orgánu, době od vlastní transplantace a o typu a intenzitě imunosupresivní terapie. Mnoho pacientů po SOT žije relativně normální a produktivní život, jejich fyzické rezervy ale často bývají omezené. I když úspěšná transplantace nahradila funkci selhávajícího orgánu, mohou přetrvávat některé patofyziologické abnormality související se základním onemocněním, jež vedlo k selhání daného orgánu, nebo chronické funkční abnormality vyplývající ze samotného selhání daného orgánu. Funkce štěpu se může v čase zhoršovat z důvodu chronické rejekce a vaskulopatie nebo selhat akutně v důsledku akutní rejekce [13] nebo poruchy cévního zásobení. Některé komplikace u pacientů po SOT souvisí s technickými aspekty transplantace a jsou typické pro určitý transplantovaný orgán [14, 15]. Imunosupresivní terapie je zásadní pro prevenci rejekce alograftu a pro ochranu jeho funkce, má ale řadu nežádoucích účinků.
IMUNOSUPRESIVNÍ TERAPIE A JEJÍ RIZIKA
Imunosupresivní režimy po SOT se dělí podle indikace a doby podávání na indukční, udržovací a antirejekční [16, 17]. V časném období po SOT, kdy je imunitní odpověď organismu na alogenní štěp nejsilnější, je indikována vysoce účinná kombinace imunosupresiv. Během transplantace je podáván bolus metylprednisolonu, eventuálně v kombinaci s antilymfocytární protilátkou (polyklonální: thymoglobulin, monoklonální: anti-CD25). Následuje udržovací terapie k profylaxi akutní rejekce, což je v praxi realizováno nejčastěji trojkombinací imunosupresiv (kortikoidy, inhibitory kalcineurinu nebo mTOR inhibitory a antimetabolity). V časovém odstupu od SOT jsou postupně dávky imunosupresiv snižovány, může se přejít na dvojkombinaci nebo monoterapii. Antirejekční terapie spočívá obvykle ve zvýšení dávky podávaných léků, pulzu kortikoidů nebo antilymfocytárních protilátek, případně v kombinaci s dalšími postupy (např. plazmaferéza, imunoglobuliny). Protokoly potransplantační imunosuprese vycházejí z rizika rejekce u konkrétního příjemce a z imunogenicity alograftu. Nezbytnou podmínkou terapie je monitorace účinnosti imunosupresiv a nežádoucích nebo toxických reakcí.
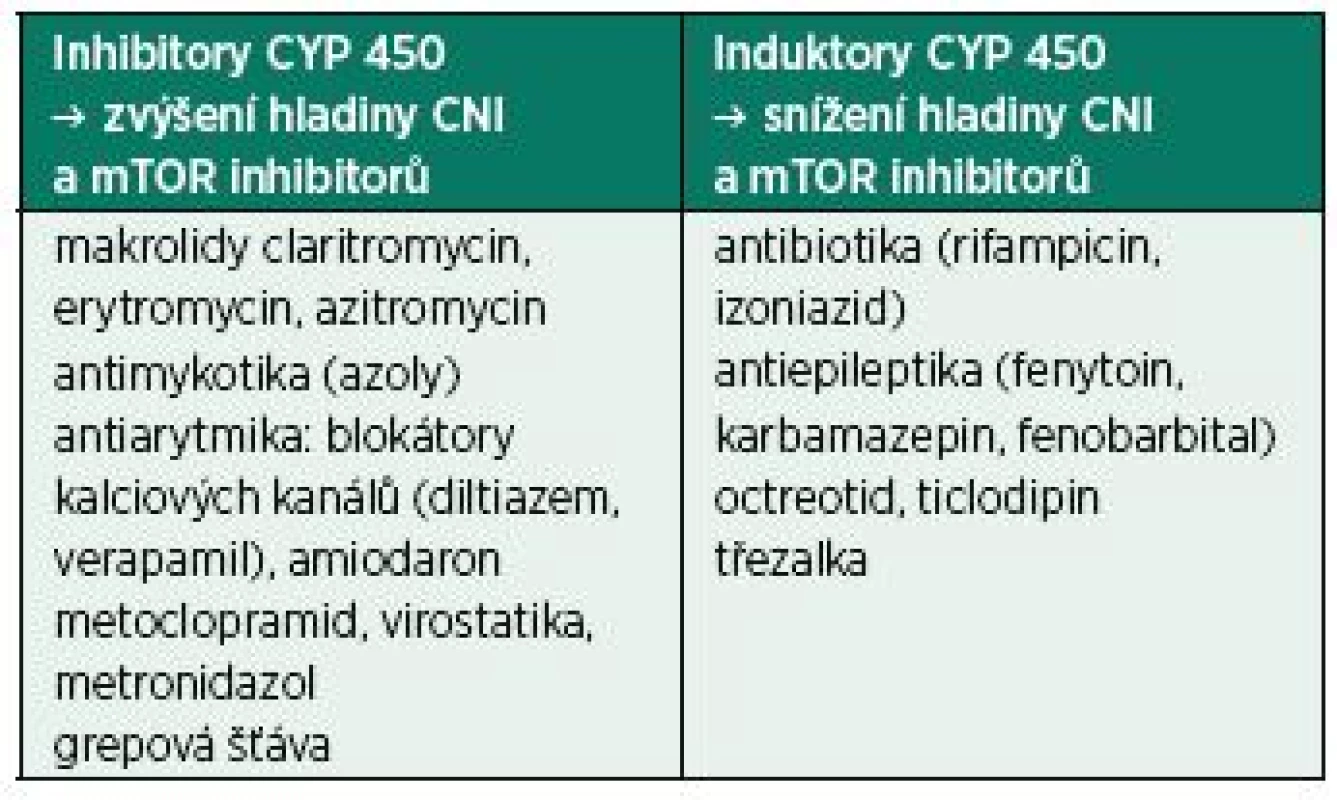
Protože pacienti po SOT užívají imunosupresiva doživotně, je zapotřebí znát jejich mechanismus působení a vedlejší účinky [18]. Např. inhibitory kalcineurinu (CNI ‒ calcineurin inhibitors), které jsou součástí většiny protokolů, mají úzký terapeutický index a řadu lékových interakcí vzhledem k jejich metabolizaci cestou cytochromu P450 (3A, 4A) spolu s transportními proteiny (P-glykoprotein) (tab. 2).
Kortikosteroidy jsou standardní součástí imunosupresivních protokolů po SOT a jsou terapií první volby při rejekci alogenního štěpu. Jejich imunosupresivní účinky jsou komplexní, vysoké dávky vedou k depresi buňkami zprostředkované imunity cestou inhibice některých cytokinů (IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8 a TNF) a k supresi tvorby protilátek; protilátková odpověď je tlumena stabilizací lyzozomálních membrán. Navíc dochází k útlumu fagocytární aktivity retikuloendotelových buněk. V posledním desetiletí řada transplantačních center podávání kortikosteroidů omezuje s cílem snížení jejich vedlejších účinků (hypertenze, katarakta, osteoporóza, vaskulární nekróza hlavice femuru, diabetes, dyslipidemie, cushingoidní projevy, vředová choroba, pankreatitida). Nízké dávky jsou dobře tolerovány.
Cytotoxické léky (antimetabolity) mají schopnost usmrtit buňky, které jsou schopny replikace. Působí na lymfocyty i na nelymfoidní proliferující buňky, jako jsou např. buňky sliznice gastrointestinálního traktu. V současnosti je nejčastěji užívaným antimetabolitem kyselina mykofenolová (mykofenolát mofetil, mykofenolát sodný), antimetabolit se selektivní inhibicí proliferace lymfocytů. Působí jako nekompetitivní reverzibilní inhibitor inosinmonofosfát dehydrogenázy, enzymu důležitého pro syntézu purinů. Tím dochází k blokádě tvorby guanosinových nukleotidů, nutných pro syntézu DNA. Protože lymfocyty nemají alternativní metabolickou cestu pro syntézu DNA, má tato blokáda specifický antiproliferační efekt. Vedlejšími účinky jsou leukopenie, anémie a gastrointestinální obtíže (průjem, zvracení, nauzea, afty, ulcerace v tlustém střevě). Pacienti užívající antimetabolity jsou ohroženi závažnými virovými (CMV ‒ cytomegalovis), fungálními i parazitárními infekcemi.
Inhibitory kalcineurinu (cyklosporin a takrolimus) jsou hlavní složku imunosupresivní terapie po SOT. Cyklosporin je cyklický undekapeptid, produkt houby Tolypocladium inflatum, takrolimus je makrolidové imunosupresivum izolované ze Streptomyces tsukubaensis. Vyznačují se selektivním působením na imunoregulační aktivitu pomocných T-lymfocytů bez ovlivnění supresorových T-lymfocytů, B-lymfocytů, granulocytů a makrofágů. Prostřednictvím blokády kalcineurinu, proteinu, který reguluje intracelulární přenos kalcia, dochází k inhibici syntézy IL-2. I když je mechanismus účinku cyklosporinu a takrolimu velmi podobný, takrolimus je několikanásobně silnější a má širší tlumivý účinek, což vede ke snížené produkci nejen IL-2, ale i IL-3, IL-4, IL-5, interferonu gama a dalších cytokinů. K vedlejším účinkům patří kardiovaskulární komplikace, hypertenze a hyperlipidemie, nefrotoxicita, neurotoxicita (takrolimus), nově vzniklý diabetes a gingivální hyperplazie a hirsutismus (cyklosporin).
Inhibitory mTOR (mammalian target of rapamycin) jsou alternativou CNI v udržovací imunosupresi, jedná se o inhibitory proliferačních signálů. Do této skupiny patří sirolimus a jeho derivát everolimus. Váží se na imunofiliny. Sirolimus (rapamycin) je makrolidové antibiotikum, které se v cytosolu váže ke svému příslušnému vazebnému proteinu mTOR, čímž inhibuje normální biochemické dráhy potřebné pro translaci mRNA, nezbytné pro dělení buněk. Oproti CNI, které snižují hladiny IL-2, mTOR inhibitory blokují transdukci cytokinového signálu pro aktivaci T a B buněk. Vedlejšími účinky jsou leukopenie, trombocytopenie a anémie, objevuje se hypercholesterolemie a hypertriglyceridemie. Antiproliferační působení inhibitorů mTOR způsobuje problémy s hojením ran. Sirolimus může navodit zánětlivou reakci s obrazem podobným atypické pneumonii.
Antilymfocytární protilátky se užívají k indukci nebo při terapii rejekce. Jedná se buď o depleční polyklonální protilátky proti T-lymfocytům (antithymocytární globulin), nebo o monoklonální protilátky (basiliximab: anti-CD25). Polyklonální protilátky mají oproti monoklonálním silnější a delší imunosupresivní efekt, ale i četnější vedlejší účinky (syndrom z uvolnění cytokinů, aktivace virových infekcí, vyšší riziko vzniku nádoru a infekční komplikace).
IMUNOSUPRESE U PACIENTŮ PO SOT PODSTUPUJÍCÍCH PLÁNOVANÝ NEBO URGENTNÍ VÝKON NEBO PŘIJATÝCH K HOSPITALIZACI
Imunosuprese je podávána v nastaveném režimu, obvykle v trojkombinaci nebo dvojkombinaci [19, 20]. Před plánovaným větším operačním výkonem je doporučováno vzhledem k problémům s hojením ran přerušit léčbu inhibitorem mTOR (zhruba na 5–10 dní) a nahradit ho mykofenolátem, CNI, eventuálně prednisonem (při předchozí terapii rapamycinem a mykofenolátem). Při příjmu k hospitalizaci je třeba ověřit místní dostupnost imunosupresiv a zajistit monitoraci hladin CNI (odběr ráno před podáním CNI). Cílem je udržení účinných hladin, kterých se dosáhne perorálním podáním, aplikací léku nazogastrickou sondou, ve výjimečných případech po konzultaci s příslušným specialistou TC je možné přejít přechodně na aplikaci intravenózní. Medikace se podává nalačno, minimálně hodinu před jídlem. Vzhledem k absenci přesvědčivých důkazů o prospěšnosti zvýšení dávky kortikoidů perioperačně není tento postup v praxi užíván. V případě sepse nebo septického šoku je nutno pomýšlet na redukci a vysazení imunosuprese, přičemž podle závažnosti stavu se na prvním místě redukují antimetabolity, poté i CNI, kortikoidy jsou jako udržovací imunosuprese během terapie sepse ponechány. Tyto situace je vhodné konzultovat s TC, v němž je pacient sledován.
SPECIFICKÉ ASPEKTY JEDNOTLIVÝCH ORGÁNOVÝCH TRANSPLANTACÍ
Srdce se transplantuje ortotopicky (OTS ‒ ortotopická transplantace srdce), biatriální nebo bikavální technikou, nejčastější indikací je dilatační kardiomyopatie a ischemická choroba srdeční [21]. Mezi vlastním a transplantovaným srdcem existuje několik důležitých fyziologických rozdílů, nevýznamnějším z nich je přerušení autonomní inervace srdečního štěpu (denervace), jejímž důsledkem je sinusová tachykardie, snížená tolerance zátěže a chybění bolesti při ischemii [22‒24]. Možnost reinervace není po měsících až letech od OTS vyloučena, ale nelze na ni spoléhat. Denervace eferentních vláken znamená ablaci klidového tonu parasympatiku, který je zodpovědný za udržení základní tepové frekvence, která je po OTS zvýšena na 90 až 100 tepů za minutu. Ztráta přímé inervace sympatikem znamená, že srdeční odpověď na fyziologické stresory (fyzická zátěž, hypovolemie, vazodilatace, bolest, lehká anestezie) je mediována cirkulujícími katecholaminy, a má tedy tendenci nastupovat pomaleji. Chybí převážně parasympatické odezvy (viscerální trakce, abdominální insuflace, okulokardiální reflex, vazovagální bradykardie, bradykardie vyvolaná hypertenzí, srdeční odpověď na masáž karotid, Valsalvovy manévry). Srdeční odpověď na endogenní katecholaminy a přímo působící látky je zachována (norepinefrin, epinefrin, isoprenalin, betablokátory), nepřímo působící katecholaminy jsou méně účinné (dopamin). Digoxin, atropin, nifedipin nemají předpokládané účinky na tepovou frekvenci, účinek efedrinu je snížen. Po OTS nebyla prokázána upregulace alfa - nebo betareceptorů ani denervační hypersenzitivita. Hemodynamicky významná bradykardie reaguje na isoprenalin a transkutánní stimulaci. Denervace aferentních vláken je u pacientů po OTS významná z hlediska chybění algických příznaků při ischemii, oslabení regulačních mechanismů systému renin-angiotenzin-aldosteron a vaskulární odezvy na změny plnicích tlaků.
Pro pacienty po OTS je typický mírný pokles komorové funkce (NYHA I), mírná až středně těžká diastolická dysfunkce, závislost na preloadu z hlediska udržení srdečního výdeje a nárůst klidového průtoku krve koronárními tepnami v důsledku ztráty adrenergního tonu. Je tedy nutné udržet konstantní předtížení, protože reakce na zátěž závisí na preloadu a reflexní mechanismy chybí [25].
Oproti tomu jsou metabolismus myokardu, kontraktilní rezerva a autoregulace průtoku krve koronárními tepnami normální a Frankův-Starlingův mechanismus je zachován. Časně po OTS se mohou vyskytnout abnormality na EKG. Pokud byla při operaci zachována část vlastní pravé síně pacienta, mohou se na EKG objevit dvě P vlny: jedna od vlastní síně (nevedená dále než k linii sutury) a další od dárcovského SA uzlu (vedená normálně z AV uzlu). Během prvních několika týdnů po transplantaci je častá komorová ektopie, která ale obvykle zeslábne. Po transplantaci jsou často přítomné supraventrikulární dysrytmie (síňové předčasné stahy, atriální fibrilace a atriální flutter), které často souvisejí s epizodami akutní rejekce. Nově vzniklá supraventrikulární dysrytmie by tedy měla být vždy považována za možný příznak rejekce. Častá je atrioventrikulární blokáda prvního stupně, stejně jako neúplná nebo úplná blokáda pravého Tawarova raménka. Významné bradyarytmie vyžadují zavedení kardiostimulátoru.
Rejekce se vyskytují obvykle v prvních šesti měsících po OTS. Akutní rejekce má obvykle nespecifické příznaky (únava, letargie, nauzea, horečka, anorexie, hypotenze, periferní edém, dyspnoe, zvýšený tlak v jugulárních žilách, pokles systolické funkce, zhoršení diastolické dysfunkce, perikardiální výpotek a nový nástup ventrikulárních nebo supraventrikulárních dysrytmií). V této době je frekventně prováděn screening v TC formou endomyokardiální biopsie, v dalším průběhu po stabilizaci stavu je pacient vyšetřován standardně jednou ročně. Koronární nemoc štěpu je kombinací chronické rejekce a akcelerované aterosklerózy, je jednou z hlavních pozdních příčin úmrtí po OTS.
Plíce se transplantují ortotopicky, jedná se o unilaterální nebo bilaterální sekvenční transplantaci, většinou za použití anastomóz bronchů hlavního kmene [8]. Od původní techniky „double-lung“ s tracheální anastomózou se ustoupilo pro významnou pooperační morbiditu. Další možností je transplantace pouze plicních laloků u menších příjemců. Hlavní indikací transplantace je chronická obstrukční plicní nemoc, cystická fibróza, dále pak zejména idiopatická plicní fibróza, onemocnění s deficitem alfa-1 antitrypsinu a plicní arteriální hypertenze [26].
Při transplantaci dochází k denervaci plíce, což vede ke ztrátě kašlacího reflexu distálně od bronchiální anastomózy se zvýšeným rizikem aspirace a infekce [27]. Není prokázána klinicky významná změna bronchomotorického tonu ani nárůst výskytu hyperreaktivity dýchacích cest. Denervace nemá zásadní vliv na dechovou frekvenci a dechový objem a pravděpodobně neovlivňuje ani hypoxickou plicní vazokonstrikci. Hodnoty funkčního vyšetření plic se zlepšují v průběhu devíti měsíců od transplantace, mírný pokles difuzní kapacity oxidu uhličitého přetrvává.
Perfuze plic při bilaterální transplantaci je normální, při unilaterální je v transplantovaném orgánu zvýšena oproti plíci netransplantované (60–70 %). Při transplantaci dochází k přerušení bronchiální cirkulace, což může ovlivňovat hojení anastomózy. Problémem je významně snížená mukociliární clearance v transplantované plíci, což spolu se ztrátou kašlacího reflexu a případnými stenózami v anastomózách znamená vysoké riziko tvorby hlenové zátky a infekce. Účinek bronchodilatancií se zásadně nemění.
Po transplantaci plic je narušena lymfatická drenáž a vaskulární permeabilita. Kvůli vysoké pohotovosti pro vznik edému plic je nezbytná pečlivá titrace tekutin s vyvarováním se jejich excesivního přívodu.
U příjemců plic jsou časté epizody akutní rejekce, většinou během prvních tří měsíců od transplantace. Časté jsou rovněž infekce, jejichž obraz může být rejekci velmi podobný. K příznakům rejekce patří kašel, horečka, malátnost, dušnost, hypoxie, sípání, nárůst teploty, přítomnost infiltrátů na rentgenu hrudníku. Odlišit rejekci od infekce je poměrně obtížné a často je to možné pouze pomocí bronchoskopie, broncho-alveolární laváže, kultivace a biopsie plic. Zásadním omezením dlouhodobého přežívání je chronická rejekce štěpu, která se projevuje jako obliterující bronchiolitida.
Játra se transplantují ortotopicky celá nebo jejich část ve formě redukovaného štěpu (část štěpu pro jednoho příjemce) nebo parciálního štěpu (jeden orgán pro dva různé příjemce). Hlavní indikací k transplantaci je cirhóza, metabolická onemocnění, vaskulární onemocnění, tumory a akutní selhání jater z různých příčin, nejčastěji z důvodu lékové toxicity a virových hepatitid [10, 28]. Pro pacienty s cirhózou je typická portální hypertenze, časté je krvácení z gastrointestinálního traktu, k obvyklým nálezům patří encefalopatie, ascites, cirhotická kardiomyopatie, plicní syndromy (hepatopulmonální syndrom, portopulmonální hypertenze), porucha funkce ledvin, koagulopatie, malnutrice a opakované infekce. Akutní selhání jater a akutní selhání nasedající na chronické je provázeno multiorgánovou dysfunkcí. Po úspěšné transplantaci začínají játra fungovat časně po výkonu, současně dochází k ústupu příznaků jaterního selhání. U pacientů s hepatopulmonálním syndromem a portopulmonální hypertenzí před transplantací může nějakou dobu po výkonu přetrvávat reziduální hypoxemie vyžadující oxygenoterapii nebo perzistentní plicní hypertenze s nutností užívání plicních vazodilatancií (sildenafil, epoprostenol). I kompenzovaná léčená plicní hypertenze se může zhoršit v kritických stavech v důsledku hypoxemie, hyperkapnie nebo acidózy. Hlavními komplikacemi po transplantaci jater jsou krvácení, infekce, rejekce, porucha žlučové drenáže a rekurence základního onemocnění [29, 30]. Závažný problém představují trombotické komplikace a porucha prokrvení štěpu. Trombóza jaterní tepny je nejčastější cévní komplikací po transplantaci jater a nejčastější komplikací, která vyžaduje retransplantaci. Velmi častá je u dětských příjemců jater. Časný uzávěr do čtyř týdnů po transplantaci může vést k akutnímu selhání jater. Je-li uzávěr subakutní, vytvoří se kolaterální oběh; nedochází sice k nekrózám hepatocytů, ale ischemie vede k poškození žlučovodů s rozvojem cholangitidy a tvorbou abscesů ve štěpu. U některých pacientů je trombóza jaterní tepny asymptomatická, přetrvává ale riziko pozdních biliárních komplikací. Poškození ledvin z předtransplantačního období po úspěšné transplantaci ustoupí, jedná-li se o funkční poruchu (hepatorenální syndrom), může ale i přetrvávat, progredovat nebo se vyvinout de novo jako následek potransplantačních komplikací nebo nefrotoxicity CNI.
Transplantace ledviny je nejčastěji prováděnou orgánovou transplantací, provádí se heterotopicky extraperitoneálně do pravé nebo levé jámy kyčelní, výjimečně s uložením orgánu do dutiny břišní, může se provést i duální transplantace [31]. Ledvina pochází od zemřelého nebo od žijícího dárce. Výkon se často kombinuje s jiným typem transplantace, většinou s transplantací pankreatu nebo jater. Transplantace ledviny je buď preemptivní, tedy v období chronického onemocnění ledvin, kdy je dialyzační léčba očekávaná, ale zatím nerealizovaná, nebo v době, kdy je již pacient chronicky dialyzován. Preemptivní transplantace eliminují negativní důsledky dialyzační léčby a jsou spojeny s delším přežíváním štěpů i pacientů [32]. Chronické selhání ledvin je spojeno s řadou komplikací, které přetrvávají i po transplantaci. Jsou to především kardiovaskulární onemocnění, hematologické abnormality (trombofilní stavy, anémie), poruchy minerálového a kostního metabolismu, obezita, chronická onemocnění trávicího traktu, malnutrice při nízkobílkovinné dietě, hyperlipidemie, periferní neuropatie, dysfunkce centrálního nervového systému a endokrinní dysfunkce [33, 34]. Hladina kreatininu v séru je u dobře fungujícího renálního alograftu v mezích normy, glomerulární filtrace ale může být snížena a léky vylučované ledvinami, zejména léky s aktivními metabolity, by se měly podávat uvážlivě. Potenciálně nefrotoxické léky a jejich kombinace by neměly být užívány vůbec. Transplantovaná ledvina je velmi citlivá k ischemii, je důležité udržovat normovolemii a zabránit hypotenzi. Není vhodné podávat diuretika bez pečlivého posouzení situace intravaskulárního objemu pacienta. Při péči o tyto pacienty je třeba počítat s vysokým rizikem kardiovaskulárních komplikací [35].
Transplantace pankreatu je zatím jediným způsobem léčby diabetu 1. typu, který může zajistit dlouhodobou normoglykemii bez potřeby zevního inzulinu [11, 36]. Většina příjemců trpí diabetem řadu let a jsou u nich vyvinuty četné komplikace diabetu. Štěp pankreatu se ukládá intraperitoneálně nebo extraperitoneálně s drenáží pankreatického vývodu do duodena, dřívější technika vývodu do močového měchýře byla opuštěna pro infekční a metabolické komplikace (ztráty bikarbonátů). Provádí se buď jako současná transplantace pankreatu a ledviny, transplantace pankreatu u pacienta, který v minulosti obdržel alograft ledviny, nebo samotná transplantace pankreatu u pacienta se zachovanou renální funkcí. Kromě toho mohou být transplantovány izolované ostrůvky pankreatu, a to především u syndromu porušeného vnímání hypoglykemie s častými hypoglykemickými epizodami, u kterého konzervativní snahy o zlepšení selhaly [37]. Izolované ostrůvky se implantují cestou portální žíly do jaterního řečiště, obvykle perkutánně pod rentgenovou kontrolou, eventuálně při laparotomii katétrem zavedeným přes některou z mezenterických žil přímo do portální žíly. Transplantace pankreatu téměř okamžitě navozuje normalizaci glykemií u většiny příjemců, po ostrůvkové transplantaci jsou obvykle nutné doplňkové dávky inzulinu. Ke komplikacím spojeným s transplantací patří zejména chirurgické komplikace, infekce, pankreatitida ve štěpu, trombotické komplikace a rejekce štěpu [38]. Po úspěšné transplantaci se zpravidla zpomaluje progrese mikrovaskulárních komplikací, zlepšuje se somatická neuropatie, zlepšují se příznaky autonomní neuropatie, stabilizuje se retinopatie a může dojít i k její regresi. Nevyvíjí se de novo nefropatie štěpu ledviny. Trvá ale riziko makroangiopatických komplikací (tj. povšechné aterosklerózy, včetně například cerebrovaskulárního řečiště) a syndromu diabetické nohy, přetrvává syndrom ztuhlých kloubů při diabetu, gastropatie a gastroparéza [39] s rizikem obtížné intubace a aspirace. U příjemců pankreatu je vyšší riziko onemocnění koronárních tepen, které často bývá tiché nebo asymptomatické. U pacientů se selhávajícím nebo špatně fungujícím štěpem pankreatu je nutná pečlivá monitorace glykemie. U pacientů s drenáží exokrinního pankreatu do močového měchýře existuje riziko těžké metabolické acidózy v důsledku ztrát bikarbonátů, je proto nutná monitorace acidobazické rovnováhy.
Transplantace střeva a multiviscerální transplantace se provádějí jen v omezeném počtu několika desítek center na světě, nejlepších výsledků dosahují centra v USA, zejména transplantační centrum v Pittsburghu [40, 41]. V České republice byla první úspěšná multiviscerální transplantace provedena v IKEM v roce 2014, příjemcem orgánů (žaludek, slinivka, slezina, játra a tenké střevo) byl 60letý pacient s cirhózou autoimunní etiologie a viscerální trombózou [42]. K polovině roku 2018 jsou v České republice čtyři žijící příjemci multiviscerální transplantace. Potenciální příjemci jsou polymorbidní, s orgánovými dysfunkcemi, závislí na parenterální výživě, často po předchozích břišních operacích, před transplantací podstupující opakované hospitalizace. Bývají kolonizováni rezistentními nemocničními kmeny bakterií. Často trpí chronickou bolestí, jsou zatíženi dlouhodobou terapií analgetiky s možným rozvojem tolerance. Vlastní výkon je technicky velmi náročný, zatížený četnými komplikacemi. Transplantovaná střeva vyvolávají významnou aloimunitní odpověď, častá je rejekce, vyskytuje se nemoc štěpu proti hostiteli, významně zvýšené je riziko infekcí a technických komplikací vyplývajících z náročného výkonu. Vzhledem k malému počtu pacientů a nutnosti vysoce specifické péče je jen malá pravděpodobnost hospitalizace pacienta mimo TC.
OBECNÉ POZNÁMKY K ANESTEZII A INTENZIVNÍ PÉČI U PACIENTŮ PO TRANSPLANTACI ORGÁNŮ
Základní východiska a postupy anestezie a intenzivní péče jsou ve shodě s obecnými doporučenými postupy, je však třeba zvažovat specifika jednotlivých transplantací a důsledky imunosupresivní terapie.
K základním informacím, které je třeba v rámci předanestetického vyšetření získat, patří funkce transplantovaného orgánu, úroveň imunosuprese a přítomnost komorbidit. Pacienti po SOT užívají často kromě imunosuprese řadu jiných farmak, před nasazením další terapie je tedy nutná kontrola lékových interakcí [15, 19, 43].
Podle klasifikace ASA jsou tito pacienti v rámci předoperačního hodnocení řazeni do skupiny ASA IV (Věstník MZ 1/2018), od toho se odvíjí i doporučený rozsah předoperačních vyšetření. Antibiotická profylaxe při operačním výkonu se podává standardně podle doporučení ústavního mikrobiologa s přihlédnutím k případné kolonizaci nemocničními kmeny bakterií v důsledku předchozích hospitalizací. Rozsah intraoperační monitorace záleží na typu výkonu a stavu pacienta. Je možné bezpečně užít všechny typy anestezie. U pacientů po transplantaci ledviny a pankreatu s diabetem v anamnéze přetrvává gastropatie a neuropatie, je možno očekávat obtížnou intubaci; gastroparéza v rámci autonomní neuropatie zvyšuje riziko aspirace žaludečního obsahu při úvodu do anestezie i přes dostatečně dlouhé předoperační lačnění. Extubace po výkonu u pacientů po SOT by měla být časná, u pacientů po transplantaci plic by měla být provedena pouze u bdělého pacienta schopného odkašlat.
Je vhodné užívat anestetika s krátkým poločasem s nižším podílem orgánové metabolizace a s ohledem na případnou renální nebo jaterní dysfunkci a monitorovat úroveň svalové relaxace. Je nutno počítat s kardiovaskulárními komplikacemi.
Transplantované orgány jsou velmi citlivé na hypoxii, je třeba obzvlášť pečlivě dbát na jejich dostatečnou perfuzi, zabránit hypovolemii i hypervolemii, kontrolovat hladinu hemoglobinu a zabezpečit dostatečnou oxygenaci. U diabetiků je třeba vyvarovat se otlakům a proleženinám, které mohou vzniknout velmi rychle, a podkládat dolní končetiny, zejména při delších operačních výkonech.
Transplantovaní mívají v anamnéze opakované kanylace centrálního žilního systému, měli nebo mají zaveden dialyzační katétr nebo permanentní žilní vstup, mohou být přítomny částečné nebo úplné uzávěry velkých žil. Je proto zapotřebí se o průchodnosti žilního systému před případnou plánovanou kanylací přesvědčit a provádět výkon nejlépe pod kontrolou ultrazvukem. U pacientů v minulosti nebo současnosti dialyzovaných je třeba kontrolovat arteriovenózní zkrat a zabránit jeho poranění a poškození útlakem. U pacientů po OTS by měl být šetřen přístup cestou pravé jugulární žíly, který je přednostně využíván pro kontrolní endomyokardiální biopsii.
V intenzivní péči je kromě standardních opatření nutná kontrola funkce štěpu biochemickými markery, eventuálně sonografické vyšetření štěpu a jeho okolí a kontrola úrovně imunosuprese (hladiny CNI). Je třeba vyhnout se nefrotoxické medikaci, omezit podávání aminoglykosidů, nesteroidních antiflogistik a diuretik a počítat s lékovými interakcemi imunosupresiv. Je-li indikováno podání transfuzních přípravků, mělo by se jednat o přípravky deleukotizované.
Samozřejmostí je analgezie, adekvátní výživa, profylaxe stresových vředů a antitrombotická profylaxe. Při náhlém zhoršení stavu pacienta a dysfunkci štěpu je nutno pomýšlet na infekci a rejekci.
INFEKČNÍ KOMPLIKACE U PACIENTŮ PO SOT
Pacienti po SOT mají vysoké riziko infekčních komplikací, které jsou determinovány celkovým stavem imunosuprese, epidemiologickou expozicí a důsledky prováděných invazivních procedur [44, 45] (tab. 3). Při transplantaci mají pacienti rutinní perioperační antimikrobiální profylaxi podle typu transplantace, dlouhodobou tříměsíční až celoživotní profylaxi trimetoprimem-sulfametoxazolem (Pneumocystis jirovecii, Toxoplasma gondii, Cyclospora cayetanensis, Listeria sp., Nocardia sp., běžné močové a respirační patogeny) a profylaxi perorálními antivirotiky, ganciklovirem, valganciklovirem či valaciklovirem (CMV, herpes viry). Zavedením potransplantační profylaxe trimetoprimem-sulfometoxazolem poklesla významně incidence pneumocystové pneumonie, došlo i ke značnému poklesu infekce močových cest po transplantaci ledviny.
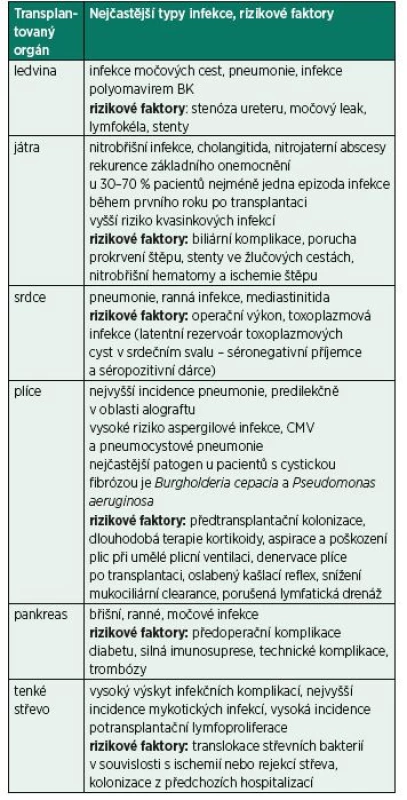
Riziko infekce po SOT se v potransplantačním průběhu mění v čase, zejména vzhledem k modifikacím imunosuprese. Z hlediska rizika infekce lze rozlišit tři časové intervaly, přičemž k většině infekcí dochází v prvních šesti měsících po výkonu. V časném pooperačním období převládají infekce bakteriální související s vlastním výkonem, předchozí hospitalizací nebo infekcí přenesenou od dárce. Pro období od 2. do 6. měsíce jsou typické infekce způsobené imunomodulujícími viry a infekce způsobené oportunními patogeny. Některé infekce (cholangitida, pneumonie, kolitida způsobená Clostridium difficile) přetrvávají z perioperačního období. Virové infekce mohou způsobit primární onemocnění (tkáňově invazivní) nebo se mohou projevit nepřímo, což představuje imunologickou reakci predisponující ke vzniku nebo zhoršenému průběhu dalších oportunních infekcí nebo potransplantačnímu lymfoproliferačnímu onemocnění v souvislosti s EBV (virus Epsteina a Barrové) a zvýšenému riziku akutního nebo chronického poškození štěpu nebo jeho rejekci.
Riziko infekce klesá po šesti měsících po transplantaci, kdy je u příjemců s uspokojivou funkcí alogenního štěpu obvykle postupně snižována imunosupresivní léčba. Většina příjemců má dobrou funkci alogenního štěpu a minimální imunosupresi. Vyskytují se u nich převážně komunitní infekce. Menší část příjemců má chronickou virovou infekci, která může vést k různým typům poškození alogenního štěpu (např. cirhóza z infekce virem hepatitidy typu C u příjemců jaterního transplantátu, bronchiolitis obliterans u příjemců plicního transplantátu, akcelerovaná vaskulopatie u příjemců srdce s CMV infekcí) nebo k vývoji malignity či potransplantační lymfoproliferace. Část příjemců s relativně špatnou funkcí štěpu s opakovanými rejekčními epizodami a silnou imunosupresí je z hlediska oportunních infekcí nejrizikovější.
Diagnostika infekce u transplantovaných je obtížná, protože imunosuprese oslabuje příznaky zánětu [46, 47]. Klinický obraz sepse transplantovaných pacientů je velmi proměnlivý, nemusí odpovídat závažnosti stavu, často se jedná o příznaky nespecifické. Může se projevit např. jen zvýšenou teplotou nebo obluzeností pacienta, případně vznikem arytmie nebo náhlou intolerancí dialýzy. Akutně vzniklá orgánová dysfunkce může souviset nejen se sepsí, ale stejně tak i s rekurencí základního onemocnění nebo rejekcí alograftu. Neexistuje jednoznačný diagnostický algoritmus sepse u transplantovaných, je však velmi důležité na tuto možnost pomýšlet a v případě zhoršení stavu pacienta zvážit v diferenciální diagnostice v první řadě možnost sepse [48, 49]. Hodnoty laboratorních markerů zánětu jsou zkresleny, je třeba hodnotit je v trendu a v souvislosti se změnou klinického stavu. Principy terapie sepse u imunokompromitovaných jsou v souladu s aktuálními obecně platnými doporučeními. V případě život ohrožující infekce je nutno zvažovat přechodnou redukci, eventuálně vysazení imunosupresivní terapie na nezbytně nutnou dobu za pečlivé monitorace funkce štěpu. Toto opatření není podloženo vědeckými studiemi, ale vychází z klinických zkušeností lékařů TC.
ZÁVĚR
Pacienti s transplantovaným orgánem budou stále častěji vyžadovat anestezii a intenzivní péči mimo TC. U těchto pacientů je vždy zapotřebí zhodnotit aktuální funkci transplantovaného orgánu, úroveň imunosupresivní terapie a přítomnost komorbidit. Potransplantační imunosuprese je nutná k prevenci rejekce transplantovaného orgánu, je ale zatížena řadou komplikací, s nimiž je nutno počítat. Každý typ transplantace má svá specifika vycházející z techniky výkonu a přidružených komorbidit. Pro všechny transplantované je velkým rizikem infekce a sepse, na něž je nutno pomýšlet při jakémkoliv zhoršení stavu pacienta.
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Financování: Podpořeno MZ ČR – RVO (Institut klinické a experimentální medicíny – IKEM, IČ 00023001)
Do redakce došlo dne 27. 9. 2018.
Do tisku přijato dne 1. 11. 2018.
Adresa pro korespondenci:
doc. MUDr. Eva Kieslichová, Ph.D.
Sources
1. Bloom RD, Goldberg LR, Wang AY, et al. An overview of solid organ transplantation. Clin Chest Med. 2005;26 : 529–543.
2. Rana A, Gruessner A, Agopian VG, et al. Survival benefit of solid-organ transplant in the United States. JAMA Surg. 2015;150 : 252–259.
3. Okidi OO, Van Dellen D, Sobajo C, et al. Kidney transplant recipients requiring critical care admission within one year of transplant. Exp Clin Transplant. 2017;15 : 40–46.
4. Li AH, Lam NN, Naylor KL, et al. Early hospital readmissions after transplantation: burden, causes, and consequences. Transplantation. 2016;100 : 713–728.
5. McElroy LM, Schmidt KA, Richards CT, et al. Early postoperative emergency department care of abdominal transplant recipients. Transplantation. 2015;99 : 1652–1657.
6. Yataco M, Cowell A, David W, et al. Predictors and impacts of hospital readmissions following liver transplantation. Ann Hepatol. 2016;15 : 356–362.
7. Kuman M. Transplantace solidních orgánů v České republice. Vnitř Lék. 2015;61 : 741–746.
8. Lischke R., Šimonek J., Pozniak J., et al. Transplantace plic. Rozhl Chir. 2011;90 : 612–620.
9. Viklicky O, Fronek J, Trunecka P, et al. Organ transplantation in the Czech Republic. Transplantation. 2017;101 : 2259–2261.
10. Trunecka P, Gerlei Z, Lisik W, et al. Liver transplantation in Central Europe. Clin Exp Hepatol. 2016;2 : 21–26.
11. Girman P, Saudek F. The IKEM Pancreas and islet transplant program as part of healthcare for type 1 diabetes patients: Retrospective analysis of outcome from 1983 to 2010. Rev Diabet Stud. 2011;8 : 35–43.
12. Hošková L, Málek I, Melenovský V, et al. 30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze. Vnitř Lék. 2014;60 : 275–281.
13. Benzimra M, Calligaro GL, Glanville AR. Acute rejection. J Thorac Dis. 2017;9 : 5440–5457.
14. Tran S. Anesthetic considerations for patients post-organ transplantation. Semin Anesth Periop Med Pain. 2003;22 : 119–124.
15. Hammel L, Sebranek J, Hevesi Z. The anesthetic management of adult patients with organ transplants undergoing nontransplant surgery. Adv Anesth. 2010;28 : 211–244.
16. Cajanding R. Immunosuppression following organ transplantation. Part 1: mechanisms and immunosuppressive agents. Br J Nurs. 2018;27 : 920–927.
17. Holt CD. Overview of Immunosuppressive therapy in solid organ transplantation. Review. Anesthesiol Clin. 2017;35 : 365–380.
18. Reske AP, Reske AW, Metze M. Complications of immunosuppressive agents therapy in transplant patients. Minerva Anestesiol. 2015;81 : 1244–1261.
19. Lin S, Cosgrove C. Perioperative management of immunosuppression. Surg Clin North Am. 2006;86 : 1167–1183.
20. Littlewood K. The immunocompromised adult and surgery. Best Pract Res Clin Anaesthesiol. 2008;22 : 585–609.
21. Gass AL, Emaminia A, Lanier G. Cardiac transplantation in the new era. Cardiol Rev. 2015;23 : 182–188.
22. Jurgens PT, Aquilante CL, Page RL 2nd, Ambardekar AV. Perioperative Management of cardiac transplant recipients undergoing noncardiac surgery: Unique challenges created by advancements in care. Semin Cardiothorac Vasc Anesth. 2017;21 : 235–244.
23. Csete M, Glas K. Anesthesia for organ transplantation. In: Barash P, Cullen B, Stoelting R. Clinical anesthesia. Philadelphia: Lippincott Williams & Wilkins; 2006 : 1358–1376.
24. Blasco L, Parameshwar J, Vuylsteke A. Anaesthesia for noncardiac surgery in the heart transplant recipient. Curr Opin Anaesthesiol. 2009;22 : 109–113.
25. Málek I. Péče o nemocné po transplantaci srdce. Interv Akut Kardiol. 2006;5 : 116–121.
26. Studer SM, Levy RD, McNeil K, Orens JB. Lung transplant outcomes: a review of survival, graft function, physiology, health-related quality of life and cost-effectiveness. Eur Respir J. 2004;24 : 674–685.
27. Feltracco P, Falasco G, Barbieri S, et al. Anesthetic considerations for nontransplant procedures in lung transplant patients. J Clin Anesth. 2011;23 : 508–516.
28. European Association for the study of the liver. EASL Clinical Practice Guidelines: Liver transplantation. J Hepatol. 2015;64 : 433–485.
29. Charlton MR. Improving long-term outcomes after liver transplantation. Clin Liver Dis. 2014;18 : 717–730.
30. Lim KB, Schiano TD. Long-term outcome after liver transplantation. Mt Sinai J Med. 2012;79 : 169–189.
31. Viklický O, Tesař V, Dusilová-Sulková S, et al. Transplantace ledviny. In: Doporučené postupy a algoritmy v nefrologii. 1. vyd. Praha: Grada, 2010.
32. Viklický O, Dusilová-Sulková S, Rychlík I, Tesař V. Predialýza. 1. vyd. Praha: Maxdorf, 2013.
33. Keegan M, Plevak D. The transplant recipient for nontransplant surgery. Anesthesiol Clin North America. 2004;22 : 827–861.
34. Bover J, Bailone L, López-Báez V, et al. Osteoporosis, bone mineral density and CKD-MBD: treatment considerations. J Nephrol. 2017;30 : 677–687.
35. Stoumpos S, Jardine AG, Mark PB. Cardiovascular morbidity and mortality after kidney transplantation. Transpl Int. 2015;28 : 10–21.
36. Stites E, Kennealey P, Wiseman AC. Current status of pancreas transplantation. Curr Opin Nephrol Hypertens. 2016;25 : 563–569.
37. Shapiro AM, Pokrywczynska M, Ricordi C. Clinical pancreatic islet transplantation. Nat Rev Endocrinol. 2017;13 : 268–277.
38. Knight S, Vogel T, Friend P. Pancreas Transplantation. Surgery. 2014;32 : 383–388.
39. Stevanovic K, Sabljak V, Toskovic A, et al. Anaesthesia and the patient with diabetes. Diabetes Metab Syndr. 2015;9 : 177–179.
40. Grant D, Abu–Elmagd K, Mazariegos G, et al. Intestinal Transplant Registry Report: Global activity and trends. Am J Transplant. 2015;15 : 210–219.
41. Bharadwaj S, Tandon P, Gohel TD, et al. Current status of intestinal and multivisceral transplantation. Gastroenterol Rep. 2017;5 : 20–28.
42. Oliverius M, Janoušek L, Kudla M, et al. Transplantace tenkého střeva v České republice. Čas Lék Česk. 2017;156 : 349–354.
43. Herborn J, Parulkar S. Anesthetic Considerations in Transplant Recipients for nontransplant Surgery. Anesthesiol Clin. 2017;35 : 539–553.
44. Haspot F, Halary FA. Infectious Diseases in Transplantation Report of the 20th Nantes Actualités Transplantation Meeting. Transplantation. 2015;99 : 2444–2447.
45. Bafi AT, Tomotani DYV, Freitas DGR. Sepsis in solid organ transplant recipient. Schock. 2017;47 : 12–17.
46. Kalil AC, Dakroub H, Freifeld AG. Sepsis and solid organ transplantation. Curr Drug Targ. 2007;8 : 533–541.
47. Kieslichová E. Sepsis in the immunocompromised patient. In: Sepsis. 1. vyd. Dover: SM Group, 2016 : 1–13.
48. Florescu DF, Sandkovsky U, Kalil AC. Sepsis and Challenging Infections in the Immunosuppressed Patient in the Intensive Care Unit. Infect Dis Clin North Am. 2017;31 : 415–434.
49. Linden PK (2009) Approach to the immunocompromised host with infection in the intensive care unit. Infect Dis N AM. 2009;23 : 535–556.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2018 Issue 6
-
All articles in this issue
- ERAS in a Czech hospital – Utopia or Reality?
- Administration of 500 ml of normal saline does not result in immediate damage to the endothelial glycocalyx determinable by sublingual microcirculation assessment
- Specifics of anaesthesia and intensive care in organ transplant patients
- Emergency medicine ultrasound curriculum for emergency medicine physicians
- Hypothermia in the operating theatre in paediatric patients: A prospective, monocentric, observational study
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- ERAS in a Czech hospital – Utopia or Reality?
- Specifics of anaesthesia and intensive care in organ transplant patients
- Emergency medicine ultrasound curriculum for emergency medicine physicians
- Administration of 500 ml of normal saline does not result in immediate damage to the endothelial glycocalyx determinable by sublingual microcirculation assessment
