Vyšetření mozkomíšního moku v diagnostice subarachnoidálního krvácení
Cerebrospinal fluid analysis in the diagnosis of subarachnoid hemorrhage
Subarachnoid hemorrhage (SAH) is a serious, life-threatening cause of morbidity and mortality in the world. Despite the progression in imaging and laboratory methods remain a significant percentage of patients with SAH misdiagnosed. Virtual unenhanced CT of the brain is the investigation of choice for establishing presence of SAH. Cerebrospinal fluid (CSF) spectrophotometry is recommended in CT negative patients, when clinical suspicion remains high. The specimen for spectrophotometry has certain requirements for the collection, handling and transport to the laboratory, however, can be a valuable diagnostic tool. According to recent recommendations is appropriate to interpret the result using serum protein, serum bilirubin and CSF protein levels. In addition to CSF spectrophotometric examination other laboratory tests as CSF cytology, red cell count examination or CSF ferritin levels can be useful.
Keywords:
subarachnoid hemorrhage, cerebrospinal fluid spectrophotometry, cytology, ferritin.
:
P. Brož; J. Ženková; K. Řezáčová
:
Ústav klinické biochemie a hematologie Lékařské fakulty UK a Fakultní nemocnice v Plzni.
:
Klin. Biochem. Metab., 21 (42), 2013, No. 4, p. 220-225
Subarachnoidální krvácení (SAK) je život ohrožující stav. Přes neustálý vývoj v oblasti zobrazovacích i laboratorních metod zůstává nemalé procento pacientů se SAK špatně diagnostikováno. V případě negativního CT vyšetření, které je vyšetřením volby v diagnostice SAK, je doporučeno provedení spektrofotometrického vyšetření mozkomíšního moku. Jedná se o vyšetření relativně náročné na preanalytické podmínky, nicméně může být cenným diagnostickým nástrojem. Dle novějších doporučení je vhodné interpretovat spektrofotometrický nález s ohledem na proteinorachii a koncentrace celkové bílkoviny a bilirubinu v krevním séru. Kromě spektrofotometrického vyšetření je přínosné posouzení i dalších kriterií, které nám biochemická laboratoř při vyšetření mozkomíšního moku nabízí, např. vyhodnocení počtu erytrocytů, zhodnocení trvalého cytologického preparátu, nebo vyšetření hladiny feritinu.
Klíčová slova:
subarachnoidální krvácení, spektrofotometrie mozkomíšního moku, cytologie, feritin.
Subarachnoidální krvácení (SAK) je život ohrožující stav vznikající při krvácení mezi arachnoideu a pia mater. Průměrná incidence ve světě je 9 případů na 100 000 obyvatel za rok a nemalé procento případů je špatně či pozdě diagnostikováno [1,2]. Nejčastější příčinou je ruptura vakovitého aneurysmatu Willisova okruhu. Aneurysmata se tvoří na podkladě kongenitálního nebo získaného defektu cévní stěny, zejména zeslabení médie. Změny na cévách mohou být potencovány druhotně např. hypertenzními změnami či aterosklerózou. K ruptuře dochází v jakémkoli věku s maximem mezi 35 a 65 lety, nejčastěji při hemodynamickém zatížení. Vznik SAK je často spojen s fyzickou aktivitou či psychickým rozrušením, může však vzniknout i v klidu ve spánku. Mezi vzácnější příčiny spontánních SAK patří ruptury arteriovenózních malformací, výjimečně pak primární vaskulopatie, disekující intrakraniální aneurysma či hypertenze [3].
SAK je charakterizováno náhle vzniklou silnou bolestí hlavy. Může být provázeno různě významnou poruchou vědomí, proto je třeba na něj při všech nevysvětlitelných poruchách vědomí myslet. Možná je též změna kvalitativní složky vědomí i přítomnost ložiskové neurologické symptomatologie v důsledku ischemie či hematomu v povodí určité cévy. SAK se může manifestovat též epileptickými paroxysmy.
Vyšetřením volby v diagnostice SAK je CT vyšetření. Při pozitivním nálezu na CT mozku je indikována angiografie za účelem průkazu lokalizace aneurysmatu. V prvních dnech po vzniku krvácení je senzitivita nativního CT vyšetření vysoká (95-98 %), poté však začíná klesat. Je-li provedeno týden od počátku krvácení, senzitivita klesá až k hodnotám kolem 50 % [4].
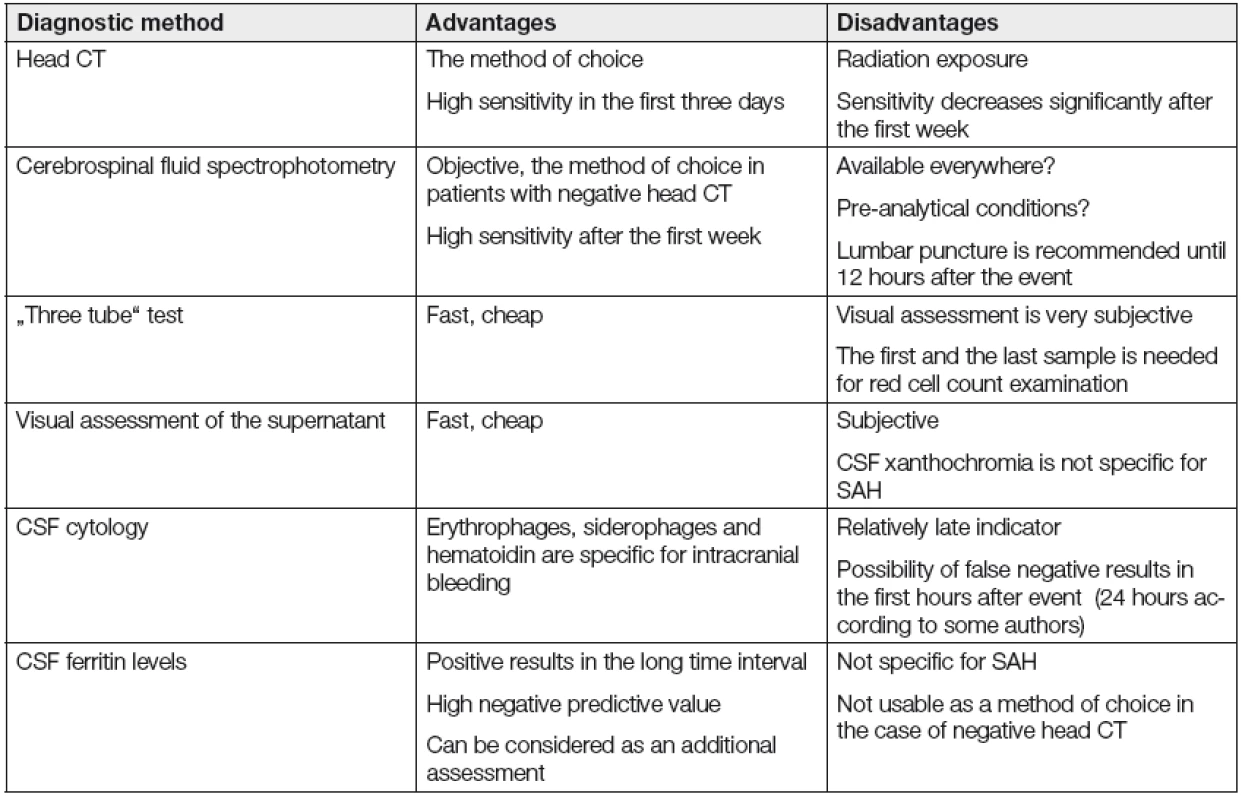
Problémem je diagnostika pacientů s negativním CT vyšetřením a trvajícím klinickém podezření na přítomnost SAK. Je možno využít jiných zobrazovacích metod (např. MRI), avšak dle platných doporučení je v případě negativního CT vyšetření indikováno spektro-fotometrické vyšetření mozkomíšního moku (obr. 1) [5,6]. To je rovněž doporučeno u pacientů s delším časovým odstupem od vzniku krvácení [7]. Spektrofotometrické vyšetření mozkomíšního moku prokáže přítomnost SAK u 3 % pacientů s podezřením na přítomnost SAK při negativním výsledku CT vyšetření [8]. K diagnostice opětovného krvácení však není spektrofotometrické vyšetření mozkomíšního moku vhodné, v těchto případech je indikováno provedení CT vyšetření. Při vyšetření mozkomíšního moku je klíčové odlišení SAK od arteficiální příměsi erytrocytů. Riziko traumatické lumbální punkce a arteficiální příměsi krve je poměrně vysoké (cca 10-15 % případů), dle některých studií i více [9].

Kromě spektrofotometrického vyšetření mozkomíšního moku může biochemická laboratoř při posuzování možnosti krvácení do likvorových cest nabídnout několik dalších prospěšných vyšetření. Zejména dříve prováděná zkouška tří zkumavek je založena na předpokladu, že při arteficiální kontaminaci vzorku krví dochází při postupném odebírání mozkomíšního moku do jednotlivých zkumavek ke snižování množství erytrocytů. V případě arteficiálního krvácení se snižuje erytrochromní (sangvinolentní) zabarvení mozkomíšního moku v následujících porcích, což je možné hodnotit vizuálně. Po centrifugaci by měl být vzorek čirý a bezbarvý se sedimentem erytrocytů, což však může být splněno i při velmi čerstvém krvácení. V případě SAK bývá krev v mozkomíšním moku rozptýlena rovnoměrně a množství erytrocytů v následujících vzorcích se nesnižuje. Je možná též zvýšená kontaminace následujících vzorků, kde příčinou může být poranění pletení při manipulaci s jehlou či minimálním pohybu pacienta. V praxi je nejvíce doporučováno odebrat nejprve cca 0,5 ml (vzorek je nejvíce kontaminován krví) a další 3 vzorky o větším objemu a na biochemické vyšetření pak zaslat nejlépe první a poslední vzorek a spočítat počet erytrocytů pod mikroskopem, protože při množství erytrocytů kolem několika stovek v 1 µl není změna barvy okem postihnutelná [10,11].
Průměrná doba přežití erytrocytů v periferní krvi je 120 dnů. Likvorové prostory jsou prostředím nepřirozeným pro erytrocyty, po jejich proniknutí do těchto prostor začíná postupně docházet k hemolýze. Uvolňuje se oxyhemoglobin, který může být detekován za 2-12 hodin od počátku krvácení, maxima dosahuje za 2-3 dny. Přítomnost oxyhemoglobinu tedy upozorňuje na čerstvé krvácení. Jeho izolovaná přítomnost však může vzniknout i při arteficiální příměsi krve a následném rozpadu erytrocytů. Oxyhemoglobin je pomocí makrofágů a dalších buněk leptomening enzymaticky přeměněn na bilirubin [12]. Tato konverze probíhá přibližně týden. Je možná též spontánní přeměna oxyhemoglobinu na methemoglobin. Oxyhemoglobin a bilirubin jsou příčinou xantochromního, resp. v případě methemoglobinu, červenohnědého zabarvení odstředěného mozkomíšního moku. Bilirubin se začíná v mozkomíšním moku objevovat asi 10-12 hodin po krvácení s maximem 2.-4. den. Přítomnost pouze bilirubinu bez oxyhemoglobinu je teoreticky možná již od 5. dne, nicméně je spíše vzácným jevem, protože oxyhemoglobin může být přítomen i 3 týdny po krvácení. Bilirubin v mozkomíšním moku může být nejen hematogenního, ale i plasmatického původu. Zvýšení koncentrace samotného bilirubinu bez přítomnosti oxyhemoglobinu v mozkomíšním moku je častější v souvislosti se zvýšenou koncentrací bilirubinu v systémové cirkulaci než v souvislosti se SAK. Xantochromní zbarvení mozkomíšního moku tedy nemusí být specifické pro intrakraniální krvácení. Pro odlišení arteficiální příměsi krve je též důležité, že ze jmenované trojice pigmentů oxyhemoglobin, bilirubin a methemoglobin vzniká pouze bilirubin in vivo cestou, ke vzniku oxyhemoglobinu a methemoglobinu může docházet in vivo i in vitro [13,14]. Provedení lumbální punkce a spektrofotometrického vyšetření mozkomíšního moku dříve než za 12 hodin po počátku krvácení může být zdrojem falešně negativních výsledků.
Je možné orientačně provést vizuální zhodnocení odstředěného mozkomíšního moku z hlediska xantochromního zbarvení, nicméně dnes již není považováno za dostačující a není doporučováno. Naopak spektro-fotometrické vyšetření je doporučováno pro svoji objektivitu a vyšší rozlišovací schopnost.
Spektrofotometrie likvoru je vyšetření relativně náročné na preanalytické podmínky. Jak bylo uvedeno výše, čas od počátku krvácení do odběru vzorku by neměl být kratší než 12 hodin. K prevenci arteficiální kontaminace erytrocyty je při lumbální punkci doporučeno provádět odběr více vzorků a spektrofotometrické vyšetření mozkomíšního moku provést z poslední porce. Pravděpodobnost vzniku falešně pozitivního výsledku stoupá s dobou od odběru k centrifugaci a s počtem erytrocytů obsažených ve vzorku. Ve studiích provedených in vitro však bylo prokázáno, že při centrifugaci provedené do 15 minut od odběru je u vzorků obsahujících méně než 40 000 erytrocytů/1 µl nepravděpodobný vznik falešně pozitivního výsledku. Splnění této podmínky v praxi není příliš reálné. Použití potrubní pošty není vzhledem ke zvýšené pravděpodobnosti výskytu hemolyzovaných vzorků doporučováno. Dle některých studií časová náročnost na včasné doručení relativně málo krvavých vzorků není tak velká. Např. Beetham et al. prokázali, že u vzorků s počtem erytrocytů 5-2215/1 µl zcentrifugovaných do 40 minut od odběru nebyla detekována přítomnost oxyhemoglobinu. Naopak Fahie-Wilson et al. prokázali, že oxyhemoglobin může být přítomen i u nižšího počtu erytrocytů (64-705/1 µl) při zpracování vzorku v nejbližší možné době po přijetí do laboratoře [15]. Pro praxi je doporučeno vzorek doručit do laboratoře tak rychle, jak je to možné, měl by být však zcentrifugován maximálně do hodiny po odběru vzorku. Centrifugace by měla být prováděna rychlostí >2000 rpm po dobu alespoň 5 minut. Je třeba dostatečné množství vzorku, ředění není doporučováno. Vzorek by měl být skladován v temnu při 4 °C. Dokumentován je úbytek absorbance bilirubinu až o 0,005 za hodinu působením přímého denního světla. Je vhodné současně odebrat vzorek krve na vyšetření hladiny bilirubinu a celkové bílkoviny.
Při spektrofotometrii je pomocí spektrofotometru sledována absorbance odstředěného vzorku při 350-650 nm. Měla by být zaměřena na sledování přítomnosti oxyhemoglobinu a bilirubinu. Oxyhemoglobin má relativně úzký absorpční pík při 413-415 nm a dva malé vrcholy při 540 a 575 nm. Nekonjugovaný (tzv. long) bilirubin tvoří široký pík při 450-460 nm. Přítomnost nekonjugovaného bilirubinu a oxyhemoglobinu tvoří charakteristickou křivku (obr. 2). Pro úplnost konjugovaný (tzv. short) bilirubin má absorpční maximum mezi 420 a 430 nm, methemoglobin při 406 nm.

Tradiční způsob vyhodnocování spektrofotometrické křivky spočívá v průkazu píku oxyhemoglobinu a bilirubinu. Spektrofotometrická křivka je sestrojena v oblasti vlnových délek od 370 do 600 nm. Určujícími limity jsou absorbance 0,04 při 415 nm v případě oxyhemoglobinu, resp. 0,02 při 460 nm v případě bilirubinu (obr. 3). Při překročení těchto limitů je výsledek brán jako pozitivní. Hodnocení však není příliš komplexní, např. nezohledňuje zvýšenou permeabilitu hematolikvorové bariéry či hyperbilirubinémii v systémové cirkulaci.

Dle novějších doporučení je spektrofotometrická křivka sestrojena v rozsahu vlnových délek 350-600 nm [16,17]. Cílem je vyhodnocení absorbance v oblasti píku oxyhemoglobinu (Net Oxyhemoglobin Absorbance - NOA) a bilirubinu (Net Bilirubin Absorbance - NBA). Základem je sestrojení tečny, od které se hodnoty NOA a NBA odečítají. Jedná se o spojnici os x a y dotýkající se spektrofotometrické křivky ve dvou bodech – prvním v rozmezí vlnových délek 350-400 nm a druhým v rozmezí 430-530 nm (obr. 4). Tečna křivku neprotíná v žádném bodě. Poté se provede odečet maximální absorbance NOA od základní linie v oblasti 410-418 nm v případě oxyhemoglobinu, resp. 476 nm v případě bilirubinu. Odečet NBA se provádí při 476 nm mimo absorpční maximum bilirubinu (460 nm) z důvodu menší interference oxyhemoglobinem. Naměřené absorbance jsou pak hodnoceny dle algoritmu platných doporučení (obr. 5). Při nejasném píku oxyhemoglobinu je třeba provést korekci v souvislosti se sérovými koncentracemi bilirubinu a sérovými koncentracemi celkové bílkoviny a proteinorachií. Na hodnocení spektrofotometrické křivky byl vypracován též software, který vede ke zjednodušení tvorby tečny, a tím zlepšení objektivity ve srovnání s manuální technikou zejména pro méně zkušený personál. Konečné vizuální posouzení a vyhodnocení je nicméně vhodné nechat v kompetenci zkušeného pracovníka [18].


K přítomnosti krvácení do likvorových cest se lze vyjádřit též na základě zhodnocení trvalého preparátu při cytologickém vyšetření mozkomíšního moku. V prvních hodinách po krvácení však může dávat falešně negativní výsledky. Po cca 4-6 hodinách po průniku krve do subarachnoidálního prostoru dochází k aktivaci elementů monocytární řady. Následuje fagocytóza erytrocytů, která je zřejmá po 6-12 hodinách, dle některých zdrojů však i za delší dobu [19]. Adhezi erytrocytů na membránu monocytů nelze považovat za patognomický znak pro SAK, protože může být přítomna rovněž při arteficiální příměsi erytrocytů, zejména není-li vzorek zpracován včas po odběru. Jsou-li v trvalém preparátu přítomny fagocytované erytrocyty, jedná se již o nepochybnou známku probíhající úklidové reakce po krvácení. V makrofázích postupně dochází k dekoloraci a rozpadu erytrocytů (za 2-3 dny od počátku SAK). Erytrofágy svědčí pro recentní SAK. Hemoglobin je makrofágy degradován na hemosiderin. Hemosiderin je přítomen od 4.-5. dne od počátku krvácení a může být přítomen i po několika týdnech. Protože obsahuje železo, je možno jej zvýraznit pomocí barvení na průkaz přítomnosti trojmocného železa (reakce na berlínskou modř). Od 14. dne může být přítomen hematoidin, jedná se o další hematogenní pigment, chemicky krystalický bilirubin, tvořící typické žluté kosočtverečné krystaly. Vzhledem k přítomnosti jednotlivých cytologických známek úklidové reakce v různých obdobích po počátku krvácení je možno se orientačně vyjádřit ke stáří krvácení, případně i k přítomnosti protrahovaného či opakovaného krvácení. Buňky obsahující železo však nemusí být vždy přítomny [20,21].
Relativně častým jevem provázejícím SAK je přítomnost reaktivní zánětlivé odpovědi charakteru aseptické meningitidy. Mohou být přítomny všechny vývojové stupně elementů lymfocytární řady, lymfofágy, rovněž elementy granulocytární řady, zejména neutrofilní granulocyty, které mohou v počátečních stádiích převažovat. Možná je též přítomnost lipofágů jako výrazu úklidové reakce při nekróze mozkové tkáně.
Při arteficiální příměsi krve jsou v mozkomíšním moku přítomny erytrocyty i leukocyty. Dle zastoupení krevních elementů v periferní krvi připadá v průměru na 1000 erytrocytů 1 leukocyt, nejedná-li se o pacienta s leukocytózou či leukopenií. Proto je při vyhodnocování počtu elementů v mozkomíšním moku v praxi vhodné provést korekci jaderných elementů při přítomnosti většího množství erytrocytů. Existují i výpočtové vztahy korigující počet leukocytů při traumatické lumbální punkci. Jedná se však o přibližné výpočty a zvláště při větší krevní příměsi (nad 10 000 erytrocytů v 1 µl) je vhodnější vyšetření opakovat [19].
V některých případech může být vhodné též posouzení koncentrace feritinu v mozkomíšním moku. Je přínosné zejména u případů s delším časovým odstupem od vzniku SAK, kde je větší pravděpodobnost negativního CT vyšetření i u pacientů s prodělaným SAK a bilirubin již nemusí být detekován. V těchto případech jsou koncentrace feritinu stále zvýšené [22]. Byť má test při hodnotě 6,4 µg/l vysokou negativní prediktivní hodnotu (1,0), vzhledem k nízké specifičnosti ho však není možno jako samostatný test při negativním CT vyšetření před provedením spektrofotometrie mozkomíšního moku doporučit [23].
Závěrem lze shrnout, že přes neustálý vývoj v oblasti zobrazovacích i laboratorních metod zůstává nemalé procento pacientů se SAK špatně diagnostikováno. V případě negativního CT vyšetření je dle platných doporučení vhodné provedení spektrofotometrického vyšetření mozkomíšního moku. Jedná se o vyšetření relativně náročné na preanalytické podmínky, nicméně může být cenným diagnostickým nástrojem. Pro správnou interpretaci je vhodné komplexní posouzení se znalostí klinického pozadí, zejména doby od počátku krvácení. Kromě spektrofotometrického vyšetření je přínosné též posouzení ostatních kriterií, které nám biochemická laboratoř může při vyšetření mozkomíšního moku nabídnout, např. vyhodnocení počtu erytrocytů ve vzorku, zhodnocení trvalého cytologického preparátu, nebo vyšetření hladiny feritinu.
Podpořeno MZ ČR - RVO (Fakultní nemocnice Plzeň - FNPl, 00669806).
Supported by Ministry of Health, Czech Republic - conceptual development of research organization (Faculty Hospital in Pilsen - FNPl, 00669806)
Do redakce došlo 2. 8. 2013
Adresa pro korespondenci
MUDr. Pavel Brož
ÚKBH FN Plzeň
Alej Svobody 80
304 60 Plzeň
brozp@fnplzen.cz
Sources
1. Rooij, N. K. de, Linn, F. H. H., Van der Plas, J. A., Algra, A., Rinkel, G. J. E. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. J. Neurol. Neurosurg. Psychiatry. 2007, 78 (12), p. 1365–1372.
2. Labovitz, D. L., Halim, A. X., Brent, B., Boden-Albala, B., Hauser, W. A., Sacco, R. L. Subarachnoid hemorrhage incidence among Whites, Blacks and Caribbean Hispanics: the Northern Manhattan Study. Neuroepidemiology. 2006, 26, p. 147–150.
3. Ambler, Z. Základy neurologie. Nakladatelství Galén. Praha. Sedmé vydání. 2011.
4. Van Gijn, J., van Dongen, K. J. The time course of aneurysmal haemorrhage on computed tomograms. Neuroradiology. 1982, 23, p. 153–156.
5. Connolly, E. S., Rabinstein, A. A., Carhuapoma, J. R., Derdeyn, C. P., Dion, J., Higashida, R. T. et al. Guidelines for the Management of Aneurysmal Subarachnoid Hemorrhage. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2009, 40, p. 994-1025. Dostupný z www: <http://stroke.ahajournals.org/content/40/3/994.full.pdf+html >
6. Tumani, H., Petzold, A., Wick, M., Kühn, H.-J., Uhr, M., Otto, M., et al. [Cerebrospinal fluid-based diagnostics of CT-negative subarachnoid haemorrhage]. Nervenarzt. 2010, 81 (8), p. 973–979.
7. Adams, H. P. Jr., Kassell, N. F., Torner, J. C., Sahs, A. L. CT and clinical correlations in recent aneurysmal subarachnoid hemorrhage: a preliminary report of the Cooperative Aneurysm Study. Neurology. 1983, 33 (8), p. 981–988.
8. Van der Wee, N., Rinkel, G. J., Hasan, D., van Gijn, J. Detection of subarachnoid haemorrhage on early CT: is lumbar puncture still needed after a negative scan? J. Neurol. Neurosurg. Psychiatry. 1995, 58 (4), p. 357–359.
9. Shah, K. H., Richard, K. M., Nicholas, S., Edlow, J. A. Incidence of traumatic lumbar puncture. Acad. Emerg. Med. 2003, 10 (2), p. 151–154.
10. Shah, K. H., Edlow, J. A. Distinguishing traumatic lumbar puncture from true subarachnoid hemorrhage. J. Emerg. Med. 2002, 23 (7), p. 67–74.
11. Irani, D. N. Cerebrospinal Fluid in Clinical Practice. Elsevier Health Sciences. Philadelphia. 2008. Dostupný z www: <http://books.google.cz/books/about/Cerebrospinal_Fluid_in_Clinical_Practice.html?id=o6SoJYPnyTQC&redir_esc=y>
12. Cruickshank, A. M. ACP Best Practice No 166 CSF spectrophotometry in the diagnosis of subarachnoid haemorrhage. J. Clin. Pathol. 2001, 54 (1), p. 827–830.
13. Söderström, C. E. Diagnostic significance of CSF spectrophotometry and computer tomography in cerebrovascular disease. A comparative study in 231 cases. Stroke. 1977, 8 (1), p. 606–612.
14. Watson, I. D. What is the role of CSF spectrophotometry in the diagnosis of subarachnoid haemorrhage? Ann. Clin. Biochem. 1998, 35 (9), p. 684–686.
15. Beetham, R., Fahie-Wilson, M. N., Holbrook, I., Thomas, P., Ward, A. M., Watson, I. D. et al. CSF spectrophotometry in the diagnosis of subarachnoid haemorrhage. J. Clin. Pathol. 2002, 55 (6), p. 479–480.
16. Cruickshank, A., Auld, P., Beetham, R., Burrows, G., Egner, W., Holbrook, I. et al. Revised national guidelines for analysis of cerebrospinal fluid for bilirubin in suspected subarachnoid haemorrhage. Ann. Clin. Biochem. 2008, 45 (5), p. 238–244. Dostupný z www: <http://acb.sagepub.com/content/45/6/617.full.pdf+html>
17. Griffiths, M. J., Chow, E., Panting, M. D., Ford, C., Gama, R. Comparison of original (2003) and revised (2008) national guidelines for reporting of cerebrospinal fluid spectrophotometric scanning for suspected subarachnoid haemorrhage against patient outcome. Ann. Clin. Biochem. 2010, 47 (1), p. 375–377.
18. Collet, N., Garcelon, N., Robbe, V., Lucas-Clerc, C., Cuggia, M., Bendavid, C. Bioinformatic software for cerebrospinal fluid spectrophotometry in suspected subarachnoid haemorrhage. Ann. Clin. Biochem. 2012, 49 (1), p. 177–183.
19. Glosová, L. Cytologický atlas mozkomíšního moku. Nakladatelství Galén. Praha. 1998.
20. Ito, U., Inaba, Y. Cerebrospinal fluid cytology after subarachnoid hemorrhage. J. Neurosurg. 1979, 51 (9), p. 352–354.
21. Adam, P. Cytologie likvoru. Pardubice. Stapro. 1995.
22. Petzold, A., Worthington, V., Appleby, I., Kerr, M. E., Kitchen, N., Smith, M. Cerebrospinal fluid ferritin level, a sensitive diagnostic test in late-presenting subarachnoid hemorrhage. J. Stroke. Cerebrovasc. Dis. 2011, 20 (11), p. 489–493.
23. Watson, I. D., Beetham, R., Fahie-Wilson, M. N., Holbrook, I. B., O’Connell, D. M. What is the role of cerebrospinal fluid ferritin in the diagnosis of subarachnoid haemorrhage in computed tomography-negative patients? Ann. Clin. Biochem. 2008, 45 (4), p. 189–192.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapistArticle was published in
Clinical Biochemistry and Metabolism

2013 Issue 4
-
All articles in this issue
- New generation of hs cardiac troponins and diagnosis of acute coronar syndrome - minireview
- Trace elements in critical states. Part 1: zinc and iron
- Trace elements in critical states. Part 2: copper and selenium
- Hypercholesterolemia in pregnancy - pathobiochemical and pathophysiological implication for atherosclerosis and evaluation in metabolic surgery
- Haemolysis influence on the determination of total and direct bilirubin
- Cerebrospinal fluid analysis in the diagnosis of subarachnoid hemorrhage
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Haemolysis influence on the determination of total and direct bilirubin
- Cerebrospinal fluid analysis in the diagnosis of subarachnoid hemorrhage
- Trace elements in critical states. Part 1: zinc and iron
- Trace elements in critical states. Part 2: copper and selenium
