Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu
:
M. Šachlová 1; L. Foretová 2
:
Gastroenterologická ambulance, Masarykův onkologický ústav, Brno2 Oddělení epidemi ologi e a genetiky nádorů, Brno
1
:
Klin Onkol 2009; 22(6): 296-297
:
Oncology Highlights
Screeningové programy jsou určeny k rozpoznání kolorektálního karcinomu (KRCA) u jedinců s nízkým populačním rizikem onemocnění. Dispenzární programy KRCA se používají u rizikových skupin tohoto onemocnění, tj. u osob s pozitivní osobní anamnézou onemocnění kolorekta nebo u osob s rodinnou anamnézou KRCA či adenomu, s familiární adenomatózní polypózou (FAP), hereditárním nepolypózním kolorektálním karcinomem (HNPCC). Dispenzární programy jsou formulovány nejednotně a často modifikovány podle místních zvyklostí. Už v roce 1999 byl v ČR publikován první návrh ke sledování, další revidovaný návrh je z roku 2005 [1–3]. Český návrh vycházel z předchozích směrnic Americké gastroenterologické asociace z roku 1997 a 2003. Za zmínku stojí i fakt, že v roce 2006 byla poprvé publikována nová doporučení dispenzarizace po endoskopické polypektomii a po resekci KRCA jako první společný dokument multidisciplinární expertní skupiny US Multi Society Task Force a Americké onkologické společnosti [4–7]. To, že vznikla 3. revize v průběhu 10 let, potvrzuje skutečnost, že směrnice pro dispenzarizaci a screening představují dynamický proces.
Dobře definované hereditární syndromy (s dědičnou monogenní dispozicí) kolorektálního karcinomu (familiární adenomatózní polypóza a hereditární nepolypózní kolorektální karcinom – Lynchův syndrom) tvoří asi 10% všech případů. Většinu kolorektálních karcinomů tvoří tzv. sporadický karcinom (50–60%) a familiární (s rodinným výskytem, bez prokázané příčiny) (20–30%) (obr. 1). Odhaduje se, že nejméně 10% dospělých osob v civilizovaných zemích má jednoho příbuzného prvního stupně postiženého kolorektálním karcinomem [8].
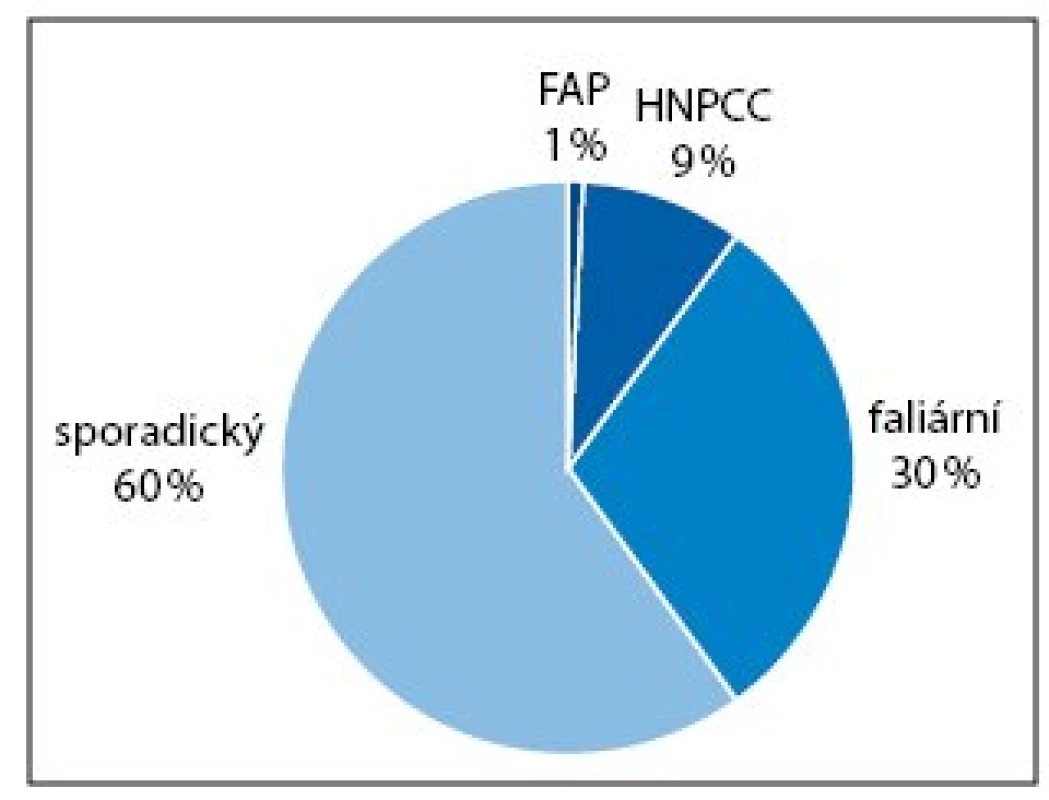
Je zajímavé, že výraznější familiární asociace byla zjištěna pro lokalizaci KRCA v proximální a distální lokalizaci. Při rektální lokalizaci byl vztah méně výrazný [8]. Z klinické praxe je známo, že ženy s anamnézou karcinomu prsu nebo gynekologického karcinomu mají i vyšší riziko karcinomu kolorektálního.
Riziko se stupňuje počtem postižených příbuzných a také jejich mladším věkem v době diagnózy [10] (tab. 1). V rodinách s výskytem nádoru u dvou a více příbuzných v linii, kde alespoň u jednoho byl nádor diagnostikován pod 50 let, by měla být doporučena genetická konzultace. Testování by mělo být provedeno i u nádoru kolorekta ve věku pod 35 let bez rodinné anamnézy.
![Odhadovaná empirická rizika dle rodinné anamnézy – podle Hodgsona [9].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/dfa355f5b361443db4faf64d3e747a6d.png)
Původní dispenzární program doporučoval jednotný postup pro všechny osoby s familiárním výskytem „nesyndromového typu“: screeningový program s úvodním testem na okultní krvácení ve stolici se začátkem od 40 let věku. Zařazení do dispenzárního programu bylo zvlášť zdůrazňováno u jedinců, v jejichž rodinách se vyskytl KRCA ve věku nižším než 55 let nebo adenom pod 60 let věku [1]. Rozdílné hodnoty relativního rizika vedly k doporučení podle příbuzenského stupně.
- Při postižení jednoho příbuzného 1. stupně KRCA nebo adenomovými polypy ve věku pod 60 let nebo dvou příbuzných 1. stupně jakéhokoliv věku: kolonoskopie v pětiletém intervalu od 40 let věku nebo od věku o 10 let nižšího, v němž byla stanovena diagnóza nejčasnějšího KRCA v rodině.
- Při postižení jednoho příbuzného 1. stupně KRCA nebo adenomem ve věku 60 let a vyšším nebo dvou příbuzných 2. stupně KRCA: program průměrného rizika od věku 40 let.
- Při postižení jednoho příbuzného 2. stupně nebo jakéhokoliv počtu příbuzných 3. stupně (prarodiče, bratranci a sestřenice): program jako u osob s průměrným rizikem.
Dne 12. 6. 2008 se v Lékařském domě v Praze v rámci XII. onkogenetického dne sešla onkogenetická skupina Společnosti lékařské genetiky a České onkologické společnosti a projednávala přípravu dispenzarizačních návrhů pro hereditární nádorové syndromy. Předkládáme vybraný diskutovaný návrh pro osoby s familiárním výskytem nádoru kolorekta.
Doporučený protokol preventivního sledování u osob s vyšším rizikem kolorektálního karcinomu dle rodinné anamnézy (HNPCC nebylo potvrzeno genetickým testováním, nebo testování nebylo provedeno pro nesplnění kritérií, neplatí pro FAP)
Základní doporučení:
- Test na okultní krvácení ročně 10 let před nejnižším věkem výskytu nádoru v rodině a dále ročně mezi kolonoskopiemi. Při makroskopickém výskytu krve ve stolici provedení kolonoskopie okamžitě, test na okultní krvácení neprovádět.
- Kolonoskopie ve dvou až pětiletých intervalech (pětiletý interval u normálního kolon, u benigních změn 2–3 roky dle typu změn, jako je četnost a velikost adenomů, dysplastické změny), začátek 5–10 let před nejnižším věkem výskytu nádoru v rodinné anamnéze.
- U rodin, které splňují Amsterdamská kritéria a pravděpodobnost dědičnosti je vysoká, je vhodné dodržovat doporučení jako u HNPCC – viz navržená pravidla, uveřejněná v roce 2009 [11].
Závěr
Potřebujeme doporučené postupy? Určitě ano. Skupina osob se zvýšeným rizikem KRCA musí být sledována. Je však potřeba postupy sjednotit tak, aby dispenzarizace splnila svůj účel a současně aby tyto osoby nebyly zbytečně vyšetřovány a stigmatizovány. Stále více se v medicíně prosazuje koncepce Evidence Based Medicine, tzn. lékařství založené na důkazech, proto i návrhy dispenzarizace se musí opřít o dostupné literární údaje. Z literatury je známo, že asi 25% diagnostických a terapeutických výkonů nelze zdůvodnit, a lze je proto považovat za nadbytečné a zbytečně nákladné [12].
Je potřeba sjednotit postupy mezi odbornými společnostmi a jednotlivými specialisty. Pak můžeme společně vyvíjet i tlak na jednání s pojišťovnou a výsledky dispenzarizace vyhodnocovat. Je zapotřebí na toto téma diskutovat v rámci široké odborné společnosti a přijmout konsenzus k jednotnému postupu.
Doporučený návrh sledování by měl být jednoduchý především pro praktické lékaře, kteří mají provádět celkové preventivní prohlídky po dvou letech u svých registrovaných osob a hodnotit i rizika rodinné anamnézy. Každý člověk v běžném riziku bez klinických problémů by měl absolvovat test na okultní krvácení od 50 do 54 let věku 1krát za rok a dále v 55 letech buď screeningovou kolonoskopii 1krát za 10 let, nebo test na okultní krvácení 1krát za 2 roky. V případě vyššího rizika by měl lékař navrhnout výše uvedenou dispenzarizaci nebo indikovat genetickou konzultaci. Stejně tak i všichni onkologové, kteří léčí pacienty s kolorektálním nádorem, by měli být schopni zhodnotit vhodnost genetické konzultace, riziko onemocnění pro další členy rodiny a doporučit preventivní sledování. Pacient by měl dostat do rukou informaci pro své příbuzné o vhodných preventivních opatřeních. Stačí jen krátký jednoduchý text.
Pacientů s nádory kolorekta přibývá, jejich příbuzní mají zvýšené empirické riziko onemocnění a je na lékařích, zda jim jednoduchou radou umožní se účinně bránit.
MUDr.
Milana Šachlová, CSc. et Ph.D.
Gastroenterologická
ambulance
Masarykův
onkologický ústav
Žlutý
kopec 7
656
53 Brno
e-mail:
sachlova@mou.cz
Sources
1. Frič P, Zavoral M. Sekundární prevence kolorektálního karcinomu (Aktuální přehled). Endoskopie 2001; 10: 39– 42.
2. Frič P, Zavoral M. Sekundární prevence kolorektálního karcinomu se zřetelem k vysokorizikovým skupinám. Postgrad Med 2005; 7: 240– 243.
3. Frič P, Zavoral M. Dispenzární programy vysokorizikových skupin kolorektálního karcinomu.Česká a slov.gastroenterologie 2006; (60) 5: 199– 200.
4. Winawer SJ, Fletcher RH, Miller L et al. Colorectal cancer screening clinical quidelines and rationale. Gastroenterology 1997; 112: 594– 642.
5. Winawer SJ, Fletcher RH, Rex D et al. Colorectal cancer screening and surveillance: clinical quidelines and rationale‑ update based on new evidence. Gastroenterology 2003; 124: 544– 560.
6. Winawer SJ, Zauber AG, Fletcher RH et al. Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi‑Society Task Force on Colorectal Cancer and the American Cancer Society. Gastroenterology 2006; 130: 1872– 1885.
7. Winawer SJ, Kahi CJ, Levin B et al. Guidelines for colonoscopy surveillance after cancer resection: a consensus update by the American Cancer Society and the US Multi‑Society Task Force on Colorectal Cancer. Gastroenterology 2006; 130: 1865– 1871.
8. Burt RW, Peterson GM. Familial colorectal cancer. Diagnosis and management. In: Young P, Rozen P, Levin B. Prevention and Early Detection of Colorectal Cancer. Philadelphia: W. B. Saunders Comp 1996: 171– 194.
9. Hodgson SV, Foulkes WD, Eng Ch et al. A Practical Guide to Human Cancer Genetics. Cambridge University Press 2007.
10. Jablonská M et al. Kolorektální karcinom, časná diagnóza a prevence. 1. vyd. Praha: Grada 2000: 303– 311.
11. Plevová P, Novotný J, Šachlová M et al. Hereditární nepolypózní kolorektální karcinom, Klin Onkol 2009; 22 (Suppl): 12– 16.
12. Woolf SH. Practice quidelines: a new reality in medicine. Arch Intern Med 1990; 115: 1811– 1818.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2009 Issue 6
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
- Obstacle Called Vasospasm: Which Solution Is Most Effective in Microsurgery and How to Pharmacologically Assist It?
Most read in this issue
- Neo‑Adjuvant Chemotherapy Followed by Interval Debulking Surgery in Advanced Ovarian Cancer Treatment – a Retrospective Study
- Aromatase Inhibitors in Risk Reduction of Breast Cancer: Potential Use in Premenopausal Women
- Influenza Vaccination for Adult Patients with Solid Malignancies
- Familliar Colorectal Cancer Surveillance
