Změny cílových objemů při použití magnetické rezonance pro plánování radioterapie lůžka prostaty – předběžné výsledky
Changes in Target Volumes Definition by Using MRI for Prostate Bed Radiotherapy Planning – Preliminary Results
Backgrounds:
Magnetic resonance imaging (MRI) is used quite routinely in radiotherapy treatment planning in the primary radiotherapy of prostate cancer as it provides more contrast imaging of soft tissues in the small pelvis than planning CT, thanks to which it allows more exact delineation of target volumes and thus the saving of organs at risk. We tried to verify whether it is possible to use MRI by analogy in the planning of prostate bed radiotherapy.
Patients and Methods:
Twentyone patients indicated for prostate bed radiotherapy were considered in this study. Here we present the preliminary results of 10 of them. Four patients were indicated for adjuvant, 6 for salvage radiotherapy. All the patients underwent, besides standard planning CT, MRI in the same position. Target volumes and organs at risk were delineated into CT, T1 and T2 MRI images – clinical target volume (CTV), planning target volume (PTV), urinary bladder and rectum. Based on the merging of images, the volumes delineated in MRI were copied into planning CT, where the evaluation was done. We evaluated the volumes of each structure, agreement in contouring with the help of the rate of union and intersection of the volumes and with Cohen’s kappa, and 3D differences between volumes of CTV on CT, T1 and T2 MRI.
Results:
Statistically, volumes of CTV and PTV are not significantly different. The volume of the rectum is significantly smaller on T1 and also T2 MRI images. The index of agreement (union/ intersection) is statistically significantly different from 1 for CTV and PTV as well. Cohen’s kappa indicates moderate agreement for CTV CT and T1, T1 and T2 MRI, fair agreement for CTV CT and T2 MRI, and substantial agreement for PTV. In the superior and superolateral direction, the CTV volume on MRI in the central plane is smaller on T1 and T2 images. In the area of seminal vesicles (SV) the cranial border is similar on CT and MRI. In the superoposterior direction, the volume of CTV is smaller on CT than on T1 and T2 MRI, which means, that seminal vesicles are delineated larger in the posterior direction on MRI (about 0.24 cm on T1; by about 0.20 cm on T2 images). In the posterior direction, there are no differences in CTV on CT and T1 while on T2 the CTV is larger (a difference of 0.29 cm). In the posterolateral direction, CTV is smaller on T1 MRI than on CT on both sides, on the right as well as on the left.
Conclusion:
Preliminary results suggest that clinical target volume defined with the help of MRI is shifted compared with CTV defined on planning CT. The agreement of CTV delineation by one radiation oncologist is moderate to fair and is similar to interobserver variability in the contouring of the prostate bed in the planning CT. MRI provides more contrast imaging of the anterior rectal wall, where we have confirmed the most differences in contouring. Moreover, it provides better imaging of local recurrences and seminal vesicles, where the most differences in our group of patients were seen in comparison with planning CT.
Key words:
prostate cancer – radiotherapy – radiotherapy planning – magnetic resonance imaging – clinical target volume
Authors:
J. Šefrová, Paluska. 1 1; K. Odrážka 2,3,4,5; Z. Bělobrádek 6; P. Hoffmann 6; P. Prošvic 7; M. Broďák 8; M. Louda 8
; Z. Mačingová 1; M. Vošmik 1
Authors‘ workplace:
Klinika onkologie a radioterapie, FN Hradec Králové
1; Multiscan s. r. o., Oddělení klinické a radiační onkologie, Pardubická krajská nemocnice, a. s., Pardubice
2; Onkologická klinika 1. LF UK a VFN, Praha
3; Radioterapeutická a onkologická klinika 3. LF UK, Praha
4; Katedra radiační onkologie, IPVZ Praha
5; Radiologická klinika, FN Hradec Králové
6; Urologické oddělení, Oblastní nemocnice Náchod a. s., Náchod
7; Urologická klinika, FN Hradec Králové
8
Published in:
Klin Onkol 2010; 23(4): 256-263
Category:
Original Articles
Overview
Východiska:
Magnetická rezonance (MRI) je používána již celkem rutinně pro plánování primární radioterapie karcinomu prostaty, protože poskytuje kontrastnější zobrazení měkkých tkání malé pánve než plánovací CT, díky čemuž umožňuje přesnější zakreslení cílových objemů a tím i šetření okolních rizikových orgánů. Ověřovali jsme, zda lze MRI použít analogicky i v plánování radioterapie lůžka prostaty.
Soubor pacientů a metody:
Do studie bylo zařazeno celkem 21 pacientů indikovaných k ozáření lůžka prostaty. Zde přinášíme předběžné výsledky u 10 z nich. Čtyři pacienti byli indikováni k adjuvantní radioterapii, šest k záchranné radioterapii. Všem bylo kromě standardního plánovacího CT provedeno vyšetření MRI ve stejné poloze. V CT, T1 a T2 MRI byly zakresleny cílové objemy a rizikové orgány – klinický cílový objem (CTV), plánovací cílový objem (PTV), močový měchýř a rektum. Na základě fúze obrazů byly objemy zakreslené v MRI přeneseny do plánovacího CT, kde probíhalo vyhodnocení. Hodnoceny byly objemy jednotlivých struktur, shoda v zakreslení pomocí poměru sjednocení/ průnik a pomocí Cohenova kappa koeficientu a prostorové odchylky mezi objemy CTV na CT, T1 a T2 MRI.
Výsledky:
Objemy CTV a PTV se statisticky významně neliší. Objem rekta je na MRI signifikantně menší na T1 i T2 vážených obrazech. Index shody (sjednocení/ průnik) je statisticky významně odlišný od 1 pro CTV i PTV. Kappa koeficienty značí průměrnou shodu pro CTV na CT a T1, T1 a T2, podprůměrnou shodu pro CTV CT a T2, podstatnou shodu pro PTV. Ve směru superiorním a superolaterálním je objem CTV na MRI v centrální rovině zakreslen menší na T1 i T2 vážených obrazech. V oblasti semenných váčků (SV) je kraniální hranice stejná na CT i MRI. Ve směru superioposteriorním je objem CTV na CT menší než na T1 i T2 MRI, což znamená, že semenné váčky jsou na MRI zakresleny větší směrem dozadu (o 0,24 cm na T1, o 0,20 cm na T2). Ve směru posteriorním se neliší CTV CT a T1, kdežto CTV T2 je v tomto směru zakreslen větší (odchylka 0,29 cm). Ve směru posterolaterálním je oboustranně, vpravo i vlevo, menší objem na T1 MRI než na CT.
Závěr:
Předběžné výsledky naznačují, že klinický cílový objem definovaný pomocí MRI je posunut vůči objemu definovanému na plánovacím CT. Shoda v zakreslení CTV jedním radiačním onkologem je průměrná až podprůměrná a odpovídá přibližně shodě v zakreslení lůžka prostaty více pozorovateli v plánovacím CT. MRI poskytuje kontrastnější zobrazení přední stěny rekta, kde jsme potvrdili největší rozdíly v zakreslení. Dále poskytuje lepší zobrazení lokálních recidiv a semenných váčků, kde se v našem souboru též vyskytly největší rozdíly ve srovnání s plánovacím CT.
Klíčová slova:
nádory prostaty – radioterapie – plánování radioterapie – magnetická rezonance – klinický cílový objem
Východiska
Magnetická rezonance (MRI) je celkem standardně používána v plánování primární radioterapie karcinomu prostaty, protože oproti CT vyšetření poskytuje kontrastnější zobrazení měkkých tkání a díky tomu i přesnější zakreslení klinického cílového objemu (clinical target volume – CTV) i rizikových orgánů [1–3]. Je prokázáno, že objem zakreslený pomocí MRI je menší než objem zakreslený pomocí plánovacího CT [2,4]. Variabilita v zakreslení na MRI je menší než variabilita zakreslení na CT, a to především v oblasti apexu prostaty a při konturování přední stěny rekta [2,5,6]. V plánování radioterapie po radikální prostatektomii (RP) se MRI využívá k lokalizaci vezikouretrální anastomózy, která je dobře viditelná zejména na sagitálních T2 vážených řezech [7].
Nález na MRI po radikální prostatektomii se od stavu před operací odlišuje více než pouhou nepřítomností předstojné žlázy. Baze močového měchýře se posouvá kaudálně a dopředu na místo resekované prostaty. V různé míře nacházíme zbytky semenných váčků a ductus deferens, které se zobrazují s nízkým nebo středním signálem na T1 i T2 MRI. V místě přední stěny rekta se často zobrazuje fibrotická tkáň jakožto lineární okrsek s nízkým signálem na T1 i T2 MRI. Stejně se zobrazuje fibróza v oblasti vezikouretrální anastomózy. Po podání gadolinia při absenci recidivy nedochází v oblasti lůžka k žádné opacifikaci v arteriální fázi a jen výjimečně k slabé opacifikaci ve fázi venózní. Někdy se objevuje reziduální prostatická tkáň, která může imitovat recidivu/perzistenci. Zobrazuje se na T2 MRI jakožto homogenní okrsek tvaru prostaty, většinou v oblasti anastomózy, na T2 se středním, na T1 s nízkým signálem [8].
Na základě zkušeností z plánování primární radioterapie karcinomu prostaty jsme se pokusili ověřit, zda použití MRI bude mít vliv na velikost cílového objemu také při plánování radioterapie lůžka prostaty po radikální prostatektomii, případně ve kterých oblastech se klinický cílový objem zakreslený na CT liší od CTV zakresleného na MRI. Pokud je autorům známo, není problematika využití MRI pro plánování ozáření lůžka prostaty v literatuře popsána.
Materiál a metody
Soubor pacientů
Do studie bylo zařazeno celkem 21 mužů s karcinomem prostaty indikovaných k pooperační radioterapii, kteří neměli kontraindikace provedení MRI a s vyšetřením vyslovili souhlas. Zde přinášíme předběžné výsledky vyhodnocení u 10 pacientů. Charakteristiku souboru shrnuje tab. 1. Průměrný věk pacientů byl 65 let, 4 pacienti byli indikováni k adjuvantní radioterapii, 6 pacientů k záchranné radioterapii pro biochemický relaps. Průměrné Gleason skóre bylo 6 (6–9), prostatický specifický antigen (PSA) před operací 7,8 ng/ml (3,5–14,3, medián 8,3 ng/ml), PSA před ozářením 0,7 ng/ml (0,2–2,6, medián 0,4 ng/ml). Devět z deseti pacientů podstoupilo transrektální ultrasonografii (TRUS) k potvrzení či vyloučení makroskopicky viditelné recidivy/perzistence. Jeden pacient pro bolestivou reakci nebyl vyšetřen ani fyzikálně, ani ultrasonograficky.
Postup vyšetření a zakreslení objemů
Pacientům bylo provedeno standardní plánovací CT v supinační poloze s fixační podložkou pod nohy na přístroji Siemens Somatom Sensation Open (Siemens AG, Erlangen, Německo) se získáním transverzálních řezů o síle 3mm. Následně ve stejné poloze podstoupili MRI na přístroji Siemens Magnetom Symphony 1.5 T (Siemens AG, Erlangen, Německo) s akvizicí T1 a T2 vážených obrazů v transverzálních řezech, taktéž o síle 3mm. Vyšetření MRI bylo provedeno průměrně jednu hodinu po CT.
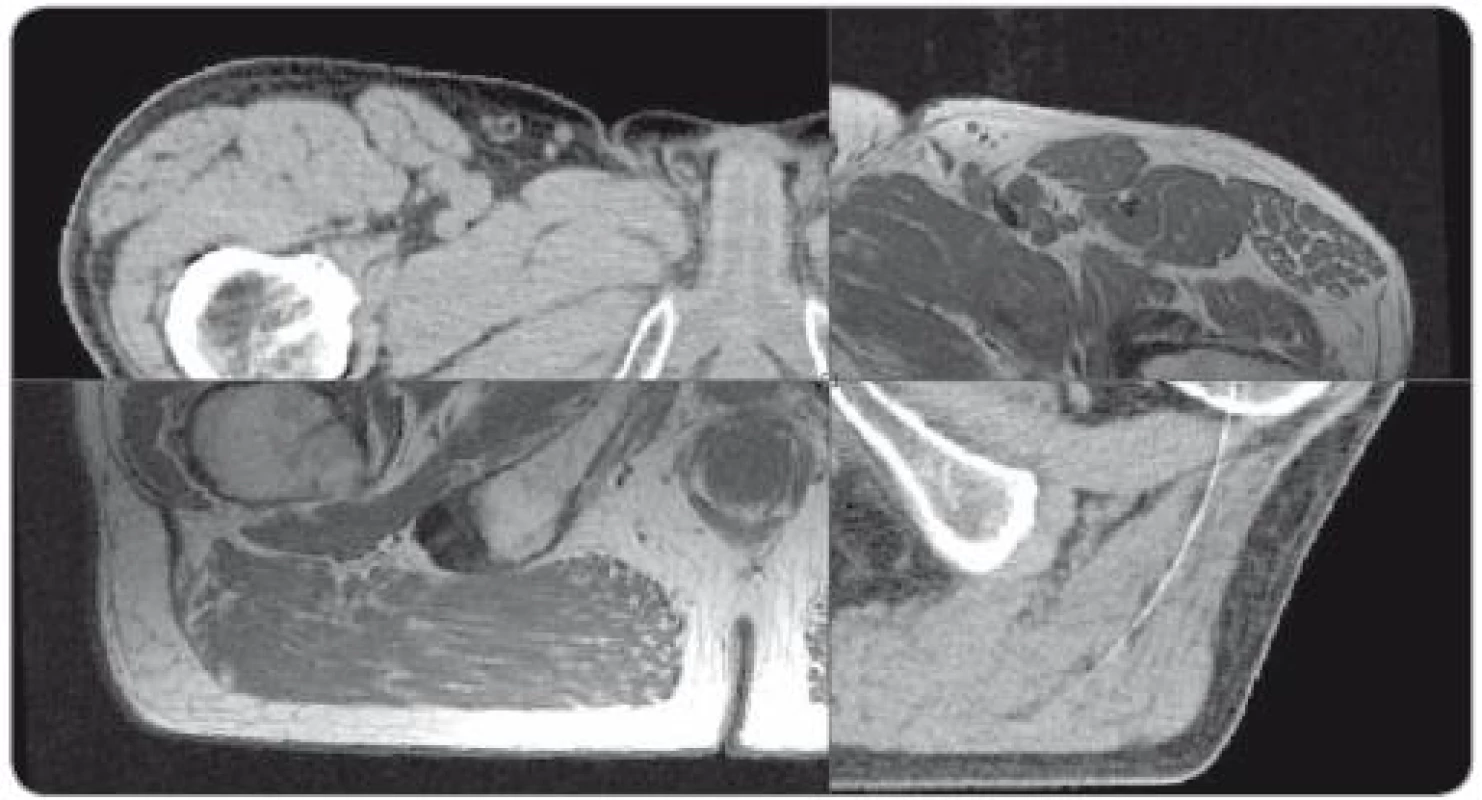
Fúze obrazů byla provedena v plánovacím systému Eclipse pomocí softwaru ARIA Radiation Oncology (Varian Medical Systems, Palo Alto, Kalifornie, USA) na základě vzájemné registrace pěti bodů umístěných na měkké tkáně v pánvi, zejména v okolí lůžka prostaty (obr. 1). Fúze byla provedena s průměrnou střední odchylkou 1,01mm pro T1, 1,06mm pro T2, s maximální průměrnou odchylkou 1,39mm a 1,40mm pro T1 a T2 MRI.
Zakreslení cílových objemů i rizikových orgánů bylo provedeno u všech subjektů jedním radiačním onkologem, nejprve do plánovacího CT, následně do T1 a T2 MRI, poté byly všechny objemy na základě provedené fúze obrazů překopírovány do plánovacího CT, kde probíhalo vyhodnocení.
Pro zakreslení klinického cílového objemu jsme zvolili doporučení European Organisation for Research and Treatment of Cancer (EORTC) [9] s následnou úpravou objemu v zadní části kolem rekta a bez rozšiřování v místě pozitivních okrajů nebo extrakapsulární extenze, a to hlavně z důvodu heterogenity patologických popisů, kde směr pozitivních okrajů není spolehlivě popsán u všech pacientů. V případě viditelné recidivy/perzistence byla tato zahrnuta do CTV, stejně jako reziduální semenné váčky (SV).
Plánovací cílový objem (planning target volume – PTV) byl vytvořen symetrickým lemem 10mm ve všech směrech, močový měchýř a rektum jsme zakreslovali 10mm nad a 10mm pod hranice PTV.
Vyhodnocení výsledků
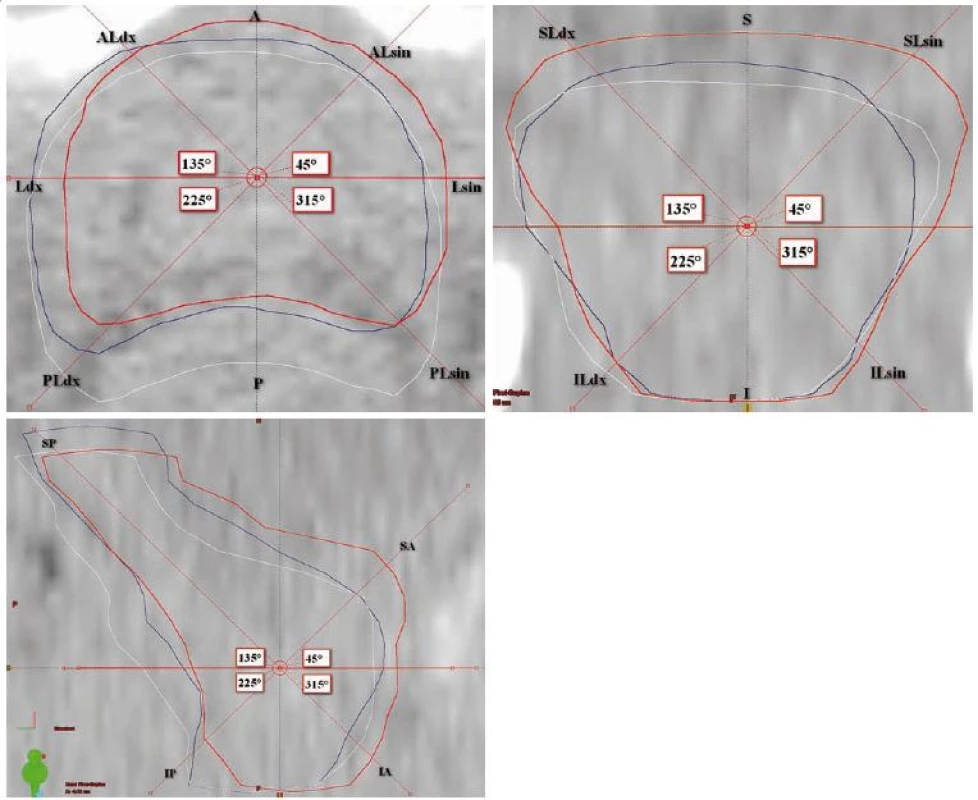
Hodnocení probíhalo v plánovacím CT za pomoci plánovacího systému Eclipse, software ARIA Radiation Oncology (Varian Medical Systems, Palo Alto, Kalifornie, USA). Hodnotili jsme objemy jednotlivých zakreslených struktur – CTV, PTV, rekta a močového měchýře, odlišnost objemů jednovýběrovým t testem poměru objemů na CT a T1, případně CT a T2, dále shodu v zakreslení mezi CT, T1 a T2 MRI, a to dvěma způsoby. Jednak pomocí indexu shody, který je dán poměrem mezi sjednocením a průnikem dvou porovnávaných objemů, kde hodnota 1 značí absolutní shodu, jednak pomocí Cohenova kappa koeficientu [10], u nějž hodnota 1 značí také absolutní shodu, hodnoty záporné značí shodu náhodnou a pro hodnoty v intervalu 0–1 jsme využili interpretační tabulku dle Landise a Kocha [11]. Pro prostorové vyhodnocení jsme měřili odchylky mezi jednotlivými objemy CTV (CTV CT vůči CTV T1 a CTV CT vůči CTV T2) ve třech rovinách, jejichž střed byl zvolen ve středu CTV CT, celkem v 18 směrech (obr. 2a–c).
Výsledky
Zobrazitelná recidiva/perzistence, případně reziduální tkáň prostaty, byla prokázána u všech 10 pacientů. U 9 pacientů na TRUS, u jednoho, který TRUS nepodstoupil, na plánovacím CT i MRI. Fyzikální vyšetření bylo pozitivní pouze u pěti pacientů.
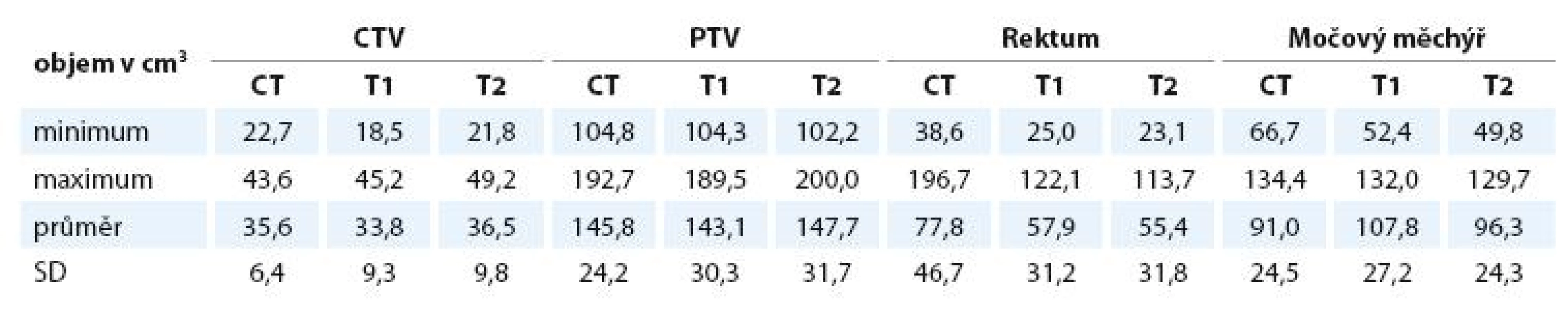
Objemy CTV ani PTV se na CT, T1 a T2 vážených obrazech statisticky významně neliší. Objem močového měchýře je signifikantně větší na T1 než na CT (p = 0,0397), na T2 se statisticky významně neliší. Objem rekta je statisticky významně menší na T1 i T2 MRI oproti CT (pro T1 i T2 p < 0,001) – viz tab. 2 a 3. Objem CTV CT je průměrně 35,6 ± 6,4 cm3, CTV T1 33,8 ± 9,3 cm3, CTV T2 36,5 ± 9,8 cm3. Objem PTV CT je 145 ± 24,2 cm3, PTV T1 143,1 ± 30,3 cm3, PTV T2 147,7 ± 31,7 cm3.
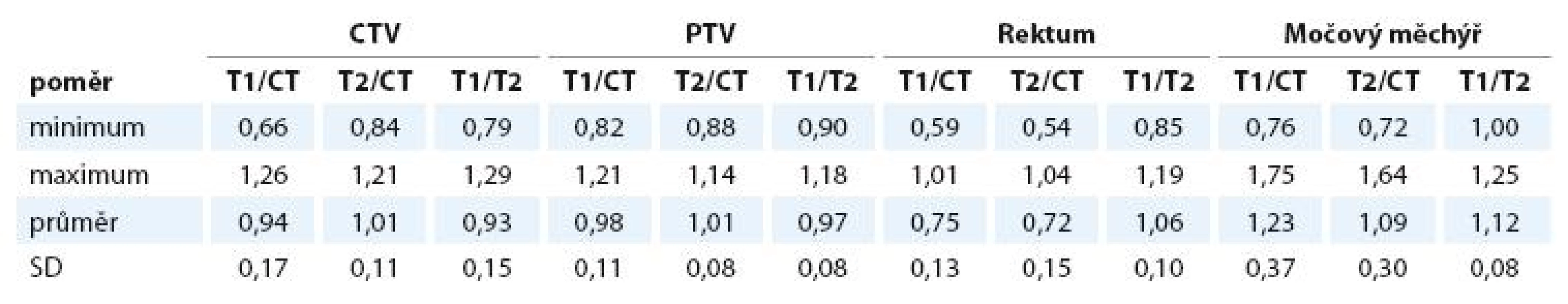
Index shody pro CTV CT/T1 je průměrně 1,51, pro CT/T2 1,61, pro T1/T2 1,46. Pro PTV jsou průměrné hodnoty indexů 1,26, 1,29 a 1,23 (tab. 4).
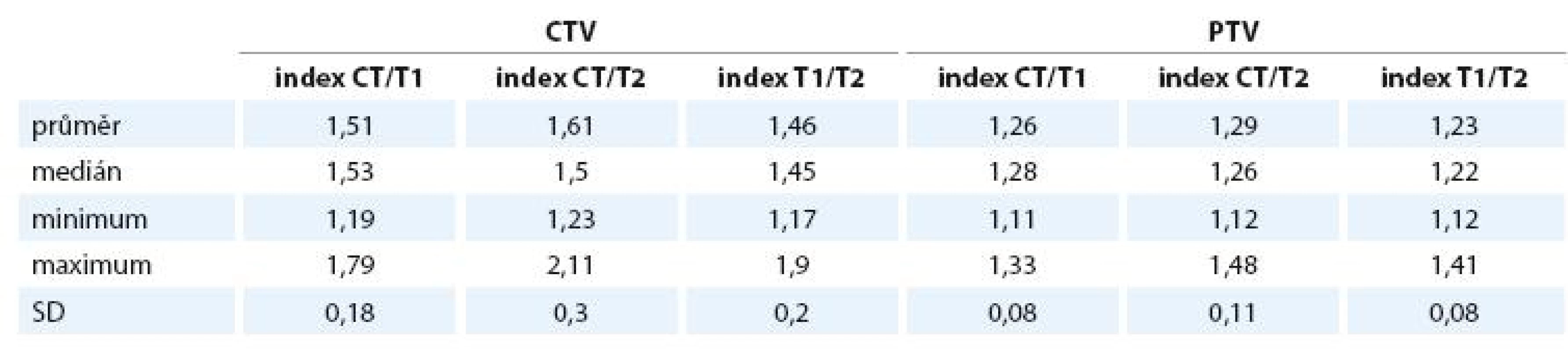
Cohenův kappa koeficient pro zakreslení CTV na plánovacím CT a T1 váženém obrazu MRI je 0,49 ± 0,18, což dle interpretační tabulky autorů Landise a Kocha značí průměrnou shodu. Kappa pro CT a T2 je 0,39 ± 0,30, což znamená shodu podprůměrnou. Kappa pro porovnání shody zakreslení na T1 a T2 váženém obrazu MRI je 0,54 ± 0,20, což značí průměrnou shodu. Kappa koeficient pro PTV se pohybuje pro všechny porovnávané objemy v oblasti značící podstatnou shodu v zakreslení (CT/T1 0,74, CT/T2 0,71 a T1/T2 0,77) – viz tab. 5.
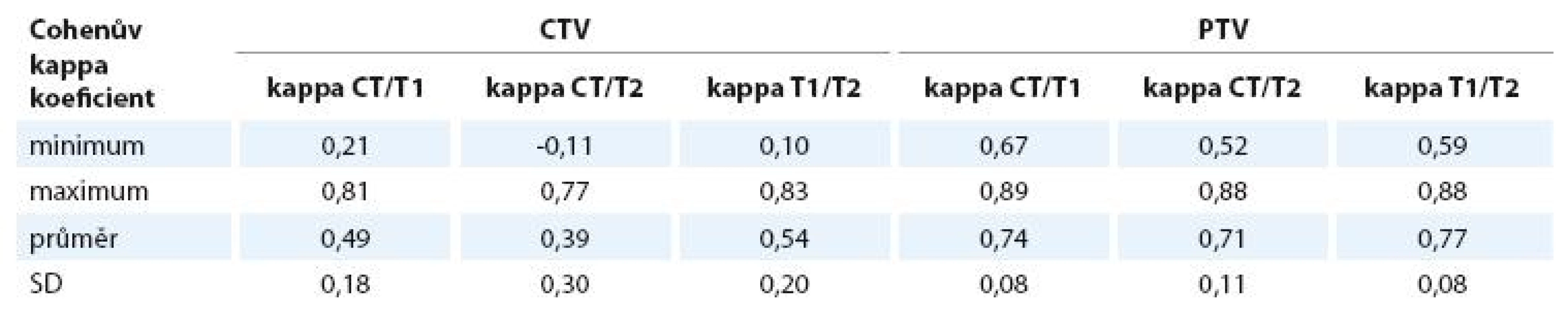
Prostorové odchylky shrnuje graf 1. Vzhledem k velikosti objemu a nepřesnosti zakreslení se dále zmiňujeme pouze o odchylkách větších než 0,10cm. Největší rozdíly jsou ve směru kraniálním, posteriorním, posterolaterálním a superioposteriorním (směry viz obr. 2). Kraniálně je objem na CT ve zvolenýchrovinách o 1–2mm větší než na T1 i T2 vážených obrazech MRI. V oblasti semenných váčků je kraniální hranice totožná na CT i MRI. Ve směru superioposteriorním je objem na CT menší než na T1 i T2 MRI, což znamená, že semenné váčky jsou na MRI zakresleny větší směrem dozadu (o 0,24cm na T1, o 0,20cm na T2). Ve směru posteriorním kontura CTV CT přibližně odpovídá kontuře CTV T1, kdežto objem CTV T2 je v tomto směru zakreslen větší (odchylka 0,29cm). Ve směru posterolaterálním je oboustranně, vpravo i vlevo, menší objem na T1 MRI než na CT.

Diskuze
Definice CTV lůžka prostaty je problematická vzhledem k časté absenci zobrazitelné recidivy, zvláště u pacientů indikovaných k adjuvantní radioterapii. MRI má pro zobrazení recidivy/perzistence vysokou senzitivitu i specificitu, a to zejména MRI s endorektální cívkou [12,13]. V našem souboru deseti pacientů byla recidiva/perzistence/reziduální prostatická tkáň na MRI viditelná u osmi, z nichž u všech byla viditelná i na plánovacím CT. Na transrektálním ultrazvuku byla recidiva popsána u všech devíti vyšetřených pacientů, jeden pacient, který nebyl pro bolestivost vyšetřen, měl pozitivní nález na MRI i CT.
Lůžko prostaty se vůči kostěným strukturám pohybuje obdobně jako prostata samotná. Z primární radioterapie karcinomu prostaty a odchylek nastavení je známo, že nastavení na kosti je méně přesné než nastavení na samotnou prostatu. Rozdíl může činit i více než 10mm [14,15], proto jsme použili fúzi na měkké tkáně v oblasti lůžka prostaty, nikoliv fúzi na kostěné struktury. Ze studií primární radioterapie karcinomu prostaty je prokázáno, že vynecháním fúze, pokud se použije plánování a simulace přímo pomocí MRI, se sníží systematická chyba během všech frakcí ozáření z 3–4mm na 2–3mm [16].
Při plánování pomocí magnetické rezonance v primární radioterapii karcinomu prostaty je objem CTV zakreslený na CT významně větší než objem zakreslený na MRI [2,4]. V práci, kterou publikovali Roach et al [2], činí rozdíl objemu CTV průměrně 32% (5–63%), v práci Rasche et al [4] je poměr objemů 1,4; to znamená, že CTV je na CT průměrně o 40% větší než na MRI, přičemž největší rozdíly jsou v oblasti baze a SV (8mm) a v oblasti apexu (6mm). Pro ozáření lůžka prostaty obdobná data zatím nejsou k dispozici. V našem souboru se objemy CTV zakreslené na CT a MRI statisticky významně neliší. Rozdílné je zakreslení močového měchýře, který je signifikantně větší na T1 než na CT, na T2 se statisticky významně neodlišuje. Rektum je na T1 i T2 MRI zakresleno menší než na CT. Důvodem může být kromě přesnější definice rekta na MRI i rozdílná náplň při plánovacích vyšetřeních, jejichž časový odstup byl průměrně jednu hodinu. Dále má jistě vliv i zvolený způsob zakreslení rizikových orgánů 10mm nad a pod hranici PTV, která se ovšem na CT, T1 a T2 obrazech různí.
V primární radioterapii prostaty se diskrepance mezi CT a MRI objevuje především v zadní části prostaty, tj. rozdílné zakreslení přední stěny rekta na CT a MRI, v posterioinferiorní apikální části, v oblasti apexu, který je rozdílně definován na CT a MRI, a v oblasti neurovaskulárního svazku [2]. Podobné závěry vyplývají i ze studie, kterou publikovali Debois et al, kteří porovnávali variabilitu mezi jednotlivými lékaři v zakreslení prostaty na CT a MRI s využitím axiálních a koronárních řezů. Variabilita je největší v oblasti apexu, a to na CT 0,54–1,07cm, na MRI je signifikantně menší, 0,17–0,25cm. V definici přední stěny rekta jsou na MRI minimální rozdíly v průběhu celé jeho délky (0,09 ± 0,02cm), kdežto na CT je poměrně stabilně zakresleno rektum v oblasti baze, u apexu se ale variabilita zvyšuje na 0,39cm. Na CT se navíc objevuje tendence zahrnovat i neurovaskulární svazek [4]. Stejně tak potvrzují problematická místa v zakreslení na CT i Smith et al, kteří opět hodnotili interpersonální variabilitu, která je na CT významně větší než na MRI. Na CT byly rozdíly v zakreslení zadní kontury prostaty, čili opět odlišení od přední stěny rekta, na MRI naopak v zakreslení přední kontury [6].
V našem souboru jsou minimální rozdíly v definici přední a laterální hranice (pouze směrem doleva je objem CTV na T1 i T2 MRI menší než na CT), což může být dáno poměrně jasnou definicí lůžka prostaty v těchto směrech, kde ohraničení nepřesahuje do kosti, objem je zakreslován v horní části kolem stěny močového měchýře, v dolní části pak kolem uretry a laterálně je celkem zřetelně ohraničen musculus obturatorius internus, do kterého nezasahuje. V kaudálním směru, tj. v definici anastomózy, se v našem souboru neobjevily významné rozdíly mezi zakreslením na CT a MRI, ačkoliv na T2 vážených obrazech je anastomóza lépe definovatelná díky hyperintenznímu zobrazení náplně močového měchýře a dobře viditelnému bulbus penis. Na T2 vážených obrazech by mělo být i lepší ohraničení od tukové tkáně v oblasti přední části prostaty a apexu [17], které se ale při zakreslení lůžka prostaty v našem souboru neprojevilo, což může být dáno posunutím tukové tkáně do původního místa prostaty [8], kde je pak tato zahrnuta do CTV na základě jeho definice pomocí jiných anatomických struktur. Mírný je rozdíl v inferioposteriorním směru, tj. v zadním ohraničení anastomózy směrem k rektu, kde na T1 je objem menší a na T2 MRI větší než na CT.
V definici zadní hranice hraje významnou roli, kromě přesnosti zakreslení, i náplň rekta. Jak ale vyplývá ze studií s primární radioterapií karcinomu prostaty [2,4,6], MRI poskytuje kontrastnější zobrazení přední stěny rekta, a to v celém jeho průběhu. Oproti tomu na CT je přední stěna rekta špatně ohraničená od prostaty/lůžka v oblasti od apexu/anastomózy až po střední část žlázy/lůžka. V našem souboru bylo na T1 MRI zakreslení CTV menší ve směru posterolaterálním vpravo i vlevo, ve směru posteriorním se od zakreslení na CT téměř neliší. Na T2 MRI je naopak objem ve směru posteriorním větší než na CT, ve směru posterolaterálním zde není rozdíl. Porovnání T1 a T2 MRI tyto rozdíly potvrzuje. CTV T2 je ve směru posteriorním i posterolaterálním větší než CTV T1, čili rektum je na T2 MRI zakresleno menší. Podíl náplně rekta na rozdílu mezi T1 a T2 MRI by měl být minoritní, neboť oba skeny T1 i T2 MRI byly získány najednou, v časovém rozmezí přibližně 10 minut a zakreslení je podobné u všech pacientů. Rozdíl může být způsoben kontrastnějším ohraničením rekta od okolní tukové tkáně na T2 MRI.
Semenné váčky bývají přítomny až u 20% pacientů po radikální prostatektomii [18], což je způsobeno rozdíly v chirurgickém přístupu. Ze studií primární radioterapie prostaty vyplývá, že zakreslení CTV v oblasti baze a SV je na CT větší než na MRI, kde je objem v této oblasti o 8mm menší než na CT [4]. V našem souboru tomu odpovídá menší rozměr CTV na T1 i T2 MRI v kraniálním i kraniolaterálním směru. Naopak ve směru superioposteriorním je objem na T1 i T2 MRI větší, to znamená, že oblast baze a zbytky semenných váčků jsou zakresleny více dozadu než na CT. Zde by důvodem opět mohlo být rozdílné zakreslení rekta na MRI a CT.
Indexy shody se pro CTV i PTV statisticky významně odlišují od jedné, což při stejné velikosti objemů znamená, že tyto jsou vůči sobě vzájemně posunuty. Hodnoty v našem souboru se pohybují v rozmezí 1,46–1,61. Pro porovnání uvádíme indexy shody v práci Rasche et al [4], kteří porovnávali variabilitu v zakreslení prostaty mezi více pozorovateli na CT a MRI.
Objem prostaty zakreslený na CT byl přibližně 1,5krát větší než na MRI, index shody mezi zakreslením na CT a MRI pro 3 zúčastněné pozorovatele byl 2,5, 2,3 a 2,6. Indexy pro rozdíly mezi jednotlivými pozorovateli byly 1,5 pro CT, transverzální a koronární MRI a 1,7 pro sagitální MRI.
Rozdílnost objemů v našem souboru podporují i hodnoty kappa koeficientů, které se pohybují od 0,39 do 0,54 a značí průměrnou až podprůměrnou shodu v zakreslení CTV, což je obdobná shoda, jakou pozorovali Michalski et al v zakreslení lůžka prostaty na CT více radiačními onkology, kteří zakreslovali objem u dvou daných pacientů v rámci tvorby doporučení RTOG pro zakreslení lůžka prostaty [19].
Rozdíly indexů i kappa koeficientů pro PTV oproti CTV jsou způsobeny velikostí objemu. Největší odlišnosti jsou mezi CT a T2 MRI, nejmenší rozdíly nalezneme, jak lze předpokládat, mezi zakreslením na T1 a T2 MRI.
Závěr
Předběžné výsledky našeho výzkumu naznačují, že klinický cílový objem definovaný pomocí MRI je posunut vůči objemu definovanému na plánovacím CT. Oba bezpečně zahrnují (na základě definice CTV a dobře provedené fúze) oblast nejčastějšího výskytu lokálních recidiv, tj. oblast kolem vezikouretrální anastomózy a krčku močového měchýře. Shoda v zakreslení CTV jedním radiačním onkologem je průměrná až podprůměrná, relativně obdobná jako shoda mezi více radiačními onkology, popisovaná v literatuře pro zakreslení samotné prostaty i lůžka prostaty, lepší než shoda mezi zakreslením prostaty na CT a MRI v primární radioterapii. MRI poskytuje kontrastnější zobrazení přední stěny rekta, kde jsme potvrdili největší rozdíly v zakreslení, analogické primární radioterapii karcinomu prostaty. Dále poskytuje lepší zobrazení lokálních recidiv a semenných váčků, kde se v našem souboru též vyskytly největší rozdíly ve srovnání s plánovacím CT.
Článek
vznikl za podpory Grantové agentury Univerzity Karlovy pod číslem
104909.
This
work was supported by the Charles University Grant Agency under
grant No. 104909.
Autoři
deklarují, že v souvislosti s předmětem studie nemají žádné
komerční zájmy.
The
authors declare they have no potential conflicts of interest
concerning drugs, products, or services
used in the study.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do biomedicínských
časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform
requirements” for biomedical papers.
MUDr. Jana Šefrová
Klinika
onkologie a radioterapie
FN
Hradec Králové
Sokolská
581
500
05 Hradec Králové
e-mail:
sefrova@fnhk.cz
Sources
1. Khoo VS, Padhani AR, Tanner SF et al. Comparison of MRI with CT for the radiotherapy planning of prostate cancer: a feasibility study. Br J Radiol 1999; 72(858): 590 – 597.
2. Roach M 3rd, Faillace - Akazawa P, Malfatti C et al. Prostate volumes defined by magnetic resonance imaging and computerized tomographic scans for three - dimensional conformal radiotherapy. Int J Radiat Oncol Biol Phys 1996; 35(5): 1011 – 1018.
3. Villeirs GM, L Verstraete K, De Neve WJ et al. Magnetic resonance imaging anatomy of the prostate and periprostatic area: a guide for radiotherapists. Radiother Oncol 2005; 76(1): 99 – 106.
4. Rasch C, Barillot I, Remeijer P et al. Definition of the prostate in CT and MRI: a multi‑observer study. Int J Radiat Oncol Biol Phys 1999; 43(1): 57 – 66.
5. Debois M, Oyen R, Maes F et al. The contribution of magnetic resonance imaging to the three - dimensional treatment planning of localized prostate cancer. Int J Radiat Oncol Biol Phys 1999; 45(4): 857 – 865.
6. Smith WL, Lewis C, Bauman G et al. Prostate volume contouring: a 3D analysis of segmentation using 3DTRUS, CT, and MR. Int J Radiat Oncol Biol Phys 2007; 67(4): 1238 – 1247.
7. Wiltshire KL, Brock KK, Haider MA et al. Anatomic boundaries of the clinical target volume (prostate bed) after radical prostatectomy. Int J Radiat Oncol Biol Phys 2007; 69(4): 1090 – 1099.
8. Allen SD, Thompson A, Sohaib SA. The normal post‑surgical anatomy of the male pelvis following radical prostatectomy as assessed by magnetic resonance imaging. Eur Radiol 2008; 18(6): 1281 – 1291.
9. Poortmans P, Bossi A, Vandeputte K et al. EORTC Radiation Oncology Group. Guidelines for target volume definition in post‑operative radiotherapy for prostate cancer, on behalf of the EORTC Radiation Oncology Group. Radiother Oncol 2007; 84(2): 121 – 127.
10. Cohen J. A coefficient of agreement for nominal scales. Educational and Psychological Measurement 1960; 20(1): 37 – 46.
11. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics 1977; 33(1): 159 – 174.
12. Sella T, Schwartz LH, Swindle PW et al. Suspected local recurrence after radical prostatectomy: endorectal coil MR imaging. Radiology 2004; 231(2): 379 – 385.
13. Silverman JM, Krebs TL. MR imaging evaluation with a transrectal surface coil of local recurrence of prostatic cancer in men who have undergone radical prostatectomy. AJR Am J Roentgenol 1997; 168(2): 379 – 385.
14. Meijer GJ, de Klerk J, Bzdusek K et al. What CTV - to - PTV margins should be applied for prostate irradiation? Four - dimensional quantitative assessment using model‑based deformable image registration techniques. Int J Radiat Oncol Biol Phys 2008; 72(5): 1416 – 1425.
15. Wong JR, Gao Z, Uematsu M et al. Interfractional prostate shifts: review of 1870 computed tomography (CT) scans obtained during image - guided radiotherapy using CT - on - rails for the treatment of prostate cancer. Int J Radiat Oncol Biol Phys 2008; 72(5): 1396 – 1401.
16. Nyholm T, Nyberg M, Karlsson MG et al. Systematisation of spatial uncertainties for comparison between a MR and a CT‑based radiotherapy workflow for prostate treatments. Radiat Oncol 2009; 4 : 54.
17. McLaughlin PW, Narayana V, Drake DG et al. Comparison of MRI pulse sequences in defining prostate volume after permanent implantation. Int J Radiat Oncol Biol Phys 2002; 54(3): 703 – 711.
18. Sella T, Schwartz LH, Hricak H. Retained seminal vesicles after radical prostatectomy: frequency, MRI characteristics, and clinical relevance. AJR Am J Roentgenol 2006; 186(2): 539 – 546.
19. Michalski JM, Lawton C, El Naqa I et al. Development of RTOG consensus guidelines for the definition of the clinical target volume for postoperative conformal radiation therapy for prostate cancer. Int J Radiat Oncol Biol Phys 2010; 76(2): 361 – 368.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2010 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- ABL1, SRC a další nereceptorové tyrozinkinázy jako nové cíle specifické protinádorové léčby
- Kožní karcinom z Merkelových buněk
- Molekulární prediktory u nádorů hlavy a krku
- Cílená léčba bronchioloalveolárního karcinomu inhibitory tyrozinkinázové aktivity EGFR: přehled literatury a kazuistika klinicky promptní a výrazné odpovědi na léčbu erlotinibem
- Bortezomib v léčbě mnohočetného myelomu u pacientů po alogenní transplantaci krvetvorných buněk
- Pozdní následky Wilmsova tumoru a jeho léčby u pacientů léčených v letech 1980– 2001 na jediném pracovišti
- Změny cílových objemů při použití magnetické rezonance pro plánování radioterapie lůžka prostaty – předběžné výsledky
- Diseminovaný karcinóm prsníka u 28- ročného muža
- Malignity žlučových cest
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Kožní karcinom z Merkelových buněk
- Diseminovaný karcinóm prsníka u 28- ročného muža
- Malignity žlučových cest
- Cílená léčba bronchioloalveolárního karcinomu inhibitory tyrozinkinázové aktivity EGFR: přehled literatury a kazuistika klinicky promptní a výrazné odpovědi na léčbu erlotinibem
