Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí
Diagnostic Pitfalls of HIV ‑ Associated Kaposi Sarcoma
Kaposi sarcoma was one of the very first diseases which indicated the advent of the AIDS pandemic. Despite the marked fall in its occurrence thanks to the introduction of the cART, Kaposi sarcoma remains the most frequent tumour in HIV ‑ positive patients and still represents a major diagnostic and therapeutic problem. Particularly in the early stages both the macroscopic and histopatological picture of Kaposi sarcoma may be very atypical, which can cause diagnostic difficulties right at the time when an early therapy may be most successful. In order to improve both the diagnostics and therapy of Kaposi sarcoma, close collaboration between physicians taking care of HIV ‑ positive patients – mainly infectologists, dermatologists and pathologists, is necessary.
Key words:
Kaposi sarcoma – HIV – AIDS – histopathology – differential diagnosis
:
D. Vaňousová 1; D. Jilich 2; L. Machala 3,4; M. Hósová 5; L. Pock 6; H. Rozsypal 2; Staňková M. Hercogová J. 7 1
:
Dermatovenerologická klinika FN Na Bulovce, Praha
1; Klinika infekčních a tropických nemocí, 1. LF UK v Praze a FN na Bulovce, Praha
2; 1. infekční klinika 2. LF UK a IPVZ, Praha
3; Patologicko‑anatomické oddělení FN Na Bulovce, Praha
4; Klinika infekčních nemocí, 3. LF UK, Praha
5; Dermatohistopatologická laboratoř s. r. o., Praha
6; Infekční klinika FN Na Bulovce, Praha
7
:
Klin Onkol 2010; 23(5): 285-292
:
Reviews
Kaposiho sarkom byl jedním z prvních onemocnění, které upozornilo na příchod pandemie AIDS. Přes výrazný pokles výskytu díky zavedení kombinované antiretrovirové terapie zůstává Kaposiho sarkom nejčastějším oportunním tumorem postihujícím HIV pozitivní pacienty a stále představuje značný diagnostický i terapeutický problém. Zvláště v počátečních stadiích může být jak makroskopický, tak i histopatologický obraz Kaposiho sarkomu netypický, což může vést k diagnostickému omylu v době, kdy je největší naděje na úspěch léčby. Aby se zlepšila diagnostika i terapie Kaposiho sarkomu u osob s HIV infekcí, je nutná úzká spolupráce odborníků poskytujících těmto osobám zdravotní péči, především infektologů, dermatologů a patologů.
Klíčová slova:
Kaposiho sarkom – HIV – AIDS – histopatologie – diferenciální diagnóza
Úvod
Kaposiho sarkom (KS, též haemangioma haemorrhagicum multiplex) je multifokální systémové onemocnění projevující se maligními vaskulárními nádory. Náhlé zvýšení výskytu KS počátkem 80. let minulého století bylo jedním z prvních signálů příchodu nového onemocnění AIDS [1–3].
Poprvé byl KS popsán vídeňským dermatologem Moritzem Kohnem Kaposim v roce 1872 jako tzv. idiopatický mnohočetný pigmentovaný sarkom. Byl dlouho považován za raritní tumor postihující především starší muže z oblasti východní Evropy a Středozemí [4,5].
V současné době se rozlišují čtyři klinické varianty KS [6]. Klasický KS (idiopatický) se vyskytuje u osob pocházejících z východní Evropy a Středozemí. Muži jsou postiženi 10–15krát častěji než ženy, věk pacientů je obvykle nad 50 let. Klinický obraz tvoří noduly a ložiska převážně na dolních končetinách a doba přežití je 10–20 let [7,8]. Endemický (africký) KS domorodých obyvatel centrální Afriky se vyskytuje zvláště u mladších dospělých jedinců a má podobný průběh jako klasický KS, ovšem u dětských pacientů bývá často pozorována fulminantní forma onemocnění klinicky připomínající lymfom [9,10]. Iatrogenní KS postihuje imunosuprimované osoby, zejména po transplantaci [11]. Poslední variantou je KS sdružený s HIV infekcí, který bývá přítomen především u mužů s homosexuální orientací. V současné době se jedná o nejčastější typ KS [12,13].
KS začala být systematicky věnována větší pozornost až od doby vzniku pandemie AIDS, kdy se KS stal nejčastější malignitou sdruženou s tímto onemocněním. Jeho výskyt byl tehdy u těchto pacientů přibližně 20 000krát častější v porovnání s ostatní populací a asi 300krát častější než u osob s jinými typy imunodeficitu [14]. Od zavedení kombinované antiretrovirové terapie (combination antiretroviral therapy – cART) v polovině 90. let minulého století výskyt KS sice poklesl o více než 90%, přesto diagnostika i léčba zůstává spojena s řadou problémů [12,15,16].
V České republice je dosud prevalence i incidence HIV infekce poměrně nízká, podle údajů Národní referenční laboratoře pro AIDS Státního zdravotního ústavu Praha bylo k 31. 12. 2009 potvrzeno celkem 1 344 případů HIV infekce (1 071 mužů a 273 žen) [17]. Také výskyt KS je u HIV pozitivních osob dosud nízký – v AIDS Centru FN Na Bulovce, kde je dispenzarizována naprostá většina HIV pozitivních osob (k 31. 12. 2009 kumulativní počet celkem 816 osob), byl dosud KS diagnostikován u celkem 10 osob [18]. Protože jsme se však při péči o HIV pozitivní pacienty AIDS Centra FN Na Bulovce opakovaně setkali s obtížemi při hodnocení jak makroskopického, tj. klinického, tak i mikroskopického obrazu KS, dovolujeme si v následujícím textu předložit přehled některých problémů spojených s diagnostikou KS a doprovodit jej kazuistikou z naší praxe.
Etiologie a patogeneze
Za původce všech forem KS je považován lidský herpetický virus 8 (HHV 8) [19–23]. Pro účast viru HHV 8 na vzniku KS svědčí také výrazně vyšší výskyt sérových protilátek proti HHV 8 u osob s KS [24]. Samotná infekce HHV 8 však není dostačující k rozvoji KS, důležitou roli hraje imunitní stav pacienta a v samotné tumorogenezi chronický zánět [25]. HHV 8 infikuje endoteliální buňky lymfatických i krevních cév [26]. Zánětlivě změněné buňky pod vlivem infekce HHV 8 produkují určité prozánětlivé mediátory a angiogenní cytokiny, jako např. IL 6 nebo chemokiny, jejichž receptory jsou přítomny na povrchu vřetenitých buněk cév. Velký význam v rozvoji KS má virový receptor G (G protein Coupled Receptor – vGPCR), který indukuje řadu signálních molekul, jež vedou k produkci dalších cytokinů, jako např. interleukinů IL 1β, IL 2, IL 8, dále TNF α, adhezních molekul VCAM 1, ICAM 1 a E selektinu [27–29]. Tato neustávající produkce vycházející z nádorové tkáně má za následek proliferaci a lymfocytární infiltraci [30]. Tyto lymfocyty produkují další cytokiny, chemokiny, enzymy a růstové faktory, které podporují růst buněk infikovaných HHV 8 a zároveň se podílejí na progresi KS. Koinfekce HIV s HHV 8 synergisticky podporuje tumorogenezi jak nepřímo ovlivněním imunitního systému, tak stimulací proliferace endotelových buněk účinkem Tat proteinů viru HIV [31].
Významným faktorem vzniku KS je snížení obranyschopnosti organizmu, ovšem výskyt u HIV pozitivních pacientů není striktně vázán na stav hlubokého imunodeficitu [32]. KS se objevuje často již při poklesu CD4+ T lymfocytů pod 300/μl, nebo dokonce i pod 400/μl [33]. Paradoxně může dojít k rozvoji KS také v rámci tzv. IRIS (immune reconstitution inflammatory syndrome) v souvislosti s úspěšným zahájením terapie cART [34]. IRIS je zvláštní typ patologické prudké zánětlivé reakce, která způsobuje zhoršení preexistujících latentních oportunních infekcí či nádorů, jako je KS či lymfom [35,36]. Mechanizmus vzniku IRIS není dosud zcela jasný, příčinou je pravděpodobně robustní imunologická odpověď podmíněná prudkým zlepšením funkce celulární imunity vedoucí k lokální nebo systémové intenzivní zánětlivé reakci na preexistující latentní noxu [37,38].
Klinický obraz
KS je maligní neoplazie s mnohočetnými vaskulárními kožními a slizničními uzly, které se vyskytují též v lymfatických uzlinách a orgánech [39]. Průběh onemocnění je rozmanitý, od ojedinělých kožních lézí až k rychle progredujícímu diseminovanému onemocnění kůže, sliznic a orgánů. Kožní projevy KS postupně procházejí stadiem makulózním, plakovým a tumorózním [40]. Nejprve se na kůži objevují diskrétní světle červené až lividní skvrny (makuly) oválného či nepravidelného tvaru v liniích štěpitelnosti kůže, často symetricky bilaterálně na dolních končetinách. Tyto skvrny se postupně vyvyšují nad niveau kůže a přecházejí v plaky, které progredují v uzly (noduly). Projevy se zvětšují plošně i do hloubky, mohou splývat a formovat se v tumorózní masy. Tato stadia jsou identická pro kožní i slizniční léze. U stejné osoby mohou být ve stejné době různé léze v různých stadiích, v určitých případech lze nalézt více než jedno stadium u jedné samotné léze. Projevy jsou palpovatelné již od makulózního stadia. Barva projevů zahrnuje poměrně širokou škálu od světle červené přes sytě červenou, tmavě modrou, červenohnědou až po lividní či lividněčernou. Hnědavé zbarvení bývá často na dolních končetinách a je dáno ukládáním hemosiderinu ve tkáni tumoru. Na povrchu kožních lézí bývají přítomny hemoragie, teleangiektazie, eroze, ulcerace, hyperkeratózy. Léze se mohou iniciálně objevovat v místech traumatu, což je charakteristické zejména pro akrální lokalizace [40].
Podle míry agresivního chování tumoru rozlišujeme KS lokalizovaný, lokálně agresivní a generalizovaný lymfadenopatický. Lokalizovaný KS se může chovat lokálně agresivním způsobem a penetrovat k hlouběji uloženým anatomickým strukturám včetně kostí [12]. Na rozdíl od lokalizovaného KS je lokálně agresivní KS nedestruktivní. Lymfadenopatický KS je klinicky agresivní forma asociovaná s postižením lymfatických uzlin a kůže.
Prvními projevy KS u HIV pozitivních pacientů jsou obvykle mnohočetné noduly na horní polovině těla, hlavě a krku s tendencí rozvinout se rychle na kůži i na sliznicích a postupně diseminovat do orgánů. To vede k orgánové dysfunkci a mortalitě. Velikost projevů bývá od několika milimetrů až do několika centimetrů. Projevy nesvědí, mohou být však palpačně citlivé. Postižena může být kterákoliv část kožního povrchu, predilekční oblastí je obličej, zvláště nos, dále trup, genitál a končetiny. Projevy v obličeji vedou ke kosmeticky závažným deformitám. Na končetinách mohou být příčinou poruchy funkce. Další komplikací je riziko vzniku lymfedému. Modré až lividní makuly, plaky a tumory se často vyskytují na orální a konjunktivální sliznici. Na kůži penisu se KS může projevovat jako solitární necharakteristické ložisko [41]. KS u HIV pozitivních pacientů často postihuje lymfatické uzliny a z vnitřních orgánů plíce a gastrointestinální trakt, ovšem izolované postižení vnitřních orgánů bez přítomnosti kožních projevů se objevuje zřídka [42–44]. Metastázy do CNS jsou vzácné [45,46]. Výjimečně může dojít ke spontánnímu vymizení kožní léze, která pak zanechává pigmentovanou jizvu [47].
Histopatologie
KS je multifokální neoplastický proces vycházející z cévních a lymfatických endotelií, které se nacházejí převážně v dermis. Histopatologický obraz KS se významně neliší v klinických varietách, ale liší se podle stadia léze [48].
Makulární stadium je charakterizováno superficiální dermální proliferací malých kapilár, které jsou ohraničené nenápadnými endoteliálními buňkami. Může se jednat i o proliferaci lymfatických cév. Charakteristickým znakem je tzv. „promotory sign“, který lze charakterizovat jako vsunování původních krevních cév a struktur kožních adnex do novotvořených cév. Tyto novotvořené kapiláry mohou rozvolňovat kolagenní vlákna, často je přítomný zánětlivý infiltrát s lymfocyty a plazmatickými buňkami, nalézány mohou být též extravazální erytrocyty a hemosiderin, hnědý pigment z rozpadlých erytrocytů. V pozdějším makulárním stadiu nacházíme novotvořené cévy, které jsou rozeklané, mají silnější cévní stěnu a obraz připomíná granulační tkáň [49].
Ve stadiu plaků dochází k výraznější vaskulární proliferaci, která prostupuje do hlubších částí dermis, někdy až do podkoží. Vřetenité buňky, které exprimují endoteliální markery (CD31 a CD34), se nacházejí ve stromatu mezi novotvořenými abnormálními cévami a jsou pravděpodobně klíčové pro tumorogenezi KS. Již v tomto stadiu, častěji u HIV pozitivních pacientů, nacházíme intracytoplazmatické hyalinní PAS pozitivní globule, které vznikají při degradaci erytrocytů. Vřetenité buňky proliferují, nahrazují kolagen v dermis a projevy se mění v nodulární. Buněčný pleomorfizmus a mitotické figury chybí [50].
Pro nodulární stadium KS jsou charakteristické dobře ohraničené uzly tvořené vaskulárními prostory, které připomínají plástev. Krví vyplněné štěrbiny jsou stlačené těsně k sobě („back to back“) a jsou lemované nevinně vyhlížejícími vřetenitými buňkami a hemosiderinovými depozity. V okolí se nacházejí lymfocyty a plazmatické buňky. Jádra vřetenitých buněk jsou oválná či plochá, jsou uložena v podélné ose buněk, obsahují jemný chromatin a mají nenápadná jadérka. Nukleární atypie nejsou přítomné, mitotická aktivita buněk je nevýznamná, přítomné jsou hyalinní globule velikosti 1–7 μm uložené intracelulárně a extracelulárně, epidermis a kožní adnexa zůstávají intaktní [50].
Agresivní léze pozdního stadia rozvinutého KS vykazují sarkomatózní charakter s redukcí či absencí vaskulární komponenty, vřetenité buňky vykazují vyšší stupeň atypií co do velikosti, tvaru a jaderných charakteristik s častými mitózami [51].
Diagnóza
KS je třeba diferenciálně diagnosticky zvažovat při nálezu diskrétních červených až lividních nepravidelných skvrn, papul a uzlů lokalizovaných nejčastěji na horní polovině trupu, na genitálu, na dolních končetinách. Papuly až noduly mohou být prvními klinickými projevy HIV infekce, se kterými pacient přichází k lékaři.
Ve srovnání s ostatními AIDS asociovanými tumory, které se vyskytují až ve fázi hlubšího imunodeficitu, se KS objevuje časněji, někdy již při poklesu CD4+ T lymfocytů k hodnotám kolem 300–400 buněk/μl, výjimkou ale nejsou ani případy, kdy se KS objeví i při výrazně vyšších počtech CD4+ T lymfocytů [52–55].
Na postižení vnitřních orgánů upozorní příslušné příznaky, při postižení GIT např. hematemeza, meléna či enteroragie, při plicním postižení hemoptýza, chronický kašel, dušnost či progredující respirační selhání. Přítomnost lézí ve vnitřních orgánech odhalí vyšetření zobrazovacími metodami či endoskopie, která však může být riskantní z důvodu nebezpečí krvácení slizničních lézí. V krvi pacientů s KS a v lézích je možno prokazovat přítomnost HHV 8 pomocí PCR metody [56–59].
Typickými rysy KS je postupný vývoj kožní léze – z makuly vzniká plak, uzlík a uzel, charakteristická barva a multifokální distribuce. Na končetinách se projevy někdy vyskytují symetricky. Klíčem k určení diagnózy je histopatologické vyšetření bioptického vzorku léze erudovaným histopatologem. Bioptický vzorek lze získat excizí z kůže a sliznice, exstirpací suspektních zvětšených lymfatických uzlin nebo biopsií měkkých tkání. Je třeba mít na paměti, že v místě jizvy po excidovaném projevu KS může dojít k recidivě [43].
Terapie
Prevence vzniku KS u HIV pozitivních pacientů spočívá především v úpravě imunodeficitu pomocí včasně zahájené cART. Základem léčby KS je kombinace cART a lokální nebo systémové protinádorové terapie podle stadia a rozsahu lézí [60]. Ve stadiu superficiálních projevů – makul a plaků – lze k odstranění použít kryoterapii (tekutý dusík o teplotě –197 °C), po jejíž aplikaci dojde k nekróze, která se zhojí jizvou. Možná je i fotodynamická terapie (aplikujeme fotosenzibilizátor a viditelné světlo 630 nm), cévní laser či lokální léčba tretinoinem (0,1% gel). U izolovaných lézí je možné i chirurgické odstranění. Radioterapie měkkým zářením je vhodná u pacientů s mnohočetnými, ale relativně lokalizovanými projevy KS. Aplikují se jednotlivé dávky záření (8–12 Gy) jednou týdně po dobu 6–8 týdnů [61]. Další možností je intralezionální aplikace vinkristinu [62].
Celkové podávání chemoterapie je indikováno u pacientů s rozsáhlejším kožním (> 25 lézí) nebo viscerálním postižením. Doporučenými chemoterapeutiky jsou pegylovaný lipozomální doxorubicin (20mg/m2 každé 3 týdny i.v.), lipozomální daunorubicin (40mg/m2 každé 2–3 týdny i.v.), paclitaxel (135mg/m2 každé 3 týdny i.v.) nebo interferon-α v různých dávkách, např. 20–30 mil. IU/den s.c. po dobu 12 týdnů, možné je i podávání nižších dávek po delší dobu [33,63–66].
Prognóza pacientů s izolovanými kožními lézemi KS, kteří mohou být léčeni cART, je vcelku příznivá a může dojít i ke kompletní remisi tumoru. Naproti tomu prognóza u pacientů s viscerálním postižením, zvláště mnohočetným, je značně nepříznivá [67–69].
Kazuistika
U 32letého muže homosexuální orientace, který měl poslední negativní výsledek HIV testu v roce 1999, byla HIV infekce diagnostikována v únoru 2007. Test byl proveden na jeho vlastní žádost.
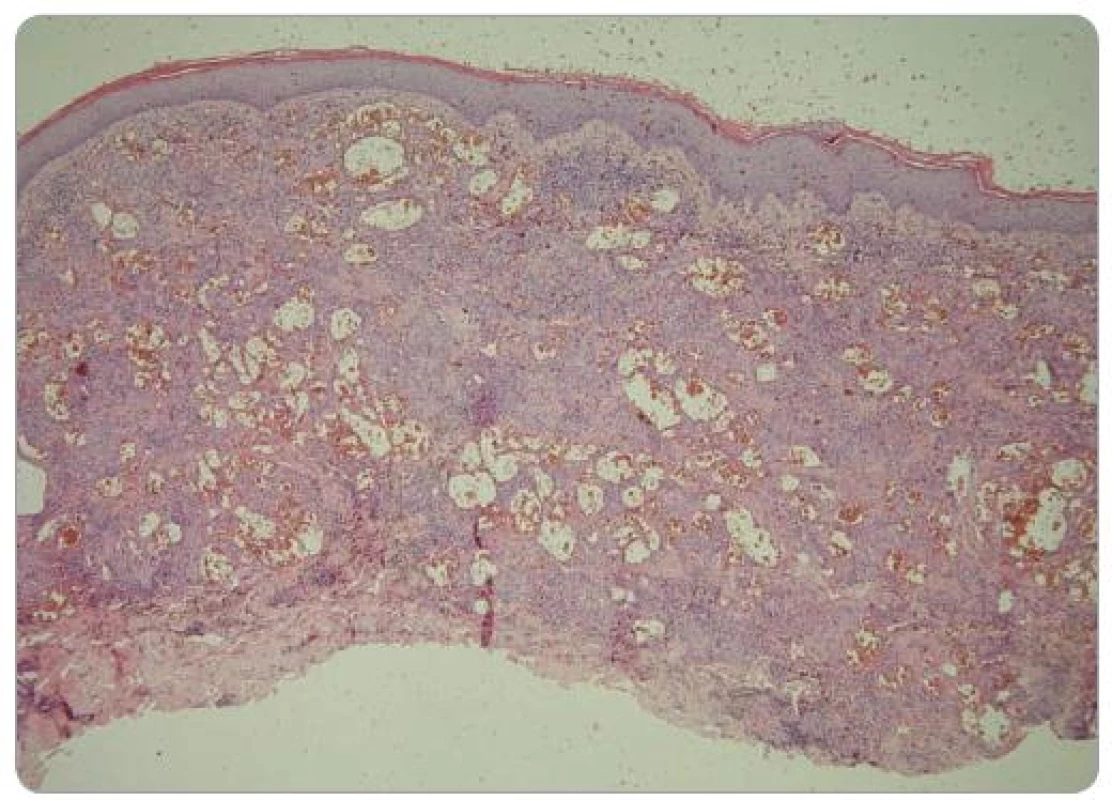
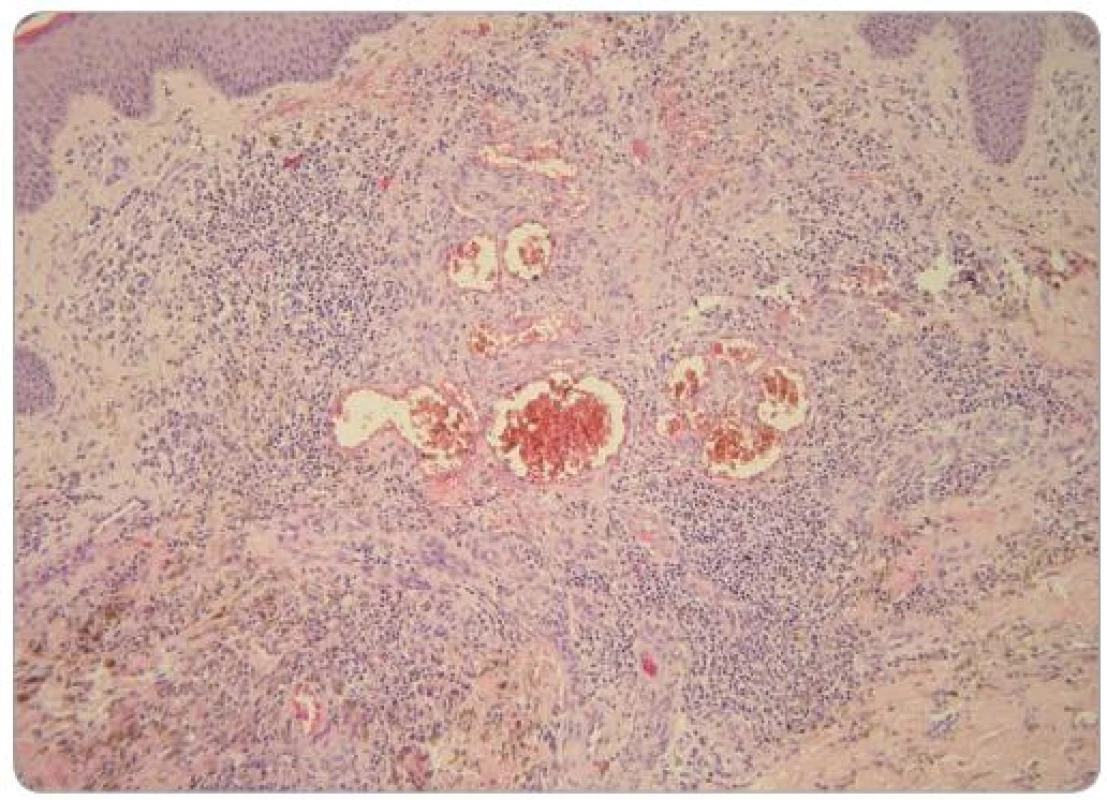
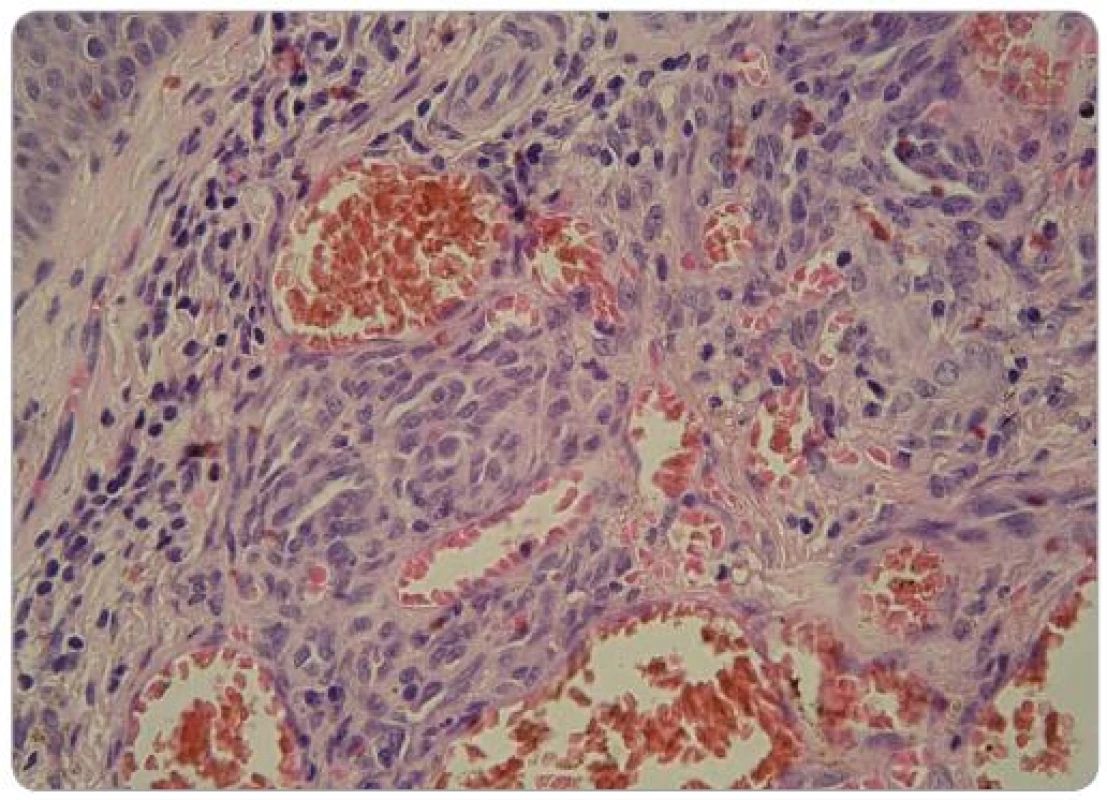
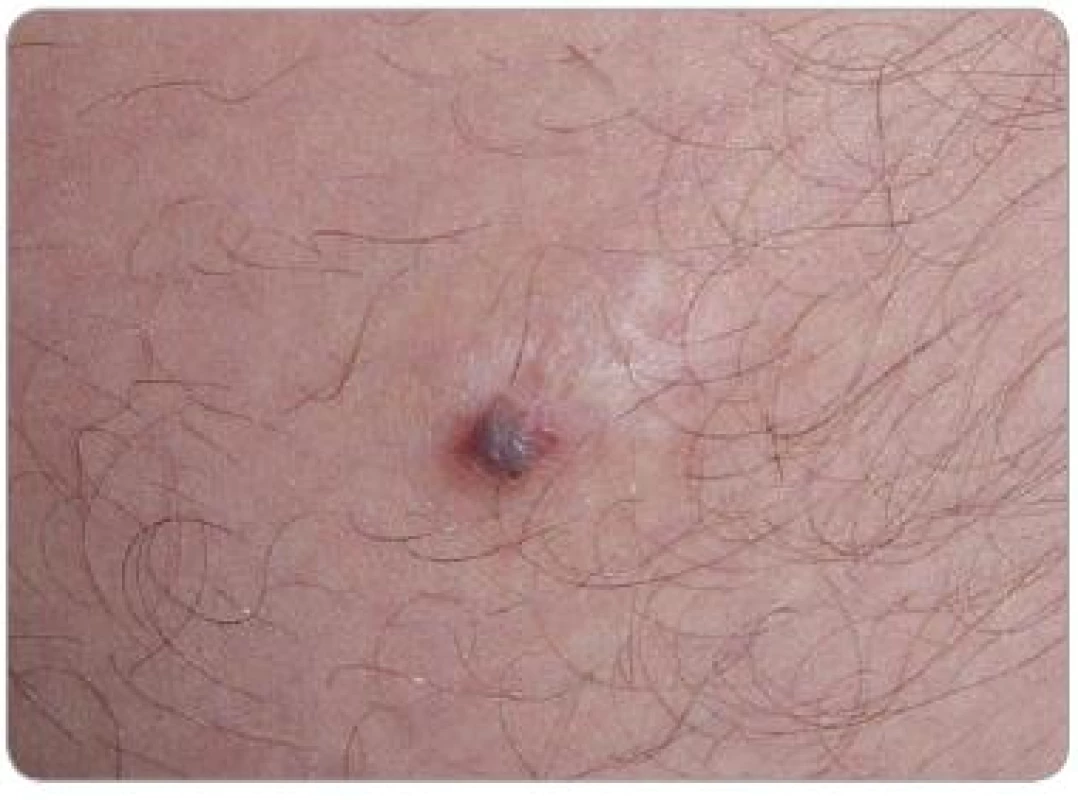
V době zjištění HIV infekce byl pacient bez klinických projevů onemocnění, počet CD4+ T lymfocytů byl 310/µl a virová nálož HIV RNA byla 37 500 kopií/ml. Pacientovi bylo doporučeno zahájit cART, kterou odmítl, ale pravidelně docházel na kontroly v AIDS Centru FN Na Bulovce. V červenci 2008 byla při pravidelné dispenzární kontrole zjištěna přítomnost suspektních kožních lézí na trupu, předkožce, 3. prstu levé horní končetiny, zadní straně stehna levé dolní končetiny a na gingivě. Na kůži se jednalo o papuly červenolividní barvy velikost lézí byla V-7, na gingivě bylo nepravidelné ložisko velikosti 8mm. Aktuální počet CD4+ T lymfocytů byl 348/µl a virová nálož HIV RNA 49 500 kopií/ml. Pro klinické podezření na KS bylo pacientovi doporučeno bioptické vyšetření, které odmítl. Souhlasil však se zahájením cART standardní kombinací emtricitabin + tenofovir + lopinavir boostovaný ritonavirem. Do ledna 2009 vzrostla hodnota CD4+ T lymfocytů na 473/µl a došlo ke kompletní regresi projevu na gingivě a na předkožce. Léze na hrudi se zmenšila, ložiska na 3. prstu levé horní končetiny a na levém stehně zůstala stacionární. Vzhledem k přetrvávajícím projevům na končetinách pacient souhlasil s bioptickým vyšetřením. Byla provedena totální excize tužší papule lividní barvy velikosti 7mm na stehně levé dolní končetiny. Bioptické vyšetření (obr. 1–3) bylo hodnoceno jako hemangiom. V dalším průběhu se vytvořily nové léze v jizvě z mládí na vnitřní straně stehna (obr. 4) a v pravé kubitě. Pro jednoznačné klinické podezření na KS bylo indikováno druhé histopatologické čtení, které potvrdilo diagnózu incipientního nodulárního KS. Následně byla za pokračování cART zahájena kryoterapie tekutým dusíkem, která byla po dobu jednoho měsíce aplikována v týdenním a posléze ve 14denním odstupu. Efekt léčby byl dobrý, po sedmi aplikacích došlo ke zhojení všech projevů jizvami (obr. 5). V současné době pacient pokračuje v antiretrovirové terapii, kterou toleruje velmi dobře, a nové projevy KS se netvoří.
Diskuze
Klinická diferenciální diagnostika KS zahrnuje nejčastěji hemangiomy a angiosarkomy. V časných stadiích se klinické projevy nejsnáze zamění za traumatické hematomy, ekchymózy (červené lividní až modrofialové skvrny vzniklé krvácením do kůže) či eflorescence vzniklé po poštípání hmyzem (většinou mnohočetné červené skvrny až pomfy s patrným centrálním vpichem) [70]. Časné stadium KS může připomínat též granuloma anulare, zejména diseminovanou formu s tvorbou hnědolividních makul, které jeví tendenci ke splývání. Histopatologicky nacházíme v lézi granuloma anulare nekrobiotické granulomy, shluky histiocytů v těsné blízkosti degenerovaného vaziva.
Ojedinělé léze mohou být klinicky mylně diagnostikovány jako benigní vaskulární proliferace. Většinou pozorujeme mnohočetné červené až fialové papuly, které se vyskytují často na dolních končetinách, jedná se však o tenkostěnné cévní malformace. Mezi další nádory, které mohou připomínat KS, patří benigní kapilární hemangiom, který tvoří většinou mnohočetné světle až tmavočervené papuly do velikosti 6mm. Hemangiomy se nacházejí převážně na trupu, histopatologicky se jedná o seskupení nově vzniklých kapilár subpapilárního plexu. Podobně vypadají i verukózní angiomy, zvláštní formy hemangiomů, které pod kůží prosvítají červeně až modře, jde o venózně arteriální cévní konvoluty. Angiosarkom je vysoce maligní neoplazie endoteliálního původu, která se klinicky manifestuje jako lividní skvrna na obličeji. Starší projevy mají fialové zbarvení. Histopatologicky je charakteristická endoteliální atypie a mitotická aktivita, která chybí u KS [71,72]. Pyogenní granulom (lobulární hemangiom) je další afekcí zaměnitelnou za KS. Je to sytě červený, polokulovitý, rychle rostoucí nádor, nachází se většinou na akrech ve spojitosti s předchozím traumatem. Histopatologicky je typická kapilární proliferace a leukocytární infiltrace s erozí na povrchu. Podobně může vyhlížet také histiocytom – solitární či mnohočetný projev hnědé až lividní barvy, jeví se jako v kůži hmatná papule a vyskytuje se u mladších lidí, nejčastěji na dolních končetinách. Vzniká jako reaktivní zánět po štípnutí hmyzem. Histopatologicky se jedná o neostře ohraničené nahromadění histiocytů a fibroblastů [73]. KS mohou připomínat i nevoidní afekce, např. névy u pacientů se syndromem dysplastických névů, dále modrý névus nebo maligní melanom.
Mnohočetné léze lze zaměnit za bacilární angiomatózu, infekční onemocnění působené rickettsií Rochalimaea henselae, které je časté u HIV pozitivních pacientů. Bacilární angiomatóza se projevuje jednotlivými i mnohočetnými červenými, lehce krvácejícími papulami. Postižena bývá nejen kůže, ale též sliznice a orgány, přítomny jsou celkové příznaky, febrilie až septický stav [74].
Pozdní stadia KS mohou připomínat akroangiodermatitidu, která vzniká při chronické venózní insuficienci. Na bércích se nacházejí ostře ohraničená, pásovitá, někdy nepravidelně lehce vyvýšená červenolividní až hnědavá ložiska. Jedná se o hyperplastické projevy při chronické hypostáze. Obraz připomíná KS nejen klinicky, ale i histologicky, proto synonymum této jednotky je pseudosarcoma Kaposi. Erythema elevatum et diutinum je chronická dermatóza s tvorbou zánětlivých papul a plaků na končetinách, které vznikají na podkladě vaskulitidy. Dále přicházejí v úvahu nádorové procesy, zejména avaskulární vřetenité sarkomy – fibrosarkom a leiomyosarkom. Odlišit je třeba také kožní metastázy, zvláště karcinomu ledvin, dále leukemie a kožní lymfomy. Při projevech na genitálu, zejména na penisu, je nutné vyloučit dlaždicobuněčný karcinom.
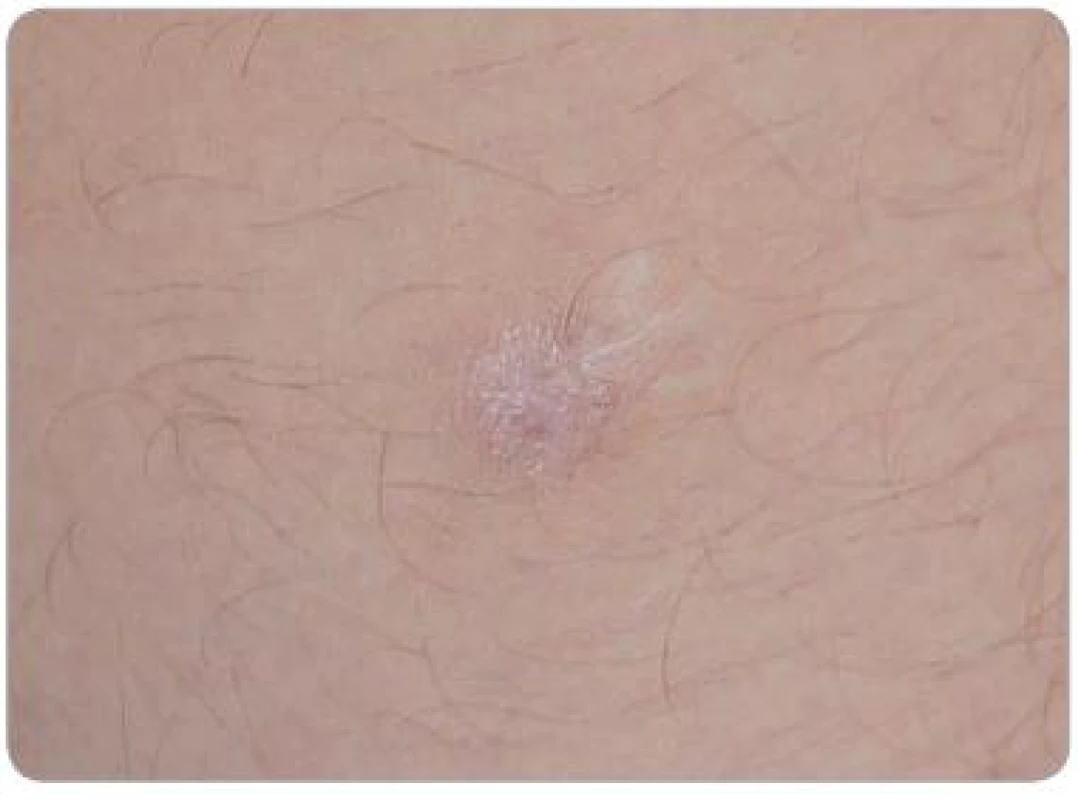
Histopatologická diferenciální diagnostika KS je též velmi široká. Obecně platí, že plně vyvinuté noduly KS nečiní diagnostický problém. Úskalím jsou časná makulární stadia, kdy časné histopatologické změny jsou nespecifické a mohou uniknout pozornosti. Též může dojít k chybnému zhodnocení zánětu či některých angiomatózních nebo lymfatických anomálií. Obtížné bývá odlišení hyperplazie původní vaskulatury, jejíž příčinou je hypostáza a zvýšený venózní tlak, zejména u lézí dolních končetin [48].
Diferenciálně diagnosticky je u časných makulózních lézí třeba odlišit zánětlivé a nenádorové procesy. Nejčastěji vylučujeme na buňky chudý (atrofický) histiocytom; při jeho diagnostice pomůže imunohistochemické vyšetření. Histiocytom obsahuje histiocyty pozitivní v CD68, zatímco endotelie v KS jsou pozitivní v CD31 a CD34 [75].
U pozdních makulózních lézí musíme odlišit dobře diferencovaný angiosarkom, pro který jsou charakteristické atypie a hyperchromazie jader. Progresivní lymfangiom je téměř neodlišitelný od KS, ale nemívá doprovodný infiltrát lymfocytů a plazmocytů [76,77]. Mikrovenulární hemangiom mívá přítomné pericyty a aktin pozitivní buňky hladkého svalu.
Nodulární léze se mohou histopatologicky podobat nodulárnímu vřetenobuněčnému hemangiomu, charakteristickým znakem jsou kavernózní nebo široce dilatované prostory a kolekce epiteloidních buněk s přítomností intracytoplazmatických štěrbin nebo bez ní. Odlišit je třeba také kaposiformní hemangioendoteliom vyskytující se u dětí, který se nachází v hlubokých měkkých tkáních, roste lobulárně, na periferii lézí bývají přítomné ložiskovité trombózy a chybí hyalinní globule [78]. V úvahu přichází i méně diferencovaný angiosarkom s vřetenobuněčnou diferenciací (charakteristické jsou buněčné atypie).
V diferenciální diagnostice agresivních lézí pozdního stadia přicházejí v úvahu především nádorové procesy, k jejichž odlišení používáme imunohistochemická vyšetření. Pro KS je typický pozitivní průkaz endoteliálních markerů CD31 a CD34, zatímco fibrosarkom má pozitivní pouze vimetin, leiomyosarkom bývá pozitivní na aktin a desmin, monofazický synoviální sarkom vykazuje pozitivitu cytokeratinu a vimentinu a maligní celulární modrý névus či desmoplastický maligní melanom vykazují pozitivitu proteinu S100 [75,79,80].
Z výše uvedeného přehledu klinické i histopatologické diferenciální diagnostiky je zřejmé, že stanovení diagnózy KS není jednoduché. V naší kazuistice byly sice léze na sliznici typické, na kůži se však jednalo o projevy počínající. Rovněž histologický obraz kožního projevu na stehně nebyl zcela typický, protože se jednalo o počínající lézi. V takovéto lézi obvykle bývají štěrbinovité prostory velmi nenápadné a jsou orientované paralelně s epidermis. V našem preparátu se nacházejí cévní prostory různé velikosti vystlané plochými nenápadnými endoteliemi. Buněčnost mezi prostorami je výraznější, ale provedené imunohistochemické vyšetření prokázalo, že se jedná o buňky na endoteliální markery většinou negativní, čili o histiocyty, které jsou součástí doprovodného zánětlivého infiltrátu. Endotelie se barvily převážně jen jako lem štěrbinovitých cévních prostor. Právě tato skutečnost vedla histopatologa při prvním čtení k diagnóze hemangiomu. Jediná zachycená mitóza se jeví jako mitóza typická a nelze spolehlivě určit, zda se jedná o mitózu endoteliální buňky. Mohlo se jednat o histiocyt přítomný v reaktivním zánětlivém infiltrátu. Přítomnost intracytoplazmatických hyalinních PAS pozitivních globulí vzniklých při degradaci erytrocytů je charakteristickým znakem pro KS, nejedná se však o znak patognomický [48,49].
Závěr
Základem správné a včasné diagnózy je pečlivé klinické vyšetřování HIV pozitivních pacientů spojené s pravidelným monitoringem imunologických a virologických markerů progrese HIV infekce optimálně v intervalu 3–4 měsíců. Při podezření na KS musí lékař pečující o HIV pozitivního pacienta odeslat pacienta k dermatologovi. Patologovi je nutné poskytnout maximum informací o klinickém stavu pacienta včetně informace o případné antiretrovirové léčbě, stejně jako výsledky imunologických a dalších laboratorních vyšetření. Klinický i histopatologický obraz KS je pestrý, a diferenciální diagnostika je proto velmi široká.
Histopatologický závěr vyšetření, které je klíčem k diagnóze KS, může být vzhledem k obtížnosti odlišení od jiných zánětlivých a zejména cévních nádorových projevů velmi složitý. V některých případech je proto nutné opakovaní histopatologického vyšetření tkáně z dalších lézí.
I přes klesající výskyt představuje KS u HIV pozitivních pacientů závažnou příčinu morbidity i mortality. Včasné stanovení diagnózy může být rozhodující pro prognózu pacienta, protože adekvátní léčba v počátečních stadiích vývoje nádoru má velkou naději na kompletní vyléčení.
Dále je třeba si rovněž uvědomit, že projevy KS mohou být prvním projevem HIV infekce, a proto by sérologické vyšetření HIV protilátek mělo být nedílnou součástí laboratorního screeningu. Toto vyšetření je důležité zejména u mužů majících sex s muži, kteří patří mezi nejvíce ohroženou skupinu v České republice.
Autoři
deklarují, že v souvislosti s předmětem studie nemají žádné
komerční zájmy.
The
authors declare they have no potential conflicts of interest
concerning drugs, products, or services
used in the study.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do biomedicínských
časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform
requirements” for biomedical papers.
doc.
MUDr. Ladislav Machala, Ph.D.
I.
infekční klinika 2. LF UK a Klinika infekčních nemocí 3. LF UK
Budínova
2
180
81 Praha 8
e-mail:
ladimachala@centrum.cz
Sources
1. Gottlieb GJ, Ragaz A, Vogel JV et al. A preliminary communication on extensively disseminated Kaposi‘s sarcoma in young homosexual men. Am J Dermatopathol 1981; 3(2): 111 – 114.
2. Hymes KB, Cheung T, Greene JB et al. Kaposi‘s sarcoma in homosexual men – a report of eight cases. Lancet 1981; 2(8247): 598 – 600.
3. Friedman ‑ Kien AE, Laubenstein LJ, Rubinstein P et al. Disseminated Kaposi‘s sarcoma in homosexual men. Ann Intern Med 1982; 96(6 Pt 1): 693 – 700.
4. Kaposi M. Idiopathisches multiples Pigmentsarkom der Haut. Arch Dermatol Syph 1872; 4 : 265 – 273.
5. Vorlíček J, Slavík M. Kaposiho sarkom po sto dvaceti letech. Klin Onkol 1991; 4(3): 75 – 83.
6. Ziegler JL, Templeton AC, Vogel CL. Kaposi‘s sarcoma: a comparison of classical, endemic, and epidemic forms. Semin Oncol 1984; 11(1): 47 – 52.
7. Goedert JJ, Vitale F, Lauria C et al. Classical Kaposi‘s Sarcoma Working Group. Risk factors for classical Kaposi‘s sarcoma. J Natl Cancer Inst 2002; 94(22): 1712 – 1718.
8. Guttman ‑ Yassky E, Bar ‑ Chana M, Yukelson A et al. Epidemiology of classic Kaposi‘s sarcoma in the Israeli Jewish population between 1960 and 1998. Br J Cancer 2003; 89(9): 1657 – 1660.
9. Chang Y, Ziegler J, Wabinga H et al. Kaposi‘s sarcoma‑associated herpesvirus and Kaposi‘s sarcoma in Africa. Uganda Kaposi‘s Sarcoma Study Group. Arch Intern Med 1996; 156(2): 202 – 204.
10. Amir H, Kaaya EE, Manji KP et al. Kaposi‘s sarcoma before and during a human immunodeficiency virus epidemic in Tanzanian children. Pediatr Infect Dis J 2001; 20(5): 518 – 521.
11. Lebbé C, Legendre C, Frances C. Kaposi sarcoma in transplantation. Transplant Rev (Orlando) 2008; 22(4): 252 – 261.
12. Schwartz RA, Micali G, Nasca MR et al. Kaposi sarcoma: a continuing conundrum. J Am Acad Dermatol 2008; 59(2): 179 – 206; quiz 207 – 208.
13. Šlampa P. Maligní nádory při syndromu získaného selhání imunity (AIDS). Klin Onkol 1989; 2(6): 183 – 185.
14. Gallafent JH, Buskin SE, De Turk PB et al. Profile of patients with Kaposi‘s sarcoma in the era of highly active antiretroviral therapy. J Clin Oncol 2005; 23(6): 1253 – 1260.
15. Mocroft A, Kirk O, Clumeck N et al. The changing pattern of Kaposi sarcoma in patients with HIV, 1994 – 2003: the EuroSIDA Study. Cancer 2004; 100(12): 2644 – 2654.
16. Yarchoan R, Tosato G, Little RF. Therapy insight: AIDS‑related malignancies – the influence of antiviral therapy on pathogenesis and management. Nat Clin Pract Oncol 2005; 2(8): 406 – 415; quiz 423.
17. NRL pro AIDS, SZÚ, Praha. Nové případy HIV infekce a onemocnění AIDS, údaje ke dni 31. 12. 2009. [http:/ / www.aids ‑ hiv.cz/ nove09/ JS12 – 2009.pdf]. Accessed April 1, 2010.
18. Dvořáková K, Hercogová J, Rozsypal H et al. Kožní projevy u HIV‑pozitivních pacientů (studie z období 1985 – 1998). Čes ‑ slov Derm 2001; 76(5): 227 – 236.
19. Humphrey RW, Davis DA, Newcomb FM et al. Human herpesvirus 8 (HHV ‑ 8) in the pathogenesis of Kaposi‘s sarcoma and other diseases. Leuk Lymphoma 1998; 28(3 – 4): 255 – 264.
20. Ablashi DV, Chatlynne LG, Whitman JE jr. et al. Spectrum of Kaposi‘s sarcoma‑associated herpesvirus, or human herpesvirus 8, diseases. Clin Microbiol Rev 2002; 15(3): 439 – 464.
21. Wen KW, Damania B. Kaposi sarcoma‑associated herpesvirus (KSHV): Molecular biology and oncogenesis. Cancer Lett 2010; 289(2): 140 – 150.
22. Cannon MJ, Laney AS, Pellett PE. Human herpesvirus 8: current issues. Clin Infect Dis 2003; 37(1): 82 – 87.
23. Martin JN, Ganem DE, Osmond DH et al. Sexual transmission and the natural history of human herpesvirus 8 infection. N Engl J Med 1998; 338(14): 948 – 954.
24. Suchankova A, Stankova M, Roubalova K et al. Seroprevalence of HHV 8 antibodies among the general population and HIV positive persons in the Czech Republic. J Clin Virol 2003; 28(1): 70 – 76.
25. Pantanowitz L, Moses AV, Dezube BJ. The inflammatory component of Kaposi sarcoma. Exp Mol Pathol 2009; 87(2): 163 – 165.
26. Boshoff C, Schulz TF, Kennedy MM et al. Kaposi‘s sarcoma‑associated herpesvirus infects endothelial and spindle cells. Nat Med 1995; 1(12): 1274 – 1278.
27. Foster CB, Lehrnbecher T, Samuels S et al. An IL6 promoter polymorphism is associated with a lifetime risk of development of Kaposi sarcoma in men infected with human immunodeficiency virus. Blood 2000; 96(7): 2562 – 2567.
28. Lehrnbecher TL, Foster CB, Zhu S et al. Variant genotypes of FcgammaRIIIA influence the development of Kaposi‘s sarcoma in HIV ‑ infected men. Blood 2000; 95(7): 2386 – 2390.
29. Bottero V, Sharma ‑ Walia N, Kerur N et al. Kaposi sarcoma‑associated herpes virus (KSHV) G protein‑coupled receptor (vGPCR) activates the ORF50 lytic switch promoter: a potential positive feedback loop for sustained ORF50 gene expression. Virology 2009; 392(1): 34 – 51.
30. Hong YK, Foreman K, Shin JW et al. Lymphatic reprogramming of blood vascular endothelium by Kaposi sarcoma‑associated herpesvirus. Nat Genet 2004; 36(7): 683 – 685.
31. Chen X, Cheng L, Jia X et al. Human immunodeficiency virus type 1 Tat accelerates Kaposi sarcoma‑associated herpesvirus Kaposin A ‑ mediated tumorigenesis of transformed fibroblasts in vitro as well as in nude and immunocompetent mice. Neoplasia 2009; 11(12): 1272 – 1284.
32. Mbulaiteye SM, Biggar RJ, Goedert JJ et al. Immune deficiency and risk for malignancy among persons with AIDS. J Acquir Immune Defic Syndr 2003; 32(5): 527 – 533.
33. Bartlett J, Gallant J. Medical management of HIV infection. Baltimore: Johns Hopkins Medicine Health Publishing Business Group 2004.
34. DeSimone JA, Pomerantz RJ, Babinchak TJ. Inflammatory reactions in HIV ‑ 1 - infected persons after initiation of highly active antiretroviral therapy. Ann Intern Med 2000; 133(6): 447 – 454.
35. Bower M, Nelson M, Young AM et al. Immune reconstitution inflammatory syndrome associated with Kaposi‘s sarcoma. J Clin Oncol 2005; 23(22): 5224 – 5228.
36. Letang E, Almeida JM, Miró JM et al. Predictors of Immune Reconstitution Inflammatory Syndrome ‑ Associated With Kaposi Sarcoma in Mozambique: A Prospective Study. J Acquir Immune Defic Syndr 2010; 53(5): 581 – 591.
37. Price P, Mathiot N, Krueger R et al. Immune dysfunction and immune restoration disease in HIV patients given highly active antiretroviral therapy. J Clin Virol 2001; 22(3): 279 – 287.
38. Hirsch HH, Kaufmann G, Sendi P et al. Immune reconstitution in HIV ‑ infected patients. Clin Infect Dis 2004; 38(8): 1159 – 1166.
39. Schwartz RA. Kaposi‘s sarcoma: advances and perspectives. J Am Acad Dermatol 1996; 34(5 Pt 1): 804 – 814.
40. Simonart T, Dobbeleer GD, Peny M et al. Pre‑Kaposi‘s sarcoma: an expansion of the spectrum of Kaposi‘s sarcoma lesions. Eur J Dermatol 1999; 9(6): 480 – 482.
41. Micali G, Nasca MR, De Pasquale R et al. Primary classic Kaposi‘s sarcoma of the penis: report of a case and review. J Eur Acad Dermatol Venereol 2003; 17(3): 320 – 323.
42. Gasparetto TD, Marchiori E, Lourenco S et al. Pulmonary involvement in Kaposi sarcoma: correlation between imaging and pathology. Orphanet J Rare Dis 2009; 4 : 18.
43. Pantanowitz L, Dezube BJ. Kaposi sarcoma in unusual locations. BMC Cancer 2008; 8 : 190.
44. Lemlich G, Schwam L, Lebwohl M. Kaposi‘s sarcoma and acquired immunodeficiency syndrome. Postmortem findings in twenty ‑ four cases. J Am Acad Dermatol 1987; 16(2 Pt 1): 319 – 325.
45. Gorin FA, Bale JF jr, Halks ‑ Miller M et al. Kaposi‘s sarcoma metastatic to the CNS. Arch Neurol 1985; 42(2): 162 – 165.
46. Eberly LE, Ohman PA, Neaton JD et al. Kaposi‘s sarcoma and central nervous system disease: a real association or an artifact of the control group? Terry Beirn Community Programs for Clinical Research on AIDS. Aids 2000; 14(8): 995 – 1000.
47. Real FX, Krown SE. Spontaneous regression of Kaposi‘s sarcoma in patients with AIDS. N Engl J Med 1985; 313(26): 1659.
48. Grayson W, Pantanowitz L. Histological variants of cutaneous Kaposi sarcoma. Diagn Pathol 2008; 3 : 31.
49. Niedt GW, Myskowski PL, Urmacher C et al. Histology of early lesions of AIDS‑associated Kaposi‘s sarcoma. Mod Pathol 1990; 3(1): 64 – 70.
50. Sangüeza OP, Requena L. Malignant neoplasms. Kaposi‘s sarcoma. In: Sangüeza OP, Requena L (eds). Pathology of vascular skin lesions. Clinicopathological correlations. New Jersey: Humana Press 2003; 217 – 235.
51. Satta R, Cossu S, Massarelli G et al. Anaplastic transformation of classic Kaposi‘s sarcoma: clinicopathological study of five cases. Br J Dermatol 2001; 145(5): 847 – 849.
52. Cannon MJ, Dollard SC, Black JB et al. Risk factors for Kaposi‘s sarcoma in men seropositive for both human herpesvirus 8 and human immunodeficiency virus. AIDS 2003; 17(2): 215 – 222.
53. Acharya S, Ross JD. Kaposi‘s sarcoma of the recto sigmoid colon in a patient with HIV infection and a high CD4 count. Int J STD AIDS 2007; 18(7): 499 – 500.
54. Mocroft A, Youle M, Phillips AN et al. The incidence of AIDS ‑ defining illnesses in 4 883 patients with human immunodeficiency virus infection. Royal Free/ Chelsea and Westminster Hospitals Collaborative Group. Arch Intern Med 1998; 158(5): 491 – 497.
55. Clifford GM, Franceschi S. Cancer risk in HIV ‑ infected persons: influence of CD4(+) count. Future Oncol 2009; 5(5): 669 – 678.
56. Polstra AM, Van Den Burg R, Goudsmit J et al. Human herpesvirus 8 load in matched serum and plasma samples of patients with AIDS‑associated Kaposi‘s sarcoma. J Clin Microbiol 2003; 41(12): 5488 – 5491.
57. Engels EA, Biggar RJ, Marshall VA et al. Detection and quantification of Kaposi‘s sarcoma‑associated herpesvirus to predict AIDS‑associated Kaposi‘s sarcoma. AIDS 2003; 17(12): 1847 – 1851.
58. Nuovo M, Nuovo G. Utility of HHV8 RNA detection for differentiating Kaposi‘s sarcoma from its mimics. J Cutan Pathol 2001; 28(5): 248 – 255.
59. Alkan S, Eltoum IA, Tabbara S et al. Usefulness of molecular detection of human herpesvirus ‑ 8 in the diagnosis of Kaposi sarcoma by fine ‑ needle aspiration. Am J Clin Pathol 1999; 111(1): 91 – 96.
60. Martellotta F, Berretta M, Vaccher E et al. AIDS‑related Kaposi‘s sarcoma: state of the art and therapeutic strategies. Curr HIV Res 2009; 7(6): 634 – 638.
61. Hauerstock D, Gerstein W, Vuong T. Results of radiation therapy for treatment of classic Kaposi sarcoma. J Cutan Med Surg 2009; 13(1): 18 – 21.
62. Brambilla L, Bellinvia M, Tourlaki A et al. Intralesional vincristine as first‑line therapy for nodular lesions in classic Kaposi sarcoma: a prospective study in 151 patients. Br J Dermatol 2010; 162 (4): 854 – 859.
63. Presant CA, Scolaro M, Kennedy P et al. Liposomal daunorubicin treatment of HIV‑associated Kaposi‘s sarcoma. Lancet 1993; 341(8855): 1242 – 1243.
64. Tulpule A, Groopman J, Saville MW et al. Multicenter trial of low‑dose paclitaxel in patients with advanced AIDS‑related Kaposi sarcoma. Cancer 2002; 95(1): 147 – 154.
65. Uneda S, Murata S, Sonoki T et al. Successful treatment with liposomal doxorubicin for widespread Kaposi‘s sarcoma and human herpesvirus ‑ 8 related severe hemophagocytic syndrome in a patient with acquired immunodeficiency syndrome. Int J Hematol 2009; 89(2): 195 – 200.
66. Adam Z, Vorlíček J. Biologie, farmakologie a přehled léčebného užití interferonů. Klin Onkol 1996; 9(4): 115 – 120.
67. Biggar RJ, Engels EA, Ly S et al. Survival after cancer diagnosis in persons with AIDS. J Acquir Immune Defic Syndr 2005; 39(3): 293 – 299.
68. Stebbing J, Sanitt A, Nelson M et al. A prognostic index for AIDS‑associated Kaposi‘s sarcoma in the era of highly active antiretroviral therapy. Lancet 2006; 367(9521): 1495 – 1502.
69. Martin‑Carbonero L, Palacios R, Valencia E et al. Long‑term prognosis of HIV ‑ infected patients with Kaposi sarcoma treated with pegylated liposomal doxorubicin. Clin Infect Dis 2008; 47(3): 410 – 417.
70. Schwartz RA, Spicer MS, Thomas I et al. Ecchymotic Kaposi‘s sarcoma. Cutis 1995; 56(2): 104 – 106.
71. Schmid H, Zietz C. Human herpesvirus 8 and angiosarcoma: analysis of 40 cases and review of the literature. Pathology 2005; 37(4): 284 – 287.
72. Kang GH, Kwon GY, Kim CW. Human herpesvirus 8 in Kaposi‘s sarcoma and Kaposi‘s sarcoma ‑ mimicking vascular tumors. J Korean Med Sci 1998; 13(1): 54 – 59.
73. Santa Cruz DJ, Kyriakos M. Aneurysmal („angiomatoid“) fibrous histiocytoma of the skin. Cancer 1981; 47(8): 2053 – 2061.
74. Ramirez Ramirez CR, Saavedra S, Ramirez Ronda CH. Bacillary angiomatosis: microbiology, histopathology, clinical presentation, diagnosis and management. Bol Asoc Med P R 1996; 88(4 – 6): 46 – 51.
75. Kanitakis J, Narvaez D, Claudy A. Expression of the CD34 antigen distinguishes Kaposi‘s sarcoma from pseudo ‑ Kaposi‘s sarcoma (acroangiodermatitis). Br J Dermatol 1996; 134(1): 44 – 46.
76. Posada Garcia C, Garcia ‑ Cruz A, Garcia ‑ Doval I et al. Lymphangioma‑like Kaposi sarcoma: case report. Dermatol Online J 2009; 15(9): 13.
77. Guillou L, Fletcher CD. Benign lymphangioendothelioma (acquired progressive lymphangioma): a lesion not to be confused with well‑differentiated angiosarcoma and patch stage Kaposi‘s sarcoma: clinicopathologic analysis of a series. Am J Surg Pathol 2000; 24(8): 1047 – 1057.
78. Lyons LL, North PE, Mac ‑ Moune Lai F et al. Kaposiform hemangioendothelioma: a study of 33 cases emphasizing its pathologic, immunophenotypic, and biologic uniqueness from juvenile hemangioma. Am J Surg Pathol 2004; 28(5): 559 – 568.
79. Armah HB, Parwani AV. Epithelioid sarcoma. Arch Pathol Lab Med 2009; 133(5): 814 – 819.
80. Bolander A, Agnarsdóttir M, Wagenius G et al. Serological and immunohistochemical analysis of S100 and new derivatives as markers for prognosis in patients with malignant melanoma. Melanoma Res 2008; 18(6): 412 – 419.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2010 Issue 5
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Diagnostic Pitfalls of HIV‑ Associated Kaposi Sarcoma
- Detection of DNA Hypermethylation as a Potential Biomarker for Prostate Cancer
- Hand‑ Foot Syndrome after Administration of Tyrosinkinase Inhibitors
- The Role of Membrane Transporters in Cellular Resistance of Pancreatic Carcinoma to Gemcitabine
- 18F‑ FDG PET/ CT and 99mTc‑ MIBI Scintigraphy in Evaluation of Patients with Multiple Myeloma and Monoclonal Gammopathy of Unknown Significance: Comparison of Methods
- Treatment Results in Patients Treated from 1980 to 2004 for Wilms‘ Tumour in a Single Centre
- A Case of a Patient with a Triple Negative Breast Cancer and Complete Response of Lung, Mediastinal and Skeletal Metastases after Treatment with Paclitaxel and Bevacizumab
- Cancer Incidence and Mortality in the Czech Republic
- Czech National Cancer Screening Programmes in 2010
- Mucoepidermoid Carcinoma of a Nasal Cavity – a Rare Tumour
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Diagnostic Pitfalls of HIV‑ Associated Kaposi Sarcoma
- Hand‑ Foot Syndrome after Administration of Tyrosinkinase Inhibitors
- Mucoepidermoid Carcinoma of a Nasal Cavity – a Rare Tumour
- 18F‑ FDG PET/ CT and 99mTc‑ MIBI Scintigraphy in Evaluation of Patients with Multiple Myeloma and Monoclonal Gammopathy of Unknown Significance: Comparison of Methods
