Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
Basal Cell Carcinoma of the Skin – Biological Behaviour of the Tumor and a Review of the Most Important Molecular Predictors of Disease Progression in Pathological Practice
Basal cell carcinoma of the skin is currently the most frequent malignancy in human population. Basal cell carcinoma represents a heterogeneous group of tumors with a variable clinical and morphological picture. Based on its biological behaviour, we generally differentiate between indolent (superficial and nodular) and aggressive type (infiltrative, micronodular, and metatypical) of basal cell carcinoma. Because of the different biological characteristics of these tumors, it is questionable whether they are a part of a continuous spectrum of carcinogenesis, starting with indolent and ending with aggressive forms, or they represent separate developmental lines. In the current clinical practice, there is an increasing demand for identification of tumors that are prognostically more adverse and their impact on the overall health status of patients is more serious. Recent advances in pathology and molecular medicine allow identification of various biomarkers from tumor tissue that are significantly involved in the mechanisms of malignant cell transformation. Detection of these biomarkers is of great importance in predicting further clinical behaviour of the cancer. The authors of the paper present basic information about biological behaviour of cutaneous basal cell carcinoma and provide an overview of the most important biomarkers that influence the clinical outcome and disease progression and are detectable through a routine biopsy tissue examination. It is now necessary to search for novel histological and molecular parameters that, in the future, could have a prognostic value in diagnostic and therapeutic process of this disorder.
Key words:
basal cell carcinoma – biological behaviour – prognosis – disease progression
Authors:
V. Bartoš 1; K. Adamicová 2; M. Kullová 3; M. Péč 4
Authors‘ workplace:
Oddelenie patologickej anatómie FNsP v Žiline, Slovenská republika
1; Ústav patologickej anatómie JLF UK a MFN v Martine, Slovenská republika
2; Oddelenie dermatovenerológie FNsP v Žiline, Slovenská republika
3; Ústav lekárskej biológie Jesseniovej lekárskej fakulty UK v Martine, Slovenská republika
4
Published in:
Klin Onkol 2011; 24(1): 8-17
Category:
Reviews
Overview
Bazocelulárny karcinóm kože je v súčasnosti najčastejšou malignitou v ľudskej populácii. V skutočnosti predstavuje rôznorodú skupinu nádorov s variabilným klinicko-morfologickým obrazom. Na základe biologického správania všeobecne rozlišujeme indolentné (superficiálny a nodulárny) a agresívne typy (infiltratívny, mikronodulárny a metatypický) bazocelulárneho karcinómu kože. Vzhľadom na rozdielne biologické charakteristiky uvedených typov je diskutabilné, či predstavujú medzičlánky kontinuálneho spektra karcinogenézy počnúc indolentnými a končiac agresívnymi formami, alebo ide o samostatné vývinové línie. V súčasnej klinickej praxi rastú požiadavky na identifikáciu tých nádorov, ktoré sú prognosticky nepriaznivejšie a ktorých dopad na celkový zdravotný stav chorých je závažnejší. Dnešný rozvoj patológie a molekulárnej medicíny umožňuje v nádorovom tkanive analyzovať rôzne biomarkery, ktoré významne participujú na mechanizmoch malígnej transformácie buniek a ktorých detekcia významne prispieva v predikcii ďalšieho klinického chovania karcinómu. Autori v článku prezentujú základné poznatky o biologickom správaní bazocelulárneho karcinómu kože a prehľad najvýznamnejších biomarkerov, ktoré ovplyvňujú klinický priebeh a progresiu ochorenia a ktoré možno detegovať v rámci rutínneho bioptického vyšetrenia tkaniva. V súčasnosti je potrebné naďalej skúmať nové histologické a molekulové parametre, ktoré by mohli mať v budúcnosti aj prognostické využitie v diagnosticko-terapeutickom procese tohto ochorenia.
Kľúčové slová:
bazocelulárny karcinóm – biologické správanie – prognóza – progresia ochorenia
Úvod
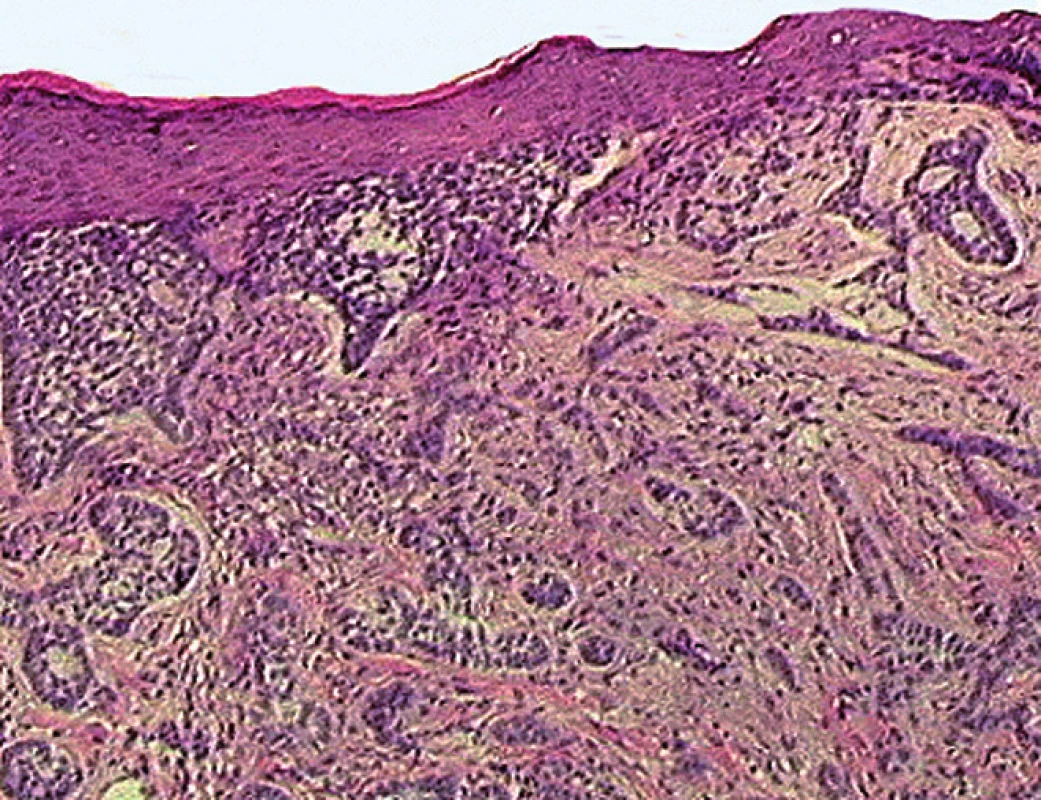
Bazocelulárny karcinóm (basal cell carcinoma – BCC, bazalióm) tvorí takmer 80 % všetkých malígnych nádorov kože a v súčasnosti je u ľudí najčastejšie sa vyskytujúcim zhubným onkologickým ochorením [1,2]. V skutočnosti predstavuje rôznorodú skupinu nádorov s variabilným klinicko-morfologickým obrazom. Hoci je jeho typickou črtou klinická indolencia, ktorou sa odlišuje od ostatných malignít, niektoré typy sú charakteristické agresívnym biologickým správaním s podstatne nepriaznivejšou prognózou. O výraznej štrukturálnej variabilite tohto karcinómu svedčí aj fakt, že dodnes boli navrhnuté viaceré histologické klasifikácie BCC. Jednotlivé klasifikačné schémy väčšinou vychádzajú z histologického rastového typu nádoru, ktorý má zároveň najväčší biologický význam a je základom koncepcie nízkorizikových a vysokorizikových typov BCC [3]. Na základe klinicko-biologických charakteristík sa všeobecne rozlišujú 2 hlavné skupiny BCC: agresívne a indolentné karcinómy [1,2,4]. Indolentné (neagresívne) typy zahrňujú najmä nodulárny a superficiálny BCC, ktoré sa vyskytujú najčastejšie a ktorých terapia a prognóza bývajú vo väčšine prípadov dobré. Agresívne typy predstavujú infiltratívne rastúci sklerotizujúci a nesklerotizujúci typ BCC (obr. 1), mikronodulárny BCC a bazoskvamózny (metatypický) karcinóm. Nádory tejto skupiny majú horšiu prognózu v dôsledku invazívneho rastu, častých recidív po liečbe a čiastočne aj metastatického potenciálu. Zatriedenie superficiálneho typu však zatiaľ nie je celkom ujednotené, nakoľko niektorí autori [5] skôr uprednostňujú jeho zaradenie k vysokorizikovým typom, najmä v súvislosti so subklinickým šírením nádoru a zvýšenou pravdepodobnosťou inkompletnej excízie a následných recidív [3]. Vzhľadom na rozdielne biologické správanie uvedených typov je stále diskutabilné, či predstavujú medzičlánky kontinuálneho spektra karcinogenézy počnúc indolentnými a končiac agresívnymi formami, alebo ide o samostatné vývinové línie nádoru. V súčasnej klinickej praxi narastajú požiadavky na identifikáciu tých nádorov, ktoré sú prognosticky nepriaznivejšie a ktorých dopad na celkový zdravotný stav chorých je závažnejší. Pri tomto procese je úloha patológa nezastupiteľná. Hoci je samotná bioptická diagnostika BCC pomerne jednoduchá, histologické vyšetrenie poskytuje okrem diagnózy a typizácie nádoru aj mnohé prognosticky významné morfologické ukazovatele. S kontinuálnym rozvojom medicínskych postupov sa v posledných desaťročiach analyzujú rôzne biomarkery, z ktorých mnohé majú v rámci bioptického vyšetrenia nádoru významnú prediktívnu hodnotu a zároveň napomáhajú pri objasňovaní patogenézy a biologických charakteristík tohto ochorenia.
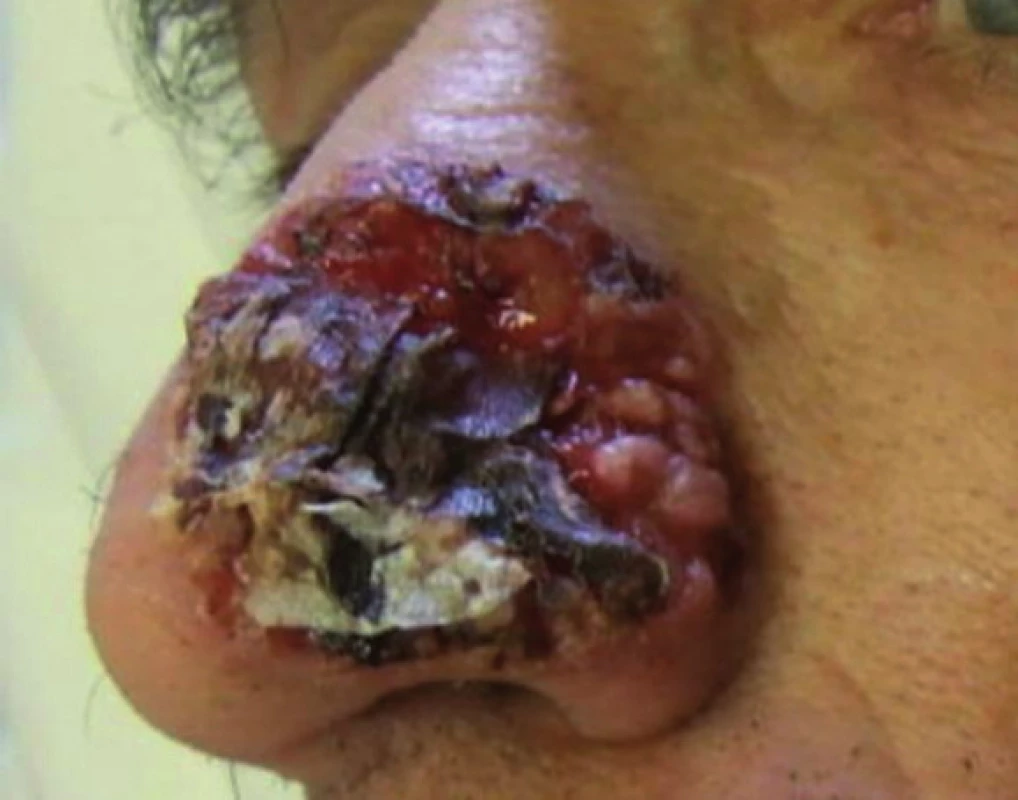
Molekulové prediktory biologického správania BCC
Hoci základné etiopatogenetické faktory vzniku BCC kože sú pomerne dobre známe, poznatky o presných mechanizmoch zodpovedných za agresivitu a invazivitu určitých typov tohto karcinómu sú zatiaľ nedostatočné. Pri predpovedaní biologického správania BCC zohrávajú prognostický význam viaceré klinicko-patologické ukazovatele, ktoré sú podrobnejšie opísané v našej predchádzajúcej práci [6] a ku ktorým patria najmä histologický typ nádoru, jeho veľkosť, hĺbka infiltrácie, anatomická lokalizácia, stav resekčných okrajov excidovanej lézie, výskyt recidivujúcich nádorov a imunologický stav pacienta. Dodnes však nie sú detailne objasnené molekulovo-genetické mechanizmy nádorovej invázie. Vývoj, progresia a najmä ojedinelé metastázovanie BCC sú sprevádzané intracelulárnymi procesmi, pôvod ktorých zatiaľ presne nepoznáme. Je známe, že tento nádor vzniká z unipotentných kmeňových buniek bazálnej vrstvy epidermy a kožných adnex, pričom hlavný induktor ich nádorovej transformácie je ultrafialová (UV) zložka slnečného žiarenia. Aj z toho dôvodu býva najčastejšie lokalizovaný na hlave, najmä v tvárových oblastiach (obr. 2). Doterajšie výsledky štúdií preukazujú, že UV žiarenie zodpovedá za indukciu mutácií tumor supresorického génu p53 a tak pravdepodobne za iniciáciu obidvoch foriem – indolentných aj agresívnych variant BCC [7,8]. Avšak skutočnosť, že obe uvedené formy obsahujú identické, UV žiarením indukované mutácie p53 napovedá, že táto genetická alterácia má pravdepodobne kľúčovú úlohu v nádorovej iniciácii, ale nie v nádorovej progresii [7]. Veľký význam zohráva individuálna genetická predispozícia súvisiaca najmä s polymorfizmami génov niektorých reparačných a detoxifikačných enzymatických systémov (cytochrómu p450, glutatión-S-transferázy, receptoru melanokor-tínu 1) [9]. Dodnes je známych aj niekoľko dedičných ochorení, ktoré sú sprevádzané vznikom BCC, najmä Gorlinov-Goltzov syndróm [10,11], Bazexov syndróm [12] či xeroderma pigmentosum [10]. Významné poznatky o molekulovej etiopatogenéze BCC boli získané práve genetickými analýzami Gorlinovho-Goltzovho syndrómu, ktoré odhalili mutačné zmeny zapríčiňujúce inaktiváciu dôležitého tumor supresorického patched génu PTCH. Tento gén kóduje transmembránový proteín Ptch, ktorý významne participuje v Sonic Hedgehog signálnej dráhe [1]. Zatiaľ je stále diskutabilné, do akej miery pri určitých typoch BCC predisponujú jednotlivé vnútorné (intrinsic) faktory k ich agresívnemu správaniu, alebo či každý BCC s neadekvátnym klinickým manažmentom či oneskorenou diagnostikou môže postupne získavať biologicky agresívny, a tým prognosticky nepriaznivý fenotyp [13]. Hoci je zjavné, že agresívne typy BCC vznikajú následkom novo selektovaných mutovaných klonov nádorových buniek, ostáva stále na ďalších výskumoch, aké genetické zmeny a v ktorom štádiu procesu karcinogenézy na ich vzniku participujú. Je veľmi pravdepodobné, že za agresívne biologické správanie BCC a ich častú rezistenciu na lokálnu terapiu nezodpovedajú samotné nádorové bunky, ale skôr biochemické procesy v okolitej stróme. Vznik a celý následný vývoj BCC sú totiž úzko späté s priľahlou stromálnou komponentou, ktorá významne ovplyvňuje progresiu nádora a jeho ďalšie vlastnosti [14]. Podobne ako pri karcinogenéze iných nádorov aj v patogenéze tohto ochorenia zohrávajú dôležitú úlohu recipročné interakcie medzi nádorovými bunkami, väzivovou matrix a zápalovou odpoveďou tkaniva. Pri týchto procesoch dochádza vplyvom karcinómových buniek k cielenej modifikácii okolitého tkaniva, ktorá podporuje novotvorbu extracelulárnej strómy s optimálnymi vlastnosťami pre nádorový rast (tumor-growth permissive tissue). V súčasnosti je známych mnoho histomorfologických, ultraštrukturálnych či geneticko-molekulových zmien a alterácií jednotlivých komponent strómy, ktoré sprevádzajú alebo aj predchádzajú malígnej konverzii epitelových buniek a ktorých detekcia pri rutínnom bioptickom vyšetrení vzoriek môže významne prispieť v predikcii ich ďalšieho biologického správania (tab. 1).
Alterácia integrity bazálnej membrány nádoru
Nádorová invázia je aktívny a postupný proces zahrňujúci oddelenie nádorových buniek navzájom, pripojenie na zložky extracelulárnej matrix (ECM), rozloženie (degradáciu) ECM a nakoniec samotnú migráciu nádorových buniek. Jeden z najdôležitejších patogenetických faktorov invazívneho správania nádorov a teda aj BCC (najmä infiltratívne rastúcich variantov) je narušenie integrity bazálnej membrány (BM). Už pred viac ako jedným desaťročím Hayakawa et al [15] zistili, že pokým sú indolentné (superficiálne a nodulárne typy) BCC na periférii ohraničené kontinuálnou BM, pri agresívnych variantoch (morfeaformný, metatypický a infiltratívne typy BCC) jej nález absentuje. V praxi sa od bioptika očakáva okrem presnej histologickej klasifikácie aj spoľahlivá predikcia ďalšieho biologického správania nádoru, a to nielen pri morfeaformnom, ale pri všetkých typoch BCC [16,17]. Za týmto účelom je zvlášť potrebné vyjadrenie sa k periférii nádorových ložísk a integrite BM. Adamicová et al [16,17] považujú v rutínnej biopsii za najsenzitívnejšiu metodiku hodnotenia integrity BM histochemické farbenie podľa Gömöriho, ktoré zobrazuje retikulínové vlákna. Modernejšie laboratórne postupy však umožňujú detegovať aj zmeny v samotnom zložení BM, ako aj peritumorózneho tkaniva. Predpokladá sa [1], že v procese neoplastickej transformácie zapríčiňuje aktivácia matrixových metaloproteináz postupnú digesciu (degradáciu) materiálu BM, čo pravdepodobne iniciuje progresiu indolentných foriem karcinómu do agresívnejších rastových variant. Jednou z hlavných komponent BM a zároveň jednou z najdôležitejších molekúl extracelulárnej matrix sú laminíny. Tieto multifunkčné trimerické glykoproteíny sa za fyziologických okolností podieľajú na adhézii, raste, migrácii, proliferácii a diferenciácii buniek. Laminíny BM zohrávajú významnú úlohu v motilite nádorových buniek vrátane BCC [14,18]. Mostafa et al [18] recentne hodnotili pri BCC kože imunohistochemickú expresiu laminínov a konštatovali, že väčšina z nich vykazovala iba disperznú intracytoplazmatickú pozitivitu. Omnoho výraznejšie však boli exprimované v BM a čím bol nádor diferencovanejší, tým bola aj intenzívnejšia ich expresia v cytoplazme nádorových buniek aj BM. Pri morfeaformných typoch nález laminínov úplne absentoval. Aj na základe týchto výsledkov možno považovať laminíny BM či cytoplazmy buniek za molekuly významne zahrnuté v procese invázie bazocelulárneho karcinómu.
Degradácia a remodelácia extracelulárnej matrix
Ako už bolo uvedené, nádorová invázia ECM nie je zapríčinená len pasívnym tlakom proliferujúcich malígnych buniek, ale vo veľkej miere aj aktívnou enzýmovou degradáciou jej zložiek. Hlavným faktorom zodpovedným za degradáciu či remodeláciu strómy je najmä proteolytická aktivita enzýmov či modifikácia ich inhibítorov. Nádorové bunky produkujú tieto enzýmy samotné, alebo k ich tvorbe potencujú ostatné nenádorové bunky. Vo všeobecnosti rozoznávame serínové proteázy, cysteínové proteázy, aspartátové proteázy a matrixové metaloproteinázy. Práve matrixové metaloproteinázy (MMP) sa v najväčšej miere podieľajú na katabolických procesoch okolitého nádorového tkaniva. Klasifikované sú do 4 podskupín: a) kolagenázy, b) gelatinázy, c) stromelyzíny a d) matrilyzíny [19].
Jeden z najdôležitejších typov MMP sú stromelyzíny, ktoré v najvýznamnejšej miere zodpovedajú za proteolytickú aktivitu strómy pri infiltratívne rastúcich nádoroch. Výsledky viacerých štúdií potvrdzujú [20,21], že hodnoty stromelyzínu-3 sú pri BCC viac než 10-násobne vyššie než v normálnej koži. Tento marker však býva najviac akumulovaný v tkanive strómy v tesnej blízkosti nádorových zoskupení, v samotných bunkách karcinómu sa nenachádza. Aj po experimentálnej indukcii sa mRNA stromelyzínu-3 vyskytovala v dermálnych fibroblastoch, ale nie v keratinocytoch [20]. Keďže stromelyzín-3 neprodukujú samotné nádorové bunky, je vysoko pravdepodobné, že k jeho tvorbe potencujú okolité celulárne komponenty, ktoré sa tak vo výraznej miere podieľajú na deštrukcii ECM a nádorovej invázii. Podobné výsledky boli dokázané aj pri syndecane-1, ktorý predstavuje ďalší významný indiktátor biologického správania BCC. Bayer-Garner et al [22] potvrdili, že so zvyšujúcou sa agresivitou BCC klesá expresia syndecanu-1 z povrchu nádorových buniek, ale v okolitom kóriu, ktoré ho za normálnych okolností neobsahuje, býva pri agresívnych typoch BCC syndecan-1 imunohistochemicky pozitívny. Podobne ako pri stromelyzíne aj v tomto prípade výsledky dokazujú, že syndecan-1 je skôr produkovaný stromálnymi bunkami než karcinómom a že proces nádorovej invazivity úzko súvisí so vzájomnou interakciou nádor – stróma. Na invazivite BCC sa vo výraznej miere podieľa aj zvýšená produkcia enzýmu kolagenázy IV [16], ktorý rozkladá kolagén IV predstavujúci hlavnú komponentu BM. Ďalším faktorom participujúcim na alterácii či remodelácii ECM pri infiltratívne rastúcich variantoch BCC je prítomnosť hyaluronanov. Bertheim et al [23] demonštrovali, že proliferačná aktivita nádorových buniek BCC signifikantne súvisí so zvýšenou produkciou hyaluronanu v stróme, pričom infiltratívne typy vykazovali intenzívnu expresiu v peritumoróznom tkanive. Je však zatiaľ otázne, či ide o prognosticky skôr priaznivú, alebo nepriaznivú črtu. Iná štúdia [14] okrem toho dokázala, že v 80 % rekurujúcich BCC býva v peritumoróznej stróme nadprodukovaný glykoproteín fibronectin, a naopak v 95 % recidivujúcich BCC dokázali v stróme v okolí karcinómu zníženú produkciu glykoproteínu vitronectinu, než býva za normálnych okolností. Zaujímavé výsledky prezentujú Boyd et al [24], ktorí porovnávali imunohistochemickú expresiu niektorých typov MMP a ich inhibítorov vo vzorkách BCC u imunosupresívnych a imunokompetentných pacientov. U ľudí s neporušenou imunitou boli inhibítory MMP omnoho výraznejšie produkované v stromálnych makrofágoch v okolí karcinómu, čo napovedá, že ich dostatočná peritumorálna expresia u inak zdravých jedincov limituje degradačné procesy ECM.
Adhezivita buniek a adhezívne faktory
Za fyziologických okolností je vzájomná väzba buniek výsledkom pôsobenia rôznych adhezívnych molekúl, pričom bunková súdržnosť je kľúčová pre udržiavanie mikroarchitektoniky a celkovej kohézie tkaniva. V procese nádorovej progresie zohráva významnú úlohu strata adhezívnych molekúl z povrchu epitelových buniek. K jedným z najvýznamnejších patria transmembránové glykoproteíny – cadheríny. V procese nádorovej invázie zapríčiňuje ich znížený počet separáciu malígnych buniek zo vzájomných zoskupení. Pizzaro et al [25] pozorovali významne zníženú expresiu E-cadherínu v nádorových bunkách pri infiltratívnych BCC v kontraste so superficiálnymi a nodulárnymi typmi. Tieto výsledky napovedajú, že E-cadherín môže súvisieť s rastovým charakterom a lokálnym agresívnym správaním BCC. Rast nádoru taktiež býva modifikovaný expresiou integrínov, ktoré slúžia ako receptory pre ďalšie zložky ECM, vrátane fibronektínu, laminínu, kolagénu a vitronektínu. Pri BCC však neboli dokázané signifikantné rozdiely v množstve alebo vzore expresie integrínového profilu (α-2 a β-1 integríny) v závislosti od rozdielnych histologických typov nádoru [26]. V jednej štúdii [27] korelovala expresia ß-catenínu v jadrách nádorových buniek BCC s ich zvýšenou proliferáciou, takže aj tento molekulový marker s adhezívnymi vlastnosťami môže mať potenciálny biologický efekt pri progresii tohto ochorenia.
Motilita buniek a molekuly s kontraktilnými vlastnosťami
V procese transformácie nádorových buniek a prechodu do invazívnejších foriem zohráva úlohu aj alterácia aktínovo-myozínového komplexu. Niektorí autori [28,29] uvádzajú pri agresívnejších rastových variantoch BCC vyšší stupeň imunohistochemickej expresie α – hladkosvalového aktínu (smooth muscle actin – SMA) v bunkách karcinómu aj v benígnych bunkách strómy. Taktiež je zjavné, že zvýšená kontraktilita proteínov v nádorových bunkách zapríčiňuje ich väčšiu motilitu a tak zvyšuje ich invazivitu a metastatický potenciál. Christian et al [29] preukázali expresiu aktínu v 0 % nodulárnych, 66 % mikronodulárnych a v 62 % morfeaformných BCC. V inej štúdii [30] sa aktín vyskytoval v 25 % nodulárnych a 100 % infiltratívnych BCC. Law et al [28] pri porovnávaní „klasických“ nodulárnych BCC (N-BCC) a kombinovaných nodulárno-infiltratívnych BCC (NI-BCC) potvrdili pozitivitu na aktín v 28 % N-BCC a v 100 % infiltratívnej rastovej komponenty NI-BCC. Navyše Bozdogan et al [4] demonštrovali signifikantné rozdiely vo vzájomnej expresii Bcl-2 proteínu (produkt významného onkogénu s antiapoptotickými vlastnosťami) v nádorových bunkách a expresii α-SMA v stróme. Zistili, že neagresívne BCC vykazovali konkomitantný a agresívne typy diskordantný typ imunoreaktivity. Z praktického hľadiska teda zvýšená expresia α-SMA v nenádorovej stróme v kombinácii so zníženou alebo až absentujúcou expresiou Bcl-2 v nádorových bunkách predikuje agresívne biologické správanie BCC. Ďalším biomarkerom s kontraktilnými vlastnosťami je calponín. Lee et al [31] potvrdili, že calponín býva omnoho častejší v zmiešaných nodulárno-infiltratívnych alebo infiltratívnych variantoch BCC v kontraste s nodulárnymi typmi, a predpokladajú, že môže byť jedným z najdôležitejších faktorov ovplyvňujúcich metastatický potenciál nádorových buniek. Na druhej strane však iná štúdia [30] nepreukázala štatisticky významné rozdiely v jeho expresii medzi jednotlivými histologickými typmi BCC.
Rastová aktivita buniek a proliferačné markery
Pri zhubných nádorových ochoreniach vo všeobecnosti platí, že vyšší stupeň proliferácie buniek koreluje s rýchlejším rastom nádoru, nižším stupňom diferenciácie a tým agresívnejším biologickým správaním. Hodnotenie proliferačnej aktivity (rastovej frakcie – growth fraction) nádoru preto patrí k jednému z najvýznamnejších morfologických prognostických indikátorov. V rutínnej bioptickej praxi sa proliferačná aktivita imunohistochemicky deteguje protilátkami proti Ki-67, prípadne PCNA (proliferačný bunkový jadrový antigén). Antigén Ki-67 je jadrový proteín prítomný v aktívnych fázach bunkového cyklu (G1, S, G2 a mitotická fáza), pokým v kľudovej fáze cyklu (G0) chýba. Hodnotenie tzv. Ki-67 indexu (obr. 3) patrí k základným prognostickým parametrom nádorov a v mnohých prípadoch je jeho stanovená percentuálna hodnota aj kritériom malignity.
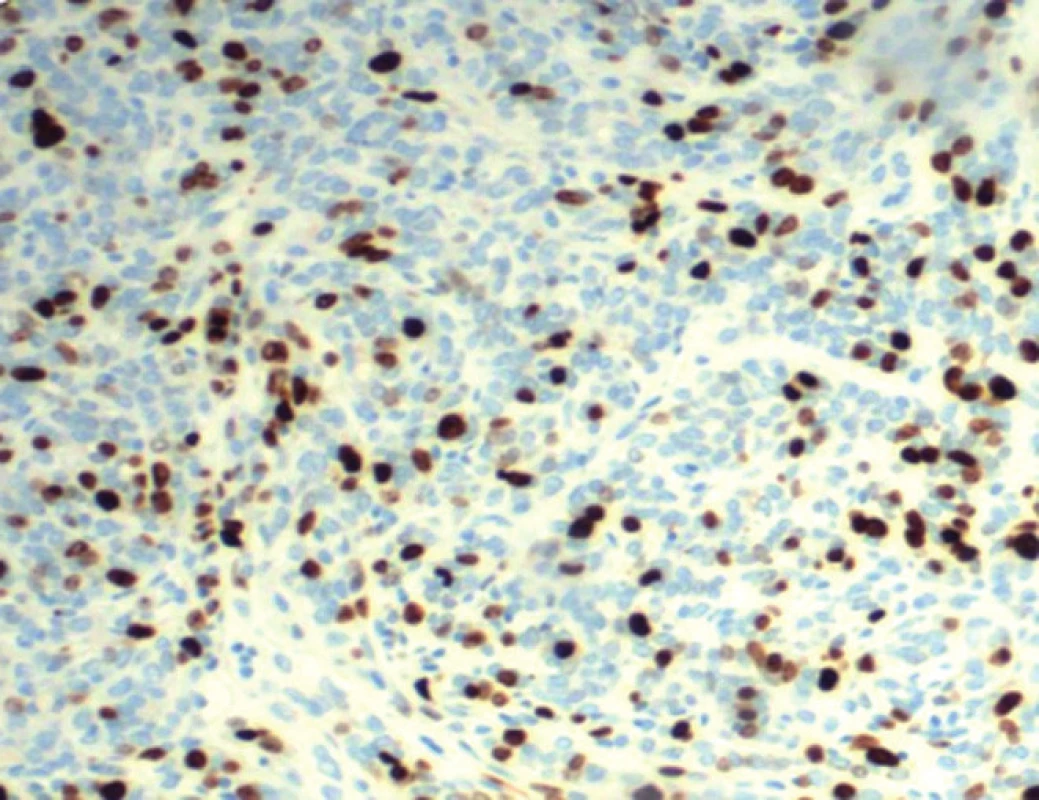
Hoci v porovnaní s inými zhubnými nádormi sa pri BCC vyskytuje pomerne vysoké percento proliferujúcich buniek, stupeň proliferácie varíruje v závislosti od jednotlivých histologických typov [32–35]. V práci Bauma et al [33] vykazovala Ki-67 rastová frakcia výrazné rozdiely medzi jednotlivými typmi BCC a to aj v rámci jednej a tej istej skupiny. Pri nodulárnom type varírovala medzi 7–67 %, pri superficiálnom medzi 18–49 % a pri fibrotizujúcom type v rozsahu 4–33 %. Aj Horlock et al [34] demonštrovali rozdiely medzi jednotlivými histologickými variantami. Najvyššie priemerné hodnoty Ki-67 pozitívnych buniek boli pri morfeaformnom (37 %), infiltratívnom (35 %) a superficiálnom type (30 %), o niečo nižšie pri nodulárnom (24 %) a mikronodulárnom (23 %) BCC. Nepotvrdili jednoznačný vzťah medzi stupňom proliferácie a stavom diferenciácie bazaliómov. Percentuálne zastúpenie proliferujúcich buniek korelovalo s veľkosťou karcinómu (väčšie lézie vykazovali vyššiu rastovú frakciu), hoci aj to mohlo súvisieť s nádorovým typom, pretože infiltratívne a morfeaformné karcinómy mali vo všeobecnosti väčšie rozmery. Zároveň možno očakávať aj rozdiely v proliferačnej aktivite primárnych a recidivujúcich BCC, pričom sa dá predpokladať vyššia rastová frakcia v rekurujúcich léziách. Niektoré štúdie skutočne potvrdili [36,37], že PCNA bol prítomný v menej než 10 % primárnych BCC, zatiaľ čo recidivujúce karcinómy vykazovali jeho expresiu vo viac ako 30 % nádorových buniek.
Hoci stupeň proliferujúcich buniek v BCC súvisí s jeho typom, resp. mikroarchitektonikou rastového vzoru, iba jednoduché percentuálne zastúpenie rastovej frakcie pravdepodobne nie je z prognostického hľadiska postačujúce [38]. Vo významnej miere závisí aj od charakteru distribúcie rastovo potentných buniek, ako aj samotnej intenzity imunohistochemického farbenia. V práci Horlocka et al [34] bola pri nodulárnom a superficiálnom BCC proliferačná aktivita akcentovaná prevažne na periférii nádorových hniezd, zatiaľ čo morfeaformné BCC preukazovali disperznejšie rozloženie proliferujúcich buniek. Vysvetlenie zonálnej distribúcie buniek s vysokým rastovým potenciálom môže byť také, že v strede hniezd sú alebo diferencovanejšie, alebo majú menší prístup k nutričným látkam, čo zapríčiňuje ich nižší rastový potenciál. K tomu môžu vo výraznej miere prispievať aj rozdielne adhezívne vlastnosti jednotlivých buniek [34]. Aj Baum et al [33] v staršej štúdii uvádzajú, že pri nodulárnych a superficiálnych BCC bola jadrová Ki-67 pozitivita prítomná buď v niekoľkých radoch periférnych buniek, alebo rovnomerne distribuovaná v centre aj v periférnych úsekoch nádorových zoskupení. Čo je však zaujímavé, charakter imunohistochemickej pozitivity v jednotlivých karcinómoch varíroval. Úseky s vysokým Ki-67 indexom sa často vyskytovali v tesnej blízkosti s oblasťami iba ojedinele sa farbiacich nádorových buniek. Táto skutočnosť napovedá, že samotný karcinóm v skutočnosti nepredstavuje stav uniformnej proliferácie buniek. Uvedené výsledky len podporuje práca Cabrala et al [38], ktorí imunohistochemicky hodnotili nodulárne a nenodulárne typy BCC. Pri nodulárnych bazaliómoch pozorovali 2 typy farbenia. Pri tzv. BCC s malými nodulmi (small nodular pattern) s dobre zachovaným periférnym palisádovatením bola proliferačná aktivita limitovaná iba na tieto bazálne bunky vo forme ložiskovej (clusters) distribúcie. Pri tzv. BCC s veľkými nodulmi (large nodular pattern) proliferačná aktivita v periférnych bazálnych bunkách absentovala a rastovo potentné bunky boli randomizovane distribuované v celej lézii. Mnoho nádorov však obsahovalo obidva uvedené vzory v separovaných (side-by-side) zoskupeniach, čo s najväčšou pravdepodobnosťou napovedá stratu bunkovej diferenciácie. Na základe toho predpokladajú, že určité mutácie môžu zapríčiňovať zmeny proliferačného stavu a rastovej mikroarchitektoniky nádorových buniek súvisiace s interakciami medzi karcinómom a extracelulárnou matrix. Následkom toho nádorové zoskupenia prechádzajú do neregulovanej proliferácie buniek difúzne distribuovaných v celej lézii. Fakt, že tieto dva rastové vzory môžu v jednom tumore vzájomne koexistovať, podporuje koncepciu biklonality (resp. polyklonality) nádorových buniek BCC. Z uvedených poznatkov teda vyplýva, že iba jednoduchá kvantifikácia proliferačnej aktivity nádorových buniek z pohľadu ďalšej prognózy tohto ochorenia nepostačuje. Aj podľa niektorých autorov [39] neexistujú signifikantné rozdiely v rastovej frakcii, resp. v stupni proliferácie buniek medzi prognosticky „priaznivejšími“ a „nepriaznivejšími“ BCC a tento parameter neobjasňuje ich rozdielne biologické správanie. Keďže skutočná mikroarchitektonika BCC je omnoho zložitejšia, než by sa dalo očakávať z „jednoducho vyzerajúcej“ distribúcie Ki-67-pozitívnych buniek, rastový vzor je pravdepodobne determinovaný okolitým väzivovým tkanivom, resp. charakterom interakcií medzi nádorom a strómou [33]. Zatiaľ preto ostáva na ďalších štúdiách, do akej miery môže prispieť hodnotenie rastovej frakcie nádorových buniek BCC pri rutínnom bioptickom vyšetrení ako prediktor ďalšieho klinického správania karcinómu.
Vzťah expresie tumor supresorických génov a onkogénov
Alterácie rôznych tumor supresorických génov a onkogénov sú významne zahrnuté v patogenéze takmer každého zhubného nádorového ochorenia a teda aj BCC kože. Z etiopatogenetického hľadiska je dôležité, že v najaktívnejších rastových fázach predstavujú bunky terč (target) pre genetické zmeny indukované rôznymi fyzikálnymi alebo chemickými mutagénmi. Podobne ako pri iných malignitách aj pri tomto nádore zohrávajú významnú úlohu mutácie tumor supresorického génu p53 a onkogénu Bcl-2, ktorých produkty možno imunohistochemicky detegovať v rámci štandardného bioptického vyšetrenia. K ďalším významným génom patrí už spomínaný tumor supresorický gén PTCH [1], či novšie študované protoonkogény WNT-1 [40] a cyklín D1 [41]. Využitie ich detekcie v bežnej patologickej praxi je však v súčasnosti obmedzené skôr na vedecko-výskumné účely.
Skutočnosť, že BCC vykazujú relatívne vysoké percento proliferujúcich nádorových buniek, nie je v súlade s poznatkom, že vo väčšine prípadov ide o pomaly a indolentne rastúce lézie. Keď berieme tento fakt do úvahy, potom možno pomerne vysokú rastovú frakciu vysvetliť buď predĺženým trvaním bunkového cyklu, alebo kontinuálnou stratou buniek s jej permanentným obnovovaním [33]. Jedným z vysvetlení indolentného biologického správania BCC môže byť vzájomná dysregulácia tvorby proteínov p53 a Bcl-2 [42]. Mutácia génu p53 alebo overexpresia Bcl-2 pravdepodobne postačujú na vznik BCC prostredníctvom supresie apoptózy [7,43]. „Imortalizácia“ progenitorových buniek epitelu vlasových folikulov a interfolikulárnej epidermy účinkom Bcl-2 predisponuje k mutagénnym inzultom UV žiarenia a indukcii BCC karcinogenézy [1]. Už v roku 1972 Kerr a Searle [44] predpokladali, že pomalý rastový charakter BCC môže vysvetlovať práve vysoký stupeň apoptózy nádorových buniek. Tento fakt neskôr potvrdili aj Mooney et al [45] pri porovnávaní výskytu mitotických a apoptotických buniek v BCC a malígnom melanóme, ktorý predstavuje kožnú malignitu s výrazne agresívnym a teda diametrálne odlišným biologickým správaním. Zistili, že pomer apoptotických a mitotických buniek (A/M pomer) bol omnoho vyšší pri BCC s priemernou hodnotou 10 (t.j. 10-násobne vyšší počet apoptózy než mitózy). Hoci množstvo apoptotických buniek všeobecne prevyšovalo nad bunkami mitotickými, samotné rozpätie A/M pomeru bolo dosť široké, pretože absolútny počet buniek podliehajúcich apoptóze výrazne varíroval v závislosti od konkrétnych prípadov. V podobnej štúdii Staibano et al [46] demonštrovali, že agresívne BCC preukazovali vyšší apoptotický index než indolentné formy a odlišovali sa od nich aj ďalšími morfometrickými nukleárnymi parametrami.
Z doterajších poznatkov sa zdá, že p53 dobre koreluje s „procesom dediferenciácie“ BCC [47] a nádory overexprimujúce p53 majú horšiu prognózu [48]. Práve agresívne rastové varianty BCC sú asociované s jadrovou p53 overexpresiou a stromálnou hyperpláziou [49]. Indolentné rastové varianty sú väčšinou sprevádzané nadprodukciou antiapoptotického proteínu Bcl-2 [50], zatiaľ čo jeho nízka hodnota koreluje s klinicky agresívnymi rastovými variantami BCCs [4]. Stupeň Bcl-2 expresie tak môže slúžiť ako marker priaznivého biologického správania nádoru. Parciálna alebo kompletná strata Bcl-2 počas histologickej transformácie karcinómu so vznikom nádorových klonov exprimujúcich p53 proteín môže byť považovaná za signál prechodu „low-grade“ do „high-grade“ BCC [43]. Z pohľadu ďalšej prognózy ochorenia a liečby môže detekcia týchto dvoch markerov v rámci bioptického vyšetrenia poskytnúť dôležité prognostické informácie, a prispieť tak k predikcii celkového priebehu ochorenia jednotlivých pacientov. Napríklad Zagrodnik et al [51] pozorovali, že pacienti liečení rádioterapiou preukazovali najčastejšie rekurencie pri sklerotizujúcom type BCC, ktorý preukazoval imunohistochemicky signifikantne vyššiu expresiu p53 a nízku expresiu Bcl-2.
Progresia ochorenia a metastázovanie
Ako už bolo spomenuté, presné faktory ovplyvňujúce progresiu ochorenia a najmä vznik metastáz nie sú dodnes známe. Kaur et al [52] nedávno postulovali možný nasledovný viacstupňový (multistep) model BCC progresie: superficiálny → nodulárny → mikronodulárny alebo superficiálny → nodulárny → infiltratívny → morfeaformný BCC. Vo svojej štúdii potvrdili lineárny vzťah uvedeného modelu s tkanivovou odpoveďou (host response) a alteráciou nádorovej strómy. Na základe toho možno predpokladať, že rôzne BCC vykazujú rozdielne epitelovo-stromálno-zápalové „vzory“, ktoré korelujú s jednotlivými typmi BCC, nádorovou progresiou a evolúciou z „low risk“ do „high risk“ foriem karcinómu. V tomto histologickom spektre medzičlánok medzi indolentnými a agresívnymi rastovými variantami pravdepodobne predstavuje mikronodulárny BCC [53]. Stále sa však diskutuje [54], či všetky infiltratívne typy BCC vznikajú z pôvodne indolentných BCC, alebo sa môžu vyvíjať aj ab initio. Ak pripustíme, že morfeaformné BCC bývajú odvodené z bežnejších typov BCC, tak ide o sekundárny fenomén nádorovej progresie a nie o de novo vzniknutú chorobnú jednotku. Na druhej strane trvalá iritácia kože alebo fibrotické zmeny tkaniva môžu prinajmenej v časti prípadov iniciovať zmeny predisponujúce k tomuto typu karcinómu. Monitorovanie vývojovej sekvencie BCC je však v klinickej praxi veľmi obtiažne až takmer nemožné, pretože prevažná väčšina nádorov býva odstránená až po určitom rastovom intervale, počas ktorého sa môže histomorfologický obraz a charakter karcinómu meniť.
Či už akceptujeme teóriu „multistep“ modelu BCC progresie, alebo nie, stále nie je ujednotený názor, do akej miery predisponujú infiltratívne rastové varianty BCC k metastatickému postihnutiu [55,56]. Metastázy sa pri tomto ochorení vyskytujú iba v extrémne raritných prípadoch a ich uvádzaná incidencia je v rozpätí 0,0028–0,5 % všetkých BCC [55]. Primárne BCC môžu metastázovať hematogénnou alebo lymfogénnou cestou, pričom doteraz najčastejšie opisované sekundárne ložiská sa nachádzali v lymfatických uzlinách, pľúcach, kostiach a koži [55]. V praxi je však dôležité nezamienať metastázy s lokálnym infiltratívnym šírením nádoru, najmä prostredníctvom perineurálnej invázie do priľahlých partií tela. Aj keď dosiaľ diagnostikované prípady metastatických BCC preukazujú častejší výskyt agresívnejších histologických typov [57], táto tematika je stále diskutabilná. V práci Loa et al [58] malo z 12 prípadov metastatických BCC až 11 pacientov morfeaformný typ karcinómu, ale všetky lézie boli buď recidivujúce, alebo invadujúce do hlbokých štruktúr a mali väčšie rozmery. Na druhej strane Snow et al [59] demonštrovali pri morfeaformnom BCC výskyt metastáz v menej než 1 %, čo je v porovnaní s predchádzajúcou štúdiou veľmi nízke percento. Zdá sa, že zo všetkých typov BCC má najvyššiu incidenciu metastáz bazoskvamózny (metatypický) karcinóm, ktorý v štúdii Bowmana et al [60] metastázoval až v 7,4 % prípadov. Keď však zohľadníme celkovo zriedkavý výskyt metastáz pri tomto ochorení, porovnávanie biologických charakteristík primárnych a sekundárnych BCC je prakticky nemožné. Z toho dôvodu aj eventuálne faktory predpovedajúce, ktoré BCC budú metastázovať, zatiaľ nemožno jednoznačne definovať. Mnohí autori však doteraz nepreukázali evidentné morfologické rozdiely v primárnych a metastatických BCC. Niektoré štúdie [26,61] sledovali význam rôznych bunkových adhezívnych molekúl v nádorových metastázach BCC, ale nepotvrdili žiadnu koreláciu ich expresie či distribúcie v závislosti od histologických typov nádoru. V práci Bauma et al [61] sa integrínový profil (α – a β – integríny) BCC významnejšie neodlišoval v metastatických karcinómoch a nemôže byť považovaný za príčinu „nemestatického“ fenotypu tohto nádorového ochorenia. Aj podľa Giriho et al [62] nevykazovali BCC pri získavaní metastatického potenciálu zmeny v expresii Bcl-2 a CD 44 (povrchový bunkový marker), ktoré sú považované za významné markery pre ich indolentné biologické správanie. Uzquiano et al [30] poukázali, že hoci zvýšená produkcia aktínu v nádorových bunkách bezpochybne ovplyvňuje lokálnu invazivitu BCC, tento marker nebol výraznejšie exprimovaný v metastatických formách. Taktiež neboli pozorované ani evidentné ultraštrukturálne rozdiely medzi metastatickými a primárnymi BCC [63]. Treba však pripomenúť, že v dôsledku výraznej fenotypovej heterogenity jednotlivých histologických typov BCC je obtiažne robiť definitívne závery týkajúce sa vzťahu medzi ich invazívnym potenciálom a rozdielmi v expresii bunkových markerov. Pri jednotlivých BCC však boli doteraz identifikované viaceré gény, ktoré môžu významne ovplyvňovať či determinovať ich individuálne klinické a morfologické charakteristiky. Výsledky molekulových štúdií napovedajú [64], že expresia génov pri určitých typoch BCC preukazuje signifikantné variácie, zvlášť v génoch asociovaných so signálnou kaskádou mitogénmi aktivovaných proteínových kináz (mitogen-activated protein kinase pathway). Táto signálna dráha za normálnych podmienok odpovedá na rozličné extracelulárne stimuly (mitogény) a reguluje mnohé bunkové aktivity, ako expresiu génov, mitózy, diferenciáciu či apoptózu buniek. Yu et al [64] recentne dokázali, že pri morfeaformnom BCC vykazujú niektoré gény omnoho výraznejšie zmeny v kontraste s nodulárnym a superficiálnym BCC a že genetické alterácie odpovedajúce na stimuly poškodenia DNA sú pri morfeaformných BCC nadmerne regulované. Ich výsledky napovedajú podobnosť v génovej expresii pri indolentných formách BCC, ale omnoho diverznejšie zmeny pri morfeaformných BCC, čím by bolo možné vysvetliť ich invazívne správanie. Významnú úlohu môže zohrávať aj metastázy-supresorický gén Nm23, ktorého expresia inverzne koreluje s metastatickým potenciálom niektorých malígnych nádorov. V práci Kanitakisa et al [65] vykazovali imunohistochemicky všetky BCC difúznu pozitivitu na Nm23, najmä v bunkách lokalizovaných na periférii nádorových ložísk. V kontraste s tým väčšina skvamocelulárnych karcinómov kože bola pozitívna iba minimálne, prípadne úplne negatívna. Preto sa zdá, že tieto rozdiely reflektujú odlišný potenciál metastázovania uvedených dvoch kožných nádorov. Na blokovaní metastatického potenciálu sa môže podieľať aj nízka expresia niektorých izoforiem receptora pre kyselinu hyalurónovú (CD44std, CD44v6, CD44v10). V štúdii Bauma et al [66] vykazovali všetky BCC imunohistochemicky veľmi nízku expresiu CD44std, na základe čoho sa predpokladá, že môže ísť o jeden z faktorov blokujúci proces metastázovania.
Záver
V našej práci sme poskytli zjednodušený prehľad najdôležitejších poznatkov o biologickom správaní BCC kože a najvýznamnejších molekulových biomarkeroch, ktoré ovplyvňujú a pri štandardnom bioptickom vyšetrení zároveň predikujú ďalší priebeh ochorenia. Potrebné je však zdôrazniť, že pri tomto ochorení ostáva zatiaľ stále množstvo nezodpovedaných otázok. Vzhľadom na jeho klinicko-morfologickú rôznorodosť niektorí autori [2] polemizujú, či je správne uvedený nádor vždy nazývať karcinóm alebo či by aspoň pre indolentné rastové varianty nebolo vhodnejšie uprednostniť „benígnejšie pôsobiace“ označenie bazalióm. Za jeho minimálnu schopnosť metastázovania pravdepodobne zodpovedajú biochemické procesy nenádorového peritumorózneho tkaniva, ktoré sú spúšťané a regulované rôznorodými vnútornými a vonkajšími faktormi. V súčasnosti je potrebné naďalej skúmať nové molekulové markery, ktoré v najväčšej miere ovplyvňujú biologické správanie a progresiu tohto nádoru a ktoré by mohli mať v budúcnosti aj prognostické využitie v diagnosticko-terapeutickom procese ochorenia.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Vladimír Bartoš
P. Mudroňa 30/16
036 01 Martin
Slovenská republika
e-mail: bartos@jfmed.uniba.sk
Obdrženo/Submitted: 15. 7. 2010
Přijato/Accepted: 6. 10. 2010
Sources
1. Crowson AN. Basal cell carcinoma: biology, morphology and clinical implications. Mod Pathol 2006; 19 (Suppl 2): S127–S147.
2. Tilli CM, Van Steensen MA, Krkels GA et al. Molecular aetiology and pathogenesis of basal cell carcinoma. Br J Dermatol 2005; 152(6): 1108–1124.
3. Vantuchová Y, Čuřík R. Histological types of basal cell carcinoma. Scripta Medica (Brno) 2006; 79(5–6): 261–270.
4. Bozdogan O, Erkek E, Atasoy P et al. Bcl-2-related proteins, alpha-smooth muscle actin and amyloid deposits in aggressive and non-aggressive basal cell carcinoma. Acta Derm Venereol 2002; 82(6): 423–427.
5. Saldanha G, Fletcher A, Slater DN. Basal cell carcinoma: a dermatopathological and molecular biological update. Br J Dermatol 2003; 148(2): 195–202.
6. Bartoš V, Adamicová K, Kullová M et al. Bazocelulárny karcinóm kože – najvýznamnejšie rizikové a prognostické parametre ochorenia v klinickej praxi. Prakt Lék 2010; 90(3): 160–166.
7. Bolskahov S, Walker CM, Strom SS et al. p53 mutations in human aggressive and nonaggressive basal and squamous cell carcinomas. Clin Cancer Res 2003; 9(1): 228–234.
8. Kim MY, Park HJ, Baek SC et al. Mutations of the p53 and PTCH gene in basal cell carcinomas: UV mutation signature and strand bias. J Dermatol Sci 2002; 29(1): 1–9.
9. Watson A, Kent P, Alam M et al. GLI1 genotypes do not predict basal cell carcinoma risk: a case control study. Mol Cancer 2009; 8 : 113.
10. Plevová P, Krutílková V, Puchmajerová A et al. Gorlinův syndrom. Klin Onkol 2009; 22 (Suppl): S34–S35.
11. Plevová P, Šilhánová E, Foretová L. Vzácné hereditární syndromy s vyšším rizikem vzniku nádorů. Klin Onkol 2006; 19 (Suppl): S68–S75.
12. Valdivielso M, Longo I, Sauárez R et al. Acrokeratosis paraneoplastica: Bazex syndrome. J Eur Acad Dermatol Venereol 2005; 19(3): 340–344.
13. Walling HW, Fosko SW, Geraminejad PA. Aggressive basal cell carcinoma: Presentation, pathogenesis, and management. Cancer Metastasis Rev 2004; 23(3–4): 389–402.
14. Marasa L, Marasa S, Sciancalepore G. Collagen IV, laminin, fibronectin, vitronectin. Comparative study in basal cell carcinoma. Correlation between basement membrane molecules expression and invasive potential. G Ital Dermatol Venereol 2008; 143(3): 169–173.
15. Hayakawa TJ, Pilavdzic D, Magro CM et al. The ultrastructure of aggressive – versus indolent – growth basal cell carcinoma: a comparative study (abstract). Lab Invest 1998; 78 : 50A.
16. Adamicová K, Fetisovová Ž, Mellová Y et al. Invazívny typ bazocelulárneho karcinómu. Lekárske Listy 2004; 17 : 4–5.
17. Adamicová K, Fetisovová Ž, Mellová Y a kol. Hodnotenie bazálnej membrány u morfeaformného (invazívneho) bazaliómu. Čes-slov Derm 2005; 80(2): 76–81.
18. Mostafa WZ, Mahfouz SM, Bosseila M et al. An immunohistochemical study of laminin in basal cell carcinoma. J Cutan Pathol 2010; 37(1): 68–74.
19. Kerkelä E, Saarialho-Kere U. Matrix metalloproteinases in tumor progression: focus on basal and squamous cell skin cancer. Exp Dermatol 2003; 12(2): 109–125.
20. Majmudar G, Nelson BR, Jensen TC et al. Increased expression of stromelysin-3 in basal cell carcinomas. Mol Carcinog 1994; 9(1): 17–23.
21. Wagner SN, Ruhri C, Kunth K et al. Expression of stromelysin 3 in the stromal elements of human basal cell carcinoma. Diag Mol Pathol 1992; 1(3): 200–205.
22. Bayer-Garner IB, Dilday B, Sanderson RD et al. Syndecan-1 expression is decreased with increasing aggressivennes of basal cell carcinoma. Am J Dermatopathol 2000; 22(2): 119–122.
23. Bertheim U, Hofer PA, Engstrom-Laurent A et al. The stromal reaction in basal cell carcinomas. A prerequisite for tumour progression and treatment strategy. Br J Plast Surg 2004; 57(5): 429–439.
24. Boyd S, Tolvanen K, Virolainen S et al. Differential expression of stromal MMP-1, MMP-9 and TIMP-1 in basal cell carcinomas of immunosuppressed patients and controls. Virchows Arch 2008; 452(1): 83–90.
25. Pizzaro A, Benito N, Navarro P et al. E-cadherin expression in basal cell carcinoma. Br J Cancer 1994; 69(1): 157–162.
26. Pentel M, Helm KF, Maloney MM. Cell surface molecules in basal cell carcinomas. Dermatol Surg 1995; 21(10): 858–861.
27. Saldanha G, Ghura V, Potter L et al. Nuclear beta-catenin in basal cell carcinoma correlates with increased proliferation. Br J Dermatol 2004; 151(1): 157–164.
28. Law AM, Oliveri CV, Pacheco-Quinto X et al. Actin expression in purely nodular versus nodular-infiltrative basal cell carcinoma. J Cutan Pathol 2003; 30(4): 232–236.
29. Christian MM, Moy RL, Wagner RF et al. A correlation of alpha-smooth muscle actin and invasion in micronodular basal cell carcinoma. Dermatol Surg 2001; 27(5): 441–445.
30. Uzquiano MC, Prieto VG, Nash JW et al. Metastatic basal cell carcinoma exhibits reduced actin expression. Mod Pathol 2008; 21(5): 540–543.
31. Lee MW, Ahn SJ, Choi JH et al. Actin and calponin expression in basal cell carcinoma. Br J Dermatol 2004; 151(4): 934–936.
32. Abdelsayed RA, Guijarro-Rojas M, Ibrahim NA et al. Immunohistochemical evaluation of basal cell carcinoma and trichepithelioma using Bcl-2, Ki67, PCNA and p53. J Cutan Pathol 2000; 27(4): 169–175.
33. Baum HP, Meurer I, Unteregger G. Ki-67 antigen expression and growth pattern of basal cell carcinomas. Arch Dermatol Res 1993; 285(5): 291–295.
34. Horlock NM, Wilson GD, Daley F et al. Cellular proliferation characteristics of basal cell carcinoma: relationship to clinical subtype and histopathology. Eur J Surg Oncol 1997; 23(3): 247–252.
35. Naeyaert JM, Pauwels C, Geerts ML et al. CD-34 and Ki-67 staining patterns of basaloid follicular hamartoma are different from those in fibroepithelioma of Pinkus and other variants of basal cell carcinoma. J Cutan Pathol 2001; 28(10): 538–541.
36. Toth DP, Guenther LC, Shum DT. Proliferating cell nuclear antigen (PCNA); prognostic value in the clinical recurrence of primary basal cell carcinoma. J Dermatol Sci 1996; 11(1): 36–40.
37. Kazantseva IA, Khlebnikova AN, Babaev VR. Immunohistochemical study of primary and recurrent basal cell and metatypical carcinomas of the skin. Am J Dermatopathol 1996; 18(1): 35–42.
38. Cabral A, Van Haaften C, Boon ME. Proliferation patterns reflect architectural dedifferentiation: A study of nodular basal cell carcinoma. J Dermatol 2004; 31(4): 305–313.
39. Horlock N, Wilson GD, Daley FM et al. Cellular proliferation characteristics do not account for the behaviour of horrifying basal cell carcinoma. A comparison of the growth fraction of horrifying and non horrifying tumours. Br J Plast Surg 1998; 51(1): 59–66.
40. Lo Muzio L, Pannone G, Staibano S et al. WNT-1 expression in basal cell carcinoma of head and neck. An immunohistochemical and confocal study with regard to the intracellular distribution of beta-catenin. Anticancer Res 2002; 22(2A): 565–576.
41. Staibano S, Lo Muzio L, Pannone G et al. DNA ploidy and cyclin D1 expression in basal cell carcinoma of the haed and neck. Am J Clin Pathol 2001; 115(6): 805–813.
42. Cerroni L, Keri H. Aberrant bcl-2 protein expression provides a possible mechanism of neoplastic cell growth in cutaneous basal cell carcinoma. J Cutan Pathol 1994; 21(5): 398–403.
43. Staibano S, Lo Muzio L, Pannone G et al. Interaction between bcl-2 and P53 in neoplastic progression of basal cell carcinoma of the head and neck. Anticancer Res 2001; 21(6A): 3757–3764.
44. Kerr JF, Searle J. A suggested explanation for the paradoxically slow growth rate of basal-cell carcinomas that contain numerous mitotic figures. J Pathol 1972; 107(1): 41–44.
45. Mooney EE, Peris Ruis JM, O‘Neill A et al. Apoptotic and mitotic indices in malignant melanoma and basal cell carcinoma. J Clin Pathol 1995; 48(3): 242–244.
46. Staibano S, Lo Muzio L, Mezza E et al. Prognostic value of apoptotic index in cutaneous basal cell carcinomas of head and neck. Oral Oncol 1999; 35(6): 541–547.
47. Barrett TL, Smith KJ, Hodge JJ et al. Immunohistochemical nuclear staining for p53, PCNA, and Ki-67 in different histologic variants of basal cell carcinoma. J Am Acad Dermatol 1997; 37 (3 Pt 1): 430–437.
48. Shea CR, McNutt NS, Volkenandt M et al. Overexpression of p53 protein in basal cell carcinomas of human skin. Am J Pathol 1992; 141(1): 25–29.
49. Crowson AN, Magro CM, Pilavdzic D et al. Differential stromal p53 expression in human basal cell carcinoma (abstract). Lab Invest 1997; 76 : 43A.
50. Crowson AN, Magro CM, Kadin M et al. Differential expression of bcl-2 oncogene in human basal cell carcinoma. Hum Pathol 1996; 27(4): 355–359.
51. Zagrodnik B, Kempf W, Seifert B et al. Superficial radiotherapy for patients with basal cell carcinoma: recurrence rates, histologic subtypes, and expression of p53 and bcl-2. Cancer 2003; 98(12): 2708–2714.
52. Kaur P, Mulvaney M, Carlson JA. Basal cell carcinoma progression correlates with host immune response and stromal alterations: a histological analysis. Am J Dermatopathol 2006; 28(4): 293–307.
53. Hendrix JD Jr, Parlette HL. Micronodular basal cell carcinoma: a deceptive histologic subtype with frequent clinically undetected tumor extension. Arch Dermatol 1996; 132(3): 295–298.
54. Widgerow AD, Christofides T. Morpheic basal cell carcinoma: transformation or original pathology? Int Journal Plastic Surg 2006; 2(2): electronic letter.
55. Malone JP, Fedok FG, Belchis DA et al. Basal cell carcinoma metastatic to the parotid: report of a new case and review of the literature. Ear Nose Throat 2000; 79(7): 511–515, 518–519.
56. Bozikov K, Taggart I. Metastatic basal cell carcinoma: is infiltrative/morpheaform subtype a risk factor? Eur J Dermatol 2006; 16(6): 691–692.
57. Ting PT, Kasper R, Arlette JP. Metastatic basal cell carcinoma: report of two cases and literature review. J Cutan Med Surg 2005; 9(1): 10–15.
58. Lo JS, Snow SN, Reizner GT et al. Metastatic basal cell carcinoma: report of twelve cases with a review of the literature. J Am Acad Dermatol 1991; 24 (5 Pt 1): 715–719.
59. Snow SN, Sahl W, Lo JS et al. Metastatic basal cell carcinoma. Report of five cases. Cancer 1994; 73(2): 328–335.
60. Bowman PH, Ratz JL, Knoepp TG et al. Basosquamous carcinoma. Dermatol Surg 2003; 29(8): 830–832.
61. Baum HP, Schmid T, Reichrath J. Integrin molecules: A clue to the non-metastasizing behaviour of basal cell carcinomas? Acta Derm Venereol 1996; 76(1): 24–27.
62. Giri DD, Gupta PK, Hoda RS. Cytologic diagnosis of metastatic basal cell carcinoma: Report of a case with immunocytochemical and molecular pathologic considerations. Acta Cytol 2000; 44(2): 232–236.
63. Sarma DP. Metastatic basal cell carcinoma: electron microscopic study of the primary and the metastatic lesion. South Med J 1980; 73(6): 799–801.
64. Yu M, Zloty D, Shapiro J et al. Superficial, nodular, and morpheiform basal-cell carcinomas exhibit distinct gene expression profiles. J Invest Dermatol 2008; 128(7): 1797–1805.
65. Kanitakis J, Euvrard S, Bourchany D et al. Expression of the nm23 metastasis-suppressor gene product in skin tumors. J Cutan Pathol 1997; 24(3): 151–156.
66. Baum HP, Schmid T, Schock G et al. Expression of CD44 isoforms in basal cell carcinomas. Br J Dermatol 1996; 134(3): 465–468.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2011 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
- Vývoj nových léčiv u solidních nádorů – změna pohledu na optimální design klinických studií
- Ischemická choroba srdca a hypertenzia ako neskoré následky liečby nádorov testis – prehľad
- Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
- Algoritmus separace plazmatických buněk ze vzorků kostní dřeně
- Oportunní infekce mozku u pacientů po komplexní terapii nádorového onemocnění
- Vulvárna intraepiteliálna neoplázia
- Antineoplastické účinky simvastatínu u experimentálnej rakoviny prsníka
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
- Vulvárna intraepiteliálna neoplázia
- Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
- Oportunní infekce mozku u pacientů po komplexní terapii nádorového onemocnění

