Castlemanova choroba: retrospektivní studie léčebných výsledků u 10 pacientů z jednoho centra
Castleman Disease: Retrospective Single-Center Study of Therapeutic Results in 10 Patients
Background:
Castleman disease is a non-clonal lymphoproliferative disorder with 2 clinical (unicentric, multicentric) and 4 histomorphological (hyaline vascular, plasma cell, mixed, plasmablastic) forms which combine creating a pleomorphic picture of this rare entity. In our work, the largest documented cohort in the Czech Republic was analyzed focusing on diagnostics and particularly on therapy.
Patients and Methods:
The retrospective study (1998–2013) included 10 patients, 6 males, 4 females. Patients with unicentric form (3) underwent surgical sanation. Patients with multicentric form (7) were followed-up only (2) or extirpation of the largest mass was carried out (1) or a systemic therapy was administered (4) which comprised the following regimens: R-CHOP (rituximab, cyclophosphamide, doxorubicin, vincristine, prednisone), CTD/CAD/CVD (cyclophosphamide, thalidomide/adriamycin/bortezomib, dexamethasone), further including monotherapies with tocilizumab, thalidomide and lenalidomide and in one case (associated POEMS syndrome, i.e. polyneuropathy, organomegaly, endocrinopathy, monoclonal gammopathy, skin changes) autologous stem cell transplantation after melphalan conditioning was performed. During treatment response monitoring, all patients underwent PET/CT examination (fluorodeoxyglucose positron emission tomography/computed tomography).
Results:
The remission rate was 50% (3 unicentric forms with remission lasting 51, 8 and 9 months, resp.; 2 multicentric forms with remission lasting 3 months during thalidomide therapy and 12 months after lenalidomide therapy), stable disease was observed in 40% of cases (multicentric forms, 2 without any treatment followed-up for 171 and 24 months, resp.; 1 after systemic therapy followed-up for 23 months; 1 after two extirpations with stable lymphadenopathy for 15 years, where the first operation was 27 years ago). In one patient (10%), the associated POEMS syndrome progressed rapidly with fatal consequences (4 months follow-up).
Conclusion:
Unlike unicentric forms completely curable by excision, multicentric forms are often treatment-refractory. Concerning high cost-effectiveness, good tolerability and documented efficacy also in rituximab-resistant cases, we prefer immunomodulatory drugs (particularly thalidomide) for managing multicentric Castleman disease in our center.
Key words:
Castleman disease – monoclonal antibody – rituximab – tocilizumab – thalidomide – lenalidomide – positron emission tomography – computed tomography
Authors:
P. Szturz 1; Z. Adam 1; Z. Řehák 2; R. Koukalová 2; A. Šprláková-Puková 3; J. Michalka 1; L. Šmardová 1; P. Volfová 1; M. Lengerová 1; J. Mayer 1
Authors‘ workplace:
Interní hematologická a onkologická klinika LF MU a FN Brno
1; Oddělení nukleární medicíny, PET centrum Masarykova onkologického ústavu v Brně
2; Radiologická klinika LF MU a FN Brno
3
Published in:
Klin Onkol 2013; 26(2): 124-134
Category:
Original Articles
Overview
Východiska:
Castlemanova choroba je neklonální lymfoproliferativní onemocnění se 2 klinickými (unicentrická, multicentrická) a 4 histomorfologickými (hyalinně-vaskulární, plazmocelulární, smíšená, plazmablastická) formami, které se mohou navzájem různě kombinovat, vytvářejíce tak pleomorfní obraz této vzácné jednotky. V naší práci analyzujeme dosud největší popsaný soubor pacientů v České republice se zaměřením na diagnostiku a zejména terapii.
Soubor pacientů a metody:
Do retrospektivní studie (1998–2013) bylo zařazeno 10 pacientů, 6 mužů a 4 ženy. Pacienti s unicentrickou formou (3) podstoupili chirurgickou sanaci. Pacienti s multicentrickou formou (7) byli jen sledováni (2), nebo byla provedena exstirpace největší masy (1), nebo podána systémová léčba (4), která sestávala z následujících režimů: R-CHOP (rituximab, cyklofosfamid, adriamycin, vinkristin, prednison), CTD/CAD/CVD (cyklofosfamid, thalidomid/adriamycin/bortezomib, dexametazon), dále zahrnovala monoterapie tocilizumabem, thalidomidem a lenalidomidem a v jednom případě (asociovaný POEMS syndrom = polyneuropatie, organomegalie, endokrinopatie, monoklonální gamapatie, kožní změny) byla provedena autologní transplantace periferních kmenových buněk po přípravném režimu s melfalanem. Všichni pacienti podstoupili v rámci sledování léčebné odpovědi vyšetření PET/CT (pozitronová emisní tomografie s 18F-fluorodeoxyglukózou/výpočetní tomografie).
Výsledky:
Bylo dosaženo 50 % remisí (3 pacienti s unicentrickou formou s remisí 51, 8 a 9 měsíců; 2 s multicentrickou formou s remisí 3 měsíce při léčbě s thalidomidem a 12 měsíců po léčbě lenalidomidem), ve 40 % případů bylo onemocnění stabilní (multicentrické formy, 2 zcela bez léčby, sledování 171 a 24 měsíců; 1 po systémové léčbě, sledování 23 měsíců; 1 po dvou exstirpacích se stabilním rozsahem lymfadenopatie 15 let, přičemž od první operace uplynulo 27 let), u jedné pacientky (10 %) došlo k rychlé progresi asociovaného POEMS syndromu s úmrtím (sledována 4 měsíce).
Závěr:
Na rozdíl od unicentrické formy vyléčitelné pouhou excizí bývá multicentrický typ často refrakterní k léčbě. Z důvodu vysoké nákladové efektivnosti, dobré snášenlivosti a popsaného efektu i v rituximab-rezistentních případech upřednostňujeme na našem pracovišti při léčbě multicentrické Castlemanovy choroby imunomodulační léky (především thalidomid).
Klíčová slova:
Castlemanova choroba – monoklonální protilátka – rituximab – tocilizumab – thalidomid – lenalidomid – pozitronová emisní tomografie – výpočetní tomografie
Úvod
Před téměř 60 lety popsali Castleman a Towne případ pacienta s mediastinální expanzí připomínající thymom [1]. Zanedlouho poté, v roce 1956, shrnul Castleman se spolupracovníky podobné histologické nálezy celkem u 13 pacientů [2]. Jednalo se tehdy o první publikace charakterizující novou nozologickou jednotku, později pojmenovanou podle svého objevitele Castlemanova choroba (Castleman disease – CD). V dnešní době je na CD pohlíženo jako na neklonální lymfoproliferativní onemocnění se dvěma klinickými (unicentrická a multicentrická) a čtyřmi histomorfologickými (hyalinně-vaskulární, plazmocelulární, smíšená a plazmablastická) formami, které se mohou navzájem různě kombinovat, a vytvářet tak pleomorfní obraz tohoto vzácného onemocnění. Na pomyslné škále agresivity pak na straně benigní ložiskové lymfadenopatie leží unicentrická hyalinně-vaskulární varianta a na protilehlé straně multicentrická plazmocelulární či ještě agresivnější plazmablastická CD s celkovými příznaky a abnormálními laboratorními nálezy (obr. 1). Zatímco lokalizovaná forma je vyléčitelná pouhou excizí postižených lymfatických uzlin, multicentrický typ je často refrakterní k léčbě, a to i přes použití intenzivní chemoterapie [3,4]. Tab. 1 srovnává v přehledu základní rysy unicentrické a multicentrické CD.
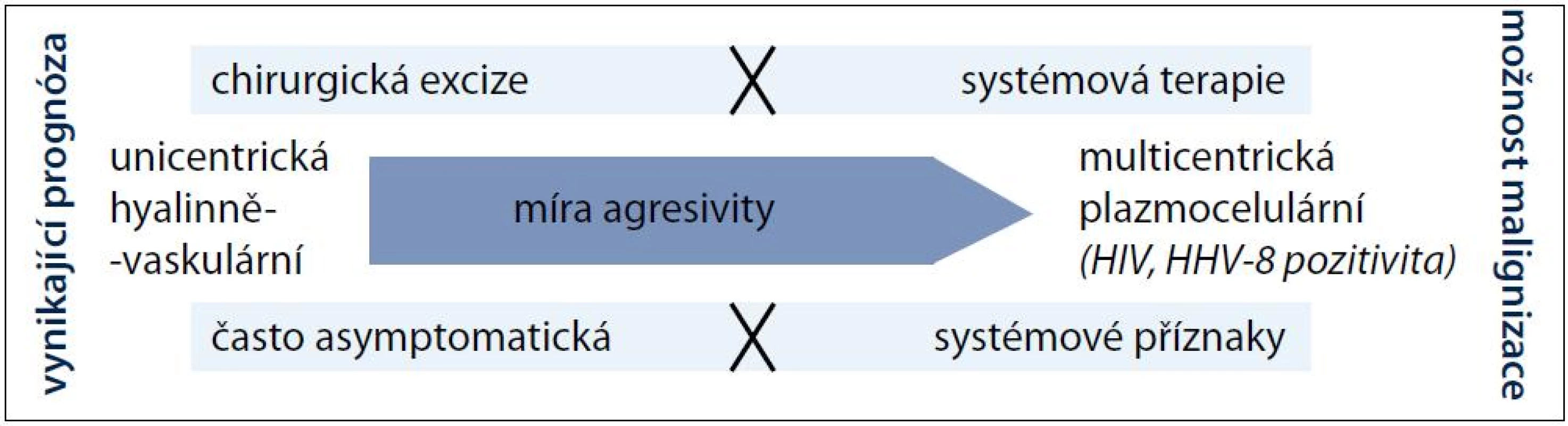
![Základní charakteristiky obou klinických forem CD [13,19,46–49].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1ffbdfae44bbb4d6eb3ab1a6be01f87a.png)
Zvětšené lymfatické uzliny jakožto typická manifestace CD bývají nejčastěji nalézány v oblasti mediastina (70 %), krku (15 %), v dutině břišní a pánvi (15 %). Nemoc však může zasáhnout jakýkoliv orgán, napodobujíc tak některé obvyklejší benigní i maligní afekce [5]. Jelikož je toto onemocnění často poddiagnostikované nebo špatně diagnostikované, přesné údaje o jeho výskytu v populaci nejsou známy. Často asymptomatická unicentrická forma totiž bývá nezřídka diagnostikována náhodně při rutinní lékařské prohlídce a multicentrická forma může naopak zůstat vzhledem ke své pestré klinické prezentaci dlouho diagnostickými nástroji nezachycena [6]. Odhadovaný počet případů v USA sahá od 30 000 ke 100 000 postižených s vypočtenou roční incidencí 2,1/100 000 osob [6–8]. Diagnostika CD je sice založena na histopatologickém nálezu, ten ale v případě plazmocelulární varianty není zcela specifický. Diferenciálně diagnosticky je třeba odlišit B lymfomy, vzácné plazmocytomy, reaktivní lymfadenopatie asociované s infekcí, autoimunitní choroby, jako je revmatoidní artritida, nebo reaktivní lymfadenopatie asociované s jinými imunodeficity [3]. Stanovení správné diagnózy CD je tak nakonec průsečíkem klinického vyšetření, laboratorních dat, nálezu ze zobrazovacích modalit a histopatologického vyšetření.
Stěžejní roli v patofyziologii CD hraje dysregulace cytokinové sítě. Jako klíčový byl v této souvislosti označen interleukin-6, který stimuluje proliferaci a vyzrávání B buněk a dále podněcuje novotvorbu cév cestou vaskulárního endoteliálního růstového faktoru [5,9]. Jak bude dále rozvedeno v diskuzní části, na signalizační dráhu interleukinu-6 je zacílena moderní biologická léčba monoklonálními protilátkami. Úzký vztah k rozvoji multicentrické CD, a to zejména u HIV (human immunodeficiency virus – virus lidského imunodeficitu) pozitivních pacientů, má rovněž lidský herpesvirus 8 (human herpes virus type 8 – HHV-8, někdy označovaný jako herpesvirus Kaposiho sarkomu). Infekce oběma těmito virusy se mohou u pacientů s multicentrickou CD vyskytovat nezávisle na sobě a jejich přítomnost je spojována s obzvláště agresivním průběhem nemoci, který má svůj histopatologický korelát v podobě plazmablastické varianty [4,10].
V posledních letech lze ve světové literatuře pozorovat zvýšený zájem o tuto chorobnou jednotku, což souvisí nejen s prohlubováním znalostí o její patofyziologii zasahující v mnoha směrech do principů neoplastického růstu, ale především s úspěšnou aplikací nových léčebných preparátů a schémat. V tuzemských publikacích je však tematika CD stále opomíjena a omezena jen na několik sporadických popisů případů [11]. Motivováni snahou zvýšit všeobecné povědomí o CD, s důrazem na diagnostiku a léčbu, rozhodli jsme se zde prezentovat naše dlouholeté zkušenosti s péčí o tyto pacienty. Výsledná retrospektivní analýza léčebných výsledků u kohorty deseti pacientů je dosud největší studií svého druhu v české literatuře. Ačkoliv je hlavní důraz kladen na představení našich zkušeností s terapeutickými modalitami v této indikaci, nemalý prostor věnujeme rovněž možnostem paraklinického zobrazování, a to zejména s využitím hybridního zobrazení pozitronovou emisní tomografií s 18F-fluorodeoxyglukózou (PET) v kombinaci s výpočetní tomografií (CT), tzv. PET/CT, které podstoupili všichni zařazení pacienti.
Soubor pacientů a metody
Pacienti
V průběhu 15 let od 1. ledna 1998 do 1. ledna 2013 bylo na naší klinice sledováno celkem 10 pacientů s diagnostikovanou CD. U 7 z nich se jednalo o multicentrickou CD, zbývající 3 případy tvořila forma unicentrická. Diagnóza onemocnění byla založena na histopatologickém rozboru resekované tkáně, který byl korelován s klinickým průběhem onemocnění (zejména tzv. B symptomy, tedy neinfekční zvýšení tělesné teploty, hubnutí, noční poty, patologická únava), laboratorními výsledky (hodnoty krevního obrazu, známky pro-inflamatorního stavu organizmu, polyklonální či monoklonální zmnožení imunoglobulinů, testování na HIV a HHV-8 pozitivitu) a nálezy ze zobrazovacích modalit, které byly, kromě standardního došetřování pomocí ultrasonografie, skiagrafie a výpočetní tomografie, rozšířeny o PET/CT. Stanovení diagnózy CD předcházelo u většiny pacientů období různě dlouhého pátrání po příčině některých nespecifických celkových příznaků nebo klinického nálezu lymfadenopatie. Výjimku představují případy 8 (náhodný nález zvýšené sedimentace před operací varixů vedl k dalšímu došetřování s nálezem tumoru ledviny na ultrasonografii břicha) a 10 (záchyt lymfadenopatie při screeningové mamografii).
Léčba
Spektrum léčebných modalit použitých ve sledované kohortě tvořila operativa, radioterapie, chemoterapie, léčba monoklonálními protilátkami (rituximab, protilátka proti antigenu CD 20 a tocilizumab, protilátka proti receptoru pro interleukin-6) a imunomodulačními léky (thalidomid, lenalidomid). Jejich poměrné zastoupení se však lišilo v závislosti na klinickém typu onemocnění a jeho agresivitě. Zatímco u všech pacientů s unicentrickou CD (případy 8, 9, 10) byla kompletní chirurgická exstirpace jedinou aplikovanou terapeutickou modalitou, u multicentrické formy to byl pouze případ 2, kdy odstranění největší uzlinové masy z retroperitonea bylo dostačujícím, i když ne definitivním řešením. Případy 1 a 4 s multicentrickou CD byly pouze pečlivě sledovány a ponechány bez cílené terapeutické intervence. V ostatních případech byla podána systémová léčba, a to i v několika liniích. Důvody jejího podání zahrnovaly: útlak okolních struktur (případy 3, 6), prozánětlivý stav organizmu (případy 3, 5, 6, 7), celkové příznaky (případy 5, 7) a asociované projevy (případy 3, 7). Tito pacienti budou detailněji rozebráni v následujících částech kapitoly. Iradiace největší uzlinové masy byla provedena jen v případu 6. Všichni pacienti podstoupili v rámci sledování léčebné odpovědi PET/CT vyšetření.
Případ 3. Tento pacient absolvoval pět léčebných linií: léčba první linie režimem R-CHOP (rituximab 375 mg/m2, cyklofosfamid 750 mg/m2, adriamycin 50 mg/m2 a vinkristin 2 mg intravenózně [i.v.] den 1; prednizon 100 mg perorálně [p.o.] den 1–5; opakování po 21 dnech, celkem 3 cykly), léčba druhé linie režimem CTD (cyklofosfamid 50 mg a thalidomid 100–200 mg p.o. denně; dexametazon 20 mg p.o. den 1–4 a 15–18; opakování po 28 dnech, celkem 10 cyklů), léčba třetí linie monoterapií tocilizumabem (400 mg i.v. každé 2 týdny, tedy poloviční dávkování s ohledem na omezenou dostupnost léku, celkem 5 dávek), léčba čtvrté linie obnoveným režimem CTD (rozdíly: thalidomid 100 mg denně, dexametazon den 1, 2, 15, 16; celkem 2,5 cyklu), léčba páté linie monoterapií lenalidomidem (25 mg p.o. den 1–21; opakování po 28 dnech, celkem 15 cyklů).
Případ 5. Podána byla pouze jedna léčebná linie režimem CTD (cyklofosfamid 300–500 mg/m2 i.v. den 1 a 15, thalidomid 100 mg p.o. denně, dexametazon 20 mg p.o. den 1–4 a 15–18; opakování po 28 dnech, celkem 4 cykly).
Případ 6. Pacient byl léčen třemi liniemi: léčba první linie režimem CTD (cyklofosfamid 500 mg/m2 i.v. den 1 a 15, thalidomid 100 mg p.o. denně, dexametazon 20 mg p.o. den 1–4; opakování po 28 dnech, celkem 1 cyklus), léčba druhé linie režimem CAD (cyklofosfamid 500 mg/m2 i.v. den 1 a 15, adriamycin 36 mg/m2 i.v. den 1, dexametazon 20 mg i.v. den 1 a 15; opakování po 28 dnech, celkem 6 cyklů), léčba třetí linie monoterapií thalidomidem (100 mg p.o. denně; celkem 16 týdnů).
Případ 7. Podán jeden cyklus režimu CVD (cyklofosfamid 500 mg/m2 i.v. den 1 a 15, bortezomib 1,3 mg/m2 i.v. den 1, 8, 14, 22, dexametazon 20 mg p.o. den 1–4; opakování po 28 dnech) následovaný autologní transplantací periferních kmenových buněk krvetvorby po přípravném režimu s melfalanem (140 mg/m2 i.v.).
Výsledky
V této retrospektivní jednocentrové studii pacientů s CD bylo hodnoceno celkem 6 mužů a 4 ženy. Věk se v době stanovení diagnózy pohyboval v rozmezí od 27 do 66 let [52,4 ± 13,5 (n = 10)]. Lymfadenopatie postihovala jak centrální oblasti dostupné pouze paraklinickým zobrazovacím metodám (6 pacientů), tak periferní lokalizace přístupné i fyzikálnímu vyšetření (8 pacientů), přičemž u 5 případů se jednalo o kombinaci obou těchto typů. Četnost postižení konkrétních anatomických úseků byla následující: v 5 případech infiltrace axil, třísel, retroperitonea, ve 4 případech mediastina, ve 3 případech krku, peritoneální dutiny a pánve a ve 2 případech supraklavikulární jamky. Méně časté postižení parenchymatózních orgánů bylo histologicky verifikováno jen u případu 8, kdy se jednalo o unicentrickou CD levé ledviny. Z ostatních mimouzlinových lokalizací jsme pozorovali nejčastější asociace s hepatomegalií či splenomegalií, které se buď samostatně, anebo v kombinaci vyskytly celkem u 6 pacientů. Rozměr největšího ložiska byl v našem souboru ohraničen hodnotami 30 a 95 mm s mediánem rovným 52,5 mm [55,7 ± 22,0 (n = 10)]. Všichni pacienti podstoupili PET/CT skenování, avšak hodnota nejvyšší metabolické aktivity v místě nejaktivnější léze byla dostupná jen u 9 z nich, neboť případ 8 absolvoval vyšetření až po chirurgické intervenci, kdy výsledek již nesvědčil pro patologický hypermetabolizmus radiofarmaka. Medián této hodnoty vyjádřené semikvantitativně jako SUVmax (Maximum Standardized Uptake Value) dosahoval 4,91 [rozsah: 2,20–8,98; 4,98 ± 1,80 (n = 9)] (obr. 2). Podrobný přehled výše uvedených charakteristik je k dispozici v tab. 2.
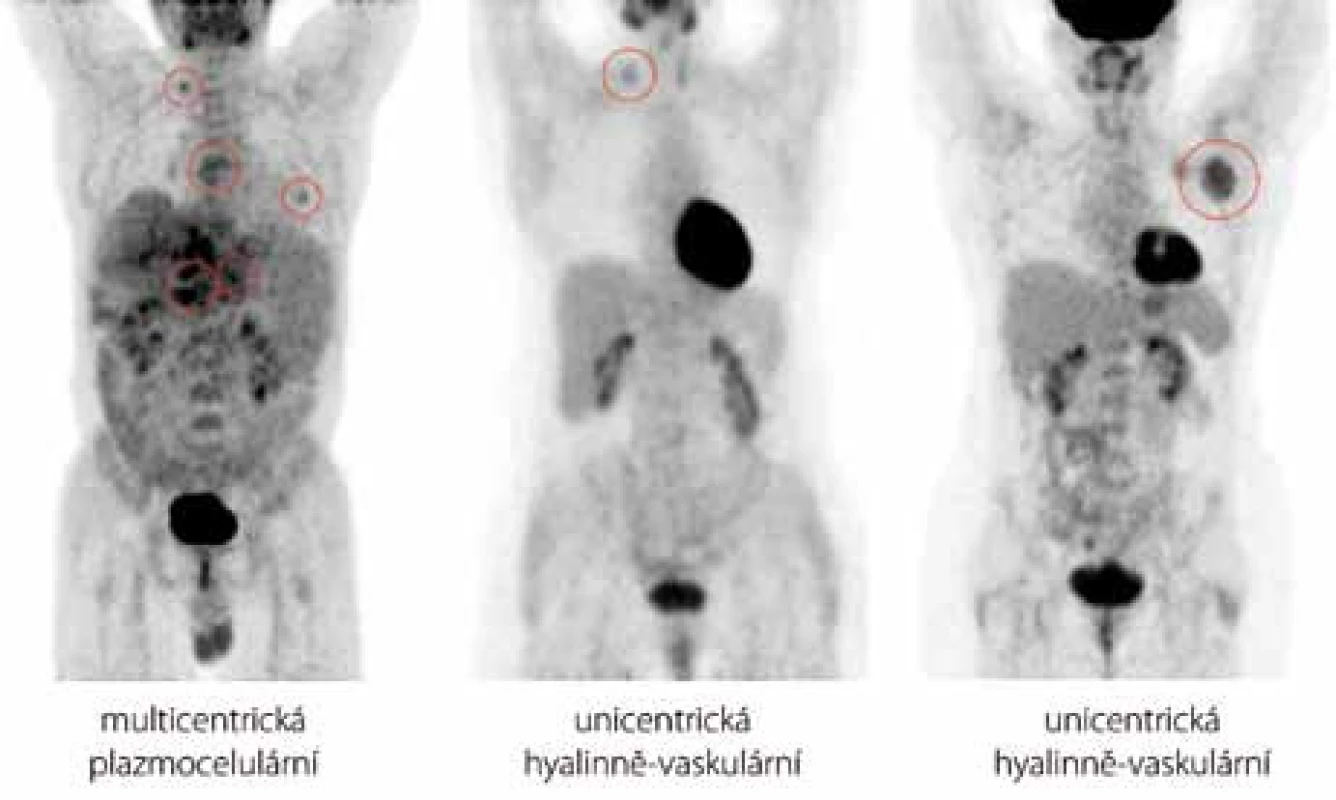
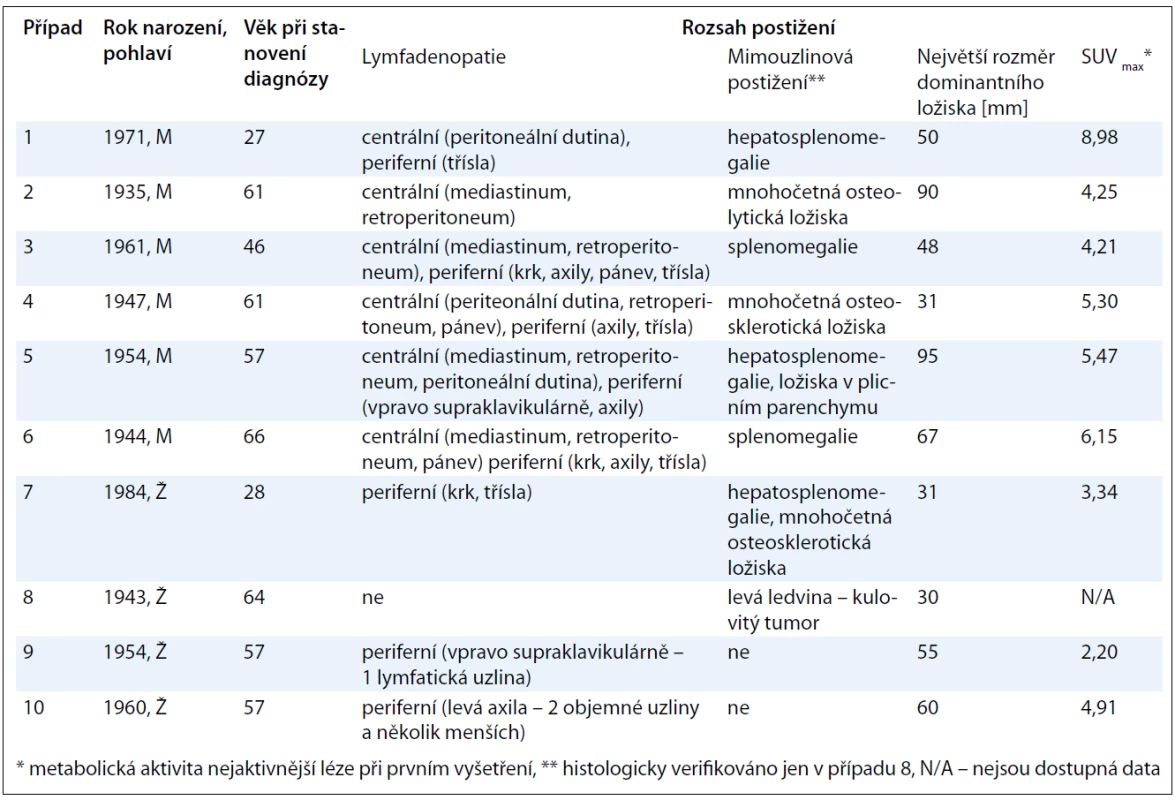
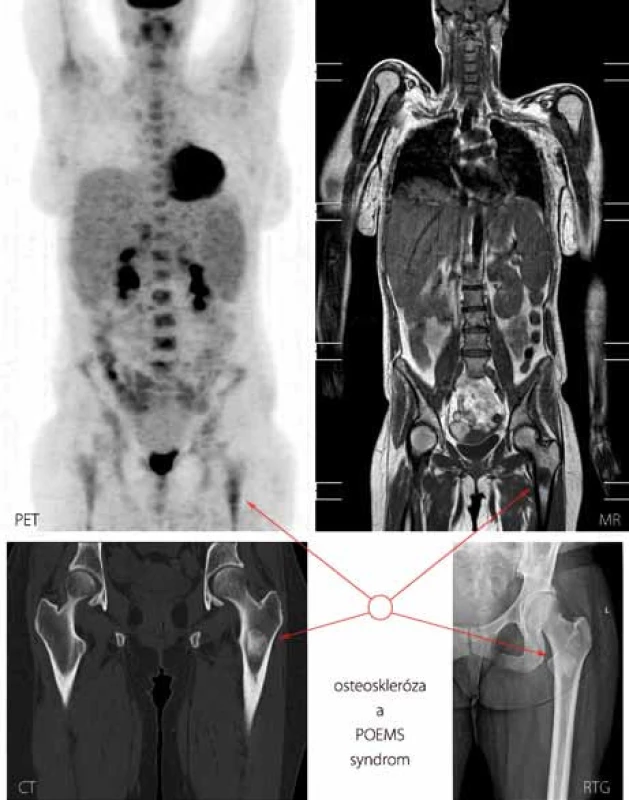
Přesnou typizaci onemocnění u jednotlivých pacientů pak přináší tab. 3. Údaje o histopatologické variantě CD jsou dostupné u 4 ze 7 pacientů s multicentrickou formou, kde převažuje plazmocelulární varianta, a dále u všech pacientů s unicentrickou formou, u které je poměr obou hlavních histologických typů obrácen ve prospěch hyalinně-vaskulární CD. V případech 1 a 2 byla diagnóza uzavřena před více než 10 lety a původní popis patologa se nám již nepodařilo získat. Histologický rozbor v případu 7 byl zkreslen několikadenním podáváním vysokých dávek kortikoidů. Jelikož však u této pacientky byla splněna kritéria POEMS syndromu (akronym označující polyneuropatii, organomegalii, endokrinopatii, monoklonální gamapatii, kožní změny), a to na základě přítomnosti obou kritérií hlavních (paraproteinemie, symetrická subakutní demyelinizační polyneuropatie) a několika dalších kritérií malých (osteoskleróza, hepatosplenomegalie, lymfadenopatie, městnavá papila oboustranně), byl nález castlemanoidních změn z exstirpované lymfatické uzliny pro stanovení diagnózy CD dostačující (obr. 3). CD bývá totiž nalézána až u 30 % pacientů s POEMS syndromem [12]. Z dalších asociovaných projevů jsme se setkali se sekundární AA amyloidózou související zřejmě s dlouhotrvajícím průběhem CD u případu 1 a s projevy vaskulitidy mozkových tepen u případu 3, manifestující se opakovanými ischemickými cévními mozkovými příhodami, a u případu 7, kde stála v popředí klinického stavu pravostranná hemiparéza, expresivní afázie a porucha kognitivních funkcí. Celkové příznaky ve formě B symptomů, které jsou jinak tradičně spojovány s lymfoproliferativními neoplaziemi, domininovaly v multicentrické subkohortě CD (případy 2, 4, 5, 7).
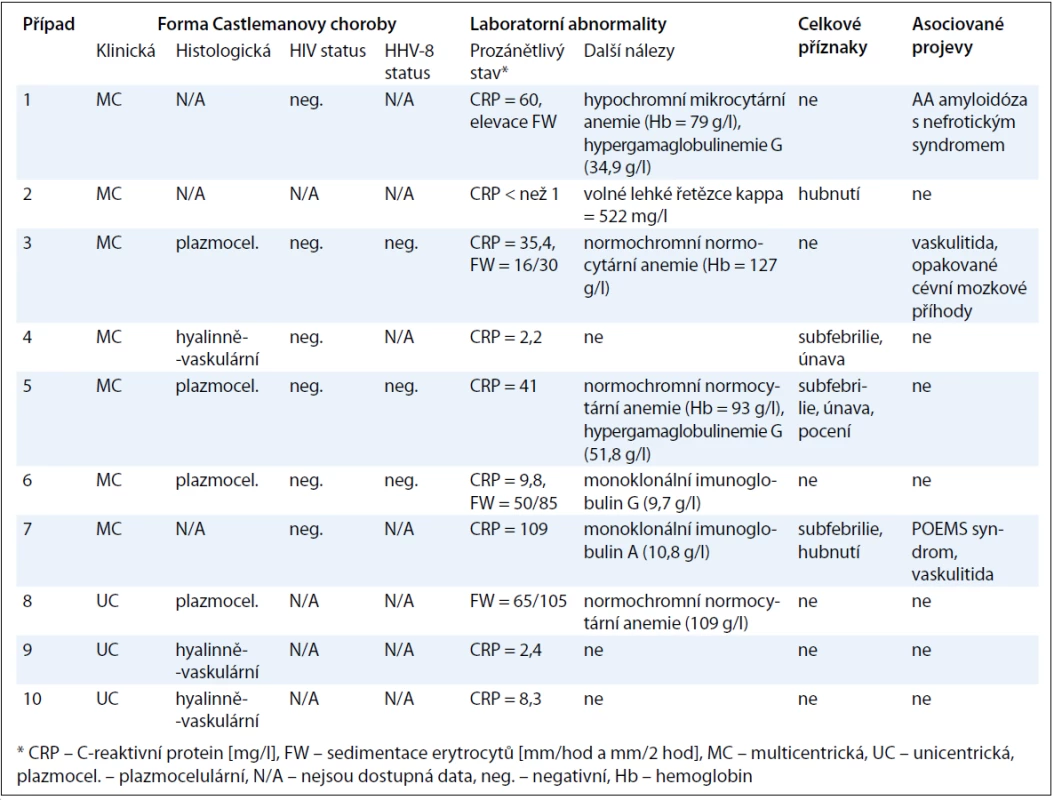
U pacientů s multicentrickou formou poskytlo testování na HIV status (6 pacientů) a HHV-8 status (3 pacienti) ve vyšetřovaných vzorcích negativní výsledek. Známky proinflamatorního stavu organizmu (elevace C-reaktivního proteinu nebo sedimentace erytrocytů) byly typicky nalézány u pacientů s multicentrickou formou, ale vyskytly se i hodnoty normálního C-reaktivního proteinu (případy 2 a 4), stejně tak jako výrazně zvýšené sedimentace erytrocytů u pacientky s unicentrickou formou (případ 8, podrobněji viz výše). Z dalších laboratorních nálezů jsme se nejčastěji setkali s anémií (zejména normochromní normocytární) různého stupně (případy 1, 3, 5, 8) a s hypergamaglobulinemií, a to jak polyklonální (případy 1, 5), tak i monoklonální (případy 6, 7).
Důležité aspekty diagnostiky, léčebné výsledky a údaje o průběhu choroby jsou obsaženy v tab. 4. V souladu se zkušenostmi popsanými v literatuře [4] byla diagnostika CD i v našem souboru mnohdy nelehká. Všech 10 pacientů podstoupilo celkem 20 bioptických zákroků, z nichž však jen 13 histologických nálezů (65 %) odpovídalo CD. U jedné poloviny souboru (případy 2, 3, 7, 8, 10) byly všechny odběry diagnostické, ve druhé polovině (případy 1, 4, 5, 6, 9) jsme se setkali jak s případem (číslo 4), kdy první biopsie byla diagnostická a ostatní dvě nikoliv, tak i s případem (číslo 5), kdy až poslední ze třech odběrů prokázal CD. Medián doby sledování pacientů byl 24,5 měsíce [rozmezí: 4–171 měsíců (n = 10)]. Zatímco u pacientů s unicentrickou formou mělo onemocnění vždy benigní průběh a kompletní chirurgická exstirpace vedla ke kompletní remisi potvrzené celotělovým PET/CT vyšetřením, průběh multicentrické CD kolísal od stabilního (3 pacienti) přes chronicky relabující (1 pacient) až po agresivní (3 pacienti), v léčbě jsme využili většinou systémovou terapii s více aktivními látkami a léčebné odpovědi se značně lišily (viz níže). Z celé kohorty 10 pacientů bylo při poslední ambulantní kontrole onemocnění v 5 případech (čísla 3, 5, 8, 9, 10) v remisi, ve 4 případech (čísla 1, 2, 4, 6) stabilní, v 1 případu (číslo 7) progredoval asociovaný POEMS syndrom. Do konce doby sledování celého souboru zemřeli celkem tři pacienti (případy 1, 5, 7), přičemž v případech 1 a 5 úmrtí nesouviselo s CD.
Případ 1. Tento pacient i přes svůj nízký věk trpěl řadou komorbidit (kongenitální aortální stenóza s implantací umělé chlopně, bifascikulární blokáda, arteriální hypertenze, nefrotický syndrom, lupus antikoagulans, vředová choroba gatroduodena), v anamnéze přiznával dlouhodobý nikotinizmus. Jeho spolupráce při kontrolách v naší ambulanci byla nedostatečná a k léčbě jsme nakonec nepřistoupili. Pacient zemřel na konkomitantní adenokarcinom levé plíce, souvislost s CD se nepotvrdila.
Případ 2. Po prvotní chirurgické sanaci retroperitoneální expanze v roce 1986 podstoupil pacient o 6 let později obdobný chirurgický zákrok. Za dalších 6 let pak CT potvrdilo již druhou recidivu nemoci, její rozsah však dle kontrolního vyšetření v roce 2012 zůstal neměnný. V současné době probíhá došetřování stran nově zjištěných osteolytických defektů bez patologické akumulace fluorodeoxyglukózy a nálezu zvýšené hladiny volných lehkých řetězců v séru. Mnohočetný myelom zatím diagnostikován nebyl, výsledky z trepanobiopsie klonální plazmocytární infiltraci neprokázaly.
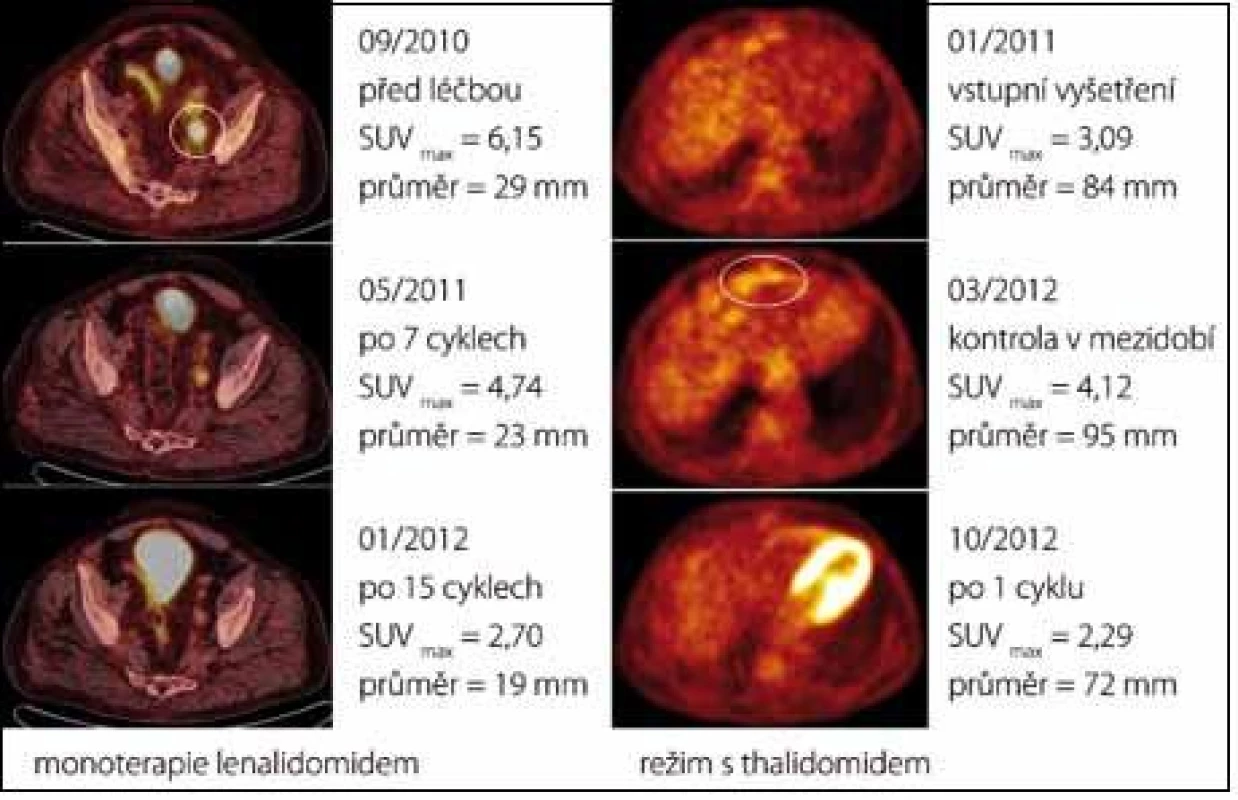
Případ 3. Při léčbě první linie (R-CHOP) docházelo postupně ke klinické progresi onemocnění (otoky končetin, vaskulitida prstů). Režim druhé linie (CTD) sice vedl k parciální remisi (dle PET/CT regrese velikosti lymfadenopatie o 50 % a pokles hypermetabolizmu glukózy), pro nežádoucí účinky thalidomidu (neuropatie) a kortikosteroidů (Cushingův syndrom) však musela být i tato léčba ukončena. Monoterapie tocilizumabem v polovičním dávkování se pro recidivu otoků v jejím průběhu neosvědčila. Bylo to až při podání lenalidomidu, kdy došlo k metabolické remisi onemocnění dle PET, dalšímu zmenšení lymfadenomegalie dle CT komponenty a klinicky ke znatelnému ústupu vstupně přítomné pravostranné hemiparézy, přičemž navozený léčebný efekt přetrvává již rok po podání poslední dávky lenalidomidu (obr. 4). Během celého léčebného období nebyly žádné závažné nežádoucí účinky (tedy stupně III a IV dle CTCAE, Common Terminology Criteria for Adverse Events, verze 4.0). Podrobný popis tohoto případu lze nalézt v jiné publikaci [13].
Případ 4. Dle opakovaných nálezů na PET/CT má onemocnění stabilní průběh, rozsah lymfadenopatie i osteosklerózy je stacionární, k léčbě se dosud nepřistoupilo. POEMS syndrom, na nějž bylo pomýšleno s ohledem na přítomnost kostního postižení, nebyl dle dosavadních nálezů potvrzen.
Případ 5. Léčebný režim s thalidomidem vedl u tohoto pacienta k neobvykle rychlé léčebné odpovědi již po podání 1. cyklu, kdy došlo k poklesu C-reaktivního proteinu (z 41,0 na 13,2 mg/l) a snížení hladiny polyklonálního imunoglobulinu G v séru (z 51,8 na 20,2 g/l) doprovázené nárůstem hodnoty albuminu (z 27,8 na 33,3 g/l) a hemoglobinu (z 93 na 118 g/l). Dále se znormalizovalo patologické vychytávání značené glukózy v lézích, které se rovněž částečně zmenšily (obr. 4). V průběhu léčby nebyly zaznamenány žádné závažné nežádoucí účinky. V důsledku komplikací vyplývajících z progrese jaterní cirhózy však pacient po aplikaci čtyř cyklů neočekávaně zemřel.
Případ 6. Podaná léčba neměla žádný významný klinický ani radiologický efekt, stav pacienta zůstává stabilní, rozhodli jsme se jej tedy jen pravidelně sledovat a k dalším terapeutickým intervencím přistoupit až při případné progresi onemocnění. Léčba se rovněž obešla bez nežádoucích účinků.
Případ 7. Průběh POEMS syndromu byl u této pacientky infaustní s rychlým zhoršováním neurologických projevů napříč veškerému léčebnému úsilí. V potransplantačním období došlo k rozvoji očekávané hematologické toxicity (leukopenie s neutropenií IV. stupně, anémie II. stupně, trombocytopenie IV. stupně dle CTCAE) a orofaryngeální mukozitidy I. stupně dle CTCAE.
Diskuze
Lokalizovaná forma CD většinou negativně ovlivňuje organizmus pouze tlakem na okolní tkáně a orgány a kompletní chirurgická resekce přináší konečné řešení včetně odeznění případných systémových příznaků spojovaných zejména se vzácnější plazmocelulární histologickou variantou. Prognóza je příznivá také v případě parciální resekce, kdy postižené oblasti mohou být dlouhodobě v klinické remisi, bez známek progrese nemoci, i když riziko recidivy je vyšší. Radioterapie byla použita s různou mírou úspěchu u neresekabilních nádorů. I v monoterapii je schopna navodit kompletní remisi, ovšem ne u všech pacientů. Může být alternativou pro nemocné, kteří nemohou podstoupit chirurgický výkon [4,14]. U hyalinně-vaskulárního typu se dále osvědčila monoklonální protilátka rituximab jak v monoterapii, tak při neoadjuvantním použití u primárně neresekabilních tumorů [15,16]. Na druhé straně i přes úplné odstranění je unicentrická varianta sdružena se zvýšeným rizikem sekundární amyloidózy a lymfomů, což opodstatňuje nutnost dlouhodobé dispenzarizace těchto pacientů [14,17,18].
Multicentrická CD bývá často doprovázena imunodeficiencí, sekundární amyloidózou, neuropatií, kožními lézemi a neoplastickými projevy (Kaposiho sarkomem, non-hodgkinskými lymfomy, hemangiomy, plazmocytomy a dalšími). Ačkoliv je stále považována za nenádorové onemocnění, její prognóza je bez léčby špatná. Většina pacientů s multicentrickou CD zemře na fulminantní infekce, renální selhání, progresi nemoci nebo na výše zmíněné příbuzné malignity. Jako negativní prognostické faktory byly označeny: plazmocelulární a plazmablastická varianta, HIV – a HHV-8 pozitivita, věk nad 60 let a přítomnost splenomegalie [3,4,19]. Výsledky chirurgického debulkingu nedosáhly dle dostupné literatury významnějších léčebných odpovědí [18]. Jeden pacient s hyalinně-vaskulární formou dlouhodobě přežil (sledování 82 měsíců) po cervikální a axilární disekci lymfatických uzlin [6]. V našem souboru zůstává stav multicentrické CD v případu 2 však stabilní již 15 let, přičemž první operační revize proběhla před více než 27 roky.
V několika případech bylo dosaženo léčebné odpovědi radioterapií. U dvou pacientů vedlo ozáření největší skupiny lymfatických uzlin dokonce k regresi i ve vzdálenějších lokalizacích [20,21]. Iradiaci uzlinové masy jsme využili jen v jednom případu (číslo 6) bez podstatného terapeutického efektu. Alkylační cytostatika jako součást intenzivní chemoterapie bývají často používána v rámci léčby první linie multicentrické CD. Vzorem pro cytoredukční léčbu se staly režimy určené pro terapii non-hodgkinských lymfomů. Mezi nejčastěji používané režimy se řadí CHOP (cyklofosfamid, vinkristin, doxorubicin, prednison) a CVAD (cyklofosfamid, vinkristin, doxorubicin, dexametazon), oba využívané se smíšenými úspěchy. Publikované malé studie udávají počet léčebných odpovědí 50 % u CHOP a 67 % u CVAD [11]. Kortikosteroidy mají u některých nemocných sice potenciál navodit remisi onemocnění, jejich dlouhodobé užívání je však spojeno se zvýšeným rizikem bakteriální infekce, kdy bylo popsáno mnoho případů úmrtí na sepsi při terapii [22,23].
V současné době patří biologická léčba monoklonálními protilátkami (tocilizumab, siltuximab, rituximab) a imunomodulačními léky (zejména thalidomid) mezi klíčové terapeutické přístupy v péči o pacienty s multicentrickou CD. Zatím jen v Japonsku je v dávce 8 mg/kg i.v. každé 2 týdny schválen tocilizumab. První prospektivní studie popisuje zmenšení lymfadenomegalie a úpravu abnormálních laboratorních parametrů v souboru 28 pacientů, přičemž u 27 z nich byl tocilizumab podáván více než 3 roky, při vysazení se totiž projevy většinou vracejí [24]. Novinku v léčbě multricentrické CD představuje siltuximab, jehož protilátková specificita je namířena proti samotnému interleukinu-6 na rozdíl od tocilizumabu, který váže receptor pro tento cytokin. Předběžné výsledky studie fáze 1 popisují klinickou odpověď téměř u 80 % nemocných [25]. Rituximab, zacílený proti antigenu CD20, byl s úspěchem zvolen po selhání předchozí léčby pomocí kortikosteroidů [26], chemoterapie [27], ale např. i u HIV a HHV-8 negativního muže s asociovanou autoimunitní hemolytickou anémií a Raynaudovým fenoménem [28]. Pozornost zaslouží především největší dosud publikovaná studie s rituximabem zahrnující 21 HIV a HHV-8 pozitivních pacientů, z nichž u 20 bylo dosaženo remise onemocnění a u 14 měla tato remise i radiologický korelát. Celkové dvouleté přežití bylo 95 %. Po léčbě rituximabem poklesla i HHV-8 virusová nálož v plazmě. Hlavním nežádoucím efektem byla reaktivace Kaposiho sarkomu [29]. V souvislosti s rituximabem se však popisují i léčebná selhání jak u HIV negativních [13 – náš případ 3], tak u HIV pozitivních pacientů [30,31].
Léčebné úspěchy byly zaznamenány u malých skupin pacientů s multicentrickou CD při použití imunomodulačních látek. V literatuře lze nalézt sporadické popisy případů, u nichž měla léčba interferonem alfa nebo all-trans retinovou kyselinou výborný terapeutický efekt [11]. Největší pozornost však vzbudil thalidomid, který snižuje produkci interleukinu-6 a má rovněž antiangiogenní vlastnosti. Výhoda podávání thalidomidu spočívá v dobrém bezpečnostním profilu léku, absenci významné myelotoxicity, a to i při několikaletém podávání, jak dokládá případ pacienta s Crohnovou chorobou, který toleroval tento lék po dobu 5 let při zachování dobré terapeutické účinnosti [32]. V jiných případech však může být limitující rozvoj periferní neuropatie [33]. Vynikající účinky thalidomidu jsou doloženy několika kazuistikami. U jedné pacientky došlo ke kompletní remisi cytopenie, ascitu a perikardiálního výpotku po dobu 40 měsíců na monoterapii thalidomidem, přetrvávala pouze lymfadenopatie (iniciální dávka 300 mg byla redukována na 200 mg pro rozvoj mírné periferní neuropatie). Po tuto dobu byla pacientka asymptomatická, začala opět pracovat, aniž by ji neuropatie omezovala [34,35]. Ke zlepšení klinického i laboratorního statusu s regresí lymfadenomegalie a hepatosplenomegalie došlo dále u pacientky s POEMS syndromem asociovaným s hyalinně-vaskulární CD, u které byla popsána 20měsíční léčba 200 mg thalidomidu denně doplněná v prvních 8 měsících o dexametazon [36]. Podobně zareagoval na kombinační podání bortezomibu s thalidomidem (100 mg denně, celkem 24 týdnů) muž, u něhož byl POEMS syndrom sdružen se smíšenou variantou CD. Důležité bylo zjištění, že 2 roky po ukončení léčby zůstává stav pacienta stabilní [37]. Thalidomidem bylo rovněž dosaženo remise asociovaných projevů zahrnujících nefrotický syndrom, paraneoplastický pemfigus či difuzní hyperpigmentované kožní plaky [38–40].
Lenalidomid je funkční a strukturální analog thalidomidu s protizánětlivými, antiangiogenními a imunomodulačními účinky. Stejně jako thalidomid snižuje produkci interleukinu-6. Je schválen pro léčbu mnohočetného myelomu a myelodysplastického syndromu, navíc byly popsány jeho pozitivní účinky u pacientů s rezistentní chronickou lymfatickou leukemií, folikulárním lymfomem, lymfomem z plášťových buněk, difuzním velkobuněčným B lymfomem, ale i u solidních tumorů. Na rozdíl od thalidomidu je hlavním nežádoucím účinkem lenalidomidu jeho myelotoxicita [41]. V medicínské databázi MEDLINE jsme kromě námi popsaného případu nalezli jen jeden popis blíže nespecifikovaného případu CD v rámci série pacientů s POEMS syndromem postihujícího měkké pleny mozkové, kdy byla pozorována jasná léčebná odpověď po 5 cyklech režimu s lenalidomidem (25 mg) posíleným o dexametazon [42].
U HIV pozitivních pacientů je další medikamentózní potlačení imunity s ohledem na preexistující těžkou imunosupresi rizikové. Podání vysoce účinné antiretrovirové terapie (HAART) k regresi většinou nevede, na rozdíl od vynikajících výsledků této modality u Kaposiho sarkomu. Některá antivirotika (foscarnet, ganciklovir, cidofovir) mají sice in vitro potenciál přerušit replikaci virusu HHV-8, jehož přítomnost je u HIV pozitivních pacientů téměř konstatně potvrzována, úspěchy v klinické praxi byly ale smíšené [11]. Zřejmě nejlepší léčebné odpovědi souvisejí s použitím protokolů obsahujících rituximab a thalidomid. Některé úspěchy rituximabu u HIV pozitivní CD byly již zmíněny výše. V dosud největší retrospektivní analýze 11 dominantně HIV a HHV-8 pozitivních případů bylo dosaženo kombinací rituximabu s thalidomidem (100 mg denně) 91 % kompletních remisí s dvouletou dobou bez progrese choroby u 60 % sledovaných [43]. Stary et al dosáhli kombinovaným režimem s thalidomidem (200 mg denně, později přechod na 100 mg) a rituximabem kompletní klinické a radiologické remise plazmocelulární multicentrické CD u HIV a HHV-8 pozitivního muže [44]. U jednoho HIV a HHV-8 pozitivního muže s Kaposiho sarkomem došlo ke zlepšení celkového stavu, zvýšení počtu destiček a negativnímu restagingovému vyšetření z kostní dřeně po 38 týdnech léčby s 200 mg thalidomidu denně, která byla na začátku doplněna o etoposid [45].
V našem souboru bylo dosaženo 50 % remisí, ve 40 % případů bylo onemocnění stabilní, u jedné pacientky (10 %) došlo k rychlé progresi asociovaného POEMS syndromu. Tyto výsledky jsou do značné míry ovlivněny dominantním zastoupením multicentrické formy CD, která je obecně spojována s horší prognózou. Převahu tohoto klinického typu vysvětlujeme spíše tím, že na naše pracoviště bývají odesíláni pacienti komplikovaní, vyžadující systémovou léčbu, než tím, že by v našem kraji byla skutečná vyšší prevalence multicentrické CD. Při volbě terapie unicentrické formy jsme plně spoléhali na chirurgické odstranění, u multicentrické formy jsme preferovali léky ze skupiny imunomodulačních látek před monoklonálními protilátkami. Významnou nevýhodu monoklonálních protilátek totiž představuje ekonomická nákladnost, nezřídka omezená dostupnost a v případech inhibitorů interleukinu-6 popisovaná recidiva nemoci po jejich vysazení. Na druhé straně ve prospěch thalidomidu hovoří především narůstající počet publikovaných pozitivních zkušeností, možnost dlouhodobého podávání s pružnou individualizovanou úpravou dávkování, přetrvávající terapeutický efekt i několik let po přerušení medikace a neméně významná je i nízká cenová kalkulace léčby a účinek u rituximab-rezistentní multicentrické CD.
Thalidomid jsme využili celkem u 3 pacientů, celková léčebná odpověď byla 67 %. V případu 3 došlo k signifikantnímu zmenšení patologické masy s poklesem hypermetabolizmu fluorodeoxyglukózy a v případu 5 k metabolické remisi již po prvním aplikovaném cyklu. Přesná kritéria hodnocení léčebné odpovědi u CD dosud stanovena nebyla, proto se zde omezujeme na takto popisné závěry. Neurotoxicita thalidomidu, která se u některých pacientů může po několika cyklech objevit, sice jistou nevýhodu představuje, řešení se však nabízí v podobě jeho derivátu lenalidomidu s minimem nežádoucích účinků a vynikající účinností. Navíc, jak dokládá případ 3 z naší kohorty, léčba lenalidomidem může být velmi dobře tolerována bez jakýchkoli závažných myelotoxických či tromboembolických příhod.
Závěr
CD představuje důležitou součást diferenciální diagnostiky lymfadenopatie, anémie, horečky nejasného původu a dalších B symptomů (hubnutí, noční poty, patologická únava). Významnou pozici ve vstupním stagingovém hodnocení rozsahu onemocnění hraje PET/CT vyšetření, které poskytne definitivní rozhodnutí stran klinické klasifikace nemoci. Rozdělení na unicentrickou a multicentrickou formu má totiž řadu důležitých diagnosticko-terapeutických implikací. Na rozdíl od lokalizované varianty, kde úplné operační odstranění bývá konečným řešením, v případě multicentrické CD spoléháme na účinky léčby systémové (glukokortikoidy, cytostatika, biologická terapie). S ohledem na vysokou nákladovou efektivnost a tolerabilitu upřednostňujeme na našem pracovišti thalidomid ze skupiny imunomodulancií. U všech pacientů s CD, včetně pacientů s unicentrickou hyalinně-vaskulární variantou po kurativní resekci, je nezbytná dlouhodobá dispenzarizace pro zvýšené riziko rozvoje maligní lymfoproliferace. Testování na HIV a HHV-8 status by mělo zůstat vyhrazeno pro pacienty s multicentrickou CD, kde případná sérologická pozitivita oznamuje obzvláště agresivní průběh onemocnění, a tedy i nutnost včasné terapeutické intervence.
Práce byla podpořena granty IGA MZd NT12215, NT12130, NT13190, grantem MUNI/A/0723/2012, podpořeno MZ ČR – RVO (MOÚ, 00209805) a MZ ČR – MZ RVO (FNBr, 65269705).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Petr Szturz, Ph.D.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: petr.szturz@fnbrno.cz
Obdrženo: 8. 2. 2013
Přijato: 19. 2. 2013
Sources
1. Castleman B, Towne VW. Case records of the Massachusetts General Hospital; weekly clinicopathological exercises; founded by Richard C. Cabot. N Engl J Med 1954; 251(10): 396–400.
2. Castleman B, Iverson L, Menendez VP. Localized mediastinal lymphnode hyperplasia resembling thymoma. Cancer 1956; 9(4): 822–830.
3. Cronin DM, Warnke RA. Castleman disease: an update on classification and the spectrum of associated lesions. Adv Anat Pathol 2009; 16(4): 236–246.
4. Dispenzieri A. Castleman disease. In: Ansell SM (ed.). Rare Hematological Malignancies. Boston MA: Springer Science + Business Medie, LLC 2008 : 293–330.
5. Bonekamp D, Horton KM, Hruban RH et al. Castleman disease: the great mimic. Radiographics 2011; 31(6): 1793–1807.
6. Ye B, Gao SG, Li W et al. A retrospective study of unicentric and multicentric Castleman‘s disease: a report of 52 patients. Med Oncol 2010; 27(4): 1171–1178.
7. Moore DF, Preti A, Tran SM. Prognostic implications following an indeterminate diagnostic work-up of lymphoma. Blood 1996; 88 (Suppl 1): 229a.
8. Mehra M, Cossrow N, Stellhorn RA et al. Use of a Claims Database to Characterize and Estimate the Incidence of Castleman’s Disease (abstract 4253). Available from: https://ash.confex.com/ash/2012/webprogram/Paper51578.html.
9. Yabuhara A, Yanagisawa M, Murata T et al. Giant lymph node hyperplasia (Castleman‘s disease) with spontaneous production of high levels of B-cell differentiation factor activity. Cancer 1989; 63(2): 260–265.
10. Dossier A, Meignin V, Fieschi C et al. Human Herpesvirus 8-Related Castleman Disease in the Absence of HIV Infection. Clin Infect Dis 2013; 56(6): 833–842.
11. Szturz P, Moulis M, Adam Z et al. Castlemanova choroba. Klin Onkol 2011; 24(6): 424–434.
12. Dispenzieri A. POEMS syndrome: update on diagnosis, risk-stratification, and management. Am J Hematol 2012; 87(8): 804–814.
13. Szturz P, Adam Z, Moulis M et al. Naše zkušenosti s léčbou multicentrické plazmocelulární Castlemanovy choroby s projevy vaskulitidy: popis případu a přehled literatury. Vnitr Lek 2012; 58(9): 679–690.
14. Chronowski GM, Ha CS, Wilder RB et al. Treatment of unicentric and multicentric Castleman disease and the role of radiotherapy. Cancer 2001; 92(3): 670–676.
15. Estephan FF, Elghetany MT, Berry M et al. Complete remission with anti-CD20 therapy for unicentric, non-HIV-associated, hyaline-vascular type, Castleman‘s disease. Cancer Invest 2005; 23(2): 191.
16. Bandera B, Ainsworth C, Shikle J et al. Treatment of unicentric Castleman disease with neoadjuvant rituximab. Chest 2010; 138(5): 1239–1241.
17. Lachmann HJ, Gilbertson JA, Gillmore JD et al. Unicentric Castleman‘s disease complicated by systemic AA amyloidosis: a curable disease. QJM 2002; 95(4): 211–218.
18. Herrada J, Cabanillas F, Rice L et al. The clinical behavior of localized and multicentric Castleman disease. Ann Intern Med 1998; 128(8): 657–662.
19. Shin DY, Jeon YK, Hong YS et al. Clinical dissection of multicentric Castleman disease. Leuk Lymphoma 2011; 52(8): 1517–1522.
20. Marti S, Pahissa A, Guardia J et al. Multicentric giant follicular lymph node hyperplasia. Favorable response to radiotherapy. Cancer 1983; 51(5): 808–810.
21. Sethi T, Joshi K, Sharma SC et al. Radiation therapy in the management of giant lymph node hyperplasia. Br J Radiol 1990; 63(752): 648–650.
22. Frizzera G, Peterson BA, Bayrd ED et al. A systemic lymphoproliferative disorder with morphologic features of Castleman‘s disease: clinical findings and clinicopathologic correlations in 15 patients. J Clin Oncol 1985; 3(9): 1202–1216.
23. Bowne WB, Lewis JJ, Filippa DA et al. The management of unicentric and multicentric Castleman‘s disease: a report of 16 cases and a review of the literature. Cancer 1999; 85(3): 706–717.
24. Nishimoto N. Clinical studies in patients with Castleman‘s disease, Crohn‘s disease, and rheumatoid arthritis in Japan. Clin Rev Allergy Immunol 2005; 28(3): 221–230.
25. van Rhee F, Fayad L, Voorhees P et al. Siltuximab, a novel anti-interleukin-6 monoclonal antibody, for Castleman‘s disease. J Clin Oncol 2010; 28(23): 3701–3708.
26. Ide M, Ogawa E, Kasagi K et al. Successful treatment of multicentric Castleman‘s disease with bilateral orbital tumour using rituximab. Br J Haematol 2003; 121(5): 818–819.
27. Gholam D, Vantelon JM, Al-Jijakli A et al. A case of multicentric Castleman‘s disease associated with advanced systemic amyloidosis treated with chemotherapy and anti-CD20 monoclonal antibody. Ann Hematol 2003; 82(12): 766–768.
28. Ocio EM, Sanchez-Guijo FM, Diez-Campelo M et al. Efficacy of rituximab in an aggressive form of multicentric Castleman disease associated with immune phenomena. Am J Hematol 2005; 78(4): 302–305.
29. Bower M, Powles T, Williams S et al. Brief communication: rituximab in HIV-associated multicentric Castleman disease. Ann Intern Med 2007; 147(12): 836–839.
30. Neuville S, Agbalika F, Rabian C et al. Failure of rituximab in human immunodeficiency virus-associated multicentric Castleman disease. Am J Hematol 2005; 79(4): 337–339.
31. Buchler T, Dubash S, Lee V et al. Rituximab failure in fulminant multicentric HIV/human herpesvirus 8-associated Castleman‘s disease with multiorgan failure: report of two cases. AIDS 2008; 22(13): 1685–1687.
32. Fishman SJ, Feins NR, D’Amato RJ et al. Long-term remission of Crohn’s disease treated with thalidomide: a seminal case report. Angiogenesis 1999; 3(3): 201–204.
33. Špička I, Hájek R, Gregora E et al. První zkušenosti s léčbou mnohočetného myelomu v České republice. Klin Onkol 2002; 15 (Suppl): 42–43.
34. Lee FC, Merchant SH. Alleviation of systemic manifestations of multicentric Castleman‘s disease by thalidomide. Am J Hematol 2003; 73(1): 48–53.
35. Starkey CR, Joste NE, Lee FC. Near-total resolution of multicentric Castleman disease by prolonged treatment with thalidomide. Am J Hematol 2006; 81(4): 303–304.
36. Kim SY, Lee SA, Ryoo HM et al. Thalidomide for POEMS syndrome. Ann Hematol 2006; 85(8): 545–546.
37. Wang X, Ye S, Xiong C et al. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman‘s disease. Jpn J Clin Oncol 2011; 41(10): 1221–1224.
30. Menegato MA, Canelles MF, Tonutti E et al. Remission of nephrotic syndrome after thalidomide therapy in a patient with Castleman‘s disease. Clin Nephrol 2004; 61(5): 352–356.
39. Miltenyi Z, Toth J, Gonda A et al. Successful immunomodulatory therapy in castleman disease with paraneoplastic pemphigus vulgaris. Pathol Oncol Res 2009; 15(3): 375–381.
40. Zhao X, Shi R, Jin X et al. Diffuse hyperpigmented plaques as cutaneous manifestation of multicentric Castleman disease and treatment with thalidomide: report of three cases. J Am Acad Dermatol 2011; 65(2): 430–432.
41. Vallet S, Palumbo A, Raje N et al. Thalidomide and lenalidomide: Mechanism-based potential drug combinations. Leuk Lymphoma 2008; 49(7): 1238–1245.
42. Briani C, Manara R, Lessi F et al. Pachymeningeal involvement in POEMS syndrome: dramatic cerebral MRI improvement after lenalidomide therapy. Am J Hematol 2012; 87(5): 539–541.
43. Ramasamy K, Gandhi S, Tenant-Flowers M et al. Rituximab and thalidomide combination therapy for Castleman disease. Br J Haematol 2012; 158(3): 421–423.
44. Stary G, Kohrgruber N, Herneth AM et al. Complete regression of HIV-associated multicentric Castleman disease treated with rituximab and thalidomide. AIDS 2008; 22(10): 1232–1234.
45. Jung CP, Emmerich B, Goebel FD et al. Successful treatment of a patient with HIV-associated multicentric Castleman disease (MCD) with thalidomide. Am J Hematol 2004; 75(3): 176–177.
46. Weisenburger DD, Nathwani BN, Winberg CD et al. Multicentric angiofollicular lymph node hyperplasia: a clinicopathologic study of 16 cases. Hum Pathol 1985; 16(2): 162–172.
47. Oksenhendler E, Duarte M, Soulier J et al. Multicentric Castleman‘s disease in HIV infection: a clinical and pathological study of 20 patients. AIDS 1996; 10(1): 61–67.
48. Talat N, Schulte KM. Castleman‘s disease: systematic analysis of 416 patients from the literature. Oncologist 2011; 16(9): 1316–1324.
49. Peterson BA, Frizzera G. Multicentric Castleman‘s disease. Semin Oncol 1993; 20(6): 636–647.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2013 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Prognostické faktory karcinomu děložního hrdla
- Antiangiogenní bioterapie a chemoterapie v terapii karcinomu prsu: přehled literatury a kazuistika
- Postavení radioterapie v léčbě maligních lymfomů – doporučení Kooperativní lymfomové skupiny
- Epidemiologická a klinicko-patologická charakteristika pacientů s renálním karcinomem: analýza 544 případů z jednoho centra
- Castlemanova choroba: retrospektivní studie léčebných výsledků u 10 pacientů z jednoho centra
- Kazuistika: Výskyt grade IV neutropenie a febrilní neutropenie u pacientky s generalizovaným karcinomem prsu léčené paliativní chemoterapií cyklofosfamid/Myocet
- Spontánní remise akutní myeloidní leukemie – klinické případy jednoho centra
- Adjuvatní radioterapie karcinomu prsu s využitím Active breathing control – moderate inspiration breath-hold – kazuistika
- Adjuvant! Online: Pozor na rozdíly!
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Prognostické faktory karcinomu děložního hrdla
- Spontánní remise akutní myeloidní leukemie – klinické případy jednoho centra
- Kazuistika: Výskyt grade IV neutropenie a febrilní neutropenie u pacientky s generalizovaným karcinomem prsu léčené paliativní chemoterapií cyklofosfamid/Myocet
- Postavení radioterapie v léčbě maligních lymfomů – doporučení Kooperativní lymfomové skupiny
