Imunoterapie v prevenci a léčbě karcinomu prsu
Immunotherapy for the Prevention and Treatment of Breast Cancer
The immune system is believed to play a dual role in carcinogenesis. On one hand, it could prompt tumorigenesis and cancer progression, on the other hand, it has the capacity to eradicate tumor cells. There has been an evidence of natural immunogenicity in breast cancer and we have also witnessed several attempts to stimulate non-specific antitumor immune response (Coley’s toxin, BCG vaccine etc.). New technologies and further knowledge of molecular basis of immune system and its function encouraged the development of effective immunotherapy capable of inducing a solid antitumor activity. These agents appear promissing in the prevention and therapy of breast carcinoma as well. The assumption is based on the results of several antitumor vaccine trials targeted against HER2, MUC1, CEA and mammaglobin-A, as well as immune checkpoint inhibitors (e.g. CTLA-4, PD-1/ PD-L1, LAG3). With regards to different mechanisms of action of these agents, their combination might bring about synergistic antitumor effects. Nonetheless, monoclonal antibodies and cytostatic agents already approved for breast cancer treatment might be exploited for their immunomodulation effect as well. This article addresses prospects for immunotherapy of breast carcinoma in detail.
Key words:
immunotherapy – breast cancer – prevention – vaccine – immune checkpoints
This work was supported by grant MH CZ – RVO (MMCI, 00209805) and No. NT/14599-32013.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
12. 11. 2015
Accepted:
26. 11. 2015
Authors:
Svoboda M. 1 4; J. Navrátil 1; O. Slabý 1,3
Authors‘ workplace:
Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
1; Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno
2; CEITEC – Středoevropský technologický institut, MU, Brno
3; Lékařská fakulta, MU, Brno
4
Published in:
Klin Onkol 2015; 28(6): 416-425
Category:
Reviews
doi:
https://doi.org/10.14735/amko2015416
Overview
Imunitní systém plní v procesu kancerogeneze dvojí roli. Na straně jedné může přispívat ke vzniku a progresi onemocnění, na straně druhé je schopen nádorové buňky eradikovat. V případě karcinomu prsu existují důkazy o jeho přirozené imunogenicitě a v minulosti již existovaly snahy potencovat nespecifickou protinádorovou buněčnou imunitu (Coleyův toxin, BCG vakcína). Ale až s dalšími poznatky o fungování imunitního systému a s rozvojem technologií bylo možné vyvinout protinádorová imunoterapeutika, která jsou schopna imunitní systém cíleně stimulovat k účinné protinádorové reakci. V případě karcinomu prsu existují předpoklady pro úspěšné uplatnění imunoterapie v jeho prevenci i léčbě. Vycházejí z dosavadních výsledků klinického hodnocení protinádorových vakcín, kde došlo k největšímu pokroku u vakcín cílených na atigeny HER2, MUC1, CEA a mammaglobin-A, a inhibitorů kontrolních bodů imunitní reakce (CTLA-4, PD-1/ PD-L1, LAG3). Vzhledem k rozdílnému mechanizmu účinku uvedených imunoterapeutik lze od jejich kombinování očekávat synergické protinádorové působení. V neposlední řadě je možné využít i imunomodulačního účinku některých cytostatik a monoklonálních protilátek, které se již v léčbě karcinomu prsu používají. Článek podrobně rozebírá výše popsané možnosti imunoterapie u karcinomu prsu.
Klíčová slova:
imunoterapie – karcinom prsu – prevence – vakcíny – kontrolní body imunitní reakce
Úvod
Imunitní systém plní v procesu kancerogeneze dvojí roli. Na straně jedné může přispívat ke vzniku a progresi onemocnění, na straně druhé je schopen nádorové buňky eradikovat [1]. Která z těchto rolí převládne, závisí na vzájemných interakcích mezi buňkami imunitního systému, nádoru a jeho stromatu, které se mění v čase. Na počátku nádorového onemocnění převládá eliminační funkce imunitního systému. Nádorem vyvolaný akutní zánět způsobený angiogenezí a remodelací nádorového stromatu vede k infiltraci nádoru buňkami zajišťujícími nespecifickou (přirozenou) imunitu (NK buňky, mastocyty, makrofágy, dendritické buňky a další fagocytující buňky) [2]. Následná produkce prozánětlivých cytokinů, zejména IL-12 a INF-γ, vede k další stimulaci nespecifické i specifické (adaptivní) imunitní reakce. Dochází k maturaci a aktivaci antigen prezentujících buněk (antigen presenting cell – APC) a T lymfocytů schopných destrukčního účinku vůči antigenně specifickým nádorovým buňkám. Současně jsou aktivovány i B lymfocyty s rozvojem humorální imunity v její plné šíři [2,3]. Pokud nedojde v průběhu eliminační fáze k rychlé a kompletní eradikaci nádorových buněk, dochází naopak k selekci klonů, které jsou schopny imunitnímu dozoru uniknout a v prostředí chronického nádorového zánětu dále expandovat a metastazovat. K únikovým mechanizmům nádorových buněk nejčastěji patří ztráta exprese glykoproteinů I. třídy hlavního histokompatibilního komplexu (MHC) a změna jejich antigenního profilu. Současně může docházet k problémům i na straně imunokompetentních buněk (poruchy v procesech zpracování, prezentace a rozpoznání antigenu nebo produkce cytokinů). Akutní „nádorový“ zánět přechází do chronické zánětlivé reakce [3]. Ve stromatu nádoru a v jeho okolí dochází k hromadění regulačních T lymfocytů (Treg) a pomocných T lymfocytů 2. typu (Th2), makrofágů, fibroblastů a dalších buněk, které svou činností mohou konat ve prospěch nádoru [3,4]. Mohou působit destruktivně na přirozené tkáňové bariéry, inhibovat dendritické buňky a cytotoxické T lymfocyty a secernovat pro nádor důležité růstové a proangiogenní faktory. V této fázi dochází i ke zvýšené aktivitě signálních drah inhibitorů kontrolních bodů imunitní reakce (immune checkpoints inhibitors), což dále potlačuje protinádorovou činnost imunitního systému (viz níže). Všechny tyto kroky nastaví podmínky umocňující expanzi nádorových buněk a jejich únik před imunitním dozorem. Tento stav interakce nádoru a imunity označujeme za únikovou fázi (escape phase) [2].
Přestože je karcinom prsu považován za méně imunogenní než maligní melanom nebo renální karcinom, imunogenicita se mezi jednotlivými podtypy karcinomu prsu liší, přičemž lze konstatovat, že u triple negativních a HER2 pozitivních karcinomů je obecně vyšší než u karcinomů luminálního typu [3,5]. To dokazuje častější nález tumor infiltrujících lymfocytů (tumor-infiltrating lymphocytes – TIL) v těchto nádorech i výskyt přirozených protilátek proti nádorovým antigenům u daných pacientů [5,6]. U obou uvedených podtypů lze na základě DNA čipových analýz odlišit podskupiny karcinomů s profily genové exprese typicky modifikovanými imunitní reakcí [7,8]. Tyto nádory pak mají i lepší prognózu [8,9]. Extrémním příkladem je medulární karcinom prsu, jehož buňky mají rysy agresivního onemocnění (nízká diferenciace – G3, velmi vysoká proliferační aktivita), nicméně jen zřídka u něj detekujeme metastázy v regionálních uzlinách nebo na vzdálených místech. Jedním z charakteristických rysů medulárního karcinomu je masivní přítomnost lymfocytů na periferii tumoru vytvářejících souvislou bariéru oddělující nádor od nenádorové tkáně. TIL jsou přítomny i mezi nádorovými buňkami a mohou se organizovat do struktur napodobujících uspořádání lymfatické tkáně (např. formace zárodečných center). Co přesně stojí za vysokou imunogenicitou medulárního karcinomu, není dosud jasné, stejně tak ani nevíme, zda je to jediná příčina jeho omezeného metastatického potenciálu [10].
Strategie imunoterapie u karcinomu prsu
V případě karcinomu prsu existují důkazy o jeho přirozené imunogenicitě a v minulosti již existovaly snahy potencovat proti němu nespecifickou protinádorovou buněčnou imunitu (Coleyův toxin, BCG vakcína). Ale až s dalšími poznatky o fungování imunitního systému a s rozvojem technologií bylo možné vyvinout protinádorová imunoterapeutika, která jsou schopna imunitní systém cíleně stimulovat k účinné protinádorové reakci. To dává předpoklad uplatnění imunoterapie v prevenci i léčbě karcinomu prsu. Za tímto účelem jsou v současnosti k dispozici protinádorové vakcíny, inhibitory kontrolních bodů imunitní reakce a v neposlední řadě lze využít i imunomodulačního účinku některých cytostatik a monoklonálních protilátek a za určitých okolností i radioterapie. Navíc vzhledem k rozdílnému mechanizmu účinku uvedených postupů lze očekávat jejich synergické protinádorové působení při kombinovaném podávání [11 – 13].
Protinádorové vakcíny
Dosud největšího pokroku u karcinomu prsu v oblasti imunoterapie bylo dosaženo použitím vakcín v prevenci rekurence onemocnění (sekundární prevence). Předpokládá se, že vakcíny bude možné uplatnit i v primární prevenci, a to u žen z různých rizikových skupin (nosičky zárodečných mutací v genech způsobujících hereditární nádorové syndromy, pacientky s rizikem sekundárních malignit, pacientky s duktálním karcinomem in situ – DCIS) [2,3].
Nespornou předností vakcín je skutečnost, že kromě iniciálního protinádorového účinku zprostředkovaného zejména cytotoxickými T lymfocyty mohou vést ke vzniku imunologické paměti, jejíž nositelkou jsou paměťové T a B lymfocyty. Stane-li se tak, další kontakt imunitního systému s nádorovým antigenem vyústí v rychlou aktivaci specifické protinádorové imunity, což může v době, kdy je malignita ještě omezena na relativně nízký počet buněk, vést k její eradikaci.
Účinnost vakcíny tak závisí nejenom na antigenu, který cílí, ale i na schopnosti úspěšně překonat mechanizmy imunotolerance a vytvořit imunologickou paměť [14].
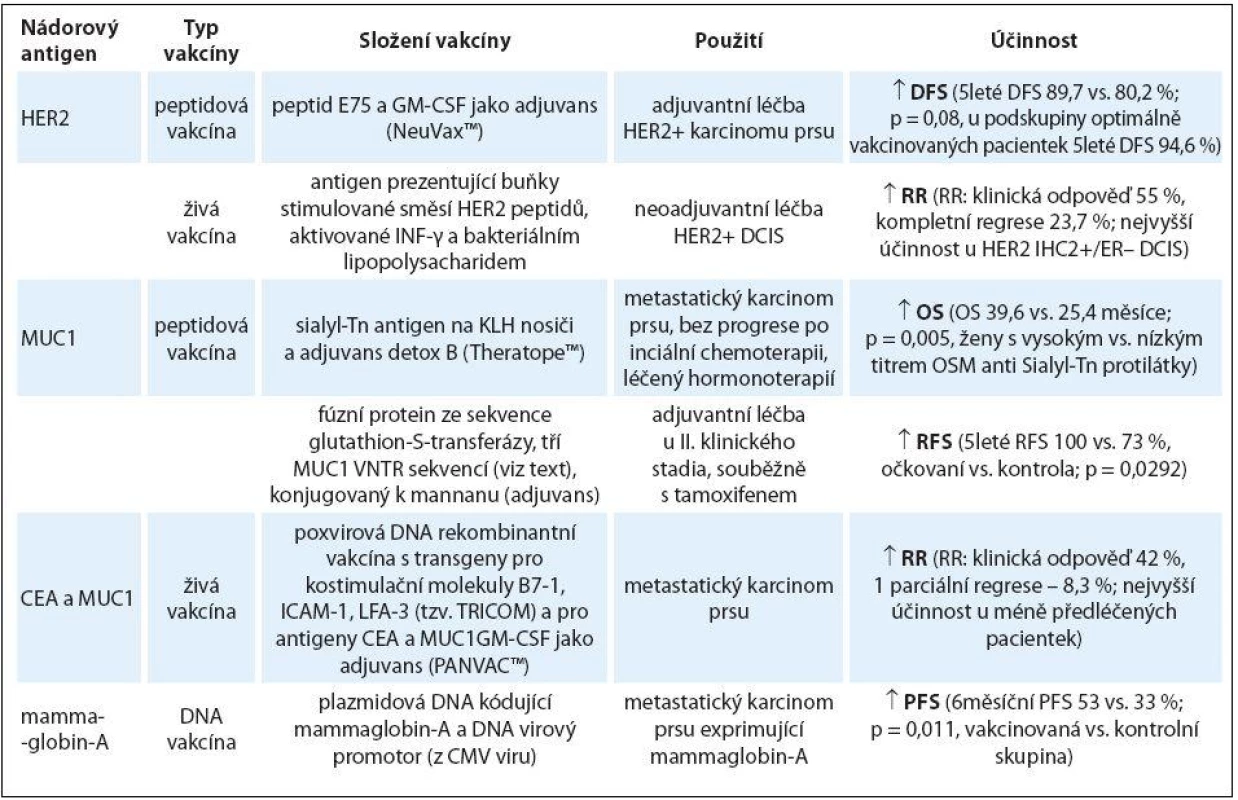
Vakcíny mohou stimulovat protinádorovou imunitu vůči jednomu, případně několika antigenům současně (polyantigenní vakcíny). Antigeny mohou být v podobě peptidů, proteinů či jiných biomolekul (např. DNA nebo RNA kódující jeden či několik antigenů). Jako antigen(y) může (mohou) sloužit i usmrcené nádorové buňky, jejich lyzáty nebo jiné fragmenty [2,11,15]. Neživé vakcíny kromě antigenu obsahují i adjuvans, která mají urychlit a posílit proces vedoucí k prezentaci antigenu a aktivovat složky přirozené imunity. Nejčastěji se používají látky GM-CSF, Montanide (skvalen), sloučeniny hliníku, agonisté Toll-like receptorů – TLR (různé bakteriální substance, např. BCG, lipopolysacharaidy a endotoxiny Gram-negativních bakterií), CpG oligodeoxynukleotidy, Freundovo adjuvans a rostlinné saponiny [3].
Další možností je aplikace „živých vakcín“. Nejvíce zkušeností je s použitím dendritických buněk, které se kultivují v přítomnosti nádorových antigenů (viz výše). Dendritické buňky tento materiál zpracují (fagocytují a následně degradují v endozomech a lyzozomech) a prezentují na svém povrchu ve spojení s molekulami MHC. Po uvedené maturaci a aktivaci se dendritické buňky expandují a aplikují pacientům. V organizmu pacienta předkládají nádorový antigen naivním CD4+ a CD8+ T lymfocytům, které vyzrají v aktivní efektorové Th a Tc lymfocyty. K tomu dojde pouze za podmínky, že se současně setkají kostimulační molekuly na povrchu dendritických buněk s odpovídajícími ligandy na povrchu T lymfocytů (podrobně viz kapitola Agonisté a antagonisté kontrolních bodů imunitní reakce). Vakcinace dendritickými buňkami má potenciálně nejvyšší schopnost indukovat Tc a paměťové T lymfocyty. Jako velmi nadějná se ukazuje vakcinace pomocí virů obsahujících DNA nebo RNA nesoucí informaci nejenom pro tvorbu antigenu, ale současně i pro kostimulační molekuly a adjuvans, jejichž následná exprese pak zajistí potřebné signály pro navození imunitní odpovědi [3,11,15]. Příkladem takové vakcíny je PROSTVAC®-VF (jiným názvem PSA-TRICOM), která v randomizované klinické studii u kastračně rezistentního karcinomu prostaty prokázala benefit 8,5 měsíce v celkovém přežití (overall survival – OS) [16].
U pacientek s karcinomem prsu byly dosud testovány vakcíny proti nádorovým antigenům HER2, MUC1 (mucin-1),CEA, mammaglobinu-A, hTERT (lidská telomerázová reverzní transkriptáza) a survivinu, a to jak samostatně, tak i v kombinaci s klasickou protinádorovou léčbou [3,11,13,15]. Nejdůležitější výsledky jsou popsány níže a v tab. 1. Ve výzkumu jsou i další vakcíny a s nástupem nových vysokokapacitních technologií (hmotnostní spektrometrie, sekvenování nové generace) lze očekávat objevení nových nádorově specifických antigenů. Současně s příchodem léčiv potlačujících mechanizmy imunotolerance (např. prostřednictvím signálních drah PD-1 a CTLA receptorů) se otevřely možnosti pro jejich společné testování s vakcínami, neboť lze očekávat, že povedou ke zvýšení protinádorové účinnosti vakcín [3,15].
Vakcíny proti HER2 antigenu
V klinickém testování nejdále pokročily peptidové vakcíny založené na E75 (nelipepimut-S), GP2 a AE37 imunogenních peptidech odvozených ze struktury HER2 receptoru [3,11]. Příkladem je vakcína NeuVax™ složená z peptidu E75 a GM-CSF, sloužící jako adjuvans stimulující maturaci, proliferaci a migraci dendritických buněk. Peptid E75 se váže k HLA-A2 a HLA-A3 antigenům I. třídy MHC, které jsou přítomny na povrchu dendritických buněk u cca 60 – 70 % populace, a jejich prostřednictvím je nabízen Tc lymfocytům. Jsou-li stimulovány, destruují pak příslušné nádorové buňky [11,17]. V první klinické studii fáze I/ II u 187 pacientek s časným stadiem HER2+ karcinomu prsu, které před vakcinací podstoupily standardní léčbu, dosáhla tato vakcína pětiletou dobu bez známek onemocnění (disease-free survival – DFS) 89,7 vs. 80,2 % v kontrolní skupině (p = 0,08). Pokud by se v úvahu vzaly pouze pacientky, jež obdržely optimální dávku vakcíny, byl by pětiletý DFS 94,6 %. Současně bylo u skutečně vakcinovaných pacientek pozorováno snížení Treg a zvýšení počtu pamětových T lymfocytů v periferní krvi. Tolerance léčby byla velmi dobrá, z lokálních potíží se nejčastěji vyskytovalo zarudnutí a svědění v místě aplikace, ze systémových příznaků se jednalo zejména o známé nežádoucí účinky léčby G-CSF (bolesti skeletu, chřipce podobné příznaky, únava) [9]. Na tuto studii navázala randomizovaná studie PRESENT, ve které je vakcína podávána pacientkám s karcinomem prsu s nízkou nebo středně zvýšenou expresí HER2 receptoru (IHC 1+ nebo 2+), které mají pro postižení regionálních lymfatických uzlin zvýšené riziko relapsu [18]. Dále je vakcína testována ve společném adjuvantním podání s trastuzumabem v klinických studiích zaměřených jak na HER2 pozitivní, tak i HER2 negativní karcinom prsu. Další klinické studie probíhají s monoantigenní vakcínou s peptidem GP2 a s polyantigenní vakcínou s peptidy GP2 a AE37. Peptid AE37 je epitopem HER2 receptoru, který je přednostně prezentován glykoproteiny MHC II. třídy. To by mělo vést k intenzivnější stimulaci zejména CD4+ (Th) lymfocytů a k vyšší pravděpodobnosti vzniku imunologické paměti [3,11].
Kromě peptidových vakcín byly proti HER2 pozitivním nádorovým buňkám vyvinuty i živé buněčné vakcíny [2,3]. U pacientek s rizikovým DCIS exprimujícím HER2 receptor byly provedeny dvě prospektivní klinické studie a výsledek jejich společné retrospektivní analýzy byl publikován v roce 2013 [19]. Celkem 48 pacientkám byla čtyři týdny před operací aplikována vakcína obsahující APC vystavené směsi HER2 peptidů a aktivované INF-γ a bakteriálním lipopolysacharidem. Do studie byly zařazeny pacientky s DCIS, ve kterém byla imunohistochemicky (IHC) prokázána zvýšená exprese HER2 receptoru alespoň na stupni 2+ (IHC HER2 2+ nebo 3+).Z nežádoucích účinků vakcinace se vyskytly teploty, zimnice, únava, bolestivost v místě aplikace, ale nikdy nepřekročily 2. stupeň závažnosti. Po vakcinaci došlo k poklesu exprese molekuly CTLA-4 na periferních T lymfocytech a u 94 %, resp. 89 % pacientek se zvýšil počet anti-HER2 specifických CD4+ (Th) a CD8+ (Tc) lymfocytů. U 21 z 38 (55 %) hodnotitelných pacientek byla zaznamenána odpověď na vakcinaci, z toho u 9 (23,7 %) nastala kompletní regrese DCIS a u 12 (31,6 %) došlo k min. 20% úbytku HER2 pozitivních buněk a ke zmenšení DCIS. Klinická odpověď nastala častěji u DCIS s HER2 expresí hodnocenou imunohistochemicky IHC 2+ než IHC 3+ (100 vs. 39,3 %; p = 0,0019), na straně druhé počet kompletních regresí se mezi oběma skupinami nelišil (30 vs. 21,4 %; p = 0,67). Odlišné pozorování bylo ve vztahu k expresi estrogenového receptoru (ER). Zatímco klinická odpověď se mezi skupinou ER+ a ER – DCIS nelišila (61,9 vs. 47,1 %), ke kompletní regresi DCIS došlo častěji u ER – DCIS (38,1 vs. 5,9 %; p = 0,03). Obecně ke kompletním regresím DCIS docházelo zejména ve skupině ER – DCIS s expresí HER2 hodnocenou jako IHC 2+ (3 z 5 případů, 60 %). V kontrolní skupině pacientek nebyla pozorována žádná klinická odpověď DCIS. Účinnost anti-HER2 cílené vakcíny vůči nádorům bez průkazu amplifikace Her-2/ neu genu autoři vysvětlují existencí nízké až střední exprese HER2 receptoru u těchto nádorů, včetně HER2 exprese na kmenových nádorových buňkách. Vakcínou se tak dosahuje eliminace těchto typů buněk, které jsou pro progresi nádoru a riziko jeho rekurence nejdůležitější. Získané výsledky vyzývají ke vzniku klinické studie zkoumající anti-HER2 vakcinaci v prevenci rekurence ER – / HER2+ DCIS [19].
V jiné pilotní studii byla 18 pacientkám s HER2 pozitivním metastatickým karcinomem prsu aplikována autologní vakcína APC, které byly ex vivo aktivovány rekombinantním fúzním proteinem obsahujícím sekvence z intra - a extracelulární části HER2 receptoru, napojené na GM-CSF (Lapuleucel-T) [20]. Jiná léčba nebyla podávána. U jedné pacientky byla zaznamenána parciální odpověď trvající déle než šest měsíců, u dalších tří stabilizace onemocnění trvající přes jeden rok. I přes další souběžná měření se nepodařilo zjistit prediktory odpovědi na léčbu. Toxicita byla minimální [21].
Vakcíny proti MUC1 antigenu
MUC1 je extenzivně glykosilovaný glykoprotein přítomný na povrchu buněk. Obecnou funkcí mucinů je ochrana buněk před patogeny. Jeho zvýšená exprese (až 100násobně) je detekována u většiny epiteliálních karcinomů, zejména však u plic, tlustého střeva, prsu, pankreatu a ovariálního karcinomu, kde plní funkci ochrany nádorových buněk před průnikem hydrofobních protinádorových léčiv a před přímým kontaktem s buňkami imunitního systému. Současně tento membránový protein vytváří podmínky, kdy dochází k těsnějšímu kontaktu receptorů růstových faktorů s jejich auto a parakrinně produkovanými ligandy nebo dimerizačními partnery. To vede k jejich aktivaci a dává nádorovým buňkám existenční výhody projevující se vyšší biologickou agresivitou, rezistencí k anti-HER2 a anti-ER terapii [3,11,22,23]. Nádorový marker CA15-3 je ve své podstatě určitá solubilní část proteinu MUC1. MUC1 má vícero epitopů, které mohou být detekovány (např. CA27.29) nebo pro svou silnou imunogenicitu využity ke konstrukci vakcín (např. Sialyl-Tn epitop) [3]. Posledně jmenovaný je základem protinádorové vakcíny Theratope™, která prošla až do III. fáze klinického zkoušení, a to jak na modelu časného, tak i pokročilého i metastatického karcinomu prsu [24]. Vakcína je složená ze Sialyl-Tn antigenu (STn), který je konjugovaný k imunogennímu nosiči KLH (keyhole limpet hemocyanin), a adjuvans detox-B bakteriálního původu. Z výsledků, které jsou k dispozici, lze předvídat její případné uplatnění zejména u luminálních karcinomů. U 180 pacientek s metastatickým karcinomem prsu, které po iniciální chemoterapii byly bez progrese a pokračovaly v léčbě hormonoterapií (ať již tamoxifenem, nebo inhibitorem aromatázy), vedla vakcinace k prodloužení OS u těch žen, v jejichž krvi byly po vakcinaci detekovány zvýšené hladiny protilátky proti OSM (ovine sub maxillary mucin), což je protein vyznačující se strukturou velmi bohatou na STn (OS 39,6 vs. 25,4 měsíce; p = 0,005, ženy s vysokým vs. nízkým titrem OSM protilátky). Výše uvedená kohorta pocházela z randomizované klinické studie čítající celkem 1 028 pacientek, u ostatních podskupin však podobný efekt vakcinace nebyl pozorován [24]. Podobně v pilotní studii fáze III u pacientek s karcinomem prsu exprimujícím estrogenový receptor, diagnostikovaných ve II. klinickém stadiu a léčených adjuvantní hormonoterapií tamoxifenem bylo dosaženo lepších výsledků ve vakcinované skupině (pětileté přežití bez relapsu 100 vs. 73 %; p = 0,0292, 12leté přežití bez relapsu 87,5 vs. 40 %; p = 0,02) [21]. Nebyly zjištěny žádné závažné akutní ani pozdní nežádoucí účinky ve vztahu k vakcinaci. V této studii však byl použitý jiný peptid MUC1 proteinu obsahující opakující se motiv 20 aminokyselin fúzovaný s GST (glutathion-S-transferaza), navázaný kovalentně k oxidovanému mannanu [21].
Vakcíny proti karcinoembryonálnímu antigenu
Karcinoembryonální antigen (CEA) je glykoprotein uplatňující se v mezibuněčném kontaktu, jehož zvýšená exprese je charakteristická pro buňky vyvíjícího se gastrointestinálního traktu v lidském plodu. Jeho solubilní frakci lze ve velmi nízké koncentraci detekovat i u zdravých dospělých, zejména kuřáků, nebo u některých nemaligních onemocnění. Plazmatická hladina CEA významně narůstá u pacientů s karcinomy v oblasti zažívacího traktu, plic, prsu, případně dalšími, které se vyznačují jeho zvýšenou expresí. Tyto skutečnosti jsou na straně jedné dobrým předpokladem pro vývoj protinádorové vakcíny, na straně druhé imunitní systém člověka je za normálních okolností vůči tomuto antigenu tolerantní [25,26]. Tuto překážku je možné překonat použitím rekombinantních vakcín, které současně obsahují kostimulační molekuly T lymfocytů (např. B7-1, ICAM-1, LFA-3) a vhodná adjuvans. PANVAC™ je příkladem takové vakcíny [27]. Jedná se o poxvirovou DNA rekombinantní vakcínu, která obsahuje transgeny pro uvedené tři kostimulační molekuly (souhrnně označovány „TRICOM“) a pro antigeny CEA a MUC1. Jako adjuvans slouží GM-CSF, který stimuluje migraci a maturaci APC. Finálně dochází ke vzniku antigenně (anti-CEA, anti-MUC1) specifických T lymfocytů zodpovědných za protinádorovou odpověď. Jako nosič může být použitý buď virus ptačích neštovic (poxvirus z rodu Avipoxvirus – „fowlpox“), nebo virus vakcínie (poxvirus z rodu Orthopoxvirus), vůči kterému však mohou častěji vznikat neutralizační protilátky [26,28]. Výsledky pilotní klinické studie, která zahrnovala 12 značně předléčených pacientek s metastatickým karcinomem prsu, prokázaly známky účinnosti této vakcíny. Přestože medián času do progrese byl relativně krátký (2,5 měsíce; rozpětí 1 – 37), čtyři pacientky dosáhly stabilizace onemocnění a jedna parciální remise (PFS v rozpětí 4 – 37 měsíců). Uvedené případy měly společné relativně menší předléčenost (0 – 3 linie paliativní léčby) a rozsah onemocnění ve srovnání s pacientkami, jejichž nádory po vakcinaci progredovaly (2 – 6 linií). Léčba byla dobře tolerována, bez výskytu toxicity 3. nebo 4. stupně, pětina pacientek měla reakci v místě aplikace vakcíny [27].
Ostatní vakcíny
Za zmínku stojí vakcína proti mammaglobinu-A. Mammaglobin-A je nádorově specifický antigen (glykoprotein) exprimovaný na povrchu 40 – 80 % primárních karcinomů prsu. Klinického zkoušení dosáhla vakcína založená na plazmidové DNA kódující mammaglobin-A a DNA virový promotor (konkrétně z CMV viru), který zajišťuje stálou expresi mammaglobinu-A [3,29]. Do klinické studie fáze I byly zařazeny pacientky s metastatickým karcinomem prsu exprimujícím mammaglobin-A, u kterých bylo dosaženo alespoň 30 dnů stabilizace onemocnění od poslední dávky paliativní chemoterapie nebo hormonoterapie. Vakcinovaných pacientek bylo ve výsledku 14, dalších 12 pacientek, u kterých při screeningu nebyl potvrzen potřebný HLA fenotyp (mammaglobin-A je prezentován pomocí glykoproteinů MHC I. třídy HLA-A2 a HLA-A3), vytvořilo kontrolní skupinu. Ve skupině vakcinovaných pacientek bylo k 6. měsíci od zahájení vakcinace zaznamenáno méně progresí ve srovnání s kontrolní skupinou (šestiměsíční PFS 53 vs. 33 %; p = 0,011). S vakcínou probíhá klinická studie u pacientek s neoadjuvantní endokrinní léčbou [29].
V současné době jsou ve studiích I. a II. fáze, do kterých lze zařazovat pacientky s karcinomem prsu, testovány další vakcíny cílené na nádorově specifické antigeny, např. MAGE-A3, NY-ESO-1, hTERT, WT1 [3,7]. Až na výjimky nejsou jejich výsledky známé nebo počty zařazených pacientek jsou tak nízké, že je nelze hodnotit. Pouze v případě vakcíny proti WT1 (Wilms tumour protein) víme, že u obou pacientek s metastatickým karcinomem prsu, které byly zařazeny do pilotní studie, došlo k redukci metastatických ložisek [30].
Agonisté a antagonisté kontrolních bodů imunitní reakce
Vznik a rozsah protinádorové imunitní reakce závisí nejenom na antigenu a způsobu jeho prezentace imunokompetentním buňkám, ale i na interakcích dalších receptorů a ligandů, které zesílí nebo utlumí proces maturace a aktivace efektorových a paměťových T lymfocytů. Jedná se o receptory kontrolních bodů imunitní reakce a jejich ligandy, které mohou být exprimovány různými buňkami v mikroprostředí nádoru (např. T lymfocyty, APC, makrofágy, fibroblasty) i nádorovými buňkami samotnými. Z hlediska dosaženého výsledku rozlišujeme agonisty a antagonisty kontrolních bodů imunitní reakce. K agonistům řadíme receptory a jejich agonisticky působící ligandy, které urychlují aktivaci, maturaci, expanzi a přežívání T lymfocytů. Jedná se např. o receptory/ ligandy: CD27/ CD70; CD28/ CD80 a CD86; CD40/ CD40L; CD122/ IL-2; CD137/ /CD137L; OX40(CD154)/ OX40L(CD154L); GITR(AITR)/ GITRL(AITRL); ICOS(CD278)/ /ICOSL [2,3]. O síle aktivace imunitní reakce, kterých jsou tyto molekuly schopny, jsme se mohli přesvědčit při realizaci klinické studie fáze 0/ I v roce 2006, v rámci které byla šesti dobrovolníkům podána humanizovaná monoklonální protilátka TGN1412 (CD28-SuperMAB) působící jako silný agonista CD28 receptoru. Chybný protokol studie (počínaje nevhodnou iniciální dávkou léčiva odvozenou na zvířecím modelu s odlišně fungujícími kontrolními body imunitní reakce a konče absencí bezpečnostních prvků při prvním testování látky na člověku) vedl k akutnímu a těžkému multiorgánovému selhání u čtyř ze šesti dobrovolníků na podkladě enormní cytokinové bouře [31]. V současnosti probíhají klinické studie časné fáze, do kterých mohou být zařazeny i pacientky s karcinomem prsu, s agonisticky působícími monoklonálními protilátkami proti CD40(APX005M), CD137(BMS-663513), OX400(MEDI6469), GITR(TRX518, MEDI1873). Antagonisté kontrolních bodů imunitní reakce naopak utlumují aktivaci, maturaci a efektorovou funkci T lymfocytů. Mezi receptory s tímto účinkem a k jejich agonisticky působícím ligandům patří molekuly A2AR (receptor)/ adenozin (ligand). CTLA-4 (CD152)/ CD80 a CD86, KIR/ glykoproteiny MHC I. třídy, LAG3/ glykoproteiny MHC II. třídy, PD-1/ PD-L1 a PD-L2, TIM-3/ galectin-9, dále zde řadíme ligandy BTLA(CD272), B7-H3(CD276) a B7-H4 (VTCN1)/ CD28, VISTA a enzym IDO (indolamindeoxygenáza) [2,3].
CTLA-4 zprostředkovaná inhibice imunitní reakce
K aktivaci signální dráhy CTLA-4 (cytotoxic T lymphocyte antigen-4) dochází po kontaktu Th lymfocytu s ligandy CD80 (B7-1) a CD86 (B7-2) na povrchu APC.
Nastává utlumení imunitní odpovědi zprostředkované T lymfocyty [11]. Přestože naprostá většina prací udává, že exprese tohoto antigenu je omezena výhradně na TIL, existují publikace, které prokazují přítomnost CTLA-4 v cytoplazmě nádorových buněk karcinomu prsu. Zvýšená denzita CTLA-4 pozitivních TIL se nachází u více než poloviny případů karcinomu prsu a častěji je spojována se sice agresivními nádory, ale s pozitivní prognózou. Naopak pozitivní nádorová exprese CTLA-4 detekovatelná u cca jedné třetiny karcinomů je asociována s vyšší agresivitou onemocnění a horší prognózou, a to nezávisle na průkazu zvýšeného počtu TIL v nádoru [32]. V klinické praxi jsou užívány monoklonální protilátky proti CTLA-4 ipilimumab (Yervoy™) a tremelimumab, byť v jiné indikaci než k léčbě karcinomu prsu.
Velmi zajímavou strategii zapojení imunoterapie do léčby karcinomu prsu provedli v Memorial Sloan-Kettering Cancer Center, kde ipilimumab podávali neoadjuvantně pacientkám s plánovanou mastektomií pro nemetastatický karcinom prsu. Přibližně 1 – 2 týdny (D8 – D15) před operací obdržely jednorázovou dávku ipilimumabu 10 mg/ kg, po které (D7 – D10) byla provedena kryoblace nádorového ložiska a následovala operace (D0) [33]. U šesti takto léčených pacientek došlo k významné aktivaci imunitního systému (aktivaci a expanzi cytotoxických a pomocných T lymfocytů, zvýšené plazmatické koncentraci INF-γ) ve srovnání s kontrolními skupinami (pouze kryoblace nebo pouze ipilimumab). Léčba byla dobře tolerována [33]. Ipilimumab je v současnosti testován rovněž v kombinaci s nivolumabem a inhibitorem histonových deacetyláz (viz níže). V případě tremelimumabu zmíníme studii, do které bylo zařazeno 26 pacientek s metastatickým karcinomem prsu exprimujícím ER, kterým byl standardně podáván exemestan a společně s ním tremelimumab v dávce 3 – 10 mg/ kg po 28 nebo 90 dnech. Léčba byla doprovázena značnou toxicitou, více než 40 % pacientek mělo průjem a svědění, u pěti byla nutná redukce dávky. Maximální tolerovaná dávka byla 6 mg/ kg aplikovaná po 90 dnech. Nejlepší dosaženou odpovědí byla stabilizace onemocnění po dobu alespoň 12 týdnů (42 %), současně došlo k expanzi aktivovaných pomocných a cytotoxických T lymfocytů [34].
PD-1 zprostředkovaná inhibice imunitní reakce
Signální dráha PD-1 patří k hlavním kontrolním bodům imunitní reakce. Vlastní PD-1 receptor je exprimován na povrchu aktivovaných lymfocytů. Jeho ligand PD-L1 (známý i pod označením B7-H1) je přítomný na TIL a dalších imunitních buňkách, ale může se ve zvýšené míře nacházet i na nádorových buňkách [35]. V případě karcinomu prsu se údaje o expresi PD-1 a PD-L1 nádorovými buňkami nebo TIL liší, a to v závislosti na metodice hodnocení a typu nádoru. Přibližně třetina nádorových buněk a polovina TIL exprimuje PD-L1. U triple negativního karcinomu prsu (triple negative breast cancer – TNBC) je nádorová exprese PD-L1 detekována u 19 – 59 % případů. Přitom PD-L1 exprimující TNBC jsou častěji infiltrovány TIL (40 – 89 %), které rovněž exprimují PD-L1 [2,3,7,36]. Zvýšená exprese PD-L1 byla zaznamenána zejména v nádorech s mutací PTEN, p53 a PIK3CA [10]. Obecně je přítomnost těchto molekul asociována s agresivitou nádoru a slabší imunitní reakcí vůči nádoru. Jednoznačný prognostický význam ve vztahu k expresi PD-1 nebo PD-L1 nebyl u karcinomu prsu zjištěn. Existují práce prokazující jejich asociaci s jak příznivým, tak i negativním vývojem nádorového onemocnění [2,3,35,36]. Případný pozitivní prognostický význam exprese PD-1/ PD-L1 je dáván více do souvislosti se souběžně zvýšenou infiltrací nádoru TIL, která reflektuje celkovou protinádorovou imunitní odpověď [2,35,36].
Jednou z prvních monoklonálních protilátek proti PD-1 je nivolumab [11]. Nivolumab (Opdivo™) je v současnosti testován u metastatického HER2 negativního karcinomu prsu v kombinaci s ipilimumabem a inhibitorem histonových deacetyláz, další studie probíhá v kombinaci s nab-paklitaxelem a u pacientek s předléčeným metastatickým TNBC je nivolumab aplikován v dávce 3 mg/ kg à 2 týdny navazující na radioterapii nebo na dvoutýdenní indukční chemoterapii nízkodávkovaným doxorubicinem (15 mg 1× týdně), cyklofosfamidem (50 mg denně) či cisplatinou (40 mg 1× týdně) [37 – 39]. Jedná se o studie fáze I nebo II s předpokládaným ukončením v roce 2017, v případě druhé uvedené studie v roce 2019. Kromě nivolumabu probíhají klinické studie u karcinomu prsu i s dalšími protilátkami proti PD-L1: atezolizumabem (MPDL3280A) a pembrolizumabem [2]. Podobně jako u nivolumabu i tyto protilátky dosáhly významných léčebných úspěchů u jiných malignit, zejména melanomu a bronchogenního karcinomu. Pembrolizumab (Keytruda™) v dávce 10 mg/ kg à 2 týdny byl hodnocen u 32 předléčených pacientek s metastatickým TNBC. Objektivní odpověď na léčbu nastala u 18,5 % pacientek (z toho jedna kompletní remise) a medián času do progrese činil 18 týdnů [40]. S protilátkou MPDL3280A proběhly klinické studie časné fáze, do kterých bylo možné zařazovat rovněž pacientky s metastatickým karcinomem prsu. V jedné z nich byla 27 pacientkám se značně předléčeným TNBC (89 % prodělalo více než čtyři linie jakékoliv systémové léčby) podáván atezolizumab v dávce 15 nebo 20 mg/ kg, případně ve fixní dávce 1 200 mg, u všech žilní aplikací a po třech týdnech. U 21 pacientek s nádory infiltrovanými buňkami imunitního systému exprimujícími PD-L1 (IHC 2+ a 3+, resp. exprese ≥ 5 %) nastala odpověď na léčbu u 24 %, z toho se jednalo o tři parciální remise a dvě kompletní remise. Autoři rovněž zaznamenali pacientku s pseudoprogresí sledovaných lézí. Ve 24. týdnu od podání léčby bylo bez známky progrese 33 % pacientek. Nežádoucí účinky jakéhokoliv stupně byly v celé kohortě zaznamenány u 67 % pacientek, nejčastěji se jednalo o únavu (22 %), horečky (15 %), neutropenii a nevolnosti (po 15 %). U tří (11 %) pacientek nastala toxicita 3. stupně (nedostatečnost funkce nadledvinek, neutropenie a leukopenie, nevolnost, zvracení), u jedné pacientky 5. stupně (plicní hypertenze u pacientky s defektem síňového septa srdce) [14]. V současnosti probíhají studie u pacientek s TNBC, kterým je podávána anti-PD-L1 protilátka MPDL3280A společně s nab-paklitaxelem v neoadjuvanci a v léčbě metastatického onemocnění [41].
LAG3 zprostředkovaná inhibice imunitní reakce
V roce 2010 byla publikována studie fáze I, ve které pacientky s předléčeným metastatickým karcinomem prsu dostávaly chemoterapii (paklitaxel 80 mg/ m2 týdně s jedním vynecháním po třech aplikacích) společně s látkou IMP321 (fúzní protein LAG3 s imunoglobulinem) podávánanou po dvou týdnech podkožně [42]. IMP321 stimuluje glykoproteiny MHC II. třídy na povrchu dendritických buněk, což vede k expanzi aktivovaných a paměťových efektorových Tc lymfocytů (CD8+) a NK buněk. Z 30 hodnotitelných pacientek byl za šest měsíců od zahájení léčby přítomný klinický efekt v podobě stabilizace nebo regrese onemocnění u 27 (90 %), z nichž 15 (50 %) dosáhlo parciální remise a jedna kompletní remise. V porovnání s historickými kontrolami pro uvedený režim paklitaxelu je to významně lepší odpověď (klinický benefit 90 vs. 50 % v šesti měsících). Z hlediska toxicity byly u tří pacientek zaznamenány nežádoucí účinky stupně 3, a to neuropatie, alergická reakce a neutropenie, ale v jiné studii, kde byla látka aplikována samotná, nedošlo k výskytu žádných nežádoucích účinků. Hlavním účinkem LAG3 je antagonistické působení na kontrolní body imunitní reakce s efektem suprese aktivace a proliferace T lymfocytů, včetně Treg [2]. Od monoklonální protilátky blokující LAG3 (BMS-986016) se očekává vyšší stimulace protinádorové účinnosti imunity než od léčiv cílících na CTLA-4 nebo PD-1, neboť současně povedou k aktivaci efektorových T lymfocytů a inhibici supresorového působení Treg lymfocytů [2,42].
Systémová a lokální léčba karcinomu prsu a její imunomodulační účinek
Imunomodulační účinek chemoterapie
Na straně jedné chemoterapie i cílená léčba mohou být doprovázeny značným poklesem obranyschopnosti organizmu proti infekcím, tedy imunosupresivním účinkem. Na straně druhé je u těchto látek známý i jejich pozitivní vliv na protinádorovou funkci imunitního systému. Výsledný efekt závisí nejenom na látce a její dávce, ale i na způsobu podávání, typu nádoru a jeho mikroprostředí a v neposlední řadě i na celkovém stavu pacienta [13].
Z cytostatik, která se používají v léčbě karcinomu prsu, byl pozitivní účinek na protinádorovou imunitu prokázaný u cyklofosfamidu, doxorubicinu, paklitaxelu, gemcitabinu, cisplatiny, 5-fluorouracilu a metotrexátu [1,13]. Mechanizmů tohoto účinku je několik. V první řadě se jedná o navození imunogenní smrti, při které kromě zvyšující se dostupnosti nádorově specifických antigenů dochází k expresi imunogenních molekul (HSP70, HSP90, calreticulin, HMBG1) na povrchu nádorových buněk a k jejich uvolňování do okolí. To vede k maturaci a aktivaci APC, efektorových Th a Tc lymfocytů a produkci cytokinů charakteristických pro destruktivní odpověď imunitního systému (TNF-α,INF-γ a interleukin IL-2). Druhý způsob spočívá v senzitizaci nádorových buněk ke smrtícímu účinku T lymfocytů, který vykonávají prostřednictvím sekrece perforinu, granzymu-B nebo Fas ligandu. Třetí cestou je selektivní inhibice Treg a nezralých myeloidních buněk tlumících imunitní odpověď. V neposlední řadě jsou některá cytostatika schopna ovlivnit expresi agonistů a antagonistů kontrolních bodů imunitní reakce na povrchu nádorových imunitních buněk (tab. 2) [2,13].
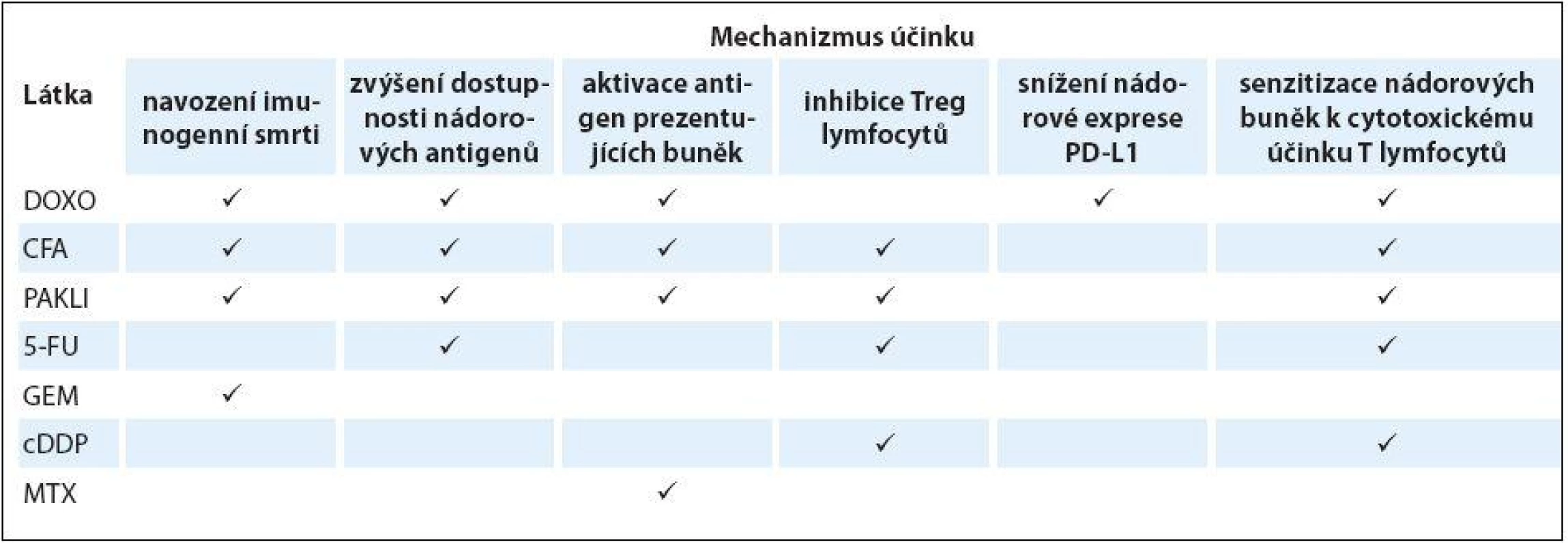
Zcela zásadní roli ve vztahu k imunitní reakci hraje dávka cytostatika a způsob jeho podání. Několik klinických studií prokázalo, že chceme-li kombinovat chemoterapii a živé protinádorové vakcíny, je předcházející nebo souběžná léčba standardními dávkami cytostatik spojena spíše s horšími výsledky imunoterapie [13]. Naopak aplikace nízkých dávek cytostatik – ať již jednorázově před vakcinací (např. cyklofosfamid 200 mg/ m2), nebo metronomicky (např. cyklofosfamid 50 mg ve fixní denní dávce nebo doxorubicin 35 mg/ m2 1× týdně) po vakcinaci – vedla k vyššímu výskytu nádorově specifických protilátek a aktivaci efektorových T lymfocytů, jak ukázala studie u pacientek s karcinomem prsu očkovaných vakcínou na bázi dendritických buněk, cílenou proti HER2 receptoru. Při tomto způsobu podávání cytostatik je zřejmě jejich působení vybalancováno co nejvíce ve prospěch potlačení imunosupresivních Treg lymfocytů [43].
Imunomodulační účinek cílené léčby monoklonálními protilátkami
Podobně jako chemoterapie i cílená léčba monoklonálními protilátkami proti nádorovým antigenům může aktivovat některé funkce přirozené imunitní reakce a tím posilovat svůj vlastní protinádorový účinek. Jedná se o aktivaci mechanizmu buněčné cytotoxicity závislé na protilátkách (tzv. ADCC – antibody dependent cellular cytotoxicity) a cytotoxicity zprostředkované komplementem (tzv. CDC – complement dependent cytotoxicity) [3,11,12].
V obou případech se musí nejprve navázát monoklonální protilátka k epitopu cílové molekuly na povrchu nádorové buňky (např. k HER2 receptoru). Po obsazení všech vazebných míst dochází v podstatě k opsonizaci nádorové buňky monoklonální protilátkou. Spuštění ADCC cytotoxicity nastane tehdy, naváže-li se k Fc fragmentu uvedené monoklonální protilátky NK buňka nebo makrofág, a to prostřednictvím svého Fc-γRIIIA receptoru. Mechanizmus CDC cytotoxicity je aktivován poté, co se k Fc fragmentu naváže C1q podjednotka C1 komplexu komplementu a spustí se komplementová kaskáda. V současnosti se používají nejvíce monoklonální protilátky IgG třídy, a to zejména podtřídy IgG1, neboť vykazují přiznivou farmakokinetiku (poločas 21 dnů) a efektorové vlastnosti. Přirozená schopnost aktivace ADCC a CDC cytotoxicity v závislosti na podtřídě monoklonální protilátky je následující: IgG1 ≥ IgG3 >> >> IgG4 ≥ IgG2 pro ADCC a IgG3 ≥ ≥ IgG1 >> IgG2 =~ IgG4 pro CDC. Vazebná místa v oblastech Fc fragmentu lze však cíleně konstruovat tak, aby se významně zvýšila jejich afinita k Fc-γR receptorům nebo k C1 komplexu komplementu [44].
Zavedení trastuzumabu (Herceptin™) do terapie HER2+ karcinomu prsu se stalo milníkem v léčbě tohoto onemocnění. Hlavním protinádorovým účinkem této humanizované monoklonální protilátky (IgG1 podtřídy) proti HER2 receptoru je inhibice jeho signální dráhy, ke které dochází po navázání trastuzumabu na příslušný epitop extracelulární domény HER2 receptoru [11,45]. Současně však může docházet i k aktivaci ADCC a CDC protinádorové reakce. Kromě intravenózně podávané vznikla i podkožně aplikovatelná forma trastuzumabu, která by teoreticky měla mít silnější potenciál stimulovat protinádorovou imunitu. Vyvinuty byly i další modifikace trastuzumabu, např. preparát T-DM1 (Kadcyla™), kde je trastuzumab konjugován s velmi účinným cytostatikem DM1 (emtansin) z řad mitotických jedů. Od jeho cíleného působení na HER2+ nádorové buňky se očekává navození jejich imunogenní smrti [11,46].
Pertuzumab (Perjeta™) je další humanizovaná monoklonální protilátka IgG1 podtřídy proti HER2 receptoru vázající se však na jiný epitop jeho extracelulární domény než trastuzumab [11]. Vysoká protinádorová účinnost pertuzumabu v kombinaci s trastuzumabem a docetaxelem byla prokázána v několika klinických studiích. Při neoadjuvantním podání došlo až ke zdvojnásobení počtu patologických kompletních remisí (studie NeoSphere), v léčbě metastatického onemocnění pak k významnému prodloužení OS (studie CLEOPATRA). Další klinické studie probíhají (APHINITY, PHEREXA, MARIANNE, TRYPHAENA) [47,48]. Z preklinických experimentů vyplývá, že pertuzumab mnohem silněji stimuluje ADCC protinádorovou toxicitu než trastuzumab [49].
Ertumaxomab (Rexomun™) je polyvalentní hybridní monoklonální proti-látka, která se současně váže k HER2 receptoru nádorových buněk, k CD3 receptoru T lymfocytů a svým IgG2 Fc fragmentem k Fc-γ receptoru I a III na povrchu buněk imunitního systému (monocytů, makrofágů, NK a dendritických buněk). Touto vazbou je schopna do úzkého kontaktu dostat nádorovou buňku exprimující HER2 receptor, T lymfocyt a další imunokompetentní buňku, což by mělo vést ke smrti nádorové buňky a její fagocytóze. Vazebné místo na HER2 receptoru je odlišné od míst, kde se váže trastuzumab a pertuzumab [50]. V roce 2014 publikované výsledky pilotní studie fáze I, do které bylo zařazeno 11 značně předléčených pacientů s různými malignitami exprimujícími HER2 receptor, potvrdily tuto hypotézu – jedna parciální remise (pacientka s karcinomem prsu, jedna ze čtyř ve studii), další dva pacienti dosáhli stabilizace onemocnění. Toxicita léčby byla tolerovatelná (nejčastěji únava, nevolnost, průjem), bez výskytu 3. a 4. stupně závažnosti [51]. Určitou opatrnost by měla vyvolávat informace, že ve vyšších koncentracích ertumaxomab vedl k fosforylaci (tj. aktivaci) HER2 receptoru. To samo o sobě by ještě nemuselo znamenat riziko pro použití této látky, zejména pokud by se prokázala její vysoká účinnost v eradikaci minimální reziduální choroby, případně by se podával v kombinaci s jinou anti-HER2 cílenou monoklonální protilátkou [11].
V časných fázích klinického testování u karcinomu prsu jsou humanizované protilátky proti IGF-IR (receptor pro inzulinu podobný růstový faktor 1) figitumumab, AVE-1642, R-1507, cixutumumab a dalotuzumab. Dosavadní výsledky ukazují na relativně dobrou toleranci léčby a potenciální protinádorový účinek. Ve vývoji a klinickém výzkumu jsou další monoklonální protilátky cílící na antigeny exprimované nádorovými kmenovými buňkami: bivatuzumab mertansin, což je anti-CD44v6 monoklonální protilátka s navázaným mertansinem, látkou strukturně odvozenou od emtansinu (DM1), a solitomab – anti-EpCAM/ anti-CD3 bispecifická monoklonální protilátka vázající se k EpCAM molekule na povrchu nádorových buněk a k CD3 receptoru T lymfocytů [2,3,11].
Imunomodulační účinek radioterapie
I radioterapie, kromě svého vlastního destrukčního působení na nádor a jeho stroma, je schopna lokálně i systémově potencovat imunitní protinádorovou reakci. Podobně jako u chemoterapie děje se tak zejména skrze uvolňování nádorových antigenů při rozpadu zářením poškozených buněk, a u některých malignit i zvýšením exprese imunogenních molekul a navozením imunogenní smrti. Již probíhají studie, které kombinují různé způsoby ozáření nádoru s aplikací vakcín nebo inhibitory kontrolních bodů imunitní reakce. Bohužel, není vůbec jasné jaké mají být frakcionace, celková dávka, rozsah ozařovaného pole či časování radioterapie, aby bylo potenciace účinku imunoterapie vůbec dosaženo [52].
Predikce odpovědi na imunoterapii
Otázka predikce odpovědi karcinomu prsu na imunoterapii má celou řadu otazníků, které bude možné adekvátně řešit až poté, co budou k dispozici dostatečné počty takto léčených pacientek s výsledky jejich dlouhodobého sledování. V současnosti se prediktory hledají na úrovni imunokompetentních buněk (výchozí stav a změny ve výskytu TIL nebo jednotlivých subtypů lymfocytů, APC, NK buněk ať již v nádoru, nebo v periferní krvi) nebo regulátorů kontrolních bodů imunitní reakce exprimovaných těmito i nádorovými buňkami (výchozí stav a změny exprese PD-1, PD-L1, CTLA-4 a dalších molekul). Rovněž se analyzují séra pacientů a zjišťuje se přítomnost přirozených protilátek proti nádorovým antigenům nebo změny v hladinách cytokinů po aplikované léčbě [7 – 9,35,36]. Příklady jsou uvedeny u jednotlivých preparátů. Bohužel, není ještě dostatek údajů, aby se prokázal případný prediktivní význam molekulárních podtypů HER2+ a TNBC k imunoterapii [7,8,53]. Zajímavou strategií je monitorace intenzity postvakcinační imunopatologické reakce pomocí kožního testu na průkaz přecitlivělosti oddáleného typu (delayed type hypersensitivity – DTH). Tento se používá u anti-HER2 peptidové vakcíny NeuVax, kde jeho pozitivita predikuje imunitní odezvu na vakcinaci [54]. Zda se potvrdí jeho význam, ukážou až výsledky studie PRESENT [18]. Zatím se tedy příliš nedaří identifikovat silné prediktory účinnosti imunoterapie. Na základě dílčích výsledků se však předpokládá, že nádory s preexistujícími projevy protinádorové aktivity imunitního systému budou mít lepší odpověď na imunoterapii.
Závěr
V případě karcinomu prsu existují předpoklady pro úspěšné uplatnění imunoterapie v jeho prevenci i léčbě. Vycházejí z dosavadních výsledků klinického hodnocení protinádorových vakcín, kde došlo k největšímu pokroku, a inhibitorů kontrolních bodů imunitní reakce. Současně lze předpokládat vznik dalších studií, které budou hodnotit, zda kombinací různých forem imunoterapie dojde k synergickému protinádorovému působení. V neposlední řadě je možné využít i imunomodulačního účinku některých cytostatik a monoklonálních protilátek, které se již v léčbě tohoto onemocnění používají. Paralelně s vývojem protinádorových imunoterapeutik se rozvíjí hledání prediktorů jejich účinnosti, aby se zamezilo zbytečnému podávání těchto léčiv, které nemusí být bez rizika.
Tato práce byla podpořena gratem MZ ČR – RVO (MOÚ, 00209805) a č. NT/14599-32013.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Marek Svoboda, Ph.D.
Klinika komplexní onkologické péče
a Oddělení epidemiologie a genetiky nádorů
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: msvoboda@mou.cz
Obdrženo: 12. 11. 2015
Přijato: 26. 11. 2015
Sources
1. Disis ML, Stanton SE. Can immunity to breast cancer eliminate residual micrometastases? Clin Cancer Res 2013; 19(23): 6398 – 6403. doi: 10.1158/ 1078-0432.CCR-13-0734.
2. Cimino-Mathews A, Foote JB, Emens LA. Immune targeting in breast cancer. Oncology (Williston Park) 2015; 29(5): 375 – 385.
3. Ernst B, Anderson KS. Immunotherapy for the treatment of breast cancer. Curr Oncol Rep 2015; 17(2): 5. doi: 10.1007/ s11912-014-0426-9.
4. Lauerová L, Kocák I. Regulace protinádorové imunity pomocných CD4+ Th1/ Th2 lymfocyty. Klin Onkol 2001; 14(5): 154 – 156.
5. DeNardo DG, Brennan DJ, Rexhepaj E et al. Leukocyte complexity predicts breast cancer survival and functionally regulates response to chemotherapy. Cancer Discov 2011; 1(1): 54 – 67. doi: 10.1158/ 2159-8274.CD-10-0028.
6. Disis ML, Knutson KL, Schiffman K et al. Pre-existent immunity to the HER-2/ neu oncogenic protein in patients with HER-2/ neu overexpressing breast and ovarian cancer. Breast Cancer Res Treat 2000; 62(3): 245 – 252.
7. Le Du F, Eckhardt BL, Lim B et al. Is the future of personalized therapy in triple-negative breast cancer based on molecular subtype? Oncotarget 2015; 6(15): 12890 – 12908.
8. Liu JC, Voisin V, Bader GD et al. Seventeen-gene signature from enriched Her2/ Neu mammary tumor-initiating cells predicts clinical outcome for human HER2+: ERα - breast cancer. Proc Natl Acad Sci U S A 2012; 109(15): 5832 – 5837. doi: 10.1073/ pnas.1201105109.
9. Ibrahim EM, Al-Foheidi ME, Al-Mansour Mm et al. The prognostic value of tumor-infiltrating lymphocytes in triple-negative breast cancer: a meta-analysis. Breast Cancer Res Treat 2014; 148(3): 467 – 476. doi: 10.1007/ s10549-014-3185-2.
10. Ghebeh H, Mohammed S, Al-Omair A et al. The B7-H1 (PD-L1) T lymphocyte-inhibitory molecule is expressed in breast cancer patients with infiltrating ductal carcinoma: correlation with important high-risk prognostic factors. Neoplasia 2006; 8(3): 190 – 198.
11. Mohit E, Hashemi A, Allahyari M. Breast cancer immunotherapy: monoclonal antibodies and peptide-based vaccines. Expert Rev Clin Immunol 2014; 10(7): 927 – 961. doi: 10.1586/ 1744666X.2014.916211.
12. Žaloudík J. Perspektivy použití monoklonálních protilátek v protinádorové imunoterapii. In: Monoklonální protilátky v onkologii. Praha: Mediforum 2000, Maxdorf: 98 – 108.
13. Emens LA, Middleton G. The interplay of immunotherapy and chemotherapy: harnessing potential synergies. Cancer Immunol Res 2015; 3(5): 436 – 443. doi: 10.1158/ 2326-6066.CIR-15-0064.
14. Emens LA, Braiteh FS, Cassier P et al. Inhibition of PD-L1 by MPDL3280A leads to clinical activity in patients with metastatic triple-negative breast cancer (abstract). In: Proceedings of the Thirty-Seventh Annual CTRC-AACR San Antonio Breast Cancer Symposium: 2014 Dec 9 – 13; San Antonio, TX. Philadelphia (PA): AACR. Cancer Res 2015; 75 (Suppl 9): abstr. nr PD1-6.
15. Melero I, Gaudernack G, Gerritsen W et al. Therapeutic vaccines for cancer: an overview of clinical trials. Nat Rev Clin Oncol 2014; 11(9): 509 – 524. doi: 10.1038/ nrclinonc.2014.111.
16. Kantoff PW, Schuetz TJ, Blumenstein BA et al. Overall survival analysis of a phase II randomized controlled trial of a poxviral-based PSA-targeted immunotherapy in metastatic castration-resistant prostate cancer. J Clin Oncol 2010; 28(7): 1099 – 1105. doi: 10.1200/ JCO.2009.25.0597
17. Schneble EJ, Berry JS, Trappey FA et al. The HER2 peptide nelipepimut-S (E75) vaccine (NeuVax™) in breast cancer patients at risk for recurrence: correlation of immunologic data with clinical response. Immunotherapy 2014; 6(5): 519 – 531. doi: 10.2217/ imt.14.22.
18. ClinicalTrials.gov. Efficacy and safety study of NeuVax™ (Nelipepimut-S or E75) vaccine to prevent breast cancer recurrence (PRESENT). [online]. Available from: https:/ / www.clinicaltrials.gov/ ct2/ results?term=NCT01479244.
19. Fracol M, Xu S, Mick R et al. Response to HER-2 pulsed DC1 vaccines is predicted by both HER-2 and estrogen receptor expression in DCIS. Ann Surg Oncol 2013; 20(10): 3233 – 3239. doi: 10.1245/ s10434-013-3119-y.
20. Park JW, Melisko ME, Esserman LJ et al. Treatment with autologous antigen-presenting cells activated with the HER-2 based antigen Lapuleucel-T: results of a phase I study in immunologic and clinical activity in HER-2 overexpressing breast cancer. J Clin Oncol 2007; 25(24): 3680 – 3687.
21. Vassilaros S, Tsibanis A, Tsikkinis A et al. Up to 15-year clinical follow-up of a pilot Phase III immunotherapy study in stage II breast cancer patients using oxidized mannan-MUC1. Immunotherapy 2013; 5(11): 1177 – 1182. doi: 10.2217/ imt.13.126.
22. Apostolopoulos V, Pietersz GA, Tsibanis A et al. Pilot phase III immunotherapy study in early-stage breast cancer patients using oxidized mannan-MUC1 [ISRCTN71711835]. Breast Cancer Res 2006; 8(3): R27.
23. Raina D, Uchida Y, Kharbanda A et al. Targeting the MUC1-C oncoprotein downregulates HER2 activation and abrogates trastuzumab resistance in breast cancer cells. Oncogene 2014; 33(26): 3422 – 3431. doi: 10.1038/ onc.2013.308.
24. Ibrahim NK, Murray JL, Zhou D et al. Survival advantage in patients with metastatic breast cancer receiving endocrine therapy plus Sialyl Tn-KLH vaccine: Post Hoc Analysis of a Large Randomized Trial. J Cancer 2013; 4(7): 577 – 584. doi: 10.7150/ jca.7028.
25. Marshall J. Carcinoembrynic antigen-based vaccines. Semin Oncol 2003; 30 (3 Suppl 8): 30 – 36.
26. Turriziani M, Fantini M, Benvenuto M et al. Carcinoembryonic antigen (CEA)-based cancer vaccines: recent patents and antitumor effects from experimental models to clinical trials. Recent Pat Anticancer Drug Discov 2012; 7(3): 265 – 296.
27. Mohebtash M, Tsang KY, Madan RA et al. A pilot study of MUC-1/ CEA/ TRICOM poxviral-based vaccine in patients with metastatic breast and ovarian cancer. Clin Cancer Res 2011; 17(22): 7164 – 7173.
28. Mittendorf EA, Clifton GT, Holmes JP et al. Final report of the phase I/ II clinical trial of the E75 (nelipepimut-S)vaccine with booster inoculations to prevent disease recurrence in high-risk breast cancer patients. Ann Oncol 2014; 25(9): 1735 – 1742. doi: 10.1093/ annonc/ mdu211.
29. Tiriveedhi V, Tucker N, Herndon J et al. Safety and preliminary evidence of biologic efficacy of a mammaglobin-a DNA vaccine in patients with stable metastatic breast cancer. Clin Cancer Res 2014; 20(23): 5964 – 5975. doi: 10.1158/ 1078-0432.CCR-14-0059.
30. Morita S, Oka Y, Tsuboi A et al. A phase I/ II trial of a WT1 (Wilms’ tumor gene) peptide vaccine in patients with solid malignancy: safety assessment based on the phase I data. Jpn J Clin Oncol 2006; 36(4): 231 – 236.
31. Suntharalingam G, Perry MR, Ward S et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med 2006; 355(10): 1018 – 1028.
32. Yu H, Yang J, Jiao S et al. Cytotoxic T lymphocyte antigen 4expression in human breast cancer: implications for prognosis. Cancer Immunol Immunother 2015; 64(7): 853 – 860.
33. Diab A, McArthur HL, Solomon SB et al. A pilot study of preoperative (Pre-op), single-dose ipilimumab (Ipi) and/ or cryoablation (Cryo) in women (pts) with early-stage/ resectable breast cancer (ESBC). J Clin Oncol 2014; 32 (Suppl): 5S (abstr. 1098).
34. Vonderheide RH, LoRusso PM, Khalil M et al. Tremelimumab in combination with exemestane in patients with advanced breast cancer and treatment-associated modulation of inducible costimulator expression on patient T cells. Clin Cancer Res 2010; 16(13): 3485 – 3494. doi: 10.1158/ 1078-0432.CCR-10-0505.
35. Moreno BH, Ribas A. Anti-programmed cell death protein-1/ ligand-1 therapy in different cancers. Br J Cancer 2015; 112(9): 1421 – 1427. doi: 10.1038/ bjc.2015.124.
36. Matsumoto H, Koo SL, Dent R et al. Role of inflammatory infiltrates in triple negative breast cancer. J Clin Pathol 2015; 68(7): 506 – 510. doi: 10.1136/ jclinpath-2015-202944.
37. ClinicalTrials.gov. Safety study of nivolumab with nab-paclitaxel plus or minus gemcitabine in pancreatic cancer, nab-paclitaxel/ carboplatin in stage IIIB/ IV non-small cell lung cancer or nab-paclitaxel in recurrent metastatic breast cancer. [online]. Available from: https:/ / www.clinicaltrials.gov/ ct2/ results?term=NCT02309177.
38. ClinicalTrials.gov. Entinostat, nivolumab, and ipilimumab in treating patients with solid tumors that are metastatic or cannot be removed by surgery or locally advanced or metastatic HER2-negative breast cancer. [online]. Available from: https:/ / www.clinicaltrials.gov/ ct2/ results?term=NCT02453620.
39. ClinicalTrials.gov. Nivolumab after induction treatment in triple-negative breast cancer (TNBC) patients (TONIC). [online]. Available from: https:/ / www.clinicaltrials.gov/ ct2/ results?term=NCT02499367.
40. Nanda R, Chow LQ, Dees EC et al. A phase Ib study of pembrolizumab (MK-3475) in patients with advanced triple-negative breast cancer (abstract). In: Proceedings of the Thirty-Seventh Annual CTRC-AACR San Antonio Breast Cancer Symposium: 2014 Dec 9 – 13; San Antonio, TX. Philadelphia (PA): AACR; Cancer Res 2015; 75 (Suppl 9): abstr. S1-09.
41. ClinicalTrials.gov. Neoadjuvant trial of nab-paclitaxel and MPDL3280A. [online]. Available from: https:/ / www.clinicaltrials.gov/ ct2/ results?term=NCT02499367NCT02530489.
42. Brignone C, Gutierrez M, Mefti F et al. First-line chemoimmunotherapy in metastatic breast carcinoma: combination of paclitaxel and IMP321 (LAG-3Ig) enhances immune responses and antitumor activity. J Transl Med 2010; 8 : 71. doi: 10.1186/ 1479-5876-8-71.
43. Emens LA, Asquith JM, Leatherman JM et al. Timed sequential treatment with cyclophosphamide, doxorubicin, and an allogeneic granulocyte-macrophage colony-stimulating factor-secreting breast tumor vaccine: a chemotherapy dose-ranging factorial study of safety and immune activation. J Clin Oncol 2009; 27(35): 5911 – 5918. doi: 10.1200/ JCO.2009.23.3494.
44. Natsume A, Niwa R, Satoh M. Improving effector functions of antibodies for cancer treatment: enhancing ADCC and CDC. Drug Des Devel Ther 2009; 3 : 7 – 16.
45. Grell P, Svoboda M, Simícková M et al. Trastuzumab in the breast cancer treatment: efficacy and resistance mechanisms. Klin Onkol 2009; 22(2): 45 – 51.
46. Verma S, Miles D, Gianni L et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012; 367(19): 1783 – 1791. doi: 10.1056/ NEJMoa1209124.
47. Tsang R, Finn R. Beyond trastuzumab: novel therapeutic strategies in HER2-positive metastatic breast cancer. Br J Cancer 2012; 106(1): 6 – 13. doi: 10.1038/ bjc.2011.516.
48. Capelan M, Pugliano L, De Azambuja E et al. Pertuzumab: new hope for patients with HER2-positive breast cancer. Ann Oncol 2013; 24(2): 273 – 282. doi: 10.1093/ annonc/ mds328.
49. Scheuer W, Friess T, Burtscher H et al. Strongly enhanced antitumor activity of trastuzumab and pertuzumab combination treatment on HER2-positive human xenograft tumor models. Cancer Res 2009; 69(24): 9330 – 9336. doi: 10.1158/ 0008-5472.CAN-08-4597.
50. Diermeier-Daucher S, Ortmann O, Buchholz S et al. Trifunctional antibody ertumaxomab: non-immunological effects on Her2 receptor activity and downstream signaling. MAbs 2012; 4(5): 614 – 622. doi: 10.4161/ mabs.21003.
51. Haense N, Pauligk C, Marme F et al. Interim analysis of a phase I/ II open label, dose-escalating study to investigate safety, tolerability, and preliminary efficacy of the trifunctional anti-HER2/ neu x anti-CD3 antibody ertumaxomab in patients with HER2/ neu expressing solid tumors progressing after standard therapy. J Clin Oncol 2014; 32 (Suppl): 5S (abstr. 3055).
52. Soukup K, Wang X. Radiation meets immunotherapy – a perfect match in the era of combination therapy? Int J Radiat Biol 2015; 91(4): 299 – 305. doi: 10.3109/ 09553002.2014.995383.
53. Navrátil J, Fabian P, Palácová M et al. Triple negativní karcinom prsu. Klin Onkol 2015; 28(6): 405 – 415. doi: 10.14735/ amko2015405.
54. Dieci MV, Mathieu MC, Guarneri V et al. Prognostic and predictive value of tumor-infiltrating lymphocytes in two phase III randomized adjuvant breast cancer trials. Ann Oncol 2015; 26(8): 1698 – 1704. doi: 10.1093/ annonc/ mdv239.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2015 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Triple negativní karcinom prsu
- Imunoterapie v prevenci a léčbě karcinomu prsu
- Psychologické aspekty nitrožilní léčby v onkologii a tolerance dlouhodobých žilních vstupů
- Případ pozdně diagnostikovaného akrolentiginózního melanomu
- Možná úskalí léčby ipilimumabem u maligního melanomu – kazuistika
- Thiazolidindiony ovlivňují úroveň exprese ABC transportérů na buňkách karcinomu plic
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Případ pozdně diagnostikovaného akrolentiginózního melanomu
- Triple negativní karcinom prsu
- Imunoterapie v prevenci a léčbě karcinomu prsu
- Psychologické aspekty nitrožilní léčby v onkologii a tolerance dlouhodobých žilních vstupů
