Možná úskalí léčby ipilimumabem u maligního melanomu – kazuistika
Possible Pitfalls of Ipilimumab Therapy in Malignant Melanoma – a Case Report
Background:
Metastatic melanoma is a malignancy with one of the highest mortality rates. However, with the introduction of new drugs during the last decade, the prognosis of patients began to improve. Ipilimumab is one of the first so ‑ called modern drugs in melanoma treatment. The therapy is often complicated by adverse effects which are referred as immune‑related adverse events due to its mechanism of action.
Case:
We present a case of 68‑year ‑ old women with metastatic melanoma who underwent treatment with ipilimumab. The patient encountered several adverse events during the treatment. Some of them are quite common (e.g. skin affections), others (e.g. endocrinopathies) are less frequent.
Conclusion:
This case study highlights the need for close observation not only during the actual treatment with ipilimumab, but also several weeks or months after the last dose. This case study also demonstrates further need of education of doctors who do not usually come in to contact with such patients.
Key word:
melanoma – ipilimumab – hypohysitis – CTLA-4
The work was realized with the support PRVOUK 37/06.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
30. 8. 2015
Accepted:
20. 9. 2015
Authors:
J. Kopecký 1; O. Kubeček 1; F. Gabalec 2; P. Hoffmann 3; I. Svilias 2
Authors‘ workplace:
Klinika onkologie a radioterapie LF UK a FN Hradec Králové
1; Endokrinologie, IV. interní hematologická klinika LF UK a FN Hradec Králové
2; Radiologická klinika LF UK a FN Hradec Králové
3
Published in:
Klin Onkol 2015; 28(6): 444-449
Category:
Case Reports
doi:
https://doi.org/10.14735/amko2015444
Overview
Východiska:
Metastazující maligní melanom patří mezi nádory s nejvyšší mortalitou. V poslední dekádě se však prognóza pacientů zlepšila díky zavedení nových léků. Jedním z prvních tzv. moderních léků byl i ipilimumab. Vzhledem k mechanizmu účinku ipilimumabu je však jeho léčba provázena typickými nežádoucími účinky, které jsou souhrnně označovány jako imunitně podmíněné nežádoucí účinky.
Případ:
Předkládáme popis případu 68leté pacientky s metastatickým maligním melanomem, která podstoupila léčbu ipilimumabem. V průběhu léčby se u pacientky vyskytly různé formy nežádoucích účinků od velice častých, jako např. kožní postižení, až po méně časté jako endokrinopatie.
Závěr:
Tato kazuistika poukazuje na nutnou obezřetnost při léčbě ipilimumabem nejen v průběhu samotné léčby, ale i několik týdnů či měsíců po samotném skončení. Tato kazuistika dále dokládá přetrvávající nutnost edukace širšího spektra lékařů, kteří nepřicházejí ve své praxi běžně do kontaktu s takto léčenými pacienty.
Klíčová slova:
melanom – ipilimumab – hypofyzitida – CTLA-4
Úvod
Maligní melanom patří mezi nejzhoubnější nádory a navzdory všem preventivním programům jeho incidence nadále stoupá. Ačkoli mortalita zůstává v čase víceméně konstantní, patří generalizované onemocnění mezi nádory s nejvyšší mortalitou s omezenými terapeutickými možnostmi.
Do roku 2011 byla v ČR k dispozici pro léčbu metastatického nebo inoperabilního onemocnění pouze chemoterapie, kdy zlatým standardem byla aplikace dakarbazinu. V nedávné době však došlo k zavedení nových léčebných možností. Jedním z prvních tzv. moderních léků byl ipilimumab, který má registraci v ČR od července 2011.
Ipilimumab je plně humánní IgG1 monoklonální protilátka namířená proti CTLA - 4 (antigenu 4 aktivovaných cytotoxických T lymfocytů). Jeho působením je zabráněno časné inhibici aktivace cytotoxických T lymfocytů, která za normálních podmínek (v nepřítomnosti ipilimumabu) usnadňuje nádorovým buňkám uniknout protinádorové aktivitě imunitního systému [1]. Ipilimumab prokázal v rámci klinických studií zlepšení parametru celkového přežití a v dlouhodobém sledování i dosažení kompletních trvalých remisí [2,3].
V ČR byl ipilimumab až do nedávné doby (srpen 2015) indikován v monoterapii k léčbě pokročilého melanomu (neresekovatelného – stadia III nebo metastatického – stadia IV) u pacientů, kteří podstoupili alespoň jednu předchozí linii léčby, a to ze skupiny chemoterapeutik nebo cytokinů schválených v této indikaci.
Vzhledem k mechanizmu účinku, kdy dochází k pro-lomení tolerancevůči nádoru, může dojít i k nežádoucímu prolomení tolerance vůči vlastním tkáním. Toto může vést k nežádoucím účinkům, které se svým charakterem blíží autoimunitním onemocněním a jsou souhrnně označovány jako tzv. imunitně podmíněné nežádoucí účinky (immune related adverse events ir ‑ AEs). Mezi nejčastější ir ‑ AEs v souvislosti s léčbou ipilimumabem patří kožní toxicita (vyrážka, svědění) a autoimunitně podmíněná kolitida. Tato kazuistika popisuje škálu možných nežádoucích účinků u jedné pacientky v průběhu léčby ipilimumabem.
Kazuistika
Žena, 68 let, s nodulárním maligním melanomem stadia IIIB podstoupila radikální odstranění primárního ložiska na levé patě v dubnu 2013. Vzhledem k pozitivitě sentinelové uzliny byla v červenci 2013 rovněž provedena exenterace levého třísla. Následovala adjuvantní léčba interferonem alfa‑2a (Roferon ‑ A, Roche) v klasickém vysokodávkovaném režimu. Vzhledem k horší toleranci byla udržovací dávka redukována z 9 MIU na 6 MIU. V průběhu udržovací fáze adjuvantní léčby došlo po třech měsících podávání k lokální recidivě v levém třísle. Pacientka prodělala v lednu 2014 opakovanou exenteraci třísla s nálezem jedné pozitivní uzliny histologicky odpovídající původnímu typu maligního melanomu. V rámci pravidelných kontrol byla v červnu 2014 pro další lokální recidivu provedena znovu operace levého třísla. Histologicky se nyní jednalo o odlišný typ nádoru – amelanotický dezmoplastický maligní melanom.
Vzhledem k nejistotě ohledně radikality výkonu, časnosti recidivy, ale i nejistému plicnímu nálezu dle CT vyšetření byla v rámci mezioborového semináře indikována k chemoterapii dakarbazinem ve vysokodávkovaném režimu (1 200 mg/ m2). Tato chemoterapie byla pacientkou velice špatně snášena (celotělový exantém, svědění kůže a gastrointestinální potíže kolikovitého charakteru). Z tohoto důvodu byla po prvním cyklu chemoterapie (září 2014) s ohledem na kontrolní PET/ CT vyšetření z listopadu 2014 (non‑avidní stacionární ložiska plic spíše pozánětlivého charakteru) a přání pacientky dále jen sledována. Dle kontrolního CT vyšetření v únoru 2015 však došlo k nárůstu velikosti i počtu ložiskového postižení (obr. 1–3). Vzhledem k absenci mutace BRAF genu a z toho plynoucí nemožnosti využití BRAF inhibitorů bylo rozhodnuto o zahájení paliativní imunoterapie ipilimumabem čtyři dávky 3 mg/ kg à 21 dní.
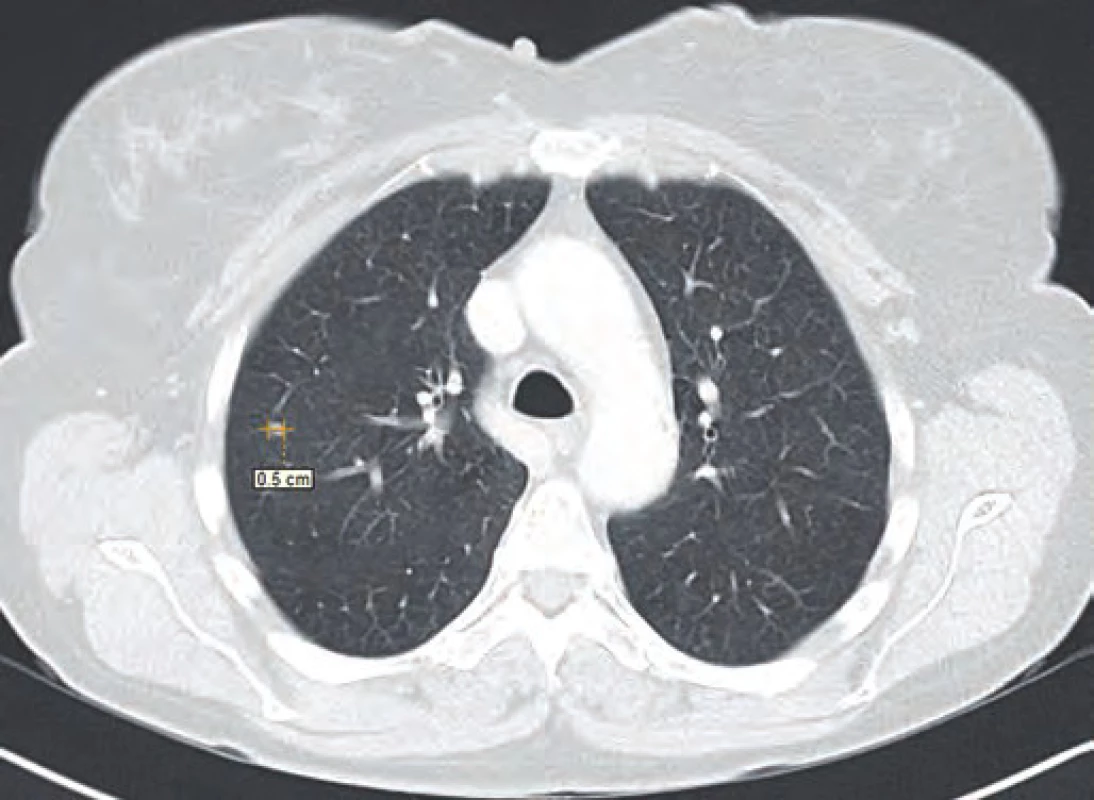
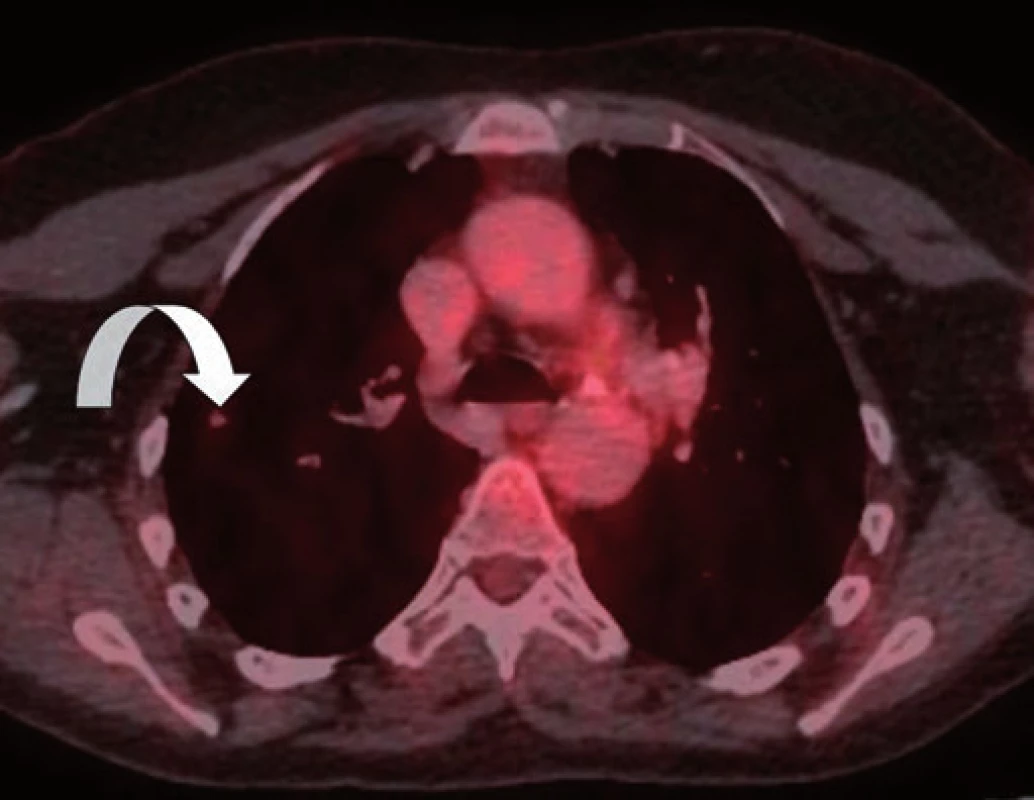
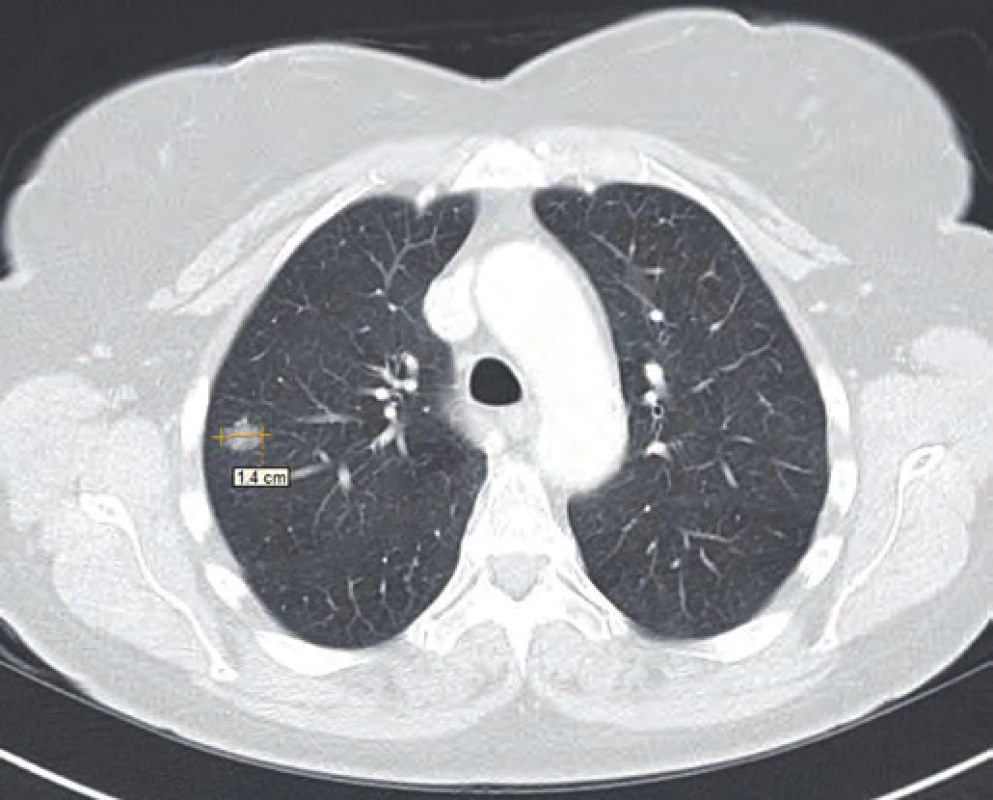
Z anamnestických údajů se pacientka do doby léčby maligního melanomu léčila s arteriální hypertenzí (v medikaci kombinovaný preparát losartan/ hydrochlorthiazid), prodělala operaci dělohy pro myomy a v dětství se léčila pro blíže nespecifikovanou hypotyreózu, kdy užívala tyroxin. Vzhledem k vysoké rodinné zátěži aterosklerózy a jejích komplikací užívala dlouhodobě kyselinu acetylsalicylovou.
Léčba ipilimumabem byla zpočátku snášena velice dobře, bez známek nežádoucích účinků, až na mírný stupeň makulo ‑ papulózního exantému zvladatelného antihistaminiky. V rámci pravidelné kontroly hormonů štítné žlázy byla zaznamenána tendence poklesu TSH mezi druhým a třetím cyklem, avšak s doposud fyziologickými hodnotami volného T3 a T4 (graf 1). Po čtvrté dávce ipilimumabu (duben 2015) byla pacientka referována spádovému endokrinologovi, který doporučil léčbu thiamazolem jedna tableta třikrát týdně pro subklinickou hypertyreózu.

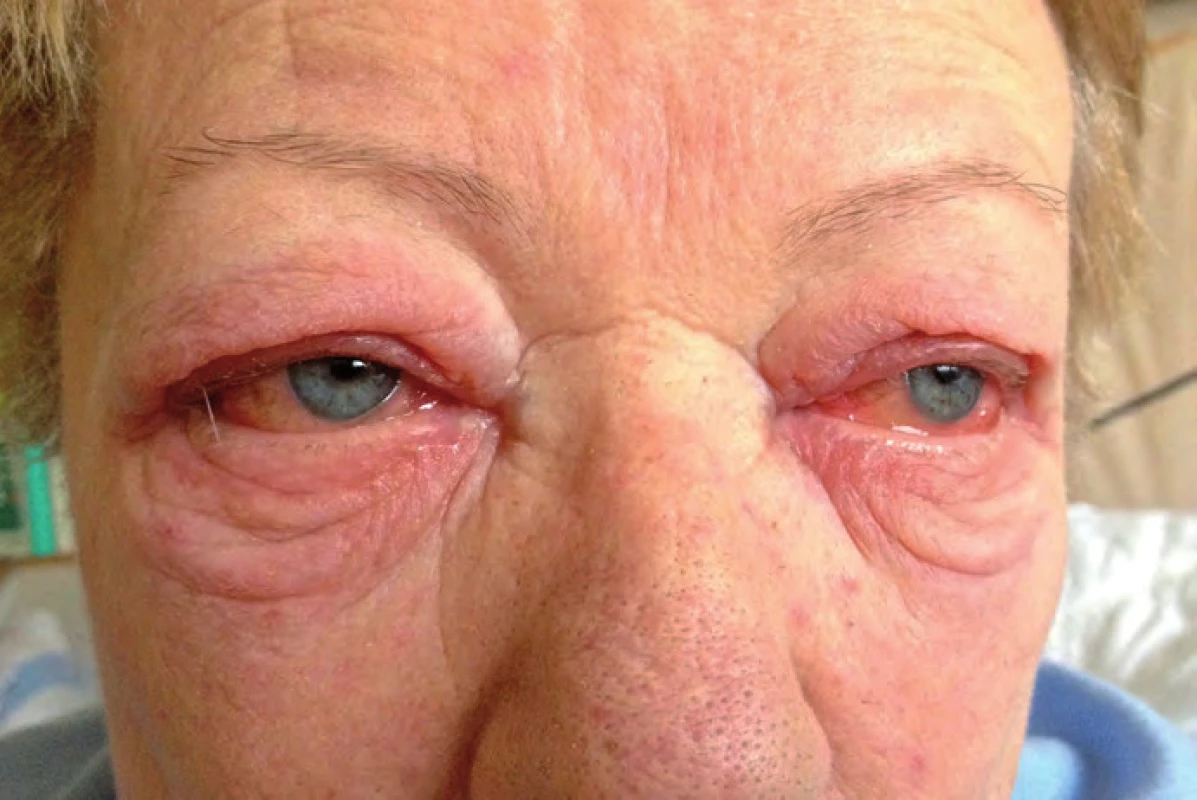
Tři měsíce od zahájení léčby ipilimumabem byla pacientka neplánovaně hospitalizována pro zhoršení stavu. V popředí obtíží dominovala nauzea a zvracení až čtyřikrát za den. Dále pacientka udávala bolesti hlavy, malátnost, slabost, motání hlavy a pocit nestability. Z klinického nálezu při přijetí byla zjištěna arteriální hypotenze 90/ 40 mm Hg (pacientce byla dva týdny před přijetím praktickým lékařem vysazena antihypertenziva), zarudlé oční spojivky oboustranně (obr. 4), výrazný otok víček (anamnesticky vznik dva dny před přijetím), stacionární lymfedém levé dolní končetiny (ultrazvukovým vyšetřením vyloučena žilní trombóza), klidná jizva bez hmatné rezistence v levém třísle a mírný makulo ‑ papulózní exantém horní části trupu a částečně i končetin. Ten se objevil již po druhé dávce ipilimumabu a jeho intenzita byla max. 1. stupně dle CTCAE v4.0.
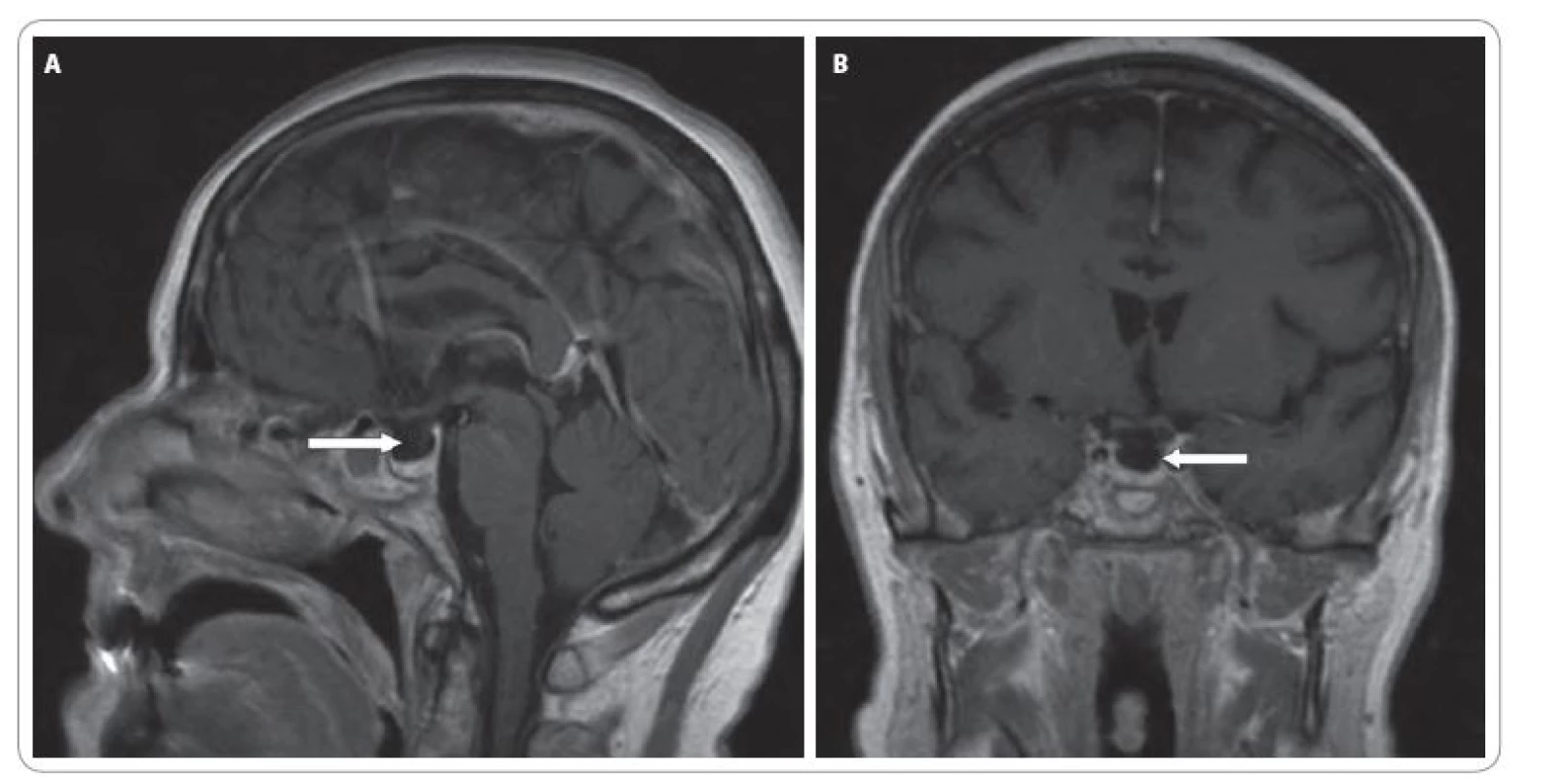
Vstupně bylo provedeno CT mozku, které vyloučilo diseminaci základního onemocnění do CNS. Další vyšetření vyloučila možnost plicní embolie (klinické vyšetření + EKG) či náhlé příhody břišní (klinické + RTG vyšetření). V rámci diferenciální diagnostiky byla provedena laboratorní vyšetření k vyloučení endokrinopatií při léčbě ipilimumabem (hormony štítné žlázy, protilátky proti tyrodiální peroxidáze (antiTPO), proti tyreoglobulinu (antiTG) a receptoru pro TSH (TRAK), sérového kortizolu, hladiny adrenokortikotropinu (ACTH), folikulů stimulačního hormonu (FSH), luteinizačního hormonu (LH) a prolaktinu). Dominantním nálezem byla sekundární adrenální insuficience (nedetekovatelná hladina sérového kortizolu, neadekvátně nízké ACTH 12,7 ng/ l), hyponatremie. Rovněž hladina gonadotropinů (LH 12,5 U/ l, FSH 19,5 U/ l) byla neadekvátně nízká pro daný věk a menopauzu. V rámci klinického obrazu bylo pomýšleno na hypofyzitidu s hypopitutarizmem. Na MRI mozku byl však nález v oblasti hypofýzy negativní. Byla zaznamenána jen nespecifická drobná ložiska supratentoriálně v bílé hmotě mozkové (obr. 5A, B). AntiTPO, antiTG a TRAK byly negativní. Dle UZ vyšetření štítné žlázy byla přítomna multinodózní struma a laboratorně nízké TSH (0,11 mU/ l) a normální volné hormony (fT3 : 7,8 pmol/ l, fT4 : 16,5 pmol/ l). Z medikace byl vysazen thiamazol a zahájena imunosuprese kortikoidy v úvodu v dávce 50 mg/ den. Vzhledem k současné konjunktivitidě bylo za hospitalizace doplněno vyšetření oftalmologem a dle doporučení zahájena lokální terapie (Tobradex kapky + Maxitrol mast).
Při substituční terapii prednisolonem, infuzní a antiemetické terapii došlo k ústupu dyspeptických obtíží, úpravě krevního tlaku (s nutností opětovného nasazení antihypertenziv) a zlepšení celkového stavu. Došlo i k vymizení kožního exantému a odeznění oboustranné konjunktivitidy. Postupně byla snižována dávka prednisolonu až na trvalou substituční dávku 5 mg/ den za současné gastroprotekce inhibitorem protonové pumpy. Pacientka byla propuštěna z nemocnice v normalizovaném stavu po 16 dnech hospitalizace.
Diskuze
Při léčbě ipilimumabem se nejčastěji objevují nežádoucí účinky zapříčiněné zvýšenou až excesivní imunitní alterací (irAEs). Časné zahájení imunosupresivní léčby kortikosteroidy v případě vyššího stupně toxicity je zásadním krokem ke zvládnutí příhody, snížení morbidity a případně i mortality. Pokud je současně přítomna adrenální insuficience, představuje podávání kortikosteroidů i prostředek substituce a prevenci rozvoje potenciálně fatální Addisonské krize. Při nedostatečném efektu kortikoidů je možné léčbu posílit o imunosupresiva jako infliximab nebo mykofenolát mofetil. Bližší algoritmy a postupy zvládání jednotlivých nežádoucích účinků byly již v literatuře dostatečně popsány [4,5].
Nejčastějším ir ‑ AEs bývá stejně jako v našem případě postižení kůže (svědění, vyrážka), které se obvykle vyskytuje po 3. týdnu léčby s vrcholem v 6. týdnu [4]. Obvyklým projevem jsou makulo ‑ papulózní exantém (20 %) a/ nebo svědění kůže (25 %). Pokud se nejedná o stupeň toxicity 3 a více, jsou projevy obvykle zvladatelné systémovým podáváním antihistaminik, v případě protrahovaných obtíží také kortikoidy.
Méně častými, avšak o to závažnějšími nežádoucími účinky ipilimumabu jsou endokrinopatie (hypofyzitida, nedostatečnost nadledvin a autoimunitní hypo ‑ či hypertyreóza). Jejich záludnost spočívá v pozdním nástupu (7 – 8 týdnů po zahájení léčby s ipilimumabem, nejvyšší výskyt mezi 12. a 24. týdnem) [4]. Tyto endokrinopatie mají širokou škálu projevů a mohou imitovat řadu jiných onemocnění. Je potřeba na ně myslet i po skončení léčby ipilimumabem.
Literárně je zdokumentován i nežádoucí účinek ipilimumabu v podobě panhypopituarizmu v důsledku postižení hypofýzy [6]. V rámci experimentálního výzkumu na myších modelech byla zjištěna exprese receptoru CTLA-4 i v oblasti hypofýzy, což může být příčinou vzniku hypofyzitidy při léčbě ipilimumabem [7].
Podání tyreostatika na základě nízkých hladin TSH v domnění subklinické hypertyreózy může v případě hypofyzitidy vést v krajním případě až k myxedémovému kómatu. Diagnostika těchto dvou odlišných stavů je založena na znalosti klinického stavu pacienta a laboratorních hodnotách (fT3, fT4, TSH).
Centrální hypotyreóza při hypofyzitidě je definována sníženou hladinou TSH spolu s nízkou hladinou fT4. Léčba spočívá v substituční léčbě tyroxinem.
Základním diagnostickým rysem subklinické hypertyreózy je suprese TSH při doposud nezvýšené hladině tyreoidálních hormonů (jak celkových, tak volných frakcí tyroxinu a trijodotyroninu). Všeobecně ve skupině osob s TSH 0,1 – 0,45 mU/ l není rutinní léčba doporučena, pro 2,5 % zdravé populace jde o normu. Pouhá dispenzarizace je též doporučována po subakutních tyreoiditidách, kdy lze očekávat spontánní normalizaci TSH a možný posun k subklinické hypofunkci, který by byl terapií tyreostatiky zbytečně urychlen a zvýrazněn. Léčba by měla být zvážena u osob s TSH pod 0,1 mU/ l, a to hlavně po 60. roce věku [8]. Subklinické hypertyreózy jsou léčeny tyreostatiky nebo podáním radiojódu. Všechny výše uvedené stavy musí být dispenzarizovány a individuálně posuzovány.
Ačkoliv jsme nebyli schopni graficky potvrdit hypofyzitidu, klinické příznaky a laboratorní výsledky tomuto nálezu nasvědčovaly. Ukazuje se, že MRI nález může být až u 50 % nemocných s klinickými příznaky hypofyzitidy negativní [9,10]. V našem případě zůstává etiologie nízkého TSH sporná. Nejvýrazněji byla postižena kortikální osa. V rámci diferenciální diagnostiky hypokortikalizmu je nutné vzhledem ke škále projevů (anorexie, nauzea, zvracení, průjem, bolesti břicha, závratě, slabost, únava apod.) vyloučit i jiné možné příčiny, jako např. náhlou příhodu břišní. Hlavním opatřením při zjištění imunitně podmíněné endokrinopatie je včasné nasazení kortikoidů, při kterém se stav rychle upravuje ad integrum. A v případě hypopituarizmu i hormonální substituční terapie.
Na rozdíl od ostatních nežádoucích účinků ipilimumabu se jedná ve většině případů o trvalý následek léčby vyžadující následně dlouhodobou, někdy i doživotní hormonální substituci.
V průběhu léčby ipilimumabem musí být zvýšená opatrnost i vůči méně častým nežádoucím účinkům. Vzhledem k mechanizmu účinku může být postižen v podstatě jakýkoliv orgán lidského těla. Jednou z méně častých, avšak subjektivně velice nepříjemných komplikací je oční postižení. Nejčastěji se jedná o episkleritidu a uveitidu s incidencí < 1 %, která vzniká přibližně dva měsíce od započetí léčby [4]. Oční postižení může mít rozličné příznaky od zarudnutí, bolesti a pálení až k fotofobii a otokům. Postup zvládnutí této toxicity se odvíjí jako v případě jiných nežádoucích účinků od stupně postižení. Podobně jako v případě jiných nežádoucích účinků je vhodné mít v týmu oftalmologa obeznámeného s toxickým profilem léčby ipilimumabem.
Závěr
Většina imunitně podmíněných nežádoucích účinků se objevuje již během indukčního období. Mohou se však projevit i v několika měsíčním odstupu od ukončení léčby, a na tuto souvislost je proto nutné myslet. I přesto, že máme k dispozici již propracované algoritmy zvládání nežádoucích účinků, je nutné provádět neustálou osvětu zvládání nežádoucích účinků i pro lékaře, kteří se nezabývají přímo léčbou maligního melanomu.
Práce byla realizována za podpory PRVOUK 37/06.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jindřich Kopecký
Klinika onkologie a radioterapie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: kopecjin@fnhk.cz
Obdrženo: 30. 8. 2015
Přijato: 20. 9. 2015
Sources
1. Peggs KS, Quezada SA, Korman AJ et al. Principles and use of anti‑CTLA4 antibody in human cancer immunotherapy. Curr Opin Immunol 2006; 18(2): 206 – 213.
2. Hodi FS, O‘Day SJ, McDermott DF et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363(8): 711 – 723. doi: 10.1056/ NEJMoa1003466.
3. Robert C, Thomas L, Bondarenko I et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011; 364(26): 2517 – 2526. doi: 10.1056/ NEJMoa1104621.
4. Weber JS, Kahler KC, Hauschild A. Management of immune‑related adverse events and kinetics of response with ipilimumab. J Clin Oncol 2012; 30(21): 2691 – 2697. doi: 10.1200/ JCO.2012.41.6750.
5. Kopecký J, Kubeček O, Trojanová P et al. Nežádoucí účinky novodobé léčby maligního melanomu a jejich léčba/ management. Klin Onkol 2014; 27(6): 393 – 400. doi: 10.14735/ amko2014393.
6. Araujo PB, Coelho MC, Arruda M et al. Ipilimumab induced hypophysitis: review of the literature. J Endocrinol Invest 2015; 38(11): 1159 – 1166. doi: 10.1007/ s40618 ‑ 015 ‑ 0301 ‑ z.
7. Iwama S, De Remigis A, Callahan MK et al. Pituitary expression of CTLA ‑ 4 mediates hypophysitis secondary to administration of CTLA ‑ 4 blocking antipody. Sci Transl Med 2014; 6(230): 230 – 245. doi: 10.1126/ scitranslmed.3008002.
8. Drbalová K, Vodák M, Zamrazil V. Subklinické tyreopatie. Med Praxi 2012; 9(4):163 – 166.
9. Min L, Vaidya A, Becker C. Association of ipilimumab therapy for advanced melanoma with secondary adrenal insufficiency: a case series. Endocr Pract 2012; 18(3): 351 – 355. doi: 10.4158/ EP11273.OR.
10. Lam T, Chan MM, Sweeting AN et al. Ipilimumab induced hypophysitis in melanoma patients: an Australian case series. Intern Med J 2015; 45(10): 1066 – 1073. doi: 10.1111/ imj.12819.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2015 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Triple negativní karcinom prsu
- Imunoterapie v prevenci a léčbě karcinomu prsu
- Psychologické aspekty nitrožilní léčby v onkologii a tolerance dlouhodobých žilních vstupů
- Případ pozdně diagnostikovaného akrolentiginózního melanomu
- Možná úskalí léčby ipilimumabem u maligního melanomu – kazuistika
- Thiazolidindiony ovlivňují úroveň exprese ABC transportérů na buňkách karcinomu plic
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Případ pozdně diagnostikovaného akrolentiginózního melanomu
- Triple negativní karcinom prsu
- Imunoterapie v prevenci a léčbě karcinomu prsu
- Psychologické aspekty nitrožilní léčby v onkologii a tolerance dlouhodobých žilních vstupů
