Genomové testy jako prediktory prognózy pacientek s karcinomem prsu
Genomic Tests as Predictors of Breast Cancer Patients’ Prognosis
Hormonal dependent breast cancer is a heterogeneous disease from a molecular and clinical perspective. The relapse risk of early breast cancer patients treated with adjuvant hormonal therapy varies. Validated predictive markers concerning adjuvant cytotoxic treatment are still lacking in ER+/ HER2 – breast cancer, which has a good prognosis in general. This can lead to the inefficient chemotherapy indication. Molecular classification of breast cancer reports evidence about the heterogeneity of hormonal dependent breast cancer and its stratification to different groups with different characteristics. Multigene assays work on the molecular level, and their aim is to provide patients’ risk stratification and therapy efficacy prediction. The position of multigene assays in clinical practice is not stabile yet. Non ‑ uniform level of evidence connected to patients’ prognosis interpretations and difficult comparison of tests are the key problems, which prevent their wide clinical use. The article is a summary of some of the most important multigene assays in breast cancer and their current position in oncology practice.
Key words:
breast cancer – adjuvant therapy – molecular classification – multigene assays – risk of recurrence – prognosis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
5. 4. 2015
Accepted:
21. 5. 2015
Authors:
Z. Bielčiková
; L. Petruželka
Authors‘ workplace:
Onkologická klinika 1. LF UK a VFN v Praze
Published in:
Klin Onkol 2016; 29(1): 13-19
Category:
Review
doi:
https://doi.org/10.14735/amko201613
Overview
Hormonálně dependentní karcinom prsu je heterogenní onemocnění z pohledu molekulárního i klinického. Riziko relapsu časného karcinomu prsu léčeného adjuvantní hormonální terapií kolísá. Prediktivní markery pro volbu chemoterapie u nádoru s obecně příznivou prognózou s pozitivitou estrogenových receptorů (ER+) a bez exprese receptoru 2 pro lidský epidermální růstový faktor (HER2–) jsou nedostatečné a vedou k její indikaci taky tam, kde nemůže mít efekt. To dokládá i molekulární klasifikace primárního nádoru, která ukazuje, že hormonálně dependentní karcinom prsu není uniformní entitou, ale skupinou nádorů s odlišnými vlastnostmi, které vyžadují individuální přístup v indikaci adjuvantní terapie. Multigenové testy charakterizují tumor na molekulární úrovni na podkladě seskupovacích (klastrových) analýz expresních profilů genů pro jednotlivé subtypy karcinomu prsu. Jejich cílem je stratifikace pacientek podle rizika relapsu nemoci a predikce účinnosti léčby. V tomto ohledu není pozice většiny multigenových testů v klinické praxi zatím stabilní. Širokému užití multigenových testů brání zejména nejednotná úroveň průkaznosti analýz spojených s prognózou nemocných a obtížné srovnání testů. Článek je přehledem několika nejdůležitějších multigenových testů u karcinomu prsu a jejich stávající pozice v onkologické praxi.
Klíčová slova:
karcinom prsu – adjuvantní terapie – molekulární klasifikace – multigenové testy – riziko relapsu – prognóza
Úvod
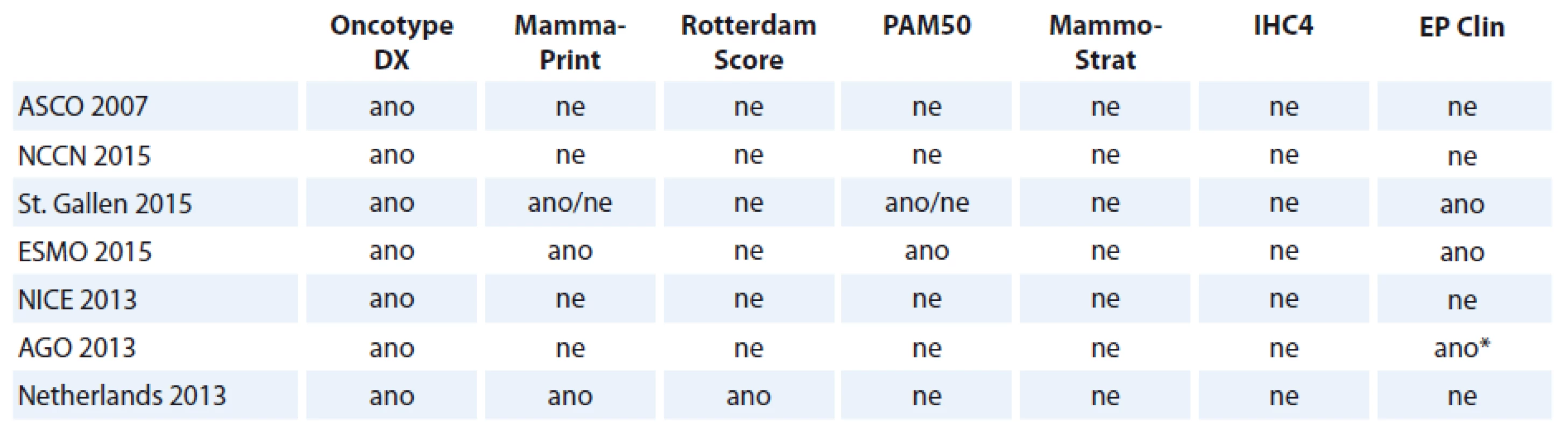
Karcinom prsu je biologicky heterogenní onemocnění odrážející se v jeho odpovědi na léčbu [1]. Ročně je diagnostikováno v ČR asi 7 000 nových případů tohoto onemocnění, nejpočetnější jsou hormonálně dependentní karcinomy. Tradičně se ve volbě adjuvantní terapie uplatňují histopatologické vlastnosti nádoru – velikost tumoru, postižení uzlin, stupeň diferenciace nádorových buněk (grade), jejich proliferační aktivita (Ki-67) a stupeň exprese estrogenového receptoru (ER), progesteronového receptoru (PR) a receptoru 2 pro lidský epidermální růstový faktor (HER2) a klinické informace o nemocných pacientkách (zejména věk, výkonnostní stav, menoaktivita) [2]. Reproducibilita některých histologických nálezů může být obtížná, a nemusí tak odrážet skutečné vlastnosti nádoru [3]. Například vyšetření gradu je zatíženo subjektivním vjemem a analytickou hodnotu Ki-67 negativně ovlivňují diskordantní výsledky napříč různými laboratořemi [4]. Molekulární klasifikace primárního tumoru vychází z genové exprese [5]. Terminologie molekulárních podtypů karcinomu prsu byla přijata odborníky na kongresu v St. Gallen v roce 2011 [6] a postupně byla zahrnuta do guidelines všech mezinárodních diagnostických a léčebných doporučení (St. Gallen, ASCO, ESMO, NCCN a další). Podle analýz genové exprese dělíme karcinom prsu na 4 – 6 základních typů [7 – 9]. V klinické praxi pracujeme se čtyřmi typy: luminální A, luminální B, HER2 pozitivní a bazální typ. Nejlepší prognózu mají karcinomy luminálního typu A, které obvykle vykazují nízký grade a jen zřídka nesou mutaci tumor supresorového genu TP53. Tvoří asi 40 % případů a jsou ER+ a/ nebo PR+, HER2 – a mají nízké Ki-67. Luminální typ B je na první pohled velmi podobný typu A (ER+ a/ nebo PR+), na jeho horší prognóze se může podílet jeden či více z uvedených faktorů: vyšší proliferační aktivita nádorových buněk, nižší stupeň diferenciace, mutace TP53 či HER2 pozitivita. Odlišení luminálních podtypů je stěžejní pro správné vedení léčebné strategie. Správná indikace adjuvantní chemoterapie pro rizikového pacienta dokáže snížit mortalitu spojenou s nádorem až o 38 % a její kombinace s hormonální léčbou může v následujících 15 letech snížit toto riziko až o polovinu [10]. Naopak pro nízce rizikovou skupinu nemocných představuje zbytečnou zátěž, která jim nepřináší další benefit. V posledních 10 letech bylo vyvinuto několik multigenových testů (multigene assay – MGA), které poskytují další prognostickou informaci a pomáhají stratifikovat nemocné podle rizika recidivy onemocnění. Správná identifikace luminálního typu B je identifikací pacientek s horší prognózou, které budou pravděpodobně profitovat z adjuvantní chemoterapie. Dalším cílem MGA je určení optimálního léčebného režimu.
Multigenové testy
Jedná se o genové testy, které mají za cíl odlišení nízce a vysoce rizikového karcinomu prsu na molekulární úrovni. Genová exprese je aktivita genů, která je určená počtem přepisů deoxyribonukleové kyseliny (DNA) do mediátorové ribonukleové kyseliny (mRNA) a do proteinů, které kódují. K analýze genové exprese se používají dvě hlavní metody: DNA microarray technologie k vyšetření zejména čerstvé nebo mražené nádorové tkáně a real ‑ time kvantitativní polymerázová řetězová reakce (qRT‑PCR). qRT‑PCR umožňuje testovat také RNA z tkáně fixované v parafinu (formaline ‑ fixed parafin embedded – FFPE). Genově‑expresní profil nádorové buňky může charakterizovat její citlivost na léčbu a indikovat prognózu. Na rozdíl od imunohistochemie, která pracuje na proteinové úrovni (např. ER, PR, HER2), qRT‑PCR a DNA ‑ microarray jsou kvantitativní metody pro měření exprese určitého genu. Klesající cena MGA zvyšuje klinickou dostupnost testů a umožňuje vyšetření většího počtu nemocných. Obecně využití MGA v praxi stoupá, stejně tak zájem odborné veřejnosti a převážně kladný postoj k testování nemocných. Patrik Neven prezentoval v rámci kongresu IMPAKT Breast Cancer Conference v roce 2014 výsledky studie, do které se zapojilo více než 900 kliniků z 52 zemí světa a jejímž cílem bylo zjistit zájem a užití MGA u nemocných s karcinomem prsu v různých zemích [11]. Více než 55 % tázaných odpovědělo na otázku o používání MGA kladně a z těch, kteří je dosud nevyužívají, 87 % vyslovilo přání zařadit genetické vyšetření do svojí praxe. Z nabídky testů (Oncotype DX, MammaPrint, PAM ‑ 50, EndoPredict, FEMTELLE, Mammastrat a jiné) se ukázaly být nejpoužívanější Oncotype DX (téměř 80 % tázaných) a MammaPrint (34 %). Oba výše uvedené testy jsou zahrnuty do mezinárodních doporučení pro diagnostiku a léčbu časného karcinomu prsu (tab. 1). Pro úplnost informace zde uvádíme odkazy na další komplexní testy molekulárních prediktorů: Genomic Grade Index [12], Breast Cancer Index [13] a CureBest 95GC Breast [14]. Úroveň průkaznosti studií dokládajících efekt jednotlivých MGA se liší. Při stoupajícím množství se jejich posouzení stává poměrně nejednoduchou výzvou. V hodnocení MGA je důležitým kritériem přesnost a robustnost měření (analytická validita), schopnost MGA přesně a spolehlivě identifikovat nebo predikovat prognózu nemocných 5 – 10 let po operaci (klinická validita) a zhodnocení jeho užitečnosti v rozhodovacím procesu volby adjuvantní terapie ve srovnání s běžnými prediktory (klinická utilita). Neméně důležitý je poměr přínosu testu a nejasností (event. finanční zátěže) s ním spojených. Na kongresu IMPAKT 2012 byly prezentovány výsledky hodnocení šesti MGA nezávislým týmem odborníků tvořících pracovní skupinu EGAPP (Evaluation of Genomic Applications in Practice and Prevention). Z posuzovaných testů (MammaPrint, Oncotype DX, EndoPredict, PAM ‑ 50 a Breast Cancer Index) byly panelem doporučeny v hodnocení analytické validity jako vyhovující pouze testy Oncotype DX a MammaPrint. Stejné bylo doporučení týkající se klinické validity testů. V hodnocení klinické užitečnosti byla většina testů označena jako neadekvátní, event. adekvátní, ne ovšem vyhovující [15]. Podpora testů na všech úrovních jejich možného přínosu z roku na rok stoupá, zhodnocení je možné pouze nezávislým panelem odborníků.
Oncotype DX
Oncotype DX je prognosticko‑prediktivní test, který je na základě molekulárního vyšetření nádoru schopen predikovat riziko relapsu nemoci v 10 letech po ukončení adjuvantní terapie a předpovědět benefit adjuvantní chemoterapie. Spolu s MammaPrintem se jedná o nejpoužívanější MGA, který je zahrnut do mezinárodních doporučení. Vyšetření je indikováno pro skupinu pacientek s ER+/ HER2 – časným karcinomem prsu. V otázce uzlinového postižení je postoj odborníků ne zcela jednotný (tab. 2). V ČR je úhrada testu omezena na pacientky s nádorem grade 2, ER+/ HER2 – , bez postižení axilárních lymfatických uzlin (N0), event. s mikrometastázou v sentinelové uzlině (pN1mi) nebo s jedním z dalších rizikových faktorů, kterými je negativita PR nebo vysoké Ki ‑ 67. Indikace testu vychází z mezinárodních doporučení (tab. 2). Podmínkou úhrady je rovněž indikace klinickým onkologem z Komplexního onkologického centra (KOC). Test byl vyvinut selekcí z 250 kandidátních genů testovaných na vzorcích 447 pacientek. Nakonec se ustálil jako platforma 16 s nádorem asociovaných genů a pěti genů referenčních, které jsou vyšetřovány metodou qRT‑PCR z RNA extrahované z FFPE. Vybrané byly geny s negativním prognostickým významem spojené s invazivitou nádoru, geny predikce efektu chemoterapie i geny s pozitivním prognostickým významem. Skóre recidivy (RS) je výsledkem jejich vzájemného poměru dosazeného do matematického modelu a nabývá hodnoty 0 – 100. Při převaze „hodných” genů je RS nízké (1 – 17) a značí dobrou prognózu, při převaze „špatných” genů je tomu naopak (RS > 30). Testování je prováděno v centrální laboratoři, což má napomoci analytické síle testování [16]. Prognostický význam testu byl validován na kohortě postmenopauzálních pacientek [17] bez postižení uzlin (N0) i s postižením (N1) spádových lymfatik [18] v prospektivních studiích na archivovaných vzorcích a výsledky prací ukazují, že nemocné s nízkým RS relabují méně často než nemocné se středním a vysokým RS. Prognostický význam RS byl také srovnán s klinickými parametry zařazenými do doporučení St. Gallen a NCCN [19]. Následujícím krokem bylo ověření, jak nemocné s různým RS profitují z přidání adjuvantní chemoterapie. Výsledky studií NSABP B ‑ 20 [20] i SWOG 8814 [21] prokázaly, že jednoznačný benefit z přidání chemoterapie má pouze vysoce riziková skupina nemocných. Ve studii NSABP B ‑ 28 [22] byly rizikové N1 nemocné léčené chemoterapií s antracykliny, event. taxány a sekvenčně tamoxifenem. RS bylo nezávislým prediktorem relapsu nemoci, pacientky s nízkým RS neměly na rozdíl od nemocných se středním nebo vysokým RS z přidání paklitaxelu benefit, nicnémě vztah mezi RS a terapií taxány nebyl signifikantní. Prospektivní doložení klinické utility testu je zatím pouze částečné. Pro volbu příslušného režimu chemoterapie nejsou ve stávajících studiích podklady. Subanalýzy NSABP B-20 ukazují, že mezi karcinomy s vysokým RS mohou patřit i nádory s nízkým stupněm diferenciace a naopak, nádory gradu 3 mohou být nízce rizikové. Stejnou diskordanci je možné sledovat i v parametrech velikosti nádoru, věku nemocné či Ki-67 [23], což potvrzuje, že klinickopatologické vlastnosti nádoru tak, jak se běžně hodnotí v praxi, nejsou pro odhad chování nádorového onemocnění dostatečné. V hodnocení uzlinového postižení se naopak ukazuje, že samotná přítomnost uzlinového postižení (4 a více uzlin) je významným rizikovým faktorem pro relaps nemoci. I když některá data naznačují, že při limitovaném postižení lymfatik (1–3 uzliny) by genetické vyšetření mohlo být přínosem [18,21,22,24], k potvrzení této teorie je potřeba prospektivních dat. Ve studii TransATAC [18] bylo riziko relapsu pro N0 pacientky s nízkým a středním rizikem 4 a 12 %, pro N1 pacientky ve stejných kategoriích 17 a 28 %. Výzvou zůstává identifikace dalších faktorů, které by umocnily kombinování standardních prediktorů a RS (řeší také prospektivní studie TAILORx). Doplňující data jsou potřebná také pro objasnění, zda může být RS aplikováno i na HER2+ populaci. Prediktivní význam testu ve volbě chemoterapie bude dál ověřen v prospektivní randomizované studii TAILORx [25], jejímž dílčím cílem je mimo jiné i určit hranice (cut-off) mezi jednotlivými rizikovými skupinami, zejména s nízkým a středním rizikem. Na ESMO 2015 byla prezentována data pro skupinu nemocných s RS do 11 s velmi dobrými výsledky – riziko relapsu nemoci méně než 1 %, což dokládá sílu testu a bezpečnost hormonální terapie samotné v této skupině nemocných. Výsledky pro skupinu s RS 11–25 bychom měli mít k dispozici v roce 2017. U N1 nemocných s RS do 25 budou v další prospektivní studii RxPONDER řešeny obdobné problémy [26].
![Indikace Oncotypu DX dle jednotlivých mezinárodních guidelines [42–45].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/fd3c5d54030dc9ce5ab064d2c635abe1.png)
MammaPrint
MammaPrint byl vyvinut na základě vyšetření vice než 25 000 genů u dvou skupin nemocných: relabujících po primárním chirurgickém výkonu a pacientek, které pět let po výkonu na prsu zůstaly zdravé. Jednalo se o pacientky s karcinomem prsu stadia T1 – T2 N0 ve věku do 55 let, které nebyly adjuvantně léčené. Pilotní klinická studie byla započata v roce 2002 [27]. Testováním byly na základě „molekulárního podpisu” identifikovány skupiny s dobrou a špatnou prognózou. Finální podoba testu nabízí vyšetření 70 genů a výsledek je možné použít k predikci prognózy nemocných po ukončení adjuvantní terapie. Test byl validován na podkladě jediné studie s 307 nepředléčenými nemocnými. Jedná se o první molekulární vyšetření svého druhu u nemocných s časným karcinomem prsu, které bylo přijato k použití do klinické praxe FDA (Food and Drug Administration) v roce 2007. Vyšetření je možné provést z nefixovaných vzorků nádorové tkáně a nově také z FFPE. Hlavním dilematem vyšetření nefixované tkáně je extrakce dostatečného množství RNA a zachování její stability. V subanalýze validační studie bylo zjištěno, že vyšetřitelných bylo pouze 80 % vzorků. Tento fakt může být event. příčinou variability výsledků při vyšetření v různých laboratořích, čemuž je předcházeno centralizací testování. Zdali může mít tato variabilita dopad na stratifikaci rizika relapsu, není jasné. Výsledek testu dělí nemocné do skupiny s nízkým a vysokým rizikem relapsu a hodnocení studií ukázalo, že MammaPrint je lepším prediktorem prognózy nemocných než tradičně užívané algoritmy. Nemocné s nízkým rizikem mají 10% šanci relapsu nemoci v 10 letech po operaci, u neléčených nemocných s vysokým rizikem tato šance stoupá k 29 % [28]. Dle doporučení FDA je test indikován pro testování pacientek ve stadiu I – II karcinomu prsu bez uzlinového postižení a s velikostí tumoru do 5 cm vč. MammaPrint má sloužit jako prognostický marker spolu s dalšími klinickopatologickými faktory. Nedostatkem testu ve srovnání se stu ‐ diemi s Oncotype DX je, že populace zahrnuta do hodnocení je na jednu stranu poměrně heterogenní (ER+, ER–, N0, N1 nádory), na druhou stranu věkově omezená (do 55–60 let). Prediktivní význam v stanovení benefitu adjuvantní chemoterapie test postrádá. Prospektivní randomizovaná studie fáze III MINDACT [29] má za cíl srovnat prognostický význam molekulárního profilu a klinickopatologických prediktorů u pacientek s karcinomem prsu s postižením 0 – 3 lymfatických uzlin. Dosavadní data poukazují na biologický význam testu spíš než na jeho význam klinický.
PAM‑ 50
Jedná se o test, který nabízí vyšetření exprese 50 genů pro klasifikaci základních typů karcinomu prsu. PAM-50 patří mezi testy první generace, které měly zjistit, zda fenotypová diverzita nádorů koresponduje s diverzitou genovou [30]. Vyšetření je realizováno na principu qRT‑PCR z mRNA extrahované z FFPE. Získaný profil je srovnán s genovou expresí jednotlivých typů karcinomu prsu. Pro výpočet rizika rekurence je použit analytický systém (nCounter), který může být použit i v necentralizovaných laboratořích. Vyšetření sděluje jednak informaci o molekulárním typu karcinomu prsu (luminální A, luminální B, HER2 pozitivní nebo bazální), jednak tzv. Prosigna skóre (ROR skóre), tj. riziko relapsu nemoci v 10 letech po ukončení adjuvance. ROR skóre nabývá hodnoty 0 – 100 a podle rozsahu uzlinového nálezu jsou z něj odvozeny skupiny s nízkým (ROR = 0 – 40), středním (ROR = 41 – 60) nebo vysokým rizikem (ROR = 61 – 100) relapsu nemoci pro N0 nemocné, skupina s nízkým (ROR = 0 – 15), středním (ROR = 16 – 40) nebo vysokým rizikem (ROR = 41 – 100) u N1 nemocných (1 – 3 LU) a vysoce riziková skupina při postižení čtyř a více uzlin (ROR = 0 – 100). Rozdělení nádorů na luminální A nebo luminální B by mohlo mít význam v další stratifikaci skupiny nemocných se středním rizikem při předpokladu nižšího rizika relapsu u luminálního typu A a vyššího u luminálních B nádorů. Test byl validován ve studiích TransATAC a ABCSG ‑ 8. V první studii se jednalo asi o 1 000 postmenopauzálních pacientek s N0 nebo N1 karcinomem prsu s postižením 0 – 3 uzlin léčených adjuvantně pět let tamoxifenem [31]. Výsledek ROR byl korelován s RS skóre. Autoři studie poukazují na to, že při použití PAM ‑ 50 ve srovnání s Oncotype DX je v menší míře zastoupena středně riziková skupina, která představuje v definici rizika šedou zónu. Ve studii ABCSG ‑ 8 [32] bylo vyšetřeno asi 1 400 pacientek, které byly stratifikovány do skupin podle rizika relapsu nemoci. Skupina s nízkým rizikem měla statisticky signifikantně delší čas do recidivy nemoci. PAM ‑ 50 rovněž nemá prediktivní hodnotu pro volbu adjuvantní terapie. Při vysokém riziku relapsu nemoci můžeme spekulovat o indikaci prodloužené adjuvantní hormonální terapie nebo indikaci chemoterapie. Dle FDA je testování doporučeno jako prediktivní vyšetření prognózy v 10 letech po ukončení adjuvantní hormonální terapie u postmenopauzálních pacientek s časným, hormonálně dependentním karcinomem prsu ve stadiu I – II bez postižení spádových lymfatik. Při postižení 1 – 3 uzlin je indikace vyšetření ve spojení s dalšími klinickopatologickými prediktory stejná. Postižení přesahující čtyři lymfatické uzliny není indikací k žádnému genetickému testování.
EndoPredict
EndoPredict test byl vyvinut k integraci klinickopatologických a genetických informací. V roce 2005 bylo na téměř tisíci vzorcích analyzováno více než 20 000 genů a vybráno osm z nich, které byly identifikovány jako relevantní pro nádorovou progresi. Jedná se o geny spojené s proliferací (BIRC5, UBE2C, DHCR7) a ER – signální dráhou (RBBP8, IL6ST, AZGP1, MGP a STC2), do testování jsou zahrnuty další tři referenční geny. Test pracuje s metodikou qRT‑PCR na mRNA extrahované z FFPE. Analytické charakteristiky a robustnost testu byly publikovány v MBC Cancer [33]. Testování je proveditelné na úrovni specializovaných patologických laboratoří, decentralizace testování je deklarována Denkertovou studií, kdy bylo dosaženo vysoké korelace měření EP skóre mezi sedmi různými laboratořemi [34]. Výsledkem testování a analýzy je skóre rizika rekurence nemoci (EP skóre), které vzorky klasifikuje jako nízce nebo vysoce rizikové, cut-off bylo stanoveno na hodnotě 5. Toto molekulární skóre rizika je v druhé době kombinováno s klinickými parametry (velikostí tumoru a počtem postižených lymfatických uzlin) a upraveno na riziko klinické (EPclin skóre). Klinická validace testu je podložena třemi studiemi na kohortě pacientek s hormonálně dependentním a HER2 negativním karcinomem prsu. Do randomizovaných studií fáze III ABCSG ‑ 6 a ABCSG ‑ 8 bylo zařazeno asi 1 700 postmenopauzálních N0 nebo N1 pacientek léčených adjuvantní hormonální terapií [35]. Do prospektivně retrospektivní studie GEICAM 9960 [36] bylo zařazeno 1 246 rizikových pacientek (s uzlinovým postižením) léčených adjuvantní chemoterapií s atracykliny, event. taxány a sekvenční hormonální léčbou. Z 800 dostupných vzorků bylo na 555 ER+/ HER2 – provedeno vyšetření EndoPredict. Primárním cílem studie byl čas do generalizace nemoci (distant metastatis‑free survival – DMFS), sekundárním cílem celkové přežívání nemocných (overall survival – OS). Jako nízce rizikových bylo klasifikováno 25 % pacientek, s DMFS 93 %, ve skupině s vysokým rizikem relapsu nemoci dle EPclin dosáhl DMFS 70 %. Z 300 premenopauzálních pacientek mělo nízké riziko 24 %. EP skóre mělo prognostický význam i u této skupiny pacientek; EP kategorizace byla také asociována s OS. Studie poskytuje informaci o reziduálním riziku relapsu nemoci po ukončení doporučené adjuvantní chemoterapie. EP skóre nepredikovalo vyšší účinnost kombinované chemoterapie s antracykliny a taxány ve srovnání s antracyklinovým režimem samotným. Otázkou zůstává, jak intenzivněji léčit nemocné s vysokým rizikem relapsu nemoci, a naopak snad můžeme spekulovat, že pětiletá sekvenční hormonoterapie bude dostatečná pro nízce rizikovou skupinu nemocných. Zda by mohla být hormonální terapie samotná dostatečná i pro část nemocných s uzlinovým postižením, je další spekulací. EP skóre je nezávislým prognostickým znakem u postmenopauzálních N0/ N1 pacientek léčených adjuvantní chemoterapií a/ nebo hormonální terapií. Test byl v letošním roce nově doporučen St. Gallenským konsenzem odborníků a je také součástí ESMO guidelines. V ČR zatím nemá úhradu.
Srovnání testů
Různé multigenové testy se liší technologií vyšetření, počtem a výběrem genů, způsobem stanovení rizika relapsu či validací (tab. 3). Důležitým aspektem v posuzování testu je uvědomění si primárního účelu, pro který byl vyvinut. Například PAM ‑ 50 byl vyvinut jako vědecký nástroj k ověření, zda fenotypová diverzita nádorů prsu má korelaci také na úrovni genové exprese. Naproti tomu Oncotype DX byl vyvinut pro účel klinický, jako prognostický test u ER+ časného karcinomu prsu s cílem stratifikace nemocných podle rizika rekurence nemoci. Žádný z testů nebyl přímo designován jako marker pro predikci přínosu chemoterapie, a proto jsou v tomto ohledu data o prediktivních schopnostech genomových testů dosud sporadická. Přestože většina z testů nabízí prognostickou informaci, nejedná se o výsledky ekvivalentní. Nabízí se tedy logická otázka, který z testů dokáže předpovědět riziko recidivy nemoci lépe. V hodnocení analytické validity je potřebné si uvědomit, že zatím neexistuje zlatý standard pro vyhodnocení genové exprese. I při použití nejmodernější technologie bude existovat analytická variabilita. Hlavním otazníkem jsou hranice (cut-off) mezi jednotlivými rizikovými skupinami a jejich srovnání s klinickými prediktory. Dosud nevíme, zda jsou tyto hranice, a tedy stratifikace nemocných, správné. Týká se to zejména nízko a středně rizikové skupiny a odpovědi na to, kde je hranice, která odděluje nemocnou s minimálním rizikem recidivy, a nemocnou, která musí dostat zajišťující chemoterapii. Pouze výsledky správně navržených prospektivních randomizovaných studií mohou být dostatečně validní, aby spolehlivě zodpověděly některé z těchto otázek. Některé studie ukazují v srovnání různých testů dobré výsledky [37], jiné ne. Srovnání MammaPrintu a Oncotype DX prezentovali Poulet et al; téměř polovina nemocných (22/ 57) s vysokým rizikem podle výsledku MammaPrintu měla dle Oncotype DX riziko relapsu nízké [38]. Při srovnání tří testů může být tento rozdíl ještě markantnější. Ze 121 vzorků vyšetřených jak Oncotypem DX, tak MammaPrintem a MammoStratem pouze 22 % bylo konkordantních v nízkém riziku a jen 9 % ve vysokém riziku. V souhrnu byla v 30 % vzorků zaznamenána diskordance výsledku [39]. Srovnání Oncotypu DX a PAM ‑ 50 vyšlo příznivěji pouze ve skupině s nízkým rizikem, a to jak v subanalýze studie TransATAC, tak v pilotní studii přímo srovnávající PAM ‑ 50 a Oncotype DX na 52 vzorcích postmenopauzálních nemocných s ER+/ HER2 – karcinomem prsu bez uzlinového postižení. Exprese ER byla stanovena metodou PCR, pomocí testu PAM ‑ 50 byly vzorky také rozděleny na luminální typy A a B. Starších 70 let bylo 56 % pacientek, 77 % tumorů nedosahovalo velikosti 2 cm a pouze 10 % z nich bylo gradu 3. Míra shody obou testů byla v nízko rizikové skupině 79 %. Nízké riziko relapsu mělo dle Oncotype DX4/7 (57 %) pacientek ve vysokém riziku dle PAM-50. Deset z 12 nádorů luminálního typu B mělo naopak nízké riziko dle Oncotype DX, ale při použití PAM ‑ 50 spadalo šest vzorků do středního a šest do vysokého rizika [40].
![Genomické testy a jejich evaluace. Dle [41].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2784086648db43c5c4abc99251918b97.png)
Závěr
Ve volbě adjuvantní terapie časného, hormonálně dependentního karcinomu prsu máme v současné době k dispozici několik genomových testů. Většina z nich stanovuje riziko relapsu nemoci na podkladě exprese genů proliferace. Dosud nelze říct, zda je možné analýzu genové exprese karcinomů prsu v populaci zobecnit, jako je tomu u jiných tradičních biomarkerů. Genová exprese může odrážet stěžejní vlastnosti nádoru a být v populaci relativně stabilní. Na druhé straně genově expresní profil mohou ovlivňovat mutace (např. mutace genu BRCA1) nebo polymorfizmy. Pro pochopení vícerozměrné podstaty genové exprese a jejího užití v klinické praxi v podobě prediktorů je nutná bližší validace testů na početných homogenních skupinách pacientek. Každý z testů stratifikuje nemocné podle jiného klíče, liší se výběrem genů i hraničními hodnotami (cut-off) mezi jednotlivými rizikovými skupinami nemocných. Oncotype DX má největší úroveň průkaznosti a data podporující zejména jeho prognostickou sílu (hlavně u N0 pacientek a nově pro RS do 11). Test je doporučen nejvýznamnějšími guidelines. Jeho prediktivní síla ve volbě adjuvantní terapie je ve srovnání s dalšími testy jedinečná, dosud jí ale chybí úplná prospektivní validace, která by mohla převážit zdrženlivý postoj odborníků v otázce jeho klinické utility. MammaPrint, PAM-50 a EndoPredict mají prognostické schopnosti, prediktivní data jsou nezralá. Ostatní testy vykazují dle odborníků zatím nejistý význam a většinou jsou hodnoceny jako neadekvátní pro použití v praxi. Ačkoli několik studií u různých MGA predikuje prognostický význam molekulárního profilu také u nemocných s uzlinovým postižením, k této skutečnosti se odborná veřejnost rovněž staví zdrženlivě. Faktem zůstává, že samotná klinická informace o postižení uzlin je zatím „dostatečná” ke konstatování rizikovosti nemocné. I když v kohortě pacientek s postižením 1 – 3 uzlin může být podskupina s dobrou prognózou, prospektivní randomizované studie podporující tuto teorii chybí. Dosud stále platí, že klinický úsudek je pro správné rozhodnutí o léčbě nenahraditelný. Do doby, než se MGA dostanou do běžné praxe, se budeme potkávat se stanovováním jednotlivých „molekulárních” typů karcinomu prsu na podkladě histologických nálezů. Je nutné si uvědomit, že se jedná o pouhou aproximaci, která se se „skutečnou” molekulární klasifikací nemusí shodovat. Hodnocení MGA patří do rukou edukovaného a zkušeného klinického onkologa. Neadekvátní interpretace testu může být matoucí. Do budoucna můžeme snad očekávat vývoj dalších testů i nová užití testů stávajících. S vývojem technologií bude patrně testován větší počet genů, potenciálně až tisíce. Některé z testů se pravděpodobně stanou alternativou pro stávající klinické prediktory, např. Oncotype DX, jako náhrada tradiční histologie a/ nebo imunohistochemie. Pro další pokrok na tomto poli výzkumu je nutné využít všechny dostupné informace testovaných nemocných a vyvážit rychlost výzkumu a inovací z něho plynoucích s dostupnými vědeckými a klinickými nástroji.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zuzana Bielčiková
Onkologická klinika 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: Zuzana.Bielcikova@vfn.cz
Obdrženo: 5. 4. 2015
Přijato: 21. 5. 2015
Sources
1. Perou CM, Sørlie T, Eisen MB et al. Molecular portraits of human breast tumours. Nature 2000; 406(6797): 747 – 752.
2. Petruželka L. Současné možnosti a nové perspektivy systémové léčby karcinomu prsu. Klin Farmakol Farm 2007; 21(3 – 4): 103 – 113.
3. Ryka A, Hovorková E, Sobande F et al. Naděje a úskalí molekulární klasifikace karcinomu prsu. Cesk Patol 2015; 51(1): 26 – 32.
4. Dowsett M, Nielsen TO, A‘Hern R et al. Assessment of Ki67 in breast cancer: recommendations from the International Ki67 in Breast Cancer working group. Natl Cancet Inst 2011; 103(22): 1656 – 1664. doi: 10.1093/ jnci/ djr393.
5. Svoboda M, Grell P, Fabián P et al. Molekulární taxonomie a prediktivní systémy karcinomu prsu definované na základě profilů genové exprese. Klin Onkol 2006; 19 (Suppl 2): 373 – 381.
6. Gnant M, Harbeck N, Thomssen C. St. Gallen 2011: summary of the consensus discussion. Breast Care (Basel) 2011; 6(2): 136 – 141.
7. Perou CM, Sorlie T, Eisen MB et al. Molecular portraits of human breast tumours. Nature 2000; 406(6797): 747 – 752.
8. Sorlie T, Perou CM, Tibshirani R et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A 2001; 98(19): 10869 – 10874.
9. Parker JS, Mullins M, Cheang MC et al. supervised risk predictor of breast cancer based on intrinsic subtypes. J Clin Oncol 2009; 27(8): 1160 – 1167. doi: 10.1200/ JCO.2008.18.1370.
10. Early Breast Cancer Trialists‘ Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15‑year survival: an overview of the randomized trials. Lancet 2005; 365(9472): 1687 – 1717.
11. IMPAKT Brussels. Belgium on 8 – 10 May 2014 by Dr Patrick Neven.
12. Sotiriou CH, Wirapati P, Loi S et al. Gene Expression profiling in breast cancer: understanding the molecular basis of histologic grade to improve prognosis. J Natl Cancer Inst 2006; 98(4): 262 – 272.
13. Zhang Y, Schnabel CA, Schroeder BE et al. Breast cancer index identifies early‑stage estrogen receptor ‑ positive breast cancer patients at risk for early ‑ and late ‑ distant recurrence. Clin Cancer Res 2013; 19(15): 4196 – 4205. doi: 10.1158/ 1078 ‑ 0432.CCR ‑ 13 ‑ 0804.
14. Naoi Y, Kishi K, Tanei T et al. Development of 95 - gene classifier as a powerful predictor of recurrences in node ‑ negative and ER ‑ positive breast cancer patients. Breast Cancer Res Treat 2011; 128(3): 633 – 641. doi: 10.1007/ s10549 ‑ 010 ‑ 1145 ‑ z.
15. Azim HA, Michiels S, Zagouri F et al. Utility of prognostic genomic tests in breast cancer practice: the IMPAKT 2012 Working Group Consensus Statement. Ann Oncol 2013; 24(3): 647 – 654. doi: 10.1093/ annonc/ mds645.
16. Cronin M, Sangli C, Liu ML et al. Analytical validation of the Oncotype DX genomic diagnostic test for recurrence prognosis and therapeutic response prediction in node ‑ negative, estrogen receptor ‑ positive breast cancer. Clin Chem 2007; 53(6): 1084 – 1091.
17. Paik S, Shak S, Tang G et al. A multigene assay to predict recurrence of tamoxifen‑treated, node ‑ negative breast cancer. N Engl J Med 2004; 351(27): 2817 – 2826.
18. Dowsett M, Cuzick J, Wale C et al. Prediction of risk of distant recurrence using the 21-gene Recurrence Score in node ‑ negative and node ‑ positive postmenopausal patients with breast cancer treated with anastrozole or tamoxifen: a TransATAC Study. J Clin Oncol 2010; 28(11): 1829 – 1834. doi: 10.1200/ JCO.2009.24.4798.
19. Paik S, Shak S, Tang G. Risk classification of breast cancer patients by teh recurrence score assay: caomparison to guidelines based on patient age, tumor size, and tumor grade. Abstract presented at Annual San Antonio Breast Cancer Symposium; December 8 – 11, 2004. San Antonio, TX: abstr. 104.
20. Paik S, Tang G, Shak S et al. Gene expression and benefit of chemotherapy in women with node ‑ negative, estrogen receptor ‑ positive breast cancer. J Clin Oncol 2006; 24(23): 3726 – 3734.
21. Albain KS, Barlow WE, Shak S et al. Prognostic and predictive value of the 21 - gene recurrence score assay in postmenopausal women with node ‑ positive, oestrogen ‑ receptor ‑ positive breast cancer on chemotherapy: a retrospective analysis of a randomized trial. Lancet Oncol 2010; 11(1): 55 – 65.
22. Mamounas EP, Tang G, Paik S et al. Association between the 21 - gene recurrence score (RS) and benefit from adjuvant paclitaxel (Pac) in node ‑ positive (N+), ER ‑ positive breast cancer patients (pts): results from NSABP B ‑ 28. Cancer Res 2012, 72: S1 – S10.
23. Gluz O, Kreipe HH, Christgen M et al. Prospective comparison of recurrence score and independent central pathology assessment of prognostic tools in early breast cancer (BC): focus on HER2, ER, PR, Ki ‑ 67 results from the phase III WSG ‑ Plan B trial. Poster presented at: American Society for Clinical Oncology Annual Meeting; June 2012; Chicago, IL: abstr. 552.
24. Penault-Llorca F, Filleron T, Asselain B et al. Prediction of recurrence with the Oncotype DX recurrence ccore in node-positive, HR-positive, breast cancer patients treated with adjuvant FEC-D or FEC Chemotherapy. American Society of Clinical Oncology Annual Meeting; May 2014; Chicago, IL.
25. Sparano JA, Gray RJ, Makower DF et al. Prospective validation of a 21-gene expression assay in breast cancer. N Engl J Med 2015; 373(21): 2005–2014. doi: 10.1056/NEJMoa1510764.
26. Cancer.gov [homepage on the Internet]. National Cancer Institute. Tamoxifen citrate, letrozole, anastrozole, or exemestane with or without chemotherapy in treating patients with invasive RxPONDER breast cancer. Available from: https://clinicaltrials.gov/ct2/show/NCT00433589.
30. Nielsen TO, Parker JS, Leung S et al. A comparison of PAM50 intrinsic subtyping with immunohistochemistry and clinical prognostic factors in tamoxifen‑treated estrogen receptor ‑ positive breast cancer. Clin Cancer Res 2010; 16(21): 5222 – 5232. doi: 10.1158/ 1078 ‑ 0432.CCR ‑ 10 ‑ 1282.
31. Dowsett M, Sestak I, Lopez ‑ Knowles E et al. Comparison of PAM50 risk of recurrence score with Oncotype DX and IHC4 for predicting risk of distant recurrence after endocrine therapy. J Clin Oncol 2013; 31(22): 2783 – 2790. doi: 10.1200/ JCO.2012.46.1558.
32. Gnant M, Filipits M, Greil R et al. Predicting distant recurrence in receptor ‑ positive breast cancer patients with limited clinicopathological risk: using the PAM50 Risk of Recurrence score in 1478 postmenopausal patients of the ABCSG ‑ 8 trial treated with adjuvant endocrine therapy alone. Ann Oncol 2014; 25(2): 339 – 345. doi: 10.1093/ annonc/ mdt494.
33. Kronenwett R, Bohmann K, Prinzler J et al. Decentral gene expression analysis: analytical validation of the endopredict genomic multianalyte breast cancer prognosis test. BMC Cancer 2012; 12 : 456.
34. Denkert C, Kronenwett R, Schlake W et al. Decentral gene expression analysis for ER+/ Her2 – breast cancer: results of a proficiency testing program for the EndoPredict assay. Virchows Arch 2012; 460(3): 251 – 259. doi: 10.1007/ s00428 ‑ 012 ‑ 1204 ‑ 4.
35. Filipits M, Rudas M, Jakesz R et al. A new molecular predictor of distant recurrence in ER ‑ positive, HER2 - negative breast cancer adds independent information to conventional clinical risk factors. Clin Cancer Res 2011; 17(18): 6012 – 6020. doi: 10.1158/ 1078 ‑ 0432.CCR ‑ 11 ‑ 0926.
36. Martin M, Brase JC, Calvo L et al. Clinical validation of the EndoPredict test in node ‑ positive, chemotherapy‑treated ER+/ HER2 − breast cancer patients: results from the GEICAM 9906 trial. Breast Cancer Res 2014; 16(2): R38. doi: 10.1186/ bcr3642.
37. Fan C, Oh DS, Wessels L et al. Concordance among gene ‑ expression‑based predictors for breast cancer. N Engl J Med 2006; 355(6): 560 – 569.
38. Poulet B, Jamshidian F, Butler S et al. Risk classification of early stage breast cancer as assessed by MammaPrint and Oncotype DX genomic assays. SABCS 2012: abstr. #P6 - 07 - 03.
39. Shivers SC, Clark L, Esposito N et al. Direct comparison of risk classification between MammaPrint®, Oncotype DX® and MammoStrat® assays in patients with early stage breast cancer. Cancer Res December 2013; 73 (Suppl 24): abstr. P6 - 06 - 02.
40. Alvarado M, Prasad C et al. A pilot laboratory study comparing the 21 - gene assay and PAM50 - ROR.
41. Kern P, Rezai M, Singer CH et al. Genomic testing in international guidelines. EMJ Oncol 2013; 1 : 68 – 74.
42. NCCN Breast cancer guidelines. V.2.2015.
43. Harris L, Fritsche H, Mennel R et al. American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer. J Clin Oncol 2007; 25(33): 5287–5312.
44. Coates AS, Winer EP, Goldhirsch A et al. Tailoring therapies – improving the management of early breast cancer: St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol 2015; 26(8): 1533–1546. doi: 10.1093/annonc/mdv221.
45. Senkus E, Kyriakides S, Ohno S et al. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann of Oncol 2015; 26 (Suppl 5): v8–v30. doi: 10.1093/annonc/mdv298.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2016 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Genomové testy jako prediktory prognózy pacientek s karcinomem prsu
- Potenciál dlouhých nekódujících molekul RNA v diagnostice nádorových onemocnění
- Analýza přežití tříletého sledování nemocných s rakovinou hlavy a krku
- Úspěšná terapie české pacientky s ROS1 translokací crizotinibem
- Úloha bielkovín tepelného šoku v leukémii
- Predikce změny vitality u starších přeživších žen s karcinomem prsu po primární onkologické léčbě – přístup založený na použití změny hladin zánětlivého markeru C reaktivního proteinu v čase
- Úspěšná spojená resekce jater a podvaz portální žíly po neúspěšné dvojité TACE proceduře komplikované sepsí a pankreatitidou
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Analýza přežití tříletého sledování nemocných s rakovinou hlavy a krku
- Genomové testy jako prediktory prognózy pacientek s karcinomem prsu
- Úloha bielkovín tepelného šoku v leukémii
- Potenciál dlouhých nekódujících molekul RNA v diagnostice nádorových onemocnění
