Karcinom prsu – specifika gynekologické péče a poradenství
Breast Cancer – Specifics of Gynecological Care and Counseling
Background:
This paper summarizes current knowledge about clinically important aspects of gynecological care in female breast cancer patients. Despite the overall positive acceptance of oral contraceptives and hormone replacement drugs, hormone therapy may raise fears of developing breast cancer. Specifics of gynecological care of fertile patients are discussed as these patients face ovarian failure when undergoing oncological treatment of breast cancer. Tamoxifen is used in adjuvant therapy of breast cancer, in metastatic breast cancer or as prophylaxis of breast cancer in high-risk patients.
Aim:
We aim to study the influence of hormonal treatment on breast cancer development in women with and without congenital predisposition. The main risk factors for developing breast cancer are family history, increased density of breast tissue, atypical hyperplasia of the breast and previous radiotherapy to the chest area. All these factors increase the relative risk of cancer more than four times. Contraceptives and hormone replacement therapy show generally less than two-fold or no increase at all (RR 0.96–1.6). We concentrate with safety of hormonal therapy in breast cancer patients after they finish breast cancer treatment in pre - and postmenopausal period. We discuss fertility-sparing methods for preservation of ovarian function due to oncological treatment. Those methods are cryopreservation of embryos, oocytes in metaphase II and ovarian tissue. Simultaneous administration of GnRH agonists may protect ovarian function before gonadotoxic chemotherapy. We describe in detail the effects of tamoxifen on gynecological organs in both pre - and postmenopausal women in relation to the potential risk of developing secondary malignancy. In premenopausal women, tamoxifen has no increased risk of cancer of the uterine body. In postmenopausal patients, the risk after five years of tamoxifen is increased 2–3 times. Transvaginal sonography is not the screening tool for detection of the pathology in the uterine cavity during tamoxifen therapy, and so we only recommend looking for symptoms. Hysteroscopy is the golden standard for the examination of the uterine cavity in symptomatic postmenopausal patients using tamoxifen.
Conclusion:
This paper summarizes the current knowledge in areas where oncological and gynecological cares for breast cancer patients mingle. It should lead to greater understanding and deepening cooperation between clinical oncologists and oncogynecologists for the benefit of our patients.
Key words:
adjuvant hormonal therapy – fertility preservation – GnRH analogs – contraceptives – endometrial hyperplasia – hormone replacement therapy – breast neoplasm – tamoxifen
This work was supported by the Czech Ministry of Health – RVO (FNBr, 65269705).
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
6. 6. 2016
Accepted:
22. 7. 2016
:
Vít Weinberger 1
; Michal Zikán 2
:
Onkogynekologické centrum, Gynekologicko-porodnická klinika LF MU a FN Brno
1; Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
2
:
Klin Onkol 2016; 29(Supplementum 3): 7-15
:
Review
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko20163S7
Východiska:
V práci se soustředíme na aktuální a klinicky důležité aspekty péče o pacientky s karcinomem prsu z pohledu gynekologa. I přes celkové pozitivní přijetí, hormonální antikoncepce a hormonální substituční terapie mohou vzbuzovat obavy ze vzniku karcinomu prsu. Jsou probrána specifika gynekologické péče o pacientky ve fertilním věku, u kterých v rámci onkologické léčby karcinomu prsu vzniká předčasné ovariální selhání. Tamoxifen se užívá v adjuvantní terapii karcinomu prsu, u metastatického nádoru prsu či v rámci profylaxe vzniku zhoubného nádoru prsu u vysoce rizikových skupin žen.
Cíl:
Zabýváme se vlivem hormonálních preparátů na vznik karcinomu prsu jak u žen s vrozenou predispozicí, tak bez ní. Faktory jako pozitivní rodinná anamnéza, zvýšená denzita prsní tkáně, atypická hyperplazie prsu a předchozí radioterapie na oblast hrudníku zvyšují riziko vzniku karcinomu více než 4krát, zatímco hormonální antikoncepce a hormonální substituční terapie představují méně než dvojnásobné či vůbec žádné zvýšení (RR 0,96–1,6). Zabýváme se bezpečností a možnostmi užívání hormonálních preparátů po ukončené léčbě karcinomu prsu v pre - i postmenopauze. U žen s karcinomem prsu v premenopauze definujeme fertilitu šetřící možnosti před aplikací chemoterapie – kryokonzervace embryí, oocytů v metafázi II nebo ovariální tkáně. Simultánní aplikace GnRH agonistů může ochránit ovariální funkce před gonadotoxickou chemoterapií. Zabýváme se vlivem tamoxifenu na gynekologické orgány. U premenopauzálních žen užívajících tamoxifen není zvýšené riziko vzniku karcinomu děložního těla, u postmenopauzálních je riziko po pěti letech užívání 2–3krát zvýšené. Transvaginální sonografie není vhodná ke screeningovému vyšetřování za účelem detekce patologie dutiny děložní při léčbě tamoxifenem. U těchto žen se řídíme symptomatologií. Hysteroskopie je zlatým standardem k vyšetření dutiny děložní u symptomatických postmenopauzálních pacientek léčených tamoxifenem.
Závěr:
Práce shrnuje současné znalosti v oblastech, kde se prolíná onkologická a gynekologická péče o pacientky s karcinomem prsu. Má napomoci k většímu porozumění a prohloubení spolupráce mezi klinickými onkology a onkogynekology ve prospěch našich společných pacientek.
Klíčová slova:
adjuvantní hormonální terapie – fertilitu šetřící postupy – GnRH analoga – hormonální antikoncepce – hyperplazie endometria – hormonální substituční terapie – karcinom prsu – tamoxifen
Úvod
Karcinom prsu je nejčastějším zhoubným nádorem u žen. Incidence onemocnění stále narůstá. Naopak mortalita od poloviny 90. let minulého století stagnuje, až mírně klesá. V roce 2013 dosáhl počet nově diagnostikovaných zhoubných nádorů prsu u žen v ČR počtu 7 140. To představuje více než 133 nádorů na 100 000 žen. V roce 2013 zemřelo na karcinom prsu 1 845 žen, což je téměř 35 úmrtí na 100 000 žen. Při stále rostoucí incidenci karcinomu prsu a stagnující či mírně klesající mortalitě na něj je nevyhnutelným důsledkem tohoto trendu zvyšování prevalence, tedy počtu žijících žen, u kterých byl v minulosti diagnostikován a léčen karcinom prsu. V roce 2013 dosáhla prevalence 74 348 žen a ve srovnání s rokem 2003 (44 981 žen) tak vzrostla v ČR o 65 %. Nejvíce zhoubných nádorů prsu je diagnostikovaných ve věkové kategorii 60–69 let, ale více než 37 % všech nemocných je v produktivním věku mladších než 60 let [1]. Léčba karcinomu prsu je komplexní. K jednotlivým modalitám léčby patří chirurgie, radioterapie, systémová léčba chemoterapií, hormonální léčba a cílená biologická léčba. Chemoterapie je u žen ve fertilním věku zodpovědná za rozvoj předčasného ovariálního selhání (premature ovarian failure – POF), s důsledky jako vznik sterility, nástup předčasné menopauzy s projevy neurovegetativního klimakterického syndromu a zvýšení rizika vzniku osteopenie, osteoporózy a kardiovaskulárních chorob [2]. Adjuvantní hormonoterapie tamoxifenem může způsobovat vedlejší nežádoucí účinky, z nichž nejzávažnějším je riziko onemocnění karcinomem děložního těla. Cílem článku je se zabývat problematikou karcinomu prsu z pohledu gynekologa. Podáváme recentní přehled o rizicích užívání hormonální antikoncepce (HAK) a hormonální substituční terapie (hormone replacement therapy – HRT) v souvislosti s rizikem vzniku karcinomu prsu. Zabýváme se možnostmi užívání hormonálních preparátů po ukončené léčbě karcinomu prsu v pre - i postmenopauze. Jsou probrána specifika gynekologické péče o pacientky ve fertilním věku, u kterých dochází v rámci onkologické léčby ke vzniku POF. Jsou definovány dostupné možnosti prevence vzniku POF a zachování si možnosti budoucí fertility. Podrobně se zabýváme jak farmakologickou profylaxí, tak možnostmi uchování fertility v rámci využití metod asistované reprodukce. V článku se podrobně zabýváme vlivem tamoxifenu na gynekologické orgány v pre - i postmenopauze v souvislosti s možným rizikem vzniku sekundární malignity. Článek reflektuje nejnovější doporučení stran gynekologické péče o pacientky s karcinomem prsu.
Karcinom prsu – HAK a HRT
I přes celkové pozitivní přijetí HAK a HRT může hormonální léčba vzbuzovat obavy ze vzniku zhoubného nádorového onemocnění prsu. Hlavními rizikovými faktory vzniku karcinomu prsu jsou pozitivní rodinná anamnéza, zvýšená denzita prsní tkáně, atypická hyperplazie prsu a předchozí radioterapie na oblast hrudníku (především ve věku 10–24 let). Tyto všechny faktory zvyšují relativní riziko (RR) vzniku karcinomu více než 4krát. Ostatní faktory vč. endogenních a exogenních hormonů působí s relativně nižším nárůstem rizika a představují méně než dvojnásobné zvýšení [3]. Cílem kapitoly je poskytnout aktuální pohled na problematiku hormonální terapie ve vztahu k hrozbě vzniku či recidivy karcinomu prsu. Zásadní v této problematice je kvalitní poradenství ženám, které se obrátí pro odbornou radu a pomoc na svého gynekologa či klinického onkologa.
Vliv HAK na vznik karcinomu prsu
Experimentální údaje naznačují, že by estrogen mohl hrát negativní roli při vzniku karcinomu prsu. Estrogeny podporují rozvoj prsní tkáně a vykazují přímé i nepřímé proliferační účinky na kultivovaných buňkách rakoviny prsu. Progestiny jsou schopné se vázat na různé steroidní receptory, progesteron je metabolizován na působky s různou biologickou aktivitou, mnohdy protichůdnou ve smyslu proliferační a antiproliferační [4,5]. Ve většině dosud publikovaných velkých studií nezvyšuje HAK riziko vzniku karcinomu prsu. Ve studiích, které referovaly malé navýšení RR vzniku zhoubného nádoru prsu, negativní účinek HAK vymizel velmi rychle po ukončení jejího užívání. Jako nejvýznamnější rizikový faktor pro vznik karcinomu prsu v souvislosti s užíváním HAK se jeví časný začátek jejího užívání před porodem prvního dítěte, neboť podané hormony mohou negativně dlouhodobě působit na méně diferencovanou prsní tkáň. Studie hodnotící vlivy HAK na ženy jsou dlouhodobé, observační a většina jich začala v době tzv. vysokodávkované HAK, kdy preparáty obsahovaly ≥ 50 mg ethinyl estradiolu. Jediná norská studie referovala o přímé souvislosti mezi obsahem estrogenu a rizikem karcinomem prsu, zůstává však jedinou studií s tímto výsledkem [6]. Ostatní studie sledující aplikační formu HAK či její konkrétní složení (preparát a dávku) neprokázaly vliv na zvýšení rizika onemocněním karcinomem prsu [7–9].
Vliv HRT na vznik karcinomu prsu
Ženy, které onemocněly karcinomem prsu v postmenopauze, mají vyšší hladinu endogenního estrogenu v krvi, ten je prokázaným rizikovým faktorem vzniku zhoubného nádoru prsu [10]. Každý rok od průměrného věku menopauzy v populaci, co žena zůstává v premenopauze, se riziko vzniku karcinomu prsu zvyšuje o 2,8 %, při užívání HRT se zvedá ročně o 2,3 % [11]. Riziko rapidně klesá k nule po vysazení HRT. Na druhé straně má karcinom prsu u uživatelek HRT lepší prognózu, nádor je dobře diferencovaný, lymfatické spádové uzliny častěji negativní a pacientky dosahují delšího přežití [12,13]. V rozsáhlé studii Million Women Study bylo prokázáno vyšší riziko pro vznik karcinomu prsu u uživatelek HRT RR 1,66 (95% CI 1,58–1,75) a pro úmrtí na karcinom prsu RR 1,22 (95% CI 1,00–1,48). Po ukončení užívání HRT nebylo detekováno zvýšené riziko vzniku karcinomu prsu RR 1,01 (95% CI 0,94–1,09) nebo úmrtí na něj RR 1,05 (95% CI 0,82–1,34). Incidence karcinomu prsu byla zvýšena nejméně u skupiny žen užívajících čistě estrogenní substituční terapii RR 1,30 (95% CI 1,21–1,40), více pak u uživatelek tibololu (steroidní hormon s kombinovaným estrogenním, gestagenním a slabým androgenním účinkem, nízkým vlivem na prsní žlázu) RR 1,45 (95% 1,25–1,68). Největší riziko vzniku karcinomu prsu je u uživatelek estrogen-gestagenní hormonální substituční terapie RR 2,00 (95% CI 1,88–2,12). RR vzniku karcinomu prsu se liší i v závislosti na aplikační formě HRT, kde perorální forma představuje RR 1,32 (95% CI 1,21–1,45), transdermální RR 1,24 (95% CI 1,11–1,39) a implantace čistě estrogenního depotního preparátu RR 1,65 (95% CI 1,26–2,16). Se vzrůstající délkou užívání HRT roste i riziko vzniku karcinomu prsu, kdy 10leté užívání čistě estrogenní HRT představuje navíc pět karcinomů a užívání kombinované substituční terapie navíc 19 karcinomů na 1 000 uživatelek [14].
HAK u žen s karcinomem prsu
Dle stávající praxe je v době diagnózy hormonálně závislého karcinomu prsu pacientce doporučeno okamžité ukončení užívání HAK. Vysazení HAK by měl předcházet pohovor pacientky s ošetřujícím gynekologem a onkologem, kdy jsou s pacientkou probrány jak nehormonální kontracepční metody, tak prodiskutovány metody umožňující zachovat fertilitu i po ukončené onkologické léčbě (zamražení ovariální tkáně, zamražení oocytů, zamražení embryí, protekce gonád GnRHa). Nejsou studie, které by prokázaly bezpečnost pokračování HAK u diagnostikovaného hormonálně dependentního karcinomu prsu. Otěhotnění po nepromyšleném vysazení HAK je v dané situaci diagnostikovaného karcinomu prsu nežádoucí [15]. Kromě méně spolehlivé bariérové antikoncepce je z bezpečných a spolehlivých kontracepčních metod na zvážení zavedení nehormonálního intrauterinního tělíska s mědí. U žen neplánujících další těhotenství je na prvním místě zvážení sterilizace formou salpingektomie, či sterilizace partnera formou vazektomie [16]. Ani po pěti letech od stanovení diagnózy karcinomu prsu a bez známek aktivity onkologického onemocnění nejsou data o bezpečnosti znovu nasazení HAK a teoretická či prokázaná rizika převažují nad jejím benefitem.
HRT u žen s karcinomem prsu
Léčba neurovegetativního klimakterického syndromu může být u pacientek s karcinomem prsu problematická. Především u vazomotorických symptomů se u dvou třetin pacientek jeví účinné podání selektivních inhibitorů zpětného vychytávání serotoninu. Systémová hormonální substituce je u pacientek s karcinomem prsu kontraindikována a musí být zvažována přísně individuálně [17]. Dvě studie, které zkoumaly možnost podání hormonální substituce tibolonem u žen po léčbě pro karcinom prsu, byly předčasně ukončeny pro nárůst recidiv. Nízkodávkovaná vaginálně aplikovaná estrogenní substituce je mnohými považována za bezpečnou; určité opatrnosti je třeba u uživatelek inhibitorů aromatáz, kde byly pozorovány vyšší systémové hladiny estrogenů i při vaginálním podání [18,19].
Hormonální léčba u žen s potenciálním rizikem rozvoje karcinomu prsu
Ve většině dosud publikovaných velkých studií nezvyšuje HAK riziko vzniku karcinomu prsu. Pro gynekologa a lékaře zabývajícího se péčí o rizikové zdravé ženy je důležité vědět, zda HAK zvyšuje riziko vzniku rakoviny prsu u žen s primárně zvýšeným rizikem vzniku karcinomu prsu.
Benigní onemocnění prsu
Nejčastějším benigním onemocněním prsu je fibroadenom. Ten sám o sobě nezvyšuje riziko vzniku zhoubného nádoru prsu. Fibrocystická nemoc s proliferativní lézí je spojena se zvýšeným rizikem vzniku karcinomu a atypická hyperplazie je považována za prekancerózu s významným zvýšením rizika karcinomu prsu (RR 4–6). Bylo publikováno několik studií, jejichž závěrem je, že HAK svoji délkou užívání snižuje přímo úměrně výskyt benigních onemocnění prsu – fibroadenomu a fibrocystické nemoci [20,21]. Některé studie ukázaly, že ochranný efekt HAK ale neplatí u lézí, které již vykazují proliferativní aktivitu, u těch je riziko zvratu v karcinom při užívání HAK zvýšeno [22,23].
Pozitivní rodinná anamnéza pro karcinom prsu
Důležitou otázkou je, zda HAK zvyšuje riziko onemocnění karcinomem prsu u žen, které mají v první či druhé příbuzenské linii rodinného příslušníka nemocného karcinomem prsu bez prokázané rodinné hereditární zátěže. Data jsou kontroverzní z důvodu nedostatečně velkých souborů pacientek, nekonzistentní a nehomogenní populace zařazené do studií a z důvodu odlišných definicí rodinné anamnézy [24]. Byly publikovány tři velké souhrnné studie, které neprokázaly statisticky významný rozdíl v incidenci rakoviny prsu u žen majících v rodině příbuzného s invazivním karcinomem prsu a užívajícího HAK [25–27]. Na druhé straně byly publikovány dvě studie, které ukázaly zvýšené riziko onemocnění karcinomem prsu RR 3,3 (95% CI 1,6–6,7) u žen, které mají v první linii příbuzného s rakovinou prsu [28,29]. U žádné z výše zmíněných studií nebyl znám BRCA statut sledovaných pacientek.
HAK u žen s BRCA1 a BRCA2 mutací
Zdravé ženy, nosičky mutace v genu BRCA1 nebo BRCA2, jsou celoživotně nejvíce ohroženy vznikem karcinomu prsu a vaječníku. Riziko karcinomu prsu stoupá od 20. roku života žen, riziko onemocnění karcinomem ovaria začíná dramaticky stoupat od 35.–40. roku života u BRCA1 pozitivních žen, u BRCA2 pozitivních od 50. roku života. S rostoucím věkem dominuje riziko onemocnění karcinomem prsu. HAK u těchto žen má zásadní protektivní vliv na vznik karcinomu ovaria. BRCA1 či BRCA2 mutované pacientky mohou užívat HAK s tím, že se mírně zvyšuje riziko (RR 1,2–4,3) onemocnění karcinomem prsu [30,31]. Nebyl popsán rozdíl v efektu různých preparátů, ani vliv odlišných hladin estrogenů v různých preparátech HAK. Volba preparátu je tedy v závislosti na toleranci pacientky, případně na žádoucích pozitivních vedlejších efektech. Zároveň bychom vždy měli zvážit jinou možnost spolehlivé antikoncepce, především nitroděložní tělísko, které je dnes již k dispozici i pro ženy, které ještě nerodily.
Menopauzální příznaky a jejich management u BRCA pozitivních žen
Existuje zatím jediná studie, která hodnotí krátkodobé podání hormonální substituce (HRT nebo estrogen replacement therapy – ERT) zdravým nosičkám mutací po adnexektomii [32] a považuje ji za bezpečnou za podmínky vysazení HRT ve věku předpokládané menopauzy, tj. kolem 50. roku života. Vzhledem k nedostatku studií je dobré poučit pacientky o tom, že užívání HRT po profylaktické operaci je relativně bezpečné, mohlo by však nepatrně snížit benefit redukce rizika karcinomu prsu. Při ponechání dělohy je třeba, aby byla pacientka substituována kombinovanou léčbou (estrogen + gestagen), event. lze kombinovat i nitroděložní tělísko s obsahem gestagenu a estrogenní substituci. Po hysterektomii je dostatečná čistě estrogenní substituce. Vždy začínáme nejnižší dávkou a případně ji stupňujeme do potlačení příznaků menopauzy. U postmenopauzálních žen bylo popsáno významnější zvýšení rizika vzniku karcinomu prsu u uživatelek kombinované HRT ve srovnání s uživatelkami čistě estrogenní léčby [33]. Tyto závěry však nelze vztahovat na ženy s arteficiální menopauzou, a navíc nebyl tento efekt u BRCA pozitivních žen užívajících HRT po profylaktické adnexektomii potvrzen [34].
Karcinom prsu – gonadotoxická chemoterapie a fertilitu šetřící metody
Adjuvantní chemoterapie a hormonoterapie tamoxifenem zlepšila celkové přežití (overall survival – OS) a interval bez nemoci, ale zároveň zvýšila riziko vzniku POF se všemi důsledky, jako jsou sterilita a předčasná menopauza s rozvojem neurovegetativního klimakterického syndromu. POF je spojené s amenorrhoeou, změnami hladin sérových markerů funkce ovariální tkáně (vzestup folikulostimulačního hormonu – FSH, luteinizačního hormonu a pokles estradiolu a antimülleriánského hormonu), sterilitou pacientky – tedy nemožností otěhotnět. V důsledku projevů neurovegetativního klimakterického syndromu dochází k dalšímu snížení kvality života, pacientky jsou ohroženy předčasně vznikem osteopenie, osteoporózy a rozvojem kardiovaskulárních chorob [2]. Riziko POF po léčbě chemoterapií se pohybuje v rozmezí 10–95 % a koreluje s věkem pacientky, typem a kumulativní dávkou chemoterapie. Kombinace chemoterapeutik cyklofosfamid, doxorubicin (adriamycin) a fluorouracil (režim CAF) je výrazně gonadotoxická, u pacientek starších 40 let vyvolá POF u 80 % z nich. Naopak u pacientek mladších 30 let bude při stejném chemoterapeutickém režimu riziko POF jen 20 % [35]. Mezi nejvíce gonadotoxická chemoterapeutika v léčbě karcinomu prsu patří alkylační činidla – cyklofosfamid [35]. Chemoterapeutika vykazující střední gonadotoxicitu jsou karbopaltina, adriamycin a taxany. Nízce gonadotoxické preparáty jsou vinorelbin, kapecitabin a 5-fluorouracil [35]. Chemoterapie působí toxicky na ovariální tkáň několika mechanizmy. Jedná se o přímou apoptózu primordiálních folikulů, zvýšenou aktivaci primordiálních folikulů následovanou jejich deplecí, poškození stromatu vaječníku a angiotoxický účinek chemoterapie. Tím dojde nepřímo ke ztrátě primordiálních folikulů [36,37]. Onkofertilita se jako nová specializace a obor dynamicky rozvíjí v posledním desetiletí, věnuje se metodám umožňujícím zachování fertility při a po ukončené onkologické léčbě. Mezi postupy zachovávající fertilitu při současné indikaci gonadotoxické chemoterapie v rámci komplexní léčby karcinomu prsu u pacientek ve fertilním věku patří kryokonzervace embryí, kryokonzervace oocytů v metafázi II, kryokonzervace ovariální tkáně [38]. Další metodou volby je aplikace GnRHa v období 7–14 dní před zahájením chemoterapie za účelem navození prepubertálního hormonálního stavu organizmu a pokračování v dané léčbě simultánně po dobu podávané gonadotoxické léčby za účelem prevence rozvoje POF [38,39]. Žádný z výše zmíněných a navržených postupů není ideální a žádný nezaručuje budoucí plodnost u přeživších pacientek.
Kryokonzervace embryí
Umělé oplodnění (in vitro fertilization – IVF) s následnou kryokonzervací embrya je nejvíce zavedená metoda zachování budoucí fertility u žen, které mají partnera či manžela. Metoda může vyžadovat odložení chemoterapie o 10–14 dní a není variantou volby pro mladé ženy bez partnera [38–40]. Proces IVF může ženě přinést určitá rizika – vznik ovariálního hyperstimulačního syndromu (0,5–5 %) a riziko pelveoperitonitidy po odběru oocytů (0,5–1 %). Nebyl zjištěn žádný rozdíl mezi pacientkami s karcinomem prsu podstupujícími stimulaci a kontrolní zdravou skupinou žen s ohledem na celkovou spotřebu gonadotropinů nutných ke stimulaci, nebyl shledán ani rozdíl v počtu odebraných oocytů (12,4 vs. 10,9) a počtu vzniklých embryí (6,6 vs. 7,1) [40]. Kumulativní míra otěhotnění (pregnancy rate) na embryotransfer je srovnatelná pro pacientky s nádorovým onemocněním a zdravou kontrolní skupinou – 37 vs. 43 % [40]. Pacientky ve skupině s karcinomem prsu měly vzhledem k vyššímu výskytu dvojčat po metodách IVF vyšší pravděpodobnost narození živého dítěte (44 vs. 14 %; p = 0,035) [40]. U pacientek s hormonálně dependentním karcinomem prsu by měl být součástí stimulačního protokolu i inhibitor aromatázy k redukci sérových hladin estradiolu a minimalizaci růstu nádorových buněk pod vlivem vysoké hladiny estrogenu během stimulace [40,41]. K prevenci vzniku hyperstimulačního syndromu je namísto aplikace lidského choriového gonadotropinu k dozrání folikulů zařazen do stimulačního protokolu GnRHa [40–43]. K zabránění oddálení začátku aplikace chemoterapie se zahajuje kontrolovaná stimulace ovarií v kterýkoliv den menstruačního cyklu pomocí gonadotropinů, a to i v luteální fázi [38,41].
Kryokonzervace oocytů
Již několik posledních let není kryokonzervace oocytů považována za experimentální metodu zachování ferti - lity [39,44,45]. Velkou předností kryokonzervace neoplodněných oocytů je použitelnost pro mladé pacientky bez partnera. Díky rostoucí úspěšnosti cyklů umělého oplodnění z kryokonzervovaných oocytů získává tato metoda na popularitě. Budoucí plodnost a pravděpodobnost početí je závislá na počtu získaných a zamražených zralých oocytů [38,39,44,45].
Kryokonzervace ovariální tkáně
Kryokonzervace ovariální tkáně a následná transplantace je stále považována za experimentální metodu zachování plodnosti onkologických pacientek [38,39,44,45]. Jedná se o jedinou metodu volby zachování fertility u prepubertálních dívek. Největším problémem této metody je dosud ne zcela optimálně technologicky zvládnutý proces in vitro maturace oocytů ze stadií primordiálních folikulů. Dosud je referováno 40 zdravých novorozenců po transplantaci zamražené ovariální tkáně. Nejedná se o jednoznačně bezpečnou a úspěšnou techniku zachování budoucí fertility. Chirurgický zákrok (obvykle laparoskopická biopsie ovaria nebo ooforektomie) v celkové anestezii představuje malé, ale jistě existující zdravotní riziko pro pacientku. Po rozmražení ovariální tkáně a její ortopické implantaci jsou hlášeny velmi nízké úspěšnosti IVF v důsledku výrazného zvýšení rizika výskytu prázdných folikulů (29 %), abnormálních a nezralých oocytů (38 %) a celkově je uskutečněn jen malý počet embryotransferů (24 %) [46]. Transplantovaná ovariální tkáň může být příčinou recidivy základního onemocnění u pacientek s hematologickými malignitami. In vitro maturace primordiálních folikulů do stadia fetilizovatelných oocytů v metafázi II má do budoucna obrovský potenciál. V současné době má ale zatím mnoho technologických překážek, které je nutné překonat, a není tedy v současnosti pro klinickou praxi dobrou variantou volby [38]. Hlavní výhodou ovariální kryokonzervace je schopnost zachovat rezervoár folikulů pro budoucnost, kdy bude možné pomocí in vitro maturace získat oocyty schopné oplodnění.
GnRHa
I přes mnoho kontroverzí o efektu a účinnosti jsou GnRHa široce užívány v klinické praxi ve snaze o minimalizaci nežádoucích gonadotoxických účinků systémové chemoterapie. GnRHa jsou dostupné, relativně levné, se snadným aplikačním schématem a u pacientek s karcinomem prsu jsou podávána pod heslem „je lépe předejít POF, než jej léčit!“ GnRHa navodí prepubertální hormonální stav za účelem zabránění vzniku POF u pacientek ve fertilním věku [38,39,47]. GnRHa způsobí po počátečním flare-up efektu desenzibilizaci GnRH receptorů na gonadotropiny vylučované hypofýzou. Tím inaktivují endogenní pulzativní vylučování gonadoliberinů a jsou příčinou vzniku hypogonadotropního endokrinního prostředí jako v prepubertě [38,39,47]. Vznikne hypoestrinní stav a jeho nežádoucím účinkem je vznik menopauzálních příznaků – návaly horka, vaginální suchost, poruchy spánku. Nejzávažnějším nežádoucím účinkem je osteopenie a osteoporóza v případech, kdy léčba trvá déle než šest měsíců. Příznaky menopauzy vyvolané léčbou GnRHa jsou častější u starších žen (> 35 let). Detailní mechanizmus protekce ovarií není dosud exaktně objasněn. Existuje několik teorií jejich působení. GnRHa simulují hypogonadotropní hormonální stav (prepubertu) organizmu, sekundárně snižují ovariální perfuzi díky nízké hladině estrogenů, vykazují přímý účinek na buňky ovaria. Dalším mechanizmem účinku může být up-regulace anti-apoptotických molekul, jako je sfingosin-1-fosfát a ochrana ovariálních zárodečných kmenových buněk [38,48]. Primordiální a primární folikuly nejsou závislé na stimulaci gonadotropiny, nemají FSH receptory, ale již pokročilejší antrální folikuly vykazují závislost na gonadotropinech a parakrinním způsobem mohou ovlivňovat růst primordiálních a primárních folikulů. Gonadotoxický účinek chemoterapie způsobuje smrt folikulů, následně dochází ke snížení hladiny estrogenu a inhibinu, což způsobí elevaci FSH a tím vstoupí ovarium do neřízené apoptózy (burn-out teorie) [38,48–50]. GnRHa snižují hladinu FSH, a tedy mají za následek snížení náboru primordiálních folikulů a minimalizují „vyhoření vaječníků“ [38,48–50].
K dnešnímu dni bylo publikováno více než 20 studií (vč. pěti prospektivních randomizovaných kontrolovaných studií), ve kterých bylo referováno celkem přes 2 000 pacientek léčených GnRHa souběžně s chemoterapií se statisticky významným poklesem rozvoje POF v rameni s GnRHa [38,48,51,52]. U pacientek léčených GnRHa paralelně s chemoterapií je pregnancy rate 19 % a jsou zachovány jejich cyklické ovariální funkce oproti skupině bez GnRHa (91 vs. 41 %) [38,52]. Existuje naopak dosud osm studií, které referují přes 500 pacientek s výsledky, které ukazují, že GnRHa nemají vliv na zabránění rozvoje POF. Jedním z argumentů pro nefunkčnost GnRHa v protekci ovariální tkáně je, že u 8 % pacientek prepubertálního věku vystavených gonadotoxické chemoterapii se rozvine POF před 40. rokem života [53,54] oproti běžné populaci (POF před 40. rokem života s incidencí pod 1 %). Ve skutečnosti ale tento údaj naopak potvrzuje funkčnost protekce GnRHa, neboť z publikovaných studií vyplývá, že ve skupině s analogy dojde k POF v 7–13 % (nasimulované prepubertální hormonální prostředí), naopak bez agonistů při chemoterapii dojde k POF ve 30–60 % případů [38].
Dosud 11 metaanalýz potvrdilo vliv GnRHa na redukci vzniku POF u onkolo - gických pacientek [38,51,52]. V rameni s GnRHa byla o 68 % vyšší míra zachování ovariální funkce (RR 1,68; 95% CI 1,34–2,1), pregnancy rate 22 vs. 14 % v rameni bez agonisty (RR 1,65; 95% CI 1,03–2,6) [52]. Slabinou studií hodnotících účinek GnRHa je jejich heterogenita. Jsou v nich hodnoceny dohromady pacientky s karcinomem prsu, ovaria, Hodgkinovým lymfomem či jinou hematologickou malignitou. Studie míchají hormonálně dependentní a independentní nádory, různé chemoterapeutické režimy a skupiny pacientek s adjuvantní hormonoterapií tamoxifenem či bez ní. Ve studiích jsou rovněž uváděny různé definice POF a hodnocení efektu GnRHa dle příznaků POF, dle nástupu menzes, dle pregnancy rate.
Preimplantační genetická diagnostika u BRCA pozitivních zdravých žen
Hereditární mutace genů BRCA1 a BRCA2 patří mezi monogenně podmíněné dispozice s neúplnou penetrancí a pozdější manifestací klinických symptomů. Nosičkám či nosičům mutací genů BRCA1 nebo BRCA2 však lze nabídnout preimplantační genetickou diagnostiku (PGD), tedy metodu založenou na selekci in vitro fertilizovaných oocytů, resp. vzniklých embryí, která je obecně eticky akceptována [42]. Příprava vlastního vyšetření pro konkrétní pár, vyvinutí sond pro PGD, ale vyžaduje určitou dobu (zpravidla 6–9 měsíců).
Karcinom prsu – adjuvantní hormonální léčba a její vedlejší účinky
Přibližně 70–80 % karcinomů prsu exprimuje v době diagnózy estrogenové a/nebo progesteronové receptory, které jsou dnes nejdůležitějším a jediným standardně vyšetřovaným prediktivním faktorem pro hormonální léčbu. Se zvyšujícím se věkem pacientek roste procento nádorů s pozitivními estrogenovými receptory (ER) [55]. Výsledky klinických studií opakovaně potvrdily přínos adjuvantní hormonální léčby, do které patří selektivní modulátory ER (tamoxifen), inhibitory aromatázy a GnRHa. Indikace a typ hormonální terapie závisí na pozitivitě steroidních receptorů v tumoru, menopauzálním stavu ženy, individuální snášenlivosti a kontraindikacích konkrétních preparátů.
Tamoxifen
Tamoxifen byl vyvinut v 60. letech minulého století jako kontraceptivum. V roce 1971 se ale zjistilo, že způsobuje ovulaci u sterilních pacientek s anovulačními cykly. Tamoxifen působí jako selektivní modulátor ER, na které má agonistický či antagonistický vliv. Tato jeho vlastnost je dána specifickým působením na nejméně dva druhy ER, které jsou v různém poměru zastoupeny v tkáních a orgánech člověka. Tamoxifen se užívá v adjuvantní terapii karcinomu prsu, dále metastatického nádoru prsu i v rámci profylaxe vzniku zhoubného nádoru prsu u vysoce rizikových skupin žen [56]. I přes vedlejší a nežádoucí účinky výhody tamoxifenu v léčbě rakoviny prsu převažují nad riziky [57,58]. Pacientky musejí být informovány o nežádoucích účincích.
Tamoxifen a jeho vliv na ženské orgány
Tamoxifen působí na ženské orgány – pochvu, dělohu, ovaria – a může být příčinou vzniku patologie v těchto orgánech. U žen v pre - i postmenopauze má tamoxifen jak agonistický, tak i antagonistický účinek na poševní sliznici, vyvolává pocity suchosti v pochvě, dyspareunii. U poloviny premenopauzálních pacientek menstruace zeslábne, až zcela vymizí. Nejčastějším nálezem při dlouhodobém užívání tamoxifenu je benigní polyp v děložním těle, a to zvláště u postmenopauzálních pa - cientek [59,60]. Polypy se vyskytují s incidencí 8–36 % oproti běžné populaci, kde jsou zastoupeny v 0–10 % [61,62]. Polypy vzniklé působením tamoxifenu jsou v průměru větší – až 5 cm, v běžné populaci se velikost polypu pohybuje mezi 0,5 a 3,0 cm. Tamoxifen je původcem vzniku endometriální cystické atrofie. Jedná se o stav, kdy se endometrium sestává z fibrózního stromatu a atrofické sliznice tvořené mnohočetnými cystami (obr. 1) [63]. Dosud se přesně neví, zda cysty vznikají z endometria či mají počátek subendometriálně, ve stromatu [64]. Endometriální žlázky se často vchlipují do myometria a vytvářejí v ultrazvukovém obraze dojem adenomyózy. Není jasné, zda se jedná o skutečnou adenomyózu či jen její obraz. Cystické formace nejsou prekancerózou a ani se v ni nevyvíjejí [63]. Několik studií poukazovalo na nárůst velikosti myomů v důsledku léčby tamoxifenem v postmenopauze [65]. Histologicky ale nebyla potvrzena žádná změna ve složení, ani nebyly detekovány premaligní či maligní léze v myomech [65,66]. Incidence endometriální hyperplazie je u pacientek s tamoxifenem zvýšená na 1,3–20 %. Hyperplazii endometria rozeznáváme bez atypií či s atypiemi a dále ji rozdělujeme na simplexní nebo komplexní [67,68]. U pacientek s nálezem endometriálních atypií je popsána progrese do karcinomu až v 22 %, naopak při hyperplazii bez atypií je progrese v karcinom jen ve 2 % případů [69]. Pre - i postmenopauzální ženy mají vyšší riziko tvorby ovariálních cyst [70]. Nebyl nikdy dokumentován vliv tamoxifenu na vznik karcinomu ovaria ani u BRCA pozitivních pacientek [71].
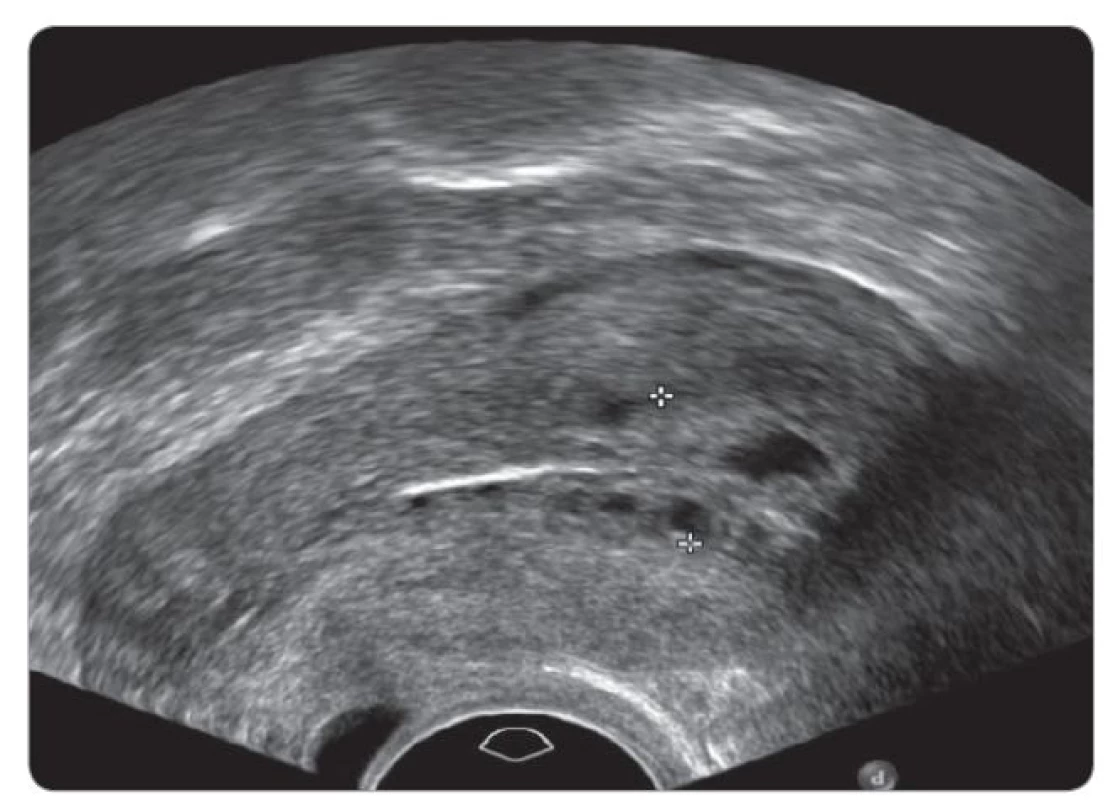
Největší obavy z užívání tamoxifenu postmenopauzálně plynou ze zvýšení rizika vzniku atypií a následně karcinomu děložního těla. Naproti tomu inhibitory aromatáz nezpůsobují vznik hyperplazie a následně karcinomu děložního těla. Mnoho studií potvrdilo, že karcinomy dělohy v souvislosti s tamoxifenem jsou až v 80 % prognosticky příznivé, endometroidní, dobře diferencované [60]. Jen kazuisticky je dáván tamoxifen do souvislosti se vznikem high-grade karcinomu děložního těla [72]. Studie u 59 929 pacientek s karcinomem prsu ukázala zvýšení RR vzniku karcinomu dělohy u žen s tamoxifenem o 2,7 [73]. Bylo zkoumáno, zda při prodlouženém užívání tamoxifenu nad pět let nedojde k nárůstu jeho nežádoucích účinků. Ze závěrů studie ATLAS (Long Against Shorter) plyne, že riziko prodloužené léčby tamoxifenem nemá vliv na navýšení rizika vzniku karcinomu děložního těla a to zůstává setrvalé na RR 1,74 (95% CI 1,30–2,34; p = 0,0002), u plicní embolie je RR 1,87 (95% CI 1,13–3,07; p = 0,01). Ve studii ATLAS nebyla navýšena incidence cévní mozkové příhody RR 1,06 (95% CI 0,83–1,36; p = 0,63) a incidence ischemické choroby srdeční se snížila RR 0,76 (95% CI 0,60–0,95; p = 0,02). Kumulativní riziko onemocnění karcinomem endometria v letech 5–14 bylo 3,1 % u žen s kontinuálním užíváním tamoxifenu oproti 1,6 % kontrol (absolutní mortalita na nádor dělohy se zvýšila o 0,2 %) [74]. Studie aTTom (Adjuvant Tamoxifen – To Offer More) potvrdila rovněž setrvalé, nezvyšující se riziko vzniku karcinomu dělohy u pacientek užívajících tamoxifen po dobu 10 let oproti populaci (102 vs. 45 endometriální karcinom, RR 2,20 (95% CI 1,31–2,34; p < 0,0001)). Bylo sledováno minimální navýšení v úmrtnosti na karcinom endometria 37 (1,1 %) vs. 20 (0,6 %) úmrtí (absolutní riziko navýšení je pouze 0,5 %; p = 0,02) [75].
Gynekologické kontroly pacientek s tamoxifenem
V ČR neexistuje oficiální doporučený postup péče o pacientky užívající tamoxifen. Mnoho gynekologů a onkologů si zve pacientky s tamoxifenem na pravidelné kontroly ve snaze časně detekovat vznikající patologii dutiny děložní při léčbě tamoxifenem pomocí transvaginální sonografie (TVUS) u pre - i postmenopauzálních žen. Tento koncept sledování se dle publikovaných studií nepotvrdil a neosvědčil. Vede k falešně pozitivním nálezům a indukuje nepotřebné bioptické zákroky jako separované abraze a hysteroskopie [60]. Onkolog v návaznosti na to mění adjuvantní endokrinní léčbu, což může mít nežádoucí efekt z pohledu dlouhodobé onkologické bezpečnosti.
Většina lézí v dutině děložní spojených s tamoxifenem je benigních, bez známek atypií. Racionálním přístupem je zhodnotit dutinu děložní pomocí TVUS před nasazením tamoxifenu. V případě jakéhokoliv patologického nálezu pak pacientku referovat k hysteroskopickému vyšetření dutiny děložní před nasazením tamoxifenu. Pokud je TVUS dutiny děložní v postmenopauze před zahájením léčby tamoxifenem bez detekce patologie, sliznice ≤ 5 mm, ostře ohraničená vůči myometriu, je nepravděpodobné, že by se během následujících tří let u pacientky vyvinula atypická hyperplazie na podkladě působení tamoxifenu. Jakákoliv ultrazvuková kontrola během prvních tří let není jen z pohledu tamoxifenu racionální a indikovaná (schéma 1) [71]. Při pravidelných TVUS kontrolách endometria při léčbě tamoxifenem budeme u pacientek pozorovat endometriální a subendometriální změny ve smyslu cystické přeměny, edému stromatu, polypy a tyto nálezy budou imitovat endometriální hyperplazii [76–78].

Tamoxifen u premenopauzálních pacientek nezvyšuje riziko vzniku atypií či karcinomu těla dělohy ani ovaria. Postmenopauzální ženy jsou ve zvýšeném riziku po pěti letech užívání tamoxifenu, riziko je navýšeno 2–3krát. U postmenopauzální ženy s tamoxifenem bychom se měli řídit pouze symptomatologií. U postmenopauzálních žen krvácení, špinění nebo poševní výtok jsou symptomy ukazující na možný rozvoj patologie v dutině děložní [76,77]. Histologicky potvrzené atypické hyperplazii předchází až v 85 % krvácení z dělohy.
Hysteroskopie je zlatým standardem k detekci atypické hyperplazie se senzitivitou 97 %, specificitou 100 %, pozitivní prediktivní hodnotou (positive predictive value – PPV) 100 % a negativní prediktivní hodnotou (negative predictive value – NPV) 96 % [77]. Kyretáž, resp. separovaná abraze dělohy je místo hysteroskopie indikována jen v případě silného krvácení z dělohy jako hemostatický urgentní výkon [78,79]. TVUS ve sledování změn endometria při léčbě tamoxifenem vykazuje velmi nízkou přesnost v detekci atypické hyperplazie endometria. V postmenopauze hranice tloušťky ≤ 5 mm při TVUS vykazuje 100% senzitivitu v detekci slizniční patologie, ale jen 15% specificitu, PPV 4 % a NPV 100 %. Posunutím hranice na 10 mm získáme senzitivitu 84 %, specificitu 69 %, PPV 10 % a NPV 99 %. Studie Seoud et al [76] nenašla při léčbě tamoxifenem žádnou korelaci mezi patologií dutiny děložní a s výškou sliznice dle TVUS (pacientka s karcinomem dutiny děložní měla sliznice 3 mm). Patologie vždy korelovala s klinickými symptomy. TVUS se zaměřením na patologii dutiny děložní by měl být proveden vždy před zahájením léčby tamoxifenem a v případě klinických obtíží. TVUS není vhodný ke screeningovému vyšetřování za účelem detekce patologie dutiny děložní při léčbě tamoxifenem [79].
Závěr
Ženy s karcinomem prsu či se zvýšeným hereditárním rizikem vzniku karcinomu prsu představují širokou populační skupinu. Díky klesající mortalitě prevalence žen s karcinomem prsu v anamnéze v populaci neustále stoupá a za posledních 10 let vzrostla o 65 %. Péče o tyto pacientky je komplexní a podílí se na ní kromě klinického onkologa také onkogynekolog/senolog a ošetřující gynekolog. Organizace onkologické a onkogynekologické péče v ČR dovoluje soustředit většinu pacientek do specializovaných center s patřičným vybavením, a především odbornou erudicí. Předkládaná práce shrnuje současné znalosti v oblastech péče o ženy s karcinomem prsu, ve kterých se nejvíce prolínají výše zmíněné odbornosti, a měla by posloužit k většímu vzájemnému porozumění a prohloubení spolupráce mezi klinickými onkology a onkogynekology ve prospěch našich společných pacientek.
Práce byla podpořena MZ ČR – RVO (FNBr, 65269705).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
MUDr. Vít Weinberger, Ph.D.
Onkogynekologické centrum
Gynekologicko-porodnická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: vit.weinberger@gmail.com
Obdrženo: 6. 6. 2016
Přijato: 22. 7. 2016
Sources
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita, Česká republika; 2005, [citováno 15. dubna 2016]. Dostupné z: http: //www.svod.cz.
2. Zikán M. Hereditární syndromy. In: Cibula D, Petruželka L (eds). Onkogynekologie. Praha: Grada 2009 : 614.
3. Cummings SR, Tice JA, Bauer S et al. Prevention of breast cancer in postmenopausal women: approaches to estimating and reducing risk. J Natl Cancer Inst 2009; 101 (6): 384–398. doi: 10.1093/jnci/djp018.
4. Medina D, Kittrell FS, Tsimelzon A et al. Inhibition of mammary tumorigenesis by estrogen and progesterone in genetically engineered mice. Ernst Schering Found Symp Proc 2007; 1 : 109–126.
5. Dumeaux V, Alsaker E, Lund E. Breast cancer and specific types of oral contraceptives: a large Norwegian cohort study. Int J Cancer 2003; 105 (6): 844–850.
6. Marchbanks PA, McDonald JA, Wilson HG et al. Oral contraceptives and the risk of breast cancer. N Engl J Med 2002; 346 (26): 2025–2032.
7. Rosenberg L, Zhang Y, Coogan PF et al. A case-control study of oral contraceptive use and incident breast cancer. Am J Epidemiol 2009; 169 (4): 473–479. doi: 10.1093/aje/kwn360.
8. Shapiro S. Re: “A case-control study of oral contraceptive use and incident breast cancer.” Am J Epidemiol 2009; 170 (6): 802–803; author reply 803–804. doi: 10.1093/aje/kwp245.
9. Thomas HV, Reeves GK, Key TJ. Endogenous estrogen and postmenopausal breast cancer: a quantitative review. Cancer Causes Control 1997; 8 (6): 922–928.
10. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Collaborative Group on Hormonal Factors in Breast Cancer. Lancet 1997; 350 (9084): 1047–1059. doi: 10.1016/S0140-6736 (97) 08233-0.
11. Schairer C, Gail M, Byrne C et al. Estrogen replacement therapy and breast cancer survival in a large screening study. J Natl Cancer Inst 1999; 91 (3): 264–270.
12. Willis B, Calle E, Miracle-McMahill L et al. Estrogen replacement therapy and risk of fatal breast cancer in a prospective cohort of postmenopausal women in the United States. Cancer Causes Control 1996; 7 (4): 449–457.
13. Beral V, Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 2003; 362 (9382): 419–427.
14. Ruddy KJ, Gelber SI, Tamimi RM et al. Prospective study of fertility concerns and preservation strategies in young women with breast cancer. J Clin Oncol 2014; 32 (11): 1151–1156. doi: 10.1200/JCO.2013.52.8877.
15. Gonçalves V, Sehovic I, Quinn G. Childbearing attitudes and decisions of young breast cancer survivors: a systematic review. Hum Reprod Update 2014; 20 (2): 279–292. doi: 10.1093/humupd/dmt039.
16. Holmberg L, Anderson H, HABITS steering and data monitoring committees. HABITS (hormonal replacement therapy after breast cancer-is it safe?), a randomised comparison: trial stopped. Lancet 2004; 363 (9407): 453–455.
17. Bundred NJ, Kenemans P, Yip CH et al. Tibolone increases bone mineral density but also relapse in breast cancer survivors: LIBERATE trial bone substudy. Breast Cancer Res 2012; 14 (1): R13.
18. Kenemans P, Bundred J, Foidart JM et al. Safety and efficacy of tibolone in breast-cancer patients with vasomotor symptoms: a double-blind, randomised, non-inferiority trial. Lancet Oncol 2009; 10 (2): 135–146. doi: 10.1016/S1470-2045 (08) 70341-3.
19. Ory H, Cole P, MacMahon B et al. Oral contraceptives and reduced risk of benign breast diseases. N Engl J Med 1976; 294 (8): 419–422.
20. Vessey M, Yeates D. Oral contraceptives and benign breast disease: an update of findings in a large cohort study. Contraception 2007; 76 (6): 418–424.
21. LiVolsi VA, Stadel BV, Kelsey JL at al. Fibroadenoma in oral contraceptive users: a histopathologic evaluation of epithelial atypia. Cancer 1979; 44 (5): 1778–1781.
22. Rohan TE, Miller AB. A cohort study of oral contraceptive use and risk of benign breast disease. Int J Cancer 1999; 82 (2): 191–196.
23. Gaffield ME, Culwell KR, Ravi A. Oral contraceptives and family history of breast cancer. Contraception 2009; 80 (4): 372–380. doi: 10.1016/j.contraception.2009.04.010.
24. Lipnick RJ, Buring JE, Hennekens CH et al. Oral contraceptives and breast cancer. A prospective cohort study. JAMA 1986; 255 (1): 58–61.
25. Collaborative Group on Hormonal Factors in Breast Cancer. Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58,209 women with breast cancer and 101,986 women without the disease. Lancet 2001; 358 (9291): 1389–1399.
26. Colditz AG, Rosner BA, Speizer FE. Risk factors for breast cancer according to family history of breast cancer. For the Nurses’ Health Study Research Group. J Natl Cancer Inst 1996; 88 (6): 365–371.
27. Grabrick DM, Hartmann LC, Cerhan JR et al. Risk of breast cancer with oral contraceptive use in women with a family history of breast cancer. JAMA 2000; 284 (14): 1791–1798.
28. Silvera SA, Miller AB, Rohan TE. Oral contraceptive use and risk of breast cancer among women with a family history of breast cancer: a prospective cohort study. Cancer Causes Control 2005; 16 (9): 1059–1063.
29. Narod SA. Modifiers of risk of hereditary breast and ovarian cancer. Nat Rev Cancer 2002; 2 (2): 113–123.
30. Cibula D, Zikan M, Dusek L et al. Oral contraceptives and risk of ovarian and breast cancers in BRCA mutation carriers: a meta-analysis. Expert Rev Anticancer Ther 2011; 11 (8): 1197–1207. doi: 10.1586/era.11.38.
31. Rebbeck R, Friebel T, Wagner T et al. Effect of short-term hormone replacement therapy on breast cancer risk reduction after bilateral prophylactic oophorectomy in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group. J Clin Oncol 2005; 23 (31): 7804–7810.
32. Chlebowski RT, Kuller LH, Prentice RL et al. Breast cancer after use of estrogen plus progestin in postmenopausal women. N Engl J Med 2009; 360 (6): 573–587. doi: 10.1056/NEJMoa0807684.
33. Rebbeck TR, Friebel T, Wagner T et al. Effect of short-term hormone replacement therapy on breast cancer risk reduction after bilateral prophylactic oophorectomy in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group. J Clin Oncol 2005; 23 (31): 7804–7810.
34. Torino F, Barnabei A, De Vecchis L et al. Chemotherapy-induced ovarian toxicity in patients affected by endocrine-responsive early breast cancer. Crit Rev Oncol Hematol 2014; 89 (1): 27–42. doi: 10.1016/j.critrevonc.2013.07.007.
35. Oktem O, Oktay K. Quantitative assessment of the impact of chemotherapy on ovarian follicle reserve and stromal function. Cancer 2007; 110 (10): 2222–2229.
36. Kalich-Philosoph L, Roness H, Carmely A et al. Cyclophosphamide triggers follicle activation and “burnout”; AS101 prevents follicle loss and preserves fertility. Sci Transl Med 2013; 5 (185): 185ra62. doi: 10.1126/scitranslmed.3005402.
37. Blumenfeld Z, Katz G, Evron A. ‚An ounce of prevention is worth a pound of cure‘: the case for and against GnRH-agonist for fertility preservation. Ann Oncol 2014; 25 (9): 1719–1728. doi: 10.1093/annonc/mdu036.
38. De Vos M, Smitz J, Woodruff TK. Fertility preservation in women with cancer. Lancet 2014; 384 (9950): 1302–1310. doi: 10.1016/S0140-6736 (14) 60834-5.
39. Cardozo ER, Thomson AP, Karmon AE et al. Ovarian stimulation and in-vitro fertilization outcomes of cancer patients undergoing fertility preservation compared to age matched controls: a 17-year experience. J Assist Reprod Genet 2015; 32 (4): 587–596. doi: 10.1007/s10815-015-0428-z.
40. Blumenfeld Z, Patel B, Leiba R et al. Gonadotropin-releasing hormone agonist may minimize premature ovarian failure in young women undergoing autologous stem cell transplantation. Fertil Steril 2012; 98 (5): 1266–1270. doi: 10.1016/j.fertnstert.2012.07.1144.
41. Revelli A, Porcu E, Levi Setti PE et al. Is letrozole needed for controlled ovarian stimulation in patients with estrogen receptor-positive breast cancer? Gynecol Endocrinol 2013; 29 (11): 993–996. doi: 10.3109/ 09513590.2013.819083.
42. Quinn GP, Vadaparampil ST, Bower B et al. Decisions and ethical issues among BRCA carriers and the use of preimplantation genetic diagnosis. Minerva Med 2009; 100 (5): 371–383.
43. Tomasi-Cont N, Lambertini M, Hulsbosch S et al. Strategies for fertility preservation in young early breast cancer patients. Breast 2014; 23 (5): 503–510. doi: 10.1016/j.breast.2014.05.024.
44. Dursun P, Doğan NU, Ayhan A. Oncofertility for gynecologic and non-gynecologic cancers: fertility sparing in young women of reproductive age. Crit Rev Oncol Hematol 2014; 92 (3): 258–267. doi: 10.1016/j.critrevonc.2014.07.001.
45. Dolmans MM, Donnez J, Camboni A et al. IVF outcome in patients with orthotopically transplanted ovarian tissue. Hum Reprod 2009; 24 (11): 2778–2787. doi: 10.1093/humrep/dep289.
46. Dolmans MM, Marinescu C, Saussoy P et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood 2010; 116 (16): 2908–2914. doi: 10.1182/blood-2010-01-265751.
47. Blumenfeld Z, von Wolff M. GnRH-analogues and oral contraceptives for fertility preservation in women during chemotherapy. Hum Reprod Update 2008; 14 (6): 543–552. doi: 10.1093/humupd/dmn022.
48. Blumenfeld Z. GnRH-agonists in fertility preservation. Curr Opin Endocrinol Diabetes Obes 2008; 15 (6): 523–528. doi: 10.1097/MED.0b013e32831a46e9.
49. Roness H, Gavish Z, Cohen Y et al. Ovarian follicle burnout: a universal phenomenon? Cell Cycle 2013; 12 (20): 3245–3246. doi: 10.4161/cc.26358.
50. Del Mastro L, Levaggi A, Giraudi S et al. Luteinising hormone releasing hormone agonists (LH-RHa) in premenopausal early breast cancer patients: current role and future perspectives. Cancer Treat Rev 2011; 37 (3): 208–211. doi: 10.1016/j.ctrv.2010.07.007.
51. Clowse ME, Behera MA, Anders CK et al. Ovarian preservation by GnRH agonists during chemotherapy: a meta-analysis. J Womens Health (Larchmt) 2009; 18 (3): 311–319. doi: 10.1089/jwh.2008.0857.
52. Wong M, O’Neill S, Walsh G et al. Goserelin with chemotherapy to preserve ovarian function in pre-menopausal women with early breast cancer: menstruation and pregnancy outcomes. Ann Oncol 2013; 24 (1): 133–138. doi: 10.1093/annonc/mds250.
53. Edgar AB, Wallace WH. Pregnancy in women who had cancer in childhood. Eur J Cancer 2007; 43 (13): 1890–1894.
54. Wang C, Chen M, Fu F et al. Gonadotropin-releasing hormone analog cotreatment for the preservation of ovarian function during gonadotoxic chemotherapy for breast cancer: a meta-analysis. PLoS One 2013; 8 (6): e66360. doi: 10.1371/journal.pone.0066360.
55. Aebi S, Davidson T, Gruber G et al. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21 (Suppl 5): v9–v14. doi: 10.1093/annonc/mdq159.
56. Cuzick J, Forbes J, Edwards R et al. First results from the International Breast Cancer Intervention Study (IBIS-I): a randomised prevention trial. Lancet 2002; 360 (9336): 817–824.
57. Bevers TB, Armstrong DK, Arun B et al. Breast cancer risk reduction. J Natl Compr Canc Netw 2010; 8 (10): 1112–1146.
58. Osborne CK. Tamoxifen in the treatment of breast cancer. N Engl J Med 1998; 339 (22): 1609–1618.
59. Polin SA, Ascher SM. The effect of tamoxifen on the genital tract. Cancer Imaging 2008; 8 : 135–145. doi: 10.1102/1470-7330.2008.0020.
60. Neven P, Vergote I. Should tamoxifen users be screened for endometrial lesions? Lancet 1998; 351 (9097): 155–157.
61. Lahti E, Blanco G, Kauppila A et al. Endometrial changes in postmenopausal breast cancer patients receiving tamoxifen. Obstet Gynecol 1993; 81 (5): 660–664.
62. McGonigle KF, Shaw SL, Vasilev SA et al. Abnormalities detected on transvaginal ultrasonography in tamoxifen-treated postmenopausal breast cancer patients may represent endometrial cystic atrophy. Am J Obstet Gynecol 1998; 178 (6): 1145–1150.
63. Cohen I, Bernheim J, Azaria R et al. Malignant endometrial polyps in postmenopausal breast cancer tamoxifen-treated patients. Gynecol Oncol 1999; 75 (1): 136–141.
64. Neven P, De Muylder X, Van Belle Y et al. Longitudinal hysteroscopic follow-up during tamoxifen treatment. Lancet 1998; 351 (9095): 36.
65. Dilts PV Jr, Hopkins MP, Chang AE et al. Rapid growth of leiomyoma in patient receiving tamoxifen. Am J Obstet Gynecol 1992; 166 (1): 167–168.
66. Ramondetta LM, Sherwood JB, Dunton CJ et al. Endometrial cancer in polyps associated with tamoxifen use. Am J Obstet Gynecol 1999; 180 (2): 340–341.
67. Cohen I. Endometrial pathologies associated with postmenopausal tamoxifen treatment. Gynecol Oncol 2004; 94 (2): 256–266.
68. Neven P, Vernaeve H. Guidelines for monitoring patients taking tamoxifen treatment. Drug Saf 2000; 22 (1): 1–11.
69. Cohen I, Rosen DJ, Altaras M et al. Tamoxifen treatment in premenopausal breast cancer patients may be associated with ovarian overstimulation, cystic formations and fibroid overgrowth. Br J Cancer 1994; 69 (3): 620–621.
70. Mourits MJ, De Vries EG, Willemse PH et al. Tamoxifen treatment and gynecologic side effects: a review. Obstet Gynecol 2001; 97 (5): 855–866.
71. Curtis RE, Freedman DM, Sherman ME et al. Risk of malignant mixed mullerian tumors after tamoxifen therapy for breast cancer. J Natl Cancer Inst 2004; 96 (1): 70–74.
72. Braithwaite RS, Chlebowski RT, Lau J et al. Meta-analysis of vascular and neoplastic events associated with tamoxifen. J Gen Intern Med 2003; 18 (11): 937–947.
73. Davies C, Pan H, Godwin J et al. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 2013; 381 (9869): 805–816.
74. Gray R. aTTom: long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years in 6,934 women with early breast cancer. J Clin Oncol 2013; 31 (Suppl): abstr. 5.
75. Love CD, Muir BB, Scrimgeour JB et al. Investigation of endometrial abnormalities in asymptomatic women treated with tamoxifen and an evaluation of the role of endometrial screening. J Clin Oncol 1999; 17 (7): 2050–2054.
76. Seoud M, Shamseddine A, Khalil A et al. Tamoxifen and endometrial pathologies: a prospective study. Gynecol Oncol 1999; 75 (1): 15–19.
77. Ceci O, Bettocchi S, Nappi L et al. Comparison of hysteroscopic and hysterectomy findings to assess the diagnostic accuracy of office hysteroscopy in tamoxifen-treated patients with breast cancer. J Am Assoc Gynecol Laparosc 2003; 10 (3): 392–395.
78. Guruwadayarhalli B, Jones SE, Srinivasan V. Hysteroscopy in the diagnosis of postmenopausal bleeding. Menopause Int 2007; 13 (3): 132–134.
79. Fung MF, Reid A, Faught W et al. Prospective longitudinal study of ultrasound screening for endometrial abnormalities in women with breast cancer receiving tamoxifen. Gynecol Oncol 2003; 91 (1): 154–159.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2016 Issue Supplementum 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Editorial
- Breast Cancer – Specifics of Gynecological Care and Counseling
- Pregnancy-associated Breast Cancer
- Pregnancy after Treatment of Breast Cancer
- Ovarian Ablation in Breast Cancer Patients and the Possibility of Influencing Treatment Side Effects
- Treatment with Aromatase Inhibitors in Postmenopausal Women with Breast Cancer and the Possibility of Influencing Side Effects
- Circulating Levels of Estradiol in Breast Cancer Patients Treated with Aromatase Inhibitors and Their Clinical Implications
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Treatment with Aromatase Inhibitors in Postmenopausal Women with Breast Cancer and the Possibility of Influencing Side Effects
- Breast Cancer – Specifics of Gynecological Care and Counseling
- Circulating Levels of Estradiol in Breast Cancer Patients Treated with Aromatase Inhibitors and Their Clinical Implications
- Pregnancy after Treatment of Breast Cancer
